Зоологический журнал, 2019, T. 98, № 4, стр. 387-392
Новые данные о вибрационной коммуникации фасолевой зерновки (Acanthoscelides obtectus, Coleoptera, Bruchidae)
Л. С. Шестаков 1, 2, *, А. А. Каспарсон 1
1 Институт проблем передачи информации им. А.А. Харкевича РАН
127051 Москва, Россия
2 Российский университет дружбы народов
117198 Москва, Россия
* E-mail: zicrona@yandex.ru
Поступила в редакцию 26.04.2018
После доработки 23.05.2018
Принята к публикации 07.06.2018
Аннотация
Изучены репертуар и способы эмиссии сигналов у Acanthoscelides obtectus (Coleoptera, Bruchidae). Обнаружено три способа эмиссии сигналов: вибрация брюшка, удары брюшка и головы о субстрат, вибрация крыльев. У самцов зарегистрированы два типа сигналов, у самок – один тип. Большинство параметров сигналов зерновок стабильны. Вариабельным элементом является число пульсов в серии сигнала самца. Частотные характеристики оказались стабильным параметром во всех типах сигналов. Кроме того, частотный максимум разных типов сигналов был сходен (889–1158 Гц).
В настоящее время акустический аппарат обнаружен у представителей многих семейств Coleoptera, что позволяет предполагать широкое использование акустической сигнализации в пределах отряда (Wessel, 2006). Cтридуляционные органы обнаружены у представителей таких крупных семейств жуков как Geotrupidae (Carisio et al., 2004), Passalidae (Palestrini et al., 2003), Scarabaeidae (Kasper, Hirschberger, 2005) и Curculionidae (Riede, Stueben, 2000). Для представителей этих семейств было показано, что одна и та же структура часто может быть использована для эмиссии разных типов сигналов: ухаживания, агрессии, агрегации (Carisio et al., 2004; Palestrini et al., 2003; Kasper, Hirschberger, 2005). Так, у представителей семейств Chrisomelidae и Curculionidae видоспецифичные акустические и вибрационные сигналы являются важной частью ритуала ухаживания и активно используются при конкуренции (Lindeman, Jak, 2013). В некоторых группах отмечены стридуляционные сигналы и у личинок, однако их биологическая функция в большинстве групп остается не выясненной (Wessel, 2006). Таким образом, нет сомнений, что большинство жесткокрылых могут обладать акустической или вибрационной коммуникацией (Wessel, 2006; Kasper, Hirschberger,2005).
Зерновки (Bruchidae) — хорошо изученное в фаунистическом и экологическом плане семейство жесткокрылых, многие представители которого являются экономически значимыми вредителями запасов и распространенными модельными объектами в исследованиях по экологии и эволюции популяций (Stojković et al., 2012), однако их акустической коммуникации были посвящены лишь единичные работы (Devereau et al., 2003). В основном исследования по биоакустике зерновок фокусировались на изучении перспектив разработки методов акустического мониторинга вредителей в пищевых субстратах. В связи с этим регистрировали неспецифические низкоамплитудные колебания, возникающие при питании личинок (Devereau et al., 2003) или имаго на фасоли (Njoroge et al., 2017). Тем не менее, косвенные данные говорят о том, что вибрации личинок могут быть не только следствием механической активности, но и могут выполнять коммуникационные функции. Было показано, что личинки Callosobruchus maculatus (Fabricius 1775), находящиеся в одном зерне, при встрече могут проявлять агрессивное поведение и даже убивать друг друга (Mano, Toquenaga, 2008); вибрации, теоретически, могут служить для предотвращения физического контакта личинок.
Работы, описывающие поведение ухаживания, позволяют предположить, что у зерновок существует развитая акустическая коммуникация. Известно, что спариванию у C. maculatus предшествует взаимодействие через химическую сигнализацию, т.н. призыв самки (поднятие над субстратом брюшка и последней пары конечностей, касание свободными конечностями брюшка; по другой версии – ритмичное сокращение и расслабление брюшка) (Burkholder, Yun-Tai, 1982), однако акустические и вибрационные сигналы при этом не регистрировались. Было отмечено, что при приближении самца к самке он ощупывает еe антеннами, что, по мнению авторов, указывает на тактильную и феромонную коммуникацию (Rup, 1986). Известно, что у представителей близких семейств жесткокрылых подобные двигательные акты могут сопровождаться эмиссией акустических и/или вибрационных сигналов (Wessel, 2006). Например, у Dendroctonus valens (Curculionidae) и других представителей рода было описано несколько типов сложных сигналов, регистрируемых при похожих движениях насекомого (Fleming, et al.,2013; Lindeman, Yack, 2013). Кроме того, у нескольких видов зерновок из рода Amblycerus были описаны морфологические структуры, предположительно служащие для стридуляции (Kingsolveret et al., 1993; Ribeiro-Costa, 1999).
Таким образом, имеются все основания полагать, что Bruchidae могут активно использовать акустические и/или вибрационные сигналы в процессе коммуникации и, кроме того, близкие виды могут иметь сходные закономерности в акустическом поведении. Целью нашего исследования было проверить данную гипотезу.
МАТЕРИАЛ И МЕТОДИКА
Насекомые
Жуки Acanthoscelides obtectus (Say 1831) были получены из культуры Института биологических исследований " Синиса Станкович” (Institute for Biological Research “Sinisa Stankovic”, University of Belgrade, Republic of Serbia). Насекомых содержали в пластиковых садках 20 × 15 × 5 см при 30°С и относительной влажности 70%. В качестве пищевого субстрата для культуры использовали семена фасоли Phaseolus vulgaris. Насекомых регулярно переводили на свежий корм, чтобы поддерживать непрерывную высокую численность лабораторной популяции. Пищевой ресурс предоставляли в неограниченном количестве для каждого из последующих поколений, чтобы обеспечивать количество вновь вылупившихся жуков на уровне нескольких сотен ежедневно.
Регистрация и анализ сигналов
Были зарегистрированы и проанализированы сигналы и поведение 68 самцов и 30 самок.
Для регистрации вибрационной компоненты сигнала применяли пьезокристаллический адаптер ГЗК-661 от проигрывателя для виниловых дисков. Сигнал с адаптера поступал на микрофонный вход звуковой платы компьютера. Методика регистрации низкоамплитудных вибрационных сигналов была подробно описана нами в предыдущих работах (Shestakov, 2008; Shestakov, 2015). Для регистрации возможной акустической компоненты сигнала применялся микрофон 4191 (1/2; Bruel & Kjær, Nærum, Denmark). Регистрацию при помощи обоих типов датчиков проводили одновременно. Частота дискретизации сигнала составляла 44.1 кГц.
Параллельно велось видеотипирование поведения насекомых. Такая методика позволяет выявить соответствие сигнала каждому конкретному двигательному акту насекомого, что облегчает задачу определения звукоизлучающих структур и выявление механизма их работы. Измерение амплитудно-временных параметров сигналов проводилось с помощью программ CoolEdit (США, Syntrillium) и Turbolab 4.0 (Германия, Bressner Technology). Для каждого параметра сигналов каждой особи проводилось не менее 20 измерений. Статистический анализ был выполнен с использованием программного обеспечения Excel и Statistica.
Поведение
Для изучения коммуникации, связанной с репродуктивным поведением, насекомых выращивали индивидуально, помещая только одно яйцо на одно семя фасоли. Самцов и самок содержали до эксперимента отдельно. Каждую особь использовали в эксперименте только один раз. Таким образом, обеспечивалась возможность использовать в опытах заведомо девственных самцов и самок. Насекомых ссаживали в следующих соотношениях: самец и самка, одиночный самец, два самца и самка, два самца. Для каждой комбинации выполняли не менее 10 ссаживаний.
Для изучения возрастной динамики акустической активности и изменчивости сигнала акустическую активность 20 пар регистрировали ежедневно в течение 10 дней, начиная со дня выхода имаго из фасоли.
РЕЗУЛЬТАТЫ
Зерновки издают вибрационные сигналы при контакте с конспецификами. Сигналы издают как самцы, так и самки. Однако, во всех случаях, эмиссия сигналов инициировалась самцами. Все зарегистрированные сигналы можно разделить на следующие типы:
Сигналы первого типа состоят из серий коротких вибрационных пульсов (рис. 1, 1–3). При визуальном наблюдении кажется, что сигнал издается ударами брюшка о субстрат. Анализ видеозаписей показал, что насекомое периодически касается субстрата не только брюшком, но и головой. Как длительность пульсов, так и период их повторения в серии стабильны. Частотный максимум сигнала составляет 889 Гц (табл. 1). Наибольшая изменчивость наблюдается в числе пульсов в серии (табл. 1) и, соответственно, в длительности серий. Этот тип сигнала регистрировали только в группах в присутствии самок. Во время эмиссии сигнала самец в большинстве случаев предпринимал попытку копуляции с самкой или активно преследовал ее. Это может указывать на то, что этот сигнал является элементом поведения ухаживания A. obtectus. Однако следует отметить, что самцы предпринимают попытки копуляции и без эмиссии сигнала.
Рис. 1.
Осциллограммы вибрационных сигналов Acanthoscelides obtectus: сигнал ухаживания самца (1–3), ответный сигнал самки (4–5), вибрация крыльев самца (6–7). Фрагменты сигналов, помеченные цифрами “2–3”, “5” и “7”, представлены при большей скорости развертки на осциллограммах под такими же номерами.
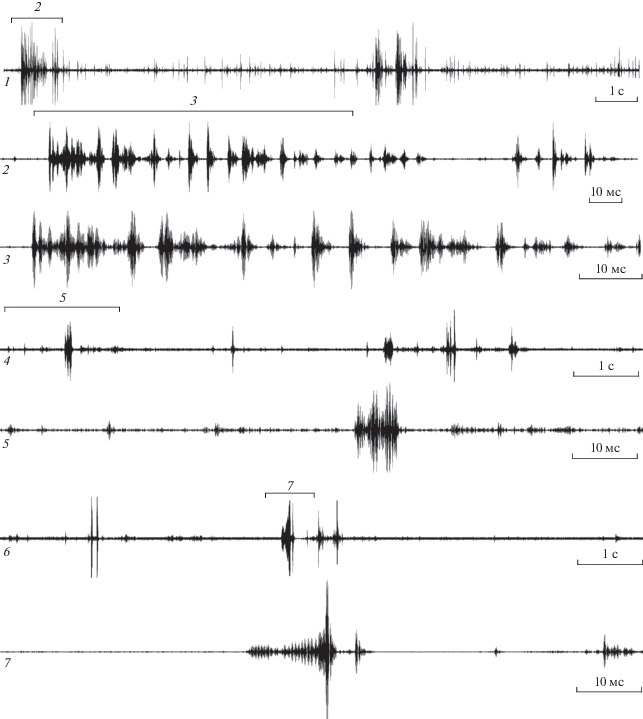
Таблица 1.
Параметры вибрационных сигналов Acanthoscelides obtectus
| Параметр сигнала | Сигнал самца 1 | Сигнал самца 2 | Сигнал самки |
|---|---|---|---|
| Длительность пульса, мс | 24.6 | 69.7 | 76.3 |
| 5 | 12 | 11 | |
| 0.2 | 0.16 | 0.14 | |
| Период повторения пульсов, мс | 43.4 | — | — |
| 10 | |||
| 0.2 | |||
| Число пульсов в серии | 11.2 | — | — |
| 6 | |||
| 0.5 | |||
| Доминантная частота пульсов, Гц | 889.3 | 1079.1 | 1158 |
| 117 | 124 | 118 | |
| 0.1 | 0.11 | 0.1 |
Самки могут издавать ответный сигнал при помощи вибрации брюшка (pис. 1, 4–5). Сигнал всегда состоит из одиночных вибрационных пульсов. Характеристики сигнала представлены в табл. 1. В наших экспериментах самка издавала сигнал после нескольких сигналов самцов или после тактильных контактов с самцами. У одиночных самок сигналы не регистрировали. В отличие от самца, ударяющего брюшком о субстрат, самка слегка приподнимает брюшко и вибрирует им, не касаясь субстрата. При этом задние конечности свободны, а первая и вторая пара используются для фиксации насекомого на субстрате. Такое поведение не всегда сопровождается эмиссией вибрационного сигнала. Иногда самка только поднимает брюшко, не касаясь им субстрата.
Сигналы третьего типа издаются самцами при движении крыльев и состоят из одиночных вибрационных пульсов с переменным периодом повторения. (рис. 1, 6–7; табл. 1). Во время эмиссии сигнала самец поднимается над субстратом, раскрывает крылья и работает ими как при полете. Этот сигнал состоит из двух элементов: первый – более длительный и имеет низкую амплитуду, а второй – короткий и имеет более высокую амплитуду. Частотная модуляция, как и в других типах сигналов, не выражена. Сигналы такого типа регистрировали как у одиночных самцов, так и в группах. При эмиссии сигнала насекомые могут подпрыгивать над субстратом на вытянутых конечностях, затем замолкают и хаотично перемещаются по субстрату. Сигналы этого типа не сопровождаются выраженными поведенческими реакциями, такими как агрессия или ухаживание, поэтому их функциональное значение остается под вопросом.
ОБСУЖДЕНИЕ:
Большинство изученных особей зерновок издавали вибрационные сигналы при конспецифических контактах. Мы отметили три механизма эмиссии сигналов: вибрация брюшка, удары брюшка и головы по субстрату и вибрацию крыльев. Подобные способы эмиссии вибрационных и акустических сигналов известны у представителей многих семейств жуков (Kasper, Hirschberger, 2005; Carisio et al., 2004). При этом стридуляционного механизма эмиссии нами обнаружено не было, хотя структуры, предположительно служащие для стридуляции, описаны у некоторых видов зерновок (Kingsolver et al., 1993), и стридуляция является одним из распространенных способов эмиссии звука у жесткокрылых (Wessel, 2006). Вопреки нашим ожиданиям, не было зарегистрировано звуковой или ультразвуковой компоненты сигналов, которые могут присутствовать в сигналах представителей близких семейств (Shade et al., 1990; Lindeman, Yack, 2013).
Нами было отмечено, что самцы начинают издавать вибрационные сигналы и готовы копулировать уже через несколько часов после выхода имаго из семян фасоли. Как правило, многие насекомые становятся акустически активными только через некоторое время после линьки. По нашему мнению, наиболее вероятным объяснением такой ранней акустической активности является то, что прошедшее метаморфоз насекомое остается на некоторое время в фасоли и после выхода уже полностью сформировано и готово к копуляции. Т.е. момент выхода имаго из фасоли может быть отсрочен от момента имагинальной линьки.
В отличие от самцов акустическая и копуляционная активность самок наблюдалась только к концу первых суток после выхода из фасоли. При этом самцы практически всегда предпринимали попытки копуляции и с только что вышедшими из зерна самками. Молодые самки не издавали специфических сигналов протеста, но убегали от самцов, что затрудняло копуляцию. Наши данные частично согласуются с результатами, полученными на близком виде — C. maculatus, на котором было показано, что самки в культуре могут копулировать с близкородственными самцами (Edvardsson et al., 2008). Мы предполагаем, что самцы и самки, выплодившиеся одновременно, могут находиться в разных репродуктивных фазах. При этом теоретически в природных популяциях вероятность возникновения инбридинга снижается, но в культуре не меняется, т.к. в последнем случае плотность популяции намного выше.
Интересно отметить, что сигналы, издаваемые ударами брюшка и головы о субстрат, по своей структуре и способу эмиссии сходны с сигналами ухаживания, издаваемыми другими жесткокрылыми например некоторыми Curculionidae (Fleming et al., 2013). Так, сигналы Dendroctonus состоят из серии пульсов, как и у A. obtectus (Fleming et al., 2013; Lindeman, Yack, 2013). По последним данным Bruchidae филогенетически достаточно далеки от Curculionoidea и сближаются с Chrysomeloidea (Hunt et al., 2007). Поэтому сходство сигналов может говорить об общих принципах организации акустической коммуникации у жуков либо о параллельном или независимом появлении сходных типов эмиссии сигналов в различных таксономических группах. Сходство структуры сигнала может быть обусловлено и относительно простым механизмом излучения, который ограничивает возможности амплитудно-временной и частотной модуляции сигнала, а, следовательно, и его сложность.
У близкого вида зерновок — C. maculatus в процессе ухаживания самки приподнимают брюшко над субстратом и вибрируют им. Авторы предположили, что такое поведение самок связано с высвобождением феромонов, но не с акустической активностью (Burkholder, Yun-Tai, 1982). По нашим наблюдениям у А. obtectus похожие движения брюшком у самок сопровождаются низкоамплитудными вибрационными сигналами. В настоящее время нет сомнений в мультимодальной природе коммуникационных сигналов, т.е. высвобождение феромонов может сопровождаться акустическими, визуальными, тактильными и другими стимулами. Каждая часть сложного сигнала может выполнять свою функцию и кодировать информацию о разных характеристиках индивидуума. Мы предполагаем что, феромонный и акустический каналы связи могут дублировать друг друга, повышая надежность распознавания конспецифической особи. По-видимому, можно ожидать, что у C. maculatus тремуляция брюшка также должна сопровождаться эмиссией коммуникационных сигналов.
Большинство параметров сигналов A. obtectus стабильно. Интересно, что даже частотные характеристики были достаточно стабильными во всех зарегистрированных типах сигналов (табл. 1). Частотная модуляция в сигналах практически не выражена. На наш взгляд, стабильность и слабую частотную модуляцию в сигналах A. obtectus можно объяснить простотой механизма эмиссии, который не позволяет сильно варьировать частотные параметры. В случае амплитудно-временных параметров сигнала ухаживания сравнительно стабильными были базовые элементы – длительность и период повторения пульсов (табл. 1). На высоких уровнях амплитудно-временной организации (число пульсов в серии), наоборот, мы наблюдали более высокую изменчивость (коэффициент вариации до 50%).
При анализе акустической активности следует учитывать, что у A. obtectus и C. maculatus описано две формы – нормальная и активная (Burkholder, Yun-Tai, 1982; Lextrait et al., 1995; Šešlija et al., 2009, Stojkovic et al., 2011). Эти формы различаются как морфологией, так и поведением – первые менее подвижны, имеют бóльшую продолжительность жизни, а последние более активны и характеризуются быстрым циклом развития (Sano, 1967; Stillwell, Fox, 2007). Было показано, что у близкого вида – C. maculatus – нормальная форма преобладает в популяциях при стабильном наличии ресурсов, например в хранилищах зерна, в то время активная форма способна жить в поле (Burkholder, Yun-Tai, 1982). Несмотря на некоторые морфологические различия, эти формы свободно скрещиваются с образованием фертильного потомства и неограниченно долго сосуществуют внутри одной популяции. Мы предполагаем, что акустическая активность этих форм может различаться. Наша лабораторная культура состояла из особей нормальной формы.
Другим важным моментом является высокая плотность популяции. В культуре рецептивные самцы и самки постоянно контактируют друг с другом. Фактически проблема поиска партнера отсутствует, но более важной может быть проблема выбора лучшего партнера. Поэтому мы можем ожидать упрощения акустического репертуара по сравнению с репертуаром насекомых из природных популяций. Эту гипотезу мы планируем проверить в будущих экспериментах с предъявлением модельных стимулов. Вероятно, для зерновок из природных популяций характерны более сложные сигналы и более выраженные предпочтения самок, чем для особей из культуры.
Список литературы
Burkholder W.E., Yun-Tai Q.I., 1982. Sex pheromone and behavior of the cowpea weevil Callosobruchus maculates // Journal of Chemical Ecology. V. 8. № 2. P. 527–534.
Carisio L., Palestrini C., Rolando A., 2004. Stridulation variability and morphology: an examination in dung beetles of the genus Trypocopris (Coleoptera, Geotrupidae) // Population Ecology. V. 46. P. 27 –37.
Devereau A.D., Gudrups I., Appleby J.H., Credland P.F., 2003. Automatic, rapid screening of seed resistance in cowpea, Vigna unguiculata (L.) Walpers, to the seed beetle Callosobruchus maculatus (F.) (Coleoptera: Bruchidae) using acoustic monitoring // Journal of Stored Products Research. V. 39. № 1. P. 117–129.
Edvardsson M., Rodriguez-Munoz R., Tregenza T., 2008. No evidence that female bruchid beetles, Callosobruchus maculatus, use remating to reduce costs of inbreeding // Animal Behaviour. V. 75. P. 1519–1524.
Fleming A.J.,Lindeman A.A., Carroll A.L., Yack J.E, 2013. Acoustics of the mountain pine beetle (Dendroctonus ponderosae) (Curculionidae, Scolytinae): sonic, ultrasonic, and vibration characteristics // Canadian Journal of Zoology. V. 91. P. 235–244.
Hunt T., Bergsten J., Levkanicova Z., Papadopoulou A., John O., et al., 2007. A comprehensive phylogeny of beetles reveals the evolutionary origins of a superradiation // Science Iss. 318. P. 1913–1916.
Kasper J., Hirschberger P., 2005. Stridulation in Aphodius dung beetles: songs and morphology of stridulatory organs in North American Aphodius species (Scarabaeidae) // Journal of Natural History. V. 39. P. 91–99.
Kingsolver J.M., Romero N.J., Johnson C.D., 1993. Files and scrapers: Circumstantial evidence for stridulation in three species of Amblycerus, one new (Coleoptera: Bruchidae) // Pan-Pacific Entomologist. V. 69. P. 122–132.
Lextrait P., Biemont J.C., Pouzat J., 1995. Pheromone release by two forms of Callosobruchus maculatus females: effect of age, temperature and host plant // Physiological entomology. V. 20. P. 309–317.
Lindeman A.A., Yack J.E., 2013. What’s the password? Female red turpentine beetles (Dendroctonus valens LeConte) grant access to their galleries based on an assessment of male signals // 14th Invertebrate Sound and Vibration international meeting, Glasgow, United Kingdom, July 23 – 26. P. 33.
Mano H., Toquenaga Y., 2008. Wall-making behavior in Callosobruchus maculatus (Coleoptera: Bruchidae) // Annals of the Entomological Society of America. V. 101 (2). P. 449–55.
Njoroge A.W., Affognon H., Mutungi Ch., Richter U., Hensel O., et al., 2017. Bioacoustics of Acanthoscelides obtectus (Coleoptera: Chrysomelidae: Bruchinae) on Phaseolus vulgaris (Fabaceae) // Florida Entomologist. V. 100. № 1. P. 109–115.
Palestrini C., Pensati F., Barbero E., Reyes-Castillo P., Zunino M., 2003. Differences in distress signals of adult passalid beetles (Coleoptera Passalidae) // Bollettino della Societa Entomologica Italiana. V. 135. P. 45–53.
Ribeiro-Costa C. S.,1999. Description of two new species of Amblycerus Thunberg (Col.: Bruchidae) with a probable stridulatory mechanism // Proceedings of the Entomological Society of Washington. V. 101. P. 337–346.
Riede K., Stueben P.E., 2000. The musical Acalles, Observations on the stridulations of Cryptorhynchinae of the Canaries (Col.: Curculionoidea). Cryptorhynchinae study 13. Snudebiller Studies on Taxonomy // Biology and Ecology of Curculionoidea (CURCULIO-Institut, Monchengladbach). V. 1. P. 307–317.
Rup J., 1986. Mating and its attendant behavior in Callosobruchus maculatus (F) (Coleoptera: Bruchidae) // Journal of Stored Products Research. V. 22(2). P. 77–79.
Sano I., 1967. Density effect and environmental temperature as the factors producing the active form of Callosobruchus maculatus (F.) (Coleoptera, Bruchidae) // Journal of Stored Product Research. V. 2. P. 187–195.
Šešlija D., Stojković B., Tucić B., Tucić N., 2009. Egg-dumping behaviour in the seed beetle Acanthoscelides obtectus (Coleoptera: Chrysomelidae: Bruchinae) selected for early and late reproduction // European Journal of Entomology. V. 106. № 4. P. 557–563.
Shade R.E., Furgason E.S., Murdock L.L., 1990. Detection of hidden insect infestations by feeding-generated ultrasonic signals // American Entomologist. V. 36. № 3. P. 231–235.
Shestakov L.S., 2008. Studies of Vibratory Signals in Pentatomid Bugs (Heteroptera, Asopinae) from European Russia // Entomological Review. V. 88. № 1. P. 20–25.
Shestakov L.S., 2015. A comparative analysis of vibrational signals in 16 sympatric bug species (Pentatomidae, Heteroptera) // Entomological Review. V. 95. № 3. P. 310–325.
Stillwell R.C., Fox C.W., 2007. Environmental effects on sexual size dimorphism of a seed-feeding beetle // Oecologia. V. 153. P. 273–280.
Stojković B., Jovanović D. Š., Perovanović J., Tucić N., 2011. Sexual Activity and Reproductive Isolation Between Age-specific Selected Populations of Seed Beetle // Ethology. V. 117. № 9. P. 812–821.
Stojković B., Šešlija Jovanović D., Tucić N., 2012. Transgenerational effects on overall fitness: influence of larval feeding experience on the oviposition behaviour of seed beetle Acanthoscelides obtectus (Say) // Polish Journal of Ecology. V. 60. № 2. P. 387–393.
Wessel A., 2006. Insect sounds and communication: physiology, behaviour, ecology and evolution // CRC Press, Taylor and Francis Group, Boca Raton, London, New York. P. 397–403.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


