Зоологический журнал, 2019, T. 98, № 7, стр. 732-748
Материалы по фауне и экологии коловраток Урала. Семейство Brachionidae (Rotifera, Eurotatoria, Ploima). Род Keratella
А. Г. Рогозин *
Ильменский государственный заповедник УрО РАН,
456317 Миасс, Челябинская обл., Россия
* E-mail: rogozin57@gmail.com
Поступила в редакцию 26.09.2018
После доработки 04.11.2018
Принята к публикации 18.12.2018
Аннотация
Обобщен материал по распространению на Урале коловраток рода Keratella (Rotifera) из семейства Brachionidae на основе исследований автора и анализа литературных источников. Указаны места находок, приведены данные по морфологии, биологии, количественному развитию и индикаторным свойствам видов в водоемах Урала.
Настоящая работа – продолжение обобщения материала по коловраткам семейства Brachionidae на Урале. В предыдущей работе (Рогозин, 2018) были рассмотрены рода Anuraeopsis, Brachionus, Notholca на основе исследований автора и анализа литературных источников. Основные сведения о коловратках содержатся в работах гидробиологов, посвященных рыбохозяйственным проблемам. Сведения по биологии отдельных видов и об их индикаторных свойствах рассеяны в многочисленных, нередко малодоступных публикациях. Мы продолжаем сведение в единое целое накопленных за столетие данных по фауне и экологии коловраток Урала на основе материалов, опубликованных в период с 1910 г. по настоящее время, а также собственных данных автора, полученных на водоемах Южного Урала и Зауралья.
По тем видам, по которым у нас было достаточно данных для расчетов, приведены индивидуальные индикаторные свойства, характеризующие особенности биологии видов по отношению к температуре воды (Рогозин и др., 2015), сапробности и трофическому типу водоема (Рогозин, 2018а). Полученные на местном материале, они наилучшим образом характеризуют биологию видов именно в местных географических условиях. Индивидуальные термо- и трофоиндексы видов, приведенные в вышеназванных работах автора, указаны в скобках. В случае отсутствия подобных сведений использованы литературные данные, применимость которых в здешних условиях, конечно, ограничена.
Род Keratella Bory de St. Vincent 1822 включает около 60 видов, многие из которых встречаются повсеместно и играют важную роль в планктоне. На Урале обнаружено 10 видов Keratella.
Keratella cochlearis (Gosse 1851)
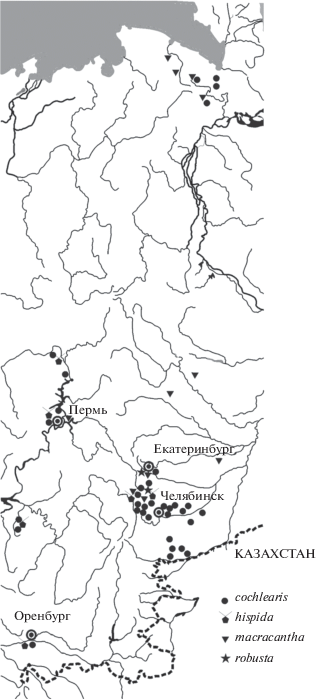
Самый известный и широко распространенный в регионе вид, встречающийся в планктоне практически всех исследованных водоемов (рис. 1). Первое обнаружение – в южноуральском оз. Тургояк (Щелкановцев, 1903). В дальнейшем – многочисленные находки во всех изученных гидробиологами озерах восточных предгорий Южного Урала (Драбкова, Сорокин, 1979; Масленникова, 1941; Подлесный, Троицкая, 1941; Рогозин, 2006, 2009а, б; Фурман, Тиебо, 1910 и др.), в мелких водоемах западных предгорий (Рогозин, 2007), в лесостепных и степных, в том числе солоноватых озерах (Ковалькова и др., 1975; Козлова, 1966; Макарцева, 1978; Подлесный, Троицкая, 1941 и др.), водохранилищах на р. Миасс (Козлова, Шилкова, 1966; Огородникова, 1977 и др.), в р. Урал у Оренбурга (Муравейский, 1923). На Среднем Урале K. cochlearis известен из окрестностей Екатеринбурга (Балабанова, 1949), из р. Камы, ее притоков и озер в ее бассейне (Керенцева и др., 1946; Опарина, 1923; Таусон, 1936, 1946, 1947 и др.), на Полярном Урале – в различных водоемах восточного макросклона Уральских гор (Богданов и др., 2004).
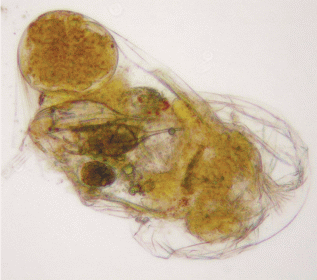
На Урале обитает несколько форм вида (рис. 2), помимо типичной формы cochlearis, это hispida (Lauterborn 1898), macracantha (Lauterborn 1898) и robusta (Lauterborn 1900), а также подвид K. c. nordica Kutikova 1978 (некоторые исследователи (Nogrady, 1980) предлагали повысить его статус до вида). Приведенные выше сведения по распространению относятся к типичной форме, остальные формы встречаются реже. Следует учитывать, что многие гидробиологи-практики при массовой обработке проб не различают и ранее не различали формы K. cochlearis либо, имея дело с типичной формой, специально это не указывали, тем более что разные формы часто встречаются вместе или сменяют друг друга в годовом цикле. Обобщая данные по более чем 500 пробам зоопланктона, собранным на разнотипных озерах Южного Урала, мы установили соотношение частоты встреч четырех форм K. cochlearis в тех случаях, когда они обнаруживались в одном водоеме: cochlearis : hispida : macracantha : robusta = 11 : 5 : 4 : 1. Таким образом, как минимум в половине всех нахождений K. cochlearis исследователь имел дело с типичной формой (рис. 2a). Это позволяет с определенной долей вероятности ориентироваться в тех случаях, когда в публикациях не указывается конкретная форма K. cochlearis. Вариативность размеров типичной формы: длина панциря 145–198, ширина 55–89 мкм, длина передних срединных шипов 22–30, промежуточных 8–15, боковых 12–24 мкм, длина заднего шипа 15–59 мкм.
Рис. 2.
Формы вида Keratella cochlearis (Gosse 1851) из водоемов Урала: a – K. cochlearis f. cochlearis (Gosse 1851) из оз. Большое Миассово, b – K. cochlearis f. hispida (Lauterborn 1898) из оз. Большое Ишкуль, c – K. cochlearis f. macracantha (Lauterborn 1898) из оз. Тургояк, d – K. cochlearis f. robusta (Lauterborn 1900) из оз. Большой Кисегач.

Форма hispida (рис. 2b) согласно опубликованным данным отмечена в р. Урал (Муравейский, 1923), предгорных озерах восточного склона Ильменского хребта на Южном Урале Б. Ишкуль, Тургояк, Увильды (Макарцева, 1978; Рогозин, 2009а), в водоемах западного макросклона Южного Урала (Рогозин, 2007), в р. Каме, ее притоках и прибрежных озерах (Керенцева и др., 1946; Красновская, 1949; Таусон, 1934, 1946, 1947). Согласно неопубликованным материалам Таусон, хранящимся в архиве Ильменского государственного заповедника (г. Миасс Челябинской обл.), а также согласно нашим данным, форма hispida встречается практически во всех исследованных озерах. Размеры: длина панциря 112–180, ширина 60–72 мкм, длина передних срединных шипов 13–20, промежуточных 8–12, боковых 8–14 мкм, длина заднего шипа 10–20 мкм.
Форма macracantha (рис. 2c) на Южном Урале обнаружена в предгорных озерах Ильменского хребта Большое Миассово (Рогозин, 2000), Тургояк (Рогозин, 1995), Увильды (Рогозин, 2009а), а по неопубликованным материалам Таусон, хранящимся в архиве Ильменского гос. заповедника (г. Миасс Челябинской обл.), и в остальных озерах Ильменской группы. На Среднем Урале найдена в озерах Дикое (бассейн р. Тавда – Таусон, 1935), Нижнеосинское, Русское, Синтур, Якунино (бассейн р. Сосьва – Таусон, 1936), Шарташ (окрестности Екатеринбурга – Балабанова, 1949), Источное (окрестности Перми – Опарина, 1923), в р. Кама (Таусон, 1946). Встречена также в различных реках и озерах Полярного Урала (Богданова, 2003; Богданов и др., 2004, 2005). Размеры: длина панциря 218–276, ширина 77–90 мкм, длина передних срединных шипов 33–38, промежуточных 16–19, боковых 22–26 мкм, длина заднего шипа 108–165 мкм.
Форма robusta (рис. 2d) встречается редко, обнаружена в нескольких озерах восточных предгорий Южного Урала (Рогозин, 2004, 2009б), а также в оз. Шарташ в Екатеринбурге (Балабанова, 1949). Размеры: длина панциря 182–188, ширина 62–77 мкм, длина передних срединных шипов 30–35, промежуточных 12–22, боковых 14–20 мкм, длина заднего шипа 60–73 мкм.
Вопрос о морфологической изменчивости K. cochlearis дискутируется давно (обзор см. Кутикова, 1970). Большинство современных исследований показывает, что формы K. cochlearis генетически не детерминированы (по крайней мере, выявленные генетические различия мало соответствуют морфологическим – Cieplinski et al., 2017). Они представляют собой морфы – популяционные приспособления к пространственно–временным неоднородностям трофических и термических условий водной среды (Galkovskaja, Mitjanina, 1989; Hillbricht-Ilkowska, 1983 и др.). Кроме того, и размеры панциря у K. cochlearis определяются условиями среды обитания, отрицательно коррелируя с концентрацией пищи и температурой воды (Diéguez et al., 1998). Действительно, согласно нашим данным, форма cochlearis приурочена преимущественно к теплым эвтрофным водам, hispida к еще более теплым, но менее эвтрофированным, macracantha к холодным олиготрофным, robusta к наиболее холодным, но умеренно эвтрофированным.
Keratella cochlearis nordica известна только на Полярном Урале в мелких водоемах восточного макросклона, в бассейне Нижней Оби в озерах Ингилор, Большое и Малое Щучье (Богданов и др., 2004, 2005).
Keratella cochlearis – самый распространенный и многочисленный вид коловраток в планктоне уральских водоемов. Встречаемость вида по всему массиву наших данных достигает 70%, средняя плотность популяции 80.8 тыс. экз./м3. Наибольшая отмеченная нами численность – свыше 1.1 млн экз./м3 (в июне 2006 г. в политрофном оз. Табанкуль в окрестностях г. Чебаркуль на Южном Урале). В большинстве гидробиологических работ, выполненных на Урале и упоминающих K. cochlearis, этот вид указывается как руководящий в зоопланктоне, составляющий основу численности коловраток и нередко имеющий 100% встречаемость (Грезе, Карпова, 1941; Любимова, 1981; Ковалькова и др., 1975; Макарцева, 1978 и др.).
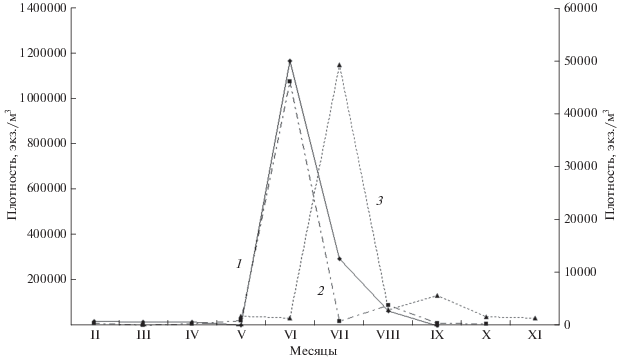
Сезонная динамика керателлы в изученных водоемах характеризуется, как правило, единственным, ярко выраженным пиком численности, приходящимся на весну, начало или середину лета (июнь–июль) в водоемах разного типа и трофического статуса (рис. 3). В ряде случаев наблюдается зимне-ранневесенний пик, еще подо льдом (февраль–март). Так, в оз. Кундравинском (южноуральская лесостепь) в конце зимы K. cochlearis достигала максимума численности 55.2 тыс. экз./м3, в то время как летом и осенью – менее 1 тыс. экз./м3 (Козлова, 1966). Мы наблюдали пик численности керателлы в марте 2015 г. (133 тыс. экз./м3 в оз. Большое Миассово, восточные предгорья Ильменского хребта).
Рис. 3.
Сезонная динамика численности Keratella cochlearis в озерах Южного Урала Табанкуль (1), Большой Кисегач (2), Тургояк (3). Левая ось – плотность в оз. Табанкуль, правая ось – плотность в озерах Большой Кисегач и Тургояк.
Согласно другим исследованиям для K. cochlearis могут быть характерны два пика численности – большой весенний и летне-осенний, вдвое меньше весеннего, а также несколько мелких пиков (Devetter, 1998). Как было упомянуто выше, K. cochlearis – потребитель бактериопланктона, нанофлагеллят, детрита и более сильный конкурент за эти ресурсы, чем другие коловратки (Kirk, 2002). Ясно, что весной вспышка численности керателлы определяется обилием пищи: в этот период воды обогащены органическим веществом и наблюдается массовое развитие и последующее отмирание планктонных водорослей. Дальнейший спад объясняется действием ряда причин. В некоторых озерах керателла активно потребляется хищными коловратками из рода Asplanchna (Hofmann, 1983), как, например, мы наблюдали в озере Большой Ишкуль (рис. 4), причем репродуктивные самки потребляются избирательно (Conde-Porkuna, Declerck, 1998). Отметим, что копеподы и молодь рыб на численность K. cochlearis влияния не оказывают (Hewitt, George, 1987; Williamson, 1986). Однако влиянием аспланхны, конечно, нельзя целиком объяснить последующий спад численности коловраток. Главную роль играет конкуренция с развивающимися к середине лета ветвистоусыми ракообразными, неоднократно было показано, что, например, дафнии конкурентно исключают K. cochlearis при питании нанофлагеллятами (Gilbert, 1985; Arvola, Salonen, 2001).
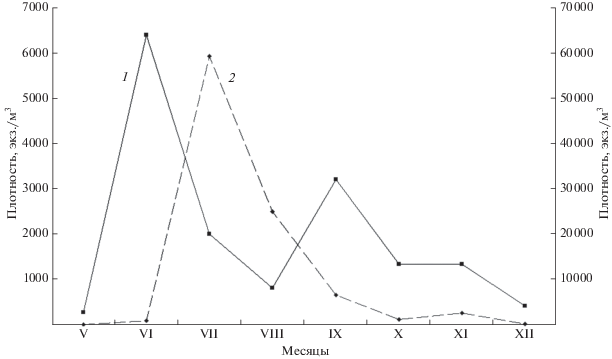
Такие особенности взаимоотношения керателлы и кладоцер иллюстрирует рис. 5. После схода льда в мае 1996 г. в южноуральском оз. Большое Миассово в июне наблюдался типичный раннелетний пик численности K. cochlearis, в этот период массовое развитие ракообразных еще только начиналось. В июле кладоцеры достигли наибольшего обилия, при этом численность керателлы стала резко снижаться. С августа при охлаждении воды началась нарастающая депрессия ветвистоусых ракообразных, что привело к появлению осеннего, менее выраженного, чем весенний, пика численности коловратки.
Рис. 5.
Сезонная динамика численности Keratella cochlearis (1) и Cladocera (2) в оз. Большое Миассово (Южный Урал). Левая ось – плотность Cladocera, правая ось – плотность K. cochlearis.
Вертикальное распределение K. cochlearis в водной толще было изучено нами в оз. Большое Миассово (максимальная глубина 21 м). Оно однотипно в течение периода открытой воды – несмотря на встречаемость по всей водной колонке, коловратки избегают гиполимниона, концентрируясь преимущественно в эпилимнионе, обычно вблизи границы термоклина или несколько выше. Наиболее населенный K. cochlearis горизонт водной толщи – 5–7 м от поверхности. Приуроченность этой коловратки преимущественно к верхним слоям воды отмечена неоднократно и другими исследователями (Galkovskaja, Mitjanina, 1989; Primicerio, 2000).
По отношению к предпочитаемой температуре воды K. cochlearis смело может быть отнесен к эвритермным видам. Однако разные формы вида существенно различаются в этом отношении. Cochlearis и hispida – термофильные эврибионтные (индекс стено/эврибионтности SEI = 1.7, см. Рогозин, 2018а), причем hispida немного более теплолюбивая (индивидуальные термоиндексы 1.7 и 1.9 соответственно); macracantha и robusta – криофильные (1.0 и 1.4), причем последняя – стенотермная.
По отношению к трофическому статусу водоема разные формы K. cochlearis по нашим данным существенно различаются. Типичная форма cochlearis приурочена преимущественно к эвтрофным условиям (может встречаться и в политрофных водах), hispida и macracantha – к мезотрофным, robusta – к олиготрофным. При этом из всех четырех форм только robusta выраженно стенобионтная (SEI = 3.9), остальные имеют довольно широкий диапазон встречаемости. Возвращаясь к вопросу о морфологической изменчивости K. cochlearis, следует отметить явную “специализацию” форм применительно к термическим и трофическим условиям водоема, а их наличие можно рассматривать как приспособительный механизм популяции при существовании в широком диапазоне условий среды обитания.
Следует отметить также высокую устойчивость керателлы к низкой концентрации растворенного кислорода – даже при 0–2 мг О2/дм3 ее популяция может достигать высокой плотности (Herzig, 1987).
Индивидуальные сапробные индексы форм K. cochlearis, полученные на материале уральских водоемов, существенно отличаются от тех, что были определены в центральной Европе (Sladeček, 1983). Типичная форма из европейского олигобетамезасапроба превращается в альфамезосапроба (сапробный индекс 2.6 вместо 1.7), hispida из олиго- в альфамезосапроба (2.5 вместо 1.1) и лишь robusta сохраняет свойства олигосапроба (1.1 в Европе, 0.9 на Урале). Данных по форме macracantha Сладечек не приводит, по нашим данным это олигосапроб (0.9). Индикаторные веса колеблются от 2.1 до 3.2, т.е. диапазон толерантности к органическому загрязнению вод умеренно широкий.
На Урале K. cochlearis показывает себя как эвригалинный вид, достигающей высокой численности как в ультрапресных, так и соленых озерах (до 3.5‰).
Вид имеет всесветное распространение, в России известен повсеместно. Одна из наиболее обычных и многочисленных коловраток в водоемах всех типов во всех географических зонах.
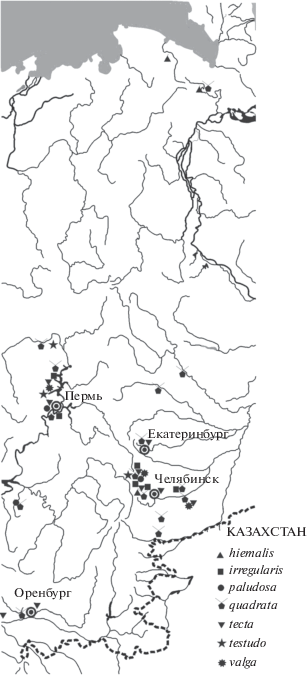
Keratella hiemalis Carlin 1943
Впервые этот вид был обнаружен только в начале 2000-х гг. на Полярном Урале (Богданова, 2003; Богданов и др., 2004, 2005). В 2007 и 2015 гг. найден нами на Южном Урале в предгорном оз. Большое Миассово (рис. 6). Это, по-видимому, подтверждает мнение Кутиковой (1970) о том, что вид довольно широко распространен в северных и умеренных широтах, а редкость его находок объясняется смешиванием с Keratella quadrata, от которого K. hiemalis внешне отличается незначительными деталями строения. По нашим данным длина панциря 190–230, ширина 85–90 мкм, длина передних спинных шипов 30–40, задних 48–63 мкм. Богданов с соавторами (2004, 2005) не указывает численность K. hiemalis. Согласно нашим данным, она не превышает 500 экз./м3. Вид встречался изредка только в начале весны, подо льдом и сразу после схода льда в нижних слоях воды (15–20 м глубины). Приуроченность популяции вида к гиполимниону в начале весны отмечена и другими исследователями (Hofmann, 1987). По типу питания K. hiemalis – типичный планктонный альгодетритофаг, потребляющий мелкоклеточные хлорококковые, вольвоксовые, эвгленовые, диатомовые водоросли размером клеток менее 10 мкм (Zimmermann, 1974). Как и для многих других коловраток с подобным типом питания, максимум развития отмечается весной (Herzig, 1987).
По отношению к температурному фактору K. hiemalis, видимо, следует считать криофильным видом, но с высокой температурной пластичностью. С одной стороны, он известен главным образом из холодноводных озер Европы, на Урале отмечен преимущественно в полярных широтах, а наши находки на Южном Урале сделаны ранней весной в придонных, наиболее холодных слоях воды. К холодноводным стенотермным видам его относят и Пейлер (Pejler, 1980), и другие исследователи (Lehtovaara et al., 2014). С другой стороны, известно, что K. hiemalis устойчив к высокой температуре воды и сохраняется в планктоне даже при 29°С (Galkovskaja, 1987). Он также выносит низкую концентрацию кислорода и успешно размножается при 0–2 мг О2/дм3 (Herzig, 1987). Деветтер (Devetter, 1998) отмечал, что численность K. hiemalis отрицательно коррелирует с температурой воды и первичной продукцией десмидиевых и сине-зеленых водорослей. В общем и целом особенности биологии вида успешно объясняют его приуроченность к весеннему сезону.
Собственных данных по предпочтению K. hiemalis вод определенного трофического статуса у нас недостаточно. Озеро Большое Миассово, в котором мы обнаружили этот вид, относится к мезотрофному типу с признаками олиготрофии. В основном он известен из ультраолиготрофных и олиготрофных озер Европы, хотя встречался также и в эвтрофных водах (Jersabek, Bolortsetseg, 2010). Неудивительно, что вид относится к олигосапробам (Sladeček, 1983).
Распространен в Голарктической области.
Keratella irregularis (Lauterborn 1898) (рис. 6; 7a, 7b)
Редкий вид для фауны региона, до настоящего времени описано всего несколько находок от Южного до Полярного Урала. В России известно 3 формы вида, помимо типичной irregularis, это angulifera (Lauterborn 1900) и wartmanni (Asper et Heuscher 1889). В ряде публикаций форма вида не была указана. Первая находка – в р. Каме (форма irregularis) и оз. Диком (форма wartmanni) в районе Перми (Опарина, 1923). В прибрежных озерах Камы был встречен также Таусон (1934). Впоследствии обнаружен в озерах восточных предгорий на Южном Урале: Большое Миассово (формы irregularis и angulifera), Тургояк (форма irregularis, Рогозин, 1995) и Увильды (форма angulifera Рогозин, 2009а). На Полярном Урале встречен в предгорных озерах бассейна р. Байдаратаяха (Богданов и др., 2004).
Наши исследования показывают, что K. irregularis распространен гораздо шире, чем можно судить по опубликованным материалам. Вероятно имело место смешение K. irregularis с K. cochlearis, особенно при разборе массового гидробиологического материала. Мы находили K. irregularis в предгорных южноуральских озерах Аракуль (типичная форма и wartmanni), Аргаяш (то же), Большой Еланчик (wartmanni), Большой Ишкуль (типичная форма и wartmanni), Большой Кисегач (типичная форма и angulifera), Еловое (то же), Иткуль (типичная форма), Кысыкуль (wartmanni), Малый Теренкуль и Савелькуль (типичная форма), а также в лесостепных солоноватых озерах Смолино (типичная форма и angulifera) и Сугояк (wartmanni).
Размеры исследованных нами особей: длина панциря без заднего шипа 105–115, ширина 60–73 мкм, длина заднего шипа 35–41, передних 19–22, боковых шипов 20–21 мкм.
Численность K. irregularis в уральских водоемах по опубликованным данным сравнительно невысока – в оз. Тургояк в среднем 340 экз./м3, в оз. Большое Миассово – обычно в пределах 17–18 тыс. экз./м3, максимальная – 22.8 тыс. экз./м3 (Рогозин, 1995). Согласно нашим материалам, средняя численность K. irregularis по всем находкам составила 2.75 тыс. экз./м3, при этом максимум достигал 154 тыс. экз./м3 (оз. Большой Кисегач, июнь 2007 г.). Большинство находок вида относятся к летним месяцам, наиболее многочислен он был в июне и июле, в осенние месяцы практически не встречался. Это согласуется с данными Вирро по Чудскому озеру (Virro, 2001), где пики численности K. irregularis приходились на июнь или август. Могут отмечаться и два пика – летом и осенью (Telesh, 1993). В целом сезонная динамика K. irregularis похожа на таковую K. cochlearis и во многом определяется конкуренцией за пищевые ресурсы с кладоцерами (Telesh, 1993).
Среди разных форм вида существует выраженная дифференциация по отношению к термическому фактору: типичная форма и wartmanni – стенотермные термобионты (индивидуальные термоиндексы 2.7 и 2.6 соответственно), angulifera – криофильная форма (1.3); соответственно в сезонном цикле angulifera обычно появляется в мае, а летом ее сменяют другие формы вида. На приуроченность K. irregularis к теплому времени года и теплым водам указывают многие авторы (Eloranta, 1982; Jersabek, Bolortsetseg, 2010).
Формы K. irregularis различаются также по отношению к трофности водоемов: angulifera и irregularis (типичная) – олиготрофы (индивидуальные индексы 0.3 и 0.8 соответственно), wartmanni – эвтроф (1.7), причем все они и вид в целом стенотрофные, хорошие индикаторы трофических условий в водоеме (Рогозин, 2018а). По мнению ряда авторов K. irregularis предпочитает эвтрофные воды (Jersabek, Bolortsetseg, 2010). В целом следует считать этот вид весьма экологически пластичным, различные его формы имеют, вероятно, приспособительное значение. Так, angulifera приурочена к холодным, а irregularis – к теплым олиготрофным водам, wartmanni – к теплым эвтрофным. Это же относится и к органическому загрязнению воды (сапробности): формы angulifera и irregularis – типичные олигосапробы с индивидуальными сапробными индексами 1.0 и 1.2 соответственно, тогда как wartmanni – бетамезосапроб (1.8), все формы имеют высокий индикаторный вес. Сладечеком (Sladeček, 1983) вид отнесен к олигосапробам (1.1) с низким индикаторным весом. Последнее становится понятным, если не различать отдельные формы вида и определять сапробность по всему их комплексу в целом. Как видим, это может быть не вполне корректно.
K. irregularis довольно широко известен в северных и умеренных широтах России (Кутикова, 1970), распространен в Голарктической области.
Kerarella paludosa (Lucks 1912) (рис. 6; 7b)
Всего три находки типичной формы этого вида известны на Урале – в болоте на берегу р. Камы (Опарина, 1923), в заболоченном озерном деривате вблизи оз. Большое Миассово в восточных предгорьях Южного Урала (Рогозин, 1995) и в Миньярском пруду на р. Сим (приток р. Белой, западный макросклон Южного Урала) (Рогозин, 2007). Размеры особей из Миньярского пруда: общая длина тела 148–154 мкм, ширина 55 мкм, длина спинных шипов 25–29 мкм, боковых шипов 15–19 мкм, брюшных шипов 14–16 мкм, заднего шипа 15–18 мкм.
Численность коловратки в пруду в июле достигала 4.2 тыс. экз./м3. Это единственные количественные данные о K. paludosa на Урале. Ввиду редкости находок экологические свойства вида нам определить не удалось. Согласно литературным данным вид стенобионтный, приурочен к растительному субстрату в мелких пресных, преимущественно заболоченных водоемах и болотах, где встречается среди сфагновых мхов (Кутикова, 1970; Pejler, Bērziņš, 1989), что частично согласуется с условиями наших находок. Пейлер и Берзинь отмечают его нахождение в шведских водоемах среди носиковой осоки (Carex rostrata), сфагнума обманчивого (Sphagnum apiculatum = = S. fallax), пузырчатки (Utricularia). Вид считается ацидофильным (обитает в водах с рН около 6 – Jersabek, Bolortsetseg, 2010), в доказательство чему приводится и сильно утолщенный панцирь с выраженной скульптурой (Pejler, Bērziņš, 1989). Авторы объясняют это тем, что в кислых водах роль хищников вместо рыб берут на себя беспозвоночные, питающиеся более мелкими животными, в том числе коловратками, у которых поэтому развивается более крепкий панцирь. Однако находка K. paludosa в Миньярском пруду при относительно высокой численности противоречит оценкам его ацидофильности, т.к. вода в пруду высокощелочная (рН до 9). Видимо, ацидофильность K. paludosa преувеличена и вопрос пока нельзя считать окончательно решенным. Сладечек (Sladeček, 1983) относит K. paludosa к олигосапробам с высоким индикаторным весом.
Вид известен на всей территории России из немногочисленных находок, имеет голарктическое распространение.
Keratella quadrata (Müller 1786) (рис. 6; 7d)
Один из наиболее широко распространенных видов планктонных коловраток, на Урале встречается повсеместно в разнотипных водоемах. Первые находки сделаны в начале прошлого века в многочисленных озерах восточных предгорий Южного Урала – Акакуль, Алабуга, Иртяш, Кажакуль, Увильды и др. (Фурман, Тиебо, 1910). В других озерах этого обширного лимнологического района K. quadrata впоследствии находили многократно на протяжении всего 20 века (Масленникова, 1941; Уломский, 1964; Драбкова, Сорокин, 1979; Козлова, 1979 и др.). На Южном Урале этот вид обнаружен и в водоемах западных предгорий (Рогозин, 2007) и в Предуралье (Боев, 1981). Южнее вид часто встречался в лесостепных и степных районах Зауралья как в пресных, так и солоноватых озерах, а также водохранилищах и прудах (Зиновьев, 1931, 1934; Подлесный, Троицкая, 1941; Козлова, 1966; Любимова, 1971; Огородникова, 1977; Макарцева, 1978 и др.) вплоть до р. Урал в районе Оренбурга (Муравейский, 1923). На Среднем Урале K. quadrata находили в р. Каме, ее притоках и озерах бассейна, а также в озерах и реках бассейнов Оби и Тобола (Опарина, 1923; Таусон, 1934, 1936, 1946; Балабанова, 1949; Богданов и др., 2007 и др.). Неоднократно встречен и на Полярном Урале (Богданов и др., 2004, 2005).
Наиболее широко распространена типичная форма K. quadrata, встречающаяся повсеместно. Более редки формы dispersa Carlin 1943, frenzeli (Eckstein 1895) и reticulata Carlin 1943. Первая известна только на Южном Урале из предгорных озер Большой Ишкуль, Большой Кисегач и Табанкуль (Рогозин, 2006), лесостепных оз. Мисяш (неопубликованные данные Таусон), Смолино (данные автора) и степного солоноватого оз. Южиган; в этом же озере сделана находка формы reticulata (данные автора), которая также обнаружена и в предгорном пресном оз. Малый Теренкуль (Рогозин, 2009б). Форма frenzeli известна только на Полярном Урале из озер бассейнов рек Малой Оби (Богданов и др., 2004) и Кары (Богданова, 2003). Поскольку названные формы K. quadrata достаточно легко различимы по внешнему виду, у нас нет оснований предполагать смешение их с типичной формой даже при массовом разборе гидробиологического материала (как, вероятно, имело место в отношении упомянутой выше K. irregularis), поэтому все ссылки на K. quadrata в литературе мы относим к типичной форме. Согласно нашим данным ее размеры: длина панциря 154–298, ширина 90–102 мкм, длина передних срединных шипов 32–48, промежуточных 15–25, боковых 15–26 мкм, длина задних шипов 135–178 мкм. Размеры формы reticulata: длина панциря 198–206, ширина 88–89 мкм, длина передних срединных шипов 35–39, промежуточных и боковых 30–34, задних 55–59 мкм.
Как и у других видов рода, формы K. quadrata отличаются по экологическим свойствам и, вероятно, имеют приспособительное значение для популяций вида. Типичная, наиболее распространенная форма – криофильная (1.0), но с высоким уровнем эврибионтности, довольно часто встречающаяся во всех температурных зонах. Форма reticulata – стенотермный криобионт (0.4), а dispersa – термофильная и также стенотермная. Подобные различия для группы форм quadrata и dispersa подтверждают и другие исследования (Roche, 1993), где показано, что типичная форма предпочитает более холодные, а dispersa – более прогретые воды. Фактор трофности водоема очевидно не играет столь существенной роли, как термический, поскольку все три формы относятся к мезоэвтрофам с довольно широкой амплитудой приспособляемости. Они также толерантны к органическому загрязнению и относятся к альфамезосапробам с индивидуальными сапробными индексами на уровне 2.5–2.8, что кардинально отличается от их свойств в водоемах Центральной Европы, где по данным Сладечека (1983) K. quadrata – олигобетамезосапробный вид (1.5).
Поскольку K. quadrata была многочисленна как в ультрапресных, так и в соленых озерах, можно сделать вывод о ее эвригалинности, что совпадает с опубликованными данными (Jersabek, Bolortsetseg, 2010).
K. quadrata – второй после K. cochlearis вид по распространенности и обилию в водоемах Урала, по массиву наших данных встречаемость превышает 52%, средняя численность по всем пробам (529) – 20.3 тыс. экз./м3. Максимальная плотность популяции – более 857 тыс. экз./м3 – зарегистрирована в мае в эвтрофном оз. Малый Теренкуль (восточные предгорья Ильменского хребта на Южном Урале в районе г. Чебаркуль Челябинской области).
Гидробиологи, работавшие на водоемах Южного Урала в прошлом веке, неоднократно отмечали, что K. quadrata один из наиболее распространенных видов, однако приводимая ими численность как правило невелика, редко превышает 1–2 тыс. экз./м3. В настоящее время вид стал гораздо более обильным, что можно связать с общим ростом трофического статуса водоемов в результате потепления климата (Рогозин, 2013).
По нашим данным для K. quadrata, как и для K. cochlearis, характерен один большой главный пик численности в течение года и один-два малых. Основной пик приходится обычно на начало-середину лета в зависимости от глубины, размеров и скорости прогревания водоема, остальные – на начало весны (еще подо льдом) и позднюю осень при остывании воды. Основной пик может наблюдаться и ранней весной, и поздней осенью, а второстепенные – в остальные упомянутые периоды (рис. 8). Сезонная динамика K. quadrata зависит от трех основных факторов – обеспеченности пищей, пресса хищников (коловратки рода Asplanchna, хищные циклопы), конкуренции за пищевые ресурсы с другими коловратками и кладоцерами. Керателла известна как полифаг, питающийся частицами размером до 10 мкм – различными зелеными, золотистыми, эвгленовыми водорослями, центрическими диатомеями, детритом (Walz, 1997). Однако предпочитает она гетеротрофных жгутиконосцев (Holst et al., 1998), а водоросли при этом являются менее эффективным кормом для K. quadrata, чем простейшие (Boёchat, Adrian, 2006). Изобилие пищи в весенний период после схода льда при отсутствии еще не развившихся кладоцер приводит к основному, наиболее типичному весенне-летнему пику численности коловратки. Осенний пик также может быть связан с массовым развитием простейших, водорослей и высоким содержанием детрита при поступлении в воду органических веществ при интенсивных осадках, а кроме того, и с развитием фитопланктона после летней депрессии, как показано в экспериментальных условиях Хофманном и Хёфле (Hoffmann, Höfle, 1993).
Как неоднократно отмечалось, динамика K. quadrata регулируется не только обилием пищевых ресурсов весной и в начале лета, но и хищничеством со стороны коловраток рода Asplanchna и циклопов, причем длина задних шипов коррелирует с прессом хищников (Conde-Porcuña, Declerck, 1998; Herzig, 1987). Однако наши неопубликованные данные по разнотипным водоемам Южного Урала показывают отсутствие влияния аспланхны на динамику плотности коловраток, скорее численность хищника следует за пиками развития K. quadrata. Что касается циклопов, то они слишком малочисленны, чтобы влиять на популяцию коловраток. Конкурентное влияние кладоцер на K. quadrata приводит к тому, что фазы массового роста популяции коловратки обычно приходятся на периоды до или после летнего пика численности ракообразных (Eckert, Walz, 1998). Наши данные в основном этому соответствуют, хотя иногда главный пик численности K. quadrata может совпадать с массовым развитием ракообразных.
Вид имеет всесветное распространение, в России известен повсеместно. Одна из наиболее обычных и многочисленных коловраток в водоемах всех типов во всех географических зонах страны.
Keratella serrulata (Ehrenberg 1838)
Единственная находка на Урале – в озерах бассейна рек Лонготьеган и оз. Возейты (бассейн р. Харбей) на Полярном Урале, в бассейне Оби (Богданов и др., 2004, 2005). Встречена форма curvicornis Rylov 1926 без задних шипов. Количественные данные авторы не приводят.
Рядом авторов K. serrulata считается холодноводным видом (Sharma, Sharma, 2014). Кутиковой (1970) отмечен как типичный обитатель дистрофных болотистых водоемов. В связи с этим характерен для планктона пресных вод с повышенной кислотностью (до 6 рН) и относится к ацидофилам (Freedman, 1995; Jersabek, Bolortsetseg, 2010). Принадлежит группе видов – индикаторов олигомезотрофных условий в водоемах (Mäemets, 1983). Сладечеком (Sladeček, 1983) отнесен к к олигосапробам с высоким индикаторным весом.
Широко распространен в северных и умеренных широтах России, а также во всех зоогеографических областях мира кроме Антарктики и Океании. Редкость находок K. serrulata на Урале, несмотря на обилие подходящих местообитаний, может быть связана с недостаточной изученностью водоемов болотного типа.
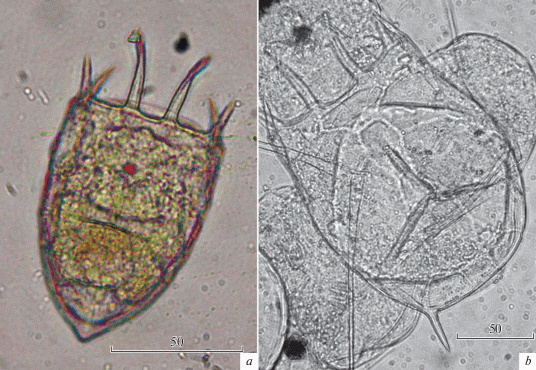
Keratella tecta (Gosse 1851) (рис. 6; 9а)
Первое обнаружение на Урале – в его самых южных районах в р. Урал (Муравейский, 1923), впоследствие там же встречен Акатовой (1954). Большинство находок на Южном Урале сделано в озерах восточных предгорий Ильменского хребта: Аргаяш, Большой Ишкуль (Макарцева, 1978), Малое Миассово (Драбкова, Сорокин, 1979), Большое Миассово (Рогозин, 2000), Табанкуль (Рогозин, 2006), Кармаккуль, Сириккуль и другие озера Ильменской группы (неопубликованные материалы Таусон и данные автора). Обнаружен также в южноуральских лесостепных озерах Кундравинское (Макарцева, 1978), Чебаркуль (неопубликованные материалы Таусон) и Шершневском водохранилище на р. Миасс (данные автора). Последняя по времени находка сделана нами в степном солоноватом озере Южиган. На Среднем Урале K. tecta встречалась в р. Каме и озерах ее бассейна (Опарина, 1923, Таусон, 1946 и др.), оз. Шарташ (Балабанова, 1949). Находок в более северных широтах Урала не зарегистрировано. По нашим материалам длина панциря 85–105, ширина 51–58 мкм, длина срединных шипов 17–19, промежуточных 9–10, боковых 9–14 мкм.
Данные по обилию вида в опубликованных материалах отсутствуют. По нашим данным встречается с мая по сентябрь, максимальная плотность свыше 380 тыс. экз./м3 зарегистрирована в июне 2015 г. в гипертрофном оз. Табанкуль. Как правило, численность колеблется в пределах 0.5–1.5 тыс. экз./м3, наибольшие значения приходятся обычно на максимальный прогрев воды в середине–конце лета. Кутикова (1970) отмечает приуроченность вида к тепловодным водоемам. Согласно нашим данным, K. tecta термобионт (2.4) со средними значениями индекса стено/эврибионтности (SEI = 2.59). Любопытно, что даже в значительно более теплом климате Индии K. tecta достигает максимума плотности в летнее время, зимой она гораздо малочисленнее (Gadhikar, Savale, 2016). Тем не менее, существует мнение об эвритермности вида (Jersabek, Bolortsetseg, 2010), с которым трудно согласиться.
Keratella tecta относится к видам эвтрофных водоемов (стенобионтный эвтроф – 1.9). Соответственно, вид устойчив к органическому загрязнению вод (Pedrozo, Rocha, 2005) и по нашим данным является альфамезосапробом (2.7) с высоким индикаторным весом. Подчеркнем, что в крупнейшей работе по сапробности Сладечека (1983) данных по K. tecta нет. Приуроченность K. tecta к теплым эвтрофным водам отмечена другими исследователями неоднократно, рост эвтрофирования приводит к увеличению плотности вида (De Manuel, Armengol, 1993; Haberman, 2000). В последней работе, например, показано, что эвтрофирование Чудского озера начиная с 1960-х гг. привело к значительному росту плотности популяции K. tecta в наиболее эвтрофированных южных частях озера (с единичных экземпляров до 34 тыс. экз./м3). Рост обилия K. tecta в планктонных сообществах многими исследователями интерпретируется как хороший показатель эвтрофирования (Demetraki, Paleolog, 2013; May et al., 2014 и др.). Вид признан индикатором эвтрофии (Haberman, Halnda, 2014). Как индикатор трофического статуса озер также рассматривается доля K. tecta относительно K. cochlearis (Ejsmont-Karabin, 2012). Для эстуария Невы предложен Keratella-индекс (KIN), учитывающий соотношение обилия K. cochlearis и K. tecta как показатель эвтрофирования (Gopko, Telesh, 2013). Численность K. tecta положительно коррелирует с содержанием в воде хлорофилла а, растворенного фосфора и азота (Celewicz-Gołdyn, Kuczyńska-Kippen, 2017). В теплых эвтрофных водах K. tecta тем не менее не достигает очень высокой численности. Такие же условия обитания предпочитают многие мелкие кладоцеры, которым коловратка проигрывает в пищевой конкуренции (Hugh, Gilbert, 1991), а крупные кладоцеры повреждают коловраток (Burns, Gilbert, 1986).
Поскольку K. tecta довольно часто встречается в солоноватых водах эстуариев рек и морских прибрежий, вид можно в определенной степени считать эвригалинным (Jersabek, Bolortsetseg, 2010).
Сравнительная редкость находок на Урале K. tecta может объясняться относительно суровыми климатическими условиями, недостаточным прогреванием многих водоемов. В России вид распространен повсеместно. Космополит.
Keratella testudo (Ehrenberg 1832)
Редкий на Урале вид (рис. 6), возможно из-за смешения с Keratella quadrata. Впервые отмечен на Среднем Урале (Предуралье) в р. Каме (Керенцева и др., 1946; Таусон, 1947). После этого единственная находка на Южном Урале сделана нами в восточных предгорьях Ильменского хребта в искусственном заболоченном водоеме Няшевский Прудок (в настоящее время не существует) в бассейне оз. Большое Миассово (Рогозин, 2004). Встречена типичная форма, панцирь имеет следующие размеры: длина 140–150, ширина 95–102 мкм, длина передних спинных шипов 30–32, промежуточных 15–18, боковых 20–21 мкм, длина задних шипов 15–18 мкм. Вид был обнаружен только в августе, численность составляла 5.6 тыс. экз./м3. Ввиду единичности находки экологические свойства вида на Урале не определены. В упомянутых выше работах по р. Каме количественных характеристик уровня его развития нет.
Кутикова (1970) характеризует вид как обитателя небольших водоемов и болот. Согласно литературным данным он эвритермный и встречается в течение всего сезона открытой воды с весны до осени как в слабокислых, так и слабощелочных водах (Jersabek, Bolortsetseg, 2010). Олигобетамезосапроб (Sladeček, 1983). Полиморфизм, выражающийся в наличии (типичная форма) или отсутствии задних шипов (форма gossei Ahlstrom 1943) определяется наличием пищевых конкурентов и беспозвоночных хищников. Как и другие керателлы, потребитель нано- и микрофлагеллят. Типичная форма более устойчива к хищничеству со стороны Asplanchna и случайному травмированию в фильтрационных камерах Daphnia pulex (Stemberger, Gilbert, 1987). Кроме того, среди хищников, потребляющих K. testudo – хищные циклопы и личинки хаоборусов (Jonsson et al., 2005).
Вид по мнению Кутиковой (1970) широко распространен на территории России, редкость находок связана со смешением с K. quadrata. Известен в Голарктической и Афротропической областях.
Keratella ticinensis (Callerio 1920)
До настоящего времени известно всего две находки этого вида на Урале, обе сделаны в Предуралье в р. Каме (Опарина, 1923; Керенцева и др., 1946). Количественные данные по развитию K. ticinensis авторы находок не приводят. Вид по одним данным эвритермный (Devetter, 1998), по другим – криофильный стенотермный (Lehtovaara et al., 2014). Согласно литературным данным может предпочитать дистрофные водоемы, однако встречается и в гипертрофных озерах. Разные авторы считали его индикатором как дистрофных (Radwan, 1976), так и эвтрофных условий (Hakkari, 1978). Олигобетамезосапробный вид (Sladeček, 1983). В России известен из немногих местообитаний, но, по-видимому, широко распространен, т.к. обнаружен в северо-западной России, на Урале, в Западной Сибири и т.д. Имеет голарктическое распространение.
Keratella valga (Ehrenberg 1834) (рис. 6; 9b)
Впервые обнаружен в р. Каме (Таусон, 1947). Долгое время это была единственная находка на Урале. В июне 2015 г. форма K. valga monospina (Klausener 1908) найдена нами в пресном эвтрофном озере Малый Теренкуль (восточные предгорья Ильменского хребта на Южном Урале), в сентябре 2017 г. типичная форма – в солоноватом эвтрофном оз. Большуха (предлесостепное Зауралье). Размеры составили: длина панциря 170–180, ширина 72–85 мкм, длина передних срединных шипов 45–55, промежуточных 25–31, боковых 26–30 мкм, длина заднего шипа 30–32 мкм. В обоих случаях численность не превышала 2–3 тыс. экз./м3. Ввиду единичности находок экологические свойства вида на Урале определить не удалось. Обычно встречается летом в небольших водоемах (Кутикова, 1970). По литературным данным K. valga эвритермный вид (Jersabek, Bolortsetseg, 2010). Как показали бельгийские исследователи (Azémar et al., 2010), K. valga вообще демонстрирует черты эврибионта по отношению ко многим факторам внешней среды (содержание биогенных веществ, кислорода, хлорофилла а, БПК5, рН, численность копепод и кладоцер и др.). Согласно другому исследованию, на обилие K. valga положительно влияет температура воды и содержание нитрат-ионов, а прозрачность, содержание хлорофилла а и концентрация нитритов – отрицательно (Medeiros et al., 2010). Олигобетамезасапроб (Sladeček, 1983). В России известен на всей территории. Космополитический вид.
Рис. 7.
Виды рода Keratella из водоемов Урала: a – K. irregularis f. wartmanni (Asper et Heuscher 1889) из оз. Аракуль, b – K. irregularis f. angulifera Lauterborn 1900 из оз. Тургояк, c – Kerarella paludosa (Lucks 1912) из Миньярского пруда, d – K. quadrata f. dispersa Carlin 1943 из оз. Табанкуль.

Рис. 8.
Сезонная динамика Keratella quadrata в озерах Южного Урала: Табанкуль (1), Большое Миассово (2), Смолино (3). Левая ось – плотность в оз. Табанкуль, правая ось – плотность в озерах Большое Миассово и Смолино.
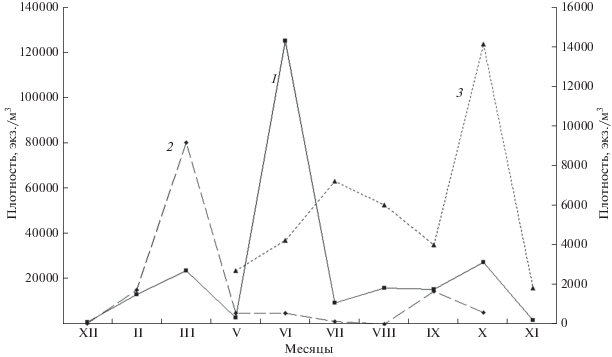
Рис. 9.
Виды рода Keratella из водоемов Урала: a – K. tecta (Gosse 1851) из Шершневского водохранилища на р. Миасс, b – K. valga (Ehrenberg 1834) из оз. Малый Теренкуль.
Род Keratella включает как наиболее широко распространенных и многочисленных в водоемах Урала коловраток, так и редкие виды, представленные единичными находками. Keratella cochlearis и K. quadrata в большинстве исследованных водоемов встречаются круглогодично и составляют основу зоопланктона по численности особей. Характерной для них является широкая амплитуда приспособляемости, выражающаяся, в частности, в наличии морф, приуроченных к определенным условиям среды обитания. Среди последних важнейшее значение имеет термический фактор. Значительную роль в планктонных сообществах играют также K. irregularis и K. tecta. Остальные 6 видов рода представлены немногочисленными или единичными находками.
Список литературы
Акатова Н.А., 1954. Исследование зоопланктона р. Урала и некоторых водоемов поймы в районе дер. Январцево Западно-Казахстанской области // Труды Зоологического ин-та АН СССР. Т. 16. С. 517–531.
Балабанова З.М. 1949. Материалы к озеру Большой Шарташ // Труды Уральского отделения ВНИИОРХ. Т. 4. С. 75–128.
Богданов В.Д., Богданова Е.Н., Госькова О.А., Мельниченко И.П., Степанов Л.Н., Ярушина М.И., 2004. Биоресурсы водных экосистем Полярного Урала. Екатеринбург: УрО РАН. 168 с.
Богданов В.Д., Богданова Е.Н., Гаврилов А.Л., Мельниченко И.П., Степанов Л.Н., Ярушина М.И., 2005. Экологическое состояние притоков Нижней Оби (реки Харбей, Лонготъеган, Щучья). Екатеринбург: Изд-во Уральского ун-та. 236 с.
Богданов В.Д., Богданова Е.Н., Госькова О.А., Морозова Л.М., Некрасова Л.С. и др., 2007. Оценка экологического состояния и рекреационной емкости экосистемы озера Песчаное. Екатеринбург: УрО РАН. 143 с.
Богданова Е.Н., 2003. К изучению зоопланктона Полярного Урала (зоопланктон бассейна р. Кара) // Биологические ресурсы Полярного Урала. Вып. 3. Ч. 2. С. 23–29.
Боев В.Г. 1981. Зоопланктон некоторых водоемов Башкирского заповедника // Вопросы экологии животных Южного Урала. Вып. 1. С. 62–74.
Грезе Б.С., Карпова К.И., 1941. О планктоне озера Тургояк // Труды Уральского отделения ВНИИОРХ. Т. 3. С. 175–205.
Драбкова В.Г., Сорокин И.Н., 1979. Озеро и его водосбор – единая природная система. Л.: Наука. 196 с.
Зиновьев А.П., 1931. Водоемы Троицкого лесостепного заповедника и их фауна (Copepoda и Phillopoda) // Труды Биологического научно-исследовательского ин-та при Пермском гос. ун-те. Т. 3. Вып. 4. С. 281–367.
Зиновьев А.П., 1934. Водоемы Троицкого лесостепного заповедника и его окрестностей // Труды Пермского биологического НИИ. Т. 6. Вып. 3–4. С. 1–118.
Керенцева Н.П., Набоких Л.Н., Егошин В.В., 1946. Гидробиология р. Камы на участке Оханск – Галево // Ученые записки Молотовского гос. ун-та. Т. 4. Вып. 2. С. 17–26.
Ковалькова М.П., Козлова И.В., Шилкова Е.В., 1975. Кормовая база озера Сугояк и использование ее рыбами // Труды Уральского отделения СибНИИРХ. Т. 9. Вып. 2. С. 3–9.
Козлова И.В., 1966. Планктон озера Кундравинского // Труды Уральского отделения СибНИИРХ. Т. 7. С. 77–83.
Козлова И.В., 1979. Зоопланктон Каслинской группы озер и его продукция // Сб. науч. трудов НИИ озерного и речного рыбного х-ва. № 10. С. 118–124.
Козлова И.В., Шилкова Е.В., 1966. Планктон Аргазинского водохранилища // Труды Уральского отделения СибНИИРХ. Т. 7. С. 17–24.
Красновская М.П., 1949. Карась озера Янычково и его значение как основного объекта хозяйства Верхне-Тавдинских озер, Свердловской области // Труды Уральского отделения ВНИИОРХ. Т. 4. С. 213–273.
Кутикова Л.А., 1970. Коловратки фауны СССР. Л.: Наука. 744 с.
Любимова Т.С., 1971. Зоопланктон выростных прудов Чесменского рыбхоза Челябинской области // Труды Уральского отделения СибНИИРХ. Т. 8. С. 253–258.
Любимова Т.С., 1981. Зоопланктон горного озера Аракуль (Южный Урал) и его продукция // Гидробиологическая характеристика различных рыбохозяйственных водоемов Европейской части РСФСР. Сб. науч. трудов НИИ озерного и речного рыбного х-ва. № 162. С. 56–68.
Масленникова Л. 1941. Материалы по гидробиологии Уфалейских озер // Труды Уральского отделения ВНИИОРХ. Т. 3. С. 24–36.
Макарцева Е.С., 1978. Видовой состав и продуктивность зоопланктона // Эколого-продукционные особенности озер различных ландшафтов Южного Урала. Л.: Наука. С. 150–188.
Муравейский С.Д., 1923. Наблюдения над весенним планктоном реки Урала и его стариц // Русский гидробиологический журнал. Т. 2. С. 14–23.
Огородникова Е.М., 1977. Зоопланктон Шершневского водохранилища и его роль в оценке качества воды // Вопросы биогенного загрязнения и регулирования качества вод Урала. Красноярск: Изд-во СибНИИ гидротехники и мелиорации. С. 27–39.
Опарина Н.Я., 1923. К фауне коловраток окрестностей г. Перми // Труды Биологического научно-исследовательского ин-та при Пермском государственном ун-те. Т. 1. Вып. 9–10. С. 165–175.
Подлесный А.В., Троицкая В.И., 1941. Ильменские озера и их рыбохозяйственная оценка // Труды Уральского отделения ВНИИОРХ. Т. 3. С. 121–174.
Рогозин А.Г., 1995. Коловратки Челябинской области. Миасс: ИГЗ УрО РАН. 128 с.
Рогозин А.Г., 2000. Зоопланктон // Экология озера Большое Миассово. Миасс: ИГЗ УрО РАН. С. 128–165.
Рогозин А.Г., 2004. Новые виды коловраток (Rotifera) в фауне водоемов восточной части Южного Урала и Южного Зауралья // Известия Челябинского научного центра. Вып. 3. С. 132–135.
Рогозин А.Г., 2006. Зоопланктон гипертрофного водоема на примере озера Табанкуль (Южный Урал): биологическое разнообразие и биология некоторых видов коловраток // Известия Челябинского научного центра. Вып. 3. С. 78–82.
Рогозин А.Г., 2007. О зоопланктоне водоемов западных предгорий Южного Урала (Миньярский пруд на реке Сим) // Известия Челябинского научного центра. Вып. 3. С. 75–79.
Рогозин А.Г., 2009а. Зоопланктон озера Увильды // Известия Челябинского научного центра. Вып. 1. С. 62–67.
Рогозин А.Г., 2009б. Зоопланктон озера Малый Теренкуль // Известия Челябинского научного центра. Вып. 3. С. 28–33.
Рогозин А.Г., 2013. Зоопланктон Аргазинского водохранилища (Южный Урал) и его многолетние изменения // Биология внутренних вод. № 2. С. 25–33.
Рогозин А.Г., 2018. Материалы по фауне и экологии коловраток Урала. Семейство Brachionidae. Рода Anuraeopsis, Brachionus, Notholca // Зоологический журнал. Т. 97. № 7. С. 273–283.
Рогозин А.Г., 2018а. О системе биоиндикации трофических условий в водоемах // Химия, физика, биология, математика: теоретические и прикладные исследования: Сборник статей по материалам XI–XII Международной научно-практической конференции “Химия, физика, биология, математика: теоретические и прикладные исследования”. № 5–6(6). М.: Интернаука. С. 10–15.
Рогозин А.Г., Снитько Л.В., Тимошкин О.А., 2015. Термоиндикаторные свойства видов зоопланктона и их измерение // Водные ресурсы. Т. 42. № 1. С. 85–91.
Таусон А.О., 1934. Гидробиологический очерк озер верхней Камы // Труды Пермского биологического ин-та. Т. 6. Вып. 1–2. С. 103–118.
Таусон А.О., 1935. Дикое озеро и его биология // Ученые записки Пермского гос. ун-та. Т. 1. Вып. 2–3. С. 3–55.
Таусон А.О., 1936. Гидробиологический очерк озер и рек Гаринского района Свердловской области и их рыбохозяйственная оценка // Ученые записки Пермского гос. ун-та. Т. 2. Вып. 1. С. 85–165.
Таусон А.О., 1946. Зоопланктон р. Камы на участке с. Галево – р. Белая // Известия Естественно-научного ин-та при Молотовском гос. ун-те. Т. 12. Вып. 5. С. 155–167.
Таусон А.О., 1947. Планктон верхней Камы // Ученые записки Молотовского гос. ун-та. Т. 4. Вып. 2. С. 3–16.
Уломский С.Н., 1964. Планктон озера Тургояк // Труды Уральского отделения ГосНИОРХ. Т. 6. С. 83–90.
Фурман О., Тиебо М., 1910. Фауна некоторых озер Урала: Предварительная заметка // Труды Уральского общества любителей естествознания. Т. 30. С. 69–82.
Щелкановцев П.Я., 1903. О некоторых озерах в бассейне р. Миасса (Южного Урала) // Землеведение. Т. 2–3. С. 48–73.
Arvola L., Salonen K., 2001. Plankton community of a polyhumic lake with and without Daphnia longispina (Cladocera) // Hydrobiologia. V. 445. Issue 1–3. P. 141–150.
Azémar F., Moris T., Mialet B., Segers H., Van Damme S. et al., 2010. Rotifers in the Schelde estuary (Belgium): a test of taxonomic relevance // Journal of Plankton Research. V. 32. № 7. P. 981–997.
Boëchat I.G., Adrian R., 2006. Evidence for biochemical limitation of population growth and reproduction of the rotifer Keratella quadrata fed with freshwater protists // Journal of Plankton Research. V. 28. Issue 11. P. 1027–1038.
Burns C.W., Gilbert J.J., 1986. Direct observations of the mechanisms of interference between Daphnia and Keratella cochlearis // Limnology and Oceanography. V. 31. P. 859–866.
Celewicz-Gołdyn S., Kuczyńska-Kippen N., 2017. Ecological value of macrophyte cover in creating habitat for microalgae (diatoms) and zooplankton (rotifers and crustaceans) in small field and forest water bodies // PLoS One. V. 12. № 5. e0177317 (online)
Cieplinski A., Weisse T., Obertegger U., 2017. High diversity in Keratella cochlearis (Rotifera, Monogononta): Morphological and genetic evidence // Hydrobiologia. V. 796. Issue 1. P. 145–159.
Conde-Porcuña J.M., Declerck S., 1998. Regulation of rotifer species by invertebrate predators in a hypertrophic lake: selective predation on egg-bearing females and induction of morphological defences // Journal of Plankton Research. V. 20. № 4. P. 605–618.
De Manuel J., Armengol J., 1993. Rotifer assemblages: a contribution to the typology of Spanish reservoirs // Hydrobiologia. V. 255/256. P. 421–428.
Demetraki A., Paleolog J.S., 2013. Planktonic rotifers of three lakes of Łęczyńsko-Włodawskie lakeland (Eastern Poland) // OL PAN. V. 10. P. 62–69.
Devetter M., 1998. Influence of environmental factors on the rotifer assemblage in an artificial lake // Hydrobiologia. V. 387. P. 171–178.
Diéguez M., Modenutti B., Queimaliños C., 1998. Influence of abiotic and biotic factors on morphological variation of Keratella cochlearis (Gosse) in a small Andean lake // Hydrobiologia. V. 387/388. P. 289–294.
Eckert B., Walz N., 1998. Zooplankton succession and thermal stratification in the polymictic shallow Müggelsee (Berlin, Germany): a case for the intermediate disturbance hypothesis? // Hydrobiologia. V. 387. Issue 0. P. 199–206.
Ejsmont-Karabin J., 2012. The usefulness of zooplankton as lake ecosystem indicators : Rotifer Trophic State Index // Polish Journal of Ecology. V. 60. № 2. P. 339–350.
Eloranta P., 1982. Notes on the morphological variation of the rotifer species Keratella cochlearis (Gosse) s.l. in one eutrophic pond // Journal of Plankton Research. V. 4. Issue 2. P. 299–312.
Freedman B. 1995. Environmental ecology: The ecological effects of pollution, disturbance, and other stresses. London: Academic Press Ltd. 606 p.
Gadhikar Y.A., Savale S.P., 2016. Seasonal abundance and diversity of rotifers of Shahanoor dam, Amravati District, India // Universal journal of environmental research and technology. V. 6. Issue 2. P. 82–90.
Gilbert J.J., 1985. Competition between rotifers and Daphnia // Ecology. V. 66. Issue 6. P. 1943–1950.
Galkovskaja G.A., 1987. Planktonic rotifers and temperature // Hydrobiologia. V. 147. P. 307–317.
Galkovskaja G.A., Mitjanina I.F., 1989. Morphological structure and functional patterns of Keratella cochlearis (Gosse) populations in stratified lakes // Hydrobiologia. V. 186/187. P. 119–128.
Gopko M.V., Telesh I.V., 2013. Estuarine trophic state assessment: New plankton index based on morphology of Keratella rotifers // Estuarine Coastal and Shelf Science. V. 130. P. 222–230.
Haberman J., 2000. Dominant zooplankton species in Lake Peipsi // Proceedings of Estonian Academy of Sciences. Biology and Ecology. V. 49. № 1. P. 34–51.
Haberman J., Halnda M., 2014. Indices of zooplankton community as valuable tools in assessing the trophic state and water quality of eutrophic lakes: Long term study of Lake Võrtsjärv // Journal of Limnology. V. 73. № 2. P. 263–273.
Hakkari L., 1978. On the productivity and ecology of zooplankton and its role as food for fish in some lakes in central Finland // Biological Research Reports. University Jyväskylä. V. 4. P. 1–87.
Herzig A., 1987. The analysis of planktonic rotifer populations: A plea for long-term investigations // Hydrobiologia. V. 147. P. 163–180.
Hewitt D.P., George D.G., 1987. The population dynamics of Keratella cochlearis in a hypereutrophic tarn and the possible impact of predation by young roach // Hydrobiologia. V. 147. P. 221–227.
Hillbricht-Ilkowska A., 1983. Morphological variation of Keratella cochlearis (Gosse) in Lake Biwa, Japan / Biology of Rotifers. Developments in Hydrobiology. V. 14. Dordrecht: Springer. P. 297–395.
Hofmann W., 1983. Interactions between Asplanchna and Keratella cochlearis in the Pluβsee (north Germany) // Hydrobiologia. V. 104. P. 363–365.
Hofmann W., 1987. Population dynamics of hypolimnetic rotifers in the Plußsee (north Germany) // Hydrobiologia. V. 147. P. 197–201.
Hofmann W., Höfle M.G., 1993. Rotifer population dynamics in response to increased bacterial biomass and nutrients: a mesocosm experiment // Hydrobiologia. V. 255/256. P. 171–176.
Holst H., Zimmermann H., Kausch H., Koste W., 1998. Temporal and spatial dynamics of planktonic rotifers in the Elbe estuary during spring // Estuarine, Coastal and Shelf Science. V. 47. P. 261–273.
Hugh J.M., Gilbert J.J., 1991. Competition between Keratella cochlearis and Daphnia ambigua: Effects of temporal patterns of food supply // Freshwater Biology. V. 25. Issue 2. P. 189–198.
Jersabek C.D., Bolortsetseg E., 2010. Mongolian rotifers (Rotifera, Monogononta) – a checklist with annotations on global distribution and autecology // Proceedings of the Academy of Natural Sciences of Philadelphia. V. 159. P. 119–168.
Jonsson T., Cohen J.E., Carpenter S.R., 2005. Food webs, body size, and species abundance in ecological community description // Advances in ecological research. V. 36. P. 1–78.
Kirk K.L., 2002. Competition in variable environments: experiments with planktonic rotifers // Freshwater Biology. V. 47. P. 1089–1096.
Lehtovaara A., Arvola L., Keskitalo J., Olin M., Rask M. et al., 2014. Responses of zooplankton to long-term environmental changes in a small boreal lake // Boreal Environment Research. V. 19 (suppl. A). P. 97–111.
Mäemets A., 1983. Rotifers as indicators of lake types in Estonia // Hydrobiologia. V. 104. Issue 1. P. 357–361.
May L., Spears B.M., Dudley B.J., Gunn I.D.M., 2014. The response of the rotifer community in Loch Leven, UK, to changes associated with a 60% reduction in phosphorus inputs from the catchment // Hydrobiologia. V. 99. № 1–2. P. 65–71.
Medeiros A.M.A., Barbosa J.E.L., Medeiros PR., Rocha R.M., Silva L.F., 2010. Salinity and freshwater discharge determine rotifer distribution at the Mossoró River estuary (semiarid region of Brazil) // Brasilian Journal of Biology. V. 70. № 3. 551–557.
Nogrady T., 1980. Canadian Rotifers II. Parc Mont Tremblant, Quebec // Hydrobiologia. V. 71. Issue 1. P. 35–46.
Pedrozo C. Da S., Rocha O, 2005. Zooplankton and water quality of lakes of the northern coast of Rio Grande do Sul State, Brazil // Acta Limnologica Brasiliensia. V. 17. № 4. P. 445–464.
PejlerB., 1980. Variation in the genus Keratella // Hydrobiologia. V. 73. P. 207–213.
Pejler B., Bērziņš B., 1989. On choice of substrate and habitat in brachionid rotifers // Hydrobiologia. V. 186. P. 137–144.
Primicerio R., 2000. Seasonal changes in vertical distribution of zooplankton in an oligotrophic, subarctic lake (Lake Takvatn, Norway) // Limnologica. V. 30. P. 301–310.
Radwan S., 1976. Planktonic rotifers as indicators of lake trophy // Annales Universitatis Mariae Curie-Skłodowska Lublin. V. 31. P. 227–235.
Roche K.F., 1993. Temporal variation in the morphology of the rotifer Keratella quadrata (Miiller, 1786) // Annales de Limnologie. V. 29. № 2. P. 119–127.
Sharma B.K., Sharma S., 2014. The diversity of Indian Brachionidae (Rotifera: Eurotatoria: Monogononta) and their distribution // Opuscula Zoologica Budapest. V. 45. № 2. P. 165–180.
Sladeček V., 1983. Rotifers as indicators of water quality // Hydrobiologia. V. 100. P. 169–201.
Stemberger R.S., Gilbert J.J., 1987. Multiple-species induction of morphological defenses in the rotifer Keratella testudo // Ecology. V. 168. P. 370–378.
Telesh I.V., 1993. The effect of fish on planktonic rotifers // Hydrobiologia. V. 255/256. P. 289–296.
Virro T., 2001. Life cycle patterns of rotifers in Lake Peipsi // Hydrobiologia. V. 446/447. Issue 1. P. 85–93.
Walz N., 1997. Rotifer life history strategies and evolution in freshwater plankton communities // Evolutionary Ecology of Freshwater Animals: Concepts and Case Studies. Basel, Boston, Berlin: Birkhäuser. P. 119–150.
Williamson C.E., 1986. The swimming and feeding behavior of Mesocyclops // Hydrobiologia. V. 134. P. 11–19.
Zimmermann C., 1974. Die pelagischen Rotatorien des Sempachersees, mit spezieller Berücksichtigung der Brachioniden und der Ernährungsfrage // Schweizerische Zeitschrift fur Hydrologie. Bd. 36. P. 205–300.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал