Зоологический журнал, 2020, T. 99, № 5, стр. 544-553
Трофическое положение плейстоценовых и совремeнных бурых медведей (Ursus arctos) Якутии по данным изотопного анализа
О. А. Крылович a, *, Г. Г. Боескоров b, c, **, М. В. Щелчкова d, ***, А. Б. Савинецкий a, ****
a Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Россия
b Институт геологии алмаза и благородных металлов СО РАН
677980 Якутск, Россия
c Академия наук Республики Саха (Якутия)
677007 Якутск, Россия
d Северо-Восточный федеральный университет им. М.К. Аммосова
677000 Якутск, Россия
* E-mail: okrylovich@gmail.com
** E-mail: gboeskorov@mail.ru
*** E-mail: mar-shchelchkova@mail.ru
**** E-mail: arkadybs@rambler.ru
Поступила в редакцию 05.09.2019
После доработки 17.09.2019
Принята к публикации 20.10.2019
Аннотация
Для оценки трофического положения очень крупных бурых медведей из плейстоцена Якутии мы использовали метод анализа стабильных изотопов азота и углерода в коллагене костей и зубов. Проведено сравнение с современными бурыми медведями Якутии и крупными плейстоценовыми хищниками. В результате измерений для плейстоценовых медведей мы получили значения δ13С, характерные для наземных экосистем, и сравнительно высокие значения δ15N, характерные для таких плейстоценовых хищников как пещерный лев. Мы объясняем высокие значения δ15N коллагена кости изученных ископаемых медведей, также как и других плейстоценовых бурых медведей Якутии и Чукотки, несколькими причинами: 1. отсутствие крупных конкурентов, таких как Arctodus simus, позволяло использовать медведям большое количество пищи животного происхождения; 2. физиологический эффект зимней спячки, выражающийся в повышенном содержании 15N в коллагене костей; 3. обусловленное более суровыми климатическими условиями повышенное содержание 15N в растительности, что сказывается на изотопном составе всей мамонтовой фауны западной Берингии. Значения δ13С и δ15N современных бурых медведей Якутии указывают на растительную диету. Эти медведи (по сравнению с ископаемыми) занимают принципиально другую трофическую нишу, адаптированную к современным низкопродуктивным экосистемам Якутии.
Крупные хищные млекопитающие являются важным элементом современных наземных экосистем. Как консументы высшего порядка они отвечают за контроль над популяциями травоядных, обеспечивая тем самым стабильность структуры растительных сообществ. Понимание трофического положения крупных хищных млекопитающих в позднем плейстоцене важно для реконструкции многих характеристик “тундростепи” (арктической степи) – экосистемы, не имеющей аналогов в современности. В средних и высоких широтах в наши дни популяции некоторых хищных представляют собой реликты плейстоценовых популяций с измененными генетической структурой и экологической нишей. Одним из таких видов является бурый медведь (Ursus arctos), ареал которого в плейстоцене почти совпадает с его современным ареалом. Реконструкция некоторых аспектов палеобиологии этого вида, в том числе трофического положения во времена плейстоцена, может обеспечить нас базовой информацией о его фундаментальной экологической нише и формировании экологической пластичности, которая способствует широкому распространению вида в самых разных экологических условиях.
Содержание стабильных изотопов углерода и азота в коллагене кости позволяет напрямую анализировать питание и экологические особенности существования как современных животных, так и уже вымерших. Так как углерод и азот, содержащиеся в коллагене костей, попадают в организм вместе с пищей, содержание стабильных изотопов азота и углерода в молекулах коллагена идеально для палеоэкологических исследований, в том числе и для определения особенностей питания древних животных.
Летом 2015 г. в береговом обнажении р. Уяндина (бассейн Индигирки, крайний север Якутии) было найдено три черепа исключительно крупных особей бурого медведя (Боескоров и др., 2016, 2019). Условия захоронения и сопутствующая фауна позволили отнести данные находки к позднему плейстоцену. Радиоуглеродная дата наиболее крупного черепа медведя с р. Уяндина, полученная в лаборатории университета г. Гронингена (Нидерланды), подтвердила плейстоценовый возраст находки (>45 000 лет (GrA-65241). Кондилобазальная длина (433 мм), скуловая ширина (283 мм) и ряд других размеров этого экземпляра намного превосходят соответствующие параметры современных подвидов Сибири и Дальнего Востока, а также ископаемых особей вида с территории Якутии (Боескоров и др., 2016, 2019). Исследования генетических особенностей этих медведей показали, что они принадлежали к ныне вымершей группе (Rey-Iglesia et al., 2019). В 2016 г., также на крайнем севере Якутии, в бассейне р. Селеннях, окрестностях села Сайылык, был найден еще один очень крупный череп бурого медведя, близкий по размерам к наиболее крупному черепу с Уяндины (кондилобазальная длина около 425 мм, скуловая ширина не менее 260 мм). Этот череп найден в льдистых лессовых отложениях верхнего плейстоцена. Палинологический анализ вмещавших череп отложений показал почти полное отсутствие пыльцы деревьев и кустарников, что свидетельствует о широком развитии открытых ландшафтов с тундростепными, степными и лугово-степными сообществами (заключение палинологов Н.Т. Бакулиной и Л.М Фартунатовой, АО “Якутскгеология”).
Известно, что бурый медведь может достигать исключительно крупных размеров при наличии богатой кормовой базы (проходная рыба, трупы морских млекопитающих, обилие питательных корней, плодов и семян растений) (Гептнер и др., 1967). Во время ледникового периода в северной Якутии медведи не могли иметь подобной пищи. Предполагалось, что бурый медведь в позднем плейстоцене мог активно охотиться на молодняк бизонов и оленей или питаться трупами мамонтов и других гигантских травоядных (Боескоров, Барышников, 2013), чем могли быть вызваны крупные размеры новых находок.
Современный подвид бурого медведя, обитающий на территории Якутии (U. a. jeniseensis), наоборот, отличается относительно мелкими размерами и разнообразным питанием с преобладанием растительных кормов (Тавровский и др., 1971; Ревин и др., 1988).
Цель нашей работы – определить трофическое положение древнего бурого медведя Якутии и сопоставить его с трофическим положением современного бурого медведя с территории Якутии на основе данных изотопного анализа.
МАТЕРИАЛ И МЕТОДИКА
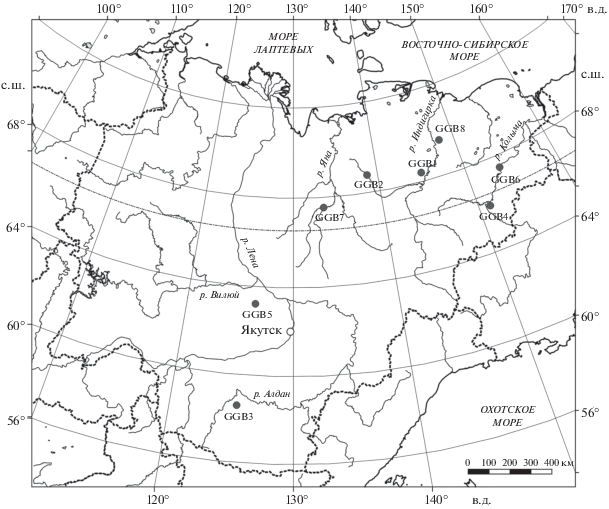
Для определения относительного положения древнего медведя в трофической сети плейстоценовых сообществ Якутии мы использовали широко распространенный метод анализа соотношения стабильных изотопов углерода и азота в коллагене и дентине двух крупных медведей из плейстоценовых отложений Якутии (табл. 1). Для сравнения трофического положения современных и древних бурых медведей Якутии мы использовали коллаген и дентин шести современных бурых медведей Якутии (рис. 1).
Таблица 1.
Результаты изотопного анализа плейстоценовых и современных бурых медведей Якутии
| География | Возраст, пол | Элемент скелета |
δ13СVPDB,‰ | δ15Nair, ‰ | Код образца |
|---|---|---|---|---|---|
| Абыйский р-н, бассейн р. Индигирка, р. Уяндина1 | Взрослый самец | Череп | –19.4 | 11.4 | GGB1 |
| Усть-Янский р-н, бассейн р. Селеннях, окрестности села Сайылык1 | Взрослый самец | Клык | –19.2 (–19.9) | 11.3 (9.9) | GGB2 |
| Алданский р-н, окр. г. Алдан, добыт в 1960-е гг.2, 3 | Взрослый самец | Ребро | –18.2 | 2.7 | GGB3 |
| Верхнеколымский р-н, окр. пос. Зырянка, добыт в 1992 г.2, 3 | Взрослый самец | Череп | –20 | 4.1 | GGB4 |
| Кобяйский р-н, добыт в 1970–1980 гг.2, 3 | Взрослый самец | Клык | –20.9 (–21.5) | 5.3 (3.8) | GGB5 |
| Среднеколымский р-н, р. Колыма, окр. г. Среднеколымска, добыт в 1970-е гг.2, 3 | Взрослая самка | Фаланга пальца |
–20.9 | 6.6 | GGB6 |
| Верхоянский р-н, окр. г. Верхоянска, добыт в 1950-е гг.2, 3 | Взрослый самец | Позвонок | –18.4 | 2.7 | GGB7 |
| Аллаиховский р-н, 100 км к югу от пос. Чокурдах, добыт в 1980-е гг.2, 4 | Молодой самец | Череп | –20.9 | 6 | GGB8 |
Для анализа содержания стабильных изотопов углерода и азота в коллагене костей или дентине зубов для каждого образца было отобрано около 0.5 г материала. Современные кости медведей до процедуры выделения коллагена были обезжирены смесью хлороформ : метанол 2 : 1 (Guiry et al., 2016). Коллаген выделяли по модифицированному методу Лонжина (Longin, 1971; Горлова и др., 2015). Изотопный состав углерода и азота в образце коллагена древних медведей определили с помощью масс-спектрометра Thermo-Finnigan Delta V Plus, сопряженного с элементным анализатором (Thermo Flash 1112) в Центре коллективного пользования ИПЭЭ РАН. Определения изотопного состава образцов коллагена современных медведей Якутии проводили на изотопном масс-спектрометре AMS precisiON IRMS в ЦКП “Лаборатория радиоуглеродного датирования и электронной микроскопии” Института географии РАН.
Различия в относительном содержании стабильных изотопов химического элемента в веществе измеряют в сравнении с едиными международными стандартами и обозначают условной единицей δ (дельта), которая выражена в доле атомов тяжелого изотопа от всех атомов данного элемента и пересчитана на тысячные доли (промилле, ‰) отклонения от международного стандарта (DeNiro, 1985; Горлова и др., 2015). В качестве стандартов для измерений δ13С и δ15N использованы “венский” эквивалент белемнита PeeDee формации (VPDB) и атмосферный азот соответственно. Аналитическую точность приборов (0.2 и 0.25‰ (SD) для δ13С и δ15N соответственно) оценивали повторными калибровками внутреннего стандарта (референтные материалы МАГАТЭ). Вместе с определением изотопного состава в пробе определяли общее содержание углерода и азота (% C, % N) и атомарное соотношение C/N, которые служат индикаторами сохранности белка в древних образцах (DeNiro, 1985).
Изменение диеты, связанное с разными этапами жизни животного, сказывается на изотопном составе разных тканей и зависит от времени формирования этих тканей. Коллаген кости синтезируется и обновляется в течение всей жизни животного и его изотопный состав отражает изотопный состав диеты за несколько последних лет жизни у долгоживущих животных. Коллаген в дентине синтезируется во время роста зуба и, таким образом, отражает состав диеты за этот ограниченный промежуток времени, который у медведей может захватывать период молочного вскармливания. Вследствие этого коллаген, выделенный из дентина, может быть обогащен тяжелым изотопом азота по сравнению с коллагеном костей того же самого индивида (Bocherens et al., 1994). Также у медведей в среднем значения δ13С коллагена дентина зубов всегда больше, чем δ13С коллагена кости. Поэтому, из-за особенностей формирования дентина, для корректного сравнения δ13С и δ15N коллагена костей и дентина мы использовали следующие поправки: δ13Сколлаген = = δ13Сдентин – 0.67‰ и δ15Nколлаген = δ15Nдентин – ‒ 1.47‰ (Bocherens, 2015).
РЕЗУЛЬТАТЫ
Для оценки сохранности коллагена в ископаемых костях было определено соотношение содержания общего углерода к азоту (C : N) и общее содержание азота (%) (DeNiro, 1985). Для изученных плейстоценовых образцов кости и дентина С : N получились 3.3 и 2.6 соответственно. Общее содержание азота в выделенном коллагене кости и дентина составило 16 и 25% соответственно. Полученные значения попадают в диапазон допустимых значений для хорошо сохранившегося коллагена (DeNiro, 1985), что позволяет использовать их для дальнейшего анализа. Соответствующие показатели для современных образцов также попадают в этот диапазон.
Результаты измерений изотопного состава коллагена костей и дентина изученных экземпляров бурых медведей представлены в табл. 1. Измерения показали, что значения δ13С плейстоценовых образцов очень схожи с современными бурыми медведями из Якутии (от –19.2 до –19.4‰ и от –18.2 до –20.9‰ соответственно), в то время как значения δ15N значительно различаются (11.3–11.4‰ у плейстоценовых образцов и 2.7–6.6‰ у современных медведей из Якутии).
ОБСУЖДЕНИЕ
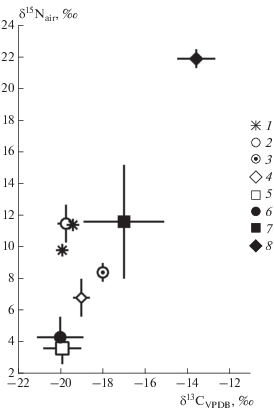
Значения δ13С и δ15N исследованных древних медведей схожи со средними значениями плейстоценовых бурых медведей и пещерных львов Якутии и Чукотки, (Kirillova et al., 2015), но δ15N заметно больше δ15N бурых медведей из Европы (около 3.5‰) и восточной Берингии (около 7‰) (Fox-Dobbs et al., 2008; Bocherens et al., 2011) (рис. 2). Современные бурые медведи Якутии показывают значения близкие ископаемым бурым медведям из Европы (Bocherens et al., 2011), и в значительной степени отличаются от ископаемых медведей Якутии. Современные бурые медведи прибрежных районов Чукотки в среднем показывают схожие с древними медведями Якутии значения δ15N (но с большим разбросом) (Горлова и др., 2015). В то же время, δ13С отличается, скорее всего, из-за присутствия в питании современных чукотских бурых медведей пищи морского происхождения. Изотопный состав азота и углерода древних якутских и чукотских бурых медведей сильно отличается от изотопного состава коллагена костей современных и голоценовых белых медведей (Ursus maritimus) (Горлова и др., 2015) (рис. 2).
Рис. 2.
Изотопный состав коллагена костей разных видов медведей из плейстоценовых отложений Европы, Якутии и Северной Америки и современных медведей восточной Чукотки (среднее ± стандартное отклонение): 1 – бурый медведь, Якутия, наши данные; 2 – бурый медведь, Якутия и Чукотка по: Kirillova et al., 2015; 3 – гигантский короткомордый медведь, восточная Берингия по: Fox-Dobbs et al., 2008; 4 – бурый медведь, восточная Берингия, по: Fox-Dobbs et al., 2008; 5 – бурый медведь, Европа, по: Bocherens et al., 2011; 6 – современный бурый медведь, Якутия; 7 – современный бурый медведь, Чукотка, по: Горлова и др., 2015; 8 – современный белый медведь, Чукотка, по: Горлова и др., 2015.
В процессе перехода с одного трофического уровня на другой происходит изменение изотопного состава организма. Величина, на которую изменяется изотопный состав, определяется как разница между изотопным составом тканей животного и изотопным составом его пищи (δконсумент – – δдиета, обозначается как Δ13С или Δ15N) и называется трофическим фракционированием, или коэффициентом трофической дискриминации (Martínez del Rio et al., 2009; Bond, Hobson, 2012). Степень трофической дискриминации изотопов углерода невелика. В среднем значение Δ13С небольшое (0.5–2.0‰), подвержено значительным колебаниям на разных трофических уровнях и зависит от состава диеты и физиологического состояния животного (Peterson, Fry, 1987; Kelly, 2000; Post, 2002). Благодаря незначительному изменению изотопного сигнала при продвижении по пищевой цепи, величина δ13С тканей животных хорошо отражает усредненный изотопный состав его диеты и первичных продуцентов, но с некоторыми исключениями.
Величина δ15N в тканях животных увеличивается в среднем на 2–5‰ с каждым трофическим уровнем (Minagawa, Wada, 1984; Hobson, Welch, 1992; Post, 2002). Благодаря трофическому фракционированию, величина δ15N может служить показателем трофического уровня животного. Ткани хищников содержат больше 15N, по сравнению с тканями травоядных (Bocherens et al., 1997; Kelly, 2000), а ткани высших консументов длинных трофических цепей (например, морских) обогащены тяжелым изотопом азота, по сравнению с тканями высших консументов коротких трофических цепей (например, наземных) (Chamberlain et al., 2005; Dehn, 2005). Конкретная величина Δ15N может колебаться в довольно широких пределах, в зависимости от таких факторов, как пол, качество диеты, репродуктивный статус, стадия роста животного. Азот поступает в организм животного преимущественно из белков, поэтому количество белка в рационе также влияет на интенсивность фракционирования изотопов азота (Pearson et al., 2003; Robbins et al., 2005). При сопоставлении значений изотопного состава коллагена костей консументов и их диеты рекомендуют использовать коэффициенты трофической дискриминации 0–2‰ для углерода и 3–5‰ для азота в зависимости от вида (Bocherens, Drucker, 2003).
Изотопный состав организма является отражением изотопного состава его пищи (с учетом трофического фракционирования), усредненного за определенный интервал времени. Скорость обмена, т.е. время, за которое после перемены питания изменяется изотопный состав ткани, зависит от скорости ее возобновления (Kelly, 2000). У крупных млекопитающих наиболее быстро состав кости меняется в процессе интенсивного роста, но изменения продолжаются даже после наступления половой зрелости: происходит резорбция старой костной ткани и отложение новой. Соответственно, полное изменение состава коллагена кости в ответ на изменения изотопного состава пищи занимает от нескольких месяцев в период интенсивного роста до нескольких лет у медленно растущих или окончивших свой рост животных. Время полного обмена коллагена в кости у крупных млекопитающих может достигать 10 лет или даже больше.
У изученных ископаемых медведей и бурых медведей Якутии и Чукотки значения δ15N коллагена близки к значениям таких хищников, как пещерные львы или Canis sp., что в первую очередь наводит на мысль о том, что медведи занимали схожее трофическое положение, и значительную часть их рациона составляла протеиновая пища. Похожий случай известен для территории Аляски и Юкона, где до 20 тыс. л. н. обитал гигантский короткомордый медведь (Arctodus simus). Значения δ15N коллагена костей A. simus схожи со значениями δ15N саблезубых тигров из этой же местности (Bocherens, 2015). В связи с этим была выдвинута гипотеза, что гигантский медведь был в большой мере хищником или падальщиком. При этом значения δ15N бурых медведей, сосуществовавших на одной территории с A. simus, на 2–3‰ ниже, т.е. в диете бурых медведей было меньше объектов животного происхождения. После исчезновения гигантских медведей в восточной Берингии значение δ15N бурых медведей увеличилось почти до значений A. simus. Такой сдвиг можно объяснить тем, что бурые медведи заняли освободившуюся нишу и стали в большем количестве употреблять “мясные продукты”, но не понятно, за счет использования падали или активной охоты.
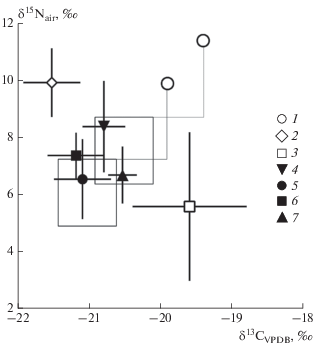
Для сравнения изотопного состава коллагена костей бурых медведей Сибири и изотопного состава коллагена их “усредненных” жертв мы использовали значения трофического фракционирования Δ13С = 1.1 ± 0.2‰ и Δ15N = 3.8 ± 1.1‰, используемые для крупных хищных (Bocherens, 2015). При использовании таких значений трофического фракционирования получается, что основными потенциальными объектами питания бурых медведей Якутии могли быть шерстистый носорог, овцебык, лошадь и бизон (рис. 3). При этом в рацион не включается мамонт, один из основных видов травоядных плейстоценовых тундростепей, по крайней мере в количестве, достаточном для влияния на изотопный состав.
Рис. 3.
Изотопный состав коллагена костей бурого медведя (наши данные) и травоядных животных из плейстоценовых отложений Якутии и Чукотки (среднее ± стандартное отклонение, по: Kirillova et al., 2015): 1 – бурый медведь, 2 – мамонт, 3 – северный олень, 4 – шерстистый носорог, 5 – лошадь, 6 – бизон, 7 – овцебык. Прямоугольник показывает область возможных видов добычи бурого медведя (по: Bocherens, 2015).
Однако в случае как современных, так и вымерших видов медведей при интерпретации результатов изотопного анализа нужно учитывать еще один важный момент. Современным бурым (и не только) медведям свойственна зимняя спячка. Спячка представляет из себя процесс сезонного снижения активности метаболизма и прекращения приема пищи, который совпадает с холодным периодом года в средних и высоких широтах. Эта стратегия связана с сезонным сокращением пищи и широко распространена среди современных медведей. В процессе зимней спячки медведи не едят, так что организм вынужден использовать запасы азота из собственных тканей. В процессе спячки не происходит выделения мочи и дефекации, и в процессах метаболизма (которые хоть и замедляются, но не прекращаются) имеющийся в организме азот используется по несколько раз для синтеза новых белков и других азотсодержащих соединений. Так происходит в организме взрослых самцов и небеременных самок. А беременные и лактирующие самки теряют азот за счет развития плода и синтеза молока для вскармливания. В качестве источника энергии и депо углерода во время спячки используется жир, запасенный летом. Жиры содержат меньше 13С, чем другие ткани организма. Драматические физиологические изменения во время спячки имеют последствия для изотопного состава углерода и азота тканей медведей, что доказано для современных бурых медведей (Jenkins et al., 2001) и самок белых медведей (Polischuk et al., 2001). При этом в связи с многократным использованием азота и длительным голоданием организма происходит накопление 15N в синтезированных во время спячки тканях, а содержание 13С, наоборот, снижается. В современных работах изучались быстро синтезируемые ткани, в основном кровь, поэтому неизвестно, до какой степени явление спячки сказывается на изотопном составе коллагена, т.к. в это время синтез коллагена замедляется, но не останавливается (Donahue et al., 2006). Из-за того, что коллаген в костях крупных млекопитающих обменивается медленно (Hedges et al., 2007), мы можем наблюдать в коллагене костей медведей эффект нескольких сезонов спячки, а именно сравнительно низкое содержание 13С и повышенное 15N.
Подобное влияние особенностей метаболизма во время зимней спячки было обнаружено у нескольких популяций пещерных медведей Испании (Perez-Rama et al., 2011). Этот эффект особенно хорошо заметен у новорожденных медвежат, чьи ткани сформированы за счет тканей медведицы в процессе спячки. Несмотря на разницу абсолютных значениях среди трех популяций, и взрослые и новорожденные показывают эффект спячки – увеличение значений δ15N и снижение значений δ13С.
Из-за того, что на данный момент степень влияния зимней спячки на изотопный состав коллагена костей медведей точно не определена, предложенные величины трофического фракционирования для реконструкции объектов питания медведей, по всей видимости, неприменимы. Можно предположить, что из-за спячки трофическое фракционирование углерода у медведей снижается (Δ 13С снижается из-за использования жиров), а фракционирование азота увеличивается (Δ 15N увеличивается). В этом случае изотопный диапазон рациона якутских бурых медведей можно расширить и включить в него северного оленя (рис. 3).
На основании результатов изотопного анализа мы с уверенностью можем сказать, что оба изученных экземпляра медведей употребляли большое количество белковой пищи, а объектами питания были разнообразные копытные животные мамонтовой фауны. В рацион не попадал шерстистый мамонт, по крайней мере, в количестве, достаточном для того, чтобы сильно повлиять на изотопный состав коллагена.
Изотопный состав углерода и азота различных тканей животного зависит от многих факторов, основные из которых — изотопный состав первичных продуцентов, находящихся в основании пищевой пирамиды в данной экосистеме, и трофический уровень животного. Изменчивость δ13С и δ15N первичных продуцентов зависит от многих факторов, в том числе и от региональных особенностей (температура, количество осадков и т.д.). Поэтому в изотопном составе тканей животного, помимо информации о его трофическом положении и диете, потенциально заложена информация об особенностях местообитаний, в которых оно питалось. Показано, что у видов, которые обитают в аридных условиях и которые выделяют концентрированную мочу, значения δ15N повышены (Ambrose, DeNiro, 1986). Это связано с относительной устойчивостью к засухе, т.к. у некоторых видов млекопитающих (включая африканских слонов) существует сильная отрицательная корреляция между δ15N и количеством осадков. Так же было обнаружено повышенное содержание 15N в тканях растений в более аридных условиях (Heaton, 1987). Именно с более аридными и/или более холодными условиями связывают более высокие значения δ15N коллагена костей мамонтов из западной Берингии по сравнению с мамонтами из Европы или восточной Берингии (Szpak et al., 2010). Содержание тяжелого изотопа азота в коллагене костей других животных мамонтовой фауны Якутии и Чукотки так же повышено по сравнению с другими регионами (Kirillova et al., 2015), что подтверждает региональный уровень отличий.
Как это ни странно, данных об “изотопном ландшафте” современных экосистем Якутии существует еще меньше, чем об “изотопном ландшафте” экосистем плейстоцена. Поэтому полученные нами данные по изотопному составу современных бурых медведей Якутии не с чем сравнивать. Однако по δ13С и δ15N современных медведей видно, что в настоящее время на территории Якутии в рационе животных присутствуют в основном растительные корма, что соответствует данным по их питанию. Основу питания якутского бурого медведя составляют корма растительного происхождения. Его рацион существенно пополняется животной пищей весной и в начале лета и постепенно уменьшается в объеме к осени (Тавровский и др., 1971; Ревин и др., 1988). В экскрементах бурого медведя в различных районах Якутии встречаемость различных растительных кормов доходила до 77.8%, а животных кормов до 55.6% (Тавровский и др., 1971). В таежной зоне Магаданской обл., граничащей с Якутией (бассейн р. Омолон), в экскрементах медведя растительные корма в общем составляли 87.5%, а животные – 12.5% (Чернявский, 1984). По специфике питания популяции медведя на Северо-Востоке Сибири разделяют на два основных типа: преимущественно растительноядный (северо-таежные и лесотундровые районы) и тип, в рационе которого значительно участие кормов животного происхождения (тундровые и приморские районы). Например, в тундрах Чукотки до 50% экскрементов бурого медведя могут содержать остатки северных оленей (кроме того, встречаются остатки птиц, птичьих яиц, полевок, леммингов, арктического суслика), остатки же отдельных видов растительности не превышают 51.1%. На южном, Беринговоморском, побережье Чукотки в различные сезоны года встречаемость различных растительных кормов в экскрементах медведя составляла до 54.5%, а животных кормов – до 66.6% (в том числе остатки морских млекопитающих – до 27.7%) (Чернявский, Кречмар, 2001). Вероятно, исключительно крупные медведи позднего плейстоцена с крайнего севера Якутии, обитавшие в открытых местообитаниях “тундростепи”, аналогично современным медведям из тундровых районов Чукотки в значительной степени питались животными кормами (мелкими млекопитающими, северным оленем, а также молодняком и павшими особями других представителей мегафауны. Чтобы определить, какую долю в питании могли составлять те или иные объекты (в том числе и гигантские фитофаги: мамонт и шерстистый носорог), нужно использовать модели изотопного смешивания (Isotope Mixing Models).
Современные экосистемы Якутии, менее продуктивные, чем тундростепь в плейстоцене, не способны поддерживать многочисленные популяции травоядных, что ограничивает ресурсы для крупных хищных. В таких условиях бурый медведь сменил трофическую нишу на оптимальную в создавшихся условиях с преобладанием растительных кормов в рационе.
Таким образом, мы можем объяснить высокие значения δ15N коллагена кости изученных ископаемых медведей, так же как и других плейстоценовых бурых медведей Якутии и Чукотки, несколькими причинами. Во-первых, отсутствие крупных конкурентов, таких как A. simus, позволяло использовать медведям в пищу большое количество пищи животного происхождения. В пользу этого говорят исключительно крупные размеры черепов исследованных плейстоценовых особей. Во-вторых, физиологический эффект зимней спячки, который приводит к повышенному содержанию 15N в коллагене костей. В-третьих, в более суровых по сравнению с Европой и восточной Берингией климатических условиях западной Берингии в плейстоцене ткани растений были обогащены 15N. Это привело к обогащению 15N всех тканей консументов мамонтовой фауны западной Берингии. Современные бурые медведи Якутии (по сравнению с ископаемыми) занимают принципиально другую трофическую нишу, адаптированную к современным низкопродуктивным экосистемам Якутии.
Список литературы
Боескоров Г.Г., Барышников Г.Ф., 2013. Позднечетвертичные хищные млекопитающие Якутии. СПб.: Наука. 199 с.
Боескоров Г.Г., Барышников Г.Ф., Протопопов А.В., Плотников В.В., Мащенко Е.Н. и др., 2016. Предварительные данные о новых находках хищных млекопитающих позднего неоплейстоцена Якутии // Материалы LXII сессии Палеонтологического общества при РАН (4–8 апреля 2016 г., г. Санкт-Петербург). СПб.: изд-во ВСЕГЕИ. С. 224–225.
Боескоров Г.Г., Барышников Г.Ф., Тихонов А.Н., Протопопов А.В., Климовский А.И., Григорьев С.Е., Чепрасов М.Ю., Новгородов Г.П., Щелчкова М.В., Ван Дер Плихт Й., 2019. Новые данные о крупном буром медведе (Ursus arctos L., 1758, Ursidae, Carnivora, Mammalia) из неоплейстоцена Якутии // Доклады Российской Академии Наук. Науки о Земле. Т. 486. № 6. С. 685–690.
Гептнер В.Г., Наумов Н.П., Юргенсон П.Б., Слудский Л.Л., Чиркова Л.Ф., Банников А.Г., 1967. Морские коровы и хищные. Т. 2. Млекопитающие Советского Союза. М.: Высшая школа. 1004 с.
Горлова Е.Н., Крылович О.А., Тиунов А.В., Хасанов Б.Ф., Васюков Д.Д., Савинецкий А.Б., 2015. Изотопный анализ как метод таксономической идентификации археозоологического материала // Археология, этнография и антропология Евразии. Т. 43. № 1. С. 110–121.
Ревин Ю.В., Сафронов В.М., Вольперт Я.Л., Попов А.Л., 1988. Экология и динамика численности млекопитающих Предверхоянья. Новосибирск: Наука. 200 с.
Тавровский В.А., Егоров О.В., Кривошеев В.Г., Попов М.В., Лабутин Ю.В., 1971. Млекопитающие Якутии. М.: Наука. 659 с.
Чернявский Ф.Б., 1984. Млекопитающие крайнего Северо-Востока Сибири. М.: Наука. 388 с.
Чернявский Ф.Б., Кречмар М.А., 2001. Бурый медведь (Ursus arctos L.) на Северо-Востоке Сибири. Магадан: ИБПС СВНЦ ДВО РАН. 93 с.
Ambrose S.H., DeNiro M.J., 1986. The isotopic ecology of east African mammals // Oecologia. V. 69. P. 395–406.
Bocherens H., 2015. Isotopic tracking of large carnivore palaeoecology in the mammoth steppe // Quaternary Science Reviews. V. 117. P. 42–71.
Bocherens H., Billiou D., Patou-Mathis M., Bonjean D., Otte M., Mariotti A., 1997. Paleobiological implications of the isotopic signatures (13C, 15N) of fossil mammal collagen in Scladina Cave [Sclayn, Belgium] // Quaternary Research. V. 48. № 3. P. 370–380.
Bocherens H., Drucker D., 2003. Trophic level isotopic enrichment of carbon and nitrogen in bone collagen: case studies from recent and ancient terrestrial ecosystems // International Journal of Osteoarchaeology. V. 13. № 1–2. P. 46–53.
Bocherens H., Fizet M., Mariotti A., 1994. Diet, physiology and ecology of fossil mammals as inferred by stable carbon and nitrogen isotopes biogeochemistry: implications for Pleistocene bears // Palaeogeography, Palaeoclimatology, Palaeoecology. V. 107. P. 213–225.
Bocherens H., Stiller M., Hobson K.A., Pacher M., Rabeder G. et al., 2011. Niche partitioning between two sympatric genetically distinct cave bears (Ursus spelaeus and Ursus ingressus) and brown bear (Ursus arctos) from Austria: Isotopic evidence from fossil bones // Quaternary International. V. 245. P. 238–248.
Bond A.L., Hobson K.A., 2012. Reporting stable-isotope ratios in ecology: recommended terminology, guidelines and best practices // Waterbirds. V. 35. № 2. P. 324–331.
Chamberlain C.P., Waldbauer J.R., Fox-Dobbs K., Newsome S.D., Koch P.L. et al., 2005. Pleistocene to recent dietary shifts in California condors // Proceedings of the National Academy of Sciences of the United States of America. V. 102. № 46. P. 16 707–16 711.
Dehn L.-A., 2005. Trophic relationships in an Arctic marine food web and implications for trace element dynamics. PhD. Fairbanks. 290 p.
DeNiro M.J., 1985. Postmortem preservation and alteration of in vivo bone collagen isotope ratios in relation to palaeodietary reconstruction // Nature. V. 317. № 31. P. 806–809.
Donahue S.W., McGee M.E., Harvey K.B., Vaughan M.R., Robbins C.T., 2006. Hibernating bears as a model for preventing disuse osteoporosis // Journal of Biomechanics. V. 39. P. 1480–1488.
Fox-Dobbs K., Leonard J.A., Koch P.L., 2008. Pleistocene megafauna from eastern Beringia: Paleoecological and paleoenvironmental interpretations of stable carbon and nitrogen isotope and radiocarbon records // Palaeogeography, Palaeoclimatology, Palaeoecology. V. 261. № 1–2. P. 30–46.
Guiry E.J., Szpak P., Richards M.P., 2016. Effects of lipid extraction and ultrafiltration on stable carbon and nitrogen isotopic compositions of fish bone collagen // Rapid Communications in Mass Spectrometry. V. 30. № 13. P. 1591–1600.
Heaton T.H.E., 1987. The 15N/14N ratios of plants in South Africa and Namibia: relationship to climate and coastal/saline environments // Oecologia. V. 74. P. 236–246.
Hedges R.E.M., Clement J.G.C., Thomas D.L., O’Connell T.C., 2007. Collagen turnover in the adult femoral mid-shaft: modeled from anthropogenic radiocarbon tracer measurements // American Journal of Physical Anthropology. V. 133. № 2. P. 808–816.
Hobson K.A., Welch H.E., 1992. Determination of trophic relationships within a high Arctic marine food web using δ13C and δ15N analysis // Marine Ecological Progress Series. V. 84. P. 9–18.
Jenkins S.G., Partridge S.T., Stephenson T.R., Farley S.D., Robbins C.T., 2001. Nitrogen and carbon isotope fractionation between mothers, neonates, and nursing offspring // Oecologia. V. 129. P. 336–341.
Kelly J.F., 2000. Stable isotopes of carbon and nitrogen in the study of avian and mammalian trophic ecology // Canadian Journal of Zoology. V. 78. № 1. P. 1–27.
Kirillova I.V., Tiunov A.V., Levchenko V.A., Chernova O.F., Yudin V.G. et al., 2015. On the discovery of a cave lion from the Malyi Anyui River (Chukotka, Russia) // Quaternary Science Reviews. V. 117. P. 135–151.
Longin K., 1971. New method of collagen extraction for radiocarbon dating // Nature. V. 230. P. 241–242.
Martínez del Rio C., Wolf N., Carleton S.A., Gannes L.Z., 2009. Isotopic ecology ten years after a call for more laboratory experiments // Biological Reviews. V. 84. № 1. P. 91–111.
Minagawa M., Wada E., 1984. Stepwise enrichment of 15N along food chains: Further evidence and the relation between δ15N and animal age // Geochimica et Cosmochimica Acta. V. 48. P. 1135–1140.
Pearson S.F., Levey D.J., Greenberg C.H., Martínez del Rio C.M., 2003. Effects of elemental composition on the incorporation of dietary nitrogen and carbon isotopic signatures in an omnivorous songbird // Oecologia. V. 135. № 4. P. 516–523.
Perez-Rama M., Fernandez-Mosquera D., Grandal-D’Anglade F., 2011. Effects of hibernation on the stable isotope signatures of adult and neonate cave bears // Quaternaire, Hors-serie. V. 4. P. 79–88.
Peterson B.J., Fry B., 1987. Stable Isotopes in Ecosystem Studies // Annual Review of Ecological Systems. V. 18. P. 293–320.
Polischuk S.C., Hobson K.A., Ramsay M.A., 2001. Use of stable-carbon and nitrogen isotopes to assess weaning and fasting in female polar bears and their cubs // Canadian Journal of Zoology. V. 79. P. 499–511.
Post D.M., 2002. Using stable isotopes to estimate trophic position: models, methods, and assumptions // Ecology. V. 83. № 3. P. 703–718.
Rey-Iglesia A., García-Vázquez A., Treadaway E.C., van der Plicht J., Baryshnikov G.F., 2019. Evolutionary history and palaeoecology of brown bear in North-East Siberia re-examined using ancient DNA and stable isotopes from skeletal remains // Scientific Reports. V. 9. № 4462. P. 1–12.
Robbins C.T., Felicetti L.A., Sponheimer M. 2005. The effects dietary protein quality on nitrogen isotope discrimination in mammals and birds // Oecologia. V. 144. P. 534–540.
Szpak P., Grocke D.R., Debruyne R., MacPhee R.D.E., Guthrie R.D. et al., 2010. Regional differences in bone collagen δ13C and δ15N of Pleistocene mammoths: Implications for paleoecology of the mammoth steppe // Palaeogeography, Palaeoclimatology, Palaeoecology. V. 286. № 1–2. P. 88–96.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал