Зоологический журнал, 2020, T. 99, № 7, стр. 757-771
Сообщества с доминированием Modiolus modiolus в Онежском заливе Белого моря: насколько они стабильны во времени и пространстве?
М. В. Чикина a, *, В. А. Спиридонов a, А. Д. Наумов b
a Институт океанологии им. П.П. Ширшова РАН
117997 Москва, Россия
b Зоологический институт РАН
199034 Санкт-Петербург, Россия
* E-mail: chikina.m@gmail.com
Поступила в редакцию 22.11.2019
После доработки 16.01.2020
Принята к публикации 09.03.2020
Аннотация
Сообщества макрозообентоса Онежского залива Белого моря были исследованы в 2010 г. на 10 станциях в точках съемок ББС ЗИН РАН, выполненных в 1950-е и 1980-е гг. На всех участках, исследованных в 2010 г., наблюдались донные сообщества с доминированием двустворчатых моллюсков по биомассе. Две основные группы образовывали станции с доминированием Modiolus modiolus и станции с доминированием Clinoсardium ciliatum. Также были отмечены сообщества с доминированием Hiatella arctica и Macoma calcarea, каждое из которых было зарегистрировано только на одной станции. В связи со сложностью точного воспроизведения методов отбора и особенностями первичной обработки исторических работ, сравнение данных проводили по наиболее надежно учитываемой группе – двустворчатым моллюскам, которые, к тому же, доминируют во всех сообществах по биомассе. Значительных изменений в характере доминирования двустворчатых моллюсков обнаружено не было. На небольшой глубине (13 м) отмечено замещение поселения мидий сообществом с доминированием Hiatella arctica. Глубже 40 м наблюдалась смена доминантов: Clinocardium ciliatum – Mya truncata (1952), Elliptica elliptica – Macoma calcarea (1981), Clinocardium ciliatum – Macoma calcarea (2010). Скорее всего, смена сообществ обусловлена мозаичностью в распределении этих массовых форм. Сообщества с доминированием Modiolus modiolus, наблюдавшиеся в Онежском заливе на глубинах до 40 м в 1952 и 1981 гг., сохранились в тех же местах и в 2010 г. Важным условием стабильности сообществ макробентоса с доминированием крупных долгоживущих двустворчатых моллюсков, в частности модиолуса, является отсутствие значительных изменений условий среды и антропогенного воздействия в Онежском заливе на протяжении, по крайней мере, второй половины 20–начала 21 столетий.
Бентос является одним из наиболее удобных объектов для оценки состояния и долговременных изменений морских экосистем (Наумов и др., 2017; Grebmeier, Barry, 1991; Pogrebov, 1993; Gray, Elliott, 2009). При этом большая часть исследований многолетней динамики донных сообществ проводится в морях, которые подвергаются значительной антропогенной нагрузке и/или воздействию климатических факторов и трендов, как, например, в Баренцевом, Беринговом, Северном или Черном морях (напр., Денисенко, 2013; Чикина, 2009; Любина и др., 2016; McConnaughey et al., 2000; Kenchington et al., 2007; Kröncke et al., 2011; Clare et al., 2015).
В то же время влияние на экосистемы Белого моря происходящих в Арктике климатических изменений далеко от однозначной оценки (Ашик и др., 2014; Spiridonov et al., 2015). Беломорский бассейн по-прежнему остается умеренно затронутым человеческой деятельностью (Моисеенко, 2010; Terzhevik et al., 2005). В связи с этим исследования длительных процессов, происходящих в экосистемах и, в частности, в донных сообществах Белого моря, представляют значительный интерес. Так, была показана стабильность биомассы бентоса и доминирования определенных групп в донных сообществах Онежского залива (Solyanko et al., 2011) и глубоководной части Белого моря (Naumov, 2001), а также продемонстрирована возможность более чем полувекового сохранения сообществ с доминированием циприны (Arctica islandica) на определенных участках в Кандалакшском заливе (Герасимова и др., 2008; Исаченко и др., 2013; Чикина и др., 2014). К сожалению, в Белом море ведется немного многолетних программ, в рамках которых по более или менее единой методике проводятся ежегодные наблюдения над теми или иными компонентами экосистемы (Наумов и др., 2017; Gerasimova, Maximovich, 2013; Naumov, 2013; Usov et al., 2013). Поэтому для изучения многолетних изменений бентоса большой интерес представляет возможность повторного исследования в точках станций, взятых в прошлые десятилетия (Чикина и др., 2014; Наумов и др., 2016; Мокиевский, Котельников, 2017).
В 1950-е гг. обширные съемки бентоса были проведены Беломорской биологической станцией Зоологического института РАН (в то время подчиненной Карело-Финскому филиалу АН СССР), в дальнейшем ББС ЗИН (Кудерский, 1966, 2006), данные первичной обработки которых хранятся в Научно-исследовательском архиве Карельского научного центра РАН. Более поздние съемки выполнены ББС ЗИН в 1980–1990-х гг. и доступны в базе данных “Бентос Белого моря” (Наумов, 2006). Эти данные были использованы для изучения динамики в донных сообществах Онежского залива в 1950-х–1980-х гг. (Solyanko et al., 2011) и для анализа изменений, которые произошли в точках станций 1952 г. более чем полвека спустя (Чикина и др., 2014). В то же время значительный массив исторических данных, собранных в Онежском заливе, где широко распространены сообщества с доминированием циприны и модиолуса (Modiolus modiolus) (Кудерский, 1962, 1966; Solyanko et al., 2011), до сих пор не был использован для сравнения.
Одной из проблем сравнения результатов исследований бентоса, выполненных в одних и тех же местах, но со значительным интервалом во времени, является отсутствие единой методики сбора и обработки материала (Любин, 2016; Cusson et al., 2007). В том случае, когда отсутствует возможность сравнения полных списков видового состава, зачастую используют какую-либо одну группу организмов, которая может отражать реакцию всего сообщества в целом. Чаще всего в качестве такой группы выбирают полихет или моллюсков (Olsgard, Somerfield, 2000; Mendes et al., 2007). Поскольку сообщества макробентоса в Онежском заливе характеризуются доминированием определенных видов двустворчатых моллюсков (Иванова, 1957; Кудерский, 1962, 1966; Голиков и др., 1985; Луканин и др., 1987, 1995; Наумов 2006; Солянко, 2010; Solyanko et al., 2011), и, принимая во внимание тот факт, что в 1952 г. до видового уровня были идентифицированы только двустворчатые моллюски, для проведения сравнительного анализа нами была выбрана именно эта группа. Оценку возможных изменений проводили на примере сообществ с доминированием Modiolus modiolus, который, как Arctica islandica, является долгоживущим видом. Однако, если исследованиям продолжительности жизни циприны и временной изменчивости в Белом море посвящен ряд исследований (Герасимова, Максимович, 2009; Basova et al., 2012; Gerasimova, Maximovich, 2013), продолжительность жизни модиолуса в Белом море неизвестна (Наумов, 2006), а исследования динамики сообществ с его доминированием практически отсутствуют. Данное исследование направлено на оценку изменений в точках исторических станций в Онежском заливе, где, по данным исследований ББС ЗИН РАН в 1952 и 1981 гг., наблюдалось доминирование модиолуса и ряда других крупных двустворчатых моллюсков.
МАТЕРИАЛЫ И МЕТОДЫ
Район исследований
Онежский залив является наиболее мелководным районом Белого моря — почти на всей акватории глубины не превышают 50 м, за исключением небольших участков к юго-западу от мыса Чесменского и Восточной Соловецкой салмы, в которой глубина достигает 87 м (Бабков, 1998). Рельеф дна Онежского залива достаточно сложен, особенно вдоль западных берегов, где находится множество малых островов, луд, корг, отмелей. Характерно большое разнообразие грунтов, при этом наличие мелких камней и гальки обычно на любых типах грунтов, в том числе на глине, илах, песках. Эти каменистые россыпи образуются за счет разноса грубообломочного материала льдом (Кудерский, 1966) и абразии моренных отложений и разноса их интенсивными приливными течениями (Невесский и др., 1977). Главные особенности гидрологического режима Онежского залива связаны с его морфометрическими характеристиками: относительно большие глубины в Соловецких салмах обеспечивают поступление в залив больших объемов вод, из-за мелководности всего залива возникают сильные приливо-отливные течения (Бабков, 1998). В результате турбулентного перемешивания на большей акватории залива часто наблюдается полная гомогалинность и гомотермия от поверхности до дна (Пантюлин, 2012). В то же время летом на глубинах более 20 м и в районах сильного влияния стока рек может устанавливаться стратификация, но выраженность и заглубленность пикноклина меняются за считанные часы в ходе приливного цикла (Кременецкий, 2012).
Сбор и обработка материала
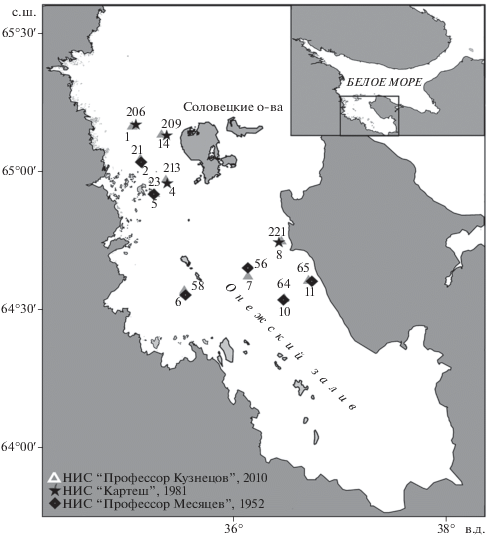
Съемка 2010 г. (рис. 1, табл. 1) была спланирована в соответствии с анализом архивных данных по съемкам в августе–сентябре 1952 г. на НИС “Профессор Месяцев” и в июле–августе 1981 г. – на НИС “Картеш” (ББС ЗИН РАН). Данные по съемке 1952 г. были получены в Научно-исследовательском архиве Карельского научного центра РАН (Рейсовые журналы, 1952; Материалы обработки бентоса, 1952; Solyanko et al., 2011). Данные по съемке 1981 г. были взяты из базы данных “Бентос Белого моря” по макробентосу, ведущейся на ББС ЗИН РАН (Наумов, 2006). Для повторного обследования были выбраны станции, на которых в прошлом наблюдалось доминирование по биомассе Modiolus modiolus (4 станции в 1952 г. и 1 станция в 1981 г.), в качестве фоновых станций были выбраны станции с доминированием Arctica islandica (2 станции в 1952 г. и 1981 г.), Elliptica elliptica (синоним Astarte elliptica, принятый WoRMS, 2018. В связи с тем, что ревизии семейства пока не проводилось, родовое имя Elliptica сохранено в целях поддержания стабильности номенклатуры) (1 станция в 1981 г.), Hiatella arctica (1 станция в 1952 г.) и Mytilus edulis (1 станция в 1981 г.) (табл. 2). Сбор материала проводили с использованием дночерпателя Ван-Вина площадью 0.1 м2 на НИС “Профессор Кузнецов” в июле 2010 г. в точках, повторяющих станции 1952 г. и 1981 г. (съемки ББС ЗИН РАН). В 1952 г. работы проводились с использованием дночерпателя Петерсена с площадью захвата 0.1 м2 (Иванова, 1957; Кудерский, 1966) а в 1981 – дночерпателя Петерсена (“Океан – 25”) с площадью захвата 0.25 м2 (Луканин и др., 1995) (табл. 3). Выход на точки станций 1952 г. и 1981 г. на большинстве (8 из 10) станций показал удовлетворительное соответствие по географическим координатам и глубине; на ст. 2 и 7 глубина оказалась меньше, чем измеренная в 1952 г. (табл. 2). На каждой станции проводили отбор проб макрозообентоса в пяти повторностях, за исключением ст. 1 (4 повторности).
Таблица 1.
Общие характеристики бентосных станций, взятых в июне 2010 г. в Онежском заливе на НИС “Профессор Владимир Кузнецов”
| Район | Станция | Широта, с.ш. | Долгота, в.д. | Глубина, м | T °С прид. | S прид., psu | Донные осадки | Тип грунта, визуальное описание | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
| галька (сверх 10 мм) | гравий (2–10 мм) | песок (0.05–2 мм) | ил (<0.05 мм) |
||||||||
| Западная Соловецкая салма | 1 | 65°09.730′ | 35°02.999′ | 58 | 3.8 | 26.9 | 4.65 | 17.52 | 57.52 | 20.31 | Песчанистый ил, гравий, галька |
| Западная Соловецкая салма | 2 | 65°02.603′ | 35°07.618′ | 32 | 8.1 | 25.7 | 14.74 | 9. 54 | 66.28 | 9.44 | Крупный промытый песок и гравий, ракуша |
| Западная Соловецкая салма | 4 | 64°58.046′ | 35°21.955′ | 13.3 | 8.1 | 26.1 | 0 | 4.27 | 8.03 | 87.7 | Глина без явных включений гравия, ракуша |
| Западная Соловецкая салма | 5 | 64°55.066′ | 35°15.766′ | 35.3 | 8 | 25.7 | 34.19 | 15.31 | 42.91 | 7.59 | Заиленный песок, гравий, галька |
| Разрез м. Чесменский– о-ва Жужмуи | 6 | 64°34.043′ | 35°32.329′ | 18.6 | 6.9 | 25.8 | 33.12 | 11.15 | 32.91 | 22.82 | Песок с примесью глины, гравий, галька, ракуша |
| Разрез м. Чесменский– о-ва Жужмуи | 7 | 64°37.146′ | 36°08.130′ | 41.5 | 5 | 26.9 | 2.32 | 8.56 | 71.17 | 17.95 | Илистый песок с крупной галькой |
| Разрез м. Чесменский– о-ва Жужмуи | 8 | 64°44.767′ | 36°26.929′ | 20.3 | 7.8 | 25.7 | 28.78 | 1.46 | 59.61 | 10.15 | Слабо заиленный песок, гравий, ракуша, крупная галька |
| Лямицкий берег | 10 | 64°32.282′ | 36°28.614′ | 30.8 | 7.0 | 26.4 | 1.5 | 15.27 | 72.11 | 11.12 | Песок, ракуша |
| Лямицкий берег | 11 | 64°36.253′ | 36°42.115′ | 17.8 | 7.8 | 25.6 | 29.39 | 8.59 | 51.31 | 10.71 | Заиленный песок, гравий, галька |
| Западная Соловецкая салма | 14 | 65°07.898′ | 35°19.498′ | 20 | 7.8 | 25.9 | Нет данных | Нет данных | Нет данных | Нет данных | Песок, ракуша, крупная галька и валуны |
Таблица 2.
Общая биомасса и численность бентоса, число видов и доминирующие виды двустворчатых моллюсков (Bivalvia) в Онежском заливе в июне 2010 г. и сравнение с данными соответствующих станций 1952 и 1980 гг.
| Показатель | Номер станции, год | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 4 | 5 | 6 | 7 | 8 | 10 | 11 | 14 | |
| 2010 | 2010 | 2010 | 2010 | 2010 | 2010 | 2010 | 2010 | 2010 | 2010 | |
| Глубина, м | 58 | 32 | 13.3 | 35.3 | 18.6 | 41.5 | 20.3 | 30.8 | 17.8 | 20 |
| Придонная T, °C* | 3.8 | 7.8–8.1 | 8.0–8.1 | 8.1 | 6.9–7.0 | 4.95–5.0 | 7.8 | 7.0 | 7.8 | 7.8 |
| Общая биомасса, г/м2 | 74.47 | 603.29 | 91.16 | 443.21 | 73.79 | 173.67 | 133.08 | 1201.68 | 338.33 | 624.34 |
| Общая численность, экз./м2 | 2895 | 1864 | 1186 | 3234 | 1368 | 4114 | 2652 | 2508 | 4708 | 1314 |
| Число видов Bivalvia | 10 | 11 | 8 | 12 | 14 | 13 | 14 | 17 | 22 | 14 |
| Доминирующие виды по биомассе | Macoma calcarea | Modiolus modiolus | Hiatella arctica | Modiolus modiolus | Clinocardium ciliatum, Elliptica elliptica |
Clinocardium ciliatum | Clinocardium ciliatum, Arctica islandica | Modiolus modiolus | Modiolus modiolus, Arctica islandica, Clinocardium ciliatum | Modiolus modiolus |
| Показатель | Номер станции, год | |||||||||
| 206 | 21 | 213 | 23 | 58 | 56 | 221 | 64 | 65 | 209 | |
| 1981 | 1952 | 1981 | 1952 | 1952 | 1952 | 1981 | 1952 | 1952 | 1981 | |
| Глубина, м | 60 | 39 | 14 | 37 | 19 | 50 | 20 | 30 | 18 | 20 |
| Придонная T, °C | нд | 9.1 | нд | 10.3 | 11.11 | 8.57 | нд | 10.2 | 11.02 | нд |
| Общая биомасса, г/м2 | 119.474 | 1558.07 | 119.67 | 366.13 | 211.95 | 150.38 | 316.322 | 1422.26 | 597.23 | 3065.88 |
| Общая численность, экз./м2 | 2480 | 2580 | 2485 | 520 | 1100 | 595 | 9434 | 6265 | 2935 | 5292 |
| Число видов Bivalvia | 13 | 7 | 3 | 4 | 9 | 6 | 9 | 9 | 8 | 10 |
| Доминирующие виды по биомассе | Elliptica elliptica, Macoma calcarea | Modiolus modiolus | Mytilus edulis | Modiolus modiolus | Clinocardium ciliatum | Clinocardium ciliatum, Mya truncata |
Arctica islandica, Clinocardium ciliatum | Modiolus modiolus | Modiolus modiolus, Arctica islandica | Modiolus modiolus |
Таблица 3.
Методика отбора проб в разные годы
| Показатель | Съемка | ||
|---|---|---|---|
| Карело-Финский филиал АН СССР, судно НИС “Профессор Месяцев” | ЗИН РАН, судно НИС “Картеш” | ИО РАН, судно НИС “Профессор Кузнецов” | |
| Дата съемки | Август–сентябрь 1952 г. | Июль–август 1981 г. | Июль 2010 г. |
| Орудие лова | Дночерпатель Петерсена (0.1 м2) | Дночерпатель Петерсена (0.25 м2) | Дночерпатель Ван-Вина (0.1 м2) |
| Размер ячеи промывочного сита | 0.75 мм | 1 мм | 1 мм |
| Количество проб на станции | 2 | 1 | 5 |
В 2010 г. промывку проб вели на палубе через сито с диаметром ячеи 1 мм, в 1952 г. для промывки использовали сито с диаметром ячеи 0.75 мм (Иванова, 1957), а в 1981 г. – 1 мм (табл. 3). Пробы фиксировали 4% нейтральным раствором формальдегида в морской воде. Дальнейшая обработка в лаборатории включала определение беспозвоночных по возможности до видового ранга, подсчет и взвешивание представителей всех видов (с точностью 0.001 г). Для определения биомассы использовали сырой вес организмов. Все видовые списки были приведены к единой таксономической номенклатуре для обеспечения сопоставимости исторических данных с результатами современных исследований.
Методы анализа и статистической обработки материала
Ряд исследований продемонстрировал возможность использования одной таксономической группы, реакция которой на изменения окружающей среды может отражать ответ всего комплекса видов (Olsgard, Somerfield, 2000). В качестве таких групп-суррогатов чаще всего используются полихеты или моллюски (Olsgard, Somerfield, 2000; Olsgard et al., 2003; Mendes et al., 2007, Włodarska-Kowalczuk, Kędra, 2007). Принимая во внимание вышеуказанные исследования, а также тот факт, что в 1952 г. до видового уровня были идентифицированы только двустворчатые моллюски, в то время как остальные животные были зарегистрированы в виде таксонов более высокого ранга, для анализа временных изменений было принято решение использовать именно эту группу.
Сравнительный анализ проводили с использованием неметрического многомерного шкалирования (MDS) на основе индекса сходства Брея-Кёртиса, вычисленного на основании данных по биомассе. Данные были предварительно стандартизованы и log-трансформированы. Результаты ординации проверяли методом однофакторного анализа сходства (ANOSIM), который позволяет оценивать достоверность объединения станций в те или иные группы (Clarke, Warwick, 2001). Для оценки различий между выборками использовали непараметрический U-критерий Манна–Уитни (Mann, Whitney, 1947). Оценку различий между выделенными комплексами видов, образующих сообщества, внутрикомплексное сходство, а также определение характерных видов, которые вносят наибольший вклад во внутрикомплексное сходство, проводили, используя программу SIMPER (similarity percentages) пакета PRIMER. Все расчеты и статистический анализ данных производили при помощи пакетов программ MS Excel 2007 (Microsoft™); Primer v. 6.1.16 (Primer™, 2001); Past 3.20 (Hammer et al., 2001). Анализ гранулометрического состава грунта был выполнен сотрудниками Аналитической лаборатории ИО РАН водно-ситовым методом.
РЕЗУЛЬТАТЫ
Гидрологические условия и донные осадки
На входе в Онежский залив, в проливе Западная Соловецкая салма, в более глубокой северной части (около 70 м, ст. 1; рис. 1) наблюдалась летняя двуслойная структура, характерная для Бассейна Белого моря (Berger, Naumov, 2001) с очень тонким прогретым (8.6–9.05°С) и распресненным (25.94–26.20 psu) перемешанным верхним двухметровым слоем, ниже которого до глубины около 13–14 м располагались термоклин и галоклин, где температура резко падала до 4.8°С, а соленость возрастала до 28.8 psu, ниже наблюдались незначительное плавное снижение температуры и увеличение солености. В южной части Западной Салмы и в самом Онежском заливе на большинстве станций наблюдались условия в значительной степени перемешанной толщи с гомотермией или достаточно плавным и незначительным понижением температуры от поверхности до дна, где она составляла 7.0–9.7°С. Только на ст. 7 в центральной части залива с глубиной более 40 м она была ниже (около 5°С) (табл. 1). Соленость обычно плавно и незначительно повышалась от поверхности до дна, составляя в придонном слое от 25.5 до 27.0 psu. На некоторых станциях, очевидно, находившихся в области влияния линз речной воды (например, станция 6), наблюдалось некоторое распреснение поверхностного слоя и связанная с этим слабая стратификация водной толщи. Полученные нами данные ни в чем не противоречат данным, опубликованным ранее другими исследователями.
Гранулометрический анализ грунта показал, что в 2010 г. основной фракцией являлся крупный, местами заиленный песок с примесью гравия и гальки (табл. 1). Доля песчаных фракций менялась от 8.03 до 72.11%. Максимальное содержание ила составило 87.7%, оно было зарегистрировано на ст. 4, расположенной на глубине 13 м. На остальных станциях содержание илистых фракций варьировало от 7.59 до 22.82%.
Общая характеристика макрозообентоса в 2010 г.
Всего в ходе съемки 2010 г. было обнаружено 192 таксона беспозвоночных. Из них максимальное количество отмечено для полихет (64 вида), также зарегистрировано 45 видов ракообразных, 30 видов двустворчатых моллюсков, 29 видов брюхоногих моллюсков, 8 видов иглокожих. Остальные таксоны были представлены одним–тремя видами. Практически половину общей численности макрозообентоса составили ракообразные (49% от общей численности), высокая численность была также отмечена для полихет – (27%) и моллюсков (17%). По биомассе преобладали моллюски, их доля в суммарной биомассе составила 73%, в то время как доля ракообразных составила 5%, а доля полихет – всего 2% от общей биомассы. Доля остальных таксонов составила 18% от суммарной биомассы (в основном благодаря высокой биомассе мшанки Flustra foliacea, зарегистрированной на ст. 14).
Суммарная численность менялась от 1186 до 4708 экз./м2. Высокий вклад в суммарную численность на большинстве станций был отмечен у усоногого рака Verruca stroemia (до 2880 экз./м2 на ст. 11). Также была зарегистрирована высокая численность полихеты Galathowenia oculata на ст. 1 (1165 экз./м2) и офиуры Ophiura robusta на ст. 5 (796 экз./м2).
Общая биомасса бентоса варьировала от 74 до 1202 г/м2 (табл. 2). На всех участках, исследованных в 2010 г., наблюдались донные сообщества с доминированием по биомассе двустворчатых моллюсков. При этом число видов двустворчатых моллюсков варьировало от 8 (на самой мелководной станции) до 22 на станцию, составляя от 14 до 21% учтенных видов макробентоса.
Характеристика сообществ
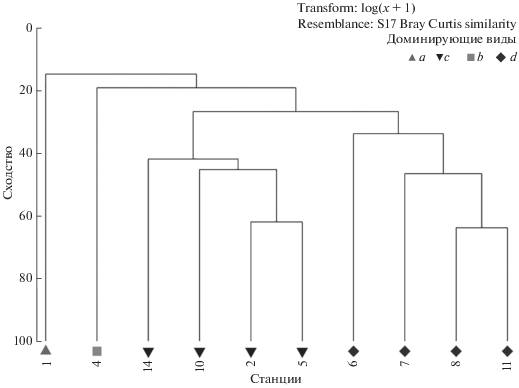
По данным дночерпательной съемки 2010 г., было выделено четыре типа сообществ. На рис. 2 представлены результаты кластерного анализа, выполненного на основе данных по биомассе. Две основные группы образуют станции с доминированием Modiolus modiolus (ст. 2, 5, 10, 14) и станции с доминированием Clinoсardium ciliatum (синоним Ciliatocardium ciliatum, принятый WoRMS, 2018) в сочетании c другими видами двустворчатых моллюсков, такими как Elliptica elliptica (ст. 6), Arctica islandica (ст. 8), M. modiolus и A. islandica (ст. 11). Станция 4, на которой отмечено максимальное заиление осадков, расположена на наименьшей исследованной глубине 13 м в Западной Соловецкой салме и характеризовалась сообществом с доминированием Hiatella arctica c общей биомассой менее 100 г/м2. На ст. 1, расположенной на входе в Западную Салму, где доминировала Macoma calcarea, также отмечена относительно низкая биомасса (табл. 2). Станции с доминированием C. ciliatum с биомассой 74–173 г/м2 располагались по линии о-ва Большой и Малый Жужмуй – мыс Чесменский на Онежском п-ове на глубинах от 18 до 41 м. Наиболее высокой (в среднем 642 ± 150 г/м2) биомасса была на станциях с доминированием M. modiolus в Западной Соловецкой салме и у берегов Онежского п-ова в диапазоне глубин 17–35 м, статистически достоверно отличаясь от биомассы на станциях с доминированием других видов (в среднем 109 ± 17 г/м2; критерий Манна-Уитни U = 0, z = –2.929, р < 0.05).
Рис. 2.
Результат кластерного анализа, проведенного с использованием индекса сходства Брэя-Кёртиса на основе log-трансформированных данных 2010 г. по биомассе. Доминирующие виды: a – Macoma calcarea, b – Hiatella arctica, c – Modiolus modiolus, d –Clinocardium ciliatum + Bivalvia varia.
Всего в сообществе с доминированием M. modiolus было зарегистрировано 135 видов беспозвоночных, из которых наибольшее число видов относится к полихетам (52 вида), ракообразным (35 видов) и двустворчатым моллюскам (19 видов). Список характерных видов, которые обеспечивают до 90% внутрикомплексного сходства, представлен в табл. 4. Оценка значимости видов по вкладу во внутрикомплексное сходство демонстрирует, что вклад доминирующего M. modiolus обеспечивает более 40% сходства. Среднее сходство между станциями составляет 45%. Основу биомассы также составил M. modiolus, биомасса меняется от 126 до 1012 г/м2, в то время как численность варьирует в диапазоне от 48 до 132 экз./м2.
Таблица 4.
Список характерных видов, которые обеспечивают до 90% внутрикомплексного сходства станций 2010 г. с доминированием M. modiolus
| Таксон | Вид | Численность средняя, экз./м2 ±SE |
Биомасса средняя, г/м2 ±SE |
Вклад
во внутрикомплексное сходство, % |
Кумулятивный вклад, % |
|---|---|---|---|---|---|
| Bivalvia | Modiolus modiolus | 101 ± 18 | 516.47 ± 188.08 | 41.19 | 41.19 |
| Bryozoa | Flustra foliacea | 7 ± 2 | 127.39 ± 114.04 | 9.03 | 50.22 |
| Crustacea | Verruca stroemia | 547 ± 283 | 7.66 ± 3.07 | 7.96 | 58.18 |
| Brachiopoda | Hemithiris psittacea | 11 ± 1 | 1.81 ± 0.37 | 6.51 | 64.69 |
| Ascidiacea | Molgula sp. | 25 ± 14 | 2.76 ± 1.09 | 4.77 | 69.46 |
| Polychaeta | Melinna elisabethae | 168 ± 79 | 1.64 ± 0.83 | 3.44 | 72.9 |
| Polychaeta | Nephtys ciliata | 5 ± 2 | 2.35 ± 1.67 | 2.66 | 75.55 |
| Crustacea | Balanus crenatus | 147 ± 123 | 17.78 ± 15.15 | 2.48 | 78.04 |
| Bivalvia | Mytilidae gen. sp. juv. | 21 ± 12 | 1.15 ± 0.52 | 2.47 | 80.5 |
| Echinodermata | Ophiura robusta | 237 ± 188 | 2.51 ± 1.85 | 2.39 | 82.89 |
| Cnidaria | Hydrozoa gen. sp. | 6 ± 2 | 13.56 ± 12.47 | 2.24 | 85.13 |
| Sipuncula | Golfingia margaritacea | 7 ± 2 | 1.23 ± 0.66 | 2.18 | 87.3 |
| Polychaeta | Nephtys longosetosa | 3 ± 1 | 0.58 ± 0.24 | 1.82 | 89.13 |
| Polychaeta | Terebellides stroemii | 16 ± 4 | 0.19 ± 0.04 | 0.98 | 90.11 |
Сравнение с данными 1952 и 1980 гг.
Постанционное сравнение данных 2010 г. с данными прошлых лет показало, что в четырех точках (2, 5, 10, 11), где в 1952 г. наблюдались донные сообщества с доминированием Modiolus modiolus, спустя 58 лет также отмечено доминирование этого вида. На станции 14 доминирование модиолуса отмечено в 1981 и 2010 гг. (табл. 2). На станции 11 в 1952 г. содоминантом была Arctica islandica. Эта ее роль отмечена и в 2010 г., однако в качестве еще одного содоминанта появился Clinocardium ciliatum.
На других станциях доминирование определенных видов двустворчатых моллюсков сохранялось лишь отчасти. Так, в 1981 г. в окрестностях станции 8 доминировали A. islandica и C. ciliatum. В 2010 г. эти два вида поменялись местами по вкладу в общую биомассу бентоса (табл. 2). В 1952 г. C. ciliatum преобладал и в средней части Онежского залива (станции 58 и 56 1952 г.). На соответствующих станциях 6 и 7 в 2010 г. доминирование этого вида сохранилось, но в первой из точек в районе архипелага Жужмуи отмечен в качестве cодоминанта Elliptica elliptica, а во второй – выпал cодоминант Mya truncata (табл. 2). Несколько изменился состав доминантов и на входе в Западную Соловецкую салму, где в 1981 г. было выражено доминирование Macoma calcarea и E. elliptica, в 2010 г. второй вид также выпал из cодоминантов (табл. 2, ст. 1). Наиболее значительные изменения отмечены на мелководной станции, где вместо поселения мидий в 1981 г. в 2010 г. наблюдалось сообщество с доминированием Hiatella arctica.
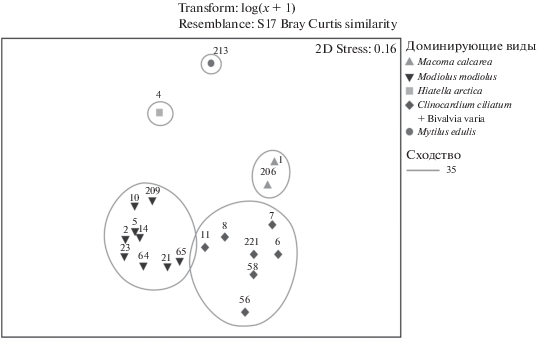
Анализ методом многомерного шкалирования позволил выделить две группы: в первой оказались станции разных лет с доминированием M. modiolus, во вторую группу объединились станции с доминированием различных моллюсков (рис. 3). Во второй группе, обозначенной нами C. ciliatum + Bivalvia varia, было зарегистрировано 10 видов, общий вклад которых во внутригрупповое сходство составлял более 90%: C. ciliatum, E. elliptica, M. calcarea, Leionucula bellotii, A. islandica, Nuculana pernula, Thyasira gouldi, Nuculana minuta, Crenella decussata, H. arctica. Еще три станции не вошли ни в одну из групп. Разделение станций в обозначенные группы неслучайно и статистически достоверно (ANOSIM: R = = 0.905, p = 0.1%).
Рис. 3.
Ординация станций методом многомерного шкалирования (МДС) с использованием индекса Брея-Кертиса на основе log-трансформированных данных по биомассе двустворчатых моллюсков. Цифрами указаны номера станций.
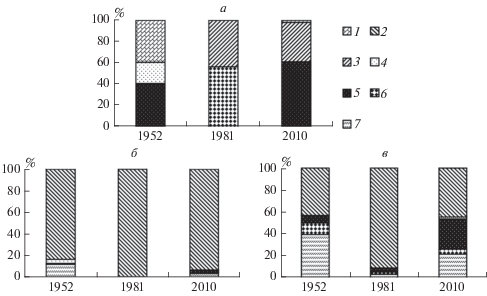
Сравнение данных по соотношению биомассы двустворчатых моллюсков, являющихся доминантами и субдоминантами донных сообществ по интервалам глубин, показал сходный состав доминантов и субдоминантов таксоценов моллюсков и практически идентичный вклад M. modiolus (около 43%) на глубинах 10–30 м в 1952 и 2010 гг. В 1981 г. доля этого вида превышала 80% (рис. 4), но причиной этого была исключительно высокая биомасса на станции 209 (табл. 2). В интервале глубин 31–40 м во все годы наблюдений модиолус составлял более 80% биомассы массовых видов моллюсков. На глубинах более 40 м доминирования M. modiolus нигде не наблюдалось, а состав доминантов существенно менялся по годам, в 1952 и 2010 гг. значительный вклад вносил C. ciliatum, а в 1981 и 2010 гг. также M. calcarea (на наиболее глубоководной станции) (рис. 4).
ОБСУЖДЕНИЕ
Прежде чем перейти к обсуждению полученных результатов, отметим, что сравнение современных данных по макробентосу с данными, полученными в тех же точках десятилетия назад, имеет определенные методические ограничения. Они связаны с практической невозможностью точного воспроизведения методики прошлых исследований, таких как способ определения географических координат, измерения глубины, особенности работы орудий лова. Так, по воспоминаниям проф. Л.А. Кудерского, который в качестве лаборанта принимал участие в съемке 1952 г. (личн. сообщ. В.А. Спиридонову), дночерпатели Петерсена, произведенные в мастерских Института океанологии АН СССР и впервые использованные в данном рейсе НИС “Профессор Месяцев”, работали значительно более эффективно и надежно, чем дночерпатели той же модели, использовавшиеся в исследованиях ББС ранее. Остаются неясными и особенности первичной обработки проб, практиковавшиеся в прошлом. Поэтому мы отказались от попыток воспроизвести методику отбора проб в деталях и сосредоточились на сравнении характеристик, которые минимально зависят от методических различий: биомассе массовых видов двустворчатых моллюсков, являющихся доминирующей группой в макробентосе Онежского залива (Кудерский, 1962; Луканин и др., 1995; Наумов, 2006; Рогачева, 2012; Solyanko et al., 2011). Они собираются всеми типами дночерпателей, при промывке проб улавливаются на ситах всех использованных типов (различия могут быть связаны только с собираемостью малоразмерной молоди; см. Любин, 2016), а определение беломорских видов разными специалистами в большинстве случаев не вызывает сомнений (хотя существуют проблемы с определением видов Nuculana; см. Наумов, 2006). При анализе материала мы также принимали во внимание разный размер дночерпателей, используемых в исторических съемках, что, безусловно, затрудняет сопоставление данных, поскольку при фиксированном количестве проб пробоотборники разной площади дают разную оценку плотности поселения донных организмов (Andrew, Mapstone, 1987; Underwood, Chapman, 2005). Показано, что дночерпатель меньшей площади может недоучитывать крупные виды макрофауны, а также виды, обитающие на крупных галечных грунтах (Boyd et al., 2006). Тем не менее, хотя различия в составе донной фауны, собранной при помощи дночерпателей разной площади (0.1 и 0.25 м2), являются статистически значимыми при прямом сравнении, они практически исчезают при пересчете полученных данных на одну и ту же площадь (Boyd et al., 2006).
Учитывая вышеописанные методические ограничения, настоящее исследование не выявило значительных изменений в характере доминирования двустворчатых моллюсков в сообществах макрозообентоса Онежского залива в течение десятилетий. Только в одном случае на небольшой глубине (13 м) отмечено замещение поселения мидий сообществом с доминированием Hiatella arctica. Для сублиторальных поселений Mytilus edulis в Белом море описаны циклические изменения, которые могут приводить к обратимому исчезновению мидиевых банок в тех или иных местах (Наумов, 2006).
Глубже 40 м наблюдалась смена доминантов: Clinocardium ciliatum – Mya truncata (1952), Elliptica elliptica – Macoma calcarea (1981), C. ciliatum – M. calcarea (2010). Порядок доминирования этих обычных для Онежского залива массовых форм в разные годы определялся, скорее всего, значительной мозаичностью в их распределении. Кроме того, для моллюсков Белого моря известны несинхронизированные квазициклы изменения численности (Наумов, 2006), которые сами по себе, даже без воздействия локальных внешних факторов, могут значительно изменить облик донных сообществ.
Сообщества макрозообентоса с выраженным доминированием Modiolus modiolus (и в одном случае циприны, Arctica islandica как содоминанта, см. табл. 2), наблюдавшиеся в Онежском заливе на глубинах до 40 м в 1952 и 1981 гг., сохранились в тех же местах в 2010 г.
Ранее было показано, что в Кандалакшском заливе сообщества с доминированием A. islandica наблюдались на одних и тех же местах с начала 1950-х до конца 2010-х гг. (Исаченко и др., 2013; Чикина и др., 2014; Мокиевский, Котельников, 2017). Ежегодный мониторинг поселения циприны в районе Керетского архипелага в Кандалакшском заливе показал, что, хотя доминирование этого вида сохранялось на протяжении четверти века, численность и возрастной состав менялись, указывая на возможность долгопериодных циклов или квазициклов (Герасимова и др., 2008; Gerasimova, Maximovich, 2013). В качестве основных факторов, определяющих стабильное сохранение сообществ A. islandica в пространстве и времени, рассматривались большая продолжительность жизни самих моллюсков и относительная стабильность условий на тех глубинах, где эти сообщества обитают (Чикина и др., 2014).
Модиолус, как и циприна, является долгоживущим видом. Однако, в то время как исследованиям продолжительности жизни и временной изменчивости A. islandica в Белом море посвящен ряд исследований (Герасимова, Максимович, 2009; Basova et al., 2012; Gerasimova, Maximovich, 2013), продолжительность жизни M. modiolus в Белом море неизвестна (Наумов, 2006). Исследования динамики сообществ с доминированием этого моллюска также практически отсутствуют. В северо-восточной Атлантике особи с длиной раковины 100 мм в разных географических популяциях имели возраст от 10–17 до 14–29 лет (Dinesen, Morton, 2015). По данным Золотарева (1989), продолжительность жизни M. modiolus в Японском море составляет 61 год, для популяций из Северного и Ирландского морей приведен предельный возраст в 45–50 лет (Anwar et al., 1990). Созревание происходит медленно, как правило, у особей старше 4 лет (Dinesen, Morton, 2015).
Скорее всего, долгоживущие виды также претерпевают колебания численности и изменения возрастной структуры, однако их квазициклы могут быть весьма долгопериодными и сглаженными. У M. modiolus описан ряд механизмов, которые могут обеспечивать успешное выживание молоди, пополнение ею агрегаций и, в конечном счете, стабильность поселений (Dinesen, Morton, 2015). Так, у молодых моллюсков развиты щетинки на раковине, которые обеспечивают камуфляж и защиту от хищников. Оседание личинок в районе существующих поселений модиолуса может быть стимулировано веществами, содержащимися в воде, выходящей из выводных сифонов взрослых особей, а теневой эффект агрегаций этих крупных моллюсков на сильные придонных течения может способствовать эффективному формированию биссусных нитей у осевшей молоди (Dinesen, Morton, 2015). Неясно, правда, возникают ли в агрегациях конкурентные отношения между взрослыми особями и молодью M. modiolus, как это происходит, например, у мидий (Kautsky, 1982; Swane, Ompi, 1993; Наумов, 2016). Мало что известно и о внутренней структуре поселений модиолуса.
В Онежском заливе сообщества M. modiolus преимущественно обитают в диапазоне глубин 10–40 м (Кудерский, 1966; Солянко, 2010; Рогачева, 2012; Спиридонов и др., 2012), где перемешивание сильными приливными течениями (Кременецкий, 2012; Пантюлин, 2012; Filatov et al., 2005) приводит к формированию в летнее время температурных условий, благоприятных для этого бореального вида (6–11°С; табл. 1). По данным видеонаблюдений, на глубинах менее 10 м, где преобладают подвижные песчаные субстраты, небольшие поселения модиолуса встречаются отдельными пятнами на вкраплениях грубообломочного осадочного материала (Спиридонов и др., 2012). Показано, что модиолус успешно адаптируется к сезонному понижению температуры, увеличивая концентрацию ферментов, определяющих скорость метаболизма (Lesser, Kruse, 2004). Этот механизм компенсации температурных колебаний также может способствовать устойчивости поселений M. modiolus.
Изменения климата в Белом море в последние десятилетия выражаются в увеличении поверхностной летней температуры, начиная со второй половины 2000-х гг. (особенно по сравнению с 1980-ми и концом 1990-х гг.), небольших трендах роста среднегодовой температуры на поверхности и уменьшения площади ледяного покрова (Ашик и др., 2014). Изменения среднемесячного количества осадков над Белым морем демонстрируют очень слабый положительный тренд с 1980-х гг. (Ашик и др., 2014), а речной сток, который может оказать серьезное влияние на динамику солености и океанографический режим в целом, не обнаруживает каких-либо трендов и существенных изменений (Filatov et al., 2005).
Данные по многолетней изменчивости придонной температуры в области обитания сообществ c доминированием M. modiolus в Онежском заливе отсутствуют. Придонная температура на исследованных нами станциях была несколько выше в 1952 г. по сравнению с 2010 г., что может объясняться различиями в сезоне: июнь в 2010 г. и август–начало сентября в 1952 г. Многолетний ряд температуры на декадной станции Беломорской биостанции ЗИН РАН у мыса Картеш не показывает каких-либо трендов средне-весенней и средне-летней температуры на глубинах более 10 м (Усов, 2015). Онежский залив открыт влиянию холодного промежуточного слоя и постоянно холодных глубинных вод Бассейна Белого моря благодаря переносу вод через структурный фронт на северной границе (Пантюлин, 2012), приливному перемешиванию и в целом антициклонической циркуляции вод (Бабков, 1998; Filatov et al., 2005а). Холодная глубинная вода Белого моря может рассматриваться как важнейший стабилизатор условий в сублиторали этого бассейна (Solyanko et al., 2011; Spiridonov et al., 2015).
Даже при стабильности сезонного цикла условий среды ряд факторов, связанных преимущественно с человеческой деятельностью, способны вызвать значительные изменения в донных сообществах: увеличение нагрузки биогенных элементов и эвтрофикация (напр., Pearson, Rosenberg, 1978; Rosenberg et al., 1987; Ganmanee et al., 2004; Revkov et al., 2014), промышленное загрязнение и сброс отходов добычи минерального сырья (напр., Ahn et al., 1995; Hughes et al., 2015), интенсивное использование донных орудий лова (напр., Kaiser et al., 1998; McConnaughey et al., 2000), инвазии чужеродных видов (напр., Чикина, 2009; Chikina, Kucheruk, 2005; Oug et al., 2018). Признаки эвтрофикации были обнаружены в Белом море при сравнении данных 1950-х и 1970–1980-х гг. (Максимова, 1991), однако в настоящее время эти данные оцениваются не столь однозначно. Помимо этого, сравнение современных данных с данными прошлых лет затруднено несовершенством океанографических измерений и химико-аналитических методов в прошлые годы (Сапожников и др., 2012). Кроме того, сельскохозяйственная и промышленная деятельность, ведущая к эвтрофикации моря через загрязнение биогенными элементами и органическим веществом, в последние десятилетия в 1990–2010 гг. в водосборном бассейне Белого моря оказалась снижена (Моисеенко, 2010; Terzhevik et al., 2005). Траловый промысел сельди существовал в Онежском заливе в 1970–80-е гг., был сосредоточен в Сорокской губе, а в последние годы проводился эпизодически (Стасенков, 2011); не обнаружено здесь и инвазивных видов.
Таким образом, отсутствие значительных изменений условий среды и антропогенного воздействия в Онежском заливе на протяжении, по крайней мере, второй половины XX – начала XXI столетий – является важным условием стабильности сообществ макробентоса с доминированием крупных долгоживущих двустворчатых моллюсков, в частности модиолуса, что уже предполагалось при рассмотрении периода с 1950-х по 1980-е гг. (Solyanko et al., 2011).
Агрегации модиолуса сами являются стабилизатором прибрежных экосистем, влияя на седиментогенез и создавая биогенные структуры (Dinesen, Morton, 2015), в которых встречаются практически все виды макрозообентоса, известные для Онежского залива (Кудерский, 1962), и которые являются средой для формирования разнообразных биотических отношений этих видов, обеспечивая, в частности, биогенный субстрат для разнообразной прикрепленной эпифауны (Наумов, 2006). В этом смысле вполне допустимо говорить о биоценозе модиолуса (Кудерский, 1962), как некоторой целостности в понимании, близком к классическому пониманию автора этого термина К. Мёбиуса. Сообщества с доминированием модиолуса и других крупных двустворчатых моллюсков, весьма вероятно, являются той кормовой базой, которая обеспечивает зимовку обыкновенной гаги (Somateria molissima), питающейся моллюсками и другими донными беспозвоночными (Краснов, 2011). Практически вся беломорская популяция этого вида проводит зиму в полыньях и разводьях Онежского залива (Краснов, 2011), преимущественно над глубинами, где развиты сообщества модиолуса. В то же время, пример ряда районов Северо-восточной Атлантики показывает, что восстановление агрегаций модиолуса, если они нарушены, происходит крайне медленно (Dinesen, Morton, 2015). Именно поэтому M. modiolus внесен в списки охраняемых видов Конвенции ОСПАР по охране окружающей среды в Северо-восточной Атлантике, а сообщества модиолуса рассматриваются как один из важнейших объектов при выделении приоритетного для охраны (в масштабах всей российской Арктики района вокруг Соловецких о-вов (Solovyev et al., 2017). Разработан проект Соловецкого комплексного природного заказника с морской зоной (Черенкова, 2013), который, будучи создан, мог бы выполнить задачу мониторинга и охраны столь важных для современной экосистемы Белого моря сообществ M. modiolus.
Список литературы
Ашик И.М., Карклин В.П., Кириллов С.А., Радионов В.А., Тимохов Л.А., 2014. Раздел 5. Воздействие изменения климата на морские природные системы. Глава 5.1. Арктические моря России // Второй оценочный доклад Росгидромета об изменениях климата и их последствиях на территории Российской Федерации. С. 590–614.
Бабков А.И., 1998. Гидрология Белого моря. СПб.: Беломорская биологическая станция ЗИН РАН. 98 с.
Герасимова А.В., Кузнецова Е.К., Максимович Н.В., 2008. О многолетней динамике структуры поселения Arctica islandica L. (Mollusca, Bivalvia) и особенностях пространственного распределения макробентоса в районе Керетского архипелага (Белое море) // Материалы XI научной конференции Беломорской биологической станции МГУ: Сборник статей. М.: Изд-во Гриф и Ко. С. 34–37.
Герасимова A.B., Максимович Н.В., 2009. О закономерностях организации поселений массовых видов двустворчатых моллюсков Белого моря // Вестник СПбГУ. № 3 (3). С. 82–97.
Голиков А.Н., Бабков А.И., Голиков А.А., Новиков О.К., Шереметевский А.М., 1985. Экосистемы Онежского залива и сопредельных участков Бассейна Белого моря // Экосистемы Онежского залива Белого моря. (Исслед. фауны морей. Т. 33 (41)). Л.: Зоол. И-т АН СССР. С. 20–87.
Денисенко С.Г., 2013. Биоразнообразие и биоресурсы макрозообентоса Баренцева моря. Структура и многолетние изменения. СПб.: Наука. 285 с.
Золотарев В.Н., 1989. Склерохронология морских двустворчатых моллюсков. Киев: Наукова Думка. 112 с.
Иванова С.С., 1957. Качественная и количественная характеристика бентоса Онежского залива Белого моря // Материалы по комплексному изучению Белого моря. Вып. I. М.-Л.: Изд-во АН СССР. С. 355–380.
Исаченко А.И., Цетлин А.Б., Мокиевский В.О., 2013. Структура поселения Arctica islandica в акватории губы Ругозерская (Белое море) и ее многолетняя динамика // Зоологический журнал. Т. 92. № 4. С. 143–153.
Кременецкий В.В., 2012. Океанологические наблюдения во время рейса на НИС “Профессор Владимир Кузнецов” в юго-восточную часть Онежского залива // Комплексные исследования подводных ландшафтов в Белом море с применением дистанционных методов (Тр. Беломорской биостанции МГУ, т. 11). Под ред. Мокиевского В.О., Спиридонова В.А., Цетлина А.Б., Красновой Е.Д. М.: Товарищество научных изданий КМК. С. 121–126.
Краснов Ю.В., 2011. Морские птицы: современное состояние популяций, распределение и трофические связи // Биологические ресурсы Белого моря: изучение и использование (Исслед. фауны морей. Вып. 69 (77)). Под ред. Бергера В.Я. СПб.: Зоологический институт РАН. С. 244–260.
Кудерский Л.А., 1962. Донное сообщество “Modiolus modiolus” Онежского залива Белого моря // Труды Карельского филиала АН СССР. Вып. 33. С. 67–81.
Кудерский Л.А., 1966. Донная фауна Онежского залива Белого моря // Труды Карельского отд. ГосНИОРХ. Т. 4. Вып. 2. С. 204–371.
Кудерский Л.А., 2006. Исследования на Белом море на начальном этапе истории Карельского Научного центра РАН // Северная Европа в XXI веке: природа, культура, экономика. Материалы Международной конференции, посвященной 60-летию КарНЦ РАН. Петрозаводск: Изд-во КарНЦ РАН. С. 11–16.
Луканин В.В., Наумов А.Д., Федяков В.В., 1987. Исследование бентоса Белого моря. Общая история изучения бентоса Белого моря // Гидрологические и ихтиологические исследования в Белом море. Ленинград: ЗИН АН СССР. С. 51–63.
Луканин В.В., Наумов А.Д., Федяков В.В., 1995. Особенности распределения бентоса в Онежском заливе // Белое море. Биологические ресурсы и проблемы их рационального использования. Ч. 1. Под ред. Бергера В.Я. СПб.: Зоол. Ин-т РАН. С. 227–232.
Любин П.А., 2016. Сравнительный анализ селективности методов промывки количественных проб бентоса, применявшихся в исследованиях на разрезе “Кольский меридиан” // Труды Кольского НЦ РАН. Т. 36. Серия Океанология. Вып. 3. С. 44–64.
Любина О.С., Стрелкова (Анисимова) Н.А., Любин П.А., и др., 2016. Современное количественное распределение зообентоса на разрезе “Кольский меридиан” // Труды Кольского НЦ РАН. Т. 36. Серия Океанология. Вып. 3. С. 64–91.
Максимова М.П., 1991. Гидрохимия Белого моря // Гидрометеорология и гидрохимия морей СССР. Т. 2. Белое море. Ч. 1. Л.: Гидрометеоиздат. С. 8–1 93.
Материалы обработки бентоса, 1953. НИС “Профессор Месяцев”, рейсы I и II. Онежский залив, 1952 г. // Научно-исслед. архив КарНЦ РАН. Ф. 20. Оп. 2. Ед. хр. 232.
Моисеенко Т.И., 2010. Загрязнение поверхностных вод водосбора и ключевые антропогенно обусловленные процессы // Система Белого моря. Т. 1. Природная среда водосбора Белого моря. Под ред. Лисицына А.П. М: Научный мир. С. 301–333.
Мокиевский В.О., Котельников К.А., 2017. Донные сообщества сублиторали Ругозерской губы (Кандалакшский залив, Белое море): современное состояние и изменения за 60 лет // Труды VI Международной научно-практической конференции “Морские исследования и образование (MARESEDU-2017)”, Москва, 30.10.2017-02.11.2017 г. Тверь: ООО “ПолиПРЕСС”. С. 471–476.
Наумов А.Д., 2006. Двустворчатые моллюски Белого моря. Опыт эколого-фаунистического анализа. СПб.: Зоол. институт РАН. 367 с.
Наумов А.Д., Мокиевский В.О., Исаченко А.И., Савченко О.Н., Биягов К.Л., Аристов Д.А., 2016. Сублиторальные сообщества макробентоса Бабьего моря // Комплексные исследования Бабьего моря, полуизолированной беломорской лагуны. Геология, гидрология, биота: изменения на фоне трансгрессии берегов (Труды Беломорской биостанции МГУ. Т. 12). Под ред. Мокиевского В.О., Исаченко А.И., Дгебуадзе П.Ю., Цетлина А.Б. М.: Товарищество научных изданий КМК. С. 121–143
Наумов А.Д., Савченко О.Н., Аристов Д.А., Биягов К.Л., 2017. Десятилетие наблюдений над литоральным бентосом на акватории морского специализированного порта Витино (северная часть Кандалакшского залива, Белое море): методологические подходы // Зоол. журн. Т. 96. № 12. С. 1464–1481.
Невесский Е.Н., Медведев В.С. Калиненко В.В., 1977. Белое море. Седиментогенез и история развития в голоцене. М.: Наука. 236 с.
Пантюлин А.Н., 2012. Динамика, структура и водные массы // Система Белого моря. Т. 2. Водная толща и взаимодействующие с ней атмосфера, криосфера, речной сток и биосфера. Под ред. Немировской И.А. М.: Научный мир. С. 309–379.
Рейсовые журналы, 1952. Район работ Белое море: Онежский залив. I и II рейсы НИС “Профессор Месяцев”. 1952 г. // Научно-исслед. архив КарНЦ РАН. Ф. 20. Оп. 2. Ед. хр. 117.
Рогачева А.В., 2012. Бентос восточной части Онежского залива по данным дночерпательной съемки // Комплексные исследования подводных ландшафтов в Белом море с применением дистанционных методов (Труды Беломорской биостанции МГУ, т. 11). Под ред. Мокиевского В.О., Спиридонова В.А., Цетлина А.Б., Красновой Е.Д. М.: Товарищество научных изданий КМК. С. 144–166.
Сапожников В.В., Аржанова Н.В., Мордасова Н.В., 2012. Гидрохимические особенности биопродуктивности и продукционно-деструкционные процессы в Белом море // Система Белого моря. Т. 2. Водная толща и взаимодействующие с ней атмосфера, криосфера, речной сток и биосфера. Под ред. Немировской И.А. М.: Научный мир. С. 433–473.
Солянко Е.Ю., 2010. Сравнительная характеристика фауны и сообществ сублиторального макробентоса Горла и Онежского залива Белого моря. Дис. канд. биол. наук. М.: Институт океанологии РАН. 167 с.
Спиридонов В.А., Мокиевский В.О., Солянко Е.Ю., 2012. Экспедиционные работы и некоторые результаты океанологических и гидробиологических исследований в юго-восточной части Онежского залива на НИС “Профессор Кузнецов” в июле 2006 г. // Комплексные исследования подводных ландшафтов в Белом море с применением дистанционных методов (Труды Беломорской биостанции МГУ. Т. 11). Под ред. Мокиевского В.О., Спиридонова В.А., Цетлина А.Б., Красновой Е.Д. М.: Товарищество научных изданий КМК. С. 112–120.
Стасенков В.А., 2011. Сельдь // Биологические ресурсы Белого моря: изучение и использование (Исследования фауны морей. Вып. 69 (77)). Под ред. Бергера В.Я. СПб.: Зоологический институт РАН. С. 159–163.
Усов Н.В., 2015. Сезонная и многолетняя динамика обилия зоопланктона в прибрежной зоне Кандалакшского залива Белого моря в связи с изменениями температуры вод. Автореф. дис. … канд. биол. наук. СПб.: Зоол. институт РАН. 26 с.
Черенкова Н.Н. (сост.), 2013. Эколого-экономическое обоснование организации Соловецкого комплексного природного ландшафтно-морского заказника. М.: Проект ГЭФ – ПРООН “Укрепление морских и приморских особо охраняемых территорий России”. 150 с.
Чикина М.В., 2009. Макрозообентос рыхлых грунтов Северо-Кавказского побережья Черного моря: пространственная структура и многолетняя динамика. Дис. … канд. биол. наук. М.: Институт океанологии РАН. 117 с.
Чикина М.В., Спиридонов В.А., Мардашова М.В., 2014. Изучение пространственной и временной изменчивости прибрежных донных сообществ Керетского архипелага и пролива Великая Салма (Кандалакшский залив, Белое море) // Океанология. Т. 54. № 1. С. 60–72.
Ahn I.Y., Kang Y.C., Choi J.W., 1995. The influence of industrial effluents on intertidal benthic communities in Panweol, Kyeonggi Bay (Yellow Sea) on the West Coast of Korea // Marine Pollution Bulletin. V. 30. № 3. P. 200–206.
Andrew N.L., Mapstone B.D., 1987. Sampling and the description of spatial pattern in marine ecology // Oceanography and Marine Biology. Annual Review. V. 25. P. 39–90.
Anwar N.A., Richardson C.A., Seed R., 1990. Age determination, growth rate and population structure of the horse mussel Modiolus modiolus // Journal of the Marine Biological Association of the United Kingdom. V. 70. P. 441–457.
Basova L., Begum S., Strahl J. et al., 2012. Age dependent patterns of antioxidants in Arctica islandica from six regionally separate populations with different life spans // Aquatic Biology. V. 14. P. 141–152.
Berger V.Y., Naumov A.D., 2001. General features // Berger V., Dahle S. (Eds) White Sea. Ecology and Environment. St. Petersburg and Tromsø: Derzhavets Publisher. P. 9–22.
Boyd S.E., Barry J., Nicholson M., 2006. A comparative study of a 0.1 and 0.25 m2 Hamon grab for sampling macrobenthic fauna from offshore marine gravels // Journal of Marine Biological Association of the United Kingdom. V. 86. P. 1315–1328.
Chikina M.V., Kucheruk N.V., 2005. Long-term changes in the structure of coastal benthic ommunities in the northeastern part of the Black Sea: influence of alien species // Oceanology. V. 45. Supplement. P. 176–182.
Clare D.S., Robinson L.A., Frid C.L. J., 2015. Community variability and ecological functioning: 40 years of change in the North Sea benthos // Marine Environmental Research. V. 107. P. 24–34.
Clarke K.R., Warwick R.M., 2001. Change in Marine Communities: An Approach to Statistical Analysis and Interpretation, 2nd edn. Plymouth, UK: Primer-E. 176 p.
Cusson M., Archambault P., Aitken A., 2007. Biodiversity of benthic assemblages on the Arctic continental shelf: historical data from Canada // Marine Ecology Progress Series. V. 331. P.291–304.
Dinesen G.E., Morton B., 2015. Review of the functional morphology, biology and perturbation impacts on the boreal, habitat forming horse mussel Modiolus modiolus (Bivalvia: Mytilidae: Modiolinae) // Marine Biology Research. V. 10. P. 845–870.
Eleftheriou A., Moore D.C., 2005. Macrofauna techniques // Methods for the study of marine benthos 3rd edn. (ed. A. Elefheriou and A. McIntyre). Oxford, UK: Blackwell Publishing. P. 160–228.
Filatov N.N., Nazarova L.E., Salo Ju A., Tolstikov A.V., 2005. Climate of the White Sea catchment scenarios of climate and river runoff changes // Filatov N.N., Pozdnyakov D.V., Johannessen O.M. (Eds). White Sea. Its Marine Environment and Ecosystem Dynamics Influenced by Global Change. Chichester: Springer-Praxis Publishing. P. 53–72.
Filatov N.N., Pozdnyakov D.V., Ingebeikin Yu.I., Zdorovenov R.E., Melentyev V.V., Tolstikov A.V., Pettersson L.H., 2005a. Oceanographical regime // Filatov N.N., Pozdnyakov D.V., Johannessen O.M. (Eds). White Sea. Its Marine Environment and Ecosystem Dynamics Influenced by Global Change. Chichester: Springer-Praxis Publishing. P. 73–154.
Ganmanee M., Narita T. Sekuchi H., 2004. Long-term investigation of spatio-temporal variations in faunal composition and species richness of megabenthos in Ise Bay, Central Japan // The Journal of Oceanography. V. 60. P. 1071–1083.
Gerasimova A.V., Maximovich N.V., 2013. Age–size structure of common bivalve mollusk populations in the White Sea: the causes of instability // Hydrobiologia. V. 706. P. 119–137.
Gray J.S., Elliott M., 2009. Ecology of marine sediments: from science to management. Second ed. Oxford: Oxford University Press. 255 p.
Grebmeier J.M., Barry J.P., 1991. The influence of oceanographic processes on pelagic-benthic coupling in polar regions: A benthic perspective // Journal of Marine Systems. V. 2. P. 495–518.
Hammer Ø., Harper D.A.T., Ryan P.D. 2001. PAST: Paleontological statistics software package for education and data analysis. Palaeontologia Electronica 4(1): 9 pp. http://palaeo-electronica.org/2001_1/past/issue1_01.htm
Hughes D.J., Shimmiled T.M., Black K.D., Howe J.A., 2015. Ecological impacts of large-scale disposal of mining waste in the deep sea // Scientific Reports. V. 5. P. 9985.
Kaiser M.J., Edwards D.B., Armstrong P.J., Radford K., Lough N.E.L., Flatt R.P., Jones H.D., 1998. Changes in megafaunal benthic communities in different habitats after trawling disturbance // The ICES Journal of Marine Science. V. 55. P. 353–361.
Kautsky N., 1982. Growth and size structure in a Baltic Mytilus edulis population // Marine Biology. V. 68. P. 117–133
Kenchington E.L., Kenchington T.J., Henry A.-A., Fuller S., Gonzales P., 2007. Multi-decadal changes in the megabenthos of the Bay of Fundy: The effects of fishing // The Journal of Sea Research. V. 58. P. 220–240.
Kröncke I., Reiss H., Egleton J.D. et al., 2011. Changes in North Sea macrofauna communities and species distribution between 1986 and 2000 // Estuarine, Coastal, Shelf Science. V. 94. P. 1–15.
Lesser M.P., Kruse V.A., 2004. Seasonal temperature compensation in the horse mussel, Modiolus modiolus: metabolic enzymes, oxidative stress and heat shock proteins // Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. V. 137. P. 495–504.
Mann H.B., Whitney D.R., 1947. On a Test of Whether One of Two Random Variables Is Stochastically Larger than the Other // Annals of Mathematical Statistics. V. 18. P. 50–60.
McConnaughey R.A., Mier C.L., Dew C.B., 2000. An examination of chronic trawling effects on soft-bottom benthos of the eastern Bering Sea // ICES Journal of Marine Science. V. 57. P. 1377–1388.
Mendes C.L.T., Tavares M., Soares-Gomes A., 2007. Taxonomic sufficiency for soft-bottom sublittoral mollusks assemblages in a tropical estuary, Guanabara Bay, Southeast Brazil // Marine Pollution Bulletin. V. 54. P. 377–384.
Naumov A.D., 2001. Benthos // Berger V., Dahle S. (Eds). White Sea. Ecology and Environment. St. Petersburg and Tromsø: Derzhavets Publisher. P. 41–53.
Naumov A.D., 2013. Long-term fluctuations of soft-bottom intertidal community structure affected by ice cover at two small sea bights in the Chupa Inlet (Kandalaksha Bay) of the White Sea. // Hydrobiologia. V. 706. P. 159–173.
Olsgard F., Brattegard T., Holthe T., 2003. Polychaetes as surrogates for marine biodiversity: lower taxonomic resolution and indicator groups // Biodiversity Conserv. V. 12. P. 1033–1049.
Olsgard F., Somerfield P.J. 2000. Surrogates in benthic investigations. Which taxonomic unit to target? // J Aquat Ecosystem Stress Recovery. V. 7. P. 25–42.
Oug E., Sundet J.H., Cochrane S.C.J., 2018. Structural and functional changes of soft-bottom ecosystems in northern fjords invaded by the red king crab (Paralithodes camtschaticus) // Journal of Marine Systems. V. 180. P. 255–264.
Pearson T.H., Rosenberg R., 1978. Macrobenthic succession in relation to organic enrichment and pollution of the marine environment // Oceanography and Marine Biology: An Annual Review. V. 16. P. 229–311.
Pogrebov V.B., 1993. Assessment of the ecological state of the West Arctic shelf by benthos // Proceedings of the Workshop on Arctic Contamination Arctic Research of the United States V. 8. Anchorage, Alaska: Interagency Arctic Research Policy Committee. P. 290–294.
Revkov N.K., Petrov A.N., Kolesnikova E.A., Dobrotina G.A., 2014. Comparative analysis of long-term alterations in structural organization of zoobenthos under permanent and antropogenic impact (Case study: Sevastopol Bay, Crimea) // Morskoi ecologichnii zhurnal. V. 8. № 3. P. 38–49.
Rosenberg R., Gray J.S., Josefson A.B., Pearson T.H., 1987. Petersen benthic stations revisited. 2. Is the Oslofjord and eastern Skagerrak ecnriched? // The Journal of Experimental Marine Biology and Ecology. V. 105. P. 219–251.
Solovyev B., Spiridonov V., Onufrenya I. et al., 2017. Identifying a network of priority areas for conservation in the Arctic seas: Practical lessons from Russia // Aquatic Conservation. Marine and Freshwater Ecosystems. V. 27. Supplement 1. P. 30–51.
Solyanko K., Spiridonov V., Naumov A., 2011. Biomass, commonly occurring and dominant species of macrobenthos in Onega Bay (White Sea, Russia): data from three different decades // Marine Ecology. V. 32. P. 36–48.
Spiridonov V.A., Naumov A.D., Chikina M.V., Simakova U.V., 2015. Resilience capacity in the White Sea ecosystem // Abstracts of the 50th European marine biological symposium. Helgoland, 21-25 September 2015. Helgoland, Germany: Alfred Wegener Institute for Polar and Marine Research. P. 27.
Swane I., Ompi M., 1993. Patch dynamics in beds of the blue mussel Mytilus edulis L.: Effects of site, patch size, and position within a patch // Ophelia. V. 37. P. 187–202.
Terzhevik A.Y., Litvinenko A.V., Druzhinin P.V., Filatov N.N., 2005. Economy of the White Sea watershed // Filatov N.N., Pozdnyakov D.V., Johannessen O.M. (Eds). White Sea. Its Marine Environment and Ecosystem Dynamics Influenced by Global Change. Chichester: Springer-Praxis Publishing. P. 241–301.
Underwood A.J., Chapman M.G., 2005. Design and analysis in benthic surveys // Methods for the study of marine benthos 3rd edn. (ed. A. Elefheriou and A. McIntyre), Oxford, UK: Blackwell Publishing. P. 1–42.
Usov N., Kutcheva I., Primakov I., Martynova D., 2013. Every species is good in its season: Do the shifts in the annual temperature dynamics affect the phenology of the zooplankton species in the White Sea? // Hydrobiologia. V. 706 (1). P. 11–33.
Włodarska-Kowalczuk M., Kędra M., 2007. Surrogacy in natural patterns of benthic distribution and diversity: selected taxa versus lower taxonomic resolution // Marine Ecology Progress Series. V. 351. P. 53–63.
WoRMS, 2018. World Register of Marine Species. Astarte J. Sowerby, 1816. Ciliatocardium Kafanov, 1974 http:// www.marinespecies.org Accessed 08.05.2018
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал