Зоологический журнал, 2020, T. 99, № 7, стр. 784-800
Роль абиотических факторов в вертикальном распределении макрозообентоса северо-восточного побережья Черного моря
Г. А. Колючкина a, *, В. Л. Семин a, **, К. С. Григоренко b, ***, А. Б. Басин a, ****, И. В. Любимов a, *****
a Институт океанологии им. П.П. Ширшова РАН
117997 Москва, Россия
b Южный научный центр РАН
344006 Ростов-на-Дону, Россия
* E-mail: galka.sio@gmail.com
** E-mail: svinovod@yandex.ru
*** E-mail: klim_grig@mail.ru
**** E-mail: ioran@mail.ru
***** E-mail: sapvanes@gmail.com
Поступила в редакцию 05.11.2019
После доработки 14.01.2020
Принята к публикации 09.03.2020
Аннотация
В настоящем исследовании сделана попытка оценить вклад абиотических факторов в вертикальное распределение макрозообентоса на северо-восточном шельфе Черного моря. Для этого в 2014–2017 гг. на четырех разрезах от п-ова Абрау до пос. Шепси были собраны дночерпательные пробы макрозообентоса на глубинах 10–70 м, а также проведена оценка гранулометрического состава грунта и придонной температуры воды. Было выделено две крупныe группы станций по структуре (обилию) и составу макрозообентоса: мелководная (10–30 м), совпадавшая с зоной с переменными температурными условиями, и глубоководная (50–70 м), соответствовавшая зоне с постоянными температурными условиями. В мелководной зоне выделялись две подгруппы, совпадавшие с верхним перемешанным слоем (10–15 м) и термоклином (20–30 м). Для первой подгруппы были характерны песчаные осадки, населенные сообществом двустворчатого моллюска–фильтратора Chamelea gallina; заиленные пески станций второй подгруппы были заняты полидоминантным сообществом Veneridae spp. В глубоководной зоне на илистых грунтах доминировали пелофильные моллюски Parvicardium simile и Modiolula phaseolina. Ведущими факторами в разделении групп станций были соотношение илистых и песчаных фракций донных осадков и придонная температура. Разделение подгрупп было обусловлено содержанием алевритовых фракций и гальки. Существенный вклад в разделение подгрупп станций вносил также коэффициент сортированности донных осадков (в основном за счет Bivalvia), отражающий стабильность гидродинамических условий и скорости поступления осадочного материала. Доли объясненной вариации для глубины практически полностью перекрывались с таковыми для других факторов. Основная роль в определении границ между группами принадлежит двум таксонам, вносящим основной вклад в биомассу (Bivalvia) и численность, а также в видовое разнообразие (Polychaeta).
Донные биоценозы шельфовой зоны Черного моря находятся под воздействием сложного комплекса абиотических, биотических и антропогенных факторов. В начале–середине ХХ века были проведены подробнейшие исследования структуры донных экосистем и анализ закономерностей их пространственного распределения (Зернов, 1913; Никитин, 1962; Киселева, 1981). Было показано, что макрозообентосные сообщества располагаются концентрическими поясами на протяжении всей береговой линии (Зернов, 1913). Ниже зоны скал, на глубинах 10–30 м располагался пояс прибрежных песков с преимущественным доминированием Chamelea gallina, глубже (на глубинах 30–50 м) – пояс мидиевого ила с доминированием Mytilus galloprovincialis, сменяющийся на глубинах около 60 м, где температура не поднимается выше 9°С, поясом фазеолинового ила с доминированием Modiolula phaseolina.
До 1980-х гг. схема распределения грунтов и макрозообентоса оставалась в целом неизменной, поскольку экосистема была сравнительно стабильной. Однако в 1980–2000 гг. в результате локальных изменений климата, антропогенной эвтрофикации и появления дальних вселенцев снизилось видовое разнообразие макрозообентоса, произошли изменения в структуре сообществ и вертикальном распределении грунтов (Zaitsev, Oztürk, 2001; Кучерук и др., 2002; Чикина, 2009). Основной тенденцией стало заиление грунтов и увеличение содержания в них органического углерода (Заика и др., 1990; Чикина, 2009; Терентьев, 2011). Вместе с этим наблюдалось и изменение населяющего его макрозообентоса: снижение роли псаммофильных видов и увеличение пелофильных, в том числе дальних вселенцев (Anadara kagoshimensis, Bivalvia) (Алексеев, Синегуб, 1992). На Кавказском побережье снижение прозрачности воды привело к сдвигу нижней границы макрофитов на меньшие глубины и обнажению щеток скальных мидий, что спровоцировало здесь всплеск численности хищного брюхоногого моллюска-вселенца Rapana venosa. После истощения пищевого ресурса на скальных грунтах рапана перешла на двустворчатых моллюсков рыхлых грунтов (Кучерук и др., 2002). В северо-западной части моря в конце 20 века, а на северо-восточном побережье в 2003–2007 гг. отмечались всплеск численности этого хищника и снижение средних размеров, численности и биомассы двустворчатых моллюсков (Кучерук и др., 2002; 2012). Таким образом, в конце 20–начале 21 века в результате комплексного воздействия абиотических и биотических факторов снизилось видовое разнообразие и изменились количественные характеристики сообществ рыхлых грунтов.
В начале 21 века в северо-западном секторе Черного моря в результате снижения антропогенного загрязнения и пресса R. venosa произошло частичное восстановление видового разнообразия и структуры вертикального распределения макрозообентоса на шельфе (Dumitrache, Abaza, 2004; Shalovenkov, 2005; Abaza et al., 2010). Однако в районе Северного Кавказа в 2000-х гг. вертикальная структура макрозообентоса рыхлых грунтов 10–30 м значительно отличалась от таковой середины 20 века: ядро сообщества Ch. gallina в начале 2000-х гг. оказалось смещено с 25 м (Киселева, 1981) на 10–15 м (Чикина. 2009), а на глубине 20–30 м доминирующую роль играли пелофилы (A. kagoshimensis, Pitar rudis и Gouldia minima). Большие глубины по данным 2001–2007 гг. не подверглись значительным преобразованиям (Кучерук и др., 2012). Проведенная в 2013 г. съемка участка побережья южнее пос. Джубга частично показала справедливость этого наблюдения (Селифонова, Часовников, 2017). Так, на глубинах 10–24 м, так же как и в середине 20 в., авторы отмечали сообщество Ch. gallina с основным субдоминантом P. rudis, а на глубинах более 50 м – типичный фазеолиновый ил. Однако ни на одной из станций не было найдено сообщества мидиевого ила, отмечаемого в 20 в. как одного из основных поясов бентали (Зернов, 1913; Киселева, 1981). Не отмечалось пояса мидии в южной части побережья и в 2007–2008 гг. (Набоженко, 2011). Однако подробного анализа закономерностей количественного распределения макрозообентоса и анализа факторов, определяющих современное распределение сообществ, в этих работах не проводилось. Поэтому в настоящем исследовании сделана попытка оценить вклад абиотических факторов в современное вертикальное распределение макрозообентоса на северо-восточном шельфе Черного моря. В ходе предварительных исследований было выявлено сохранение поясного разделения сообществ и уровня заиления грунтов начала 21 в. (Колючкина и др., 2017; Колючкина и др., 2017a).
МАТЕРИАЛЫ И МЕТОДИКА
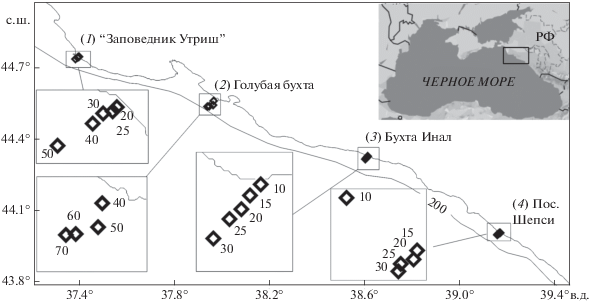
Сбор материала проводили на четырех разрезах у кавказского побережья Черного моря: (1) в районе Водопадной щели “Заповедник Утриш” (июль 2016 г.); (2) на траверзе Голубой бухты (март 2017 г.); (3) в районе бухты Инал (июль 2014, 2015, 2016 и 2017 гг.); (4) в районе пос. Шепси (июль 2014 г.) (рис. 1). Проведенное исследование охватило несколько районов побережья, максимально удаленных друг от друга на 160 км. Разрезы расположены в разных по структуре рельефа дна районах. Утриш – участок рыхлого грунта в месте впадения маловодного ручья в Водопадной щели между оползневым телом и скальными выходами м. Большой Утриш, Шепси – также бессточный участок берега (кроме точки 10 м напротив р. Шепси), а Инал и Голубая бухта – районы устьев рек.
На каждой станции проводили отбор проб макрозообентоса дночерпателем Океан с площадью раскрытия 0.1 м2 в трех повторностях. Исключение составили станции инальского разреза 2017 г. (горизонты 10, 40 и 50 м – одна повторность; горизонты 20 и 70 м – две повторности) и горизонт 40 м на траверзе Голубой бухты (дночерпатель Петерсена, три повторности). Из четвертого дночерпателя пластиковым пробоотборником отбирали верхние 5 см донных осадков для определения гранулометрического состава. В районе “Заповедника Утриш” в 2016 г., а также в бухте Инал в 2017 г. на каждой станции было выполнено CTD–профилирование океанографическим зондом CTD–60m (ЮНЦ РАН). В 2014 г. в районе бухты Инал и пос. Шепси температуру придонной воды определяли с использованием водолазного компьютера (табл. 1).
Таблица 1.
Значения абиотических факторов на станциях
| Район | Год | Глубина, м | Температура придонная, °С | Галька (>10 мм), % |
Песок (0.1–2 мм), % |
Ил | |
|---|---|---|---|---|---|---|---|
| алеврит (0.01–0.1 мм), % | пелит (<0.1 мм), % | ||||||
| Инал | 2014 | 10 | 24.4* | 0 | 62.45 | 23.1 | 9.4 |
| 15 | – | 0.32 | 64.3 | 21.37 | 14.01 | ||
| 20 | – | 9.8 | 25.63 | 14.38 | 50.19 | ||
| 25 | 20* | 1.78 | 22.97 | 13.96 | 61.29 | ||
| 30 | – | 0.73 | 28.67 | 15.74 | 54.86 | ||
| Инал | 2015 | 10 | – | 0 | 52.79 | 38.5 | 8.71 |
| 15 | – | 0.47 | 69.94 | 24.52 | 5.07 | ||
| 20 | – | 6.57 | 57.59 | 20.01 | 15.83 | ||
| 25 | – | 11.06 | 71.16 | 17.78 | 0 | ||
| 30 | – | 6.34 | 23.08 | 33.1 | 37.48 | ||
| Инал | 2016 | 10 | – | 0.06 | 63.21 | 25.05 | 11.68 |
| 15 | – | 0.54 | 82.14 | 8.41 | 8.91 | ||
| 20 | – | 13.86 | 60.1 | 14.93 | 11.11 | ||
| 25 | – | 26.1 | 45.79 | 13.42 | 14.69 | ||
| 30 | – | 2.04 | 49.11 | 15.88 | 32.97 | ||
| Инал | 2017 | 10 | 21.9 | 0.05 | 54.98 | 31.64 | 13.33 |
| 15 | 21.6 | 11.02 | 67.99 | 15.1 | 5.89 | ||
| 20 | 20.4 | 21.79 | 59.06 | 11.28 | 7.87 | ||
| 25 | 11.2 | 14.55 | 65.0 | 12.82 | 7.63 | ||
| 30 | 10.7 | 16.03 | 50.75 | 11.38 | 21.84 | ||
| 40 | 9.1 | 0.29 | 3.07 | 38.8 | 57.84 | ||
| 50 | 8.1 | 7.24 | 3.54 | 2.95 | 86.27 | ||
| 70 | 7.4 | 7.51 | 4.89 | 10.64 | 76.96 | ||
| Шепси | 2014 | 10 | – | 0.74 | 60.68 | 19.59 | 18.99 |
| 15 | – | 0 | 56.15 | 21.71 | 22.14 | ||
| 20 | – | 13.34 | 55.67 | 12.65 | 18.34 | ||
| 25 | 26.5* | 3.93 | 44.68 | 27.61 | 23.78 | ||
| 30 | – | 11.08 | 40.9 | 22.38 | 25.64 | ||
| Утриш | 2016 | 20 | 20.7 | 0.25 | 68.0 | 24.7 | 7.05 |
| 25 | 12.8 | 0.05 | 66.86 | 19.24 | 13.85 | ||
| 30 | 12.9 | 0.2 | 85.56 | 8.64 | 5.6 | ||
| 40 | 11.4 | 0.45 | 65.81 | 20.06 | 13.68 | ||
| 50 | 10.1 | 0.08 | 0.78 | 16.35 | 82.79 | ||
| Голубая бухта | 2017 | 50 | – | 0.23 | 0.64 | 21.24 | 77.89 |
| 60 | – | 0.47 | 0.65 | 23.29 | 75.59 | ||
| 70 | – | 2.47 | 4.37 | 21.64 | 71.52 | ||
Пробы макрозообентоса промывали на палубе через сито (ячея со стороной 0.5 мм) и фиксировали 4% раствором формальдегида на морской воде. В лабораторных условиях проводили первичный разбор, идентификацию организмов бентоса по возможности до вида, подсчет и взвешивание особей каждого вида (с точностью до 0.001 г). При идентификации использованы определители фауны Черного (Киселева, 2004 – полихеты; Grintsov, Sezgin, 2011 – амфиподы; Мордухай-Болтовской, 1968–1972 – для остальных групп) и Средиземного (Bellan-Santini еt al., 1982, 1989, 1993, 1998 – ракообразные) морей. При определении полихет использована также литература по отдельным видам и группам (Mackie, 1996; Bick et al., 2010; Dagli, Çinar, 2011; Meiβner et al., 2011; Radashevsky, Selifonova, 2013) и чек-листы для Черного и Средиземного морей (Kurt Sahin, Çinar, 2012; Çinar et al., 2014). Проверка валидности видовых названий (на декабрь 2019 г.) осуществлялась согласно международной базе данных WoRMS.
Основную статистическую обработку данных проводили в программе Primer v. 6.1.16 с расширением Permanova 1.0.6. Оценку видового разнообразия макробентоса проводили, используя кумулятивную кривую накопления числа видов с увеличением числа проб. Кроме того, проводили расчет ожидаемого полного числа видов с поправкой Chao2 на встречаемость редких видов (Chao, 1987). Для анализа видового богатства и разнообразия использовали индексы биоразнообразия Шеннона (H'), видового богатства Маргалефа (d), выравненности распределения обилий видов Пиелу (J') и концентрации доминирования Симпсона (С) (Clarke, Warwick, 2001).
Был проведен попробный анализ данных по численности и биомассе макрозообентоса, предварительно стандартизованным и log-трансформированным. Сравнение структуры сообществ проводили с использованием неметрического многомерного шкалирования (MDS) на основе индекса сходства Брея-Кертиса, вычисленного как по численности, так и по биомассе, а также индекса таксономической обособленности (taxonomic distinctness) Theta+ (Warwick, Clarke, 1998). Последний является аналогом “качественной” формы индекса Кульчинского, однако учитывает таксономические взаимоотношения между видами (Clarke et al., 2006). Благодаря этому он является более точным инструментом для определения сходства/различия между станциями. Кроме того, он является более устойчивым к разнородным данным, в которых “появление” или “исчезновение” тех или иных видов в действительности может являться результатом различной квалификации специалистов (Clarke et al., 2006). Проверку качества модели в MDS осуществляли с помощью величины стресса и графика Шепарда. Модель считали удовлетворительной, если значение стресса в трехмерной модели было менее 0.1. Для наглядности и удобства восприятия уровней сходства диаграммы приведены в 2D представлении. Достоверность группировки проверяли методом ANOSIM. Уровень значимости принимали равным 0.1%.
Непараметрический регрессионный анализ проводили методом DistLM постанционно, так как значения факторов измерялись для станции. Для этого с помощью ANOSIM проверяли, достоверно ли сходство между пробами с одной станции превышает межстанционное сходство, и рассчитывали среднее арифметическое биомассы и численности каждого вида в трех пробах; полученные величины стандартизовали и log–трансформировали. DistLM позволяет определить, какая доля объясненной вариации перекрывается для нескольких факторов, а какие доли вариации объяснены индивидуальными предикторами (Clarke, Gorley, 2006), что важно при анализе такой тесно взаимосвязанной системы, как донный биотоп и населяющие его сообщества. Для этого после определения доли вариации, которая может быть объяснена каждым фактором без учета других факторов (маргинальный тест), процедура включает последовательные тесты, состоящие в последовательном добавлении факторов и определении прироста доли объясненной вариации для всех возможных сочетаний. В качестве меры сходства использовали индекс Брея-Кертиса по численности и биомассе и индекс Theta+. Т.к. данные по придонной температуре были доступны не для всех станций, для учета влияния температуры был проведен отдельный анализ то тем станциям, для которых такие данные имелись (табл. 1).
Непараметрический анализ корреляций проводили в программе Statistica 12 (Statsoft Inc.). Корреляцию считали достоверной при p < 0.05. Достоверность различий между массивами данных проводили методом непараметрической статистики Permutational ANOVA (PERMANOVA) в пакете Primer. Различия считали достоверными при p < 0.05.
Анализ гранулометрического состава грунта был выполнен сотрудниками Аналитической лаборатории ИО РАН водно-ситовым методом. Было определено содержание основных фракций: от <0.01 до >10 мм. Сортированность характеризовали мерой относительной энтропии, рассчитываемой как Hr = 1 – Hi/Hmax, где Hi – энтропия образца по Шеннону, Hmax – максимальная энтропия (Романовский, 1977).
РЕЗУЛЬТАТЫ
Абиотические факторы
Донные осадки глубин 10–15 м были представлены песками вне зависимости от района исследования, содержание илистых фракций грунта (<0.1 мм) не превышало здесь 47% (табл. 1). На глубинах 20–30 м в Инале и Шепси были отмечены заиленные пески, здесь содержание илистой фракции достигало 75%. На 40 м изобате в бух. Инал были отмечены илы (табл. 1). В районе “Заповедника Утриш” пески опускались до 40 м – значительно глубже, чем в других районах. Диапазон глубин 50–70 м характеризовался илистыми донными осадками (содержание фракций <0.1 мм достигало 99%) вне зависимости от района исследований (табл. 1).
Из двенадцати гранулометрических фракций, использованных в анализе, только содержание четырех оказывало значимое влияние на структуру макробентоса. Это частицы менее 0.01 мм (пелит), 0.25–0.1 и 0.1–0.05 мм (мелкий песок – грубый алеврит) и более 10 мм (средняя и крупная галька, представленная ракушей). Исключение остальных фракций из анализа не приводило к заметным изменениям в структуре результатов и уменьшало суммарную долю объясненной вариации не более чем на 1%.
Температура на глубинах 10–20 м в исследованный летний период была выше 20°С во всех исследованных районах (табл. 1). Между 20 и 25 м температура резко падала до 11–13°С (зона термоклина). Температуры глубин 50–70 м составляли 8–10°С.
Интегральные характеристики макрозообентоса
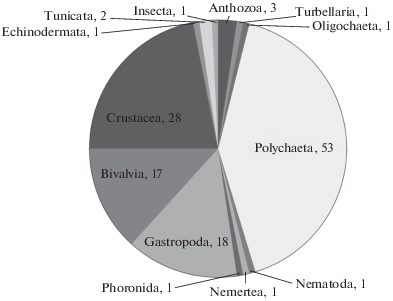
Было отмечено 129 форм макрозообентоса (из них 111 видового ранга). Кривая накопления видов не выходила на плато, поэтому было рассчитано ожидаемое число видов (Chao2), которое составило 149 ± 10 видов (среднее ± стандартное отклонение) Большинство (90%) из обнаруженных и идентифицированных видов принадлежало к трем основным группам: Polychaeta, Mollusca и Crustacea (главным образом Amphipoda – 11%) (рис. 2).
Рис. 2.
Соотношение числа видов макрозообентоса по таксономическим группам; цифрами обозначено число видов в каждой группе.
Число видов, отмеченных на станциях, составляло от 12 до 53 (табл. S1 ) и в целом не зависело от глубины и района работ. Наибольшее число видов было отмечено на глубине 40 м в районе “Заповедника Утриш”. В бухте Инал с 2014 по 2017 гг. число видов на глубинах 10–30 м снижалось (рис. 3a, табл. S2 ).
Рис. 3.
Зависимость интегральных параметров макрозообентоса на разных глубинах в бухте Инал от времени; a – число видов, b – численность, c – индекс Маргалефа, d – индекс Пиелу.
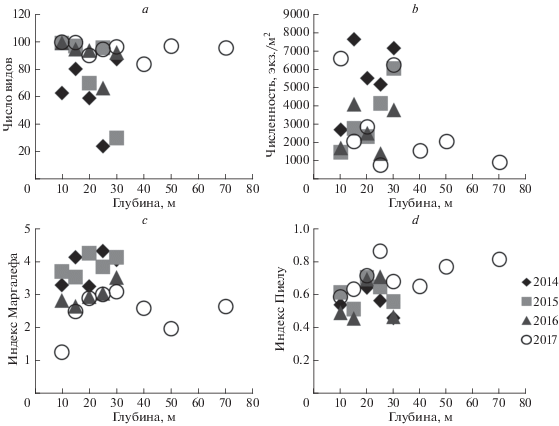
Численность макрозообентоса составляла от 777 до 9190 экз/м2. Наибольшие значения были отмечены на глубине 40 м в районе “Заповедника Утриш” в 2014 г. (табл. S1 ). В целом, численность макрозообентоса не зависела от района, глубины и года исследования (рис. 3b, табл. S2 ). Исключение составили достоверно более низкие значения этого параметра в 2016 г. по сравнению с 2014 г. (рис. 3b, табл. S2 ). Наибольший вклад в численность вносили полихеты, составляя 2–20% численности на станциях на глубинах 10–15 м и достигая 50–87% на станциях глубин 30–70 м. Доля полихет в сообществах достоверно возрастала с глубиной (R = 0.8), а абсолютная численность этой группы достигала максимума также на глубине 40 м и снижалась как с уменьшением, так и с увеличением глубины.
Биомасса макрозообентоса составляла от 3.6 до 181 г/м2 (табл. S1 ). Наибольшее ее значение было отмечено на глубине 10 м и не превышало 5 г на глубинах 50–70 м. Однако достоверной зависимости биомассы от глубины станции выявлено не было. Биомасса также не зависела от района и года исследования (табл. S2 ). Основную долю биомассы (24–99%) на всех исследованных глубинах составляли двустворчатые моллюски. Их доля в сообществах и абсолютные значения их биомассы не зависели от глубины.
Индексы Маргалефа, Пиелу, Симпсона и Шеннона составляли 1.65–5.70, 0.27–0.87, 0.10–0.64 и 0.98–2.63 соответственно (табл. S1 ). Видовое богатство (индекс Маргалефа) не зависело от глубины и района исследования. Распределение видов по обилию (индекс Пиелу) было более равномерным на глубинах 20–25 м по сравнению с 10–15 м во всех исследованных районах. А концентрация доминирования (индекс Симпсона) зависела только от глубины и была достоверно выше на глубинах 10–15 и 50–70 м по сравнению с 20–25 м. Биоразнообразие макрозообентоса (индекс Шеннона) было достоверно выше на глубинах 15–25 м по сравнению с 10 м во всех исследованных районах. На повторных станциях в бухте Инал было выявлено незначительное снижение видового богатства (рис. 3c, табл. S2 ) и возрастание выравненности распределений обилий видов со временем (рис. 3d, табл. S2 ). При этом биоразнообразие достоверно не менялось (табл. S2 ).
Структура макрозообентоса
Основная роль в определении границ между выделенными сообществами принадлежала двум таксонам, вносившим основной вклад в биомассу (Bivalvia) и, в меньшей степени, в численность и видовое разнообразие (Polychaeta). Это объясняется принадлежностью всех доминантов и большинства субдоминантов к Bivalvia, в связи с чем они были распределены наиболее закономерно, в то время как среди прочих групп была велика доля случайных видов. В таксоцене Polychaeta были представлены все трофические и экологические группировки, а высокое видовое разнообразие было обеспечено в значительной мере случайными и второстепенными видами. Кроме того, была велика доля пластичных видов, встречавшихся на большинстве станций в исследованном диапазоне глубин. Таким образом, помимо массовых видов и части второстепенных, которые были четко приурочены к определенным условиям и распределение которых носило закономерный характер, значительная часть таксоцена Polychaeta вносила “шум” в анализируемые данные.
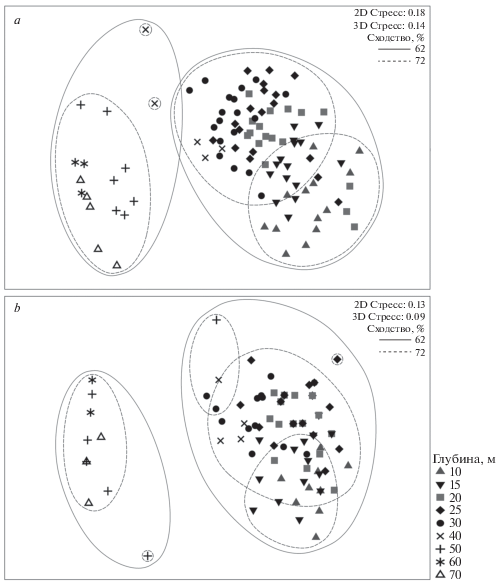
Анализ структуры сообществ позволил выявить группировки, связанные достоверно только с глубиной, но не с районом или годом исследования. Исследованные сообщества по фаунистической структуре достоверно разделялись на две большие группы с внутренним сходством 62% (мера сходства Theta+), соответствующие глубинам 10–30 и 50–70 м (рис. 4). Пробы с горизонта 40 м заняли переходное положение: большая их часть оказалась ближе к мелководной группе, но две (Инал-2017) – к группе 50–70 м. При этом 39% видов встречались в обоих диапазонах глубин. На переходном горизонте 40 м, помимо видов, общих для обоих диапазонов, встречались виды, приуроченные как к 10–30 м, так и к 50–70 м. На глубинах 10–40 м наибольшая встречаемость (свыше 90% от числа всех проб) была у двустворчатых моллюсков Chamelea gallina, Lucinella divaricata и Spisula subtruncata. Наиболее устойчивым, как в пространстве, так и во времени, элементом в этой группе были псаммофилы-фильтраторы Ch. gallina, средняя биомасса которых превышала на порядок таковую остальных видов. На чистых песках эти же виды Bivalvia преобладали и по численности. При наличии хотя бы небольшого количества илистых фракций (<0.1 мм) доминантами по численности становились пелофильные полихеты Aricidea claudiae, а по биомассе – пелофильные фильтраторы Pitar rudis и Gouldia minima.
Рис. 4.
Ординация обследованных станций с помощью MDS; мера сходства: индекс Theta+; a – весь макрозообентос, b – Bivalvia.
В диапазоне глубин 50–70 м встречаемостью около 100% характеризовались пелофильные полихеты (A. claudiae, Eunereis longissima, H. filiformis, Terebellides aff. stroemi) и двустворчатые моллюски (Parvicardium simile). Полихеты доминировали по численности, а P. simile – по биомассе; как и в мелководной группе, биомасса доминирующих моллюсков была в среднем на порядок выше, чем у остальных видов.
Различия между группами 10–30 и 50–70 м были обусловлены в первую очередь доминирующей по биомассе группой – Bivalvia (рис. 4b). На глубинах 10–30 м по обилию доминировали двустворчатые моллюски семейства Veneridae (Ch. gallina, P. rudis, G. minima), а на 50–70 м – двустворчатые моллюски семейства Cardiidae (P. simile) и Mytilidae (Modiolula phaseolina). Различия в видовом составе остальных групп были обусловлены в основном случайными и второстепенными видами. Это подтверждается тестами ANOSIM, показавшими большую разницу между группами при анализе отдельно Bivalvia (R = 0.973–0.974 при всех мерах сходства) и меньшую – при анализе всего массива данных по численности (R = = 0.839, мера сходства индекс Брея-Кертиса).
Внутри мелководной группы по структуре бентоса выделялись две подгруппы, соответствующие глубинам 10–15 и 20–30 м с внутренним сходством от 41 (по биомассе) до 51% (по численности) (рис. 5). Исключение составил Утришский разрез, где станции 20 и 25 м попали в первую подгруппу. В первой подгруппе доминировали псаммофильные виды (сообщество Ch. gallina). Во второй подгруппе более высокой встречаемостью и численностью отличались пелофильные полихеты (A. claudiae, Heteromastus filiformis, Prionospio cf. multibranchiata и пр.) и двустворчатые моллюски (Pitar rudis и Gouldia minima). Степень доминирования Ch. gallina в этой подгруппе была существенно ниже: было характерно содоминирование Ch. gallina–G. minima–P. rudis. Хищный брюхоногий моллюск Rapana venosa был встречен на 17% от числа всех станций и только в диапазоне 15–30 м. Его численность не превышала 10 экз./м2.
Рис. 5.
Ординация обследованных станций с помощью MDS; мера сходства: индекс Брея-Кёртиса по стандартизованным и лог-трансформированным: a – численности, b – биомассе.
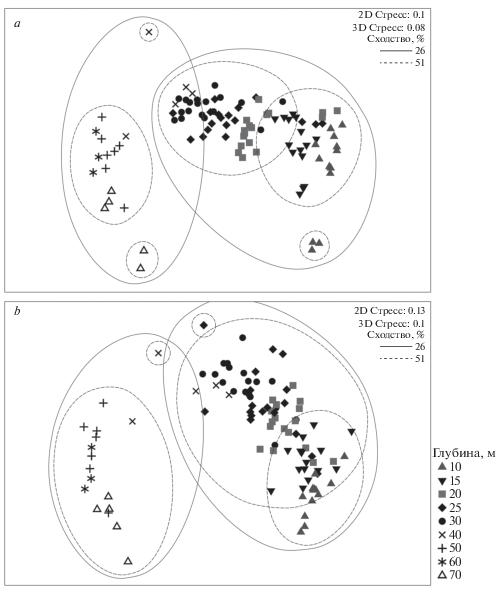
Разделение станций мелководной группы на подгруппы достигалось за счет различий в структуре доминирования в большей мере, чем видового состава (ср. рис. 4a и 5). Различия между подгруппами были выше при анализе численности и биомассы (ANOSIM R = 0.568, 0.539, соответственно; мера сходства индекс Брея-Кертиса), чем при анализе видового состава (ANOSIM R = = 0.372, мера сходства Theta+). При этом число общих видов было выше, чем у глубоководной и мелководной групп: из 118 видов, отмеченных в диапазоне 10–30 м, общих видов в двух подгруппах было 56%.
Таким образом, различия между глубоководной и мелководной группами были обусловлены в большей мере изменением видового состава макрозообентоса в доминирующей группе, а различия двух подгрупп мелководной группы – разницей в структуре доминирования.
Связь структуры макрозообентоса с абиотическими факторами
По результатам DistLM-анализа, как и в случае MDS, четко выделялись две большие группы станций, соответствующие тем же глубинам (10–30 и 50–70 м); глубина 40 м также занимала переходное положение. Основные результирующие параметры DistLM-анализа представлены в табл. S3 и на рис. 6 и 7.
Рис. 6.
Анализ влияния абиотических факторов на структуру макробентоса методом DistLM; мера сходства – индекс Брея–Кертиса по численности; обозначения: Глуб. – глубина, Сорт. – сортированность грунта; цифрами обозначены фракции грунта в мм; пунктиром отделены подгруппы станций 10–15 и 20–30 м; a – весь макрозообентос, b – Bivalvia.
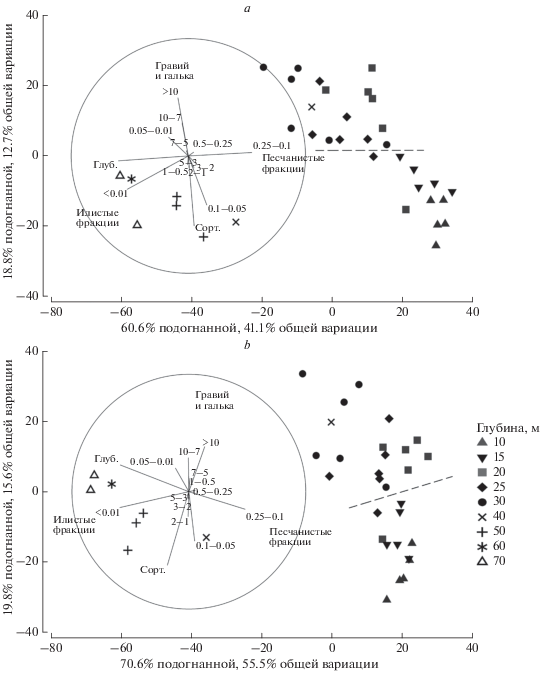
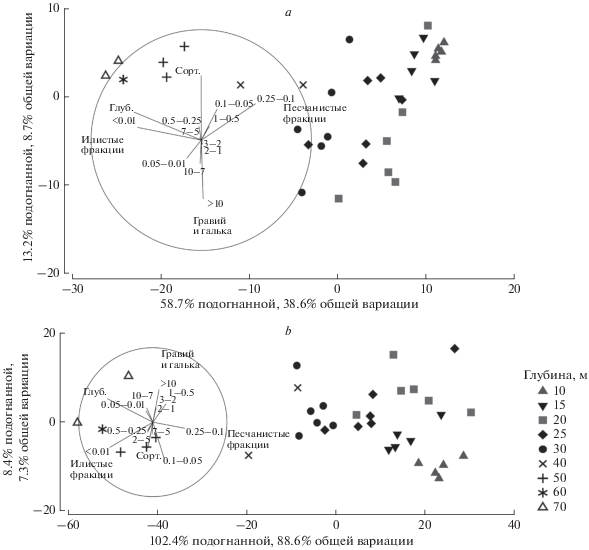
Рис. 7.
Анализ влияния абиотических факторов на структуру макробентоса методом DistLM; мера сходства – индекс таксономической обособленности Theta+; обозначения как на рис. 6; a – весь макрозообентос, b – Bivalvia.
Анализ всего массива данных по трем факторам (гранулометрический состав и сортированность грунта, глубина). Анализ DistLM показал, что суммарная доля объясненной вариации составляла 63–68% для всего массива данных и 77–87% для Bivalvia. Наибольшую связь со структурой макробентоса имел гранулометрический состав грунта (около 50% объясненной вариации). Наибольшую роль он играл для группы Bivalvia (53–56% объясненной вариации). Кроме того, для двустворчатых моллюсков высокое значение имела сортированность грунта (до 23–25% объясненной вариации). Для макрозообентоса в целом значение этого фактора было значительно меньшим (11–12% объясненной вариации), за исключением анализа по биомассе (24.8%, обусловлено тем, что основная часть биомассы приходилась на Bivalvia). Вариация, объясненная глубиной, перекрывалась с таковой для остальных факторов практически полностью (остаток в последовательных тестах 3–9%); доля объясненной этим фактором вариации была высокой лишь в маргинальных тестах.
Анализ станций, для которых доступны данные по температуре (гранулометрический состав и сортированность грунта, глубина, температура). Суммарная доля вариации, объясненной четырьмя факторами, составила 83–88% для всего массива данных и 88–93% для Bivalvia. В этом случае наибольшую связь со структурой макробентоса также имел гранулометрический состав грунта – доля объясненной им вариации составляла порядка 42–51% для всего макробентоса, однако для двустворчатых моллюсков она была в среднем на 10% меньше, чем для всего бентоса. Роль фактора сортированности грунта для Bivalvia была, как и при анализе по трем факторам, выше, чем для макрозообентоса в целом (24–26 против 14–19% объясненной вариации, соответственно). Наименьший вклад в вариацию макрозообентоса в целом давал фактор температуры (14–16% объясненной вариации). У Bivalvia же доля объясненной этим фактором вариации составляла 19–22% при анализе численности и биомассы и достигала 32% при анализе фаунистической структуры данных. Вариация, объясненная глубиной, как и в первом случае, практически полностью перекрывалась с другими факторами (остаток в последовательных тестах 2–7%).
Дополнительные материалы (таблицы S1–S3 ) доступны по ссылке: www.sevin.ru/seminars/zoojournal.
ОБСУЖДЕНИЕ
Особенности структуры современных фаунистических комплексов макрозообентоса
Настоящее исследование является частью мониторинговых работ Института океанологии на северо-восточном побережье Черного моря. Единая схема станций и методы отбора проб позволяют сравнивать результаты последних лет с данными по структуре макрозообентоса и гранулометрическому составу грунтов глубин 10–30 м начала 2000-х гг. (Чикина, 2009).
Выявленное число видов достаточно полно характеризовало макрозообентос исследуемого участка, т.к. ожидаемое число видов превышало реальное всего на 13%. Интересно отметить, что в 2001 г. число видов на глубинах 10–30 м на побережье было ниже – всего 81 (Чикина, 2009) по сравнению со 106 видами в 2014–2017 гг. Возможно, это связано не только с различиями в районах отбора, но и с повышением видового разнообразия макрозообентоса на этих глубинах в современный период. Об этом свидетельствует двукратное увеличение видового богатства (индекса Маргалефа) и биоразнообразия (индекс Шеннона) в 2014–2017 гг. При этом в среднем численность стала в 1.5–2 раза ниже, а биомасса – в 5–10 раз ниже, чем в 2001 г. и в два раза ниже, чем в конце 1980-х гг. (Киселева, 1992). Биомассы примерно соответствовали значениям 1920–1930-х гг. (Никитин, 1962) и 1950–1960-х гг. (Киселева, 1981).
В середине 20 в. на глубинах 10–30 м основным биоценозом был пояс “венусового песка” с содержанием пелита в грунте не более 3% (Киселева, 1981; 1992). Характерными видами здесь выступали Pitar rudis и Gouldia minima. При повышении заиления грунта (до 27% пелита) эти виды становились доминирующими, но даже в этом случае состав видов сохранялся (Киселева, 1981; 1992). Напротив, в 2001–2005 гг. сообщества глубин 10–15 м (слабо заиленные пески) по своей структуре достоверно отличались от сообществ заиленных грунтов (содержание пелита до 38%) на глубинах 20–30 м (Чикина, 2009). На станциях 10–15 м доминировал псаммофил Chamelea gallina. На глубинах 20–30 м ведущую роль играли пелофилы и хищный брюхоногий моллюск Rapana venosa. В 2001–2003 гг. здесь доминировала Anadara kagoshimensis, в 2004–2004 гг. – R. venosa, а в 2005 г. (Чикина, 2009), в 2012 г. (Chikina et al., 2014) – P. rudis и G. minima, в 2013 г. – Ch. gallina и P. rudis (Селифонова, Часовников, 2017). В современный период состав доминирующих видов и характер грунта (содержание пелита до 61%) были сходны с таковыми в 2005 и 2012–2013 гг. Однако в настоящее время увеличилась роль второстепенных видов (Lucinella divaricata, Spisula. subtruncata, P. rudis, G. minima, Aricida claudiae) и снизилась роль Ch. gallina, A. kagoshimensis и R. venosa, отличавшихся абсолютным доминированием в сообществах 2001–2005 гг. В результате выравненность обилий видов возросла (на 10–15 м – на порядок по сравнению с 2001–2002 гг.: Чикина, 2009). Увеличение обилия второстепенных видов двустворчатых моллюсков объясняется, скорее всего, снижением пресса Mnemiopsis leidyi на их личинки в результате стабилизации его численности хищным ктенофорофагом Beroe ovata (Арашкевич и др., 2015). А снижение роли A. kagoshimensis, по всей видимости, связано с выеданием этого моллюска рапаной в конце 2000-х гг. (Чикина, 2009) и снижением конкурентоспособности ее личинок в результате параллельного увеличения обилия других видов Bivalvia.
Проведенный анализ показал, что различия сообществ на 10–15 и 20–30 м были обусловлены, так же как и в 20 в., главным образом разницей в количественной структуре, а не сменой видового состава. По всей видимости, на глубинах 10–30 м как в 20 в., так и в 2014–2017 гг. присутствовал единый пул доминирующих видов. Более половины видов, включая доминантов и субдоминантов, были отмечены в обоих диапазонах. При этом, хотя это число заметно больше, чем число общих видов у групп 10–30 и 50–70 м, различия в видовом составе также были существенными: 17% видов были отмечены только в диапазоне 10–15 м, 25% – только в диапазоне 20–30 м. Тем не менее, при анализе только таксономической структуры (Theta+) подгруппы практически перемешивались. Это, по всей видимости, объясняется тем, что в диапазоне 10–30 м абиотические условия были неоднородными: переменные температурные условия, разнообразие состава грунтов, в то время как для диапазона 50–70 м были характеры постоянная придонная температура и однородные грунты. Соответственно и состав второстепенных и случайных видов варьировал в группе 10–30 м значительно сильнее.
Различия между станциями 10–30 и 50–70 м были в первую очередь фаунистическими и были обусловлены сменой доминантов, субдоминантов и характерных видов, что следовало как из прямого сравнении видовых списков, так и из статистического анализа качественной структуры этих выделов.
Сообщества и грунты глубин 50–70 м в середине 20 в. (Киселева, 1981, 1992), в 2013 г. (Селифонова, Часовников, 2017) и в современный период были сходными. Здесь в оба периода преобладали фазеолиновые пелитовые илы (89–99% от всех фракций) с доминированием двустворчатых моллюсков Modiolula phaseolina, Parvicardium simile, Abra alba (по биомассе) и полихет Aricidea claudiae, Heteromastus filiformis, Terebellides aff. stroemi (по численности).
На глубине около 40 м проходила граница фаунистических комплексов. Эта зона, по всей видимости, является переходной, т.к. здесь наблюдались различия в составе макрозообентоса и грунтов в разных районах побережья не только в современный период, но и в исследованиях 20 в. (Киселева, 1981; 1992). К сожалению, съемка 2013 г. не затронула этот горизонт (Селифонова, Часовников, 2017). Так, в 20 в. основным биоценозом на этой глубине был мидиевый ил с содержанием пелитовой фракции 31–36% и биомассой мидии до 680 г/м2. Однако кроме мидиевого ила здесь отмечали и биоценоз P. simile на илистых грунтах с примесью ракуши и G. minima на песчано-илистых грунтах (Киселева, 1981). Мы предполагаем, что в основе такой высокой мозаичности грунтов и структуры макрозообентоса глубины 40 м может лежать неоднородность гидродинамического режима этой пограничной зоны, связанная с варьированием сезонного термоклина в зависимости от района и года.
Связь структуры макрозообентоса с абиотическими факторами
Среди абиотических факторов, влияющих на распределение макрозообентоса на рыхлых грунтах, наибольшее значение имеют характер грунта, глубина, температура и гидродинамика (Барковская, 1961; Peres, 1982; Rosenberg, 1995). Поскольку в настоящем исследовании глубины не превышали 70 м, то влиянием фактора глубины как таковой на структуру бентоса, по всей видимости, можно пренебречь. Анализ данных показал, что в данном случае глубина выступала как интегральный показатель характера грунта и температуры (положения относительно термоклина). Гидродинамический же режим не только напрямую воздействует на донные организмы, но и организует грунты, определяя, наряду с источником осадочного материала, их гранулометрический состав и степень сортированности (Барковская, 1961).
В настоящем исследовании группы станций, выделенные с помощью регрессионного анализа (DistLM) и методом ординации (MDS), соответствовали зонам как с разным гранулометрическим составом грунта, так и с отличающимися гидрологическими параметрами. Диапазон 10–30 м, где были отмечены песчаные и илисто-песчаные грунты, соответствовал зоне с переменными температурными условиями (Зацепин и др., 2007; Кныш и др., 2011). Станции подгруппы 10–15 м, где доминировали псаммофилы, были расположены в зоне верхнего перемешанного слоя, где высока интенсивность гидродинамики (Заика и др., 1990), и отличались грунтами с высоким содержанием крупных фракций – песка и гальки. Именно в этой зоне, вблизи берега происходит осаждение наиболее тяжелых фракций осадочного материала, поступающих с суши (Барковская, 1961).
Зона 20–30 м, по всей видимости, являющаяся зоной контакта сезонного термоклина с дном, отличается меньшей интенсивностью гидродинамики по сравнению с верхним перемешанным слоем. Здесь характер грунтов был переходный от песков к илам. Причем уровень заиления здесь, по всей видимости, определяется как уровнем антропогенной эвтрофикации, изменяющей содержание илистых фракций во времени, что приводит к увеличению площадей сообществ пелофилов, обитающих на заиленных песках (настоящее исследование, Терентьев, 2011 – по сравнению с 20 в.: Киселева, 1981, 1992), так и характером берегового стока, рельефом и уклоном шельфа (Барковская, 1961). По всей видимости, именно большим уклоном дна и чрезвычайно низким уровнем стока объясняется присутствие песков на Утрише на бóльших глубинах по сравнению с остальными разрезами, что, в свою очередь, объясняет сходство сообществ 20–25 м разреза Утриш и 10–15 м других районов (рис. 8).
Рис. 8.
Схема распределения групп станций в исследованном районе. На Утришском разрезе биоценозы глубин 20–25 м по структуре и составу макрозообентоса и структуре донных осадков также попадают на схеме в подгруппу 10–15 м.
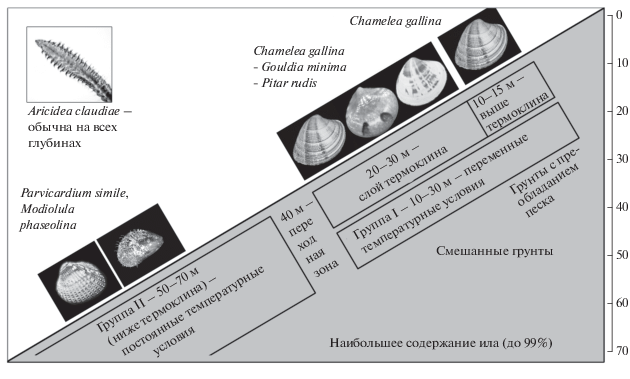
Диапазон 50–70 м, где были отмечены только илистые грунты, а доминанты были представлены пелофильными моллюсками и полихетами, соответствовал зоне с постоянными температурными условиями, располагающейся ниже сезонного термоклина (Зацепин и др., 2007). Для этих глубин характерны чрезвычайно низкая интенсивность гидродинамики и постоянство температурного режима, а также удаленность от источника поступления осадочного материала, поэтому здесь грунты имели наиболее тонкую структуру (Заика и др., 1990; Бондарев, 2014).
На границе мелководной и глубоководной зон происходила смена 62% видового состава макрозообентоса, причем наиболее значимые изменения наблюдались в составе доминантов сообществ (Bivalvia) (рис. 7b). Определяющими факторами здесь были соотношение илистых и песчаных фракций (рис. 6 и 7) и температура. Граница же между комплексами 10–15 м и 20–30 м определялась содержанием алеврита и гальки, а также коэффициентом сортированности грунта (рис. 6).
По нашему мнению, среди изученных факторов наибольшее непосредственное влияние на структуру донных сообществ оказывал характер грунтов (гранулометрический состав и сортированность донных осадков). Причем уровень сортированности и содержание крупных фракций оказывали противоположное влияние (рис. 6). Сортированность, по нашим данным, имела наибольшее значение для двустворчатых моллюсков по сравнению с другими группами. Это связано, по-видимому, с тем, что данный параметр определяется придонной гидродинамикой, оказывающей решающее влияние на условия питания сестонофагов (Butman et al., 1994), представленных преимущественно Bivalvia.
Значимую связь со структурой макрозообентоса по нашим данным показали только четыре из двенадцати гранулометрических фракций (рис. 6, 7). Пелит (<0.01 мм) был доминирующей фракцией и определял облик грунтов на глубинах 50–70 м, грубый алеврит (0.1–0.05 мм) и мелкий песок (0.25–0.1) – на 10–30 м. Однако среди них наибольшую корреляцию со структурой сообществ показала фракция >10 мм, содержание которой в грунтах на всех глубинах было столь же невысоко, как и “незначимых фракций”. В наших материалах эта фракция была представлена, главным образом, крупной ракушей, играющей важную роль в качестве субстрата и убежища для многих организмов (прикрепленных, перфораторов и т.п.). Незначительное присутствие ракуши в пробе (даже нескольких раковин), слабо отражаясь на процентном соотношении фракций, может оказать существенное влияние на видовой состав макрозообентоса, что и объясняет сильную, несмотря на малое процентное содержание, связь этой фракции со структурой макрозообентоса.
Температура имела на исследованных станциях как прямое, так и косвенное влияние на распределении макрозообентоса. С одной стороны, температура является маркером различных водных масс; на их границах происходит смена гидрологического режима, приводящая к смене условий осадконакопления. Горизонт с постоянными температурными условиями, помимо стабильно низкой (7–9°С) температуры, характеризуется также более высокой соленостью и низким содержанием кислорода (Зенкевич, 1956; Бондарев, 2014). В настоящем исследовании регрессионный анализ показал, что часть объясненной температурой вариации перекрывалась с таковой для состава грунтов и глубины. Остаток объясненной вариации, составлявший 14–16% для всего макрозообентоса и 19–32% для Bivalvia, относится, по-видимому, к прямому воздействию температуры на организмы зообентоса. Следует отметить, что многие виды, характерные для зоны под термоклином, способны существовать и при более высоких температурах и единично отмечаются на меньших глубинах. Однако за пределами оптимальной зоны они, по-видимому, конкурентно исключаются более приспособленными теплолюбивыми видами и вследствие этого не достигают значительных количественных показателей.
ЗАКЛЮЧЕНИЕ
В современный период на северо-восточном побережье Черного моря в районе узкого шельфа количественные характеристики макрозообентоса и показатели разнообразия, по всей видимости, возвращаются к значениям 20 в. до начала эвтрофикации этого водоема. Однако состав грунтов и в меньшей степени структура сообществ имеют высокую степень сходства с состоянием начала 2000-х гг., что выражается в повышенном содержании пелитовой фракции в грунтах глубин 20–30 м по сравнению с 20 в. и доминировании здесь пелофильных видов.
В ходе настоящего исследования были выделены три фаунистических группировки глубин 10–15, 20–30 и 50–70 м. Основная роль в определении границ между группами принадлежала двум таксонам, вносившим основной вклад в биомассу (Bivalvia) и численность, а также видовое разнообразие (Polychaeta). Различия между комплексами станций 10–15 и 20–30 м были обусловлены, так же как и в 20 в., разницей в количественной структуре сообществ, а не сменой видового состава. И на глубинах 10–30 м как в 20 в., так и в 2014–2017 гг. присутствовал и остается единый пул доминирующих видов. Напротив, различия между комплексами 10–30 (40) и 50–70 м были обусловлены в первую очередь сменой видового состава в доминирующей группе Bivalvia: на глубинах 50–70 м доминируют более холодолюбивые североатлантические виды (например, Modiolula phaseolina (Паули, 1927)) и регулярно встречаются виды, практически не встречаемые на вышележащих горизонтах, что может быть связано также с более высокой соленостью – к примеру, Amphiura stepanovi, Amphitritides gracilis,Terebellides aff. stroemi, Aonides spp., Eunereis longissima. Смена видового состава по нашим данным обусловлена разницей в свойствах донных осадков (преобладание пелитовой фракции и высокая степень сортированности) и разницей параметров гидрологического режима: температуры и, вероятно, связанными с ней параметрами (соленостью, содержанием кислорода).
Список литературы
Алексеев Р.П., Синегуб И.А., 1992. Макрозообентос и донные биоценозы Черного моря на шельфах Кавказа, Крыма и Болгарии // Экология прибрежной зоны Черного моря. М.: ВНИРО. С.218–234.
Арашкевич Е.Г., Луппова Н.Е., Никишина А.Б., Паутова Л.А., Часовников В.К. и др., 2015. Судовой экологический мониторинг в шельфовой зоне Черного моря: оценка современного состояния пелагической экосистемы // Океанология. Т. 55. № 6. С. 964–964.
Барковская М.Г., 1961. Закономерности распределения донных осадков на шельфе советских берегов Черного моря // Труды Института Океанологии. АН СССР. Т. 53. С. 123–152.
Бондарев И.П., 2014. Биологические основы фациального структурирования шельфа Черного моря // Геология и полезные ископаемые мирового океана. № 4. С. 72–89.
Заика В.Е., Валовая Н.А., Повчун А.С., Ревков Н.К., 1990. Митилиды Черного моря. АН УССР. Ин-т Биологии Южных Морей им. А.О. Ковалевкого. Киев: Наукова думка. 208 с.
Зацепин А.Г., Голенко Н.Н., Корж А.О., Кременецкий В.В., Пака В.Т. и др., 2007. Влияние динамики течений на гидрофизическую структуру вод и вертикальный обмен в деятельном слое Черного моря // Океанология. Т. 47. № 3. С. 327–339.
Зенкевич Л.А., 1956. Моря СССР их фауна и флора. М.: Государственное учебно-педагогическое издательство Министерства Просвещения РСФСР. 424 с.
Зернов С.А., 1913. К вопросу об изучении жизни Черного моря // Записки Императорской Академии Наук. Т. 32. № 1. 99 с.
Киселева М.И., 1981. Бентос рыхлых грунтов Черного моря. Киев: Наукова думка. 168 с.
Киселева М.И., 1992. Сравнительная характеристика донных сообществ у побережья Кавказа // Многолетние изменения зообентоса Черного моря. Отв. ред. Заика В.Е. Киев: Наукова думка. С. 84–98.
Киселева М.И., 2004. Многощетинковые черви (Polychaeta) Черного и Азовского морей. Апатиты: Кольский научный Центр. 409 с.
Кныш В.В., Коротаев Г.К., Моисеенко В.А., Кубряков А.И., Белокопытов В.Н., Инюшина, Н.В., 2011. Сезонная и межгодовая изменчивость гидрофизических полей Черного моря, восстановленных на основе реанализа за период 1971–1993 гг. // Известия Российской академии наук. Физика атмосферы и океана. Т. 47. № 3. С. 433–446.
Колючкина Г.А., Семин В.Л., Григоренко К.С., Басин А.Б., Любимов И.В., 2017. Роль абиотических факторов в вертикальном распределении макрозообентоса северо-восточного побережья Черного моря // Труды VI Международной научно-практической конференции “Морские исследования и образование (MARESEDU-2017): [сборник]. Тверь: ООО “ПолиПРЕСС”. С. 414–418.
Колючкина Г.А., Чикина М.В., Басин А.Б., Прохорова Т.Д., Любимов И.В., 2017a. Таксоцен Bivalvia северо-восточного побережья Черного моря: результаты 16-летнего мониторинга // Труды VI Международной научно-практической конференции “Морские исследования и образование (MARESEDU-2017): [сборник]. Тверь: ООО "ПолиПРЕСС” С. 410–413.
Кучерук Н.В., Флинт М.В., Максимова О.В., Чикина М.В., Симакова У.В., 2012. Современная динамика бентосных сообществ северо-восточного шельфа Черного моря // Отв. ред. Котляков В.М., Люри Д.И. Изменение природной среды России в XX веке. М.: Молнет. С. 274–288.
Кучерук Н.В., Басин А.Б., Котов А.В., Чикина М.В., 2002. Макрозообентос рыхлых грунтов северокавказского побережья Черного моря: многолетняя динамика сообществ // Комплексные исследования северо-восточной части Черного моря. Ред. Зацепин А.Г., Флинт М.В. М.: Наука. С. 289–298.
Мордухай-Болтовской Ф.Д., 1968–1972. Определитель фауны Черного и Азовского морей. Киев: Наукова думка. Т. 1–3. 1312 с.
Набоженко М.В., 2011. Современное распределение двустворчатых моллюсков (Mollusca: Bivalvia) северо-восточной части Черного моря // Наука Юга России. Т. 7. № 3. С. 79–86.
Никитин В.В., 1962. Количественное распределение донной макрофауны в Черном море у берегов Кавказа // Доклады АН СССР. Т. 143. № 4. С. 968–971.
Паули В.Л., 1927. К биологии и анатомии Modiolae phaseolinae Philippi // Научные записки по биологии. С. 157–164.
Романовский С.И., 1977. Седиментологические основы литологии. Л.: Недра. 408 с.
Селифонова Ж.П., Часовников В.К., 2017. Экологическое состояние зообентоса прикавказской зоны Черного моря (район Джубга – Хоста) // Системы контроля окружающей среды. Севастополь: ИПТС. Т. 10. № 30. С. 109–118.
Терентьев А.С., 2011. Сообщество Двустворчатого Моллюска Pitar rudis, образовавшееся в результате разрушения донных биоценозов Керченского предпроливья Черного моря // Труды Южного научно-исследовательского института рыбного хозяйства и океанографии. Т. 49. С. 108–122.
Чикина М.В., 2009. Макрозообентос рыхлых грунтов Северо-Кавказского побережья Черного моря: пространственная структура и многолетняя динамика. Дис. … канд. биол. наук. М.: ИО РАН. 117 с.
Abaza V., Dumitrache C., Dumitrescu E., 2010.Structure and distribution of the main molluscs from the Romanian marine areas designated for their growth and exploitation // Recherches Marines-Cercetări Marine. V. 39. P. 137–152.
Bellan–Santini D., Diviacco G., Krapp-Schickel G., Ruffo S., 1989. The Amphipoda of the Mediterranean. Part 2. Gammaridea (Haustoriidae to Lysianassidae) // Mémoires de l’Institut océanographique. Monaco. 13. Ed. Ruffo S. Institut Océanographique: Monaco. Multiprint Monaco. 576 p.
Bellan–Santini D., Karaman G., Krapp-Schickel G., Ledoyer M., Myers A. et al., 1982. The Amphipoda of the Mediterranean. Part 1: Gammaridae (Acanthonotozomatidae to Gammaridae). // Memories de l’Institut Oceanographique. № 13. Ed. Ruffo S. Institut Océanographique. Monaco: Multiprint Monaco. 364 p.
Bellan–Santini D., Karaman G., Krapp-Schickel G., Ledoyer M., Ruffo S., 1993. The Amphipoda of the Mediterranean. Part 3: Gammaridea (Melphidippidae to Talitridae), Ingolfiellidea, Caprellidea // Mémoires de l’Institut océanographique. Monaco. 13. Ed. Ruffo S. Institut Océanographique. Monaco: Multiprint Monaco. 1993. 813 p.
Bellan–Santini D., Karaman G., Ledoyer M., Myers A., Ruffo S., Vader W., 1998. The Amphipoda of the Mediterranean. Part 4: Localities and Map, Addenda to Parts 1–3, Key to Families, Ecology, Faunistics and Zoogeography, Bibliography, Index // Mémoires de l’Institut océanographique, Monaco, 13. Ed. Ruffo S. Institut Océanographique. Monaco: Multiprint Monaco. 959 p.
Bick A., Otte K., Meißner K., 2010. A contribution to the taxonomy of Spio (Spionidae, Polychaeta, Annelida) occurring in the North and Baltic Seas, with a key to species recorded in this area // Marine Biodiversity. V. 40. P. 161–180.
Butman C.A., Frèchette M., Geuer W., Rockwell M., Starzak V., 1994. Flume experiments on food supply to the blue mussel Mytilus edulus L. as a function of boundary layer flow // Limnology and Oceanography. V. 39. № 7. P. 1755–1768.
Chao A., 1987. Estimating the population size for capture-recapture data with unequal catchability // Biometrics. V. 43. № 4. P.78–791.
Chikina M.V., Kolyuchkina G.A., Prohorova T.D., 2014. The Role of the Invasive Bivalve Anadara kagoshimensis in Contemporary State of the Northeastern Black Sea Coastal Biocenosis // Abstracts Volume from 49th European Marine Biology Symposium. September 8−12. 2014. St. Petersburg. Russia. P. 66–67.
Çinar M.E., Dagli E., Kurt Sahin G., 2014. Checklist of Annelida from the coasts of Turkey // Turkish Journal of Zoology. V. 38. P. 734–764.
Clarke K.R., Gorley R.N., 2006. PRIMER v6: User Manual/Tutorial. PRIMER–E. Plymouth. 192 p.
Clarke K.R., Somerfield P.J., Chapman M.G., 2006. On resemblance measures for ecological studies, including taxonomic dissimilarities and a zero-adjusted Bray-Curtis coefficient for denuded assemblages // Journal of Experimental Marine Biology and Ecology. V. 330. № 1. P. 55–80.
Clarke K.R., Warwick R.M., 2001. Change in marine communities: an approach to statistical analysis and interpretation, 2nd edition. PRIMER–E. Plymouth. 172 p.
Dagli E., Çinar M.E., 2011. Species of the subgenus Minuspio (Polychaeta: Spionidae: Prionospio) from the southern coast of Turkey (Levantine Sea, eastern Mediterranean), with the description of two new species // Zootaxa. V. 3043. P. 35–53.
Dumitrache C., Abaza V., 2004. The present state of benthic communities in the Romanian coastal waters // Recherches Marines. INCDM. Constanta. V. 35. P. 61–75.
Grintsov V., Sezgin M., 2011. Manual for identification of Amphipoda from the Black Sea. Digit print. 151 p.
Kurt Sahin G., Çinar M.E., 2012. A check-list of polychaete species (Annelida: Polychaeta) from the Black Sea. Journal of Black Sea // Mediterranean Environment. V. 18. № 1. P. 10–48.
Mackie A.S.Y., 1996. Taxonomy and phylogeny of spioniform polychaetes (Annelida). Gøteborg University PhD thesis. 32 p.
Meißner K., Bick A., Bastrop R., 2011. On the identity of Spio filicornis (O.F. Müller, 1776) – with the designation of a neotype, and the description of two new species from the North East Atlantic Ocean based on morphological and genetic studies // Zootaxa. V. 2815. P. 1–27.
Peres J.M., 1982. Major benthic assemblages, in Marine Ecology, Vol. V, Ocean Management, Part 1. O. Kinne ed. Wiley. Chichester. Sussex. U.K. 642 p.
Radashevsky V.I., Selifonova Z.P., 2013. Records of Polydora cornuta and Streblospio gynobranchiata (Annelida, Spionidae) from the Black Sea // Mediterranean Marine Science. V. 14. № 2. P. 261–269.
Rosenberg R., 1995. Benthic marine fauna structured by hydrodynamic processes and food availability // Netherlands Journal of Sea Research. V. 34. № 4. P. 303–317.
Shalovenkov N., 2005.Restoration of some parameters in the development of benthos after reduction of anthropogenous loading in the ecosystem of the Sevastopol Bay in the Black Sea // Mitigation and Adaptation Strategies for Global Change. V. 10. № 1. P. 105–113.
Warwick R.M., Clarke K.R., 1998. Taxonomic distinctness and environmental assessment // Journal of Applied ecology. V. 35. № 4. P. 532–543.
Zaitsev Yu., Ozturk B., 2001. Exotic species in the Aegean, Marmara, Black, Azov and Caspian seas. Published by Turkish Marine Research foundation. Istanbul. Turkey. 267 p.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал