Зоологический журнал, 2021, T. 100, № 10, стр. 1165-1174
Влияние энтомопатогенных грибов Beauveria bassiana и Metarhizium robertsii на физиологические и поведенческие показатели красной полевки (Myodes rutilus, Rodentia, Cricetidae) в стрессовых условиях
Е. А. Новиков a, b, *, П. А. Задубровский a, Е. Ю. Кондратюк a, В. Ю. Крюков a, Е. В. Новикова a, В. В. Глупов a
a Институт систематики и экологии животных СО РАН
630091 Новосибирск, Россия
b Новосибирский государственный аграрный университет
630036 Новосибирск, Россия
* E-mail: eug_nov@ngs.ru
Поступила в редакцию 24.07.2020
После доработки 20.12.2020
Принята к публикации 28.12.2020
Аннотация
Проведен эксперимент по выявлению последствий добавления в зерновой корм конидий двух видов энтомопатогенных аскомицетов – Beauveria bassiana и Metarhizium robertsii. Особи красной полевки (Myodes rfutilus), в течение 15 дней получавшие в пище конидии M. robertsii, имели более высокий уровень триглицеридов, глюкозы и пероксидазы в крови, отличались от остальных животных по паттернам социального поведения, проявляли достоверно меньшую эмоциональность в тесте открытого поля, чем контрольные животные и демонстрировали тренд к пониженной выживаемости в неволе. Эти данные свидетельствуют об ощутимом воздействии энтомопатогенных грибов на метаболизм, поведение и продолжительность жизни млекопитающих.
Использование химических инсектицидов создает серьезную угрозу для здоровья нынешнего и будущих поколений (Colborn, 1995), что диктует острую необходимость более широкого применения биологических методов борьбы с вредителями сельского и лесного хозяйства. При этом необходимо ответственно подходить к оценке биологической безопасности всех без исключения препаратов, в том числе и созданных на основе микроорганизмов. Применение биоинсектицидов – грибов и бактерий – имеет давнюю историю, однако до последнего времени они были менее востребованы, чем химические препараты – из-за относительно высокой стоимости, сложности производства и быстрой инактивации в наземно-воздушной среде (Bruner-Mendoza et al., 2018). Так, наиболее широко используемые в мире в качестве продуцентов грибных препаратов грибы родов Beauveria и Metarhizium поражают насекомых многих отрядов. На основе данных грибов в мире зарегистрировано более 120 продуктов для регуляции численности насекомых (De Faria, Wraight, 2007). Кроме того, препараты на основе B. bassiana sensu lato и M. anisopliae sensu lato регламентированы Минсельхозом России в государственном каталоге пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации для регуляции популяций проволочников и саранчовых (Государственный каталог…, 2020). В 2000-х годах установлена способность грибов Beauveria и Metarhizium вступать во взаимодействия с ризосферой растений, а также существовать в их тканях качестве эндофитов (Vega, 2018). Последнее позволяет существенно расширить сферу их применения и использовать не только в качестве инсектицидов, но и стимуляторов роста и иммунитета растений, а также антагонистов фитопатогенов (Moonjely et al., 2016; Bamisile et al., 2018). Подобные технологии в настоящее время развиваются и в России, в частности для обработки картофеля (Tomilova et al., 2020). Следует отметить, что для борьбы с фитофагами используются препараты, содержащие споры грибов высокой концентрации: 107–108 конидий/мл при обработке посадочного материала и почвы, 1012–1014 конидий/га при обработке растений (Jaronski, 2010). При этом естественный фон данных грибов существенно ниже, например в почве он составляет лишь 102–104 КОЕ/г (Scheepmaker, Butt, 2010; Clifton et al., 2015), а на поверхности надземных органов растений и внутри них эти грибы встречаются, видимо, лишь спорадически. Следовательно, применяемые технологии обработки создают риск взаимодействия нецелевых организмов с повышенными концентрациями энтомопатогенных грибов, например при поедании животными посадочного материала, корней или зеленой массы растений, а также зараженных насекомых.
Результаты исследований, посвященных оценке экологической безопасности энтомопатогенных грибов родов Beauveria и Metarhizium, свидетельствуют об относительной безвредности этих биоинсектицидов для здоровья человека и окружающей среды. Среди вырабатываемых ими метаболитов есть токсичные соединения – боверицин, деструксины и др., с широким кругом патогенных воздействий на беспозвоночных (Strasser et al., 2000; Vey et al., 2001). Однако негативные эффекты воздействия этих токсинов на позвоночных при проведении инсектицидных обработок не обнаружены. Летальные дозы, установленные для позвоночных животных, значительно превышают те, с которыми эти животные могут сталкиваться на обработанных площадях и в окружающих водных и наземных биоценозах. Случаи развития у человека патологий (аллергия, воспаление роговицы), вызываемых спорами грибов родов Beauveria и Metarhizium, единичны (Zimmermann, 2007, 2007a; Brunner-Mendoza et al., 2018). С целью изучения побочных эффектов, возникающих при использовании таких препаратов, проводили, преимущественно, лабораторные эксперименты по принудительному введению в организм подопытных животных грибных конидий или высоких доз экстрактов вырабатываемых грибами токсинов (Ignoffo, 1973; Strasser et al., 2000; Zimmermann, 2007, 2007a; Mancebo et al., 2009). Ни тот, ни другой метод не дает возможность в полной мере оценить последствия для позвоночных животных, которые могут возникнуть в результате потребления растительной пищи с пропагулами энтомопатогенных грибов. Работы по оценке хронического воздействия энтомопатогенных грибов на позвоночных при алиментарном пути попадания в организм практически отсутствуют. Очень мало известно о путях метаболизма и биохимическом действии грибных токсинов в организме позвоночных (García-Herranz et al., 2019). Тем не менее, вполне очевидно, что действие токсического агента, способного накапливаться в экосистеме (почве, тканях растения), может оказаться достаточно продолжительным и, не вызывая признаков острого патогенеза, может привести к снижению жизнеспособности животного. В подавляющем большинстве случаев объектами экспериментальных токсикологических исследований, направленных на оценку хронических эффектов пестицидов, являются лабораторные животные, которых содержат и которые размножаются в комфортных и относительно стабильных условиях. Вместе с тем устойчивость организма диких животных к действию токсичных веществ, как правило, снижается на фоне активации защитных систем организма в ответ на стрессовые воздействия, которым животные неизбежно подвергаются в природе (Безель и др., 1994; Calow, 1989; VanStraalen, 2003).
Основной целью нашей работы стало выявление последствий алиментарного поступления энтомопатогенных грибов в организм у позвоночных животных как потенциального нецелевого объекта обработок. Молодым особям красной полевки (Myodes rutilus), которые были отловлены в природе и которых в течение всего эксперимента содержали в условиях, близких к естественным, в течение двух недель в качестве основной пищи предлагали зерна овса, обработанные конидиями энтомопатогенных грибов – B. bassiana либо M. robertsii. Животные были отловлены в горной тайге Северо-Восточного Алтая, на территории, где обрабатываемые посевы зерновых практически отсутствуют. Это исключало вероятность предшествующего контакта животных с тестируемыми грибами в высоких дозах.
Патологическое действие токсических агентов на позвоночных животных оценивается, как правило, по активации детоксицирующих систем, а также по показателям, характеризующим общее состояние организма: гомеостаз внутренней среды, интенсивность обмена веществ, состояние иммунной системы, поведение (Безель и др., 1994; Vos, Moore, 1977; Tête et al., 2015; Baas, Kooijman, 2015). Эти параметры и были рассмотрены в предлагаемой работе.
МАТЕРИАЛЫ И МЕТОДЫ
Молодых особей красной полевки отлавливали в низкогорной тайге северно-западной части долины Телецкого озера (республика Алтай) в период с 21 по 26 августа 2019 г. В предпочитаемых видом биотопах (участки кедрово-пихтового леса) устанавливали стандартные линии живоловок, которые проверяли через каждые 4 ч.
Отловленные зверьки (35 самцов, 25 самок) были доставлены на экспедиционную базу Новосибирского Научного центра, где содержались при естественном освещении в индивидуальных клетках 30 × 20 × 20 см, с поилками, древесными опилками в качестве подстилки и ватой в качестве гнездового материала. Температура в помещении менялась в соответствии с естественной суточной и сезонной динамикой, но не опускалась до отрицательных значений. В качестве корма животным предлагали семена овса и подсолнечника с добавлением свежей моркови и ягод рябины. После двадцатидневной передержки, необходимой для карантина и адаптации животных к условиям содержания, они были поделены на три экспериментальные группы по 20 особей с одинаковым соотношением полов и близкими средними значениями массы тела. Предварительно по наблюдениям за группой из 6 случайно выбранных особей в течение 4 дней была установлена средняя норма потребления зерен овса, равная 4 г/сут.
В работе использовали культуры грибов B. bassiana (штамм Sar-31) и M. robertsii (штамм P-72, GenBank ID KP172147) из коллекции микроорганизмов ИСиЭЖ СО РАН. Конидии грибов были получены путем культивирования на дважды автоклавированном пшене по методике, описанной ранее (Tomilova et al., 2019), с последующей сушкой при 25°С (8 сут), просевом через почвенное сито и хранением при 4°С до проведения тестов (15 сут). Концентрацию конидий определяли путем их суспендирования в водном растворе Tween-20 (0.05%) и подсчетом в гемоцитометре.
В период с 15 по 29 сентября животным опытных групп ежедневно давали фиксированное количество корма, которое соответствовало его среднесуточному потреблению. Корм был обработан для первой группы животных конидиями B. bassiana, для второй группы животных – конидиями M. robertsii из расчета 4 мл суспензии, содержащей 5 × 107 конидий/мл на одну особь. Суточную дозу каждого из грибов, рассчитанную на 20 животных, суспендировали в 80 мл водно-твинного раствора (0.05%) с помощью магнитной мешалки. Затем полученную суспензию заливали в суточную дозу корма для 20 животных (80 г) и инкубировали в течение 3 ч при температуре 26–29°С для адгезии конидий на поверхность зерна. Затем удаляли жидкую фракцию и подсушивали семена в течение 3–4 ч при комнатной температуре, после чего раздавали животным. Особям контрольной группы давали овес, обработанный по той же схеме, но без добавления конидий грибов. Выдачу дополнительных кормов в этот период ограничивали несколькими ягодами рябины и 2–4 семенами подсолнечника.
Взвешивание животных проводили после доставки в лабораторию (1 сентября), перед началом раздачи корма, содержащего конидии грибов (15 сентября), и после ее окончания (30 сентября). Через десять дней экспериментального кормления у животных из ретро-орбитального синуса были собраны пробы крови объемом 100 мкл для проведения общего и биохимического анализа. Подсчет количества лейкоцитов проводили в камере Горяева. Концентрацию гемоглобина измеряли гемоглобинцианидным методом с помощью набора Гемоглобин-Агат (Агат-Мед, Россия, г. Москва). После центрифугирования образцов (2600 об/мин, 15 мин) в полученной плазме измеряли основные биохимические показатели: количество общего белка биуретовым методом с помощью набора на общий белок “Агат” (Агат-Мед, Россия, Москва), количество глюкозы и триглицеридов с помощью наборов “Глюкоза-ново” и “Триглицериды-ново” (Вектор-Бэст, Россия, Новосибирск). Концентрацию пероксидазы в плазме измеряли в соответствии с инструкцией к набору PerOx (ImmunDiagnostik) при длине волны 450 нм с использованием в качестве субстрата раствора тетраметилбензидина.
Особенности поведения животных разных групп оценивали по частоте проявления различных поведенческих актов в стандартных тестах открытого поля (1–2 октября) и парного ссаживания (8–10 октября). Тест открытого поля проводили в круглой арене высотой 30 см и диаметром 63 см (изготовитель “НПК Открытая Наука”, Россия). Пол и стенки арены изготовлены из белого пластика, пол расчерчен на центральный круг и два кольца секторов (6 и 12 соответственно). Центральный круг и прилежащий к нему ряд секторов мы относили к центральной зоне, а сектора вдоль борта арены – к периферической. Освещенность арены была равномерной и составляла 300 лк. Каждого зверька тестировали однократно в течение 3 мин, помещая в центральный круг арены в затемненном пластиковом цилиндрическом садке. Для нейтрализации запаховых стимулов после каждого теста арену и садок протирали 3 раза ветошью: влажной, смоченной 96% спиртом и сухой. Поведение животных фиксировали на видеокамеру (Panasonic HC-V720M), расположенную над ареной на высоте 1.5 м, с обязательным включением в кадр стенок арены. Полученный видеоматериал анализировали с помощью программы EthoVision 3.1 (Noldus Information Technology, Нидерланды), позволяющей фиксировать и сохранять траекторию перемещения животного в виде координат с частотой 12.5 кадра/с. Исходя из полученной траектории, программа в автоматическом режиме рассчитывает латентное время выхода из центральной зоны арены, количество переходов из центральной части в периферическую и обратно, среднюю скорость перемещения, пройденную дистанцию отдельно для центра и периферии арены, а также суммарную дистанцию, пройденную животным (горизонтальная двигательная активность). Частоту и продолжительность вертикальных стоек (вертикальная двигательная активность) и актов груминга; число прыжков, отряхиваний, актов уринации и дефекации, а также количество фекальных болюсов определяли по характеру изображения животного, используя программу EthoVision.
Социальное поведение грызунов изучали в 10-минутных однополых диадных тестах (Birke, 1981). Для проведения тестов применяли круглую “нейтральную арену”, изготовленную из белого пластика, диаметром 50 см с высотой стенки 30 см. Поведение животных записывали на видеокамеру и затем при покадровом просмотре регистрировали частоту проявления каждого из 21 поведенческих актов, наблюдаемых у красных полевок в тестах парного ссаживания. Для получения интегральных характеристик поведения особи полученные данные обрабатывали методом факторного анализа (Ройс и др., 1975) с вращением осей ”varimax normalized“. Критической величиной факторной нагрузки принято значение 0.3. При анализе данных, полученных при тестировании в открытом поле, рассматривали первые две главные компоненты, в совокупности объясняющие 46.5% всей дисперсии, а при анализе результатов тестов парного ссаживания – первые три компоненты, объясняющие 43.6% всей дисперсии. Биологическая интерпретация этих компонент, как правило, не вызывает затруднений (Животовский, 1991). Значимую нагрузку на первый фактор в тесте “открытое поле” дали следующие элементы поведения (здесь и далее перечисление по мере уменьшения факторной нагрузки): пройденная дистанция (суммарная, пройденная на периферии и в центре), вертикальная активность, количество прыжков и, с отрицательным вкладом в этот фактор, – латентное время выхода из центра арены. На второй фактор значимую нагрузку дали частота груминга, количество фекальных болюсов и актов дефекации. Эти факторы были классически интерпретированы как двигательная активность и эмоциональность, соответственно (Hall, 1934, 1936). В результатах анализа теста парного ссаживания первый фактор, на который значимую нагрузку дали непосредственные контакты (залезание на партнера, нахождение голова к голове), назо-назальное и назо-генитальное обнюхивания, аллогруминг и, с отрицательной нагрузкой, замирание, был интерпретирован как миролюбивое поведение. На второй фактор значимые нагрузки дали отряхивание, чесание задними лапами, вертикальные стойки и прыжки, что было интерпретировано как индивидуальное поведение. Значимую нагрузку на третий фактор, интерпретированный как агонистическое поведение, дали такие поведенческие элементы как писк, выпад, боксирование, оборонительная стойка и стук зубами.
Через 10–15 дней после завершения поведенческих тестов у животных измеряли величину основного обмена по стандартной методике, детально описанной ранее (Поликарпов и др., 2016). Тестирование проводили в респирометре закрытого типа при температуре, соответствующей термонейтральной зоне вида (25–27°С). В качестве величины основного обмена принимали среднее количество потребленного кислорода, приведенное к нормальным условиям с использованием поправочного коэффициента, в 15 последовательных ежеминутных измерениях (Шилов, 1961).
Ежедневно проводили осмотр клеток для выявления случаев гибели животных. Павших зверьков замораживали при –20°С и передавали в НПО “Вектор” для выявления случаев естественного заражения инфекциями.
Результаты наблюдений анализировали с использованием стандартных методов вариационной статистики с применением пакета Statistica 10.0. Статистическую значимость влияния рациона (с добавлением конидий Beauveria, Metarhizium или без грибов) оценивали с помощью двухфакторного дисперсионного анализа с принадлежностью к экспериментальной группе и полом животного в качестве факторов. Для отслеживания временной динамики массы тела использовали дисперсионный анализ с повторными измерениями. Множественные сравнения проводили с помощью HSD критерия Тьюки. Для анализа выживаемости применяли тест Гехана–Уилкоксона.
Работа выполнена с соблюдением правил проведения научных исследований с использованием экспериментальных животных, утвержденных распоряжением Президиума АН СССР от 2 апреля 1980 № 12 000-496 и приказом Минвуза СССР от 13 сентября 1984 № 22. Протокол экспериментов утвержден на заседании комиссии по биоэтике ИСиЭЖ СО РАН.
РЕЗУЛЬТАТЫ
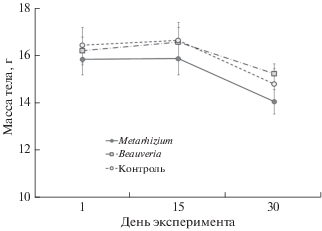
Дисперсионный анализ с повторными измерениями показал, что достоверное влияние на массу тела животных в первый месяц лабораторного содержания оказывала только повторность измерения (F2,94 = 22.8, P < 0.001). Влияние пола и принадлежности к той или иной экспериментальной группе было статистически не значимым (в обоих случаях P > 0.05). Масса тела не менялась с 1 по 15 сентября, когда животным начали давать обработанный конидиями корм, и достоверно снизилась к 30 сентября – к моменту окончания раздачи (рис. 1).
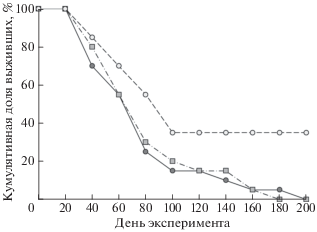
Анализ кривых выживаемости (рис. 2) (тест Гехана–Уилкоксона) показал тренды к большей смертности среди животных, получавших корм с конидиями B. bassiana (P = 0.09) и корм с конидиями M. robertsii (P = 0.06), по сравнению с контрольной группой. Первые случаи гибели животных были отмечены на десятый день после начала раздачи обработанного корма. Далее элиминация животных шла довольно высокими темпами до средины ноября. К этому времени в живых осталось 50% от исходной численности контрольных животных, 25% – от получавших корм, обработанный конидиями Beauveria, и 20% – конидиями Metarhizium. Затем смертность снизилась, однако к концу февраля, через полгода после начала эксперимента, все животные, получавшие корм с конидиями грибов, погибли. Из контрольной группы к средине апреля в живых осталось 7 особей (35% исходного поголовья). Корреляция между изменением массы тела в период с 15 по 30 сентября и временем дожития особи отсутствовала (r = –0.05, P > 0.05).
Рис. 2.
Кумулятивная доля выживших среди особей, получавших с пищей конидии энтомопатогенных грибов, и особей контрольной группы. Условные обозначения те же, что и на рис. 1.
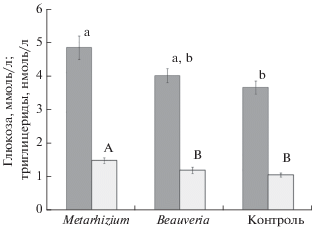
Двухфакторный дисперсионный анализ с полом животного и принадлежностью к экспериментальной группе в качестве категориальных переменных позволил выявить достоверное влияние экспериментальной группы (F2,46 = 7.9, P < 0.01) и ее взаимодействия с полом животного (F2,46 = 3.5, P < 0.05) на уровень пероксидазной активности плазмы. Самцы контрольной группы имели более низкие значения пероксидазы в крови, чем особи, получавшие конидии энтомопатогенных грибов (рис. 3). У самок достоверные различия между группами отсутствовали. Достоверное влияние скармливания конидий показано также для уровня глюкозы (F2,46 = 4.0, P < 0.05) и триглицеридов в крови (F2,46 = 6.0, P < 0.01). В обоих случаях максимальные значения этого показателя отмечали у особей, получавших с кормом конидии Metarhizium, и минимальные значения – у особей контрольной группы (рис. 4). Анализируемые факторы не вносили статистически значимого вклада в такие показатели, как величина основного обмена, число лейкоцитов, содержание гемоглобина и общее количество белка в плазме (во всех случаях P > 0.05).
Рис. 3.
Содержание пероксидазы в крови у животных из разных экспериментальных групп. Темные столбики – самцы, светлые столбики – самки. Здесь и далее значения одного и того же показателя, достоверно (Тьюки HSD – тест, P < 0.05) различающиеся у особей разных групп, помечены разными буквами.
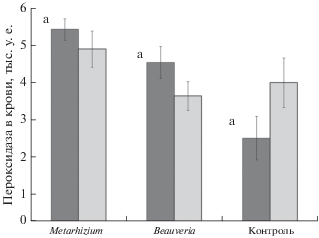
Рис. 4.
Содержание биоэнергетических субстратов в крови у особей разных экспериментальных групп. Темные столбики – глюкоза, светлые столбики – триглицериды. Достоверные (Тьюки HSD – тест, P < 0.05) различия концентраций глюкозы помечены строчными буквами, концентраций триглицеридов – прописными буквами.
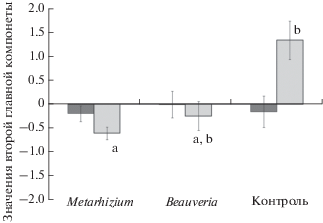
Двухфакторный дисперсионный анализ, в котором в качестве независимых переменных рассматривали принадлежность к экспериментальной группе и пол животного, не выявил статистически значимого влияния исследуемых факторов на значения первой главной компоненты факторного анализа, отражающей двигательную активность красных полевок в тесте открытого поля. На значения второй главной компоненты, отражающей эмоциональность животных в тесте, достоверное влияние оказывали принадлежность к экспериментальной группе (F2,47 = 5.9, P < 0.01) и эффект взаимодействия экспериментальной группы с полом животного (F2,47 = 6.1, P < 0.01). У контрольных самок значения показателя эмоциональности были достоверно выше, чем у самок, получавших с пищей конидии M. robertsii. По самцам существенные различия отсутствовали (рис. 5).
Рис. 5.
Средние значения второй главной компоненты факторного анализа, отражающей эмоциональное поведение в тесте открытого поля у особей разных экспериментальных групп. Условные обозначения – те же, что и на рис. 3.
Ни пол животного, ни принадлежность к экспериментальной группе не оказывали статистически значимого влияния на значения первых трех главных компонент поведения животных в тестах парного ссаживания (во всех случаях P > > 0.05).
ОБСУЖДЕНИЕ
Неполовозрелые особи красной полевки, отловленные в третьей декаде августа, принадлежат к последней сезонной когорте, формирующей зимующую часть популяции (Оленев, 2002). Их численность в изучаемой популяции, как правило, достаточно высока осенью, но существенно уменьшается в течение зимы (Новиков, 1995; Новиков и др., 2012). Данные по динамике численности в подснежный период в изучаемой популяции отсутствуют, однако можно предполагать, что она соответствует паттерну, описанному для красной полевки в окрестностях г. Новосибирска (Панов, 2001) – с двумя сезонными спадами, приходящимися на ноябрь (заморозки до установления постоянного снегового покрова) и апрель (период интенсивного снеготаяния). Высокую смертность молодых особей красной полевки, отловленных в конце сезона размножения и помещенных в лабораторию, мы наблюдали и ранее (Novikov et al., 2019), однако в предыдущих экспериментах она не была настолько высокой, как в данном случае. Наиболее вероятное объяснение наблюдаемых различий связано с тем, что ранее мы содержали животных в комфортных и стабильных условиях – при постоянной температуре выше 20°С и кормлении ad lib. со сбалансированным содержанием нутриентов в рационе. В текущем эксперименте температура в лабораторном помещении колебалась от 5 до 15°С. В течение 15 дней – с 15 по 30 сентября – набор предлагаемых кормов был ограничен фиксированным количеством семян овса с добавлением небольшого количества дополнительных кормов. При таком режиме содержания у животных наблюдалось значительное, свыше 10%, снижение массы тела. Однако, судя по отсутствию корреляции с продолжительностью жизни, оно не являлось непосредственной причиной гибели животных. Различия по уровню смертности и значениям некоторых биохимических показателей (пероксидазная активность сыворотки, содержание глюкозы и триглицеридов в крови) между животными опытных и контрольной групп позволяют предположить, что элиминация животных в первые месяцы эксперимента была в значительной мере связана с интоксикацией веществами, образующимися в корме после обработки конидиями энтомопатогенных грибов либо в желудочно-кишечном тракте при поедании обработанного зерна. Известно, что ряд вторичных метаболитов (боверицидин, деструксин) изучаемых видов грибов, содержащихся, в том числе, и в конидиях (Skrobek et al., 2008), может оказывать достаточно сильное токсическое воздействие на позвоночных животных при обработке препаратами, содержащими эти метаболиты, клеточных культур или при внутрибрюшинных инъекциях (Zimmermann, 2007, 2007a). Однако при кормлении бройлеров пищей, обработанной микотоксинами в достаточно высоких дозах, патогенных эффектов не наблюдали (Zollitsch et al., 2003). Остается не ясным, возможно ли высвобождение грибных токсинов при попадании конидий в пищеварительную систему хозяев и попадают ли они затем в кровоток. Следует отметить, что поскольку грызуны потребляли обработанный корм в течение суток, а также могли запасать его на определенное время, в зерне могли происходить процессы прорастания конидий и накопление указанных метаболитов. Известно, что на искусственных средах и в теле насекомых экспрессия генов, связанных с продукцией деструксинов, наблюдается уже в первые сутки после инокуляции, а на 2–3 сутки эти токсины детектируются хроматографически (Kershaw et al., 1999; Golo et al., 2014; Ríos-Moreno et al., 2017). Последующие работы будут направлены на количественное определение вторичных метаболитов грибов в кишечнике и других органах грызунов после скармливания субстратов, обработанных конидиями.
Увеличение концентрации сывороточной пероксидазы, участвующей в окислении попадающих в организм ксенобиотиков (Саундерс, 1978; Андреева, 1988), свидетельствует об активации детоксицирующих систем организма животных, получавших пищу, обработанную конидиями грибов. Изменение пероксидазной активности под действием энтомопатогенных грибов регистрировалось у насекомых (Wei et al., 2017) и растений (Senthilraja et al., 2013), а для позвоночных выявлено нами впервые. Повышение потребности в энергоресурсах, необходимых для детоксикации организма, требует мобилизации дополнительных энергосубстратов. Это, возможно, и было причиной увеличения концентрации глюкозы и триглицеридов в крови у животных экспериментальных групп. Увеличение содержания глюкозы в крови отловленных в природе красных полевок при искусственной интоксикации инсектицидами пиретроидного ряда отмечали и другие авторы (Чигринский и др., 2018). Вместе с тем уровень энергообмена, рассматриваемый экотоксикологами как один из важнейших показателей резистентности организма к внешним воздействиям (Михайленко, 2002), спустя 2–3 недели после прекращения дачи препаратов у особей опытных и контрольной групп достоверно не различался. Не выявлено достоверных различий между сравниваемыми группами полевок по концентрации гемоглобина в крови, которая остро реагирует на интоксикацию организма химическими агентами (Тарахтий, Мухачева, 2011), и числом лейкоцитов в крови, отражающим состояние врожденного иммунитета. Поскольку лесные полевки активно участвуют в распространении зоонозных инфекций (Шилова, 1993), одной из возможных причин гибели животных в первые месяцы после отлова (в том числе в контрольном варианте) могла стать их естественная инфицированность, роль которой будет выявлена в дальнейших исследованиях.
Одним из наиболее распространенных и удобных методов выявления депрессивных состояний, обусловленных фармакологическими препаратами и другими ксенобиотиками, являются поведенческие тесты (Drugan et al., 1997; Prut, Belzung, 2003). Результаты тестирования красных полевок, проведенного сразу же после прекращения дачи препаратов, показали, что скармливание пищи, обработанной конидиями энтомопатогенных грибов, снижало эмоциональность животных в тесте открытого поля, но не влияло на уровень исследовательской активности и характеристики социального поведения, оцененные в тесте парного ссаживания. Это свидетельствует о том, что попадающие в организм полевок грибы не вызывают повышения тревожности или развития депрессивных состояний.
Во всех случаях, когда удавалось обнаружить отличия животных, получавших пищу, обработанную конидиями грибов, от контроля, эти отличия были ярче выражены для группы, получавшей M. robertsii, что может свидетельствовать о большей токсичности метаболитов данного гриба для позвоночных животных по сравнению с токсинами грибов B. bassiana. Данное отличие соотносится с тем, что M. robertsii имеет большее количество генов, вовлеченных в продукцию вторичных метаболитов, по сравнению с B. bassiana (Xiao et al., 2012).
Основной задачей проведенной работы было моделирование ситуации, в которой грибные пропагулы попадают в организм диких животных в высоких дозах (например, при посеве обработанных препаратом семян), с учетом возможного действия на них естественных стрессоров, наиболее обычных в природе – некомфортных температур и обедненного рациона. Полученные результаты позволяют предположить, что, несмотря на относительно слабую выраженность острых токсических эффектов энтомопатогенных грибов при алиментарном поступлении в организм, в стрессовых условиях их действие растягивается во времени, вызывая хроническую интоксикацию, приводящую к повышенной по сравнению с контролем смертности животных. Полученные результаты показывают целесообразность развития подходов к оценке безопасности биологических пестицидов для диких животных с учетом не только непосредственных, но и отдаленных эффектов их применения. Экспериментальное изучение неспецифического действия естественных токсикантов на позвоночных (на человека и животных) как на нецелевые объекты позволяет выявить общие закономерности формирования физиологических и поведенческих адаптаций. Эти адаптации направлены на компенсацию токсических воздействий, количество которых неуклонно возрастает по мере увеличения масштабов загрязнения окружающей среды.
Список литературы
Андреева В.А., 1988. Фермент пероксидаза. М.: Наука. 128 с.
Безель В.С., Большаков В.Н., Воробейчик Е.Л., 1994. Популяционная экотоксикология. М.: Наука. 80 с.
Государственный каталог пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации на 8 февраля 2021. Ч. I. Пестициды. Минсельхоз России, Москва 2021. 803 с.
Животовский Л.А., 1991.Популяционная биометрия. М.: Наука. 271 с.
Михайленко В.Г., 2002. Неоднозначность резистентности организмов // Успехи современной биологии. Т. 122. № 4. С. 334–341.
Новиков Е.А., Панов В.В., Мошкин М.П., 2012. Плотностно-зависимые механизмы регуляции численности популяций красной полевки (Myodes rutilus) в оптимальных и субоптимальных местообитаниях Юга Западной Сибири // Журнал общей биологии. Т. 73. № 1. С. 63–72.
Новиков Е.А., 1995. Динамика численности и пространственное распределение красной полевки в Прителецкой тайге // Экология. № 3. С. 40–46.
Оленев Г.В., 2002. Альтернативные типы онтогенеза цикломорфных грызунов и их роль в популяционной динамике (экологический анализ) // Экология. № 5. С. 335–344.
Панов В.В., 2001. Зимний период в жизни мелких млекопитающих приобских сосновых боров северной лесостепи Западной Сибири // Сибирский экологический журнал. Т. 8. № 6. С. 777–784.
Поликарпов И.А., Кондратюк Е.Ю., Петровский Д.В., Новиков Е.А., 2016. Межпопуляционная изменчивость эндокринно-метаболической реакции на холодовой стресс у красной полевки (Myodes rutilus) // Журнал общей биологии. Т. 77. № 4. С. 284–292.
Ройс Дж.Р., Поли У., Иедалл Л.Т., 1975. Генетико-поведенческий анализ эмоциональности у мышей. Факторный анализ // Актуальные проблемы генетики поведения. Л.: Наука, Ленинградское отделение. С. 176–194.
Саундерс Б., 1978. Пероксидазы и каталазы // Неорганическая биохимия. Т. 2. М.: Мир. С. 434–470.
Тарахтий Э.А., Мухачева С.В., 2011. Реакция системы крови лесных полевок на стресс на фоне хронического химического загрязнения среды // Успехи современной биологии. Т. 131. № 6. С. 613–621.
Чигринский Е.А., Герунова Л.К., Конвай В.Д., Герунов Т.В., 2018. Биохимические маркеры токсичности циперметрина для лесных полевок Myodes // Проблемы и мониторинг природных экосистем. С. 155–159.
Шилов И.А., 1961. Практикум по экологии наземных позвоночных животных. М.: Высшая школа. 148 с.
Шилова С.А., 1993. Популяционная экология как основа контроля численности мелких млекопитающих. М.: Наука. 201 с.
Baas J., Kooijman S.A., 2015. Sensitivity of animals to chemical compounds links to metabolic rate // Ecotoxicology. V. 24. № 3. P. 657–663.
Bamisile B.S., Dash C.K., Akutse K.S., Keppanan R., Afolabi O.G., Hussain M., et al., 2018. Prospects of endophytic fungal entomopathogens as biocontrol and plant growth promoting agents: An insight on how artificial inoculation methods affect endophytic colonization of host plants // Microbiological research. V. 217. P. 34–50. https://doi.org/10.1016/j.micres.2018.08.016
Birke L., 1981. Some behavioral changes associated with guinea pig oestrus cycle // Zeitschrift für Tierpsychologie. Bd. 55. P. 79–89.
Brunner-Mendoza C., Reyes-Montes M.D.R., Moonjely S., Bidochka M.J., Toriello C., 2019. A review on the genus Metarhizium as an entomopathogenic microbial biocontrol agent with emphasis on its use and utility in Mexico // Biocontrol Science and Technology. V. 29. № 1. P. 83–102.
Calow P., 1989. Proximate and ultimate responses to stress in biological systems // Biological Journal of the Linnean Society. V. 37. № 1–2. P. 173–181. https://doi.org/10.1111/j.1095-8312.1989.tb02101.x
Clifton E.H., Jaronski S.T., Hodgson E.W., Gassmann A.J., 2015. Abundance of soil-borne entomopathogenic fungi in organic and conventional fields in the midwestern USA with an emphasis on the effect of herbicides and fungicides on fungal persistence // PLoS ONE. V. 10. № 7. e0133613. doi: 10.1371
Colborn T., 1995. Pesticides-how research has succeeded and failed to translate science into policy: endocrinological effects on wildlife // Environmental health perspectives. V. 103. №. suppl 6. P. 81–85.
De Faria M.R., Wraight F.R., 2007. Mycoinsecticides and Mycoacaricides: A comprehensive list with worldwide coverage and international classification of formulation types // Biological Control. V. 43. P. 237–256. https://doi.org/10.1016/j.biocontrol.2007.08.001
Drugan R.C., Basile A.S., Ha J.H., Healy D., Ferland R.J., 1997. Analysis of the importance of controllable versus uncontrollable stress on subsequent behavioral and physiological functioning // Brain Research Protocols. V. 2. P. 69–74.
García-Herranz V., Valdehita A., Navas J.M., Fernández-Cruz M.L., 2019. Cytotoxicity against fish and mammalian cell lines and endocrine activity of the mycotoxins beauvericin, deoxynivalenol and ochratoxin-A // Food and Chemical Toxicology. V. 127. P. 288–297.
Golo P.S., Gardner D.R., Grilley M.M., Takemoto J.Y., Krasnoff S.B., Pires M.S., et al., 2014. Production of destruxins from Metarhizium spp. fungi in artificial medium and in endophytically colonized cowpea plants // PloS ONE. V. 9. № 8. https://doi.org/10.1371/journal.pone.0104946
Hall C.S., 1934. Emotional behavior in the rat. I. Defecation and urination as measures of individual differences in emotionality // J. Comp. Psychol. V. 18. P. 385–403.
Hall C S., 1936. The relationship between emotionality and ambulatory activity // J. Comp. Psychol. V. 22. P. 345–452.
Ignoffo C.M., 1973. Effects of entomopathogens on vertebrates // Annals of the New York Academy of Sciences. V. 217. № 1. P. 141–164.
Jaronski S.T., 2010. Ecological factors in the inundative use of fungal entomopathogens // BioControl. V. 55. P. 159– 185. https://doi.org/10.1007/s10526-009-9248-3
Kershaw M.J., Moorhouse E.R., Bateman R., Reynolds S.E., Charnley A.K., 1999. The role of destruxins in the pathogenicity of Metarhizium anisopliae for three species of insect // Journal of invertebrate pathology. V. 74. № 3. P. 213–223.
Mancebo A., González F., Aldana L., González Y., Lugo S., González B., et al., 2009. Pathogenicity of the entomopathogenic fungus Beauveria bassiana 9205 in rats using different routes of exposition // Toxicological & Environmental Chemistry. V. 91. № 1. P. 99–108.
Moonjely S., Barelli L., Bidochka M.J., 2016. Insect pathogenic fungi as endophytes // Advances in genetics. V. 94. P. 107–135. https://doi.org/10.1016/bs.adgen.2015.12.004
Novikov E.A., Kondratuk E.Yu., Polikarpov I.A., 2019. Age-related differences in physiology and survival of northern red-backed voles (Myodes rutilus) in captivity // Biogerontology (online). https://doi.org/10.1007/s10522-019-09847-w
Prut L., Belzung C., 2003. The open field as a paradigm to measure the effects of drugs on anxiety-like behaviors: a review // European Journal of Pharmacology. V. 4. № 63. P. 3–33.
Ríos-Moreno A., Garrido-Jurado I., Raya-Ortega M.C., Quesada-Moraga E., 2017. Quantification of fungal growth and destruxin A during infection of Galleria mellonella larvae by Metarhizium brunneum // Journal of invertebrate pathology. V. 149. P. 29–35.
Scheepmaker J.W.A., Butt T.M., 2010. Natural and released inoculum levels of entomopathogenic fungal biocontrol agents in soil in relation to risk assessment and in accordance with EU regulations // Biocontrol Sci. Technol. V. 20. № 5. P. 503–552. https://doi.org/10.1080/09583150903545035
Senthilraja G., Anand T., Kennedy J.S., Raguchander T., Samiyappan R., 2013. Plant growth promoting rhizobacteria (PGPR) and entomopathogenic fungus bioformulation enhance the expression of defense enzymes and pathogenesis-related proteins in groundnut plants against leafminer insect and collar rot pathogen // Physiological and molecular plant pathology. V. 82. P. 10–19.
Skrobek A., Shah F.A., Butt T.M., 2008. Destruxin production by the entomogenous fungus Metarhizium anisopliae in insects and factors influencing their degradation // BioControl. V. 53. № 2. P. 361–373.
Strasser H., Vey A., Butt T.M., 2000. Are there any risks in using entomopathogenic fungi for pest control, with particular reference to the bioactive metabolites of Metarhizium, Tolypocladium and Beauveria species? // Biocontrol science and technology. V. 10. P. 717–735.
Tête N., Afonso E., Bouguerra G., Scheifler R., 2015. Blood parameters as biomarkers of cadmium and lead exposure and effects in wild wood mice (Apodemus sylvaticus) living along a pollution gradient // Chemosphere. V. 138. P. 940–946.
Tomilova O.G., Yaroslavtseva O.N., Ganina M.D., Tyurin M.V., Chernyak E.I., Senderskiy I.V., et al., 2019. Changes in antifungal defence systems during the intermoult period in the Colorado potato beetle // Journal of insect physiology. V. 116. P. 106–117. https://doi.org/10.1016/j.jinsphys.2019.05.003
Tomilova O.G., Shaldyaeva E.M., Kryukova N.A., Pilipova Y.V., Schmidt N.S., Danilov V.P., Krukov V.Y., Glupov V.V., 2020. Entomopathogenic fungi decrease Rhizoctonia disease in potato in field conditions // PerJ. V. 8. e9895. https://doi.org/10.7717/peerj.9895
Van Straalen N.M., 2003. Ecotoxicology becomes stress ecology // Environmental science & technology. 324A–330A. https://doi.org/10.1021/es0325720
Vega F.E., 2018. The use of fungal entomopathogens as endophytes in biological control: a review // Mycologia. V. 110. № 1. P. 4–30. https://doi.org/10.1080/00275514.2017.1418578
Vey A., Hoagland R.E., Butt T.M., 2001. Toxic metabolites of fungal biocontrol agents // Fungi as biocontrol agents. P. 311–346.
Vos J.G., Moore J.A., 1977. Immune suppression as related to toxicology // CRC critical reviews in toxicology. V. 5. № 1. P. 67–101.
Wei G., Lai Y., Wang G., Chen H., Li F., Wang S., 2017. Insect pathogenic fungus interacts with the gut microbiota to accelerate mosquito mortality // Proceedings of the National Academy of Sciences. V. 114. № 23. P. 5994–5999. https://doi.org/10.1073/pnas.1703546114
Xiao G., Ying S. H., Zheng P., Wang Z.L., Zhang S., Xie X.Q., et al., 2012. Genomic perspectives on the evolution of fungal entomopathogenicity in Beauveria bassiana // Scientific Reports. V. 2. P. 483. https://doi.org/10.1038/srep00483
Zimmermann G., 2007. Review on safety of the entomopathogenic fungi Beauveria bassiana and Beauveria brongniartii // Biocontrol Science and Technology. V. 17. № 6. P. 553–596. https://doi.org/10.1080/09583150701309006
Zimmermann G., 2007a. Review on safety of the entomopathogenic fungus Metarhizium anisopliae // Biocontrol Science and Technology. V. 17. № 9. P. 879–920. https://doi.org/10.1080/09583150701593963
Zollitsch W., Raffaseder C., Böhm J., Wagner E., Leitgeb R., 2003. Impact of the mycotoxins moniliformin and beauvericin on growth and carcass traits of broilers // Wiener Tierärztliche Monatsschrift. P. 90. № 9. P. 238–243.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал