Зоологический журнал, 2022, T. 101, № 10, стр. 1173-1189
Формирование генетической структуры популяций дальневосточной полевки (Alexandromys fortis, Rodentia, Arvicolinae) на северной периферии ареала
И. Н. Шереметьева a, *, И. В. Картавцева a, М. В. Павленко a, И. В. Моролдоев b, Ю. А. Баженов c, Ф. Н. Голенищев d
a Федеральный научный центр биоразнообразия наземной биоты Восточной Азии ДВО РАН
690022 Владивосток, Россия
b Институт систематики и экологии животных СО РАН
630091 Новосибирск, Россия
c Институт природных ресурсов, экологии и криологии СО РАН
672014 Чита, Россия
d Зоологический институт РАН
199034 Санкт-Петербург, Россия
* E-mail: sheremet76@yandex.ru
Поступила в редакцию 24.09.2021
После доработки 24.03.2022
Принята к публикации 02.04.2022
- EDN: QJWRIJ
- DOI: 10.31857/S0044513422080098
Аннотация
По данным изменчивости контрольного региона мтДНК изучена генетическая структура дальневосточной полевки (Alexandromys fortis (Büchner 1889)) на северной периферии ареала. Показано высокое гаплотипическое и нуклеотидное разнообразие на севере ареала вида. Разнообразие обусловлено присутствием двух линий, которые формируют на дендрограммах филогенетические субклады в пределах линии NORTH. Гаплотипы субклады MAIN имеют широкое географическое распространение. Распространение гаплотипов субклады ISL приурочено в основном к островам архипелага Римского-Корсакова Японского моря (Большой Пелис и Матвеева) и Баргузинской котловине в Бурятии, также с небольшой частотой они встречаются в локальных материковых популяциях на юге Дальнего Востока. Отмечено, что гаплотипы субклады ISL близки к таковым, выявленным ранее на ископаемом материале из пещерных отложений юга Приморского края. Рассмотрено несколько альтернативных гипотез о путях формирования такой филогеографической структуры. Высказано предположение о существовании в северной части ареала локальных участков с подходящими условиями для обитания дальневосточной полевки. Эти участки способствовали сохранению особей, имеющих гаплотипы субклады ISL. Эти локальные участки можно рассматривать как микрорефугиумы, сыгравшие важную роль в поддержании высокого генетического разнообразия вида на юге Дальнего Востока России. Вторичное расселение линии, соответствующей субкладе MAIN, произошло, вероятно, уже после завершения климатического минимума, во время широкой экспансии вида на север из южного макрорефугиума. Нами также рассмотрена гипотеза о существовании двух макрорефугиумов, в которых формировались две линии, представленные субкладами MAIN и ISL. Нынешнее распространение этих линий обусловлено случайной фиксацией более редких гаплотипов субклады ISL в небольших изолированных популяциях.
Дальневосточная полевка (Alexandromys fortis (Büchner 1889)) – политипический вид, распространенный на обширной территории Маньчжуро-Китайской подобласти Восточной Палеарктики (Громов, Ербаева, 1995; Batsaikhan, Tsytsulina, 2016). Ареал A. fortis представлен несколькими крупными изолятами (рис. 1А) (Shenbrot, Krasnov, 2005), а на его периферии имеется ряд малых изолированных популяций: на островах залива Петра Великого Японского моря (Чугунов, Катин, 1984; Костенко, 2000; Шереметьев, 2001), на севере о-ва Сахалин (Воронов, 1992; Тиунов и др., 2009) и в Баргузинской котловине в Бурятии (Громов, Ербаева, 1995). Как обитатель лесной и лесостепной зоны (Batsaikhan, Tsytsulina, 2016), этот вид преимущественно приурочен к влажным биотопам, расположенным по берегам рек, озер и болот, а также морских побережий, что объясняет его мозаичное распределение. Известно семь подвидов дальневосточной полевки: A. fortis fortis (Buchner 1889), описан из Приордосских районов Китая, распространен в провинции Шеньси, Нинся-Хуэйском автономном районе на юге Внутренней Монголии Китая; A. f. calamorum (Thomas 1902), описан из окрестностей г. Нанкин (провинция Цзянсу, Китай), распространен в провинциях Аньхой, Чжэцзян, Цзянси, Хунань, Хубэй, Цзянсу и окрестностях Шанхая; A. f. michnoi (Kastschenko 1905), описан из Юго-Западного Забайкалья, близ г. Кяхта в бассейне р. Чикой, населяет Западное и Восточное Забайкалье; A. f. pelliceus (Thomas 1911), описан из поймы р. Уссури, распространен на юге Дальнего Востока России (Приморский край, юг Хабаровского края, Еврейская автономная обл. и юг Амурской обл.), в провинциях Хэйлунцзян, Цзилинь и в северо-восточной части Внутренней Монголии Китая; A. f. dolichocephalus (Mori 1930), описан из центральной части Северо-Восточного Китая, обитает в провинциях Ляонин, Гирин (Цзилинь) и Внутренней Монголии Китая; A. f. uliginosus (James et Jonson 1955), описан из центральной части Корейского п-ова; A. f. fujianensis (Hong 1981), описан из провинции Фуцзянь, Китай. Принято считать, что на территории России встречаются два морфологически слабо обособленных подвида: A. f. michnoi и A. f. pelliceus (Громов, Поляков, 1977). Относительно границ распространения этих подвидов мнения расходятся (Виноградов, 1933; Фетисов, 1940; Огнев, 1950; Лукашин, 1975).
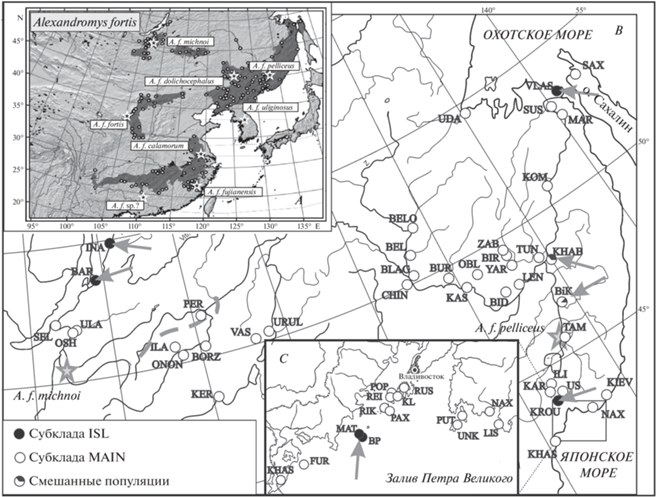
Рис. 1.
Ареал (А) и места сбора материала (В и C) дальневосточной полевки. Ареал вида приведен по: Шенброт, Краснов (Shenbrot, Krasnov, 2005). Коды выборок соответствуют таковым в табл. 1. Звездочкой указаны места первоописания подвидов. Пунктирной линией указана предполагаемая граница между подвидами A. f. michnoi и A. f. pelliceus в Забайкалье. Стрелкой указаны места обнаружения особей, имеющих мтДНК филогруппы ISL.
Благодаря широкому ареалу, большому количеству и разнообразию изолированных популяций, дальневосточная полевка представляет большой интерес для филогеографических исследований (Chelomina, Sheremetyeva, 2007; Шереметьева и др., 2006; Haring et al., 2011; Гуськов, Шереметьева, 2012; Guo et al., 2012; Gao et al., 2017; Lissovsky et al., 2018), которыми, тем не менее, ареал вида охвачен еще не в полной мере. Наиболее масштабная работа по филогеографической структуре A. fortis была выполнена Гао с соавторами (Gao et al., 2017), которые проанализировали 86 животных из 6 провинций Китая и выделили три группы (NORTH, SOUTH и GX) с четкой географической приуроченностью. Также были изучены взаимоотношения между подвидами дальневосточной полевки, обитающими в центральной части ареала. В то же время, филогенетические связи двух подвидов A. fortis, обитающих в северной части ареала (на территории России), остаются неясными. Кроме того, до сих пор остается неисследованным ряд изолированных популяций на периферии ареала.
Целью настоящей работы является исследование генетической структуры дальневосточной полевки (A. fortis) на периферии северной части ареала по результатам анализа изменчивости контрольного региона митохондриальной ДНК.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовано 142 особи A. fortis, отловленные в 55 локальных популяциях (включая 13 островных) на севере ареала: на юге Дальнего Востока России, в Забайкальском крае, Бурятии, Монголии и Китае (табл. 1, рис. 1В и 1C). Образцы собственных сборов хранятся в коллекции тканей млекопитающих ФНЦ Биоразнообразия ДВО РАН, Владивосток.
Таблица 1.
Материал для исследования контрольного региона мтДНК Alexandromys fortis
| Код выборки | Выборка (число образцов) | Координаты | Число гаплотипов | Филогруппа |
|---|---|---|---|---|
| A. f. pelliceus (Thomas 1911) | ||||
| Островные популяции | ||||
| Острова залива Петра Великого (Японское море) | ||||
| PUT*# | о-в Путятина (n = 3) | 42.83° N, 132.42° E | 3 | MAIN |
| LIS*# | о-в Лисий (n = 4) | 42.76° N, 132.91° E | 4 | MAIN |
| RUS# | о-в Русский (n = 1) | 43.00° N, 131.85° E | 1 | MAIN |
| POP*# | о-в Попова (n = 2) | 42.95° N, 131.72° E | 2 | MAIN |
| REI*# | о-в Рейнеке (n = 2) | 42.90° N, 131.72° E | 1 | MAIN |
| KL*# | о-в Клыкова (n = 3) | 42.94°N, 131.77° E | 3 | MAIN |
| RIK*# | о-в Рикорда (n = 5) | 42.87° N, 131.65° E | 5 | MAIN |
| FUR# | о-в Фуругельма (n = 2) | 42.47° N, 130.92° E | 2 | MAIN |
| MAT*# | о-в Матвеева (n = 8) | 42.67° N, 131.43° E | 7 | ISL |
| BP# | о-в Большой Пелис (n = 5) | 42.66° N, 131.46° E | 4 | ISL |
| PAX# | о-в Пахтусова (n = 4) | 42.90° N, 131,65° E | 3 | MAIN |
| UNK# | камни Унковского (n = 1) | 42.82° N, 132.37° E | 1 | MAIN |
| О-в Сахалин | ||||
| SAX | Залив Помрь (n = 3) | 53.69° N, 142.59° E | 3 | MAIN |
| Материковые популяции | ||||
| Приморский край | ||||
| KHAS*# | Хасанский р-н, окр. пос. Хасан (n = 9) | 42.43° N, 130.65° E | 9 | MAIN |
| NAX*# | Окр. г. Находка (n = 4) | 42.88° N, 132.74° E | 2 | MAIN |
| US*# | Окр. г. Уссурийск (n = 1) | 43.63° N, 132.22° E | 1 | MAIN |
| KROU* | Окр. с. Кроуновка (n = 1) | 43.70° N, 131.60° E | 1 | ISL |
| KAR* | Падь “Карантинная” (n = 1) | 40.68° N, 131.47° E | 1 | MAIN |
| ILI* | Окр. с. Ильичевка (n = 1) | 44.20° N, 131.92° E | 1 | MAIN |
| TAM | Лесозаводский р-н, окр. пос. Тамга (n = 4) | 45.57° N, 133.61° E | 4 | MAIN |
| KIEV | Лазовский р-н, окр. с. Киевка (n = 4) | 42.84° N, 133.69° E | 3 | MAIN |
| Хабаровский край | ||||
| KHAB | Окр. г. Хабаровск, с. Галкино (n = 14) | 42.78° N, 134.28° E | 13 | MAIN (8), ISL (5) |
| BIK | Окр. г. Бикин (n = 8) | 46.83° N, 134.25° E | 8 | MAIN (7), ISL (1) |
| KOM * | Окр. г. Комсомольск на Амуре (n = 3) | 50.50° N, 136.99° E | 3 | MAIN |
| SUS* | Окр. пос. Сусанино (n = 2) | 52.73° N, 140.11° E | 2 | MAIN |
| VLAS* | Окр. пос. Власьево (n = 1) | 53.42° N, 140.91° E | 1 | ISL |
| UDA* | Река Уда (n = 2) | 54.70° N, 135.26° E | 2 | MAIN |
| MAR* | Окр. пос. Мариинское (n = 1) | 51.71° N, 140.21° E | 1 | MAIN |
| ZAB | Заказник Забеловский (n = 2) | 48.94° N, 133.12° E | 2 | MAIN |
| Еврейская автономная область | ||||
| TUN | Пос. Даниловка, река Тунгуска (n = 2) | 48.59° N, 134.60° E | 2 | MAIN |
| BIR | Окр. г. Биробиджан (n = 1) | 48.73° N, 133.04° E | 1 | MAIN |
| BID | Окр. пос. Биджан (n = 8) | 47.99° N, 131.96° E | 7 | MAIN |
| LEN | Окр. пос. Ленинское (n = 2) | 47.93° N, 132.60° E | 2 | MAIN |
| YAR* | Река Бира, Желтый Яр (n = 2) | 48.57° N, 133.05° E | 1 | MAIN |
| OBL | Окр. г. Облучье (n = 5) | 48.93° N, 130.70° E | 5 | MAIN |
| Амурская область | ||||
| BUR | Пойма ниж. течения реки Бурея (n = 9) | 49.71° N, 129.69° E | 9 | MAIN |
| BLAG* | Окр. г. Благовещенск (n = 4) | 50.31° N, 127.48° E | 4 | MAIN |
| KAS* | Окр. пос. Касаткино (n = 1) | 48.97° N, 130.07° E | 1 | MAIN |
| BEL | Окр. г. Белогорск (n = 1) | 50.89° N, 128.65° E | 1 | MAIN |
| BELO | Окр. с. Белоярово (n = 1) | 51.60° N, 128.77° E | 1 | MAIN |
| Север Китая | ||||
| CHIN | Окр. пос. Хэйхе (n = 4) | 50.25° N, 127.54° E | 4 | MAIN |
| HLJ** | Окр. г. Цзямусы, пров. Хэйлунцзян (n = 3) | 47.50° N, 133.50° E | 3 | MAIN |
| FU** | Окр. пос. Фуюань, пров. Хэйлунцзян (n = 2) | 48.35° N, 134.28° E | 2 | MAIN |
| A. f. michnoi (Kastschenko 1905) | ||||
| Бурятия | ||||
| ULA | Окр. г. Улан-Удэ (n = 9) | 51.82° N, 107.41° E | 9 | MAIN |
| OSH* | Окр. г. Улан-Удэ, с. Ошурково (n = 13) | 51.95° N, 107.48° E | 12 | MAIN |
| SEL | Дельта реки Селенга, окр. с. Степной Дворец (n = 1) | 52.15° N, 106.34° E | 1 | MAIN |
| BAR | Окр. с. Баргузин (n = 1) | 53.60° N, 109.70° E | 1 | ISL |
| INA | Баргузинская котловина, окр. с. Ина-соел (n = 1) | 53.76° N, 110.23° E | 1 | ISL |
| Забайкальский край | ||||
| ONON | Река Онон, восточней устья р. Иля, Нарин-Кундуй (n = 3) | 50.43° N, 113.79° E | 3 | MAIN |
| BORZ | Ононский р-н, Усть Борзя, река Борзя (n = 4) | 50.62° N, 115.66° E | 4 | MAIN |
| URUL | Приаргунский р-н, река Урулюнгуй (n = 1) | 50.32° N, 118.99° E | 1 | MAIN |
| VAS | Борзинский р-н, с. Васильевский хутор (n = 2) | 50.59° N, 117.80° E | 1 | MAIN |
| ILA | Иля (n = 2) | 50.81° N, 113.58° E | 2 | MAIN |
| PER | Окр. пос. Первомайский (n = 1) | 51.65° N, 115.80° E | 1 | MAIN |
| Аймак Дорнод, Монголия | ||||
| KER | 50 км на северо-восток от г. Чойбалсан, нижнее течение р. Керулен (n = 1) | 48.36° N, 115.35° E | 1 | MAIN |
| A. f. fortis (Buchner 1889) | ||||
| NX** | Нинся-хуэйский автономный р-н, Китай (n = 20) | 38.20° N, 106.20° E | 3 | MAIN |
| NIN** | » (n = 1) | 36.60° N, 105.32° E | 1 | MAIN |
| A. f. dolichocephalus (Mori 1930) | ||||
| JL** | Пров. Цзилинь, Китай (n = 1) | 43.50° N, 125.60° E | 1 | MAIN |
| A. f. calamorum (Thomas 1902) | ||||
| DON** | оз. Дунтинху, пров. Хунань, Китай (n = 164) | 29.32° N, 112.95° E | 30 | HN |
| HN** | » (n = 19) | 29.10° N, 112.50° E | 3 | HN |
| A. f. fujianensis (Hong 1981) | ||||
| FJ** | Пров. Фуцзянь, Китай (n = 20) | 27.10° N, 117.20° E | 5 | FJ−1(2), FJ−2(3) |
| A. f. subspecies | ||||
| GX** | Гуанси-Чжуанский автономный р-н, Китай (n = 20) | 25.20° N, 110.10° E | 10 | GX |
Выделение ДНК осуществляли методом солевой экстракции (Aljanabi, Martinez, 1997) из фиксированных в спирте мышц и печени. Подробная методика по приготовлению реакционной смеси, схема ПЦР-реакции и подготовки проб к секвенированию были описаны ранее (Шереметьева и др., 2015). Нуклеотидную последовательность контрольного региона определяли на автоматическом секвенаторе ABI Prizm 3130 на базе Центра коллективного пользования ФНЦ Биоразнообразия ДВО РАН, Владивосток. От всех дальневосточных полевок из наших сборов были получены полные нуклеотидные последовательности контрольного региона, которые внесены в Genbank/NCBI под номерами MZ056579–MZ056719. Кроме того, в анализ включены полученные нами ранее и помещенные в Genbank/NCBI под номерами HM135815–HM135852 (Haring et al., 2011) 38 нуклеотидных последовательностей контрольного региона дальневосточных полевок из популяций России, а также 86 нуклеотидных последовательностей контрольного региона полевок из Китая, Genbank/NCBI KJ207290–KJ207373, FJ597650– FJ597731 и GU474450-GU474511 (Guo et al., 2012; Gao et al., 2017). В качестве внешней группы нами выбрана полевка-экономка (A. oeconomus) № HM135920 (Haring et al., 2011).
Редактирование и выравнивание полученных последовательностей проводили с использованием программы BioEdit 7.0.9.0 (Hall, 1999). Длина последовательностей варьировала от 925 до 958 п.н., а после выравнивания составила 905 п.н. Построение филогенетических деревьев методом максимального правдоподобия (Maximum Likelihood) выполнено в программе MEGA X (Kumar et al., 2018). Нами использована модель Hasegawa-Kishino-Yano с G-распределением (BIC = 8847.319), достоверность кластеризации оценивалась с помощью бутстрэп-анализа (1000 повторностей). Сети гаплотипов построены с помощью программы Network 10.0.0.0 с использованием метода “median joining” (Bandelt et al., 1999). При построении филогенетических деревьев и сетей делеции не учитывались. Расчет показателей генетического разнообразия (нуклеотидного (π) и гаплотипического (h) разнообразия, числа вариабельных сайтов (Vs), среднего числа попарных нуклеотидных различий (k)), а также построение графика распределения попарных нуклеотидных различий между гаплотипами выполнены с помощью программы DnaSP 6.00 (Rozas et al., 2017). Расчет статистик нейтральности (Tajima’ D и Fu’s F), анализ демографической и пространственной экспансии проводили в программе Arlequin 3.5 (Excoffier, Lischer, 2010).
РЕЗУЛЬТАТЫ
В выборке из 142 особей A. fortis, не исследованных ранее, обнаружено 116 гаплотипов, из которых 111 выявлены впервые. С учетом гаплотипов, описанных ранее (Haring et al., 2011; Guo et al., 2012; Gao et al., 2017), их общее число для вида составляет 209, а число вариабельных сайтов – 169 (табл. 2). В целом, для вида отмечено высокое гаплотипическое (94%) и нуклеотидное (1.63%) разнообразие.
Таблица 2.
Показатели генетического разнообразия филогрупп Alexandromys fortis
| Показатель | GX | SOUTH | NORTH | Все | |||
|---|---|---|---|---|---|---|---|
| FJ–1 | FJ–2 | HN | MAIN | ISL | |||
| n | 20 | 5 | 15 | 163 | 184 | 23 | 410 |
| N | 11 | 2 | 3 | 33 | 139 | 21 | 209 |
| Vs | 16 | 2 | 2 | 30 | 120 | 29 | 169 |
| h ± SD | 0.726 ± 0.092 | 0.535 ± 0.016 | 0.514 ± 0.014 | 0.693 ± 0.026 | 0.972 ± 0.009 | 0.957 ± 0.034 | 0.9428 ± 0.0068 |
| k ± SE | 4.74 ± 2.42 | 0.80 ± 0.68 | 0.68 ± 0.07 | 2.81 ± 1.49 | 7.48 ± 3.51 | 5.85 ± 2.90 | 14.436 |
| π ± SD | 0.0053 ± 0.0003 | 0.0008 ± 0.0001 | 0.0007 ± 0.0006 | 0.0031 ± 0.0018 | 0.0082 ± 0.0004 | 0.0065 ± 0.0003 | 0.0163 ± 0.0003 |
| Tajima’s D (P) | 0.65(>0.10) | –0.001(>0.10) | –0.02(>0.10) | –1.61(<0.05) | –2.32(0.000) | –1.99(<0.05) | –1.45(>0.10) |
| Fu’s F(P) | –20.03(0.000) | –5.41(0.000) | –6.40(0.000) | –26.48(0.000) | –24.59(0.000) | –12.95(0.000) | –34.36(0.000) |
Примечания. n – объем выборки, N – число гаплотипов, Vs – число вариабельных сайтов, k – среднее число попарных нуклеотидных различий, h – гаплотипическое разнообразие, π – нуклеотидное разнообразие, Tajima’s D – коэффициент теста Таджимы, Fu’s F – коэффициент теста Фу, SD – стандартное отклонение, SE – стандартная ошибка, P – уровень значимости.
ML-филогенетическая реконструкция продемонстрировала разделение всех гаплотипов A. fortis на три обособленные клады с высокими бутстреп поддержками (рис. 2). Эти клады соответствуют филогенетическим линиям NORTH, SOUTH и GX, выделенным ранее на территории Китая (Gao et al., 2017). Все гаплотипы дальневосточных полевок с территории России, выявленные в ходе данной работы, принадлежали к линии NORTH.
Рис. 2.
Дендрограмма филогенетических отношений контрольного региона мтДНК дальневосточной полевки. GX, SOUTH и NORTH – филогенетические линии (по: Gao et al., 2017). HN, FJ–1 и FJ–2 – группы внутри линии SOUTH; MAIN и ISL – группы внутри линии NORTH.
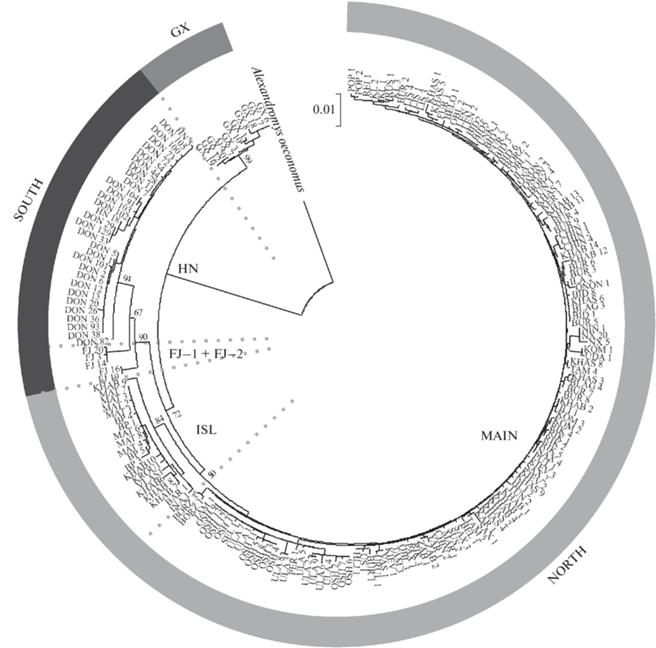
В пределах линии SOUTH можно выделить три субклады: HN, FJ−1 и FJ−2 (рис. 2 и 3). Гаплотипы этих групп, так же как и линии GX, имеют четкую географическую локализацию. При этом гаплотипы, относящиеся к сильно дифференцированным субкладам FJ−1 и FJ−2, были обнаружены у особей из одной локальной популяции в провинции Фуцзянь, Китай (Gao et al., 2017). Показатели гаплотипического и нуклеотидного разнообразия в субкладах линии SOUTH и в пределах линии GX не превышают значений 0.723 и 0.0053 соответственно, что значительно ниже, чем для вида в целом (табл. 2).
Рис. 3.
Филогенетическая сеть гаплотипов контрольного региона мтДНК дальневосточной полевки. GX, SOUTH и NORTH – филогенетические линии (по: Gao et al., 2017). HN, FJ–1 и FJ–2 – группы внутри линии SOUTH; MAIN и ISL – группы внутри линии NORTH.
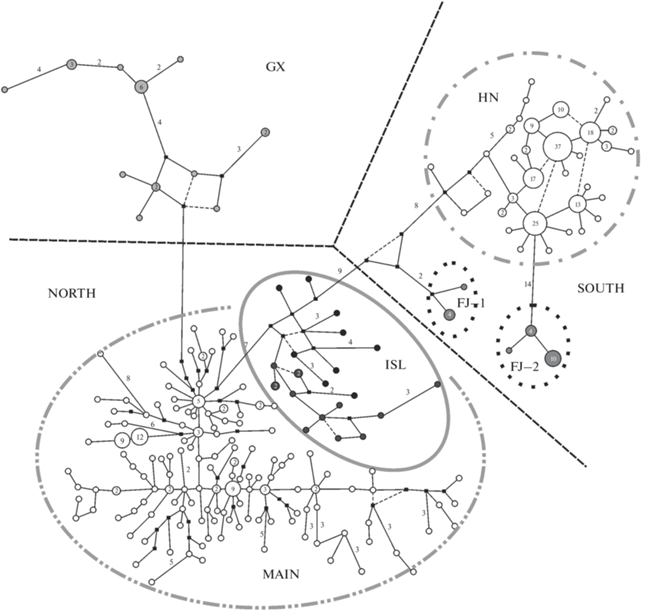
В пределах линии NORTH как на филогенетическом дереве, так и на медианной сети можно выделить две субклады: MAIN и ISL (рис. 3). При этом показатели гаплотипического разнообразия в субкладах MAIN и ISL остаются высокими (0.972 и 0.957 соответственно), тогда как значения нуклеотидного разнообразия ниже (0.0082 и 0.0065 соответственно), чем для вида в целом (табл. 2). Распределение гаплотипов в субкладах MAIN и ISL не имеет четкой географической локализации. В северной части ареала вида преимущественно обитают особи, имеющие гаплотипы субклады MAIN. Доля полевок с гаплотипами субклады ISL составляет только 11% от всех особей линии NORTH.
Значение D Tajima для всех субклад за исключением линии GX было отрицательным, однако значимым оно было только для групп линии NORTH. Результаты теста Фу (Fu’s F) на селективную нейтральность для всех субклад были не только отрицательными, но и высоко достоверно отличались от нуля, что свидетельствует в пользу гипотезы роста численности в прошлом (табл. 2).
Распределение попарных нуклеотидных различий между гаплотипами полевок для групп HN, MAIN и ISL имело унимодальную форму, при этом только для группы HN пик приходится на начало шкалы (рис. 4). Распределение попарных нуклеотидных различий между гаплотипами особей в популяции провинции Фуцзянь характеризуется бимодальным распределением, что является следствием смешивания гаплотипов субклад FJ−1 и FJ−2. Присутствие пика в области минимальных различий в субкладах HN, FJ−1 и FJ−2 предполагает внезапный рост популяции с эффектом основателя.
Рис. 4.
Частота (ось ординат) попарных нуклеотидных различий (ось абсцисс) в филогенетических группах дальневосточной полевки с применением модели роста-уменьшения популяции. Наблюдаемая частота обозначена сплошной линией, ожидаемое распределение – пунктирной линией.
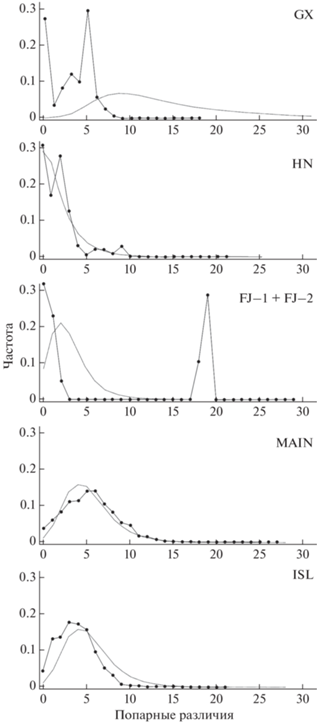
Небольшие значения условного времени экспансии τ, а также низкие и статистически недостоверные значения суммы отклонений SSD свидетельствуют в пользу гипотезы роста численности для популяций всех исследуемых субклад кроме FJ−1 (табл. 3).
Таблица 3.
Показатели демографической экспансии филогрупп Alexandromys fortis
| Показатель | GX | SOUTH | NORTH | |||
|---|---|---|---|---|---|---|
| FJ–1 | FJ–2 | HN | MAIN | ISL | ||
| τ | 6.6 | 0.0 | 0.7 | 2.1 | 6.2 | 4.7 |
| θ0 | 0.00 | 0.00 | 0.00 | 0.54 | 2.05 | 1.42 |
| θ1 | 13.32 | 99 999 | 99 999 | 25.63 | 50.70 | 92.34 |
| SSD(P) | 0.012(0.57) | 0.32(0.000) | 0.006(0.57) | 0.002 (0.38) | 0.005(0.87) | 0.009(0.27) |
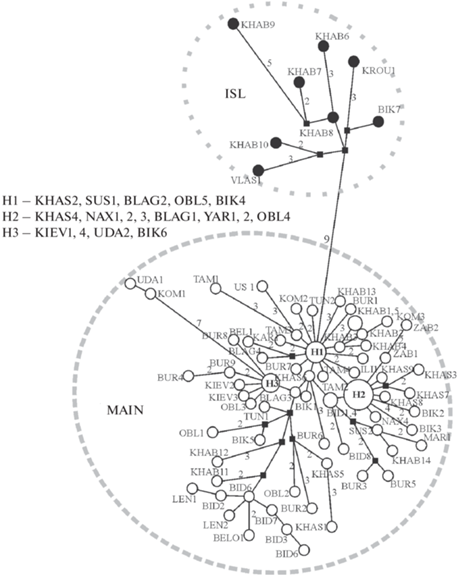
Распределение гаплотипов филогенетических субклад на материковой части юга Дальнего Востока России. Для определения филогенетических отношений гаплотипов A. fortis на юге Дальнего Востока России построена медианная сеть (рис. 5). Обнаруженные у исследованных особей варианты гаплотипов относятся к двум субкладам: MAIN и ISL. При этом доля особей с гаплотипами субклады MAIN значительно выше в сравнении с ISL (91.2 и 8.8% соответственно). Образующие отдельную группу гаплотипы ISL были обнаружены в выборках из окрестностей городов Хабаровск (KHAB) и Бикин (BIK), а также в выборке из нижнего Приамурья (окрестности пос. Власьево, VLAS) и западного Приморья (окрестности с. Кроуновка, KROU) (табл.1). Гаплотипы субклады MAIN группируются на сети в структуру, близкую к звездчатой, большинство их были уникальными (т.е. выявлены только у одной особи), однако обнаружено три гаплотипа (H1, H2 и H3), которые встречались у трех и более особей из разных удаленных друг от друга выборок. Гаплотип H1 на сети имеет центральное положение. В целом, гаплотипы этой субклады не формировали групп в соответствии с их географической принадлежностью.
Рис. 5.
Филогенетическая сеть гаплотипов мтДНК Alexandromys fortis дальневосточной части ареала (материк). Размеры кружков пропорциональны количеству образцов с данным гаплотипом. Гаплотипы обозначены в соответствии с кодами выборок в табл. 1. Цифры на ветвях сети соответствуют числу нуклеотидных замен, превышающему 2.
Распределение гаплотипов филогенетических субклад на дальневосточных островах. Медианная сеть (рис. 6), построенная для гаплотипов дальневосточных полевок из островных популяций, также выявила их принадлежность к двум субкладам: MAIN и ISL. К субкладе ISL относятся гаплотипы полевок островов Матвеева (MAT) и Большой Пелис (BP) архипелага Римского-Корсакова Японского моря, а к группе MAIN – гаплотипы полевок всех остальных островов залива Петра Великого Японского моря и о-ва Сахалин.
Рис. 6.
Филогенетическая сеть гаплотипов мтДНК Alexandromys fortis с островов залива Петра Великого и Сахалин. Размеры кружков пропорциональны количеству образцов с данным гаплотипом. Гаплотипы обозначены в соответствии с кодами выборок в табл. 1. Цифры на ветвях сети соответствуют числу нуклеотидных замен, превышающему 2.
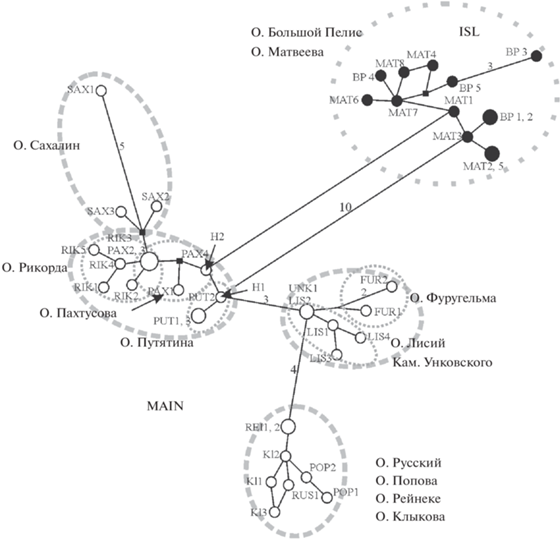
Гаплотипы островных полевок, относящиеся к субкладе MAIN, формируют на сети четыре группы. В первую группу вошли особи с островов Рикорда (RIK), Пахтусова (PAX) и Путятина (PUT). В эту же группу попадают два гаплотипа (H1 и H2), которые часто встречаются у полевок в материковых популяциях Дальнего Востока, при этом гаплотип H1 сохранился в популяции о-ва Путятина, а гаплотип H2 – на о-ве Пахтусова. Следует отметить, что полевки островов Рикорда и Пахтусова имеют один общий гаплотип. Это, вероятно, связано с тем, что предковая популяция полевок этих островов была единой. Во вторую группу вошли гаплотипы особей с о-ва Сахалин, при этом два из них отличаются от общего гаплотипа островов Рикорда и Пахтусова только двумя заменами, тогда как различия между сахалинскими гаплотипами достаточно велики (до шести нуклеотидных замен). Третью группу образуют гаплотипы полевок с островов Лисий (LIS), Камни Унковского (UNK), а также значительно удаленного от них о-ва Фуругельма (FUR). Особи островов Лисий и Камни Унковского имеют общий гаплотип. Четвертую группу составляют гаплотипы особей четырех близлежащих островов архипелага Императрицы Евгении: Русский (RUS), Попова (POP), Рейнеке (REI) и Клыкова (KL).
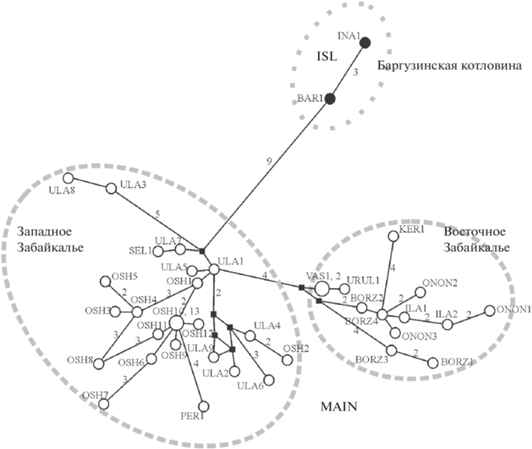
Распределение гаплотипов филогенетических субклад в Забайкалье. Бо́льшая часть гаплотипов исследованных животных из Забайкалья (Бурятия, Забайкальский край) также относится к субкладе MAIN (рис. 7). На филогенетической сети они сформировали две группы в соответствии с их географической принадлежностью: Восточное и Западное Забайкалье. Лишь одна особь из Восточного Забайкалья (окрестности пос. Первомайский, PER) имела гаплотип, близкий особям Западного Забайкалья. Гаплотипы субклады ISL обнаружены только у обеих особей, отловленных в Бурятии, в Баргузинской котловине (окрестности с. Баргузин, BAR и окрестности с. Ина-соел, INA). К сожалению, эти выборки были слишком малы, и утверждать, что здесь отсутствуют полевки с гаплотипом субклады MAIN, нельзя.
Рис. 7.
Филогенетическая сеть гаплотипов мтДНК Alexandromys fortis забайкальской части ареала. Размеры кружков пропорциональны количеству образцов с данным гаплотипом. Гаплотипы обозначены в соответствии с кодами выборок в табл. 1. Цифры на ветвях сети соответствуют числу нуклеотидных замен, превышающему 2.
ОБСУЖДЕНИЕ
Результаты проведенного нами анализа изменчивости нуклеотидных последовательностей контрольного региона A. fortis подтвердили наличие трех филогенетических линий (NORTH, SOUTH и GX), выделенных ранее (Gao et al., 2017). При этом, как отмечалось в указанной работе, филогенетическая линия GX является наиболее древней. Филогенетическая линия NORTH – эволюционно самая молодая и наиболее распространенная, она отмечена на большей части ареала.
В настоящей работе нами впервые показано, что линия NORTH разделена на две сестринские филогенетические субклады, обозначенные нами как MAIN и ISL. Гаплотипы первой из них имеют широкое географическое распространение, тогда как гаплотипы второй приурочены к островам архипелага Римского-Корсакова Японского моря (Большой Пелис и Матвеева) и Баргузинской котловине в Бурятии, а также с небольшой частотой встречаются в материковых популяциях на юге Дальнего Востока России, прежде всего в бассейне нижнего Амура. Следует отметить, что гаплотипы субклады ISL на территории Китая обнаружены не были, но, возможно, это обусловлено небольшим числом исследованных выборок и особей. Популяции островов Большой Пелис и Матвеева, а также, возможно, Баргузинской котловины в настоящее время не контактируют с популяциями основной части ареала, сохраняя один (ISL) тип мтДНК.
В литературе, в том числе посвященной млекопитающим Северо-Восточной Азии (Matsuhashi et al., 2001; Abramson et al., 2012; Ye et al., 2015), имеются примеры сходных геногеографических паттернов, когда на краях ареала какого-либо вида обнаруживаются редкие филогенетические линии (как наряду с основной линией, так и фиксировано), не встреченные в основной части ареала. Традиционно такую филогеографическую картину объясняют обусловленными изменениями климата, флуктуациями границ ареалов видов в плейстоцене. Заселение отдельных участков ареалов происходит линиями, сформировавшимися в разных рефугиумах. Как известно, резкие колебания климата в плейстоцене, особенно в последний ледниковый максимум (21 000–18 000 л.н.), оказывали сильное влияние на географическое распространение и генетическое разнообразие многих видов умеренного пояса в Северном полушарии (Hewitt, 2000). Несмотря на отсутствие крупного четвертичного оледенения на территории Восточной Азии, климатические колебания на данной территории были весьма значительными. Так, известно, что климат северной части субтропического Китая (между 32° и 45° с.ш.) был холоднее, по крайней мере, на 7–10°С и суше по сравнению с климатом в настоящее время (Xiangjun, Yinshuo, 1991). В результате климатических изменений ареалы многих видов умеренного пояса сократились за счет их северной части до макрорефугиумов на юге, где региональный климат был приемлем для существования. После последнего ледникового максимума многие виды повторно заселили северные территории, которые они занимали ранее, причем в ряде случаев экспансия происходила гораздо быстрее, чем предсказывают ее модели (Clark et al., 2003; Magri, 2008). Известно, что многие современные представители фауны Восточной Азии распространились из ледниковых рефугиумов, находящихся в Северо-Восточном Китае и на Корейском п-ове (Xie, Zhang, 2005; Zhang et al., 2008; Sakka et al., 2010; Aizawa et al., 2012; Kim et al., 2018; Lee, et al., 2018; Choi et al., 2020).
Самая ранняя находка A. fortis (600–700 тыс. л.н.) известна из отложений раннего плейстоцена пещеры Choukoutien в Центральном Китае (Zheng, Li, 1990), поэтому этот вид, несомненно, претерпел неоднократные значительные изменения в своем распространении и численности, следуя за глобальными климатическими колебаниями в течение плейстоцена. Интересно, что A. fortis отмечается в отложениях позднего плейстоцена на о-ве Мияко (Япония), хотя в современной фауне острова не встречается (Kaneko, Hasegawa, 1995). Кавамура (Kawamura, 2014) предположил, что A. fortis мигрировал с континента на о-в Мияко в среднем плейстоцене. В этот период ареал дальневосточной полёвки был значительно шире современного, 30–24 тыс. л.н. она была обычным, широко распространенным видом на юге Дальнего Востока (Алексеева, Голенищев, 1986; Панасенко, Тиунов, 2010) и встречалась в Юго-Западном Забайкалье (Тологой, верхняя толща) (Алексеева, 2005). Начиная с 24–21 тыс. л.н. численность вида резко сокращалась вплоть до начала голоцена (10 тыс. л.н.) в связи с похолоданием (Панасенко, Тиунов, 2010); вместо дальневосточной полевки в раскопках начинают преобладать полевка Максимовича и лемминги. В этот период отмечался последний климатический минимум, среднегодовые температуры были ниже современных на 8–12°С при небольшом количестве осадков – 400–500 мм в год (Короткий и др., 1996). Бо́льшая часть популяций дальневосточной полевки сместилась, вероятно, значительно южнее, где она сохранялась в рефугиумах вместе с другими видами (Aizawa et al., 2012; Kim et al., 2018; Sakka et al., 2010; Zhang et al., 2008). На большей части Забайкалья популяции A. fortis были уничтожены огромным ледниково-подпрудным озером (“Витимское море”), которое существовало в период Сартанского оледенения, 28–12.5 тыс. л.н. (Еникеев, Старышко, 2009). После 10 тыс. л.н. начинаются резкий подъем численности (Панасенко, Тиунов, 2010) и восстановление ареала дальневосточной полевки. После деградации “Витимского моря” освободившаяся от него территория Забайкалья, возможно, была вторично заселена дальневосточными полевками из южных регионов двумя путями: первый путь проходил по бассейну р. Селенга, а второй – вдоль р. Амур и ее притоков. Таким образом, популяции A. fortis Восточного и Западного Забайкалья могли сформироваться независимо друг от друга. Эта гипотеза подтверждается морфологическими данными, согласно которым полевки, обитающие в Восточном и Западном Забайкалье, принадлежат к разным подвидам (Фетисов, 1940): в Западном Забайкалье встречается исключительно полевка Михно (A. f. michnoi), а в Восточном Забайкалье обитает форма, близкая к дальневосточному подвиду (A. f. pelliceus). Кроме того, на различия между A. fortis Восточного и Западного Забайкалья указывают и сведения об изменчивости гетерохроматиновых блоков в хромосомах (Ковальская и др., 1991).
Полученные нами данные по изменчивости контрольного региона у дальневосточной полевки подтвердили опубликованные ранее результаты, свидетельствующие о существовании крупного макрорефугиума на территории Северо-Восточного Китая (Gao et al., 2017). Существование двух субклад MAIN и ISL в филогенетической линии NORTH и неравномерность распределения соответствующих им линий можно рассматривать в свете нескольких гипотез: с одной стороны, как свидетельство более древнего (анцестрального) полиморфизма, что (с учетом небольшой генетической дистанции между субкладами ISL и MAIN) позволяет допустить нерефугиальное происхождение их гаплотипов вследствие случайной утраты промежуточных вариантов. С другой стороны, можно предположить заселение краевых участков ареала из двух рефугиумов, в которых независимо сформировались гаплотипы субклад MAIN и ISL, а неравномерность их распределения можно объяснить генетико-автоматическими процессами. Например, снижением встречаемости гаплотипов субклады ISL на большей части ареала со временем и случайной их фиксацией в небольших изолированных популяциях.
В случае с дальневосточной полёвкой мы имеем возможность детализировать историю формирования генетической структуры вида, привлекая для сравнения данные анализа древней ДНК из ископаемых образцов. Ранее нами было проведено сравнение древней мтДНК, которая была выделена из палеоматериала, взятого из разновозрастных слоев пещеры Медвежий Клык (Haring et al., 2015), и мтДНК от дальневосточных полевок из современных популяций островов залива Петра Великого Японского моря (Шереметьева, 2020). В результате было показано, что все древние гаплотипы, так же как и современные, делятся на две субклады, MAIN и ISL, имея фиксированные отличия по 4 сайтам (длина анализируемого фрагмента для древних гаплотипов – 344 п. н.). При этом отмечено, что все древние гаплотипы субклады ISL, схожие с гаплотипами современных полевок архипелага Римского-Корсакова, были выявлены в более старых останках (>40 и >30 тыс. л. н.). Возможно, что обитавшие на территории юга Приморского края полевки в период 30–24 тыс. л. н. имели, в основном, гаплотипы субклады ISL (Шереметьева, 2020), но впоследствии были “вытеснены” гаплотипами субклады MAIN. Как предполагалось выше, это могло произойти в результате случайных генетико-автоматических процессов. Но нам представляется возможным рассмотреть филогенетические паттерны у A. fortis также с позиций гипотезы микрорефугиумов или “загадочных рефугиумов” (Rull, 2009). Существование множественных микрорефугиумов предполагалось несколькими авторами у разных видов животных в континентальной части Восточной Азии (Bao et al., 2015; Zeng et al., 2015; Ye et al., 2019). Важной характеристикой микрорефугиума является стабильный микроклимат, который достаточно отличается от климатических условий окружающего региона, чтобы способствовать сохранению вида (Hampe, Jump, 2011). Эта гипотеза предполагает, их небольшой размер, поскольку они локальны и окружены неподходящими местами обитания. Микрорефугиумы могут находиться в защищенных местах, например в глубоко изрезанных долинах рек и озер. Эти долины обеспечивают микроклимат, способствующий выживанию видов (Stewart, Lister, 2001). Также микрорефугиумы могут находиться на морском побережье, где климат более влажный и с меньшей сезонной изменчивостью (Stewart et al., 2010). При этом, согласно результатам исследований, микрорефугиумы достаточно трудно идентифицировать даже по генетическим данным. Следует также отметить, что не все виды способны сохраняться в микрорефугиумах (Hylander et al., 2015), поскольку малые изолированные популяции особо подвержены негативному воздействию инбридинга и демографических колебаний численности (Примак, 2002). Однако дальневосточная полевка способна длительно существовать даже в очень маленьких популяциях благодаря механизмам регуляции плотности населения (Катин, 1989). Такие малые популяции мы можем наблюдать и сейчас на мелких островах залива Петра Великого. Вероятно, эта особенность имеет глубокие эволюционные корни, поскольку она характерна и для других видов серых полевок (Lomolino, 1986).
Следуя теории микрорефугиумов, можно предположить, что во время последнего климатического минимума, при смещении основного ареала дальневосточных полёвок на юг, небольшая часть особей удерживалась в прежних (расположенных севернее) местообитаниях со стабильным микроклиматом, прежде всего, на морском побережье, где оставались луговые сообщества, и именно в этих небольших изолятах сохранились гаплотипы субклады ISL. Свидетельства существования микрорефугиумов мы можем наблюдать на изолированных шельфовых островах залива Петра Великого (Матвеева и Большой Пелис) – именно тех, которые раньше отделились от материка (Велижанин, 1976; Шереметьев, 2001). Следы существования микрорефугиумов могут быть обнаружены и на других островах архипелага Римского-Корсакова в заливе Петра Великого. По крайней мере, на двух о-вах Дурново и Де-Ливрона у дальневосточных полевок были отмечены особенности морфотипической изменчивости антероконидной формы первого нижнего моляра по сравнению с другими островными и материковой популяциями (Винокурова и др., 2022). Предполагать наличие микрорефугиумов у дальневосточной полевки можно также в бассейне нижнего течения реки Амур и в более континентальной, северо-западной части ареала – в межгорных котловинах Забайкалья, таких как Баргузинская, где в популяциях имеются особи с гаплотипами субклады ISL (рис. 1). Таким образом, микрорефугиумы могли способствовать сохранению гаплотипов субклады ISL в некоторых краевых популяциях как в период климатического минимума, когда произошло исчезновение большинства популяций вида в северной части ареала, так и во время голоцена, когда данные территории были повторно заселены полёвками с гаплотипами субклады MAIN. Однако остается не ясным, почему за время длительной изоляции этих удаленных друг от друга небольших популяций (т.е. при невысокой эффективной численности животных) в них не накопилось заметных различий гаплотипов субклады ISL. Возможно, это обусловлено особенностями биологии вида.
Таким образом, возможны несколько гипотез, объясняющих выявленную в данной работе генетическую изменчивость дальневосточной полевки на территории Забайкалья и Дальнего Востока. Часть из них с большей вероятностью объясняют существование гаплотипов субклад ISL и MAIN в пределах линии NORTH, тогда как роль микрорефугиумов могла заключаться в сохранении гаплотипов субклады ISL в период климатического минимума и после его завершения при широкой экспансии вида на север. Для проверки этих гипотез данная работа нуждается в продолжении как с исследованием материала из ранее неизученных локалитетов, так и с вовлечением в анализ дополнительных молекулярных маркеров.
Список литературы
Алексеева Н.В., 2005. Эволюция природной среды Западного Забайкалья в позднем кайнозое (по данным фауны мелких млекопитающих). Москва: Изд-во ГЕОС. 141 с.
Алексеева Э.А., Голенищев Ф.Н., 1986. Ископаемые остатки серых полевок рода Microtus из южного Приморья (пещера “Близнец”) / Грызуны и зайцеобразные позднего кайнозоя. Л.: Наука. С. 134–142.
Виноградов Б.С., 1933. Млекопитающие СССР. Грызуны. Л.: Изд-во АН СССР. 157 с.
Винокурова М.А., Гусев А.Е., Тиунов М.П., 2022. Сравнительный морфотипический анализ первых нижнекоренных зубов островных и ископаемых популяций восточной полевки Alexandromys fortis (Büchner, 1889) юга Дальнего Востока России (Приморский край) // Зоологический журнал. Т. 101. № 2. С. 213–227.
Велижанин А.Г., 1976. Время изоляции материковых островов северной части Тихого океана // Доклады Академии наук СССР. Т. 231. № 1. С. 205–207.
Воронов Г.А., 1992. Microtus fortis (Rodentia, Cricetidae) – новый вид фауны о-ва Сахалин // Зоологический журнал. Т. 71. № 4. С. 85–88.
Громов И.М., Ербаева М.А., 1995. Млекопитающие фауны России и сопредельных территорий. Зайцеобразные и грызуны. Санкт-Петербург. 520 с.
Громов И.М., Поляков И.Я., 1977. Фауна СССР: Млекопитающие. Т. III. Вып. 8. Полевки (Microtinae). Л.: Наука. 504 с.
Гуськов В.Ю., Шереметьева И.Н., 2012. Генетическая изменчивость и дифференциация малых островных популяций дальневосточной полевки Microtus fortis Buchner, 1889 (Rodentia, Cricetidae) // Растительный и животный мир островов северо-западной части Тихого океана (Материалы Международного курильского и Международного сахалинского проектов). Владивосток. С. 388–395.
Еникеев Ф.И., Старышко В.Е., 2009. Гляциальный морфогенез и россыпеобразование Восточного Забайкалья. Чита: ЧитГУ. 370 с.
Катин И.О., 1989. Динамика популяций дальневосточной полевки в условиях островной изоляции // Териологические исследования на юге Дальнего Востока. Владивосток: Изд-во ДВО АН СССР. С. 89–99.
Ковальская Ю.М., Анискин В.М., Картавцева И.В., 1991. Географическая изменчивость по С-гетерохроматину восточной полевки Microtus fortis (Rodentia, Cricetidae) // Зоологический журнал. Т. 70. № 12. С. 97−103.
Короткий А.М., Гребенникова T.A, Пушкарь В.С., 1996. Климатические смены на территории юга Дальнего Востока в позднем кайнозое (миоцен-плейстоцен). Владивосток: Дальнаука. 158 с.
Костенко В.А., 2000. Грызуны (Rodentia) Дальнего Востока России. Владивосток: Дальнаука. 208 с.
Лукашкин А.С., 1975. Монгольские элементы в фауне млекопитающих Северной Манчжурии // Зоологический журнал. Т. 54. № 10. С. 1578−1581.
Огнев С.И., 1950. Звери СССР и прилежащих стран. Т. 7. Грызуны. М.-Л.: Изд. Госиздат. 706 с.
Панасенко В.Е., Тиунов М.П., 2010. Население мелких млекопитающих (Mammalia: Eulipotyphla, Rodentia, Lagomorpha) на южном Сихотэ-Алине в позднем плейстоцене и голоцене // Вестник ДВО РАН. № 4. С. 60–67.
Примак Р., 2002. Основы сохранения биоразнообразия / Пер. с англ. О.С. Якименко, О.А. Зиновьевой. М.: Издательство Научного и учебно-методического центра. 256 с.
Тиунов И.М., Тиунов М.П., Шереметьева И.Н., 2009. Находки на Сахалине монгольской жабы (Bufo raddei) и большой полевки (Microtus fortis) // Зоологический журнал. Т. 88. № 11. С. 1406–1408.
Фетисов А.С., 1940. Определитель грызунов Прибайкалья, Забайкалья. Иркутск: Иркутское обл. изд-во. С. 1−42.
Чугунов Ю.Д., Катин И.О., 1984. Численность и распределение по биотопам грызунов на островах Дальневосточного государственного морского заповедника // Животный мир Дальневосточного морского заповедника. Владивосток: Изд-во ДВНЦ АН СССР. С. 107–121.
Шереметьев И.С., 2001. Формирование наземной териофауны островов залива Петра Великого (Японское море) // Вестник ДВО РАН. № 4. С. 11–22.
Шереметьева И.Н., 2020. Сравнение древних мт ДНК гаплотипов дальневосточной полевки и современных гаплотипов с островных популяций // Генетика. Т. 56. № 7. С. 848–854.
Шереметьева И.Н., Картавцева И.В., Фрисман Л.В., 2006. Кариологическая и аллозимная изменчивость дальневосточной полевки (Microtus fortis, Buchner, 1889 Cricetidae, Rodentia) Дальнего Востока России // Генетика. Т. 42. № 6. С. 833−843.
Шереметьева И.Н., Картавцева И.В., Фрисман Л.В., Васильева Т.В., Аднагулова А.В., 2015. Полиморфизм и генетическая структура полевки Максимовича Microtus maximowiczii (Schrenck 1858) (Rodentia, Cricetidae) Среднего Приамурья по данным секвенирования контрольного региона мтДНК // Генетика. Т. 51. № 10. С. 1154–1162.
Abramson N.I., Petrova T.V., Dokuchaev N.E., Obolenskaya E.V., Lissovsky A.A., 2012. Phylogeography of the Gray Red-backed Vole Craseomys rufocanus (Rodentia: Cricetidae) across the distribution range inferred from nonrecombining molecular markers // Russian Journal of Theriology. V. 11. № 2. P. 137–156.
Aizawa M., Kim Z.-S., Yoshimaru H., 2012. Phylogeography of the Korean pine (Pinus koraiensis) in northeast Asia: inferences from organelle gene sequences // Journal of Plant Research. V. 125. P. 713–723. https://doi.org/10.1007/s10265-012-0488-4
Aljanabi S.M., Martinez I., 1997. Universal and rapid salt extraction of high quality genomic DNA for PCRbased techniques // Nucleic Acids Research. V. 25. № 22. P. 4692–4693. https://doi.org/10.1093/nar/25.22.4692
Bandelt H.J., Forster P., Röhl A., 1999. Median-joining networks for inferring intraspecific phylogenies // Molecular Biology and Evolution. V. 16. № 1. P. 37–48. https://doi.org/10.1093/oxfordjournals.molbev.a026036
Bao L., Kudureti A., Bai W., Chen R., Wang T. et al., 2015. Contributions of multiple refugia during the last glacial period to current mainland populations of Korean pine (Pinus koraiensis) // Scientific Reports. V. 5. P. 18608. https://doi.org/10.1038/srep18608
Batsaikhan N., Tsytsulina K., 2016. Microtus fortis (errata version published in 2017). The IUCN red list of threatened species. e.T13430A115112605. https://doi.org/10.2305/IUCN.UK.2016-3.RLTS. T13430A22350311
Chelomina G.N., Sheremetyeva I.N., 2007.Genetic variation of Microtus fortis pelliceus in mainland and island populations of the Russian Far East based on random amplified polymorphic DNA markers // Mammal Study. V. 32. № 2. C. 63–74. https://doi.org/10.3106/1348-6160(2007)32[63:GVOMFP] 2.0.CO;2
Choi S.K., Kim K.S., Ranyuk M., Babaev E., Voloshina I. et al., 2020. Asiawide phylogeography of wild boar (Sus scrofa) based on mitochondrial DNA and Y-chromosome: Revising the migration routes of wild boar in Asia // PLoS ONE. V. 15. № 8. P. e0238049. https://doi.org/10.1371/journal.pone.0238049
Clark J.S., Fastie C., Hurtt G., Jackson S.T., Johnson C. et al., 2003. Reid’s Paradox of rapid plant migration // BioScience. V. 48. P. 13–24. https://doi.org/10.2307/1313224
Excoffier L., Lischer H.E.L., 2010. Arlequin suite ver 3.5: A new series of programs to perform population genetics analyses under Linux and Windows // Molecular Ecology Resources. № 10. P. 564–567. https://doi.org/10.1111/j.1755-0998.2010.02847.x
Gao J., Yue L., Jiang X., Ni L., Ashraf M.A. et al., 2017. Phylogeographic patterns of Microtus fortis (Arvicolinae: Rodentia) in China based on mitochondrial DNA sequences // Pakistan Journal of Zoology. V. 49. P. 1185− 1195. https://doi.org/10.17582/journal.pjz/2017.49.4.1185.1195
Guo Z., Song P., Guo C., Song Z., Wang Y. et al., 2012. Genetic variation and population dispersal of Yangtze voles Microtus fortis calamorum in the Dongting Lake region // Current Zoology. V. 58. № 2. P. 211–220. https://doi.org/10.1093/czoolo/58.2.211
Hall T.A., 1999. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98 // Nucleic acids symposium series. V. 41. № 41. P. 95–98. https://doi.org/10.1021/bk-1999-0734.ch008
Hampe A., Jump A.S., 2011. Climate Relicts: Past, Present, Future // Annual Review of Ecology, Evolution, and Systematics. V. 42. P. 313–333. https://doi.org/10.1146/annurev-ecolsys-102710-145015
Haring E., Sheremetyeva I., Kryukov A., 2011. Phylogeny of Palearctic vole species (genus Microtus, Rodentia) based on mitochondrial sequences // Mammalian Biology. V. 76. P. 258−267. https://doi.org/10.1016/j.mambio.2010.04.006
Haring E., Voyta L.L., Däubl B., Tiunov M.P., 2015. Comparison of genetic and morphological characters in fossil teeth of grey voles from the Russian Far East (Rodentia: Cricetidae: Alexandromys) // Mammalian Biology. V. 80. P. 496–504. https://doi.org/10.1016/j.mambio.2015.08.001
Hewitt G., 2000. The genetic legacy of the Quaternary ice ages // Nature. V. 405. P. 907–913. doi https://www.nature.com/articles/35016000.pdf
Hylander K., Ehrlén J., Luoto M., Meineri E., 2015. Microrefugia: Not for everyone // AMBIO. V. 44. P. 60–68. https://doi.org/10.1007/s13280-014-0599-3
Kaneko Y., Hasegawa Y., 1995. Some fossil arvicolid rodents from the Pinza-Abu Cave, Miyako Island, the Ryukyu Islands, Japan // Bulletin of the Biogeographical Society of Japan. V. 50. P. 23–37.
Kawamura Y., 2014. Research on Quaternary mammal faunas in Japan and adjacent East Asian areas: a review of my research // The Quaternary Research (Daiyonki-Kenkyu). V. 53. № 3. P. 119–142. https://doi.org/10.4116/jaqua.53.119
Kim S.-I., Park S.-K., Lee H., Oshida T., Kimura J. et al., 2018. Phylogeography of Korean raccoon dogs: implications of peripheral isolation of a forest mammal in East Asia // Zoological Science. V. 35. № 3. P. 249–259. https://doi.org/10.2108/zs170140
Kumar S., Stecher G., Li M., Knyaz C., Tamura K., 2018. MEGA X: Molecular evolutionary genetics analysis across computing platforms // Molecular Biology and Evolution. V. 35. № 6. P.1547–1549. https://doi.org/10.1093/molbev/msy096
Lee S.J., Lee MY., Lin LK., Lin Y.K., Li Y. et al., 2018. Phylogeography of the Asian lesser white-toothed shrew, Crocidura shantungensis, in East Asia: role of the Korean Peninsula as refugium for small mammals // Genetica. № 146. P. 211–226. https://doi.org/10.1007/s10709-018-0014-2
Lissovsky A.A., Petrova T.V., Yatsentyuk S.P., Golenishchev F.N., Putincevet N.I. et al., 2018. Multilocus phylogeny and taxonomy of East Asian voles Alexandromys (Rodentia, Arvicolinae) // Zoologica Scripta. V. 47. № 1. P. 9–20. https://doi.org/10.1111/zsc.12261
Lomolino M.V., 1986. Mammalian community structure on islands: the importance of immigration, extinction and interactive effects // Biological Journal of the Linnean Society. V. 28. P. 1–21.
Magri D., 2008. Patterns of post-glacial spread and the extent of glacial refugia of European beech (Fagus sylvatica) // Journal of Biogeography. V. 35. P. 450–463. https://doi.org/10.1111/j.1365-2699.2007.01803.x
Matsuhashi T., Masuda R., Mano T., Murata K., Aiurzaniin A., 2001. Phylogenetic relationships among worldwide populations of the brown bear Ursus arctos // Zoological Science. V. 18. № 8. 18. P. 1137–1143. https://doi.org/10.2108/zsj.18.1137
Rozas J., Ferrer-Mata A., Sánchez-DelBarrio J.C., Guirao-Rico S., Librado P. et al., 2017. DnaSP 6: DNA sequence polymorphism analysis of large datasets // Molecular Biology and Evolution. V. 34. P. 3299–3302. https://doi.org/10.1093/molbev/msx248
Rull V., 2009. Microrefugia // Journal of Biogeography. V. 36. P. 481–484. https://doi.org/10.1111/j.1365-2699.2008.02023.x
Sakka H., Quere J.P., Kartavtseva I.V., Pavlenko M., Chelomina G. et al., 2010. Comparative phylogeography of four Apodemus species (Mammalia: Rodentia) in the Asian Far East: evidence of Quaternary climatic changes in their genetic structure // Biological Journal of the Linnean Society. V. 100. P. 797–821.
Shenbrot G.I., Krasnov B.R., 2005. An atlas of the geographic distribution of the arvicoline rodents of the world (Rodentia, Muridae: Arvicolinae). Sofia: Pensoft. 336 p.
Stewart J.R., Lister A.M., 2001. Cryptic northern refugia and the origins of modern biota // Trends in Ecology & Evolution. V. 16. P. 608–613. https://doi.org/10.1016/S0169-5347(01)02338-2
Stewart J.R., Lister A.M., Barnes I., Dale’n L., 2010. Refugia revisited: individualistic responses of species in space and time // Proceedings of the Royal Society B: Biological Sciences. V. 277. P. 661–671. https://doi.org/10.1098/rspb.2009.1272
Xiangjun S., Yinshuo C., 1991. Palynological records of the last 11,000 years in China // Quaternary Science Reviews. V. 10. P. 537–544. https://doi.org/10.1016/0277-3791(91)90047-X
Xie J., Zhang Z., 2005. Mitochondrial Dna phylogeography of populations of Cricetulus triton in the north China plain // Journal of Mammalogy. V. 86. № 4. P. 833–840. https://doi.org/10.1644/1545-1542(2005)0862.0.CO;2
Ye J., Xiao Z., Li C., Wang F., Liao J., Fu J., Zhang Z., 2015. Past climate change and recent anthropogenic activities affect genetic structure and population demography of the greater longtailed hamster in northern China // Integrative Zoology. V. 10. P. 482–496. https://doi.org/10.1111/1749-4877.12150
Ye J.-W., Zhang Z.-K., Wang H.-F., Bao L., Ge J.-P., 2019. Phylogeography of Schisandra chinensis (Magnoliaceae) reveal multiple refugia with ample gene flow in northeast China // Frontiers in Plant Science. V. 10. P. 199. https://doi.org/10.3389/fpls.2019.00199
Zeng Y.-F., Wang W.-T., Liao W.-J., Wang H.-F., Zhang D.-Y., 2015. Multiple glacial refugia for cool-temperate deciduous trees in northern East Asia: the Mongolian oak as a case study // Molecular Ecology. V. 24. № 22. P. 5676– 5691. https://doi.org/10.1111/mec.13408
Zhang H., Yan J., Zhang G., Zhou K., 2008. Phylogeography and demographic history of chinese black-spotted frog populations (Pelophylax nigromaculata): evidence for independent refugia expansion and secondary contact // BMC Evolutionary Biology. V. 8. P. 21. https://doi.org/10.1186/1471-2148-8-21
Zheng S., Li C., 1990. Comments on fossil Arvicolines of China // International Symposium on Evolution, Phylogeny and Biostratigraphy of Arvicolines. In eds: Fejfar O., Heinrich W.D. Praha: Geological Survey. P. 431–442.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


