Зоологический журнал, 2022, T. 101, № 12, стр. 1416-1423
Генетический мониторинг разведения и реинтродукции эндемика России стерха (Leucogeranus leucogeranus, Gruidae)
Е. А. Мудрик a, *, Т. А. Кашенцева b, **, К. А. Постельных b, ***, Д. В. Политов a, ****
a Институт общей генетики имени Н.И. Вавилова РАН
119991 Москва, Россия
b Питомник редких видов журавлей, Окский государственный природный биосферный заповедник
391071 Рязанская область, Брыкин Бор, Россия
* E-mail: mudrik@vigg.ru
** E-mail: tk.ocbc@mail.ru
*** E-mail: kirill_cbc@mail.ru
**** E-mail: dmitri.p17@gmail.com
Поступила в редакцию 26.05.2022
После доработки 27.06.2022
Принята к публикации 08.07.2022
- EDN: WHDBYY
- DOI: 10.31857/S0044513422110095
Аннотация
Искусственная популяция стерха (Leucogeranus leucogeranus) существует в России более 40 лет. На данный момент эта популяция представлена 13 основателями природного происхождения и 17 производителями из первого и второго поколений, размножающихся в основном с помощью искусственного осеменения. С 2010 г. с использованием молекулярно-генетических маркеров мы осуществляем мониторинг процессов разведения и реинтродукции стерха, проводя анализ генетического разнообразия и родства в разных поколениях популяции; устанавливая отцовство у птенцов, полученных в результате множественного искусственного осеменения, и определяя пол у особей на разных стадиях индивидуального развития. Всего по микросателлитным локусам получены генотипы 304 особей стерха. Показано, что в группе производителей из первого и второго поколений сохраняется высокий уровень гетерозиготности, свойственный основателям, однако наблюдаются снижение аллельного разнообразия и увеличение степени родства. Установлено отцовство для 135 особей, идентификация пола проведена для 225 потомков. Показано, что первичное (на момент оплодотворения) и вторичное (на момент вылупления) соотношения самцов и самок в потомстве стерхов при вольерном разведении не отличаются от равновесия 1 : 1. Восполнена недостающая информация по полу и отцовству в Международной племенной книге стерха, в том числе ретроспективно по коллекции подскорлуповых оболочек и образцов от погибших или выпущенных в природу птиц. В целом, в современном поголовье производителей первого и второго поколений в искусственной популяции стерха в России поддерживается высокое генетическое разнообразие, однако в связи с ростом показателей родства и инбридинга в потомстве, старением и естественной убылью основателей и недостаточным репродуктивным успехом молодых производителей необходимо обогащение генофонда данной популяции за счет новых птиц из природы или неродственных особей из других центров разведения или зоопарков.
Для успешного разведения редких видов животных, особенно с целью реинтродукции их потомства в природу, требуются поддержание и обогащение исходного генофонда в созданных для этого искусственных популяциях. При размножении небольшого количества особей возникают угрозы близкородственных скрещиваний, которые приводят к снижению генетического разнообразия, усилению инбредной депрессии, патологиям индивидуального развития потомства и общему снижению его адаптивных возможностей. Для предупреждения таких неблагоприятных процессов необходимо осуществлять контроль над размножением и мониторинг состояния генофонда в разных поколениях искусственных популяций (Lacy, 1994; Ivy, Lacy, 2010).
Стерх (Leucogeranus leucogeranus Pallas 1881) – один из самых редких журавлей мира, находящийся под угрозой исчезновения (BirdLife International, 2018). Это эндемик Российской Федерации, гнездящийся в низменных тундрах северо-восточной Якутии (восточная популяция) и в бассейне нижней Оби (западная популяция) (Флинт, Кищинский, 1975; Meine, Archibald, 1996). Восточная популяция достаточно стабильна – по состоянию на 2020 г. минимальная оценка ее численности составляет 5.5 тыс. особей (Арчибальд, 2021). Западная популяция, насчитывавшая около 20 птиц в конце 1990-х гг. (Meine, Archibald, 1996; Сорокин и др., 2000), к настоящему времени практически исчезла (Mirande, Ilyashenko, 2019; Арчибальд, 2021). С целью создания резервного генофонда стерха, в период 1980–1996 гг. в России, США и Европе были сформированы три размножающиеся искусственные популяции, маточное поголовье которых выращено из яиц, полученных большей частью из природы Восточной Якутии (Stewart, 1987; Панченко, Кашенцева, 1995). Вся история разведения и учет стерхов, содержащихся в неволе, регистрируется в Международной племенной книге этого вида (Kashentseva, Belterman, 2014).
Ядро российской искусственной популяции стерха содержится в Питомнике редких видов журавлей (далее – Питомник), созданном в 1979 г. на базе Окского государственного природного биосферного заповедника для получения и выращивания птенцов с целью их выпуска в места обитания западной популяции. С 1988 г. стерхи регулярно размножаются в Питомнике самостоятельно и с применением методов повышения продуктивности (Панченко, Кашенцева, 1995; Кашенцева, Роздина, 2002; Кашенцева, 2005, 2006). От этой группы происходят все стерхи, содержащиеся в зоопарках и центрах разведения России и ближнего зарубежья. На данный момент маточное поголовье в Питомнике представлено 24 особями, из которых 13 принадлежат к основателям природного происхождения, а 11 являются производителями из первого и второго поколений, полученных от основателей. За более чем 40-летний период существования этой популяции, последнее обогащение ее генофонда за счет поступления новых особей из природы происходило 26 лет назад, а поддержание генетического разнообразия в ней осуществлялось только благодаря контролю над размножением. Данный контроль заключается не только в формировании пар самостоятельно размножающихся птиц, но в большей степени – в подборе доноров спермы для искусственного осеменения самок, в том числе от нескольких самцов, что увеличивает эффективность размножения и позволяет получать потомство от более широкого спектра производителей (Кашенцева и др., 2019).
С 2010 г. мы осуществляем генетический мониторинг процессов, связанных с оптимизацией размножения и сохранением генофонда искусственной популяции стерха в России. С использованием молекулярно-генетических методов мы оцениваем уровни генетического разнообразия и показатели родства в разных поколениях и у отдельно взятых пар птиц; устанавливаем отцовство у птенцов, полученных в результате множественного искусственного осеменения самок спермой разных доноров, определяем пол потомства и осуществляем индивидуальную идентификацию птиц. Эти мероприятия необходимы для выращивания генетически здорового потомства стерхов, способного воспроизводиться в неволе и выживать, адаптироваться, мигрировать и размножаться в природе при реинтродукции.
Цель работы – обзор результатов генетического мониторинга размножения и реинтродукции искусственной популяции стерха в 2010–2021 гг., а также анализ современного состояния ее генофонда в России с применением молекулярно-генетических методов.
МАТЕРИАЛЫ И МЕТОДЫ
Биологический материал
Материалом для исследований в период 2010–2021 гг. служили индивидуальные неинвазивные биологические образцы (аллантоисы подскорлуповых оболочек после вылупления птенцов, замершие эмбрионы, растущие перья, кровь, мышечные ткани от погибших птиц) от 304 особей стерхов, относящихся к искусственной популяции стерха в России. Это число включает 37 особей, из которых была сформирована исходная популяция (35 особей из природы Западной и Восточной Сибири, а также две птицы из Международного фонда охраны журавлей, США, и Парка птиц “Вальсроде”, Германия), и 267 потомков, полученных в Питомнике с 1989 по 2021 гг. К потомкам относятся стерхи, содержащиеся в Питомнике и зоопарках, а также выпущенные в природу и погибшие на разных стадиях развития, включая эмбриональную. Биологический материал от потомков, рожденных в период с 1989 по 2009 гг., был доступен для анализа от 92 особей, а в период 2010–2021 гг. – от всех в количестве 175 (итого 267 потомков). Этот материал использовали для оценки динамики генетической структуры популяции во времени, определения пола и отцовства ретроспективно у потомков, по которым эти данные отсутствовали, и для всех потомков в 2010–2021 гг. Всего отцовство было установлено у 135 особей, диагностика пола проведена для 233 стерхов.
Оценку генофонда современной искусственной популяции по состоянию на 2021 г. осуществляли в общей выборке размножающихся стерхов из 30 особей, содержащихся в Питомнике (24 особи – 12 самок и 12 самцов), Московском (2), Ивановском (2) и Ярославском (2) зоопарках (по самцу и самке в каждом). Из этих 30 птиц к группе основателей относятся 13 особей из природы: 4 из западной и 9 из восточной популяций. Остальные 17 стерхов являются их потомками в первом (F1) и втором (F2) поколениях. Производителей из этих поколений объединили в одну группу для анализа изменений, произошедших в генетической структуре поголовья, постепенно сменяющего основателей, по сравнению с исходным генофондом, свойственным птицам из природы.
Молекулярно-генетический и статистический анализ
Выделение ДНК из биологических образцов осуществляли с использованием ионообменной смолы Chelex100 (Walsh et al., 1991) или набором DIAtom™ DNAPrep100 (ООО “Лаборатория Изоген”, Москва, Россия). Полученную геномную ДНК использовали для последующей ПЦР-амплификации аллелей микросателлитных локусов и маркера пола с помощью набора реагентов GenPak PCR Core (OOO “Лаборатория Изоген”). Оценку генетического разнообразия, индивидуальную идентификацию, анализ отцовства и родства осуществляли на основе 8 полиморфных микросателлитных локусов: GjM15, GjM34 (Hasegawa et al., 2000), Gpa12, Gpa38, Gpa39 (Meares et al., 2008), Gram22, Gram30 (Jones et al., 2010) и Gj2298 (Zou et al., 2010). Методика анализа микросателлитных локусов, их изменчивость у стерха, количество и размер аллелей охарактеризованы нами ранее (Мудрик и др., 2011, 2014, 2014а), так же как и методика анализа отцовства и определения сроков переживания спермы (Мудрик и др., 2016). В качестве молекулярно-генетического маркера пола использовали специфическую последовательность W-хромосомы EE0.6 по адаптированной для журавлей методике Бао с соавторами (Bao et al., 2009), надежно различающей самцов и самок стерха (Мудрик и др., 2013, 2013а). Параметры генетического разнообразия (средне число аллелей на локус, уровни ожидаемой и наблюдаемой гетерозиготности, коэффициент инбридинга) и родства по методу Queller, Goodnight (1989) рассчитывали в надстройке для электронной таблицы MS Excel – GenAlEx 6.501 (Peakall, Smouse, 2012).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Генетическая структура искусственной популяции стерха в России
Основатели искусственной популяции стерха природного происхождения характеризуются высоким уровнем генетического разнообразия по микросателлитным локусам, который в целом сохранен в выборке производителей из первого и второго поколений (табл. 1). Так, обе группы размножающихся птиц демонстрируют близкий высокий уровень наблюдаемой гетерозиготности, который в среднем составляет НО = 0.768 ± 0.043. Группа основателей, представленных особями из подразделенной природной популяции, находится в равновесном состоянии генотипов – внутрипопуляционный коэффициент инбридинга в ней почти равен нулю (FIS = –0.001). В выборке производителей из F1 и F2 отмечен небольшой избыток гетерозигот (13.5%, FIS = –0.135), связанный с пониженным значением ожидаемой гетерозиготности (НЕ = 0.687 ± 0.030) по сравнению с наблюдаемой (НО = 0.787 ± 0.057). Эта группа также характеризуется меньшим числом аллелей на локус (NA) по сравнению с основателями за счет утраты шести уникальных аллелей (Gram30 178, Gram30 182, Gpa38 174, GjM15 112, Gj2298 178, Gj2298 205), однако она унаследовала от одного из умерших основателей два редких аллеля (Gpa12 218, Gpa38 190), которые на данный момент не представлены в выборке птиц природного происхождения (табл. 2).
Таблица 1.
Параметры генетического разнообразия в группах основателей искусственной популяции стерха и производителей из первого (F1) и второго (F2) поколений по микросателлитным локусам
| Группа | N | NA | HO | HE | FIS |
|---|---|---|---|---|---|
| Основатели | 13 | 6.4 | 0.750 ± 0.068 | 0.741 ± 0.038 | –0.001 |
| Производители F1 и F2 | 17 | 5.9 | 0.787 ± 0.057 | 0.687 ± 0.030 | –0.135 |
| В среднем | 6.2 | 0.768 ± 0.043 | 0.714 ± 0.024 | –0.068 |
Таблица 2.
Аллельное разнообразие и частоты аллелей микросателлитных локусов в группах основателей искусственной популяции стерха и производителей из первого (F1) и второго (F2) поколений
| Локус | Аллель | Основатели (N = 13) |
Производители F1 и F2 (N = 17) |
|---|---|---|---|
| Gram22 | 160 | 0.654 | 0.412 |
| 164 | 0.038 | 0.059 | |
| 168 | 0.154 | 0.235 | |
| 172 | 0.154 | 0.294 | |
| Gram30 | 178 | 0.038 | 0 |
| 182 | 0.038 | 0 | |
| 186 | 0.115 | 0.059 | |
| 190 | 0.115 | 0.088 | |
| 194 | 0.269 | 0.412 | |
| 198 | 0.308 | 0.294 | |
| 202 | 0.077 | 0.118 | |
| 210 | 0.038 | 0.029 | |
| Gpa12 | 202 | 0.192 | 0.088 |
| 206 | 0.269 | 0.147 | |
| 210 | 0.308 | 0.265 | |
| 214 | 0.231 | 0.412 | |
| 218 | 0 | 0.088 | |
| Gpa38 | 170 | 0.269 | 0.088 |
| 174 | 0.077 | 0 | |
| 178 | 0.385 | 0.676 | |
| 182 | 0.154 | 0.176 | |
| 186 | 0.115 | 0.029 | |
| 190 | 0 | 0.029 | |
| Gpa39 | 86 | 0.192 | 0.059 |
| 90 | 0.077 | 0.029 | |
| 102 | 0.308 | 0.471 | |
| 104 | 0.077 | 0.206 | |
| 106 | 0.077 | 0.029 | |
| 108 | 0.038 | 0.059 | |
| 112 | 0.038 | 0.029 | |
| 116 | 0.115 | 0.059 | |
| 120 | 0.077 | 0.059 | |
| GjM15 | 100 | 0.077 | 0.206 |
| 104 | 0.385 | 0.529 | |
| 106 | 0.077 | 0.029 | |
| 108 | 0.269 | 0.118 | |
| 110 | 0.154 | 0.118 | |
| 112 | 0.038 | 0 | |
| GjM34 | 138 | 0.269 | 0.353 |
| 140 | 0.462 | 0.324 | |
| 144 | 0.115 | 0.147 | |
| 146 | 0.154 | 0.176 | |
| Gj2298 | 145 | 0.077 | 0.088 |
| 151 | 0.115 | 0.324 | |
| 154 | 0.038 | 0.029 | |
| 157 | 0.077 | 0.059 | |
| 160 | 0.115 | 0.294 | |
| 163 | 0.077 | 0.029 | |
| 166 | 0.192 | 0.029 | |
| 169 | 0.154 | 0.118 | |
| 172 | 0.077 | 0.029 | |
| 178 | 0.038 | 0 | |
| 205 | 0.038 | 0 |
Отрицательное значение коэффициента родства в группе основателей из природы свидетельствует о том, что основатели неродственны (R = = ‒0.076). В выборке производителей из F1 и F2 данный показатель был положительным (R = 0.034) и достоверно отличался от такового у основателей (рис. 1), что указывает на повышенную и очевидную степень генетического родства новых поколений производителей и нарастание инбридинга. Тем не менее значение этого показателя удалось снизить для производителей из F1 и F2 за счет пополнения этой группы новыми особями (на данный момент их 17) по сравнению с 2014 г., когда в ней было восемь птиц и коэффициент их родства составлял R = 0.164 (Мудрик и др., 2014а).
Рис. 1.
Средние значения показателя родства R и границы 95% доверительных интервалов, определенных с помощью 1000 бутстрэп-повторов, в выборках основателей искусственной популяции стерха и производителей из поколений F1 и F2.
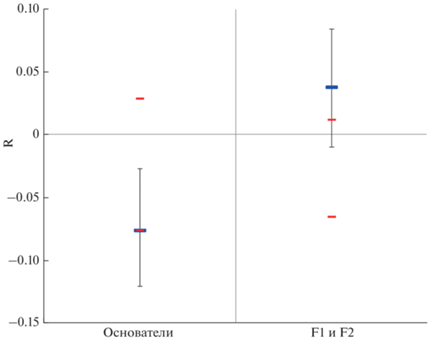
В других поколениях потомков, большая часть которых была выпущена в природу на места гнездования и пролета западной популяции стерха, отмечали снижение аллельного разнообразия, а в выборке, состоящей только из потомков поколения F2, коэффициент родства был максимальным и находился на уровне сибсов (R = 0.320) (Мудрик и др., 2014а). В связи с этим производителей из разных поколений размножают в разных комбинациях, в том числе с неродственными основателями, чтобы получить максимально возможное генетически разнообразное потомство, неотягощенное последствиями инбридинга.
Предотвращение инбридинга и анализ отцовства
Скрещивания неродственных стерхов в современной искусственной популяции стерха с каждым годом осуществлять сложнее, поскольку в разведении используются уже три поколения родственников. Из 30 птиц четыре пары (8 особей) скрещиваются самостоятельно – это одна пара основателей в Питомнике и три пары производителей из F1 и F2 в зоопарках. Остальные 22 особи содержатся в Питомнике парами, однако их скрещивают как между собой, так и перекрестно с помощью искусственного осеменения, вовлекая в этот процесс птиц из всех поколений. При этом для повышения успеха размножения каждую самку осеменяют многократно, используя сперму разных самцов-доноров. Такие меры вызваны малым количеством эякулята, часто недостаточным для осеменения самки, низкой продуктивностью (в норме один птенец за сезон размножения), сложным половым поведением, чувствительностью к внешним условиям и подверженностью стрессам, затрудняющим размножение у журавлей в целом, и у стерха в особенности (Gee, Mirande, 1996; Кашенцева и др., 2019).
Осеменение самок проводят весной в период размножения с периодичностью в 2–3 дня до получения нужного количества яиц для искусственной инкубации или насиживания родителями или приемными семьями. До внедрения молекулярно-генетических методов в процесс разведения стерха, при последовательном осеменении самки спермой разных доноров отцом птенца считался самец, чью сперму использовали за двое суток до откладки оплодотворенного яйца. Однако, поскольку сперматозоиды журавлей могут некоторое время сохранять жизнеспособность в половых путях самки (переживание) (Максудов, 2006), установить отцовство у птенцов, полученных в результате множественного искусственного осеменения, можно только с помощью ДНК-анализа. Срок переживания сперматозоидов в половых путях самки, осемененной спермой одного самца, может доходить до шести суток, а в условиях конкуренции сперматозоидов, когда самку последовательно осеменяют спермой разных доноров, это время может достигать максимальных для журавлей сроков – 15 суток (Мудрик и др., 2016). С использованием микросателлитного анализа нами было установлено отцовство у 135 особей (птенцов и эмбрионов), полученных в результате искусственного осеменения.
Важность установления отцовства у потомков диктуется не только необходимостью внесения этой информации в племенную книгу. Главным образом это необходимо для понимания того, как использовать птиц для будущего размножения в неволе или для учета генетических линий, выпущенных в природу, в случае реинтродукции. Иногда в искусственном осеменении происходили ошибки, и в оплодотворении самок участвовала сперма родственников по вертикальной или горизонтальной линии. Как правило, потомки от таких близкородственных скрещиваний погибали на стадии эмбрионов или в ювенильном возрасте от тяжелых поражений опорно-двигательного аппарата вследствие нарушения обмена кальция (рахита) (Мудрик и др., 2015, 2016). В нескольких случаях инбредные птенцы выживали и внешне нормально развивались, однако таких особей не использовали для размножения и не выпускали в природу.
Молекулярно-генетическая диагностика пола
Определение пола является неотъемлемым элементом процесса разведения, особенно в отношении птиц без выраженного полового диморфизма, к которым относятся журавли. С помощью современных молекулярных маркеров, сцепленных с полом, мы устанавливаем пол стерхов на разных этапах развития, в том числе сразу после вылупления птенцов по ДНК из капиллярных сосудов аллантоиса (Мудрик и др., 2013, 2013а). С целью уточнения полового статуса птенцов и взрослых птиц или первичного определения пола потомков искусственной популяции стерха мы провели диагностику пола у 233 особей. Из них впервые пол был установлен у 169 птенцов и эмбрионов, полученных в период 2010–2021 гг. Первичное соотношение (на момент оплодотворения) самок (81 особь) и самцов (89 особей) в этой выборке было равным и составило 1 : 1.09, соответственно. Также нами были показаны одинаковая смертность эмбрионов обоих полов и отсутствие отклонений во вторичном соотношении (на момент вылупления) самцов и самок у стерха (Мудрик и др., 2015а), что является хорошим показателем воспроизводства этого редкого вида журавлей в искусственно созданных условиях.
ЗАКЛЮЧЕНИЕ
Использование молекулярно-генетических маркеров качественно повышает возможности контролирования процесса разведения стерха и позволяет получать нужную информацию о родственных связях размножающихся птиц, инбридинге, отцовстве и половой принадлежности потомков, в том числе ретроспективно. Так, в шестой выпуск МПК стерха (Kashentseva, Belterman, 2014) нами были внесены 16 исправлений отцовства и 15 исправлений пола для птиц, включенных в предыдущие издания МПК.
В целом, согласно нашим исследованиям, современное поголовье производителей первого и второго поколений в искусственной популяции стерха в России удалось сформировать таким образом, что в нем сохранился высокий уровень гетерозиготности, свойственный основателям, однако потери отдельных аллелей и генетическое родство в поколениях новых производителей постепенно увеличиваются. Обеднение аллельного разнообразия и возрастание уровня инбридинга отражаются на генетической структуре их потомков, реинтродуцируемых в места гнездования и пролета западной популяции стерха.
В результате естественной убыли и старения за последнее десятилетие поголовье основателей сократилось и стало менее продуктивным, а некоторые птицы 30–40-летнего возраста вовсе перестали размножаться. При этом новое поколение производителей еще не достигло пика своих репродуктивных возможностей и его потенциала может оказаться недостаточно для получения нужного количества жизнеспособных птенцов для реинтродукции и поддержания генофонда искусственной популяции стерха, хотя генетический контроль над размножением и усилия по повышению генетического качества потомства в имеющихся условиях предпринимаются постоянно. В связи с этим в настоящее время искусственная популяция стерха в России нуждается в обогащении генофонда за счет новых птиц из природы или неродственных особей из других центров разведения или зоопарков. В то же время проведённые исследования показали эффективность генетического мониторинга разведения стерхов, который нужно продолжать и в будущем.
Список литературы
Арчибальд Д., 2021. Статус журавлей мира в 2021 г. // Журавли Евразии (распространение, биология). Вып. 6. С. 31–67.
Кашенцева Т.А., 2005. Питомник редких видов журавлей: прошлое и настоящее / Окский заповедник (история, люди, природа). Рязань: Русское слово. С. 138–169.
Кашенцева Т.А., 2006. Успешность разведения стерхов в неволе // Журавли Евразии (биология, охрана, разведение). Вып. 2. С. 221–233.
Кашенцева Т.А., Роздина О.И., 2002. Вольерное разведение журавлей // Журавли Евразии (распределение, численность, биология). С. 271–277.
Кашенцева Т.А., Постельных К.А., Постельных Т.В., Мудрик Е.А., 2019. Искусственное осеменение журавлей – путь к сохранению генетического разнообразия ex situ // Научные исследования в зоологических парках. № 34. С. 17–28.
Максудов Г.Ю., 2006. Экологические аспекты длительного переживания сперматозоидов в половых путях самок журавлей // Журавли Евразии (биология, охрана, разведение). Вып. 2. С. 57–60.
Мудрик Е.А., Кашенцева Т.А., Политов Д.В., 2011. Генетическое разнообразие и мультилокусное генотипирование стерха по микросателлитным локусам // Журавли Евразии (биология, распространение, миграции, управление). Вып. 4. С. 81–87.
Мудрик Е.А., Кашенцева Т.А., Гамбург Е.А., Гаврикова Е.Ю., Политов Д.В., 2013. Неинвазивный метод идентификации пола птенцов журавлей по ДНК из капиллярных сосудов аллантоиса // Онтогенез. Т. 44. № 5. С. 372–376.
Мудрик Е.А., Кашенцева Т.А., Гамбург Е.А., Политов Д.В., 2013а. Определение пола у десяти видов журавлей с помощью ДНК-маркера ЕЕ0.6 // Генетика. Т. 49. № 12. С. 1254–1257.
Мудрик Е.А., Кашенцева Т.А., Гамбург Е.А., Политов Д.В., 2014. Генетическая паспортизация и идентификация стерхов (Grus leucogeranus Pallas) в искусственно созданных условиях // Известия РАН. Серия биологическая. Т. 41. № 3. С. 219–227.
Мудрик Е.А., Кашенцева Т.А., Постельных К.А., Носаченко Г.В., Политов Д.В., 2014а. Генетическое разнообразие и родство в разных поколениях искусственной популяции стерха (Grus leucogeranus Pallas) // Генетика. Т. 50. № 11. С. 1345–1353.
Мудрик Е.А., Кашенцева Т.А., Политов Д.В., 2015. Интеграция молекулярно-генетических подходов в программу создания резервного генофонда редкого вида журавлей стерха (Grus leucogeranus Pallas) // Успехи современной биологии. Т. 135. № 2. С. 139–147.
Мудрик Е.А., Кашенцева Т.А., Постельных К.А., Носаченко Г.В., Политов Д.В., 2015а. Соотношение полов в потомстве искусственной популяции стерха (Grus leucogeranus Pallas) // Генетика. Т. 51. № 12. С. 1439–1443.
Мудрик Е.А., Кашенцева Т.А., Политов Д.В., 2016. Длительное сохранение сперматозоидов у стерха (Grus leucogeranus Pallas): анализ отцовства и родства при искусственном осеменении // Онтогенез. Т. 47. № 3. С. 131–137.
Панченко В.Г., Кашенцева Т.А., 1995. Размножение журавлей в питомнике Окского заповедника // Научные основы охраны и рационального использования птиц. Рязань: Русское слово. С. 236–270.
Сорокин А.Г., Маркин Ю.М., Панченко В.Г., Шилина А.П., 2000. Современное состояние и работы по сохранению западной и центральной популяций стерха // Научный вестник. Вып. 4. С. 74–84.
Флинт В.Е., Кищинский А.А., 1975. Стерх (Grus leucogeranus Pallas, 1773) в Якутии // Зоологический журнал. Т. 54. № 8. С. 1197–1212.
Bao W.B., Wu S.L., Zhang H.X., 2009. Sex identification of seven species of cranes in China by PCR // Journal of Animal and Veterinary Advances. V. 8. № 6. P. 1137–1140.
BirdLife International, 2018. Leucogeranus leucogeranus. The IUCN Red List of Threatened Species 2018: e.T22692053A134180990. https://doi.org/10.2305/IUCN.UK.2018-2.RLTS.T22692-053A134180990.en
Gee G.F., Mirande C.M., 1996. Special techniques, Part A: Crane artificial insemination // Cranes: their biology, husbandry, and conservation. P. 205–217.
Hasegawa O., Ishibashi Y., Abe S., 2000. Isolation and characterization of microsatellite loci in the Red-crowned crane Grus japonensis // Molecular Ecology. V. 9. P. 1677–1678.
Ivy J.A., Lacy R.C., 2010. Using molecular methods to improve the genetic management of captive breeding programs for threatened species // Molecular approaches in natural resource conservation and management. DeWoody J.A. et al., editors. Cambridge: Cambridge University Press. P. 267–295.
Jones K.L., Henkel J.R., Howard J.J., Lance S.L., Hagen C., Glenn T., 2010. Isolation and characterization of 14 polymorphic microsatellite DNA loci for the endangered Whooping crane (Grus americana) and their applicability to other crane species // Conservation Genetic Resources. V. 2. № 1. P. 251–254.
Kashentseva T.A., Belterman R., 2014. Siberian Crane – Grus leucogeranus International Studbook. Oka State Biosphere Nature Reserve. Russia. 184 p.
Lacy R.C., 1994. Managing genetic diversity in captive populations of animals // Restoration of endangered species. Bowles M.L., Whelan C.J., editors. Cambridge: Cambridge University Press. P. 63–89.
Meares K., Dawson D., Horsburgh G., Perrin M., Burke T., Taylor T., 2008. Characterisation of 14 blue crane Grus paradisea (Gruidae, AVES) microsatellite loci for use in detecting illegal trade // Conservation Genetics. V. 9. P. 1363–1367.
Meine C.D., Archibald G.W., 1996. The cranes: status survey and conservation action plan. Gland, Cambridge: IUCN. 294 p.
Mirande C., Ilyashenko E.I., 2019. Siberian crane (Leucogeranus leucogeranus) // Crane conservation strategy. Mirande C.M., Harris J.T., editors. Baraboo, Wisconsin, USA: International Crane Foundation. P. 209–222.
Peakall R., Smouse P.E., 2012. GenAlEx 6.5: genetic analysis in Excel. Population genetic software for teaching and research – an update // Bioinformatics. V. 28. № 19. P. 2537–2539.
Stewart J.M., 1987. The ‘lily of birds’: the success story of the Siberian white crane // Oryx. V. 21. № 1. P. 6–10.
Queller D.C., Goodnight K.F., 1989. Estimating relatedness using genetic markers // Evolution. V. 43. № 2. P. 258–275.
Walsh P.S., Metzger D.A., Higuchi R., 1991. Chelex-100 as a medium for simple extraction of DNA for PCR-based typing from forensic material // Biotechniques. V. 10. № 4. P. 506–513.
Zou H.F., Dong H.Y., Kong W.Y., Ma J.H., Liu J.H., 2010. Characterization of 18 polymorphic microsatellite loci in the red-crowned crane (Grus japonensis), an endangered bird // Animal Science Journal. V. 81. № 4. P. 519–522.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


