Зоологический журнал, 2022, T. 101, № 12, стр. 1424-1428
Новый вид летучей мыши Eptesicus pachyomus (Chiroptera, Vespertilionidae) в фауне России
М. П. Тиунов a, *, А. А. Проскурякова b, А. К. Батурина b, П. Л. Перельман b, А. С. Графодатский b
a Федеральный научный центр биоразнообразия наземной биоты Восточной Азии ДВО РАН
690022 Владивосток, Россия
b Институт молекулярной и клеточной биологии СО РАН
630090 Новосибирск, Россия
* E-mail: tiunov@biosoil.ru
Поступила в редакцию 29.04.2022
После доработки 15.06.2022
Принята к публикации 16.06.2022
- EDN: RJZUST
- DOI: 10.31857/S004451342212011X
Аннотация
Приведены сведения о летучей мыши, которая была отловлена на юге Приморья и которая оказалась новым видом для России. По данным сравнительно-морфометрического и молекулярно-генетического анализов по двум ключевым регионам митохондриальной ДНК (цитохром b и NADH дегидрогеназы), нами было выявлено, что летучая мышь принадлежит к виду Eptesicus pachyomus, ареал которого распространяется от Ирана до Кореи. Описываемая летучая мышь по данным генотипирования выделяется в отдельную ветвь внутри вида E. pachyomus. Сравнительно-морфометрический анализ показал, что полученный образец ближе к подвиду E. p. pallens, хотя для достоверного определения подвида требуется подробное филогеографическое исследование внутри вида E. pachyomus.
Глобальное потепление климата привело к обогащению фауны юга Дальнего Востока России. В 2019 г. на территории национального парка “Земля леопарда” (Приморский край, Россия) был зарегистрирован корейский водяной олень (Hydropotes inermis argyropus Heude 1884), расселившийся с Корейского п-ова (Дарман и др., 2019). В настоящее время в Хасанском р-не существует устойчивая группировка этого вида численностью около 170 особей (Дарман, Седаш, 2020). В 2015 г. на территории Дальневосточного морского заповедника впервые зарегистрирован залет питты-нимфы (Pitta nympha Temminck et Schlegel 1850) (Глущенко, Коробов, 2015). Ранее, при анализе видового состава обитающих в Приморье рукокрылых (Тиунов и др., 2021), было высказано предположение о вероятном появлении в ближайшее время на этой территории новых видов. В данной работе мы приводим сведения о морфологических и генетических особенностях отловленной на юге Приморья летучей мыши, оказавшейся новым видом для России.
МАТЕРИАЛ И МЕТОДЫ
Тридцатого мая 2020 г. на п-ове Краббе (42°35′54″ N, 130°54′13″ E) сотрудником базы отдыха Е.А. Кравцовой была подобрана поранившая крыло летучая мышь. По фотографии (рис. 1А), летучая мышь была предварительно определена как Eptesicus serotinus (Schreber 1774). В районе базы отдыха каждый вечер наблюдали охотящихся летучих мышей. Второго июля здесь была отловлена самка этого же вида (рис. 1B). Образец был зафиксирован в 70% этаноле для дальнейшего камерального изучения. Предварительно были взяты пробы на молекулярный анализ.
Рис. 1.
Внешний вид Eptesicus pachyomus: A – Eptesicus pachyomus, пойманный 13.05.2020 г. (фото выполнено Е.А. Кравцовой); B – Eptesicus pachyomus, пойманный 02.07.2020 г. (фото выполнено М.П. Тиуновым).

Выделение ДНК проводили при помощи стандартного фенол-хлороформного метода (Higuchi et al., 1988; Maniatis et al., 1989). Для определения видовой принадлежности по сиквенсу были амплифицированы два участка митохондриальной ДНК, ранее использованные в исследованиях летучих мышей рода Eptesicus (Juste et al., 2013): фрагменты генов цитохрома b (CytB) и NADH дегидрогеназы (ND). Для амплификации этих последовательностей были использованы праймеры: ND-f (5'-CCTCGATGTTGGATCAGG-3') и ND-r (5'-GTATGGGCCCGATAGCTT-3') (Mayer, von Helversen, 2001) и CytB-f (5'-ACTCTTTCTAGCCATGCACTAC-3'), CytB-r (5'-ACCCGGTTTCGTGTAAGAATAG-3'). Праймеры для цитохрома b были подобраны с использованием сервиса IDT. Ожидаемый размер ПЦР продукта для фрагмента гена NADH составлял 1427 п.н. и CytB 470 п.н.
Амплификацию регионов митохондриальной ДНК проводили помощью стандартной ПЦР. Амплификация проводилась по следующей схеме: денатурация в течение 5 мин при 95°C, 30 циклов амплификации (15 с при 95°C, отжиг праймеров 30 с при 55°C для ND и 53°C для CytB, 90 с при 72°C), финальная наработка продукта проводилась в течение двух минут при 72°C. Очистку полученных ПЦР-продуктов проводили с использованием стандартного набора ExoSAP-IT (Thermo-Fisher). С очищенным продуктом проводили реакцию с использованием стандартного набора BrightDye (Thermo-Fisher). Продукт реакции очищали с использованием BigDye XTerminator Purification Kit (Thermo Fisher) и далее производили секвенирование по Сэнгеру (капиллярный секвенатор 3500 Genetic Analyzer, Applied Biosystems).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для определения видовой принадлежности обнаруженного индивида был проведен молекулярно-генетический анализ образца по двум регионам митохондриальной ДНК: фрагментам генов цитохрома b (CytB) и NADH дегидрогеназы (ND). Полученные последовательности фрагментов генов ND (ON310507) и CytB (ON310508) сравнили c последовательностями других представителей рода Eptesicus (из базы данных GenBank): E. serotinus turcomanus, E. s. serotinus, E. pachyomus pallens, E. p. andersoni, E. p. pachyomus, E. ognevi, E. bottae omanensis, E. b. innesi и Myotis lucifugus, Myotis myotis, Vespertilio murinus, Rhyneptesicus nasutus matschiei, R. n. batinensis в качестве внешней группы. Последовательности митоходриальных генов Myotis lucifugus взяты из работы Isidoro-Ayza et al., 2018 (MG851810, MG851800), остальные последовательности – из филогенетического исследования Juste et al., 2013. При помощи программы MEGA последовательности генов были выровнены и построено филогенетическое древо на основе объединенной последовательности двух генов (CytB и ND) методом присоединения соседей (Neighbor joining) после 1000 итераций (рис. 2).
Рис. 2.
Филогенетическое древо, построенное на основании сравнения конкатенированных последовательностей фрагментов генов NADH дегидрогеназы и цитохрома b методом присоединения соседей (Neighbor joining) при 1000 итераций. Исследуемый образец обозначен Eptesicus pachyomus sp. (выделен синим цветом). Последовательности митохондриальных генов других видов летучих мышей из базы данных GenBank: Myotis lucifugus из работы Isidoro-Ayza et al., 2019 (MG851810, MG851800), остальные последовательности из филогенетического исследования Juste et al., 2013, номера животных сохранены из оригинального исследования.
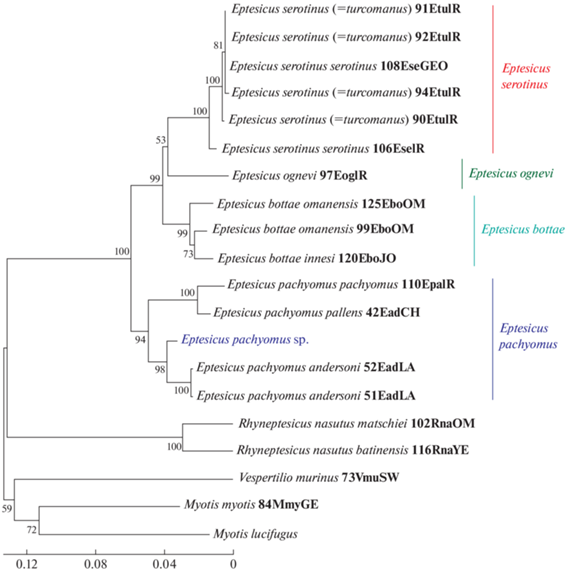
На основе сравнения последовательностей ДНК можно утверждать, что описываемая нами летучая мышь принадлежит роду Eptesicus (рис. 2). Также на полученном филогенетическом древе изучаемый образец входит в ветвь вида E. pachyomus (поддержка 94).
Из четырех подвидов, выделяемых в составе E. pachyomus (andersoni, pallens, pachyomus и horikawai), в базе данных NCBI имеются последовательности фрагментов митохондриальной ДНК только для первых трех подвидов. Однако проведенные филогенетические построения не позволяют однозначно определить, к какому подвиду принадлежит исследуемый образец. На филогенетическом древе исследуемый нами образец E. pachyomus ssp. кластеризуется с поддержкой 98 E. p. andersoni, что указывает на принадлежность к подвидовому комплексу andersoni в рамках вида E. pachyomus. Интересно, что последовательности фрагмента гена цитохрома b исследуемой здесь летучей мыши имеет большое сходство с последовательностями летучих мышей из Китая (MG570068.1) – 99.27% и Гонконга (KFBG_HZ0123, Ades et al., 2018) – 99.2%, однако при проведении филогенетического анализа исследованный нами экземпляр из Приморья и летучие мыши из Китая и Гонконга не образуют единой клады.
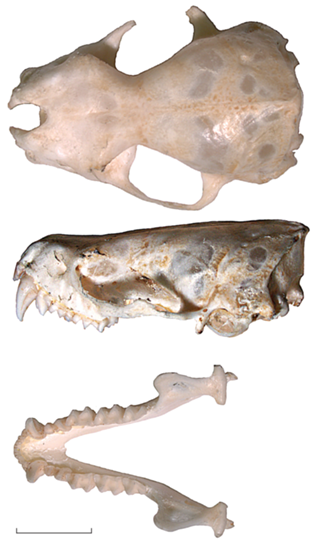
От близкого по размерам Vespertilio sinensis (Peters 1880), встречающегося на юге Дальнего Востока России в летний период, добытый нами экземпляр отличается, в первую очередь, строением козелка и более крупным черепом. У V. sinensis козелок короткий булавовидный, заметно расширенный в предвершинной части. У рассматриваемого экземпляра козелок высокий и прямой, наиболее широк у основания.
Основные морфометрические параметры (мм) добытого экземпляра следующие: длина головы и тела 59.0, длина хвоста 47.8, длина предплечья 50.3, длина уха 14.6, длина козелка 5.7, длина ступни 11.9, наибольшая длина черепа 20.7, кондилобазальная длина черепа 19.6, межглазничная ширина 4.7, ширина мозговой капсулы 9.1, наибольшая ширина черепа 10.8, длина верхнего ряда зубов 7.4, длина нижнего ряда зубов 8.2, длина нижней челюсти 15.3. В отличие от V. sinensis, у которого задний край передненёбной вырезки достигает линии, соединяющей передние грани больших переднекоренных зубов, у рассматриваемого экземпляра носовая вырезка небольшая, задний край передненёбной вырезки не достигает линии, соединяющей задние грани клыков (рис. 3).
В настоящее время считается, что на востоке Азии обитает E. pachyomus (Tomes 1857), ранее рассматривавшийся в качестве подвида или группы подвидов E. serotinus (Simmons, 2005) и признаваемый самостоятельным видом большинством современных авторов (Juste et al., 2013). При этом отдельные авторы считают, что его статус пока окончательно не определен, поскольку данные анализа яДНК противоречат данным митохондриальной филогении и больше поддерживают гипотезу о существовании единого видового комплекса E. serotinus s. l. (Артюшин др., 2018).
В составе E. pachyomus выделяют четыре подвида – E. p. pachyomus (Tomes 1857), E. p. andersoni (Dobson 1871), E. p. horikawai (Kishida 1924) и E. p. pallens (Miller 1911) (Juste et al., 2013; Ruedi et al., 2018; Wilson, Mittermeier, 2019). К подвиду Eptesicus p. pachyomus относят кожанов, обитающих в Пакистане, Индии, Непале, Иране и, возможно, в Мьянме (Smith, Xie, 2008; Benda et al., 2012; Juste et al., 2013; Ades et al., 2018), к подвиду E. p. horikawai – кожанов, встречающихся на Тайване (Smith, Xie, 2008; Huang et al., 2020), к подвиду E. p. andersoni – кожанов, распространенных в Лаосе. А также в южных и юго-восточных провинциях Китая (Smith, Xie, 2008; Juste et al., 2013), к подвиду E. p. pallens – кожанов, обитающих в Корее, северо-восточных и центральных провинциях Китая (Smith, Xie, 2008; Jo et al., 2018).
По однотонной светло-каштановой окраске шерстного покрова (Allen, 1938), размерам тела и черепа (рис. 1, 3) добытая нами особь ближе к подвиду E. p. pallens.
Обнаруженный нами E. pachyomus, вероятно, мог появиться на территории России, прилетев с территории КНДР или северных провинций Китая (Хэйлунцзян, Цзилинь). Основной рельеф полуострова представляет собой холмогорье с луговой растительностью, рединами и кустарником. Места летних убежищ у этого вида связаны обычно с постройками человека, но на полуострове подобных мест не обнаружено и, возможно, здесь местами укрытиями в дневной период могут являться расщелины и гроты в скальных обрывах на морском побережье.
Список литературы
Артюшин И.В., Крускоп С.В., Лебедев В.С., Банникова А.А., 2018. Молекулярная филогения кожанов (Mammalia, Chiroptera, Eptesicus) c акцентом на исторической эволюции и таксономии видовой группы E. serotinus // Известия РАН (Серия биологическая). № 5. С. 527–536.
Глущенко Ю.Н., Коробов Д.В., 2015. Питта-нимфа Pitta nympha – представитель нового для фауны России семейства птиц // Русский орнитологический журнал. Т. 24. Экспресс-вып. 1154. С. 2084–2086.
Дарман Ю.А., Седаш Г.А., 2020. Корейский водяной олень (Hydropotes inermis argyropus Heude, 1884): очерк для включения нового вида в Красную книгу Российской Федерации // Редкие виды биоты. № 3. С. 35–40.
Дарман Ю.А., Сторожук, В.Б., Седаш Г.А., 2019. Hydropotes inermis (Cervidae) – новый вид для фауны России из национального парка “Земля леопарда” (Россия) // Nature Conservation Research. Заповедная наука. Т. 4. № 3. С. 127–129.
Тиунов М.П., Крускоп С.В., Орлова М.В., 2021. Рукокрылые Дальнего Востока России и их эктопаразиты. М.: Перо. 191 с.
Ades G.W.J., Zhang G., Crow P., Ki W.Y., Fok W.L., 2018. A new locality record for the asian serotine bat Eptesicus pachyomus // Kadoorie Farm and Botanic Garden (KFBG), Publication Series № 15.
Allen G.M., 1938. The mammals of China and Mongolia (Natural History of Central Asia, V. 11) (W. Granger, ed.). Central Asiatic Expeditions of the American Museum of Natural History, New York. Part 1. 620 p.
Benda P., Faizolachi K., Andreas M., Obuch J., Reiter A., Sevcik M., Uhrin M., Vallo P., Ashrafi S., 2012. Bats (Mammalia: Chiroptera) of the Eastern Mediterranean and Middle East. Pt 10. Bat fauna of Iran // Acta Soc. Zool. Bohem. V. 76. P. 163–582.
Higuchi R., von Beroldingen C.H., Sensabaugh G.F., Erlich H.A., 1988. DNA typing from hairs // Nature. V. 332. P. 543–546.
Huang J.C.-C., Ho Y.-Y., Kuo H.-C., 2020. Illustrated field keys to the bats (Mammalia: Chiroptera) of Taiwan // Journal of Threatened Taxa. V. 12. № 6. P. 15 675–15 710. https://doi.org/10.11609/jott.5485.12.6.15675-15710
Isidoro-Ayza M., Jones L., Dusek R.J., Lorch J.M., Landsberg J.H., Wilson P., Graham S., 2019. Mortality of Little Brown Bats (Myotis lucifugus carissima) Naturally Exposed to Microcystin-LR. // J. Wildl. Dis. V. 55. Issue 1. P. 266–269. https://doi.org/10.7589/2018-02-047
Jo Y.-S., Baccus J.T., Koprowski J.L., 2018. Mammals of Korea: a review of their taxonomy, distribution and conservation status // Zootaxa. V. 4522. № 1. 216 p.
Juste J., Benda P., Garcia-Mudarra J.L., Ibáñez C., 2013. Phylogeny and systematics of Old World serotine bats (genus Eptesicus, Vespertilionidae, Chiroptera): an integrative approach // Zoologica Scripta. V. 42. Issue 5. P. 441–457.
Maniatis T., Fritsh E.F., Sambrook J., 1989. Molecular Cloning: A Laboratory Manual, 2nd edn. Cold Spring Harbor: Cold Spring Harbor Laboratory Press. 1659 p.
Mayer F., von Helversen O., 2001. Cryptic diversity in European bats. Proceedings of the Royal Society of London, Series B — Biological Sciences. V. 268. Issue 1478. P. 1825–1832. https://doi.org/10.1098/rspb.2001.1744
Ruedi M., Eger J.L., Lim B.L., Csorba G., 2018. A new genus and species of vespertilionid bat from the Indomalayan Region // Journal of Mammalogy. V. 99. Issue 1. P. 209–222. https://doi.org/10.1093/jmammal/gyx156
Simmons N.B., 2005. Order Chiroptera. Wilson D.E., Reeder D.M. (eds). Mammal species of the World: A taxonomic and geographic reference, 3rd ed. 1. Baltimore: John Hopkins University Press. P. 312–529.
Smith A.T., Xie Y., 2008. A guide to the mammals of China. Princeton, New Jersey: Princeton University Press. 543 p.
Wilson D.E., Mittermeier R.A., 2019. Handbook of the mammals of the world. V. 9. Bats. Barcelona: Lynx Ediciones. 1008 p.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал