Зоологический журнал, 2022, T. 101, № 2, стр. 153-164
Особенности размножения и раннего развития у самого высокогорного земноводного территории бывшего СССР – батурской жабы (Bufotes baturae, Amphibia, Bufonidae) (по результатам лабораторных исследований)
А. А. Кидов a, *, Р. А. Иволга a, Т. Э. Кондратова a, Е. А. Кидова a
a Российский государственный аграрный университет – МСХА имени К.А. Тимирязева
127550 Москва, ул. Тимирязевская, 49, Россия
* E-mail: kidov_a@mail.ru
Поступила в редакцию 30.11.2020
После доработки 31.12.2020
Принята к публикации 31.01.2021
- EDN: HFIOHC
- DOI: 10.31857/S0044513421120060
Аннотация
Батурская жаба (Bufotes baturae) – триплоидный вид, населяющий высокогорья Афганистана, Пакистана и Таджикистана. На Восточном Памире (окрестности оз. Яшилькуль, Мургабский район, Республика Таджикистан) эти животные поднимаются до высоты 3800 м над ур. м., что является самой высокой находкой земноводных на территории бывшего СССР. На верхнем пределе своего распространения B. baturae круглый год придерживаются выходов геотермальных ручьев, где они размножаются и зимуют. Представляется интересным, какие особенности размножения и раннего развития развились у этого вида в условиях высокогорий. Нами в августе 2018 г. в геотермальном источнике урочища Сасык-Булак на южном берегу оз. Яшилькуль были отловлены 8 пар взрослых B. baturae, от которых весной 2019 г. было получено потомство. Длина тела взрослых самок перед икрометанием составляла 58.28–64.17 мм, а масса 25.90–32.93 г, у самцов 53.69–58.75 мм и 17.73–23.92 г. Плодовитость самок 882–1850 яиц. Диаметр зародыша 1.18–2.19 мм. При температуре 16.0–20.5°C длительность инкубации яиц от откладки до выхода предличинок 2–4 сут, а общая продолжительность эмбриогенеза до начала экзогенного питания 8–11 сут. Общая длина тела с хвостом у предличинки при отделении от икряного шнура 2.26–4.31 мм, а у личинки в начале питания 8.73–12.64 мм. Личиночное развитие при 17.5–22.5°C длилось 42–94 сут. Личинки батурской жабы характеризовались относительно других видов рода (B. sitibundus и B. viridis) очень длинным хвостом и черной окраской тела вплоть до начала метаморфоза. Молодые жабы выходили на сушу при длине тела 12.98–18.85 мм. Наблюдалась зависимость между длиной тела молодых жаб и длительностью личиночного развития (r = 0.52, p ≤ 0.05). Таким образом, большинство показателей размножения и раннего развития у батурской жабы не имеет отличий от аналогичных показателей других представителей рода Bufotes. Низкая плодовитость самок B. baturae может объясняться их мелкими размерами. В то же время, авторы считают темную окраску и длинный хвост у личинок этого вида адаптивными признаками для обитания в высокогорных проточных водоемах.
Батурская жаба (Bufotes baturae (Stöck, Schmid, Steinlein et Grosse 1999)), изначально описанная как внутривидовая форма пуштунской жабы (B. pseudoraddei (Mertens 1971)), в настоящее время признается самостоятельным видом (Литвинчук и др., 2012, 2016; Litvinchuk et al., 2011) с облигатной бисексуальной триплоидией (3n) (Боркин и др., 2012). Считается (Литвинчук и др., 2019; Dufresnes et al., 2019), что B. baturae возникла в результате гибридизации предков двух центральноазиатских диплоидных (2n) видов – жабы Латаста (B. latastii (Boulenger 1882)) и жабы Перрена (B. perrini Mazepa, Litvinchuk, Jablonski et Dufresnes 2019). Долгое время распространение вида исследователи ограничивали только территорией северного Пакистана и прилегающими районами Афганистана (Stöck et al., 1999, 2001), однако впоследствии было установлено, что к B. baturae следует относить и триплоидных жаб из Восточного Памира в Таджикистане (Litvinchuk et al., 2011). В таджикской части ареала обитание вида достоверно установлено цитогенетическими методами для трех локалитетов в Горно-Бадахшанской автономной области – кишлаков Ишкашим (Ишкашимский р-н), Лянгар и Булункуль (Мургабский р-н) (Litvinchuk et al., 2011). В окрестностях Булункуля, являющегося одним из наиболее высоко расположенных постоянных населенных пунктов Памира и самой холодной точкой Центральной Азии, батурская жаба известна только из впадающих в оз. Яшилькуль ручьев с геотермальным питанием в урочищах Сасык-Булак и Иссык-Булак (или Суман). Теплая вода источников позволяет повысить выживаемость жаб в период зимовки и ускорить эмбриональное и личиночное развитие в условиях короткого лета в высокогорьях.
Обитающие вокруг Яшилькуля зеленые жабы долгое время привлекали внимание исследователей, так как эта популяция является самой высокогорной у земноводных на территории бывшего СССР (Кузьмин, 2012). Стоит отметить, что Тоймастов (1989) и Писанец (1992) ранее считали их тетраплоидными (4n) данатинскими жабами “Bufo danatensis” (сейчас конспецифична с B. oblongus (Nikolskii 1896) (Dubois, Bour, 2010)). По сведениям Литвинчука с соавторами (Litvinchuk et al., 2011), B. baturae в этом локалитете из-за низких ночных температур даже летом ведут дневной полуводный образ жизни и способны сохранять жизнеспособность после вмерзания в лед. Также взрослые особи из термальных источников Яшилькуля характеризуются очень темной окраской (Тоймастов, 1989) и мелкими размерами, что, вероятно, связано с низкой продолжительностью жизни (Кондратова и др., 2020).
О репродуктивной биологии батурской жабы известно мало, что обусловлено труднодоступностью местообитаний этого вида и сложными для длительной стационарной работы климатическими условиями. Многочисленные проведенные ранее исследования (Матушкина, Кидов, 2013; Кидов, Матушкина, 2015; Кидов и др., 2017; Kidov et al., 2014; Matushkina et al., 2020) показали, что для слабоизученных, узкоареальных и малочисленных видов Bufonidae одним из перспективных путей выявления особенностей размножения и раннего развития является изучение в лабораторных условиях. Накопленный к настоящему времени опыт позволяет утверждать, что отловленные в природе взрослые особи при дальнейшем воспроизводстве в лаборатории обычно имеют репродуктивные показатели, схожие с таковыми в природных условиях.
Уже были описаны случай первого размножения в лаборатории одной пары B. baturae, выращенной из пойманных в природе сеголетков (Матушкина и др., 2017), а также особенности последующего выращивания их личинок (Матушкина и др., 2017а, 2020) и молоди после метаморфоза (Матушкина и др., 2020а). При гибридизации самца батурской жабы с самкой североафриканского диплоидного вида B. boulengeri (Lataste 1879) было получено жизнеспособное фертильное потомство (Матушкина и др., 2019). Наши новые сборы B. baturae, осуществленные в Сасык-Булаке, позволили получить необходимое по числу поголовье для более полного изучения особенностей размножения у этого вида.
Цель настоящей работы – характеристика репродуктивных показателей и раннего развития батурской жабы из высокогорной популяции Восточного Памира по результатам наблюдений в лабораторных условиях.
МАТЕРИАЛ И МЕТОДЫ
Взрослых жаб отлавливали в I декаде августа 2018 г. в Иссык-Булаке (37.731° с.ш., 72.890° в.д.) – урочище с двумя рядом расположенными геотермальными источниками в 3 км к северо-западу от Булункуля. Один из источников, Восточный, или Банный ручей, выходит на поверхность в крытом помещении на высоте 3734 м над ур. м. и через 230 м впадает в оз. Яшилькуль (3724 м над ур. м.). При выходе из источника вода имеет температуру 28.8°С, а в месте впадения температура снижается до 10.6°С (наблюдение 14 августа 2018 г.). Всех жаб отловили в первой четверти течения Банного ручья, так как ниже они уже не встречались.
Животных перевозили в лабораторный кабинет зоокультуры кафедры зоологии РГАУ–МСХА имени К.А. Тимирязева, где рассаживали группами по 10–12 особей в полиуретановые контейнеры размером 56 × 39 × 28 см с плотно закрывающейся крышкой с прорезанными и затянутыми металлической сеткой вентиляционными отверстиями. В качестве субстрата использовали вискозные полотенца, которые промывали под проточной водой через день. Из-за длительной перевозки в лабораторию без кормления (более двух недель) жабы были истощены, поэтому в первый год после поимки их усиленно кормили и зимовку не проводили, ограничившись лишь двухнедельным снижением температуры до 12–16°C перед икрометанием.
Основным кормом для жаб служили двупятнистые сверчки (Gryllus bimaculatus De Geer 1773) и туркестанские тараканы (Blatta lateralis Walker 1868) лабораторного разведения, которых предлагали трижды в неделю в избытке. Нерегулярно жабам задавали также личинок большого мучного хрущака (Tenebrio molitor Linnaeus 1758). Перед каждым кормлением жаб насекомых присыпали порошком из кормового мела. Источником воды служили пластиковые поилки с погруженными в них кусками поролона, которые препятствовали гибели попадающих туда кормовых насекомых.
Размножение жаб осуществляли в III декаде мая 2019 г. По нашему предположению, в этот период начинается икрометание у батурских жаб в Сасык-Булаке. У отобранных для разведения восьми пар животных по стандартным методикам (Банников и др., 1977) измеряли длину тела (L) и массу. Жаб попарно рассаживали в полиуретановые контейнеры размером 28 × 19 × 14, наполненные 2 л воды с уровнем 6 см. Чтобы добиться постепенного, равного для всех сформированных пар повышения температуры воды, имитирующего весеннее потепление, контейнеры с животными единовременно ставили в наполненный водой бассейн, снабженный аквариумными обогревателями марки “Aquael Platinium Heater” (производитель Aquael, Польша) мощностью 200 Вт. В течение первого дня после высадки в контейнеры температуру воды повышали с 16 до 25°C, а далее, до окончания икрометания, удерживали на этом уровне.
Как и в других подобных исследованиях (Кидов, Матушкина, 2015; Кидов и др., 2017; Kidov et al., 2014; Matushkina et al., 2020), для синхронизации созревания половых продуктов у самцов и самок, а также для дополнительной стимуляции икрометания применяли гормональные инъекции сурфагона (синтетического аналога рилизинг-гормона люлиберина) в подмышечные или паховые лимфатические мешки. Вечером в день помещения взрослых жаб в нерестовые контейнеры инъекции осуществляли только самцам, по 12.5 мкг на одно животное вне зависимости от размера. Если на утро формировался амплексус, то инъекцию в той же дозировке делали только самке, если же нет – опять только самцу до образования амплексуса. В дальнейшем гормональную стимуляцию проводили каждые 12 ч каждой паре в амплексусе до наступления икрометания. Таким образом, до откладки яиц на одного самца приходилось 1–3 инъекции (2.0 ± 0.76) сурфагона, а на одну самку – 2–4 инъекции (2.8 ± 0.71).
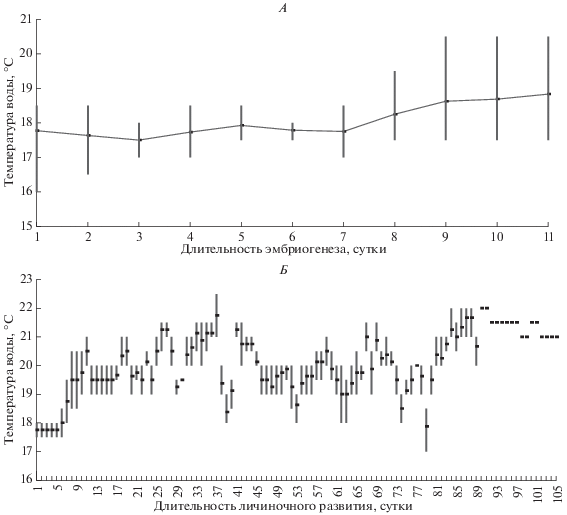
После откладки всех яиц и распада амплексуса взрослых животных высаживали из контейнера и взвешивали. В каждой кладке еще в момент икрометания определяли толщину икряного шнура (по 5 измерений) и диаметр зародыша без оболочки (по 10 измерений). Плодовитость самки устанавливали полным поштучным пересчетом всех яиц в кладке. Обогрев контейнеров с кладками отключали, и температура в период эмбриогенеза (от откладки яиц до начала внешнего питания личинками) составляла 16.0–20.5°C, а во время личиночного развития – 17.5–22.5°C (рис. 1). Близкие значения температуры наблюдались нами в центральной части Банного ручья в урочище Иссык-Булак в августе 2018 г. При отделении предличинок от икряного шнура (18–20 стадии по шкале Госнера (Gosner, 1960)) и при переходе личинок к экзогенному питанию (20–24 стадии по шкале Госнера) у них измеряли общую длину тела с хвостом (L + Lcd).
Рис. 1.
Температурный режим (среднее по восьми повторностям) в период: А – эмбриогенеза и Б – личиночного развития Bufotes baturae в лабораторных условиях.
Из потомства каждой пары случайным образом отбирали по 27 личинок, которых рассаживали в контейнеры размером 39 × 28 × 14 см, наполненные 9 л воды. При этом начальная плотность посадки составляла 3 личинки на 1 л воды.
Кормление личинок осуществляли вволю сухим хлопьевидным комбикормом для аквариумных рыб марки “TetraMin” (производитель Tetra GmbH, Германия). Также еженедельно молоди предлагали свежие листья шпината, ошпаренные крутым кипятком листья крапивы, желток сваренного вкрутую куриного яйца. Учитывая, что личинки этого вида в Иссык-Булаке обитают в ручьях, подмену 4/5 объема воды на отстоянную того же состава в контейнерах с личинками проводили ежедневно.
У личинок на 39–41 стадиях по шкале Госнера, когда их размеры для жаб семейства Bufonidae максимальны (Ткаченко и др., 2015; Gosner, 1960), измеряли длину тела (L), длину хвоста (Lcd), общую длину тела с хвостом (L + Lcd), а также наибольшую ширину тела (LtCr). При прорыве передних конечностей (42–44 стадии) измеряли L и Lcd, а при выходе на сушу и полной резорбции хвоста (47 стадия по шкале Госнера) – L.
Для сравнения привлекали литературные данные по размножению и раннему развитию других зеленых жаб рода Bufotes Rafinesque 1815, а также собственные неопубликованные результаты. Так, при сопоставлении размерных показателей личинок и жаб сразу после метаморфоза использовали рожденную в лаборатории молодь двух диплоидных видов: западной (B. viridis (Laurenti 1768)) (Шараповские карьеры, Одинцовский городской округ, Московская обл.) и восточной (B. sitibundus (Pallas 1771)) (село Джаба, Ахтынский р-н, Республика Дагестан) зеленых жаб. Потомство от этих видов получали единовременно с B. baturae и выращивали по аналогичной методике.
Статистическую обработку проводили с помощью пакета программ Microsoft Excel и STATISTICA for Windows 8.0. Рассчитывали среднюю арифметическую и стандартное отклонение (M ± SD), а также размах признаков (min–max). Так как гипотеза о нормальности распределения выборки во всех случаях была отклонена, статистическую значимость наблюдаемых различий оценивали при помощи непараметрического U-критерия Манна–Уитни (Uэмп), а взаимосвязь между признаками определяли расчетом коэффициента корреляции Спирмена (r). Для изучения морфометрической изменчивости личинок батурской жабы в сравнении с другими представителями рода применяли многофакторный дискриминантный анализ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Использованные для лабораторного размножения самки и самцы B. baturae по длине тела находились у верхнего предела изменчивости, приводимой для данного вида. Так, Тоймастов (1989) указывал, что взрослые самки батурской жабы из ближайшего к Сасык-Булаку локалитета – термального источника в урочище Суман на южном берегу оз. Яшилькуль, имели длину тела 50.0–68.3 мм (M = 57.96), а самцы – 45.6–57.4 мм (M = = 50.31). У измеренных Кондратовой с соавторами (2020) взрослых батурских жаб из Сасык-Булака длина тела составляла 41.9–70.0 мм (M = 57.44) для самок и 49.1–59.3 мм (M = 54.81) для самцов.
За период икрометания масса некоторых животных зачастую не только не уменьшалась, но даже увеличивалась (табл. 1), что многократно наблюдалось и у других Bufonidae (Кидов, Матушкина, 2015; Кидов и др., 2017; Kidov et al., 2014; Matushkina et al., 2020).
Таблица 1.
Размерные и репродуктивные показатели Bufotes baturae (среднее по восьми повторностям)
| Показатель | $\frac{{M \pm SD}}{{{\text{min}}{\kern 1pt} - {\kern 1pt} {\text{max}}}}$ | ||
|---|---|---|---|
| Длина тела взрослых особей, мм | Самки | $\frac{{62.01 \pm 2.063}}{{58.28{\kern 1pt} - {\kern 1pt} 64.17}}$ | |
| Самцы | $\frac{{56.29 \pm 1.936}}{{53.69{\kern 1pt} - {\kern 1pt} 58.75}}$ | ||
| Масса тела взрослых особей, г | Самки | перед икрометанием | $\frac{{29.76 \pm 2.492}}{{25.90{\kern 1pt} - {\kern 1pt} 32.93}}$ |
| после икрометания | $\frac{{29.57 \pm 2.429}}{{26.10{\kern 1pt} - {\kern 1pt} 33.00}}$ | ||
| Самцы | перед икрометанием | $\frac{{20.70 \pm 2.379}}{{17.73{\kern 1pt} - {\kern 1pt} 23.92}}$ | |
| после икрометания | $\frac{{20.74 \pm 2.509}}{{16.40{\kern 1pt} - {\kern 1pt} 24.00}}$ | ||
| Количество яиц в кладке, шт. | $\frac{{1421.0 \pm 322.10}}{{882{\kern 1pt} - {\kern 1pt} 1850}}$ | ||
| Толщина икряного шнура, мм | $\frac{{3.17 \pm 0.380}}{{2.55{\kern 1pt} - {\kern 1pt} 4.09}}$ | ||
| Диаметр зародыша, мм | $\frac{{1.69 \pm 0.201}}{{1.18{\kern 1pt} - {\kern 1pt} 2.19}}$ | ||
Сравнение плодовитости батурской жабы из Сасык-Булака с другими видами зеленых жаб представляет определенные трудности из-за непрерывно изменяющихся представлений об объеме рода Bufotes (Dufresnes et al., 2019). Большинство сведений по репродуктивной биологии, приводимых в прошлом для B. viridis и некоторых других признаваемых на тот момент таксонов (Терентьев, Чернов, 1949; Банников и др., 1977; Ананьева и др., 1998; Кузьмин, 1999, 2012), могли относиться к другим самостоятельным видам разной плоидности. Однако из некоторых работ, в которых приводится детализация региона исследований, можно почерпнуть информацию о плодовитости самок конкретных видов (табл. 2).
Таблица 2.
Сравнительная характеристика некоторых показателей размножения и развития у зеленых жаб рода Bufotes
| Вид | Условия | Показатель | Источник | |||||
|---|---|---|---|---|---|---|---|---|
| плодовитость самок, яиц | диаметр зародыша, мм | длительность эмбриогенеза, сут | длина тела с хвостом у предличинок при выходе из яйца, мм | длительность личиночного развития, сут | длина тела молоди после метаморфоза, мм | |||
| Диплоиды (2n) | ||||||||
| Bufotes balearicus | Природа | 5687–17 602 | – | – | – | – | – | Castellano et al., 2004 |
| Bufotes boulengeri | Природа | 2960 | 1.08–1.45 | – | – | – | 13.35–18.29 | Hussein, Darwish, 2000; Akef, 2013 |
| Лаборатория | 3069–4378 | 1.00–1.60 | 8–9 | 2.8–3.7 | 40–218 | 10.70–19.00 | Матушкина и др., 2019, 2020 | |
| Bufotes latastii | Лаборатория | 31–10 149 | 0.80–1.90 | 4–8 | 2.0–4.3 | 68–178 | 12.30–15.80 | Кидов и др., 2016; Матушкина и др., 2020; Matushkina et al., 2020 |
| Bufotes perrini | Лаборатория | – | – | – | – | 48–111 | 10.90–15.50 | Матушкина и др., 2020 |
| Bufotes sitibundus | Природа | 6600–36 950 | 1.33–1.80 | – | – | – | 22.80–23.00 | Алекперов, 1978; Başkale et al., 2011; Yaghobi et al., 2018 |
| Лаборатория | – | – | 8–10 | – | 51–92 | 12.03–16.05 | Наши данные | |
| Bufotes surdus | Природа | 338–2019 | 1.40 | – | – | – | – | Parvaresh, 2016 |
| Bufotes viridis | Природа | 5000–30 000 | 2.34–2.35 | – | 3.0–4.0 | – | – | Писанец, 2007 |
| Лаборатория | – | – | – | – | – | 13.16–14.98 | Наши данные | |
| Триплоиды (3n) | ||||||||
| Bufotes baturae | Лаборатория | 882–1850 | 1.18–2.19 | 8–11 | 2.26–4.31 | – | 12.98–18.85 | Наши данные |
| Тетраплоиды (4n) | ||||||||
| Bufotes oblongus | Лаборатория | 1904–2560 | – | – | – | – | – | Писанец, 1987 |
| Bufotes pewzowi | Природа | 2182–2623 | 1.40–1.75 | 3.0–4.0 | 2.25–2.55 | – | 10.50–18.00 | Боркин, Кузьмин, 1988; Dujsebayeva et al., 2004; Кузьмин и др., 2017 |
| Лаборатория | 2000–2500 | – | – | – | – | 18.0–23.0 | Орлова, Утешев, 1986 | |
В сравнении с другими представителями рода плодовитость самок B. baturae из Сасык-Булака можно считать относительно низкой, схожей лишь с другим мелким представителем рода – диплоидной B. surdus (Boulenger 1891). Учитывая, что в наших исследованиях мы использовали самых крупных самок из этого локалитета, нельзя исключать, что минимальная и средняя плодовитость у батурской жабы в природе еще ниже.
Изменчивость диаметра зародышей у B. baturae широко перекрывается с этим показателем у других изученных представителей рода (табл. 2). Ранее Писанец (1987) утверждал, что размеры зародыша полиплоидных видов существенно больше, чем у диплоидов, и эти различия видны даже невооруженным взглядом. Согласно приведенному выше сравнению, такое утверждение безосновательно.
Поскольку длительность стадий раннего развития у бесхвостых амфибий обусловлена многими факторами (температура, освещение, изначальная плотность генерации, условия питания и др.), то сопоставить значения этого показателя у разных видов возможно только в лаборатории при схожих условиях содержания (табл. 2). B. baturae в сравнении с другими изученными представителями рода характеризуется схожей продолжительностью эмбрионального и личиночного развития (табл. 3).
Таблица 3.
Длительность раннего развития у Bufotes baturae (среднее по восьми потомствам)
| Показатель | $\frac{{M \pm SD}}{{{\text{min}}{\kern 1pt} - {\kern 1pt} {\text{max}}}}$ | |
|---|---|---|
| Длительность инкубации яиц, сут | До выхода первых предличинок | $\frac{{2.2 \pm 0.46}}{{2{\kern 1pt} - {\kern 1pt} 3}}$ |
| До выхода всех предличинок | $\frac{{3.1 \pm 0.35}}{{3{\kern 1pt} - {\kern 1pt} 4}}$ | |
| Длительность развития от выхода из шнура, сут | До начала экзогенного питания первых личинок | $\frac{{5.5 \pm 0.52}}{{5{\kern 1pt} - {\kern 1pt} 6}}$ |
| До начала экзогенного питания всех личинок | $\frac{{7.3 \pm 0.71}}{{6{\kern 1pt} - {\kern 1pt} 8}}$ | |
| Общая длительность эмбриогенеза от откладки яиц, сут | До начала экзогенного питания первых личинок | $\frac{{8.5 \pm 0.53}}{{8{\kern 1pt} - {\kern 1pt} 9}}$ |
| До начала экзогенного питания всех личинок | $\frac{{10.4 \pm 0.74}}{{9{\kern 1pt} - {\kern 1pt} 11}}$ | |
| Длительность личиночного развития, сут | До выхода на сушу первой жабы после метаморфоза | $\frac{{48.8 \pm 5.50}}{{42{\kern 1pt} - {\kern 1pt} 57}}$ |
| До выхода на сушу последней жабы после метаморфоза | $\frac{{88.4 \pm 4.57}}{{84{\kern 1pt} - {\kern 1pt} 94}}$ | |
| Общая длительность раннего развития от откладки яиц, сут | До выхода на сушу первой жабы после метаморфоза | $\frac{{58.3 \pm 3.99}}{{53{\kern 1pt} - {\kern 1pt} 64}}$ |
| До выхода на сушу последней жабы после метаморфоза | $\frac{{98.8 \pm 4.62}}{{94{\kern 1pt} - {\kern 1pt} 105}}$ | |
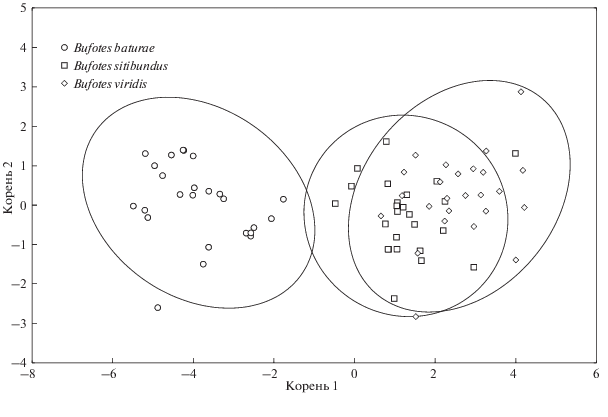
Визуально личинки батурской жабы на 39–41 стадиях развития по шкале Госнера были более крупными, при этом обладали относительно узким, коротким телом и длинным хвостом, по сравнению с другими изученными нами представителями рода, например B. sitibundus и B. viridis (рис. 2). Проведенные измерения морфометрических показателей подтвердили это наблюдение (табл. 4, рис. 3): личинки B. baturae статистически значимо превосходили личинок этих видов по значениям L (Uэмп = 10 (p ≤ 0.01) и Uэмп = 3 (p ≤ 0.01) соответственно), Lcd (Uэмп = 0 (p ≤ 0.01) и Uэмп = 0 (p ≤ 0.01)), и Lcd/(L + Lcd) (Uэмп = 96 (p ≤ 0.01) и Uэмп = 33 (p ≤ 0.01)), но уступали по L/(L + Lcd) (Uэмп = 96 (p ≤ 0.01) и Uэмп = 33 (p ≤ 0.01)) и LtCr/(L + Lcd) (Uэмп = 49 (p ≤ 0.01) и Uэмп = 5 (p ≤ 0.01)).
Рис. 2.
Личинки трех видов Bufotes (слева направо: B. sitibundus, B. viridis и B. baturae) на 39–41 стадиях развития.

Таблица 4.
Морфометрические показатели (M ± SD/min–max) личинок трех видов Bufotes на 39–41 стадиях развития по шкале Госнера (Gosner, 1960)
| Показатель, мм | Bufotes baturae (Памир) (n = 25) |
Bufotes sitibundus (Дагестан) (n = 25) |
Bufotes viridis (Московская обл.) (n = 25) |
|---|---|---|---|
| L | $\frac{{18.18 \pm 1.225}}{{16.17{\kern 1pt} - {\kern 1pt} 20.26}}$ | $\frac{{15.05 \pm 1.029}}{{12.88{\kern 1pt} - {\kern 1pt} 16.87}}$ | $\frac{{14.58 \pm 1.06}}{{12.60{\kern 1pt} - {\kern 1pt} 16.31}}$ |
| Lcd | $\frac{{26.80 \pm 1.568}}{{23.72{\kern 1pt} - {\kern 1pt} 30.57}}$ | $\frac{{19.66 \pm 1.565}}{{14.26{\kern 1pt} - {\kern 1pt} 22.06}}$ | $\frac{{17.29 \pm 1.959}}{{12.6{\kern 1pt} - {\kern 1pt} 21.6}}$ |
| LtCr | $\frac{{7.63 \pm 0.837}}{{6.37{\kern 1pt} - {\kern 1pt} 9.71}}$ | $\frac{{7.37 \pm 0.860}}{{5.74{\kern 1pt} - {\kern 1pt} 9.03}}$ | $\frac{{7.12 \pm 0.556}}{{6.08{\kern 1pt} - {\kern 1pt} 8.18}}$ |
| L + Lcd | $\frac{{44.99 \pm 2.077}}{{40.26{\kern 1pt} - {\kern 1pt} 49.00}}$ | $\frac{{34.71 \pm 1.992}}{{29.11{\kern 1pt} - {\kern 1pt} 37.75}}$ | $\frac{{31.87 \pm 2.344}}{{27.81{\kern 1pt} - {\kern 1pt} 36.41}}$ |
| L/(L + Lcd) | $\frac{{0.40 \pm 0.018}}{{0.37{\kern 1pt} - {\kern 1pt} 0.44}}$ | $\frac{{0.43 \pm 0.025}}{{0.39{\kern 1pt} - {\kern 1pt} 0.51}}$ | $\frac{{0.46 \pm 0.032}}{{0.38{\kern 1pt} - {\kern 1pt} 0.44}}$ |
| Lcd/(L + Lcd) | $\frac{{0.59 \pm 0.018}}{{0.56{\kern 1pt} - {\kern 1pt} 0.63}}$ | $\frac{{0.57 \pm 0.025}}{{0.49{\kern 1pt} - {\kern 1pt} 0.61}}$ | $\frac{{0.54 \pm 0.032}}{{0.44{\kern 1pt} - {\kern 1pt} 0.62}}$ |
| LtCr/(L + Lcd) | $\frac{{0.17 \pm 0.019}}{{0.14{\kern 1pt} - {\kern 1pt} 0.21}}$ | $\frac{{0.21 \pm 0.022}}{{0.16{\kern 1pt} - {\kern 1pt} 0.25}}$ | $\frac{{0.22 \pm 0.012}}{{0.19{\kern 1pt} - {\kern 1pt} 0.25}}$ |
Рис. 3.
Распределение выборок личинок трех видов Bufotes по комплексу морфометрических признаков (L, Lcd, LtCr) в пространстве дискриминантных функций.
Вероятно, удлинение тела и хвоста у личинок батурской жабы является следствием адаптации к обитанию в проточных водоемах, в отличие от лимнофильных личинок диплоидных B. sitibundus и B. viridis. Также мы регулярно отмечали, что личинки B. baturae в условиях лаборатории выпрыгивают на высоту до 1.0–1.5 см над поверхностью воды, особенно при включении освещения или при резком движении у контейнера. Для личинок других видов зеленых жаб этой поведенческой реакции мы никогда не наблюдали. Возможно, эта особенность поведения позволяет личинкам уходить от преследования хищных рыб (Diptychus Steindachner 1866, Schizopygopsis Steindachner 1866 и Schizothorax Heckel 1838), которые встречаются в нижнем течении населяемых ими ручьев на Памире.
До момента выхода на сушу молодые B. baturae сохраняли темный, почти черный цвет, тогда как личинки других изученных нами видов (B. boulengeri, B. latastii, B. sitibundus, B. viridis) уже после 39–41 стадий начинали светлеть вплоть до болотно-зеленого с хорошо заметными темными пятнами. Вероятно, темная окраска личинок и взрослых батурских жаб позволяет им интенсивнее прогреваться в условиях высокогорий. Увеличение числа меланистических особей у горных видов земноводных и пресмыкающихся отмечалось и ранее (Туниев, 1990).
Длина тела полученных в лаборатории сеголетков сразу после метаморфоза (12.98–18.85 мм) (табл. 5) в среднем была несколько меньше, чем у восьми особей, отловленных в урочище Сасык-Булак в августе 2018 г. (15.10–19.95 мм, 17.21 ± 1.653). Позднее личинки в природном водоеме уже не наблюдались, поэтому можно заключить, что отловленные сеголетки выходили на сушу последними. В лаборатории нами была отмечена статистически значимая зависимость длины тела при выходе на сушу (r = 0.52, p ≤ 0.05) от длительности личиночного развития, т.е. самые последние выходящие на сушу молодые жабы в среднем являлись и самыми крупными (рис. 4). В связи с этим можно предположить, что средняя длина тела сеголетков в природе сопоставима со средними размерами полученных в лаборатории животных.
Таблица 5.
Размерные показатели предличинок, личинок и молоди после метаморфоза у Bufotes baturae
| Показатель | n | $\frac{{M \pm SD}}{{{\text{min}}{\kern 1pt} - {\kern 1pt} {\text{max}}}}$ | |
|---|---|---|---|
| Общая длина (L + Lcd) предличинки при отделении от икряного шнура, мм | 190 | $\frac{{2.99 \pm 0.419}}{{2.26{\kern 1pt} - {\kern 1pt} 4.31}}$ | |
| Общая длина (L + Lcd) личинки в начале экзогенного питания, мм | 200 | $\frac{{10.98 \pm 0.630}}{{8.73{\kern 1pt} - {\kern 1pt} 12.64}}$ | |
| Размеры личинки при прорыве передних конечностей, мм | L + Lcd | 206 | $\frac{{46.00 \pm 2.361}}{{36.6{\kern 1pt} - {\kern 1pt} 52.87}}$ |
| Lcd | 204 | $\frac{{29.67 \pm 2.171}}{{16.96{\kern 1pt} - {\kern 1pt} 34.92}}$ | |
| L | 208 | $\frac{{16.28 \pm 0.882}}{{9.85{\kern 1pt} - {\kern 1pt} 19.31}}$ | |
| Длина тела (L) молоди при выходе на сушу, мм | 205 | $\frac{{15.58 \pm 0.842}}{{12.98{\kern 1pt} - {\kern 1pt} 18.85}}$ | |
Рис. 4.
Длина тела (L) молоди Bufotes baturae при выходе на сушу в зависимости от длительности личиночного развития.

В целом, батурские жабы по многим анализируемым признакам (размерные характеристики предличинок, личинок и сеголетков после метаморфоза, длительность раннего развития) схожи с другими представителями рода. Низкая плодовитость у этого вида, по всей видимости, обусловлена мелкими размерами взрослых самок. Это может объясняться ограниченными пищевыми ресурсами высокогорной пустыни и небольшой продолжительностью жизни.
Для личинок батурской жабы отмечен ряд адаптивных особенностей (темная окраска и удлиненный хвост), которые, по всей видимости, позволяют им более успешно развиваться в ручьях высокогорий.
Список литературы
Алекперов А.М., 1978. Земноводные и пресмыкающиеся Азербайджана. Баку: Элм. 264 с.
Ананьева Н.Б., Боркин Л.Я., Даревский И.С., Орлов Н.Л., 1998. Земноводные и пресмыкающиеся. Энциклопедия природы России. М.: ABF. 576 с.
Банников А.Г., Даревский И.С., Ищенко В.Г., Рустамов А.К., Щербак Н.Н., 1977. Определитель земноводных и пресмыкающихся фауны СССР. М.: Просвещение. 415 с.
Боркин Л.Я., Кузьмин С.Л., 1988. Земноводные Монголии: видовые очерки // Земноводные и пресмыкающиеся Монгольской Народной Республики. Общие вопросы. Земноводные. М.: Наука. С. 30–197.
Боркин Л.Я., Литвинчук С.Н., Мазепа Г.А., Пасынкова Р.А., Розанов Ю.М., Скоринов Д.В., 2012. Западные Гималаи как арена необычного триплоидного видообразования у зеленых жаб группы Bufo viridis // Отчетная научная сессия по итогам работ 2011 г. СПб: Зоологический институт РАН. С. 10–12.
Кидов А.А., Матушкина К.А., 2015. Плодовитость самок кавказской жабы, Bufo verrucosissimus (Pallas, 1814) в искусственных условиях // Вестник Бурятского государственного университета. № 4 (1). С. 75–80.
Кидов А.А., Матушкина К.А., Блинова С.А., Африн К.А., 2017. Лабораторное размножение кубинской жабы, Peltophryne empusa Cope, 1862 // Современная герпетология. Т. 17. № 1–2. С. 36–43. https://doi.org/10.18500/1814-6090-2017-17-1-2-36-43
Кидов А.А., Матушкина К.А., Литвинчук С.Н., Блинова С.А., Африн К.А., Коврина Е.Г., 2016. Первый случай размножения жабы Латаста Bufotes latastii (Boulenger, 1882) в лабораторных условиях // Современная герпетология. Т. 16. № 1–2. С. 20–26. https://doi.org/10.18500/1814-6090-2016-16-1-2-20-26
Кондратова Т.Э., Иволга Р.А., Иванов А.А., Кидова Е.А., Литвинчук С.Н., Кидов А.А., 2020. К вопросу о видовой идентификации азиатских полиплоидных зеленых жаб рода Bufotes по стандартным морфометрическим признакам // Актуальные вопросы зоологии, экологии и охраны природы: Материалы научно-практической конференции. М.: ЗооВетКнига. С. 65–70.
Кузьмин С.Л., 1999. Земноводные бывшего СССР. М.: Товарищество научных изданий КМК. 298 с.
Кузьмин С.Л., 2012. Земноводные бывшего СССР. Издание второе, переработанное. М.: Товарищество научных изданий КМК. 370 с.
Кузьмин С.Л., Дунаев Е.А., Мунхбаяр Х., Мунхбаатар М., Оюунчимэг Ж., Тэрбиш Х., 2017. Земноводные Монголии. М.: Товарищество научных изданий КМК. 302 с.
Литвинчук С.Н., Боркин Л.Я., Скоринов Д.В., Мазепа Г.А., Пасынкова Р.А. и др., 2012. Необычное триплоидное видообразование у зеленых жаб комплекса Bufo viridis высокогорной Азии // Вопросы герпетологии. Материалы V съезда Герпетологического общества имени А.М. Никольского. Минск: ИООО “Право и экономика”. С. 160–165.
Литвинчук С.Н., Боркин Л.Я., Скоринов Д.В., Пасынкова Р.А., Розанов Ю.М., 2016. Природная полиплоидия у амфибий // Вестник Санкт-Петербургского государственного университета. Сер. 3, Биология. № 3. С. 77–86. https://doi.org/10.21638/11701/spbu03.2016.314
Литвинчук С.Н., Скоринов Д.В., Пасынкова Р.А., Кидов А.А., Матушкина К.А. и др., 2019. Полиплоидное видообразование у азиатских зеленых жаб рода Bufotes (Bufonidae) // Известия высших учебных заведений. Поволжский регион. Естественные науки. № 1 (25). С. 80–93. https://doi.org/10.21685/2307-9150-2019-1-9
Матушкина К.А., Кидов А.А., 2013. Репродуктивная биология талышской жабы (Bufo eichwaldi) в Ленкоранской низменности // Современная герпетология. Т. 13. № 1/2. С. 27–33.
Матушкина К.А., Кидов А.А., Литвинчук С.Н., 2017. Первые результаты лабораторного размножения батурской жабы, Bufotes baturae Stoeck, Schmid, Steinlein et Grosse, 1999 // Вестник Тамбовского университета. Серия: Естественные и технические науки. Т. 22. № 5–1. С. 955–959. https://doi.org/10.20310/1810-0198-2017-22-5-955-959
Матушкина К.А., Кидов А.А., Серякова А.А., 2017а. Выращивание личинок узкоареальных триплоидных жаб, Bufotes baturae (Stöck, Schmid, Steinlein et Grosse, 1999) с применением полнорационных кормов для аквариумных рыб // Вестник Тамбовского университета. Серия: Естественные и технические науки. Т. 22. № 5–1. С. 960–964. https://doi.org/10.20310/1810-0198-2017-22-5-960-964
Матушкина К.А., Кидов А.А., Шульга А.В., 2019. Размножение и гибридизация магрибской жабы, Bufotes boulengeri (Lataste, 1879) в лабораторных условиях // Известия высших учебных заведений. Поволжский регион. Естественные науки. № 2 (26). С. 129–136. https://doi.org/10.21685/2307-9150-2019-2-13
Матушкина К.А., Кидов А.А., Серякова А.А., 2020. Применение полнорационных кормов для рыб в зоокультуре жаб рода Bufotes (Amphibia, Anura, Bufonidae) // Известия высших учебных заведений. Поволжский регион. Естественные науки. № 1 (29). С. 36–45. https://doi.org/10.21685/2307-9150-2020-1-4
Матушкина К.А., Неверова А.О., Иволга Р.А., 2020а. Особенности роста и развития батурской жабы Bufotes baturae (Stöck, Schmid, Steinlein and Grosse, 1999) на различных кормах // Естественные и технические науки. № 2 (140). С. 82–86. https://doi.org/10.25633/ETN.2020.02.06
Орлова В.Ф., Утешев В.К., 1986. Тетраплоидная жаба группы Bufo viridis из Джунгарской Гоби // Герпетологические исследования в Монгольской Народной Республике. М.: Наука. С. 95–110.
Писанец Е.М., 2007. Амфибии Украины (справочник-определитель земноводных Украины и сопредельных территорий). Киев: Зоологический музей ННПМ НАН Украины. 312 с.
Писанец Е.М., 1992. Полиплоидия и отклонения в морфологии гонад у тетраплоидных жаб Bufo danatensis (Amphibia: Anura: Bufonidae) // Цитология и генетика. Т. 26. № 6. С. 35–39.
Писанец Е.М., 1987. Различия в кладке икры зеленой и данатинской жаб // Вестник зоологии. № 6. С. 80–81.
Терентьев П.В., Чернов С.А., 1949. Определитель пресмыкающихся и земноводных. М.: Советская наука. 340 с.
Ткаченко О.В., Кидов А.А., Матушкина К.А., Блинова С.А., Африн К.А., 2015. Некоторые морфологические особенности развития личинок талышской (Bufo eichwaldi Litvinchuk, Rosanov, Borkin et Skorinov, 2008) и кавказской (B. verrucosissimus (Pallas, 1814)) жаб в лабораторных условиях // Вестник Московского государственного областного университета. Серия: Естественные науки. № 2. С. 6–13.
Тоймастов С.С., 1989. Особенности морфологии жаб из окрестностей оз. Яшилькуль на Памире // Известия Академии наук Таджикской ССР, отделение биологических наук. № 4 (117). С. 43–48.
Туниев Б.С., 1990. Герпетофауна уникальных колхидских лесов и ее современные рефугиумы // Почвенно-биогеоценологические исследования на Северо-Западном Кавказе. Пущино: Изд-во НТИ НЦ АН СССР. С. 55–70.
Akef M.S.A., 2013. Female reproductive cycle of the green toad (Bufo boulengeri) from northwestern Egypt // Russian Journal of Herpetology. Vol. 20. № 2. P. 97–104. https://doi.org/10.30906/1026-2296-2013-20-2-97-104
Başkale E., Sayim F., Yıldırım Ş., Atatür M.K., Kaya U., 2011. Reproductive ecology and body size-fecundity relationships of the green toad, Pseudepidalea viridis (Laurenti, 1768), in the Kocaçay Stream, İzmir, Turkey // Zoology in the Middle East. V. 52. № 1. P. 39–46. https://doi.org/10.1080/09397140.2011.10638477
Castellano S., Gucco M., Giacoma C., 2004. Reproductive investment of female green toads (Bufo viridis) // Copeia. V. 2004. № 3. P. 659–664. https://doi.org/10.1643/CE-03-182R2
Dubois A., Bour R., 2010. The nomenclatural status of the nomina of amphibians and reptiles created by Garsault (1764), with a parsimonious solution to an old nomenclatural problem regarding the genus Bufo (Amphibia, Anura), comments on the taxonomy of this genus, and comments on some nomina created by Laurenti (1768) // Zootaxa. V. 2447. P. 1–52. https://doi.org/10.5281/zenodo.195113
Dufresnes C., Mazepa G.O., Jablonski D., Oliveira R.C., Wenseleers T. et al., 2019. Fifteen shades of green: The evolution of Bufotes toads revisited // Molecular Phylogenetics and Evolution. V. 141. P. 1–25. https://doi.org/10.1016/j.ympev.2019.106615
Dujsebayeva T., Arifulova I., Gnidenko E., Giacoma C., 2004. The study of the development of the Middle Asiatic tetraploid green toads (Amphibia: Bufonidae) with notes on some infraspecific and interspecific differences within Bufo viridis complex // Russian Journal of Herpetology. V. 11. № 3. P. 230–246. https://doi.org/10.30906/1026-2296-2004-11-3-230-246
Gosner K.L., 1960. A simplified table for staging anuran embryos and larvae // Herpetologica. V. 16. P. 183–190.
Hussein H., Darwish A.D.M., 2000. Variation in developmental duration and metamorphosis of the green toad, Bufo viridis in temporary ponds as an adaptation to desert environment // Pakistan Journal of Biological Sciences. V. 3. № 10. P. 1784–1789. https://doi.org/10.3923/pjbs.2000.1784.1789
Kidov A.A., Matushkina K.A., Uteshev V.K., Timoshina A.L., Kovrina E.G., 2014. The first captive breeding of the Eichwald’s toad (Bufo eichwaldi) // Russian Journal of Herpetology. V. 21. № 1. P. 40–46. https://doi.org/10.30906/1026-2296-2014-21-1-40-46
Litvinchuk S.N., Mazepa G.O., Pasynkova R.A., Saidov A., Satorov T., Chikin Yu.A., Shabanov D.A., Crottini A., Borkin L.J., Rosanov J.M., Stöck M., 2011. Influence of environmental conditions on the distribution of Central Asian green toads with three ploidy levels // Journal of Zoological Systematics and Evolutionary Research. V. 49. № 3. P. 233–239. https://doi.org/10.1111/j.1439-0469.2010.00612.x
Matushkina K.A., Kidov A.A., Litvinchuk S.N., 2020. Keeping, breeding and maintenance of zooculture of the Ladakh toad, Bufotes latastii (Boulenger, 1882) // Russian Journal of Herpetology. V. 27. № 5. P. 284–290. https://doi.org/10.30906/1026-2296-2020-27-5-284-290
Parvaresh Z., Seddighi N., Roushenas F., Rahimi S., Hasani E. et al., 2016. Reproductive strategy and embryonic development of Bufotes surdus annulatus in Iran // Salamandra. V. 52. № 3. P. 230–242.
Stöck M., Frynta D., Grosse W.-R., Steinlein C., Schmid M., 2001. A review of the distribution of diploid, triploid and tetraploid green toads (Bufo viridis complex) in Asia including new data from Pakistan // Asiatic Herpetological Research. V. 9. P. 77–100. https://doi.org/10.5962/bhl.part.15562
Stöck M., Schmid M., Steinlein C., Grosse W.-R., 1999. Mosaicism in somatic triploid specimens of the Bufo viridis complex in the Karakoram with examination of calls, morphology and taxonomic conclusions // Italian Journal of Zoology. V. 66. P. 215–232. https://doi.org/10.1080/11250009909356259
Yaghobi S., Vaissi S., Khas Z.T., Sharifi M., 2018. Effects of increased salinity on growth, development and survival in early life stages of the green toad Bufotes variabilis (Anura: Bufonidae) // Asian Herpetological Research. V. 9. № 2. P. 128–134. https://doi.org/10.16373/j.cnki.ahr.170083
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


