Зоологический журнал, 2022, T. 101, № 3, стр. 326-335
Меланиновая и каротиноидная окраска оперения и уровень агрессивности: связь этих параметров у зеленушки (Chloris chloris, Passeriformes, Fringillidae)
М. Е. Диатроптов a, А. С. Опаев a, *
a Институт проблем экологии и эволюции имени А.Н. Северцова РАН
119071 Москва, Россия
* E-mail: aleksei.opaev@gmail.com
Поступила в редакцию 27.12.2020
После доработки 27.04.2021
Принята к публикации 29.04.2021
- EDN: BDYWSF
- DOI: 10.31857/S0044513422010056
Аннотация
У воробьиных птиц окраска оперения связана с двумя группами пигментов – меланинами и каротиноидами. Физиологические основы возникновения меланиновой и каротиноидной окраски принципиально различны, и эти типы окраски отражают разные характеристики особи. Считается, что выраженность меланиновой окраски в первую очередь зависит от генетических факторов, а выраженность каротиноидной – от состояния и здоровья особи в данный момент. Поэтому индивидуальная изменчивость этих двух типов окраски должна быть независима одна от другой. Мы изучили окраску 2-го (от дистального края) рулевого пера у 109 самцов зеленушки двух возрастных когорт (годовалых и в возрасте двух и более лет). Также была рассмотрена связь уровня агрессивности разных птиц с их окрасочными признаками. Интересующие нас перья двухцветные – их дистальная часть черная (или черноватая), а проксимальная (основание) – желтая. Черный цвет обусловлен меланинами, а желтый – каротиноидами. Мы показали, что у самцов зеленушки насыщенность желтой каротиноидной окраски имеет достоверную и обратную связь с протяженностью черного (меланинового) пятна на одном и том же рулевом пере (связь насыщенности желтой окраски с протяженностью желтого поля, соответственно, положительная). Таким образом, индивидуальная изменчивость меланиновой и каротиноидной окраски в нашем случае параллельна. Это говорит о том, что роли этих групп пигментов в качестве показателей (маркеров) качества и состояния особи могут быть не столь принципиально различными, как обычно считается. Тем не менее различия в этой связи между меланиновой и каротиноидной окраской определенно есть: черная меланиновая окраска у зеленушки связана с агрессивностью, а желтая каротиноидная – нет.
Особи в популяции различаются по своим индивидуальным характеристикам, в том числе по так называемому качеству (individual quality). Одни индивидуумы могут лучше выживать и/или успешнее размножаться – они считаются более качественными. Условно можно выделить две составляющие качества: (1) состояние особи и ее здоровье в данный момент и (2) качество, обусловленное наследственностью и развитием особи в ранний период жизни. Первые характеристики лабильны и могут неоднократно меняться в течение жизни (хотя это не значит, что они никак не обусловлены генетически). А вторые – остаются (во взрослом состоянии) более или менее постоянными. К первым характеристикам можно отнести, например, гормональный или иммунный статус, а ко вторым – размер тела. Существуют фенотипические показатели (корреляты) одной и другой групп признаков. Один из них – окраска. Для птиц наиболее изученной является окраска оперения.
Окраска оперения птиц обусловлена пигментами (пигментная окраска) либо пигментами в сочетании со структурой пера (структурная окраска). Пигменты – это особые молекулы, которые избирательно поглощают и отражают свет с определенной длинной волны. Структурная окраска возникает комплексно – за счет преломления света в бородках пера и отражения его от гранул пигмента эумеланина (Мосалов, Коблик, 2017).
В настоящей работе речь пойдет о двух наиболее распространенных классах пигментов – меланинах и каротиноидах (McGraw, 2003, 2003a; Stoddard, Prum, 2011). У воробьиных птиц (отряд Passeriformes) только и исключительно эти пигменты – но нередко в сочетании со структурой пера – определяют всю цветовую палитру оперения. В контексте данной работы важно, что физиологические основы возникновения меланиновой и каротиноидной окраски принципиально различны (Griffith et al., 2006). Значит, эти типы окраски, предположительно, по-разному могут отражать индивидуальные особенности особи и, соответственно, выполнять разные функции в жизни птиц (Badyaev, Hill, 2000).
Птицы не могут самостоятельно синтезировать каротиноиды de novo – они получают эти пигменты с пищей, но способны видоизменять их. К примеру, самцы красного кардинала (Cardinalis cardinalis) получают с пищей желтые и оранжевые пигменты, но метаболически трансформируют их в красные, обусловливающие цвет их оперения (McGraw et al., 2001). Красное оперение часто (но не всегда) обусловлено биохимически-трансформированными каротиноидами. А пигменты желтого цвета могут быть как трансформированными, так и точно теми же, что птица получила с кормом (Weaver et al., 2018). Учитывая происхождение каротиноидов, каротиноидная окраска традиционно считается показателем физического состояния и здоровья особи в данный момент – а точнее, в момент линьки и непосредственно перед ней. Ведь такая окраска зависит от способности птицы успешно кормиться, состава кормов и особенностей метаболизма. Поэтому год от года она может меняться. Было показано, что выраженность каротиноидной окраски (насыщенность цвета и площадь соответствующих партий оперения) связана с тем, как и чем питалась птица (Hill, 2000; Navara, Hill, 2003), ее иммунным ответом (Simons et al., 2012; но: Koch et al., 2018) и гормональным статусом (Stoehr, Hill, 2001), зараженностью паразитами (Thompson et al., 1997; Hõrak et al., 2001), успехом размножения (Wolfenbarger, 1999), выживаемостью (Hõrak et al., 2001), а у некоторых (но далеко не у всех) видов – также с уровнем окислительного стресса (Costantini, Møller, 2008; Koch et al., 2018).
Меланины, в отличие от каротиноидов, не требуют поступления каких-то специальных веществ с пищей. Они синтезируются как “побочный” (т.е. не главный) продукт аминокислотного катаболизма (Riedler et al., 2014). По этой причине характер депонирования меланинов в перьях, как традиционно считается, находится под генетическим контролем и меньше зависит от внешних факторов (например, диеты) и состояния птицы в момент линьки (Decker, McGinnis, 1947; но: Veiga, Puerta, 1996). Так, у серого юнко (Junco hyemalis) были выявлены различия в экспрессии ряда генов в зависимости от концентрации меланинов в перьях (Abolins-Abols et al., 2018). Иными словами, меланиновая окраска отражает, как считается, более или менее постоянные (главным образом – наследственные) характеристики особи.
Учитывая кратко рассмотренные различия в физиологических путях возникновения меланиновой и каротиноидной окрасок, следует ожидать, что та и другая должны быть в целом независимы друг от друга. Такие данные действительно есть, хотя их и не много. У серой куропатки (Perdix perdix) – как у самцов, так и у самок – позади глаза имеется небольшой участок красной кожи (его окраска обусловлена каротиноидами), а также темно-коричневое подковообразное пятно на груди (меланины). Тот и другой окрасочный признак связаны с некоторыми (разными) показателями качества и состояния особи, но не коррелируют друг с другом (Svobodová et al., 2013, 2016).
Однако в последнее время накапливаются данные о том, что меланиновая окраска может быть связана с качеством и состоянием особи примерно таким же образом, как и каротиноидная. Т.е. меланиновая окраска может коррелировать с такими варьирующими в течение жизни особи показателями, как гормональный и иммунный статус, а также уровень окислительного стресса (Slagsvold, Lifjeld, 1992; Bókony et al., 2008; Griffith et al., 2006; Hõrak et al., 2010; Guindre-Parker, Love, 2014; Roulin, 2016). Причина может быть, в частности, в том, что полностью исключать влияние рациона на синтез меланинов нельзя. Эти пигменты являются продуктом процессов меланогенеза, которые строятся на окислении тирозина с последующей полимеризацией. Предшественником тирозина является фенилаланин – незаменимая аминокислота, которая поступает в организм животного с белками, содержащимися в пище. Кроме того, было показано, что дефицит в пище витамина D может приводить к избыточному количеству меланинов в оперении (Decker, McGinnis, 1947).
Каротиноидная окраска, в свою очередь, может быть связана и с наследственностью. К примеру, у зебровой амадины (Taeniopygia guttata) наследственность объясняла в среднем 42% изменчивости, условия жизни в раннем возрасте 19%, а состояние особи в данный момент – 39% изменчивости каротиноидной окраски клюва (Schielzeth et al., 2012).
Наконец, во многих случаях именно сочетание меланиновой и каротиноидной окрасок формирует видоспецифичный рисунок оперения, что предполагает их сопряженное проявление. В этой связи интересна зеленая окраска. В большинстве случаев (но не всегда) она связана с сочетанием синей структурной и желтой, обусловленной ксантофилами, окраски. Но в некоторых случаях зеленый цвет может быть результатом комбинирования желтой и коричневой (феомеланины) окраски (Riedler et al., 2014).
На основе приведенных данных можно предположить, что по крайней мере в некоторых случаях следует ожидать однонаправленную индивидуальную изменчивость меланиновой и каротиноидной окрасок. Но, насколько нам известно, таких данных пока нет. Между тем они могут оказаться полезны как в плане общего изучения окраски птиц и ее физиологических механизмов, так и при поиске разнообразных коррелятов окрасочных признаков (таких, например, как поведение, иммунный статус и проч.). На наш взгляд, перспективным в этой связи является сравнительное изучение не разных частей тела птицы (как в приведенном выше примере с серой куропаткой), а одного пера, окраска разных частей которого обусловлена меланинами и каротиноидами. В этом случае мы сможем протестировать напрямую, имеется ли (и какая) взаимосвязь каротиноидной и меланиновой окрасок? Именно такую цель мы поставили в предлагаемом исследовании. Кроме того, мы рассмотрели связь с окрасочными признаками одного из важных индивидуальных показателей особи – уровня ее агрессивности в отношениях с конспецификами.
Объект нашего исследования – зеленушка (Chloris chloris), представитель певчих воробьиных птиц (подотряд Passeri отряда Passeriformes). Каротиноидная окраска (желтая и в известной степени зеленая) этой птицы обусловлена ксантофилами А и В и их cis-изомерами (Saks et al., 2003). Они синтезируются в организме зеленушки из пигментов, получаемых с пищей (Weaver et al., 2018). Известно, что интенсивность желтых партий оперения зеленушки связана с количеством каротиноидов, депонированных в соответствующих перьях (Saks et al., 2003), а также с уровнем каротиноидов в плазме крови во время линьки (Karu et al., 2007). Кроме того, было показано, что насыщенность каротиноидной окраски оперения зеленушки обратно зависит от наличия различных заболеваний и интенсивности инфекции (Merilä et al., 1999; Lindström, Lundström, 2000; Hõrak et al., 2004). Что касается меланиновой окраски, то в одном исследовании ее насыщенность (“чернота”) зависела от уровня окислительного стресса (Hõrak et al., 2010). Таким образом, как каротиноидная, так и меланиновая окраска зеленушки могут, в той или иной степени, отражать разнокачественность особей в популяции.
МАТЕРИАЛ И МЕТОДЫ
Полевые исследования и отлов птиц
Зеленушек отлавливали в 2019–2020 гг. западней либо лучком на прикормке, действовавшей постоянно с апреля по сентябрь в с. Ярустово Спасского р-на Рязанской обл. В работе использовали только самцов, всего 109 особей. Их делили на две возрастные когорты: годовалые птицы прошлого года рождения (т.е. в возрасте около года: 71 самец) и более старшие, возрастом 2 и более лет (38 самцов). Относили особей к одной или другой возрастной когорте, главным образом, на основании контраста зеленой окраски кроющих второстепенных маховых и/или плечевых перьев с оперением крылышка. У птиц в возрасте до года окраска этих участков контрастирует между собой (Svensson, 1992), так как перья крылышка начинают линять только с первой послебрачной линьки, а кроющие и плечевые самец обычно меняет уже в ходе постювенальной линьки. В качестве дополнительного критерия возраста мы использовали форму рулевых перьев – у первогодков они более заостренные (Svensson, 1992). Этот параметр мы оценивали также для того, чтобы удостовериться в том, что рулевые перья первогодка остались птенцовыми, а не выросли заново после потери хвоста.
У всех птиц для дальнейшего анализа брали (вырывали) 2-е и 5-е рулевые перья, считая от дистального края хвоста. Каждое перо хранили в отдельном конверте без доступа света.
Измерения перьев и их цветовой палитры
В анализе использовали 2-е рулевое перо каждой птицы. Эти перья у самцов зеленушки двухцветные – их дистальная часть черная (или черноватая), а проксимальная (основание) – желтая (рис. 1). Для начала мы измеряли длину опахала пера по стержню (с точностью до 1 мм). Затем – длину черной дистальной части пера (с точностью до 1 мм). Граница черного участка пера часто не ровная. Чтобы компенсировать это, мы определяли границу черной части усреднением по площади. Для этого мы визуально учитывали, сколько желтого входит в измеряемую (дистальную) часть пера, и “уступали” столько же черного желтой проксимальной части пера. Затем мы рассчитывали, какую часть пера (в процентах от всей длины) составляет его черный кончик.
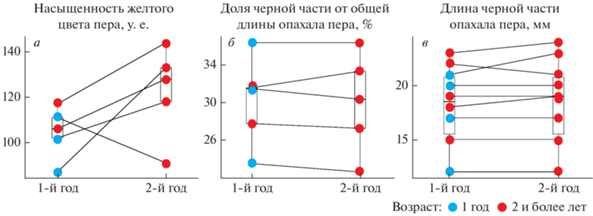
Рис. 1.
Верхний ряд – 2-е с дистального края рулевые перья. Нижний ряд – 5-е с дистального края рулевые перья одних и тех же птиц. а–г – птицы в возрасте больше года; д, е – перья одной и той же птицы, взятые у нее в годовалом возрасте (д) и в возрасте двух лет (е).

Мы считаем, что доля черного на 2-м рулевом пере отражает распространенность этого цвета по всему хвосту. Наши наблюдения свидетельствуют, что, как показано на рис. 1, у птиц с высоким показателем доли черного и, следовательно, низким показателем доли желтого на 2-м дистальном рулевом пере, мала доля желтого и на 5-м рулевом. Напротив, у особей с маленькой долей черного и большой долей желтого на 2-м рулевом пере бóльшая часть наружного опахала 5-го рулевого пера желтая.
Насыщенность желтой окраски проксимальной части пера определяли следующим образом. Перья сканировали на белом фоне в цветном сканере МФУ HP 3540 DeskJet (Китай). Полученное изображение анализировали в программе ImageJ 2.0.0-rc-30: выбирали вкладку Image, затем открывали Type, выбирали HSB Stack и указывали канал определения насыщенности изображения (среднее положение нижнего бегунка). Насыщенность цвета (в условных единицах: у.е.) определяли для участка внутренней части опахала в центре пера (рис. 1).
Для валидации описанной методики насыщенность желтого цвета у части особей (n = 42) была оценена альтернативным методом. На микрофотометре Anthos 2010 (Biochrom, Великобритания) мы измерили оптическую плотность (в единицах оптической плотности, D) изображения фрагмента пера, предварительно напечатанного на прозрачной пленке. Мы измеряли оптическую плотность сканов пера, при этом один скан был отпечатан на прозрачной пленке при светофильтре 450 нм (желтом), другой – при светофильтре 630 нм. Затем вычисляли разницу между оптической плотностью, измеренной для 450 и 630 нм. Данный прием обеспечивал исключение вклада в оптическую плотность, полученную на 450 нм, структурных особенностей образца, вызывающих отражение/поглощение света, специфически не связанное с желтой областью спектра.
Количественные оценки, полученные двумя описанными методами, имели высокую степень корреляции (корреляция Пирсона: r = 0.87, p < < 0.001, n = 42). В настоящей работе мы использовали первый метод (определение насыщенности цвета в программе ImageJ) как менее трудоемкий.
Эксперименты по ссаживанию самцов
Экспериментальные самцы (n = 12) были пойманы осенью 2019 г. и содержались в индивидуальных клетках при естественном освещении и температуре (эти особи были использованы также и в описанном выше анализе окраски рулевых перьев). Птиц кормили семенами подсолнечника и зерносмесью “RIO” для лесных певчих птиц. Эксперимент был начат 20 февраля 2020 г. В этот день в каждую из шести клеток размером 35 см (высота) × 40 см (длина) × 25 см (ширина) посадили по два самца. В четырех клетках содержали молодых птиц (возрастом менее года), а в двух других – птиц старшего возраста. Основной задачей опытов было оценить взаимосвязь размера черной дистальной части рулевого пера как предположительно индивидуально-стабильного показателя (см. Результаты) с уровнем агрессивности птицы. Поэтому “пары” подбирались таким образом, чтобы входящие в них самцы были контрастны по протяженности черной части рулевого пера, но имели сходную интенсивность желтой окраски хвоста (за одним исключением) и относились к одной возрастной когорте.
Самцы содержались “парами” в течение 20 дней. По истечении этого срока в каждой клетке легко можно было определить доминанта (более агрессивная особь) и подчиненного. Дело в том, что все подчиненные зеленушки потеряли большую часть оперения затылочной области: оно было выщипано доминантом. При этом доминанты во всех клетках целиком сохранили оперение на затылке. Отметим, сам факт выщипывания перьев мы неоднократно фиксировали визуально. Далее мы сравнили хвостовое оперение доминантов и подчиненных как описано выше.
Для уточнения результатов проведенных экспериментов в с. Ярустово (Рязанская обл.) в мае–июне 2020 г. мы провели провизорные наблюдения над дикими зеленушками на стационарной кормушке. Часть самцов из числа регулярно посещавших кормушку были помечены цветными кольцами (n = 12). Хотя эти наблюдения носят предварительный характер, мы решили привести их в данной работе.
Статистический анализ
Взаимосвязь протяженности черной части пера и интенсивности желтой окраски, а также влияние на эти параметры возраста птицы оценивали при помощи обобщенных линейных моделей (GLM: generalized linear models) с Гауссовским распределением. Распределение двух изученных параметров (протяженность черной части пера и интенсивность желтой окраски) не отличалось от нормального (тест Шапиро-Уилка: p > 0.05). Поэтому, применяя одномерную статистику, мы использовали параметрические тесты – корреляцию Пирсона и критерий Стьюдента, а для характеристики выборок использовали среднее ± ± стандартное отклонение. Анализ проводили в среде программирования R 4.0.1 (R Core Team, 2020).
РЕЗУЛЬТАТЫ
Меланиновая и каротиноидная окраска хвостовых перьев
Длина опахала изученных рулевых перьев отличалась у годовалых и птиц более старшего возраста (критерий Стьюдента: t = 3.37, p = 0.002). Перья птиц первой группы были достоверно короче: 53.9 ± 1.4 мм (разброс 51–57 мм, n = 71) против 54.8 ± 1.3 мм (разброс 52–57 мм, n = 38) у птиц возрастом 2 и более лет.
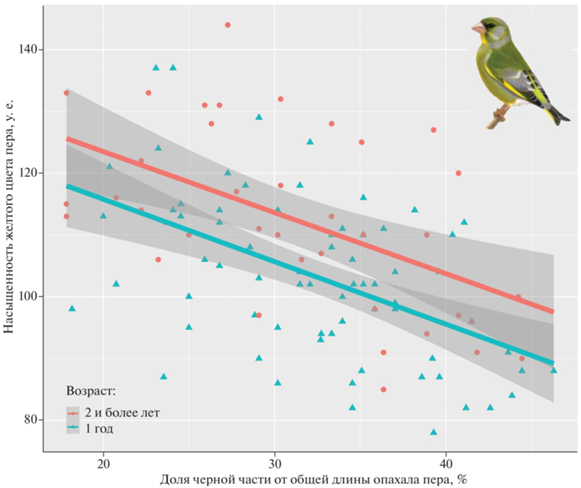
При этом длина (в % от длины всего опахала) черной дистальной части пера не зависела от возраста птицы (GLM; t = –0.73, p = 0.466), но зависела от интенсивности желтой окраски проксимальной части (основания) того же пера (GLM; t = –6.14, p < 0.001). Коэффициент корреляции Пирсона между длиной (%) черной части пера и интенсивностью желтой окраски (рис. 2) для всей выборки самцов составил: r = –0.52 (n = 109, p < < 0.001), только для годовалых птиц: r = –0.50 (n = 71, p < 0.001), а для более взрослых (возрастом 2 года и более): r = –0.53 (n = 38, p < 0.001). Интенсивность желтой окраски основания пера, в свою очередь, зависела не только от черной проксимальной части (GLM; t = –6.14, p < 0.001), но и от возраста (GLM; t = –3.35, p = 0.001). Самцы в возрасте двух и более лет в среднем имели более яркий хвост: интенсивность желтой окраски составила у них 112.7 ± 14.5 у.е. (разброс значений 85–144 у.е., n = 38) против 103.1 ± 13.2 у.е. (разброс 78–137 у.е., n = 71) у годовалых зеленушек (различия между возрастными группами достоверны по критерию Стьюдента: t = 3.38, p = = 0.001).
Рис. 2.
Взаимосвязь обилия черного цвета на дистальной части рулевого пера с насыщенностью желтой окраски в основании того же пера у самцов зеленушки разного возраста.
Таким образом, у самцов зеленушки насыщенность желтых участков рулевого оперения обратно пропорциональна длине черного пятна на тех же перьях. При этом, судя во всему, с возрастом хвост становится ярче, а вот количество черного не меняется. Эту закономерность подтверждают также результаты повторных измерений одних и тех же зеленушек, отловленных в последовательные годы. Измеренные хвостовые перья были у них, очевидно, разными, так как птицы линяли в периоды между отловами. Всего таких самцов было 9. Но образцы перьев в оба года отлова мы взяли только у пяти из них – в первый год отлова трое из них были годовалыми, а двое имели возраст не менее 2 лет (рис. 3а–3б). Таким образом, данных для статистического анализа недостаточно. Тем не менее в большинстве случаев (как у годовалых, так и у более взрослых птиц) насыщенность желтого оперения возросла на второй год отлова по сравнению с первым. В то же время, относительный размер черной дистальной части пера не изменился. Еще для четырех птиц (т.е. всего для 9) мы измерили длину (мм) черной дистальной части пера – значения этого показателя также были индивидуально-повторяемы (рис. 3в).
Связь окраски с агрессивностью птицы
Эксперименты показали, что при парных ссаживаниях во всех случаях доминантом становился самец с меньшим размером черного пятна на рулевом пере (табл. 1). Эти лабораторные результаты подтверждаются нашими провизорными наблюдениями в природе. Было замечено, что ни одна из восьми меченых особей (4 годовалые и 4 – возрастом не менее двух лет), имевших протяженность черного на рулевом пере от 19 до 23 мм (что соответствует приблизительно 35–45% от длины всего пера), обычно не проявляли агрессивности по отношению к прочим самцам. При этом особи с более коротким черным пятном (5 птиц: доля черного 23.5–28.5% от длины пера) занимали центральное положение на кормушке и проявляли агрессию по отношению к другим самцам.
Таблица 1.
Параметры окраски 2-го рулевого пера доминанта и подчиненного самца
| № клетки | Возраст | Доминант | Подчиненный самец | ||
|---|---|---|---|---|---|
| Доля черной части от общей длины опахала пера, % | Насыщенность желтого цвета пера, у. е. | Доля черной части от общей длины опахала пера, % | Насыщенность желтого цвета пера, у. е. | ||
| 1 | Не менее 2-х лет | 26.3 | 128 | 38.6 | 127 |
| 2 | Не менее 2-х лет | 23.6 | 112 | 41.5 | 96 |
| 3 | 1 год | 25.9 | 106 | 35.2 | 110 |
| 4 | 1 год | 28.8 | 97 | 35.2 | 102 |
| 5 | 1 год | 26.8 | 105 | 41.5 | 97 |
| 6 | 1 год | 23.2 | 124 | 35.1 | 88 |
В то же время насыщенность желтого цвета, судя по всему, не влияет на агрессивность птиц. Об этом свидетельствует, во-первых, широкая изменчивость интенсивности желтой окраски у доминантов и подчиненных птиц в опытах (табл.). А во-вторых – аналогичная изменчивость у птиц на кормушке. У неагрессивных птиц (протяженность черного 19–25 мм) насыщенность желтого цвета на 2-м рулевом пере варьировала от 91 до 128 у.е. у птиц возрастом не менее двух лет (n = 4) и от 97 до 112 у.е. у годовалых особей (n = 4). Т.е. покрывала значительную часть спектра изменчивости этого параметра для всех изученных зеленушек (см. рис. 2).
ОБСУЖДЕНИЕ
В данной работе мы показали, что у самцов зеленушки насыщенность желтой каротиноидной окраски имеет обратную связь с протяженностью черного (меланинового) пятна на одном и том же рулевом пере. Доля черного обратно-пропорциональна доле желтого (ведь перо двухцветное), поэтому правомерно и обратное толкование: чем более насыщенна желтая окраска, тем более протяженно желтое поле данного пера. Кроме того, окраска оказалась связанной с агрессивностью птицы: более агрессивные самцы имели меньших размеров черное пятно на хвосте (и, соответственно, бóльшую площадь желтого цвета). А вот интенсивность желтой окраски на агрессивность, вероятно, не влияла.
Связь уровня агрессивности с окрасочными признаками выявлена и у некоторых других видов птиц. Это касается как меланиновой, так и каротиноидной окраски (Pryke et al., 2002; Ducrest et al., 2008). Однако есть немало исследований, где рассматриваемую связь изучали, но не обнаружили. К примеру, у мексиканской чечевицы (Haemorhous mexicanus) красная каротинодная окраска не была связана с доминантным статусом самца (McGraw, Hill, 2000). Интересен пример с домовым воробьем (Passer domesticus), у которого размер черной манишки на горле и груди традиционно считают показателем доминантного статуса и уровня агрессивности его обладателя. Недавний мета-анализ показал, что имеющиеся материалы в совокупности говорят скорее об отсутствии связи либо о наличии очень слабой зависимости (Sánchez-Tójar et al., 2018).
Индивидуальные вариации меланиновой и каротиноидной окрасок, а также поведения (в т.ч. агрессивного), могут быть обусловлены следующими группами причин: (1) генетической (наследственной) разнокачественностью особей; (2) различиями в условиях жизни птиц в “детстве”; (3) различиями в состоянии разных особей в данный момент (применительно к окраске оперения – на момент линьки).
Роли генетических факторов и условий развития в ранний период жизни (группы причин № 1 и № 2) нередко бывает трудно разделить. Во-первых, в ряде случаев обе эти причины влияют одновременно (Slagsvold, Lifjeld, 1992). Во-вторых, более качественные птицы могут, в свою очередь, обеспечивать более качественные условия жизни своим потомкам – например, обильнее кормить их (Wendeln, Becker, 1999; Siefferman, Hill, 2003). Говоря об индивидуальных вариациях в оперении и агрессивности зеленушек, мы, очевидно, не может дифференцировать здесь роли генетических и онтогенетических факторов. Но мы считаем, что эти факторы (один или другой, либо оба сразу) играют ключевую роль. А состояние особи в данный момент (группа причин № 3) менее важна. В пользу этого говорят данные по индивидуальной стабильности разных признаков, а также взаимосвязям между ними.
Во-первых, размер черного пятна на хвосте, возможно, является индивидуальной характеристикой, остающейся более или менее постоянной на протяжении по крайней мере двух лет жизни особи. Однако из-за малого объема выборки пока это остается только предположением.
Во-вторых, интенсивность желтой окраски также, вероятно, различна у разных особей – хотя и предсказуемо увеличивается с возрастом. Мы имеем ввиду, что если один самец ярче другого в годовалом возрасте, то он скорее всего будет ярче и позже, в возрасте двух и более лет. Наши собственные данные в целом недостаточны для такого заключения, однако подтверждающие этот тезис материалы имеются и в литературе. Исследование эстонских ученых показало, что интенсивность желтой окраски оперения зеленушки зависит не только от диеты, но также от индивидуальных, физиологическими и/или генетическими особенностей птиц (Karu et al., 2007).
Наконец, в-третьих, интенсивность желтого цвета достоверно зависит от протяженности черного пятна. А последний признак связан с агрессивностью птицы. Уровень агрессивности – это обычно индивидуальная черта, остающаяся неизменной на протяжении всей жизни особи либо заметной ее части (Réale et al., 2007).
Тем не менее мы не считаем, что меланиновая и каротиноидная окраска зеленушки никак не зависят от сиюминутного состояния особи. Мы уже упоминали о том, что различные паразитарные инфекции негативно сказываются на насыщенности желтой окраски (Merilä et al., 1999; Lindström, Lundström, 2000; Hõrak et al., 2004), а насыщенность черной окраски может зависеть у этого вида от уровня окислительного стресса (Hõrak et al., 2010). Однако наши данные говорят о том, что сиюминутное состояние птицы не является основным детерминантом как меланиновой, так и каротиноидной окраски у зеленушки.
Таким образом, на основе полученных данных мы предполагаем, что как меланиновая, так и каротиноидная окраска могут интегрально отражать качество особи и особенности ее поведения (например, агрессивность) – т.е. характеристики, остающиеся относительно постоянными на протяжении всей жизни особи. Выявленная зависимость между меланиновой и каротинодиной окрасками говорит о том, что роли этих групп пигментов в качестве подобных показателей (маркеров) могут быть не столь принципиально различными, как это часто считается. Тем не менее различия между меланиновой и каротиноидной окраской в этом смысле определенно есть: черная меланиновая окраска у зеленушки связана с агрессивностью, а желтая каротиноидная – если и связана, то в значительно меньшей степени. Дальнейшее изучение особей, сочетающих в себе крайние проявления насыщенности желтого и доли черного на рулевом пере, позволит более детально определить, какие характеристики птицы отражает каждый из этих типов окраски.
Список литературы
Мосалов A.A., Коблик E.A., 2017. Окрасочные признаки, как маркеры базальных групп певчих воробьиных (Oscines, Passeriformes, Aves) // Труды Мензбировского орнитологического общества. Вып. 3. С. 96–111.
Abolins-Abols M., Kornobis E., Ribeca P., Wakamatsu K., Peterson M.P., Ketterson E.D., Milá B., 2018. Differential gene regulation underlies variation in melanic plumage coloration in the dark-eyed junco (Junco hyemalis) // Molecular Ecology. V. 27. P. 4501–4515.
Badyaev A.V., Hill G.E., 2000. Evolution of sexual dichromatism: contribution of carotenoid- versus melanin-based coloration // Biological Journal of the Linnean Society. V. 69. P. 153–172.
Bókony V., Garamszegi L.Z., Hirschenhauser K., Liker A., 2008. Testosterone and melanin-based black plumage coloration: a comparative study // Behavioral Ecology and Sociobiology. V. 62. P. 1229–1238.
Costantini D., Møller A.P., 2008. Carotenoids are minor antioxidants for birds // Functional Ecology. V. 22. P. 367–370.
Decker A., McGinnis J., 1947. Black pigmentation in feathers of buff orpington chicks is caused by vitamin D deficiency // Proceedings of the Society for Experimental Biology. V. 66. P. 224–228.
Ducrest A.-L., Keller L., Roulin A., 2008. Pleiotropy in the melanocortin system, coloration and behavioural syndromes // Trends in Ecology & Evolution. V. 23. P. 502–510.
Griffith S.C., Parker T.H., Olson V.A., 2006. Melanin-versus carotenoid-based sexual signals: is the differences really so black and red? // Animal Behaviour. V. 71. P. 749–763.
Guindre-Parker S., Love O.P., 2014. Revisiting the condition-dependence of melanin-based plumage // Journal of Avian Biology. V. 45. P. 29–33.
Hill G.E., 2000. Energetic constraints on expression of carotenoid-based plumage coloration // Journal of Avian Biology. V. 31. P. 559–566.
Hõrak P., Ots I., Vellau H., Spottiswoode C., Møller A.P., 2001. Carotenoid-based plumage coloration reflects hemoparasite infection and local survival in breeding great tits // Oecologia. V. 126. P. 166–173.
Hõrak P., Saks L., Karu U., Ots I., Surai P.F., McGraw K.J., 2004. How coccidian parasites affect health and appearance of greenfinches // Journal of Animal Ecology. V. 73. P. 935–947.
Hõrak P., Sild E., Soomets U., Sepp T., Kilk K., 2010. Oxidative stress and information content of black and yellow plumage coloration: an experiment with greenfinches // Journal of Experimental Biology. V. 213. P. 2225–2233.
Karu U., Saks L., Hõrak P., 2007. Carotenoid coloration in greenfinches is individually consistent irrespective of foraging ability // Physiological and Biochemical Zoology. V. 80. P. 663–670.
Koch R.E., Kavazis A.N., Hasselquist D., Hood W.R., Zhang Y., Toomey M.B., Hill G.E., 2018. No evidence that carotenoid pigments boost either immune of antioxidant defenses in a songbird // Nature Communication. V. 9:491.
Lindström K., Lundström J., 2000. Male greenfinches (Carduelis chloris) with brighter ornaments have higher virus infection clearance rate // Behavioral Ecology and Sociobiology. V. 48. P. 44–51.
McGraw K., 2003. Mechanisms of carotenoid-based coloration. In: Hill G.E., McGraw K.J. Bird coloration. V. I. Mechanisms and measurements. Cambridge. MA: Harvard University Press. P. 177–242.
McGraw K., 2003a. Mechanisms of melanin-based coloration. In: Hill G.E., McGraw K.J. Bird coloration. V. I. Mechanisms and measurements. Cambridge. MA: Harvard University Press. P. 243–294.
McGraw K., Hill G.E., 2000. Carotenoid-based ornamentation and status signalling in the house finch // Behavioral Ecology. V. 11. P. 520–527.
McGraw K.J., Hill G.E., Stradi R., Parker R.S., 2001. The influence of carotenoid acquisition and utilization on the maintenance of species-typical plumage pigmentation in male American Goldfinches (Carduelis tristis) and Northern Cardinals (Cardinalis cardinalis) // Physiological and Biochemical Zoology. V. 74. P. 843–852.
Merilä J., Sheldon B.C., Lindström K., 1999. Plumage brightness in relation to haematozoan infections in the greenfinch Carduelis chloris: bright males are a good bet // Ecoscience. V. 6. P. 12–18.
Navara K.J., Hill G.E., 2003. Dietary carotenoid pigments and immune function in a songbird with extensive carotenoid-based plumage coloration // Behavioral Ecology. V. 14. P. 909–916.
Pryke S.R., Andersson S., Lawes M.J., Piper S.E., 2002. Carotenoid status signaling in captive and wild red-collared widowbirds: independent effects of badge size and color // Behavioral Ecology. V. 13. P. 622–631.
R Core Team., 2020. R: A language and environment for statistical computing. Vienna. https://www.R-project.org
Réale D., Reader S.M., Sol D., McDougall P.T., Dingemanse N.J., 2007. Integrating animal temperament within ecology and evolution // Biological Reviews. V. 82. P. 291–318.
Riedler R., Pesme C., Druzik J., Gleeson M., Pearlstein E., 2014. A review of color-producing mechanisms in feathers and their influence on preventive conservation strategies // Journal of the American Institute for Conservation. V. 53. P. 44–65.
Roulin A., 2016. Condition-dependence, pleiotropy and the handicap principle of sexual selection in melanin-based colouration // Biological Reviews. V. 91. P. 328–348.
Saks L., McGraw K.J., Hõrak P., 2003. How feather colour reflects its carotenoid content // Functional Ecology. V. 17. P. 555–561.
Sánchez-Tójar A., Nakagawa S., Sánchez-Fortún M., Martin D.A., Ramani S., Girndt A., Bókony V., Kempenaers B., Liker A., Westneat D.F., Burke T., Schroeder J., 2018. Meta-analysis challenges a textbook example of status signalling and demonstrates publication bias // eLife. V. 7. e37385.
Schielzeth H., Kempenaers B., Ellegren H., Forstmeier W., 2012. QTL linkage mapping of Zebra Finch beak color shows an oligogenic control of a sexually selected trait // Evolution. V. 66. P. 18–30.
Siefferman L., Hill G.E., 2003. Structural and melanin coloration indicate parental effort and reproductive success in male eastern bluebirds // Behavioral Ecology. V. 14. P. 855–861.
Simons M.J.P., Cohen A.A., Verhulst S., 2012. What does carotenoid-dependent coloration tell? Plasma carotenoid level signals immunocompetence in birds – a meta-analysis // PLoS One. V. 7. e43088.
Slagsvold T., Lifjeld J.T., 1992. Plumage color in a condition-dependent sexual trait in male pied flycatchers // Evolution. V. 46. P. 825–828.
Stoddard M.C., Prum R.O. 2011. How colorful are birds? Evolution of the avian plumage color gamut // Behavioral Ecology. V. 22. P. 1042–1052.
Stoehr A.M., Hill G.E., 2001. The effects of elevated testosterone on plumage hue in male House Finches // Journal of Avian Biology. V. 32. P. 153–158.
Svensson L., 1992. Identification guide to European passerines. 4th edition. Stockholm. 368 p.
Svobodová J., Gabrielová B., Synek P., Marsik P., Van$\overset{\lower0.5em\hbox{$\smash{\scriptscriptstyle\smile}$}}{e} $k T., Albrecht T., Vinkler M., 2013. The health signaling of ornamental traits in the grey partridge (Perdix perdix) // Journal of Ornithology. V. 154. P. 717–725.
Svobodová J., Gabrielová B., Hyršl P., Albrecht T., Vinkler M., 2016. Melanin and carotenoid ornaments are related to the individual condition in free-living grey partridges (Perdix perdix) // Journal of Ornithology. V. 157. P. 1007–1015.
Thompson C.W., Hillgarth N., Leu M., McClure H.E., 1997. High parasite load in house finches (Carpodacus mexicanus) is correlated with reduced expression of a sexually selected trait // American Naturalist. V. 149. P. 270–294.
Veiga J.P., Puerta M., 1996. Nutritional constraints determine the expression of a sexual trait in the house sparrow, Passer domesticus // Proceedings of the Royal Society of London B. V. 263. P. 229–234.
Weaver R.J., Santos E.S.A., Tucker A.M., Wilson A.E., Hill G.E., 2018. Carotenoid metabolism strengthens the link between feather coloration and individual quality // Nature Communication. V. 9. Article № 73. P. 1–9.
Wendeln H., Becker P.H., 1999. Effects of parental quality and effort on the reproduction of common terns // Journal of Animal Ecology. V. 68. P. 205–214.
Wolfenbarger L.L., 1999. Red coloration of male northern cardinals correlated with mate quality and territory quality // Behavioral Ecology. V. 10. P. 80–90.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал