Зоологический журнал, 2022, T. 101, № 3, стр. 294-313
Нейрогенез в центральной нервной системе насекомых и его своеобразие в грибовидных телах головного мозга
А. А. Панов *
Институт проблем экологии и эволюции имени А.Н. Северцова РАН
119071 Москва, Ленинский просп. 33, Россия
* E-mail: tortrix@yandex.ru
Поступила в редакцию 17.02.2021
После доработки 22.03.2021
Принята к публикации 27.03.2021
- EDN: UKJSRN
- DOI: 10.31857/S0044513422030114
Аннотация
Нейрогенез подразделяется на два основных этапа: пролиферативный и этап дифференцировки. Нейральные стволовые клетки были открыты у насекомых почти полтора столетия назад, в 1885 г. А.А. Коротневым, назвавшим их ганглиозными клетками, а введение термина нейробласт было сделано У.М. Уилером в 1891 г. Первоначально существовало предположение об одноступенчатости процесса нейрогенеза. Считалось, что меньшие дочерние клетки нейробласта непосредственно дифференцируются в нервные клетки. Установление двухступенчатости процесса и введение понятия (термина) ганглиозная материнская клетка, как особого этапа нейрогенеза, было сделано В. Бауэром в 1904 г. Более чем через столетие было обнаружено, что такой тип нейрогенеза – не единственный, а имеется второй, трехступенчатый. Он характеризуется включением дополнительного звена между нейробластом и ганглиозной материнской клеткой, названного промежуточным нейральным прогенитором. Традиционные нейробласты стали называться нейробластами типа I, а нейробласты, дающие при делении промежуточный нейральный прогенитор, – нейробластами типа II. Современный этап изучения нейрогенеза характеризуется резким сужением круга исследуемых видов практически до одного, Drosophila melanogaster, и введением в практику исследований огромного арсенала молекулярно-генетических методов, что позволило выяснить тонкие механизмы управления нейрогенезом. При сопоставлении судьбы одиночных нейробластов типа I в ходе развития насекомого выделены 4 типа их функционирования: 1) только в течение эмбрионального времени; 2) непрерывное у эмбрионов и личинок; 3) прерывистое с периодом покоя в позднем эмбриогенезе – начале личиночной стадии; 4) в виде двух независимых поколений нейробластов, эмбрионального и постэмбрионального. Особенность начального этапа нейрогенеза в грибовидных телах заключается в большей продолжительности митотической активности нейробластов и в наличии агрегаций нейробластов разного происхождения. Предположено, что некоторые из нейробластов грибовидных тел могут быть нейробластами типа II. На втором этапе нейрогенеза происходит формирование многообразия клеток Кеньона, собственных клеток грибовидных тел. Как и у потомков одиночных нейробластов клеточной коры, оно зависит от времени их образования.
Имеется несколько причин, побудивших автора написать этот краткий обзор. Во-первых, вспомнить исследователей, работы которых легли в основу наших современных знаний хода эмбриогенеза нервной системы, но, к сожалению, все реже упоминаются в современной научной литературе. Во-вторых, подчеркнуть многообразие течения нейрогенеза у различных представителей такой огромной группы животных, какой являются насекомые. И, в-третьих, попытаться хоть как-то стимулировать исследования по развитию насекомых в России тем более, что именно такие российские ученые, как И.И. Мечников. А.О. Ковалевский, А.А. Коротнев, А.А. Тихомиров и др. в середине XIX в. стали основоположниками биологии развития, широко используя насекомых в качестве объектов исследований.
ИСТОРИЯ ИЗУЧЕНИЯ НАЧАЛЬНОГО, ПРОЛИФЕРАТИВНОГО ЭТАПА НЕЙРОГЕНЕЗА В ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЕ НАСЕКОМЫХ
Развитие центральной нервной системы насекомых стало интенсивно изучаться в последней четверти XIX века. Было найдено, что туловищный отдел нервной системы насекомых закладывается у эмбрионов в виде двух продольных валиков (нервных валиков), идущих медиально вдоль зародышевой полоски и разделенных углублением, нервной бороздой. По сторонам от стомодеального впячивания они переходят в лопастные зачатки головного мозга (Kowalevski, 1871). Гистологическое строение нервных валиков на поперечных срезах зародышевой полоски бабочки-златогузки (Euproctis chrysorrhoea) было впервые изучено Гачеком (Hatschek, 1877). Он установил, что первоначально эктодерма в области валиков едина, но затем она расслаивается на дерматогенный и нейрогенный слои клеток. Дерматогенный слой не утолщается, а число клеток, формирующих нейрогенный слой, сильно возрастает. В результате образуются два боковых нервных тяжа, которые впоследствии подразделяются на ганглии. Клеточный слой нервных тяжей рассматривался Гачеком как собрание однотипных клеток. Гачек также описал появление первых нервных волокон, которых постепенно становится больше, и они в итоге формируют волокнистое вещество.
Открытие стволовых клеток в составе эмбриональных зачатков нервной системы принадлежит Коротневу (Korotneff, 1885), который исследовал эмбриональное развитие медведки Gryllotalpa gryllotalpa. Он обнаружил, что некоторые из эктодермальных клеток зоны нервного валика начинают расти, их ядра значительно увеличиваются и митотически делятся. Коротнев назвал эти клетки ганглиозными. По его словам, каждая ганглиозная клетка делится таким образом, что образуется целый столбик вновь возникших дочерних клеток, и на срезах легко различить, какая группа клеток соответствует ганглиозной клетке, расположенной ближе к поверхности зародышевой полоски (рис. 1). Благодаря такому умножению клеток нервный валик становится все более и более высоким. Более того, Коротнев был убежден, что дочерние клетки, окружающие ганглиозные клетки, также делятся, но картины кариокинеза, по его словам, не так легко было увидеть, потому что ядра дочерних клеток значительно мельче и плотнее.
Рис. 1.
Возникновение нервных клеток в нервном узле Gryllotalpa gryllotalpa (Korotneff, 1885): Ecn – нейроэктодермальные (ганглиозные) клетки.
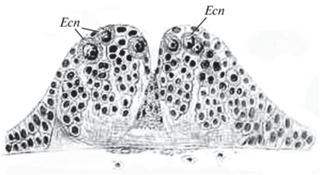
Клетки, подобные ганглиозным клеткам Коротнева, были обнаружены в эмбриональных зачатках нервных ганглиев и других насекомых: у мухи Lucilia, жуков Chrysomela tremulae и Melolontha (Graber 1889), саранчового Stenobothrus variabilis (Graber 1890) и жука Meloe proscarabaeus (Nusbaum 1891), однако по сравнению с работой Коротнева эти публикации ничего нового не содержали.
Следующий этап выяснения генезиса нервных клеток связан с работами двух исследователей, В.М. Уилера (W.M. Wheeler) и М. Виаллана (M.H. Viallanes), которые опубликовали свои работы почти одновременно. В первой по срокам публикации работе Уилера (Wheeler, 1889) были приведены результаты изучения эмбрионального развития таракана Blattella germanica и колорадского картофельного жука (Leptinotarsa decemlineata). Гистогенез нервной системы был исследован преимущественно у колорадского жука, и, в принципе, были повторены результаты, полученные Коротневым. Так, у колорадского жука было найдено, что на ранних стадиях развития эмбриона наружная часть нервных валиков занята некоторым числом крупных, светло окрашивающихся клеток, которые интенсивно делятся митотически и которые были названы ганглиобластами, т.к. в результате их делений увеличивается количество клеток, названных ганглиозными. Судьба ганглиозных клеток Уилером не обсуждалась и, таким образом, в качестве делящихся клеток рассматривались только ганглиобласты.
В следующей публикации Уилер подробно описал гистогенез центральной нервной системы у эмбрионов кузнечика Conocephalus ensiferum (Wheeler, 1891). Для обозначения делящихся крупных клеток в нервных валиках Уилер вместо названия ганглиобласт впервые применил термин нейробласт, который до этого неоднократно применялся разными авторами для обозначения клеток различного типа и у разных животных. Как показала история, этому термину была уготована долгая жизнь: для обозначения нейральных стволовых клеток в нервной системе насекомых он широко применяется и по сей день. Уилер установил, что в каждом нервном валике эмбриона Conocephalus нейробласты располагаются в четыре продольных ряда от ануса до стомодеального впячивания, где они огибают его и продолжаются в головные лопасти. В последних к ним добавляются еще восемь рядов нейробластов. У эмбрионов кузнечика на ранних этапах развития очень хорошо обнаруживается организация нервных валиков из рядов клеток: нейробласты находятся у наружной поверхности валика и возглавляют колонны более мелких клеток (рис. 2). Эти клетки, по данным Уилера, отпочковываются от внутренней стороны нейробластов и являются будущими ганглиозными клетками (нейронами).
Рис. 2.
Поперечный разрез брюшного ганглия эмбриона кузнечика Conocephalus ensiferum (Wheeler, 1891): E – дерматогенные клетки, G – нервные клетки, M – нейробласт медиального тяжа, P – нейропиль, S1–S4 – нейробласты на разных этапах деления.
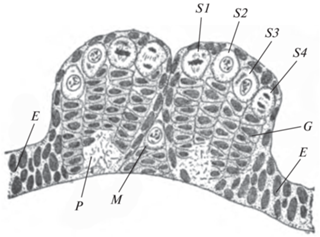
При исследовании развития мозга Conocephalus Уилер обнаружил, что мелкие дочерние клетки нейробластов сами также могут делиться. Оси их делений располагаются под прямым углом к осям веретен нейробластов. Таким образом, каждый нейробласт оказывается на вершине колонны, состоящей из 2 или 4 рядов ганглиозных клеток, которые произошли благодаря делению первоначально единственной в этом ряду клетке – нейробласта. Однако, как отметил Уилер, позднее клетки в ганглиях становятся так плотно расположенными, что нейробластам не хватает места для отпочкования потомков перпендикулярно поверхности ганглия, и потомки располагаются почти параллельно ей. После обрастания желтка зародышем нейробласты постепенно уменьшаются в размерах до такого состояния, что становятся неотличимыми от своего потомства, ганглиозных клеток.
Третья публикация Уилера (Wheeler, 1893) – это его докторская диссертация, включающая фактический материал двух предыдущих работ, перепроверка которого привела автора к неоднозначным выводам. После просмотра материала по колорадскому жуку он убедился, что некоторые из недавно образовавшихся мелких дочерних клеток нейробластов могут действительно митотически делиться и давать следующие поколения дочерних клеток. С другой стороны, он отказался от своих выводов о делениях дочерних клеток нейробластов у Conocephalus. По его мнению, дочерние клетки нейробластов, по-видимому, никогда не делятся, превращаются прямо в ганглиозные (т.е. нервные) клетки, и вся пролиферативная мощь сосредоточена в нейробластах. Свое прежнее предположение он объяснил тем, что при применявшейся им технике фиксации яиц нагреванием некоторые хроматиновые структуры в ядрах мелких дочерних клеток могли быть ошибочно приняты за картины кариокинеза.
В те же самые годы было проведено изучение развития нервной системы у эмбрионов обыкновенного богомола (Mantis religiosa) (Viallanes, 1890, 1891). В составе нервных валиков были выделены два рода клеток: ганглиогенные, крупные митотически делящиеся клетки, которые в один слой располагаются под дерматогенным слоем зародышевой полоски, и их потомки, ганглиозные, или нервные, клетки, лежащие в глубине нервных валиков. В мозге число ганглиогенных клеток постепенно увеличивается. Этот процесс Виаллан назвал самовоспроизводством ганглиогенных клеток. Затем рост числа ганглиогенных клеток прекращается, и они начинают делиться, образуя мелкие хромофильные дочерние клетки. Едва возникнув, эти клетки, по Виаллану, начинают активно самовоспроизводиться (делиться). В конце эмбрионального периода развития ганглиогенные клетки постепенно дегенерируют, уменьшаясь в размерах, обедняясь цитоплазмой и как бы “усыхая”. В это же время деления ганглиозных клеток продолжаются.
Следовательно, хотя Виаллан и писал об активном размножении дочерних клеток, он не выделял мелкие делящиеся клетки в качестве особого промежуточного поколения клеток между ганглиогенными клетками и дефинитивными нервными (ганглиозными) клетками. Следует заметить, что Виаллан не цитировал (не знал?) работ Гачека и Коротнева.
Таким образом, в начале 90-х годов XIX в. уже было твердо установлено, что в развивающейся нервной системе эмбрионов насекомых имеется относительно небольшое число особых клеток, названных Коротневым ганглиозными клетками, Виалланом – ганглиогенными и Уилером – нейробластами. Каждая такая клетка, митотически делясь, образует одну крупную, себе подобную дочернюю клетку и одну более мелкую клетку. Однако мнения о том, каким образом происходит последующее развитие этой мелкой клетки, различались. Виаллан был твердо уверен, что эти клетки сначала интенсивно размножаются и только потом превращаются в нервные клетки. Уилер, как было указано выше, не имел на этот счет твердого мнения. В большинстве же эмбриологических работ, опубликованных на рубеже XIX и XX веков, авторы склонялись к мнению о прямой дифференцировке меньших дочерних клеток нейробластов в ганглиозные (нервные) клетки (Heymons, 1895; Escherich, 1902; Lécaillon, 1908: Hirschler, 1909). Как отмечалось уже Уилером, неопределенность в установлении статуса меньших дочерних клеток нейробласта в значительной степени была связана с трудностью получения хороших гистологических препаратов эмбрионов насекомых, окруженных почти непроницаемым хорионом.
Кажется печальной судьба пионерской работы Коротнева, посвященной эмбриональному развитию большинства систем органов обыкновенной медведки. Эта работа широко цитировалась в литературе в связи с развитием зародышевых листков, пищеварительной системы и других органов, но не нервной системы. Например, его работа была цитирована Уилером, но не в связи с первоописанием ганглиозных клеток, а Виалланом вообще не была упомянута.
Этапным стало исследование Бауэром постэмбрионального нейрогенеза у насекомых (Bauer, 1904). Используя более адекватные методы фиксации и окраски, а также имея дело с более крупными клетками личинок разных насекомых, Бауэр впервые описал процесс асимметричного деления нейробластов и пришел к заключению, что Уилер был неправ, когда считал дочерние клетки нейробластов сразу превращающимися в ганглиозные клетки. Бауэр нашел, что вскоре после своего образования меньшие дочерние клетки нейробластов начинают делиться. В противоположность, например, Виаллану, он счел эти делящиеся клетки особым типом клеток и назвал их ганглиозными материнскими клетками, при делении каждой из которых образуются две клетки, впоследствии дифференцирующиеся в нейроны. Термин ганглиозная материнская клетка с тех пор прочно вошел в научную литературу. Бауэр, правда, не смог установить, один или несколько раз делится каждая ганглиозная материнская клетка (рис. 3).
Рис. 3.
Нервная система насекомых в период метаморфоза (Bauer, 1904). A – фронтальный разрез предкуколки рабочей особи – муравья Formica gagates. B – асимметричное деление нейробласта из пролиферативного центра грибовидного тела предкуколки Formica gagates. C – фронтальный разрез подглоточного ганглия личинки шершня Vespa crabro незадолго до наступления стадии предкуколки (ниже левого нейробласта – метафаза митоза ганглиозной материнской клетки). Af – клеточный отросток ганглиозной клетки, Ap – зачаток глаза, B1– первый пролиферативный центр зрительной доли; B2 – второй пролиферативный центр зрительной доли; Bh – пролиферативные центры грибовидного тела; Sz – нервные клетки зрительных ганглиев; F – β-доля; Gz – ганглиозные (нервные) клетки; Hg – гиподерма; Kb – полость головы; Lgz – личиночные нервные клетки; Mu – ротовые части; Nb – нейробласты; Oe – пищевод; Pn – перинейриум; Tr – трахея.
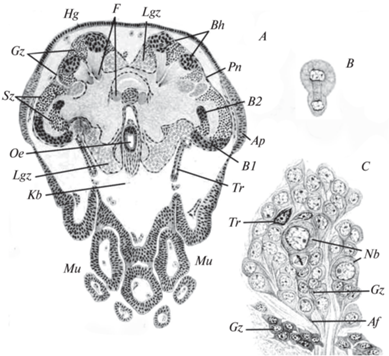
Несмотря на убедительность наблюдений Бауэра, многие исследователи как эмбрионального, так и постэмбрионального нейрогенеза продолжали долгое время считать, что меньшая дочерняя клетка нейробласта прямо дифференцируется в нервную клетку (Strindberg, 1913; Eastham, 1930; Baden, 1936; Roonwal, 1937; Butt, 1949; Roberts, 1955), и лишь немногие разделяли точку зрения Бауэра (Pyle, 1941; Risler, 1954; Johannson, 1957; Панов, 1957). У медоносной пчелы Нельсон (Nelson, 1915) видел в ганглиях эмбрионов деления меньших дочерних клеток нейробластов, но не мог решить, все они делятся или только какая-то их часть. Наконец, Шрадер (Schrader, 1938) допускал оба пути развития меньшей дочерней клетки нейробласта.
Несмотря на известность журнала, в котором была опубликована работа Бауэра, для многих авторов, исследовавших нейрогенез как у эмбрионов, так и на постэмбриональных стадиях развития, она, по-видимому, осталась неизвестной и не была цитирована во многих работах (Strindberg, 1913; Nelson, 1915; Eastham, 1930; Baden, 1936; Roonwal, 1937; Tiegs, Murray, 1938; Johannsen, Butt, 1941; Butt, 1949; Roberts, 1955).
Ход нейрогенеза и выделение малых дочерних клеток нейробластов в качестве особого типа клеток – ганглиозных материнских клеток, описанных Бауэром, – были сначала подтверждены в работе по постэмбриональному развитию нервной системы мельничной огневки (Schrader, 1938), а затем у медоносной пчелы (Панов, 1957). Бейт (Bate, 1976), по-видимому, не знакомый с работой Бауэра, в нервной системе эмбрионов перелетной саранчи выделил в особый тип малые дочерние клетки нейробластов, назвав их преганглиозными клетками, делящимися однократно. Современные исследования подтвердили правильность выводов Бауэра (Hartenstein, Campos-Ortega, 1984; Doe, 1992).
СОВРЕМЕННЫЙ ЭТАП ИЗУЧЕНИЯ НЕЙРОГЕНЕЗА В ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЕ НАСЕКОМЫХ
В последние десятилетия были развернуты обширные исследования молекулярно-генетических механизмов нейрогенеза у насекомых, проводившиеся почти исключительно на Drosophila melanogaster. В значительной степени это было связано с тем, что некоторые нарушения нейрогенеза у дрозофилы оказались по своим механизмам сходными с образованием опухолей в нервной системе человека (см., например, обзор Neumüller, Knoblich, 2009). Было обнаружено, что в эмбриональной нейроэктодерме, соответствующей будущим нервным валикам зародышевой полоски, имеются особые участки. Каждый такой участок состоит из 5–7 эквипотентных клеток, одна из которых увеличивается в размерах, выходит из слоя нейроэктодермальных клеток и становится нейробластом. Было также показано, что процессы формирования одного нейробласта и подавление потенций других соседних клеток определяются клеточными взаимодействиями на основе экспрессии ряда регуляторных белков (Doe et al., 1985; Skeath, Carroll, 1992).
Подавляющее большинство образующихся нейробластов как в брюшной цепочке, так и в мозге располагается отдельно друг от друга, функционирует независимо друг от друга и называется одиночными нейробластами. В центральной нервной системе дрозофилы было выделено 2 типа нейробластов. К типу I было отнесено подавляющее большинство ранее описанных нейробластов. Как уже было указано выше, эти нейробласты делятся неравномерно (асимметрично) с образованием двух различных клеток: дочернего нейробласта и ганглиозной материнской клетки. В основе асимметричности деления лежат сложные молекулярные процессы, подробно изученные в последние десятилетия. Результаты этих исследований обобщены в ряде обзоров (Knoblich, 2008; Doe, 2008; Homem, Knoblich, 2012; Harding, White, 2018) и сводятся к следующему.
Начальным этапом неравномерного деления является поляризация нейробласта, определяющая направление оси веретена и распределение в нейробласте белков-детерминаторов клеточного развития (“клеточной судьбы”). Последние образуют два комплекса, апикальный, остающийся в дочернем нейробласте, и базальный, который при делении переходит в ганглиозную материнскую клетку. Среди белков базального комплекса определяющую роль играет транскрипционный фактор Prospero, который подавляет молекулярную систему клеточных циклов и стимулирует гены клеточной дифференцировки (Choksi et al., 2006). Это приводит к тому, что ганглиозная материнская клетка делится только один раз, а два ее потомка дифференцируются в нейроны или клетки глии.
Второй тип нейробластов был обнаружен в медиальной части мозга эмбрионов и личинок дрозофилы (Bello et al., 2008; Boone, Doe, 2008; Bayraktar et al., 2010). Нейробласты этого типа также делятся асимметрично, но в результате их деления вместе с дочерним нейробастом образуется не ганглиозная материнская клетка, а так называемый промежуточный нейральный прогенитор. Эта клетка способна ограниченное число раз делиться на дочерний промежуточный нейральный прогенитор и типичную ганглиозную материнскую клетку. Формирование промежуточного нейрального прогенитора связано с низким уровнем Prospero в нейробластах типа II. Поэтому при их делении образуется не ганглиозная материнская клетка, а обладающий определенной пролиферативной активностью промежуточный нейральный прогенитор (Bayraktar et al., 2010).
ВРЕМЯ ФУНКЦИОНИРОВАНИЯ ОДИНОЧНЫХ НЕЙРОБЛАСТОВ
Судьба одиночных нейробластов, относящихся в подавляющем большинстве к нейробластам типа I и формирующих основную массу нейронов центральной нервной системы, прослежена лишь у представителей немногих групп насекомых.
Прямокрылые. Выделение нейробластов из нейроэктодермы у прямокрылых, как было указано выше, происходит типичным для насекомых путем. Они активно делятся на протяжении значительной части эмбрионального периода, но к концу его, как уже было показано в ранних работах (Wheeler, 1891; Viallanes, 1891; Roonwal, 1937), постепенно уменьшаются в размерах и перестают различаться. У Acheta domesticus сокращение числа нейробластов в брюшной цепочке начинается значительно раньше завершения эмбриогенеза. При этом процесс сначала начинается в брюшных ганглиях и только позднее – в грудных ганглиях и мозге. В итоге к моменту выхода из яйца одиночные нейробласты клеточной коры перестают идентифицироваться (Панов, 1966).
Подробно деятельность туловищных нейробластов была исследована у Locusta migratoria (Bate, 1976) и Schistocerca gregaria (Sheperd, Bate, 1990). У обоих саранчовых был установлен переднезадний градиент времени начала делений одиночных нейробластов и заднепередний градиент прекращения их делений. У перелетной саранчи сокращение числа выявляемых нейробластов совпадало с появлением деформированных нейробластов и многочисленных картин пикноза в слое нейробластов.
Исключение из общего для прямокрылых правила составляет обыкновенная медведка, у которой в связи с общим отставанием развития нервной системы делящиеся одиночные нейробласты были найдены в грудных ганглиях и мозге даже у нимф 1-го возраста (Панов, 1966).
Во всех исследованных случаях одиночные нейробласты клеточной коры не выявлялись на протяжении нимфального развития (Панов, 1957, 1966).
Двукрылые. У дрозофилы из туловищного отдела нейроэктодермы в целом выделяются около 500 нейробластов (Hartenstein et al., 1987), и около 100 в каждой половине головной нейроэктодермы (Urbach et al., 2003). В течение эмбрионального развития разные нейробласты делятся от более чем 5 до более чем 8 раз, образуя клоны клеток. При каждом делении нейробласты не дорастают до первоначальной величины, в конце эмбриогенеза прекращают делиться и становятся неотличимыми от соседних клеток.
У новорожденных личинок 1-го возраста нейробласты также не обнаруживаются. Однако позднее в периферической части клеточной коры некоторые клетки начинают увеличиваться в размерах и затем начинают делиться подобно эмбриональным нейробластам (Prokop, Technau, 1991). Как в мозге, так и в туловищных ганглиях новых нейробластов оказывается приблизительно в 1.5 раза меньше, чем эмбриональных, особенно мало их обнаруживается в брюшных ганглиях. Деления нейробластов продолжаются в течение личиночного периода.
Сразу, естественно, был поставлен вопрос, являются ли постэмбриональные нейробласты “проснувшимися” после периода покоя эмбриональными нейробластами или они являются вновь образованными? Было установлено, что потомки постэмбрионального нейробласта всегда появляются в одном и том же клоне с клетками, образованными в эмбриональный период. Кроме того, на основании BrdU мечения делившихся клеток можно было сделать предположение, что именно эмбриональные нейробласты, а не какие-либо другие клетки возобновляют деления у личинок как постэмбриональные нейробласты (Prokop, Technau, 1991). Позднее эти выводы были подтверждены путем молекулярно-генетического анализа клеточных клонов туловищного отдела центральной нервной системы дрозофилы (Birkenholz et al., 2015).
Перепончатокрылые. У медоносной пчелы выделение слоя нейробластов происходит на стадии IX (около 2 суток эмбрионального развития). Приблизительно с этого же времени они начинают делиться. Деления происходят в течение всего оставшегося периода эмбриогенеза и встречаются также у только что вышедшей из яйца личинки (рис. 4) (Nelson, 1915).
Рис. 4.
Горизонтальный разрез 3-го грудного ганглия новорожденной личинки медоносной пчелы (Nelson, 1915): Nb – нейробласты, NbM – делящиеся нейробласты.
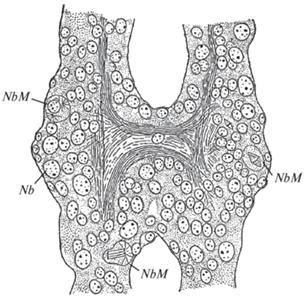
Чешуекрылые. По сравнению с предыдущими видами насекомых, изученные чешуекрылые обладают большим своеобразием хода нейрогенеза, впервые обнаруженным у мельничной огневки (Ephestia kühniella) (Schrader, 1938). В протоцеребральных долях полностью сформированного эмбриона было обнаружено большое число крупных интенсивно делившихся нейробластов. Несколько позднее нейробласты дегенерировали, исключая нейробласты грибовидных тел, дейтоцеребрума и зрительных долей. Подробно процесс дегенерации описан не был, но, судя по приводимому рис. 5, дегенерирующий нейробласт съеживался и становился сильнее окрашиваемым.
Рис. 5.
Последовательные этапы (A–E) формирования одиночных постэмбриональных нейробластов клеточной коры в головном мозге гусениц 3-го возраста китайского дубового шелкопряда (Antheraea pernyi) (Панов, 1963): A и B – стрелками указаны первые этапы дифференцировки постэмбриональных нейробластов, E – под нейробластом – метафаза митоза материнской ганглиозной клетки.
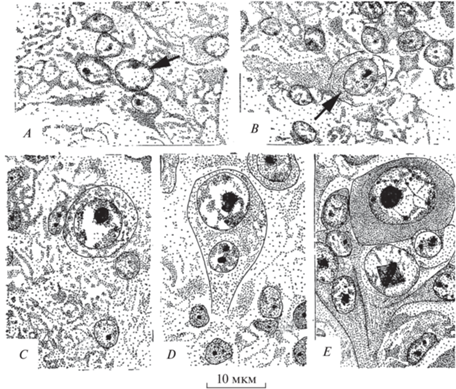
Среди клеток, встречавшихся в мозге эмбрионов и молодых гусениц, Шрадер выделил самые мелкие из них, имевшие, судя по его рис. 7 а, вид “голых ядер”. Он назвал их недифференцированными клетками, которые встречались по всему клеточному слою. В течение 1-го и 2-го гусеничного возраста эти клетки сильно увеличивались в размерах и к 3-му возрасту приобретали вид и свойства нейробластов. К концу 3-го возраста около них появлялись ганглиозные материнские клетки, не делившиеся вплоть до 6-го гусеничного возраста.
Практически та же самая картина была выявлена и у других исследованных в этом отношении чешуекрылых: павлиноглазки Antheraea pernyi (Панов, 1963), данаиды Danaus plexippus plexippus (Nordlander, Edwards, 1969) и бражника Manduca sexta (Booker, Truman, 1987). Так, у A. pernyi нейробласты выделяются из нейроэктодермы между 2-м и 3-м днями эмбриогенеза, вскоре начинают делиться, и их деления продолжаются до 6-го дня. На 6-й день, когда бластокинез уже завершился, происходит массовое отмирание нейробластов и ганглиозных материнских клеток, что подтверждается появлением многочисленных картин пикноза в поверхностном слое ганглиев, где располагались нейробласты. У более поздних эмбрионов и у гусениц 1-го возраста одиночные нейробласты не обнаруживались во всех туловищных ганглиях, а в мозге нейробласты сохранялись только в грибовидных телах, дейтоцеребруме и зрительных долях.
Во 2-м и, особенно, 3-м возрасте по всей поверхности нейропиля, граничащей с клеточной корой, среди ядер нейропилярной глии, лежащих на границе нейропиля и тел нейронов, появляются ядра особой структуры (рис. 5). Эти ядра постепенно увеличиваются в размере, и в них появляются крупные ядрышки. Вокруг все более увеличивающихся ядер становится видно цитоплазматическое окружение, и клетки начинают асимметрично делиться подобно одиночным нейробластам. При этом дочерние клетки в свою очередь делятся симметрично как типичные ганглиозные материнские клетки. Потомки нового нейробласта располагаются на его стороне, обращенной к нейропилю, и постепенно отодвигают нейробласт от нейропиля к поверхности ганглия. Формирование новых клеточных клонов, возглавляемых новыми нейробластами, протекает одинаково в туловищных ганглиях и мозге. Деления новых одиночных нейробластов продолжаются в туловищных ганглиях в течение 4-го и 5-го возрастов и заканчиваются у предкуколки. В мозге их деления можно было видеть даже у молодых куколок.
В мозге бабочки-монарха новые одиночные нейробласты прекращают делиться у полуторасуточных куколок. Приблизительно через одни сутки после этого в месте расположения нейробластов появляются многочисленные хроматиновые шарики, указывающие на дегенерацию нейробластов (Nordlander, Edwards, 1969).
Таким образом, образование постэмбриональных нейробластов у всех четырех исследованных чешуекрылых различного таксономического положения происходит сходным образом из некоторых клеток, которые характеризуются очень мелкими ядрами и цитоплазмой, не выявляемой применявшимися гистологическими методами. Эти клетки приурочены у трех видов к поверхности нейропиля, а у одного вида также встречаются в слое тел нейронов. Лежащие на поверхности нейропиля клетки являются клетками так называемой обкладочной глии (ensheating glia), происхождение которой у чешуекрылых неизвестно. У A. pernyi ее клетки во 2-м и 3-м возрастах уже многочисленны и интенсивно размножаются в ритме линек (Панов, 1960).
Происхождение глии на поверхности нейропиля туловищных ганглиев подробно исследовано у дрозофилы, у эмбрионов которой она образуется в результате нескольких делений глиобласта GP, расположенного в самой боковой части зачатков туловищных ганглиев (Schmidt et al., 1997). Первоначально таких клеток оказывается 9, и они идентичны клеткам продольной глии, которые являются также потомками GP (LGB) и после образования мигрируют к местам их окончательного расположения вдоль коннектив (Jacobs at al., 1989). У поздних эмбрионов и новорожденных личинок клетки не делятся, и, следовательно, их число в это время остается постоянным. Далее число клеток нейропилярной глии растет медленно в течение 1-го и 2-го личиночных возрастов и резко увеличивается в течение 3-го возраста. Например, в мозге к концу 3-го возраста их насчитывается уже от 17 до 90. При этом считается, что это происходит как за счет деления самих глиальных клеток, так и дифференцировки в глию некоторых потомков постэмбриональных нейробластов (Pereanu et al., 2005).
Клетки на поверхности нейропиля, из которых развиваются постэмбриональные нейробласты у табачного бражника, были названы покоящимися нейробластами (Booker, Truman, 1987). Возможно, это было сделано по аналогии с дрозофилой. Однако происхождение постэмбриональных нейробластов у дрозофилы и чешуекрылых совершенно различно. У дрозофилы как уже было указано выше, постэмбриональные нейробласты начинают проявляться в поверхностной части клеточного слоя во главе уже существующего клона клеток, образованных в эмбриональное время (первичных нейронов). Вторичные нейроны, производимые постэмбриональным нейробластом, являются составной частью того же клона. Клетки на поверхности нейропиля чешуекрылых, каким бы ни было их происхождение, формируют клоны клеток заново не у поверхности клеточной коры, а у самого нейропиля, и только позже, по мере увеличения клеток в клоне, сдвигаются в толщу клеточной коры.
Таким образом, на основе имеющихся данных можно установить следующие варианты деятельности одиночных нейробластов (по-видимому, у всех насекомых нейробласты грибовидных тел, дейтоцеребрума и зрительных долей имеют специфическую программу функционирования):
1. Функционирование только в течение эмбриогенеза характерно, по-видимому, для насекомых с неполным превращением. Известное исключение – обыкновенная медведка, у которой, по-видимому, в связи с заботой о потомстве произошли дезэмбрионизация развития и сдвиг поздних эмбриональных этапов развития нервной системы на начало нимфального развития.
2. Значительная часть эмбриональных нейробластов после периода покоя у поздних эмбрионов и в начале личиночной жизни восстанавливает функционирование в качестве постэмбриональных нейробластов – дрозофила.
3. Нейробласты не прекращают делиться в конце эмбриогенеза и у молодых личинок, что приводит к непрерывному нейрогенезу – медоносная пчела.
4. Эмбриональные нейробласты дегенерируют в конце эмбриогенеза. Появление второго независимого поколения нейробластов из некоторых клеток на поверхности нейропиля в начале постэмбрионального развития – чешуекрылые.
РАЗНООБРАЗИЕ НАЧАЛЬНЫХ ЭТАПОВ НЕЙРОГЕНЕЗА В ГРИБОВИДНЫХ ТЕЛАХ НАСЕКОМЫХ
Грибовидные тела являются обязательной структурой мозга насекомых и участвуют в обработке нервных сигналов, поступающих от различных органов чувств и других отделов центральной нервной системы. Они образованы собственными нейронами, так называемыми глобулярными клетками, или клетками Кеньона, а также приходящими чужеродными волокнами. Тела клеток Кеньона располагаются в дорсокаудальном протоцеребруме, а отходящие от них отростки формируют сложную нейропилярную структуру, подразделяющуюся на так называемую чашечку (совокупность дендритических отростков) и стебельчатый аппарат, состоящий из аксонов глобулярных клеток и включающий в простейшем случае ножку, альфа и бета-доли. Клетки Кеньона собраны в одну или несколько групп (в старой литературе – глобулусов), что отражается на общей структуре чашечки и стебельчатого аппарата. В результате грибовидное тело каждой стороны мозга может быть единым или подразделенным на субчасти, число которых преимущественно равно двум, но может быть равным трем или даже четырем (Farris, 2005).
Каждый глобулус формируется пролиферативным центром, состоящим из одного или нескольких нейробластов и ганглиозных материнских клеток. Число нейробластов, формирующих пролиферативный центр, в большинстве случаев отрядоспецифично (Панов, 1957). Один нейробласт в каждом пролиферативном центре был найден у поденок, клопов, равнокрылых, нейроптероидов и подавляющего большинства мекоптероидов. В этом случае нейробласт грибовидного тела ведет себя подобно одиночному нейробласту I типа и, делясь, образует дочерний нейробласт и ганглиозную материнскую клетку. Как показали исследования на дрозофиле, формирование таких нейробластов в эмбриональное время происходит, по-видимому, тем же путем, как и одиночных нейробластов клеточной коры мозга и брюшной цепочки (Kunz et al., 2012). Однако, в отличие от последних, нейробласты грибовидных тел, возникнув в период эмбрионального развития, продолжают функционировать не только у личинки, но и на протяжении значительной части куколочного развития, а в ряде случаев и у имаго (Панов, 1957, 1966; Cayre et al., 1994; Trebels et al., 2020).
Пролиферативные центры со многими нейробластами были найдены во многих группах насекомых: у стрекоз, тараканов, прямокрылых, перепончатокрылых, некоторых жуков, чешуекрылых и двукрылых, однако особенности нейрогенеза клеток Кеньона большей частью выяснены не были. Наиболее простой случай был обнаружен у некоторых жуков, у которых в составе каждого пролиферативного центра имелось несколько нейробластов. Они функционировали независимо друг от друга подобно одиночным нейробластам I типа и формировали обособленные группы клеток Кеньона, отростки которых в виде первоначально обособленных пучков шли в чашечку (Панов, 2010, 2012). У жужелиц удалось установить связь между степенью развития грибовидных тел и составом пролиферативных центров. Виды со слабо развитыми грибовидными телами имеют в пролиферативных центрах один нейробласт, а виды с сильно развитыми грибовидными телами – несколько (Панов, 2013). Как формируются эти полинейробластные пролиферативные центры жужелиц, установить не удалось.
У исследованных жуков-плавунцов была обнаружена та же зависимость состава пролиферативных центров от степени развития грибовидных тел. Большинство плавунцов имеет слабо развитые грибовидные тела, и в каждом пролиферативном центре был найден только один нейробласт. Исключение составил крупный Cybister lateralimargimalis с сильно развитыми грибовидными телами, у которого в каждой из трех групп клеток Кеньона есть сложно устроенный пролиферативный центр (Панов, 2014). В нем имеются пролиферирующие клетки трех типов: 1) одна очень крупная асимметрично делящаяся клетка; 2) ее окружают многочисленные клетки средних размеров, делящиеся также асимметрично; 3) на периферии центра находятся самые мелкие клетки, делящиеся симметрично. На периферии центра располагаются также дифференцирующиеся клетки Кеньона. Было предположено, что самую крупную делящуюся клетку можно идентифицировать как нейробласт II типа, который при делении самовоспроизводится, а его вторая дочерняя клетка оказывается промежуточным нейральным прогенитором. Последний при асимметричном делении также самовоспроизводится и дает начало ганглиозной материнской клетке. При симметричном делении последней образуются две клетки, дифференцирующиеся в клетки Кеньона.
Второй группой насекомых, у которых было предположено участие нейробластов II типа в формировании грибовидных тел, являются палочники. У них клетки Кеньона собраны в многочисленные группы, от которых отходят пучки отростков, входящих в единую чашечку. Ранее у эмбрионов Carausius morosus в каждом грибовидном теле были найдены два пролиферативных центра с одним нейробластом в каждом (Malzacher, 1968). Кроме них, в центрах были обнаружены еще два типа пролиферирующих клеток: более крупные, встречающиеся по всему пролиферативному центру и особенно рядом с нейробластом, и более мелкие, приуроченные главным образом к проксимальной части центра рядом с чашечкой (Панов, 2021).
При анализе такого клеточного состава пролиферативных центров было принято во внимание, что, согласно современным представлениям, нейроны центральной нервной системы насекомых собраны в группы, имеющие общее происхождение от одного родоначальника. Отростки нейронов одной группы большей частью объединяются в общий пучок, имеющий единый вход в нейропиль и единую зону концевых ветвлений в нейропиле. В брюшной цепочке и в подавляющем большинстве отделов головного мозга родоначальниками групп нейронов являются нейробласты типа I. В тех же случаях, когда имеются нейробласты типа II, родоначальниками групп нейронов являются промежуточные нейральные прогениторы (Lovick et al., 2013; Wong et al., 2013). Поскольку в эмбриональном грибовидном теле палочников было найдено множество групп клеток Кеньона и только два нейробласта, было сделано предположение, что они являются нейробластами типа II, а окружающие их крупные пролиферирующие клетки могут быть идентифицированы как промежуточные нейральные прогениторы, формирующие группы клеток Кеньона (Панов, 2021).
Крайне своеобразным является образование клеток Кеньона у двукрылого Muscina prolapsa. У личинки четыре нейробласта грибовидного тела функционируют как типичные нейробласты типа I, образуя при делении, как и одиночные нейробласты клеточной коры мозга, дочерний нейробласт и ганглиозную материнскую клетку. У взрослых личинок нейробласты делятся, по-видимому, чаще, чем ганглиозные материнские клетки, и поэтому вокруг нейробластов всегда встречается некоторое количество ганглиозных материнских клеток. Однако у предкуколки ганглиозные материнские клетки, окружающие нейробласт, начинают расти. Первоначально вокруг каждого нейробласта образуется группа из 8-11 таких растущих клеток, которые вскоре начинают асимметрично делиться на себе подобную и типичную ганглиозную материнскую клетку. Трансформированные клетки были названы вторичными нейробластами, деления которых наблюдались с 3-х по 7-е сутки после образования пупария. Затем вторичные нейробласты отмирали путем апоптоза. Судьба четырех первичных нейробластов грибовидных тел осталась невыясненной. Было сделано предположение, что либо сами первичные нейробласты грибовидных тел изменяют свою идентичность, превращаясь в период метаморфоза в нейробласты типа II, либо последние ганглиозные материнские клетки, образовавшиеся перед началом метаморфоза, превращаются в промежуточные нейральные прогениторы (Панов, 2020).
Две группы насекомых характеризуются особенно многочисленными пролиферирующими клетками в развивающихся грибовидных телах. Одной из этих групп являются прямокрылые. В их грибовидных телах клетки Кеньона образуют единую группу, а их образование происходит в одном пролиферативном центре, действующем у поздних эмбрионов, нимф и в течение значительной части жизни имаго (Панов, 1957, 1966; Cayre et al., 1994, 1996; Malaterre et al., 2002). Число нейробластов, образующих пролиферативный центр, у домового сверчка на разных стадиях развития достигает 100–150 (Cayre et al., 1994: Malaterre et al., 2002). Каждый нейробласт является типичным нейробластом типа I, т.е. делится асимметрично и функционирует независимо от других нейробластов.
Долгое время оставалось неизвестным, каким образом образуется такое большое количество асимметрично делящихся нейробластов. Первоначально предполагали, что формирование такого полинейробластного пролиферативного центра может быть связано с деятельностью одиночных нейробластов (Malaterre et al., 2002), однако изучение раннего эмбриогенеза у двух видов сверчков и перелетной саранчи показало сложность этого процесса (Панов, 2019). Было обнаружено, что в ходе эмбрионального развития центр проходит два последовательных этапа: размножения клеток и их дифференцировки. На первом этапе первоначально немногочисленные клетки размножаются путем симметричных делений. На втором этапе клетки превращаются в асимметрично делящиеся нейробласты типа I, которые в течение длительного времени самовозобновляются и дают симметрично делящиеся ганглиозные материнские клетки. Поскольку сверчки и саранчовые представляют собой диаметрально удаленные друг от друга ветви филогенетического древа прямокрылых (Zhang et al., 2013), было сделано предположение, что описанный процесс формирования пролиферативного центра грибовидных тел характерен для прямокрылых в целом.
Многоклеточным пролиферативным центром обладают также перепончатокрылые, причем не только жалящие, но и сидячебрюхие (Панов, 1957). Впервые существование полинейробластных пролиферативных центров было отмечено еще Бауэром (Bauer, 1904) у личинок и куколок Vespa crabro и Formica gagates (рис. 3), однако до сих пор ход нейрогенеза исследован в них недостаточно. Панов (1957), исследовавший становление грибовидных тел у медоносной пчелы, предположил, правда, не приводя документальных доказательств, существование равномерных делений нейробластов, за счет которых происходит их многократный рост у личинки и предкуколки. В составе пролиферативных центров он различал лишь центрально расположенные нейробласты и окружающие их по периферии центра глобулярные нейроны (клетки Кеньона).
Мeлун (Malun, 1998) описала пролиферативные центры грибовидных тел личинок пчелы состоящими из клеток одинакового размера, существенно меньшего, чем у одиночных нейробластов, которые равномерно метились BrdU. Это дало основание считать, что клетки пролиферативных центров делятся симметрично, в результате чего происходит рост центра. Кроме того, Мелун привела фотографии двух митозов этих клеток, которые она считала симметричными. Мелун упомянула о ганглиозных материнских клетках при обсуждении функционирования одиночных нейробластов, но ничего не сообщила о них при описании нейрогенеза в пролиферативных центрах грибовидных тел пчелы. Она также называет нейробласты центров предшественниками (precoursors) клеток Кеньона.
Наконец, согласно данным Феррис с соавторами (Farris et al., 1999), у личинки 5-го возраста медоносной пчелы середину пролиферативных центров грибовидных тел занимают нейробласты, между которыми встречаются более мелкие клетки, предположительно названные ганглиозными материнскими клетками. Делящиеся ганглиозные материнские клетки у личинки 5-го возраста были найдены на периферии центров. Снаружи они были окружены уже образовавшимися клетками Кеньона. По данным авторов, число нейробластов в каждом из четырех центров за личиночное время увеличивается в 10 раз и достигает 500. Это происходит, по их мнению, в результате равномерных делений нейробластов, которые также могут делиться неравномерно, формируя дочерние нейробласты и ганглиозные материнские клетки. Последние затем мигрируют на периферию центров, где делятся равномерно. Авторы, однако, не определили, может ли один и тот же нейробласт делиться то симметрично, то асимметрично, либо имеются два типа нейробластов.
У другого перепончатокрылого, муравья Camponotus japonicas, в пролиферативных центрах грибовидных тел были также найдены два типа клеток: нейробласты с более крупными ядрами и более мелкие ганглиозные материнские клетки, которые, как и у пчелы, собираются на периферии центра. Не было обнаружено ни симметричных, ни асимметричных делений нейробластов. О существовании первых лишь было предположено на основании значительного роста числа нейробластов в ходе личиночного развития (Ishii et al., 2005).
Выше уже было указано, что подавляющее большинство исследованных чешуекрылых имеют по одному нейробласту в составе пролиферативных центров грибовидных тел (Панов, 2018). Пока что единственным исключением является бабочка-монарх D. plexippus plexippus, у которой в составе пролиферативных центров было найдено несколько нейробластов (Nordlander, Edwards, 1970). У нее каждый из четырех центров имеет вид однослойного диска, образованного у новорожденной гусеницы тремя нейробластами, немногими ганглиозными материнскими клетками и клетками Кеньона. В течение 1-го возраста число нейробластов удваивается, а к середине 5-го возраста их число дорастает приблизительно до 30. В центре были обнаружены симметричные и асимметричные деления нейробластов, причем первые, за счет которых происходило умножение нейробластов, не были приурочены к какому-либо отделу диска, а встречались повсеместно. Веретена их делений находились в плоскости диска, который поэтому оставался однослойным. Оси веретен асимметричных делений были перпендикулярны слою подобно тому, что наблюдается у нейробластов в раннем эмбриогенезе. Проблема, имеются ли в пролиферативных центрах бабочки-монарха два типа нейробластов, делящихся симметрично или асимметрично, или одни и те же нейробласты способны к делениям обоих типов, авторами не обсуждалась. Особенность строения пролиферативных центров у бабочки-монарха авторы предположительно связали с продолжительностью жизни имаго и сложными миграциями. Однако у другой бабочки-мигранта, таксономически достаточно близкого вида, нимфалиды Vanessa cardui, в центрах имелось только по одному нейробласту (Köllisch et al., 2002).
МНОГООБРАЗИЕ КЛЕТОК КЕНЬОНА И ЕГО ФОРМИРОВАНИЕ (ВТОРОЙ ЭТАП НЕЙРОГЕНЕЗА)
После деления ганглиозных материнских клеток начинается второй этап нейрогенеза, заключающийся в дифференцировке постмитотических клеток в нейроны различных типов. Согласно интенсивно разрабатываемой в настоящее время концепции, существует пространственно-временная регуляция компетенции нейральных прогениторов определять характеристики своего потомства. Получен огромный массив данных о том, что в зависимости от положения прогениторов в нервной системе и времени образования ганглиозных материнских клеток в нейральных прогениторах экспрессируется последовательно ряд транскрипционных факторов, которые переходят в ганглиозные материнские клетки и в дальнейшем определяют судьбу их дочерних клеток (обзоры, например, Kohwi, Doe, 2013; Yasugi, Nishimura, 2016; Holguera, Desplan, 2018). Ниже приводятся известные сведения о многообразии клеток Кеньона у представителей разных отрядов насекомых и о пути его формирования.
Тараканы. Первоначально у американского таракана Periplaneta americana среди клеток Кеньона были выделены “обычные” клетки Кеньона, заполнявшие полости бокалов, и “наружные” клетки Кеньона, тела которых лежали около края бокалов и далее вдоль их наружного края (Weiss, 1974). В дальнейшем грибовидные тела тараканов исследовались почти исключительно путем импрегнации по методу Гольджи. В первом таком исследовании в качестве критериев использовались топография тел клеток относительно бокала, форма и место ветвления дендритов, ход аксонов в ножке и долях (Mizunami et al., 1998). Было выделено четыре класса клеток Кеньона (К1, К2, К3 и К4), тела которых располагались концентрическими кольцами, начиная от центра бокала (К1) и к его периферии (К4). Дендриты K2- и K3-клеток были распределены по всему нейропилю чашечки, тогда как дендриты K1- и K4-клеток встречались, соответственно, в наружном и внутреннем слоях ее нейропиля. По-видимому, клетки класса 4 соответствуют “наружным” клеткам Кеньона, описанным Вайсом, а клетки классов 1–3 – “обычным” клеткам Кеньона.
Позднее на основании преимущественно строения окончаний дендритов клетки Кеньона тараканов были подразделены на два класса. Клетки класса I характеризовались обилием шипиков на дендритических окончаниях и соответствовали клеткам классов 1–3 Мицунами, тогда как клетки класса II имели “когтевидные” дендритические окончания и соответствовали клеткам класса 4 (Farris, Strausfeld, 2001). Кроме того, у американского таракана был найден еще один тип клеток Кеньона, клетки класса III, которые образуются уже у эмбрионов, посылают дендриты в придаточную чашечку, а их аксоны формируют специфические субструктуры в долях (Farris, Strausfeld, 2003).
Пролиферативные центры в развивающихся грибовидных телах тараканов, состоящие из немногих нейробластов, находятся вблизи основания бокалов (Malzacher, 1968). Поэтому можно предположить, что наиболее рано образованными, помимо клеток класса III, являются клетки класса 4 Мицунами, располагающиеся на периферии комплекса клеток Кеньона, а клетки класса 1 Мицунами, расположенные ближе всех ко дну бокала, являются самыми молодыми. Раннее формирование клеток класса II подтверждается также тем, что уже у новорожденных нимф таракана имеются соответствующие им отделы долей (Farris, Strausfeld, 2001).
Прямокрылые. Сложность строения чашечки у представителей прямокрылых была установлена уже в конце XIX века (Dietl, 1876; Viallanes, 1887), причем первый автор у обыкновенной медведки обнаружил ее двухраздельность. Двухраздельность чашечки была затем установлена у домового сверчка и двух видов саранчовых (Hanström, 1940), а еще позже – у широкого круга прямокрылых (Weiss, 1981).
Разделение чашечки на два отдела предполагает существование по крайней мере двух типов клеток Кеньона. Впервые они были описаны при использовании общего гистологического окрашивания у домового сверчка: более мелкие клетки, заполнявшие главный бокал чашечки, и клетки с более крупными перикарионами, связанные с задней чашечкой (Hanström, 1940). После импрегнации по Гольджи клетки Кеньона домового сверчка были подразделены на 3 класса: клетки классов 1 и 2, связанные с главной чашечкой, и клетки класса 3, связанные с задней чашечкой (Schürmann, 1973). Крупные нейроны класса 3 имеют снабженные шипиками дендриты в задней чашечке. Пучки их аксонов образуют тяжи, расположенные по периферии главной ножки, периферию α-доли, а также γ-долю, прилегающую к β-доле. Дендриты клеток 1-го и 2-го классов находятся в главной чашечке. Позднее клетки 1-го класса стали рассматриваться как незрелые нейроны 2-го класса (Mashaly et al., 2008).
В каждом грибовидном теле домового сверчка имеется около 50 000 мелких клеток Кеньона, связанных с главной чашечкой, и около 5000 более крупных клеток вокруг задней чашечки. Крупные клетки образуются только в эмбриональное время, в конце которого начинают образовываться и мелкие клетки. Молодые клетки располагаются по оси бокала и оттесняют старые клетки к его краям. Предполагается, что в пролиферативном центре имеются две группы нейробластов, из которых одна производит крупные клетки, а потом включается вторая группа, производящая мелкие клетки (Malaterre et al., 2002).
Жесткокрылые. У Tribolium castaneum в грибовидных телах были обнаружены те же доли, что и у дрозофилы, что подразумевает существование клеток Кеньона γ-, α'/β'- и α/β-типов. Кроме того, у этой чернотелки была найдена еще особая δ-доля, сформированная отростками соответствующих клеток Кеньона. В ходе онтогенетического развития клетки Кеньона этих типов образуются, как и у дрозофилы, последовательно, но время их формирования иное, чем у дрозофилы. Так, самыми рано формирующимися считаются δ-клетки, затем на протяжении личиночного времени формируются γ-клетки. У куколки появляются α'/β'- клетки и только у долгоживущего имаго – α/β- клетки (Zhao et al., 2008).
У пластинчатоусого жука Pachnoda marginata были выявлены только две категории клеток Кеньона: центральные и периферические. Дендритические окончания центральных клеток морфологически сходны с таковыми клеток класса II, аксоны которых образуют γ-доли у других насекомых. Периферические клетки по морфологии похожи на клетки класса III, обнаруженные у тараканов и некоторых других насекомых (Larsson et al., 2004). Данные о развитии грибовидных тел у этого жука отсутствуют, но по аналогии с другими насекомыми можно предположить, что периферические клетки Кеньона образуются первыми.
Перепончатокрылые. Медоносная пчела имеет самую многолетнюю историю изучения многообразия клеток Кеньона. Уже Кеньон (Kenyon, 1896) внутри бокалов грибовидных тел медоносной пчелы выделил два типа нейронов. Нейроны с более мелкими клеточными телами формировали медиально расположенную группу, окруженную со всех сторон более крупными клетками. Последние имели сильно разветвленные дендриты в стенке бокалов, тогда как у мелких центральных клеток слабо разветвленные дендриты располагались в основании бокала. Подобное разделение нейронов внутри бокалов на центральную и периферическую группы было обнаружено также у многих Aculeata (Alten, 1910). Правда, этот автор предполагал соответствие центральной группы “образовательному центру”, незадолго до этого описанному в грибовидных телах куколок перепончатокрылых (Bauer, 1904).
По-видимому, Ионеску (Jonescu, 1909) был первым, указавшим на существование в грибовидных телах медоносной пчелы, помимо двух типов внутрибокаловых клеток, третьего типа нервных клеток, расположенных вокруг бокалов. Однако эти клетки специально не были им охарактеризованы и не была указана граница, разделявшая их и крупные периферические внутрибокаловые клетки.
Более подробная характеристика наружных клеток была сделана при изучении грибовидных тел нескольких видов Bombus и Psythirus (Barendrecht, 1931) и позднее – медоносной пчелы (Панов, 1957; Farris et al., 1999). Как и в предыдущих, в этих работах характеристики типов клеток Кеньона основывались на положении клеток относительно чашечки и на размере тела клетки (практически – ядра).
Гораздо большее разнообразие клеток Кеньона было выявлено в грибовидных телах медоносной пчелы при использовании метода импрегнации по Гольджи и других нейрогистологичских методов. Первой такой работой, в которой типы клеток Кеньона у медоносной пчелы определялись по строению и топографии клеточных отростков, было исследование Моббса, выделившего 5 типов клеток Кеньона (Mobbs, 1982).
Страусфелд (Strausfeld, 2002) подразделил крупные клетки Кеньона на три группы. Клетки маленькой проксимальной группы посылают дендриты в наружную зону базального кольца. Дендриты средней группы находятся в наружной, промежуточной и внутренней зонах воротничковой части чашечки. Дендриты наружной группы, расположенной вокруг верхнего края чашечки, идут в ее краевую часть. Центральная группа мелких клеток Кеньона, связанная с базальным кольцом чашечки, подразделена на наружную и внутреннюю группы. Все эти нейроны имеют шипиковые дендритические окончания и относятся к классу I клеток Кеньона, описанному у американского таракана (см. выше). От перикарионов всех этих клеток отходят отростки к внутренней стенке чашечки, где они ветвятся. Одна ветвь входит в нейропиль чашечки, а вторая идет вдоль внутренней поверхности бокала в ножку.
Отростки мелких наружных клеток Кеньона входят в наружную стенку чашечки с внешней стороны и идут в нейропиле перпендикулярно поверхности чашечки. От каждого нейрита отходит небольшое число коротких дендритных веточек, которые оканчиваются в виде когтевидных структур. Таким образом, мелкие наружные клетки Кеньона относятся к классу II. Во всех трех отделах воротничковой части чашечки их отростки формируют палисадную структуру нейропиля. Отростки клеток Кеньона II типа проходят также через нейропиль базального кольца.
Иное подразделение крупных клеток Кеньона было получено на основе анализа преимущественной экспрессии генов в перикарионах клеток (Kaneko et al., 2013; Kaneko et al., 2016). В составе крупных клеток внутри бокала была выделена большая компактная группа нейронов, названых клетками Кеньона “среднего типа”, располагающаяся вокруг внутренних мелких клеток. Такое же подразделение внутренних крупных клеток было найдено у осы-сколии Campsomeris prismatica, складчатокрылой осы Vespa mandarina, но отсутствовало у наездника Ascogaster reticulata (Oya et al., 2017).
Три основных типа клеток Кеньона образуются у медоносной пчелы последовательно в течение личиночного и начала куколочного периодов развития (Панов, 1957; Farris et al., 1999). Мелкие наружные клетки появляются вокруг пролиферативного центра уже у 3-дневной личинки, и их образование длится вплоть до стадии предкуколки. Затем вокруг пролиферативного центра появляется слой крупных внутренних клеток, продукция которых продолжается вплоть до второго куколочного дня. После этого деятельность очага снова изменяется, и вокруг него появляются тела мелких внутренних клеток, которые продолжают формироваться до 6-го дня куколки, когда начинается дегенерация пролиферативного центра. Имея в виду такой характер формирования состава клеток Кеньона, можно считать, что клетки Кеньона “среднего типа”, упомянутые выше, представляют собой наиболее молодую по времени образования группу внутренних крупных клеток Кеньона. В целом, картина формирования всего комплекса клеток Кеньона в грибовидных телах медоносной пчелы хорошо соответствует концепции возрастно-зависимой дифференцировке нейронов, производимых нейробластами.
Двукрылые. Многообразие клеток Кеньона у двукрылых исследовалось почти исключительно на примере дрозофилы с помощью различных молекулярных маркеров. Первоначально было найдено, что нейропилярная часть грибовидных тел дрозофилы, помимо обычных стебелька, α- и β-долей, включает также так называемый шип и γ-долю, которая тесно прилегает к β-доле (Heisenberg, 1980), и подразделение клеток Кеньона на особые категории было основано на ходе их аксонов в долях. Так, сначала клетки Кеньона дрозофилы были подразделены на три категории: 1) клетки, посылающие аксоны в α- и β-доли; 2) клетки с аксонами в шипе и γ-доле и 3) клетки с аксонами в β- и γ-долях (Yang et al., 1995). Иммуноцитохимический анализ структуры грибовидных тел дрозофилы показал, что в их нейропилярной части можно выделить не три, а пять долей: α-долю, α'-долю, β-долю, β'-долю и γ-долю. В связи с этим были выделены три группы клеток Кеньона, посылающих аксоны: 1) в α - и β-долю (α/β-клетки), 2) в α'- и β'-долю (α'/β'-клетки) и 3) в γ-долю (γ-клетки) (Crittenden et al., 1998). При этом из приблизительно 2000 клеток Кеньона, выделенных в каждом грибовидном теле молекулярными маркерами, 33% составляли γ-клетки, 18% – α'/β'-клетки и 49% α/β - клетки (Aso et al., 2009).
Такой сложный состав клеток Кеньона формируется в строгой зависимости от времени образования клеток. Так, нейроны, посылающие аксон в γ-долю, формируются уже у эмбриона (Armstrong et al., 1998) и у личинки вплоть до середины 3-го возраста. Нейроны с аксонами в α'/β'-долях образуются с середины 3-го возраста и до момента образования пупария, а нейроны с аксонами в α/β-долях образуются у предкуколки и куколки (Lee et al., 1999).
Во всех перечисленных работах использовались лишь молекулярно-генетические и иммуногистохимические характеристики клеток Кеньона. С учетом их связей с чужеродными нейронами в чашечке и долях число типов клеток Кеньона в грибовидных телах дрозофилы было доведено до семи (Aso et al., 2014). Из них клетки Кеньона 5 типов имели дендритические ветвления в главной чашечке, а двух типов – в двух придаточных.
Исследование структуры грибовидных тел с помощью метода импрегнации по Гольджи было проведено в единственном исследовании (Strausfeld et al., 2003). Путем комбинации этого метода с иммуноцитохимическим выявлением некоторых медиаторов и других биологически активных молекул доли грибовидного тела дрозофилы были подразделены на несколько новых отделов, а клетки Кеньона – на 8 типов, различающихся по ходу их отростков в долях, характеру ветвлений дендритов в чашечке и иммуноцитохимическим характеристикам. Клетки Кеньона с аксонами в γ-доле и когтевидными дендритическими окончаниями были отнесены к классу II клеток Кеньона.
Чешуекрылые. У чешуекрылых имеющиеся классификации клеток Кеньона основаны преимущественно на структуре их дендритических ветвей в чашечке и на топографии и строении аксональных отростков. В первом из таких исследований, проведенном преимущественно на сиреневом бражнике (Sphinx ligustri), были выделены три типа клеток Кеньона. Также было обнаружено существование в грибовидных телах многих чешуекрылых своеобразной структуры, так называемого Y-тракта, формируемого аксонами клеток Кеньона особой категории (Pearson, 1971).
В двух других исследованиях характеристики дендритических ветвлений клеток Кеньона были дополнены указанием мест окончания аксональных ветвей в системе долей, которая у исследованных чешуекрылых оказалась по сложности сходной с таковой у дрозофилы. У совки Spodoptera littoralis и тутового шелкопряда Bombyx mori были обнаружены сходный с дрозофилой состав и взаиморасположение основных долей и в соответствии с этим установлено существование одинакового с дрозофилой состава клеток Кеньона (табл. 1). Помимо них, у Spodoptea littoralis иммуноцитохимически был выявлен еще один тип клеток Кеньона, так называемые клетки класса III (Sjöholm et al., 2006).
Таблица 1.
Типы клеток Кеньона в грибовидных телах чешуекрылых (Панов, 2018)
| Вид | Тип клеток | Положение тел клеток |
Дендриты | Положение волокон в ножке |
Окончания в долях |
Литература | ||
|---|---|---|---|---|---|---|---|---|
| Расположение | Вид древа | Окончания | ||||||
| Sphinx ligustri L. |
1 | В бокалах и вокруг них | В чашечке | Широкопольный | Шипиковидные | ? | ? | Pearson, 1971 |
| 2 | Выше и сбоку от бокалов | В чашечке | Узкопольные гроздевидные | Клешневидные | ? | ? | ||
| 3 | Антеролатеральнее чашечки |
В чашечке | Широкопольные (узкопольные) | Клешневидные | Y-тракт | Y-доли | ||
| Spodoptera littoralis Bd. |
γ | ? | В чашечке | Длинное и узкое | Клешневидные | Наружное кольцо волокон в шейке ножки |
γ-доли | Sjöholm et al., 2005 |
| α'/β' | ? | В чашечке | Широкие и густоветвистые | Шипиковидные | ? | α'/β' -доли | ||
| α/β | ? | В чашечке | Широкие зонтиковидные, густоветвистые | Шипиковидные | ? | α/β- доли | ||
| Y | Дорсо-латеральнее чашечки |
В чашечке | Редкие, но обширные | Клещевидные компактные | Y-тракт | Y-доли | ||
| Bombyx mori L. |
γ | Перед α/β-клетками | В чашечке | Небольшое удлиненное поле | Клешневидные | Латеральное | γ -доли | Fukushima, Kanzaki, 2009 |
| α'/β' | По всему слою клеток над чашечкой | В чашечке | Широкие ветвления в бóльшей части чашечки | Шипиковые | Центральное | α'/β' -доли | ||
| α/β | В наиболее заднем положении над чашечкой | В чашечке | Медиальная и латеральная части чашечки | Шипиковые | Медиальное | α/β- доли | ||
| Y | Недалеко от места отхождения Y-тракта антеродорсальнее чашечки | В чашечке, но некоторые ветви выходят в окружающий нейро- пиль |
Маленькие | Гроздевидные | Y-тракт | Y-доли | ||
Особого внимания заслуживают данные по генезису клеток Кеньона у табачного бражника Manduca sexta, у которого клетки Кеньона класса III образуются протоцеребральными нейробластами, расположенными вне грибовидных тел (Farris et al., 2011). Клетки класса III у других насекомых (у которых они обнаруживаются) формируются первыми в череде типов клеток Кеньона. Однако у табачного бражника они начинают образовываться только с середины гусеничной стадии развития. Именно в это время, как было показано выше, у чешуекрылых начинают функционировать одиночные нейробласты второго поколения.
ЗАКЛЮЧЕНИЕ
Многолетняя история изучения образования нервных клеток в центральной нервной системе насекомых может быть подразделена на несколько главных этапов. Первый этап, начавшийся с открытия нейральных стволовых клеток, характеризуется медленным накоплением данных почти исключительно по эмбриональному нейрогенезу. В значительной степени это было связано с преобладанием интереса исследователей конца XIX–начала XX в. к общим вопросам эмбриологии: формированию зародышевых оболочек, зародышевой полоски, образованию отделов кишечника и других систем органов. Практически отсутствовали работы по развитию только нервной системы. По-видимому, лишь Уилер и Виаллан специально исследовали развитие нервной системы. Слабое развитие микроскопической техники, трудности получения хороших препаратов эмбрионов из-за существования прочного, практически непроницаемого для большинства фиксирующих жидкостей хориона были объективными причинами медленного прогресса в исследованиях.
Второй этап охватывает почти весь XX век. Он может быть охарактеризован продолжением медленного накопления данных на относительно широком круге насекомых с применением традиционных гистологических методов. Появляются исследования по нейрогенезу в нервных центрах головного мозга.
Современный этап – невероятное сужение круга исследуемых насекомых, практически до одного вида, Drosophila melanogaster, и невероятная глубина исследований на основе широкого применения молекулярно-генетических методов исследований. В современной литературе почти отсутствуют исследования нейрогенеза у иных, чем дрозофила, видов насекомых. В значительной степени это было обусловлено открытием мутаций нейрогенеза у дрозофилы, сходных с гиперплазией недифференцированных клеточных элементов при нейральном туморогенезе у млекопитающих. Благодаря этим исследованиям, были расшифрованы молекулярные механизмы дифференцировки нейробластов из клеток нейроэктодермы, механизмы симметричных и асимметричных делений нейробластов, открыто существование особого вида нейробластов, нейробластов типа II и многое другое.
Вместе с тем анализ процессов нейрогенеза на клеточном уровне показывает, что Drosophila melanogaster – лишь один из огромного числа видов насекомых, существенно отличающихся от нее по ходу нейрогенеза как в эмбриональный, так и постэмбриональный периоды развития. Это хорошо продемонстрировано в обзоре на примере нейрогенеза в грибовидных телах головного мозга и побуждает исследовать процессы нейрогенеза у насекомых разных таксономических групп, обладающих разными типами развития и разной биологией.
Список литературы
Панов А.А., 1957. Строение головного мозга насекомых на последовательных этапах постэмбрионального развития // Энтомологическое обозрение. Т. 36. Вып. 2. С. 269−284.
Панов А.А., 1960. Характер размножения нейробластов, клеток нейрилеммы и нейроглии в головном мозге гусеницы китайского дубового шелкопряда // Доклады АН СССР. Т. 132. № 3. С. 689−692.
Панов А.А., 1963. Происхождение и судьба нейробластов, нейронов и клеток нейроглии в центральной нервной системе китайского дубового шелкопряда Antheraea pernyi Guér. (Lepidoptera, Attacidae) // Энтомологическое обозрение. Т. 42. Вып. 2. С. 337−350.
Панов А.А., 1966. Соотношение онтогенетического развития центральной нервной системы домового сверчка Gryllus domesticus L. и обыкновенной медведки Gryllotalpa gryllotalpa L. (Orthoptera, Grylloidea) // Энтомологическое обозрение. Т. 45. Вып. 2. С. 326−340.
Панов А.А., 2010. Строение грибовидных тел пластинчатоусых жуков (Coleoptera: Scarabaeoidea). II. Растительноядные пластинчатоусые и общее обсуждение // Известия РАН. Серия биологическая. № 6. С. 683−694.
Панов А.А., 2012. Жуки-листоеды (Coleoptera: Chrysomelidae): упрощение грибовидных тел в ходе прогрессивной эволюции семейства // Известия РАН. Серия биологическая. № 1. С. 35−42.
Панов А.А., 2013. Гистологическое строение трехчастных грибовидных тел жужелиц (Insecta: Coleoptera: Carabidae) // Известия РАН. Серия биологическая. № 5. С. 574−582.
Панов А.А., 2014. Новый, необычный (по крайней мере для жуков) способ продуцирования клеток Кеньона, найденный у жука-плавунца Cybister lateralimarginalis Deg. (Coleoptera: Dytiscidae) // Известия РАН. Серия биологическая. № 2. С. 150−154.
Панов А.А., 2018. Нейробласты грибовидных тел мозга чешуекрылых (Insecta: Lepidoptera) // Известия РАН. Серия биологическая. № 5. С. 519−526.
Панов А.А., 2019. Пролиферация и дифференцировка: два последовательных этапа активности пролиферативных центров в грибовидных телах эмбрионов сверчков Gryllus bimaculatus и Acheta domesticus и пустынной саранчи Schistocerca gregaria (Insecta: Orthoptera) // Известия РАН. Серия биологическая. № 3. С. 273−283.
Панов А.А., 2020. Десятки на смену четырем: два поколения нейральных прогениторов в развивающихся грибовидных телах Muscina prolapsa Harris (Diptera, Muscidae) // Зоологический журнал. Т. 99. Вып. 8. С. 911−918.
Панов А.А., 2021. Грибовидные тела палочников (Phasmatodea: Insecta): структура и источники формирования // Известия РАН. Серия биологическая. № 1. С. 83−92.
Alten H., 1910. Zur Phylogenie des Hymenopterengehirns // Jenaische Zeitschrift für Naturwissenschaft. Bd. 46. H. 2–3. S. 511−590.
Armstrong J.D., de Belle J.S., Wang Z., Kaiser K., 1998. Metamorphosis of the mushroom bodies: large-scale rearrangements of the neural substrates for associative learning and memory in Drosophila // Learning and Memory. V. 5. P. 102−114.
Aso Y., Grübel K., Busch S., Friedrich A.B., Siwanovicz I., Tanimoto H., 2009. The mushroom body of adult Drosophila characterized by GAL4 drivers // Journal of Neurogenetics. V. 23. Iss. 1–2. P. 156−172.
Aso Y., Hatton D., Yu Y., Johnston R., Alyer N., et al., 2014. The neuronal architecture of the mushroom body provides a logic for associative learning // e Life. 3: e04577.
Baden V., 1936. Embryology of the nervous system in the grasshopper, Melanoplus differentialis // Journal of Morphology. V. 60. P. 156−190.
Barendrecht G., 1931. Die Corpora pedunculata bei der Gattungen Bombus und Psythirus // Acta Zoologica. Bd. 12. S. 153−204.
Bate C.M., 1976. Embryogenesis of an insect nervous system. I. A map of the thoracic and abdominal neuroblasts in Locusta migratoria // Journal of Embryology and Experimental Morphology. V. 35. Iss. 1. P. 107−123.
Bauer V., 1904. Zur inneren Metamorphose des Zentralnervensystems der Insekten // Zoologische Jahrbücher. Abteilung für Anatomie und Ontogenie der Tiere. Bd. 20. S. 123−152.
Bayraktar O.A., Boone J.Q., Drummond M.L., Doe C.Q., 2010. Drosophila type II neuroblast lineages keep Prospero level low to generate large clones that contribute to the adult brain central complex // Neural Development. V. 5. Iss. 26. P. 3−16.
Bello B.C., Izergina N., Caussinus E., Reichert H., 2008. Amplification of neural stem cell proliferation by intermediate progenitor cell in Drosophila brain development // Neural Development. V. 3. Iss. 5. P. 1−17.
Birkenholz O., Rickert C., Novak J., Coban I.C., Technau G.M., 2015. Bridging the gap between postembryonic cell lineages and identified embryonic neuroblasts in the ventral nerve cord of Drosophila melanogaster // Biology Open. V. 4. P. 420-434.
Booker R., Truman J.W., 1987. Postembryonic neurogenesis in the CNS of the tobacco hornworm, Manduca sexta. I. Neuroblast arrays and the fate of their progeny during metamorphosis // Journal of Comparative Neurology. V. 255. P. 548−559.
Boone J.Q., Doe C.Q., 2008. Identification of Drosophila type II neuroblast lineages containing transit amplifying ganglion mother cells // Developmental Neurobiology. V. 68. P. 1185−1195.
Butt F.H., 1949. Embryology of the milkweed bug, Oncopeltus fasciatus (Heteroptera) // Cornell University Experimental Station Ithaca New York. Memoire 283. 43 p.
Cayre M., Strambi C., Strambi A., 1994. Neurogenesis in an adult insect brain and its hormonal control // Nature. V. 368. P. 57–59.
Cayre M., Strambi C., Charpin P., Augier P., Meyer M.R. et al., 1996. Neurogenesis in adult insect mushroom bodies // Journal of Comparative Neurology. V. 371. P. 300–310.
Choksi S.P., Southall T.D., Bossing T., Edoff K., de Wit E. et al., 2006. Prospero acts as a binary switch between self-renewal and differentiation in Drosophila neural stem cells // Developmental Cell. V. 11. P. 775−789.
Crittenden J.R., Skoulakis E.M.C., Han K.-A., Kaldron D., Davis R.L., 1998. Tripartite mushroom body architecture revealed by antigenic markers // Learning and Memory. V. 5. P. 38−51.
Dietl M.J., 1876. Die Organisation des Arthropodengehirns // Zeitschrift für Wissenschaftliche. Zoologie. Bd. 27. H. 4. S. 488−517.
Doe C.Q., 1992. Molecular markers for identified neuroblasts and ganglion mother cells in the Drosophila central nervous system // Development. V. 116. P. 855−863.
Doe C.Q., 2008. Neural stem cells: balancing self-renewal with differentiation // Development. V. 135. P. 1575−1587.
Doe C.Q., Kuwada Y., Goodman C.S., 1985. From epithelium to neuroblasts to neurons: the role of cell interactions and cell lineage during insect neurogenesis // Philosophical Transactions of the Royal Society. London. B. Biological Sciences. V. 312. P. 67−81.
Eastham L.E.S., 1930. The embryology of Pieris rapae. Organogeny // Philosophical Transactions of the Royal Society. London. B. Biological Sciences. V. 219. P. 1−50.
Escherich K., 1902. Zur Entwicklung des Nervensystems der Musciden, mit besonderer Berücksichtigung des sog. Mittelstranges // Zeitschrift für Wissenschaftliche Zoologie. Bd. 71. S. 525−549.
Farris S.M., 2005. Evolution of insect mushroom bodies: old clues, new insights // Arthropod Structure and Development. V. 34. Iss. 3. P. 211−234.
Farris S.M., Pettrey C., Daly K.C., 2011. A subpopulation of mushroom body intrinsic neurons is generated by protocerebral neuroblasts in the tobacco hornworm moth, Manduca sexta (Sphingidae, Lepidoptera) // Arthropod Structure and Development. V. 40. Iss. 5. P. 395−408.
Farris S.M., Robinson G.E., Davis R.L., Fahrbach S.E., 1999. Larval and pupal development of the mushroom bodies in the honeybee, Apis mellifera // Journal of Comparative Neurology. V. 414. P. 97−113.
Farris S.M., Strausfeld N.J., 2001. Development of laminar organization in the mushroom bodies of the cockroach: Kenyon cell proliferation, outgrowth, and maturation // Journal of Comparative Neurology. V. 439. Iss. 3. P. 331−351.
Farris S.M., Strausfeld N.J., 2003. A unique mushroom body substructure common to basal cockroaches and termites // Journal of Comparative Neurology. V. 456. Iss. 4. P. 305−320.
Fukushima R., Kanzaki R., 2009. Modular subdivision of mushroom bodies by Kenyon cells in the silkmoth // Journal of Comparative Neurology. V. 513. P. 315−330.
Graber V., 1889. Vergleichende Studien über die Embryologie der Insekten und insbesondere der Musciden // Denkschriften der Kaiserische Akademie der Wissenschaften. Mathematisch-Naturwissenschaftliche Klasse. Wien. Bd. 55. № 2. S. 109−162. (цит. пo: Nelson, 1915).
Graber V., 1890. Vergleichende Studien am Keimstreifen der Insekten // Denkschriften der Kaiserische Akademie der Wissenschaften. Mathematisch-Naturwissenschaftliche Klasse. Wien. Bd. 57. S. 621−734. (цит. пo: Nelson, 1915).
Hanström B., 1940. Inkretorische Organe, Sinnesorgane und Nervensystem des Kopfes einiger niederer Insektenordnungen // Kungliga Svenska Vetenskapsakademiens Handlingar. Ser. 3. Bd. 18. № 8. 266 p.
Harding K., White K., 2018. Drosophila as a model for developmental biology: stem cell-fate decisions in the developing nervous system // Journal of Developmental Biology. V. 6. Iss. 4. P. 1−25.
Hartenstein V., Campos-Ortega J.A., 1984. Early neurogenesis in wild-type of Drosophila melanogaster // Wilhelm Roux’s Archiv für Entwicklungsmechanik der Organismen. V. 193. P. 308−325.
Hartenstein V., Eberhardt R., Campos-fOrtega J.A., 1987. The pattern of proliferation of the neuroblasts in the wild-type embryo of Drosophila melanogaster // Roux’s Archiv of Developmental Biology. V. 196. Iss. 8. P. 473–485.
Hatschek B., 1877. Beiträge zur Entwicklungsgeschichte der Lepidopteren // Jenaische Zeitschrift für Naturwissenschaft. Bd. 11. H. 4. S. 115−145.
Heisenberg M., 1980. Mutants of brain structure and function. What is the significance of the mushroom bodies for behaviour? // Development and Biology of Drosophila (Ed. by Siddiqi O., Babu P., Hall L.M., Hall J.C.). New York: Plenum Press. P. 337−390.
Heymons R., 1895. Die Embryonalentwicklung von Dermapteren und Orthopteren unter besonderer Berücksichtigung der Keimblätterbildung. Monographisch bearbeitet. Jena: Gustav Fischer Verlag. 136 S. + 12 Taf.
Hirschler J., 1909. Die Embryonalentwicklung von Donacia crassipes L. // Zeitschrift für Wissenschaftliche Zoologie. Bd. 92. H. 4. S. 627−744.
Holguera I., Desplan C., 2018. Neuronal specification in space and time // Science. V. 326. № 6411. P. 176–180.
Homem C.F., Knoblich J.A., 2012. Drosophila neuroblasts: a model for stem cell biology // Development. V. 139. P. 4297−4310.
Ishii Y., Kubota K., Hara K., 2005. Postembryonic development of the mushroom bodies in the ant, Camponotus japonicas // Zoological Science. V. 22. P. 743−753.
Jacobs J.R., Hiromi Y., Patel N.H., Goodman C.S., 1989. Lineage, migration and morphogenesis of longitudinal glia in the Drosophila CNS as revealed by a molecular lineage marker // Neuron. V. 2. Iss. 6. P. 1625−1631.
Johannsen O.A., Butt F.H., 1941. Embryology of Insects and Myriapods. New York: McGraw-Hill. 462 p.
Johansson A.S., 1957. The nervous system of the milkweed bug, Oncopeltus fasciatus (Dallas) (Heteroptera, Lygaeidae) // Transactions of the American Entomological Society. V. 83. Iss. 3. P. 119−183.
Jonescu C.N., 1909. Vergleichende Untersuchungen über das Gehirn der Honigbiene // Jenaische Zeitschrift für Naturwissenschaft. Bd. 45. S. 111−180.
Kaneko K., Ikeda T., Nagai M., Hori S., Umatani C. et al., 2013. Novel middle-type Kenyon cells in the honeybee brain revealed by area-preferential gene expression analysis // PLoS ONE. 8(8):e71732. doi:101731/ journal. pone. 0071732
Kaneko K., Suenami S., Kubo T., 2016. Gene expression profiles and neural activities of Kenyon cell subtypes in the honeybee brain: identification of novel “middle-type” Kenyon cells // Zoological Letters. V. 2. P. 1−13. https://doi.org/10.1186/s40851-016-0051-6
Kenyon F.C., 1896. The brain of the bee. A preliminary contribution to the morphology of the nervous system of the Arthropoda // Journal of Comparative Neurology. V. 6. P. 133−210.
Knoblich J.A., 2008. Mechanisms of asymmetric stem cell division // Cell. V. 132. P. 583−597.
Kohwi M., Doe C.Q., 2013. Temporal fate specification and neural progenitor competence during development // Nature Reviews Neuroscience. V. 14. Iss. 12. P. 823−838.
Korotneff A., 1885. Die Embryologie der Gryllotalpa // Zeitschrift für Wissenschaftliche Zoologie. Bd. 41. H. 4. S. 570−604.
Kowalevski A.O., 1871. Embryologische Studien an Würmern und Arthropoden // Mémoires de l’Academie Impériale des Sciences de St. Péetersbourg. 7 Sér. V. 16. № 12. 86 p.
Köllisch G.V., Hoffmann K.H., Strambi A., Strambi C., 2002. Postembryonic mushroom body development in a migrating butterfly, Vanessa cardui (Lepidoptera: Nymphalidae) // Entomon. V. 27. Iss. 2. P. 117−124.
Kunz T., Kraft K.F., Technau G.M., Urbach R., 2012. Origin of Drosophila mushroom body neuroblasts and generation of divergent embryonic lineages // Development. V. 139. P. 2510−2522.
Larsson M.C., Hansson B.S., Strausfeld N.J., 2004. A simple mushroom body in an african scarabid beetle // Journal of Comparative Neurology. V. 478. P. 219−232.
Lécaillon A., 1898 Recherches sur le développement embryonnaire de quelques chrysomélides // Archives d’Anatomie Microscopique et de Morphologie Expérimentale. V. 2. P. 118−176.
Lee T., Lee A., Luo L., 1999. Development of the Drosophila mushroom bodies: sequential generation of three distinct types of neurons from a neuroblast // Development. V. 126. P. 4065−4076.
Lovick J.K., Ngo K.T., Omoto J.J., Wong D.C., Nguyen J.D., Hartenstein V., 2013. Postembryonic lineages of the Drosophila brain: I. Development of the lineage-associated fiber tracts // Developmental Biology. V. 384. P. 228−257.
Malaterre J., Strambi C., Chiang A.-Sh., Aouane A., Strambi A., Cayre M., 2002. Development of cricket mushroom bodies // Journal of Comparative Neurology. V. 452. P. 215–227.
Malun D., 1998. Early development of mushroom bodies in the brain of the honeybee Apis mellifera as revealed by BrdU incorporation and ablation experiments // Learning and Memory. V. 5. Iss. 1. P. 90−101.
Malzacher P., 1968. Die Embryogenese des Gehirns paurometaboler Insekten. Untersuchungen an Carausius morosus und Periplaneta americana // Zeitschrift für Morphologie und Ökologie der. Tiere. Bd 62. H. 2. S. 103−161.
Mashaly A., Winkler M., Frambach I., Gras H., Schürmann F.-W., 2008. Sprouting interneurons in mushroom bodies of adult cricket brain // Journal of Comparative Neurology. V. 508. P. 153–174.
Mizunami M., Iwasaki M., Okada R., Nishikawa M., 1998. Topography of four classes of Kenyon cells in the mushroom bodies of the cockroach // Journal of Comparative Neurology. V. 399. P. 162−175.
Mobbs P.G., 1982. The brain of the honeybee, Apis mellifera L. The connections and spatial organization of the mushroom bodies // Philosophical Transactions of the Royal Society. London. B. Biological Sciences. V. 298. P. 309−354.
Nelson J.A., 1915. The embryology of the Honey Bee. Princeton: Princeton Univ. Press. London: Humphrey Milford Oxford Univ. Press. 312 p.
Neumüller R.A., Knoblich J.A., 2009. Dividing cellular asymmetry: asymmetric cell division and its implication for stem cells and cancer // Genes and Development. V. 23. Iss. 23. P. 2675−2699.
Nordlander R.H., Edwards J.S., 1969. Postembryonic brain development in the monarch butterfly, Danaus plexippus plexippus L. I. Cellular events during brain morphogenesis // Wilhelm Roux’s Archiv für Entwicklungsmechanik der Organismen. V. 162. P. 197−217.
Nordlander R.H., Edwards J.S., 1970. Postembryonic brain development in the monarch butterfly, Danaus plexippus plexippus L. III. Morphogenesis of centers other than the optic lobes // Wilhelm Roux’s Archiv für Entwicklungsmechanik der Organismen. V. 164. P. 247−260.
Nusbaum J., 1891. Studya nad morfologia zweierzad. I. Przyczynek do embryologii maika (Meloë proscarabaeus Marsham) // Kosmos (Lemberg). V. 15. P. 17−47. (цит. пo: Nelson, 1915).
Oya S., Kohno H., Kainoh Y., Ono M., Kubo T., 2017. Increased complexity of mushroom body Kenyon cell subtypes in the brain is associated with behavioral evolution in hymenopteran insects // Scientific=Reports. V. 7: 13785. https://doi.org/10.1038/s41598-017-14174-6
Pearson L., 1971. The corpora pedunculata of Sphinx ligustri L. and other Lepidoptera: an anatomical study // Philosophical Transactions of the Royal Society. London. B. Biological Sciences. V. 259. P. 477−576.
Pereanu W., Shy D., Hartenstein V., 2005. Morphogenesis and proliferation of the larval brain glia in Drosophila // Developmental Biology. V. 283. Iss. 1. P. 191−203.
Prokop A., Technau G.M., 1991. The origin of postembryonic neuroblasts in the ventral nerve cord of Drosophila melanogaster // Development. V. 111. Iss. 1. P. 79–88.
Pyle R.W., 1941. Changes in the nervous system of Lepidoptera during metamorphosis // Theses Harvard University. Department of Biology. Canbridge Massachusetts. 105 p.
Risler H., 1954. Die somatische Polyploidie in der Entwicklung der Honigbiene (Apis mellifica) und die Wiederherstellung der Diploidie bei den Drohnen // Zeitschrift für Zellforschung und Mikroskopische Anatomie. Bd. 41. H. 1. S. 1−78.
Roberts H.S., 1955. The mechanism of cytokinesis in neuroblasts of Chortophaga viridifasciata (DeGeer) // Journal of Experimental Zoology. V. 130. Iss. 1. P. 83−105.
Roonwal M.L., 1937. Studies on the embryology of the African migratory locust, Locusta migratoria migratorioides. II. Organogeny // Philosophical Transactions of the Royal Society. London. B. Biological Sciences. V. 227. P. 157−244.
Schmidt H., Rickert C., Bossing T., Vef O., Urban J., Technau G.M., 1997. The embryonic central nervous system lineages of Drosophila melanogaster. II. Neuroblast lineages derived from the dorsal part of the neuroectoderm // Developmental Biology. V. 189. Iss. 2. P. 186−204.
Schrader K., 1938. Untersuchungen über die Normalentwicklung des Gehirns und Gehirntransplantationen bei der Mehlmotte Ephestia kühniella Zeller nebst einigen Bemerkungen über das Corpus allatum // Biologisches Zentralblatt. Bd. 58. S. 52−90.
Schürmann F.-W., 1973. Über die Struktur der Pilzkörper des Insektengehirns. III. Die Anatomie der Nervenfasern in der Corpora pedunculata bei der Acheta domesticus L. (Orthoptera): Eine Golgi Studie // Zeitschrift für Zellforschung und Mikroskopische Anatomie. Bd. 145. S. 247−285.
Sheperd D., Bate C.M., 1990. Spatial and temporal patterns of neurogenesis in the embryo of the locust (Schistocerca gregaria) // Development. V. 108. P. 83−96.
Sjöholm M., Sinakevitch I., Ignell R., Strausfeld N.J., Hansson B.S., 2005. Organization of Kenyon cells in subdivisions of the mushroom bodies of a lepidopteran insect // Journal of Comparative. Neurology. V. 491. P. 290−304.
Sjöholm M., Sinakevitch I., Strausfeld N.J., Ignell R., Hansson B.S., 2006. Functional divisions of intrinsic neurons in the mushroom bodies of male Spodoptera littoralis, revealed by antibodies against aspartate, taurine, FMRF-amide, Mas-allatotropin, and DCO // Arthropod Structure and Development. V. 35. P. 153−168.
Skeath J.B., Carroll S.B., 1992. Regulation of proneural gene expression and cell fate during neuroblast segregation in the Drosophila embryo // Development. V. 114. P. 939−946.
Strausfeld N.J., 2002. Organization of the honey bee mushroom body: representation of the calyx within the vertical and gamma lobes // Journal of Comparative Neurology. V. 450. P. 4−33.
Strausfeld N.J., Sinakevitch I., Vilinsky I., 2003. The mushroom bodies of Drosophila melanogaster: an immunocytological and Golgy study of Kenyon cell organization in the calices and lobes // Microscopy Research and Technique. V. 62. P. 151−169.
Strindberg H., 1913. Embryologische Studien an Insekten // Zeitschrift für Wissentschaftliche Zoology. Bd. 106. S. 1−227.
Tiegs O.W., Muurray F.V., 1938. The Embryonic Development of Calandra oryzae // Quarterly Journal of Microscopical Science. V. 80. P. 159−284.
Trebels B., Doppel S., Schaaf M., Balakrishnan K., Wimmer E.A., Schachtner J., 2020. Adult neurogenesis in the mushroom bodies of red flour beetles (Tribolium castaneum Herbst) is influenced by the olfactory environment // Scientific Reports. V. 10. № 1090. https://doi.org/10.1038/s41598-020-57639-x
Urbach R., Schnabel R., Tchnau G.M., 2003. The pattern of neuroblast formation, mitotic domains and proneural gene expression during early brain development in Drosophila // Development. V. 130. P. 3589−3606.
Viallanes M.H., 1887. Etudes histologiques et organologiques sur les centres nerveux. V. Le cerveau du criquet (Oedipoda coerulescens et Calliptamus italicus) // Annales des Sciences Naturelles. Zoologie. 7me Sér. V. 4. P. 1–120.
Viallanes H., 1890. Sur quelques pointes de l’histoire du développement embryonnaires de la mante religieuse (Mantis religiosa). Communication préliminaire // Revue Biologique de Nord France. V. 2. P. 479−488.
Viallanes H., 1891. Sur quelques pointes de l’histoire du développement embryonnaires de la mante religieuse (Mantis religiosa) // Annales des Sciences Naturelles. Zoologie. 7me Sér. V. 11. P. 283−328.
Weiss M.J., 1974. Neuronal connections and the function of the corpora pedunculata in the brain of the american cockroach, Periplaneta americana // Journal of Morphology. V. 142. P. 21−69.
Weiss M.J., 1981. Structural patterns in the corpora pedunculata of Orthoptera: a reduced silver analysis // Journal of Comparative Neurology. V. 203. P. 515−553.
Wheeler W.M., 1889. The embryology of Blatta germanica and Doryphora decemlineata // Journal of Morphology. V. 3. Iss. 2. P. 291−384.
Wheeler W.M., 1891. Neuroblasts in the arthropod embryo // Journal of Morphology. V. 4. Iss. 3. P. 337−343.
Wheeler W.M., 1893. A contribution to insect embryology // Journal of Morphology. V. 8. Iss. 1. 160 p.
Wong D.C., Lovick J.K., Ngo K.T., Borisuthirattana W., Omoto J.J., Hartenstein V., 2013. Postembryonic lineages of the Drosophila brain: II. Identification of the lineage projection patterns based on MARCM clones // Developmental Biology. V. 384. P. 258−289.
Yang M.Y., Armstrong J.D., Vilinsky I., Strausfeld N.J., Kaiser K., 1995. Subdivision of the Drosophila mushroom bodies by enhancer-trap expression patterns // Neuron. V. 15. P. 45−54.
Yasugi T., Nishimura T., 2016. Temporal regulation of the generation of neuronal diversity in Drosophila // Development Growth and Differentiation. V. 58. P. 73−87.
Zhang H.-L., Huang Y., Lin L.-L., Wang X.-Y., Zheng Z.-M., 2013. The phylogeny of the Orthoptera (Insecta) as deduced from mitogenomic gene sequences // Zoological Studies. V. 52. № 37. P. 1–13.
Zhao X., Coptis V., Farris S.M., 2008. Metamorphosis and adult development of the mushroom bodies of the red flour beetle, Tribolium castaneum // Developmental Neurobiology. V. 68. P. 1487–1502.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


