Зоологический журнал, 2022, T. 101, № 7, стр. 791-804
Слитная и раздельная песни в акустической коммуникации птиц и других животных
В. В. Иваницкий a, *, И. М. Марова a
a Биологический факультет Московского государственного университета
имени М.В. Ломоносова
119991 Москва, Россия
* E-mail: vladivanit@yandex.ru
Поступила в редакцию 21.08.2021
После доработки 15.12.2021
Принята к публикации 17.12.2021
- EDN: XZUAKX
- DOI: 10.31857/S0044513422070066
Аннотация
Представлен обзор данных о слитном (континуальном) и раздельном (дискретном) стилях пения. Эти стили составляют одно из важных проявлений изменчивости рекламной вокализации птиц. Главным критерием для отнесения пения к слитному или раздельному стилю служит наличие или отсутствие жестких регламентов в отношении длительности отдельных песен и пауз между ними. Вокализации раздельного типа свойственна четкая ритмическая организация вокальных сессий, т.е. правильное чередование единичных песен и пауз при относительном постоянстве их длительности. Для слитного пения, напротив, характерно отсутствие жестких регламентов в отношении длительности песен и пауз между ними. Продолжительность отдельных песен варьирует в очень широких пределах, некоторые из них звучат десятки секунд без перерывов, но всегда исполняются и намного более короткие фрагменты. Раздельная песня распространена намного шире и является, по-видимому, более оперативным вариантом рекламной вокализации певчих птиц за счет того, что процесс пения имеет четкую ритмическую организацию, а вокализация предсказуемо чередуется с паузами, облегчающими слуховое сканирование окружающей среды. Кроме того, вариации ритма чередования песен и пауз могут выступать в качестве дополнительного средства кодирования информации, например, об уровне возбуждения поющей птицы. Не исключено, что раздельная манера пения требует более совершенного контроля за процессом вокализации со стороны исполнителя. Эпизоды слитного пения у видов с раздельной песней обычно приурочены к ситуациям, когда такой контроль затруднен, например, возрастным несовершенством вокализации, интенсивной локомоцией (пение в токовом полете) или высоким уровнем возбуждения (агрессивная и брачная песня). Слитная песня может быть эффективным средством монополизации канала связи в сообществах с насыщенной звуковой средой и высоким уровнем акустической конкуренции или может способствовать более надежной трансляции сигналов в условиях, экстремальных с точки зрения распространения звука, благодаря большой длительности и непрерывности.
Использование акустического канала связи в целях внутривидовой коммуникации широко распространено в мире животных. Звуковая сигнализация описана у насекомых, рыб, бесхвостых амфибий, птиц и млекопитающих. Огромное структурное разнообразие используемых сигналов, важность выполняемых ими биологических функций, своеобразные проявления внутрипопуляционной и географической изменчивости – все это привлекает к изучению акустической сигнализации животных внимание многих исследователей (Жантиев, 1981; Никольский, 1984; Попов, 1985; Gerhardt, 1994; Catchpole, Slater, 2008; Касумян, 2009; Greenfield, 2016).
Особенно сложна и многообразна акустическая сигнализация у представителей многочисленного подотряда певчих птиц (Oscines). В системе внутривидовой коммуникации большинства видов певчих птиц, как и у многих других животных, приверженных активному использованию акустической сигнализации, ключевое значение имеют специфические сигналы, часто называемые рекламной песней (advertising song). Песни этого типа используются как сигнал широкого вещания, исполняемый с высокой частотой, в спонтанном режиме, и обычно не имеют персональной адресации. Ярко выраженная спонтанность рекламной песни, ее зависимость главным образом от эндогенных факторов, отличает ее от прочих компонентов коммуникативной системы певчих птиц (позывки и специализированные типы пения), исполняемых лишь при непосредственном контакте с определенным стимулом, например брачным партнером, конкурентом за территорию, хищником (Marler, 2004). В акустическом репертуаре вида рекламная песня обычно обладает наиболее сложной и строго видоспецифичной структурой и выступает в роли эффективного средства саморекламирования, охраны гнездовой территории и привлечения конспецифичного брачного партнера (Catchpole, Slater, 2008). Другими словами, рекламная песня птиц представляет собой мультифункциональный сигнал, оповещающий получателей о статусе, мотивационном состоянии, индивидуальности, популяционной и видовой принадлежности поющей особи.
Структурное разнообразие рекламных песен птиц выглядит неисчерпаемым (Kroodsma, 1982; Eens et al., 1989; Darolova et al., 2012) и являет собой “одно из самых впечатляющих свидетельств диверсификации поведения в мире животных” (Podos, Novicki, 2004). Подотряд певчих птиц (Oscines) содержит свыше 5000 видов, и среди них, вероятно, нет ни одной пары с одинаковой песней. Песни разных видов различаются по частотно-временным и амплитудным параметрам, ритмическим особенностям, синтаксической организации (Price, Lanyon, 2002; Панов, Опаев, 2011; Tietze et al., 2015; Иваницкий, Марова, 2021). Особый интерес представляет, на наш взгляд, различие между раздельными (дискретными) и слитными (континуальными) песнями. Обе эти вокальные манеры распространены достаточно широко, причем не только у певчих птиц, но и во всех вышеупомянутых группах животных с развитой акустической коммуникацией. Тем не менее на протяжении последних десятилетий, отмеченных бурным развитием биоакустики, внимание орнитологов было сосредоточено почти исключительно на видах с типично раздельным пением. Поэтому принципы организации слитных песен, механизмы их популяционно-географической дифференциации и направления эволюции изучены недостаточно. Соответственно этому, причины приверженности разных видов к раздельной или слитной вокализации, их функциональные возможности в коммуникативной сфере, формы эволюционной преемственности между ними также практически не исследованы.
Слитная (непрерывная, континуальная) и раздельная (дискретная) песни – полярные варианты ритмической структуры рекламной вокализации у певчих птиц. Будучи связанными спектром промежуточных вариантов, в своем типичном проявлении слитная и раздельная песни представляют собой весьма различные вокальные конструкции, что позволяет говорить об их своеобразной структурной, функциональной и эволюционной дихотомии. В этом обзоре мы сформулируем критерии слитного и раздельного пения, проанализируем их физиологические, экологические и эволюционные аспекты, рассмотрим типичные примеры. Мы рассмотрим также проявления дихотомии слитной и раздельной вокализации и в других группах животных, использующих в целях коммуникации акустический канал связи: у насекомых (Desutter-Grandcolas, Robillard, 2004; Жантиев и др., 2003; Корсуновская, 2008, 2009, 2009а), бесхвостых амфибий (Blair, 1958; Gerhardt, 1994; Zhou et al., 2014) и китообразных (Stafford et al., 2001; Garland, McGregor, 2020).
Критерии слитной и раздельной песни
Хотя в орнитологии дихотомия слитной и раздельной песни известна давно, основные различия между ними до сих пор сформулированы, на наш взгляд, недостаточно четко. Широко известна в этой связи статья Хартшорна (Hartshorne, 1956), где предпринята попытка ввести универсальный количественный критерий для разграничения разных типов пения в зависимости от соотношения отрезков времени, заполненных собственно звуками пения и разделяющими их паузами. Это соотношение предложено в качестве критерия для отнесения рекламной вокализации птиц к дискретному (доля пауз >70%), промежуточному (70–50%) и континуальному (<50%) типам. Этот критерий был предложен еще до того, как в практику биоакустических исследований был введен сонограф (это произошло на рубеже 50-х и 60-х гг.), поэтому, на наш взгляд, он содержит в себе некоторую неопределенность. В частности, на сонограмме можно измерять паузы с точностью до нескольких миллисекунд, и в этой связи не вполне понятно, какой длины паузы следует учитывать при подсчете их совокупной продолжительности?
Со своей стороны, мы также попытались подытожить некоторые различия между слитным и раздельным пением.
| Песни стандартной длительности с раздельным исполнением | Песни произвольной длительности со слитным исполнением |
|---|---|
| Продолжительность отдельных вокальных эпизодов (единичных песен) не превышает нескольких секунд и является видоспецифическим признаком с незначительным размахом вариаций | Продолжительность отдельных вокальных эпизодов (единичных песен) варьирует в широких пределах и бывает значительной (десятки секунд непрерывного пения) |
| По ходу вокализации четко выражены компактные, монолитные акустические конструкции – отдельные песни (строфы). У многих видов эти конструкции строго стереотипны и имеют сложную структуру с четко выраженной начальной, центральной и заключительной частью | Степень выраженности монолитных акустических конструкций (единичных песен) варьирует в зависимости от режима пения и принадлежности к виду. Песни не стереотипны и не имеют четко выраженной внутренней структуры |
| Песни разделены паузами, протяженность которых, как правило, превышает длительность самих песен (или сопоставима с ними); ритм исполнения устойчивый | Большинство пауз между песнями значительно короче самых длинных песен, ритм исполнения неустойчивый |
Вокализации раздельного типа свойственна четкая ритмическая организация вокальных сессий, т.е. правильное чередование единичных песен и пауз при относительном постоянстве их длительности. Размах вариаций продолжительности отдельных (единичных) песен ограничен, и обычно этот параметр также обладает четко выраженной видовой спецификой. У многих видов c раздельной вокализацией единичные песни обладают достаточно сложной и притом универсальной (видоспецифической) структурой. Например, почти в каждой песне восточного соловья (Luscinia luscinia), зяблика (Fringilla coelebs) и пеночки-веснички (Phylloscopus trochilus) имеются особые фразы, исполняемые только в начале песни, только в центральной ее части и только в заключении (рис. 1; наши данные).
Рис. 1.
Образцы песен. Слитная песня: а – болотная камышевка, б – тонкоклювая камышевка. Раздельная песня: в – пеночка-весничка, г – зяблик, д – восточный соловей, е – вводная фраза, ж – заключительная фраза, з – замыкающий элемент. По вертикальным осям – частота, кГц; по горизонтальным осям – время, с (по нашим записям).

Для слитного пения, напротив, характерно отсутствие жестких регламентов в отношении длительности песен и пауз между ними. Продолжительность отдельных песен варьирует в широких пределах, некоторые из них звучат десятки секунд без перерывов, но всегда исполняются и намного более короткие фрагменты. Разделение единичных песен на внутренние функциональные блоки (введение, центральная часть, заключение) обычно отсутствует или выражено в очень слабой форме (рис. 1, 2).
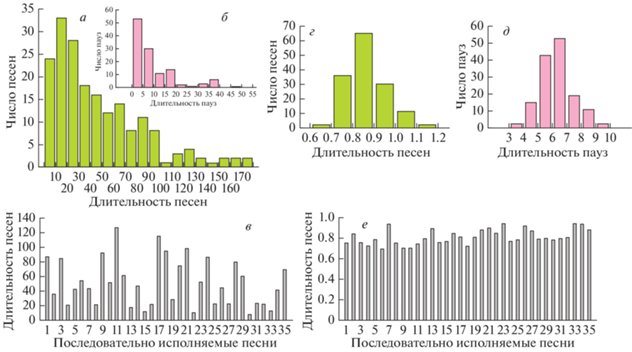
Рис. 2.
Изменчивость продолжительности отдельных песен и пауз в слитном пении тростниковой камышевки (а, б, в) (измерено 190 песен и 120 пауз у 5 самцов) и раздельном пении голосистой пеночки (г, д, е) (измерено 150 песен и 150 пауз у 5 самцов): а, г – длительность песен; б, д – длительность пауз; в, е – вариации продолжительности последовательно исполняемых песен (наши данные).
Контекстуальные и онтогенетические корреляты слитного и раздельного пения
Как отмечено выше, в типичном исполнении слитное и раздельное пение различаются с очевидностью. Например, пение зябликов (Fringilla coelebs) (Slater, Ince, 1979), большинства пеночек (Phylloscopus sp.) (Tietze et al., 2015), овсянок (Emberiza sp.), (McGregor, 1980; Рубцов, Опаев, 2012), дроздов (Turdus sp.) (Dabelsteen, 1984; Bjerke, Bjerke, 1981), мухоловок (Ficedula sp.) (Vabishchevich, Formozov, 2010) всегда строго раздельное, тогда как многие камышевки (Acrocephalus sp.), сверчки (Locustella sp.), бормотушки (Hippolais sp.) (см. ниже) всегда поют только слитно. Таким образом, тип пения (слитный или раздельный) часто выступает в роли видоспецифического признака.
В то же время известны примеры того, как в акустическом репертуаре вида совмещены обе манеры. При этом обычно слитное или раздельное исполнение используется в разных контекстах или в функционально различных категориях песен.
Самцы восточного соловья в дневное время поют, как правило, в раздельной манере, отделяя стереотипные песни друг от друга четкими паузами, однако ночью – в часы наиболее интенсивного пения – они нередко переключаются на типично слитное исполнение песни, когда промежутки между песнями сравниваются с промежутками между отдельными элементами внутри песен (Симкин, 1981; Ivanitskii et al., 2017). Аналогичную суточную изменчивость ритмической структуры песни демонстрирует и садовая камышевка (Acrocephalus dumetorum). Ночью ее интенсивное слитное пение может звучать без перерыва более часа; в дневное время пение становится заметно менее интенсивным и входит в режим своеобразной “диссоциации”. Оно дробится на отдельные относительно короткие отрезки, разделенные четкими паузами. При этом, однако, в отличие от соловья, продолжительность фрагментов вокализации и разделяющих пауз у садовой камышевки произвольная – так же как и их структура, что не позволяет говорить о наличии у этого вида типично раздельной стереотипной песни (Иваницкий и др., 2009).
Еще один пример контекстуальных различий – пение в полете и на присаде. Самцы каменок (Oenanthe sp.) исполняют рекламную песню сидя на возвышении (песенном посту) или во время токового полета. В первом случае отчетливо преобладает раздельное пение (короткие песни стереотипной или импровизационной природы), во втором случае – слитное (Панов, 1978). У лесного конька (Anthus trivialis) и серой славки (Sylvia communis) средняя продолжительность единичных песен, исполняемых во время токовых полетов, почти в 3–4 раза превосходит продолжительность песен, исполняемых самцами, поющими в стационарной позиции, т.е. сидя на вершине дерева или куста (Balsby, Dabelsteen, 2001; Petruscova et al., 2008). Вероятно, наиболее продолжительные слитные песни среди всех певчих птиц исполняют жаворонки (Alaudidae), у большинства видов которых самцы поют преимущественно или даже исключительно во время токовых полетов. Так, у полевого жаворонка (Alauda arvensis) зафиксировано непрерывное пение в течение одного токового полета продолжительностью около одного часа (Geberzahn, Aubin, 2014). По нашим наблюдениям в Калмыкии, весьма продолжительные токовые полеты (более 10 мин) в сопровождении непрерывного слитного пения типичны также для степного жаворонка (Melanocorhypha calandra).
У многих видов, которым в стационарных условиях сольной рекламной вокализации свойственно раздельное пение, песни, сопровождающие напряженные социальные взаимодействия (обычно параллельно с интенсивным демонстративным поведением) – территориальные конфликты (“агрессивная песня”), образование пары, предкопуляционные демонстрации (“брачная песня”), – исполняются в слитной манере (Панов, 1978).
Нетрудно видеть, что во всех приведенных выше примерах прослеживается одна и та же тенденция. При стационарном сольном пении в условиях, когда отсутствуют явные сильные внешние возбудители и общий уровень возбуждения исполнителя умеренный, у него преобладает типично раздельная рекламная песня, которая с нарастанием уровня возбуждения под влиянием эндогенных или экзогенных факторов сменяется слитным пением. Самец каменки, спокойно сидящий на своем песенном посту на вершине скалы, неизменно исполняет раздельную песню, но, завидев самку или соперника-самца, он устремляется к ним с интенсивной слитной песней. Тот же самец при периодическом нарастании эндогенного возбуждения время от времени взмывает ввысь в токовом полете, во время которого также исполняется слитная песня (наши наблюдения). Обращает на себя внимание в целом тесная контекстуальная связь слитного пения с воздушной локомоцией. Не исключено, что раздельная манера исполнения рекламной песни требует более совершенного контроля за процессом вокализации со стороны исполнителя. Примечательно, что эпизоды слитного пения у видов с раздельной песней обычно приурочены к ситуациям, когда такой контроль затруднен, например, интенсивной локомоцией (пение в токовом полете) или высоким уровнем возбуждения (агрессивная и брачная песня).
В этой связи определенный интерес представляют, на наш взгляд, и процессы онтогенеза. Заслуживает внимания тот факт, что первые стадии онтогенеза песни (подпесня и пластичная песня) обычно представлены именно слитной вокализацией, причем даже у тех видов, у которых дефинитивная песня является строго раздельной. Например, у молодых южных соловьев (L. megarhynchos) подпесня типично слитная, ей на смену приходит слитная же пластичная песня, которая в возрасте 46–49 недель в свою очередь сменяется на типичную раздельную дефинитивную песню (Hultsch, Todt, 2004). Несколько примеров опережающего появления в онтогенезе слитной песни при последующей смене ее раздельной песней приводит также Constantine (2006).
Таким образом, данные по онтогенезу песни соответствуют высказанным выше представлениям о том, что раздельная манера исполнения рекламной песни требует более совершенного контроля за процессом вокализации со стороны исполнителя.
К сходному выводу пришла также Корсуновская (2009) при анализе структуры и эволюции систем акустической сигнализации кузнечиковых (Tettigonioidea). В каждой группе кузнечиков ею были найдены виды, издающие призывный сигнал в виде простой протяженной трели, и виды, звуки которых обладают сложной временно́й организацией с несколькими ритмическими уровнями. По ее мнению, “простейшей ритмической организацией обладает трель, следующая ступень развития временно́й структуры – появление сигналов, издаваемых в виде периодически повторяющихся серий. В этом случае на ритм повторения пульсов накладывается ритм повторения серий, и, наконец, последовательность фраз из однотипных серий представляет собой сигнал с тремя ритмическими уровнями”. Отметим, что длительные слитные трели признаются в качестве предкового типа рекламной вокализации также и в эволюции сверчков (Grylloidea) (Alexander, 1962; Robillard, Desutter-Grancolas, 2011).
Эволюционные и экологические аспекты слитного и раздельного пения
Судя по тому, что нередко даже близкородственные виды исполняют свои рекламные песни в совершенной разной манере, переходы между слитной и раздельной песней в процессе эволюции могут происходить довольно быстро. Например, у многих палеарктических сверчков (Locustella naevia, L. fluviatilis, L. luscinioides, L. lanceolata) песни слитные с нерегламентированной (часто весьма значительной) длительностью и очень плотной упаковкой нот (“стрекочущие”). Так, песня речного сверчка, по нашим данным, может тянуться непрерывно свыше 12 мин с абсолютно постоянным и притом очень высоким ритмом эмиссии 14–15 нот/с и с промежутками между нотами 25–30 мс. В противоположность этому, ржавчатая пестрогрудка (L. mandelli), обитающая в Юго-Восточной Азии и имеющая фонетически сходную песню “стрекочущего” типа, придерживается раздельной манеры исполнения – даже при наиболее интенсивном пении, когда паузы между отдельными песнями сокращаются до 0.25–0.30 с, оставаясь, однако, вполне сопоставимыми с продолжительность самих песен (Alström et al., 2015). Песни таежного (L. fasciolata) и певчего (L. certhiola) сверчка также раздельные, однако они намного более разнообразны и фонетически резко отличны от песен “стрекочущих” видов) (наши данные).
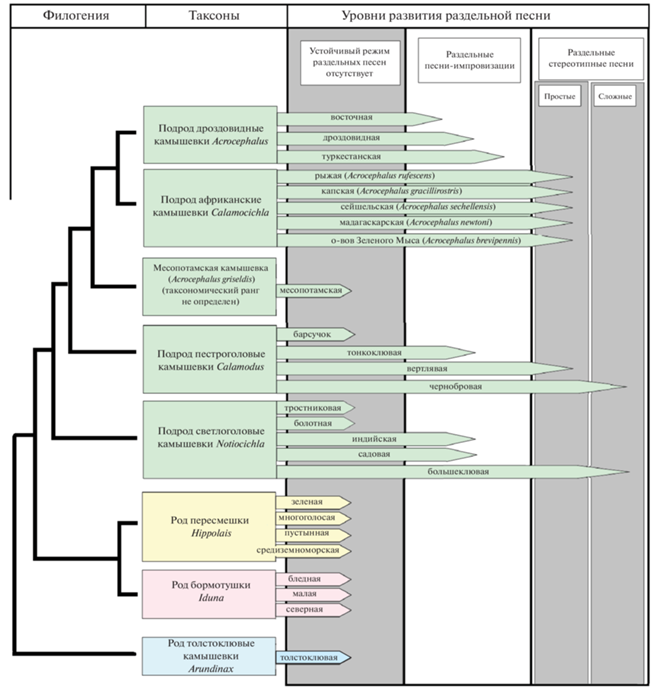
Рассмотрим данные о ритмической организации рекламной песни разных видов камышевок, обобщенные в схематической форме на рис. 3. В настоящее время род настоящих камышевок (Acrocephalus), включающий свыше 30 видов, вместе с относительно немногочисленными родами пересмешек (Hippolais), бормотушек (Iduna) и монотипическим родом толстоклювых камышевок (Arundinax), выделяют в отдельное семейство Acrocephalidae (Fregin et al., 2009; Arbabi et al., 2014). Здесь мы видим практически все варианты ритмической организации песни. Наиболее яркий пример слитной вокализации дают тростниковая камышевка (Acrocephalus scirpaceus) и барсучок (A. schoenobaenus), у которых единичные песни могут звучать десятки секунд без перерыва, а устойчивого режима раздельных песен нет вовсе. Отметим, что они относятся к разным подродам (Catchpole, 1980; Иваницкий и др., 2008а). У болотной камышевки (A. palustris), которая по генетическим данным является близким родичем тростниковой камышевки, у всех бормотушек и пересмешек, месопотамской (A. griseldis) и толстоклювой (Arundinax aedon) камышевок также преобладает слитное пение (Secondi et al., 2003; Kennerley, Pearson, 2010; Darolova et al., 2012). По–видимому, именно его следует считать эволюционно наиболее древним (исходным) вариантом ритмической организации в данном семействе. Скорее всего, слитная песня является в данном случае предковым признаком, тогда как раздельную песню можно считать производным признаком.
Рис. 3.
Модель параллельной изменчивости и эволюции рекламной вокализации в разных филогенетических стволах семейства камышевковых (Acrocephalidae). Филогенетические взаимоотношения между разными подродами и родами (слева) приведены в схематической форме по Arbabi (2014). Длина стрелки соответствует степени развития раздельной песни у данного вида. Источники данных: Иваницкий и др., 2006, 2008, 2008а, 2009; Опаев, Иваницкий, 2010; Catchpole, 1976, 1980; Catchpole, Komdeur, 1993; Darolova et al., 2012; Kennerley, Pearson, 2010; Milder, Schreider, 1989; Samotskaya et al., 2016; Secondi et al., 2003.
Примером попеременного использования в рекламной вокализации и слитной, и раздельной песни – при быстром переключении между ними по ходу одного сеанса пения – могут служить тонкоклювая (Acrocephalus melanopogon) и индийская (A. agricola) камышевка. Так, при рекламировании территории самец тонкоклювой камышевки исполняет подряд несколько коротких песен (<10 с), после чего звучит намного более длительная песня (до 50–60 с). При исполнении коротких песен у этого вида отчетливо преобладает импровизация, т.е. каждая следующая песня отличается от предыдущей. Напротив, длинные песни содержат стереотипные вокальные композиции, которые в неизменном виде повторяются полностью или частично в ходе пения особи. Одна длинная песня может содержать до шести полных серийных повторений одной композиции (чаще 2–3), после чего, не прекращая пения, самец переключается на другую композицию (Иваницкий и др., 2006; Иваницкий, Бочкарева, 2008).
Сочетание преимущественно раздельной песни и импровизационного стиля ее исполнения типично для всех представителей группы “дроздовидных” камышевок: восточной (A. orientalis), голосистой (A. stentoreus) и собственно дроздовидной (A. arundinaceus) (Catchpole, 1980; Опаев, Иваницкий, 2010). Еще дальше в направлении эволюции раздельной песни с относительно простой структурой продвинулись камышевки, населяющие тропическую Африку и прилежащие к ней острова: Мадагаскар, Сейшельские, Зеленого мыса (Catchpole, Komdeur, 1993), а также некоторые камышевки, изолированно обитающие на островах западной части Тихого океана (Milder, Schreiber, 1989; Kennerley, Pearson, 2010).
Особое положение в континууме “раздельная – слитная песня” занимают чернобровая (A. bistrigiceps) и большеклювая (A. orinus) камышевка (подроды Calamodus и Notiocichla, соответственно). Их рекламная вокализация занимает промежуточное положение между слитной и раздельной песней. С одной стороны, их единичные песни могут быть достаточно продолжительны при плотной упаковке составляющих нот. С другой стороны, многие такие песни повторяются по ходу пения практически в неизменном виде. Таким образом, единичные песни хорошо выражены, разделены отчетливыми паузами, имеют сложную структуру и в известной мере могут быть названы стереотипными (Иваницкий и др., 2008а; Samotskaya et al., 2016).
Контроль временны́х параметров песни резко различается даже у близких видов с очень сходным типом вокализации. Например, камышевка-барсучок заметно превосходит чернобровую камышевку как по средней протяженности и уровню вариабельности длины отдельных песен, так и по протяженности и равномерности темпа исполнения гомотипических серий, являющихся главным материалом для построения песни у обоих видов. Отсутствие эффективного контроля за эмиссией нот, образующих серии, может служить существенным препятствием на пути выработки системы дискретных стереотипных песен и других устойчивых акустических конструкций, в основе которых лежит тенденция к копированию однажды заученных образцов (Иваницкий и др., 2008а).
Можно допустить, что физические условия распространения звука в местах обитания разных видов способствуют развитию у них раздельной или слитной песни. Чтобы оценить вероятность такого эволюционного сценария, полезно, как мы полагаем, сравнить между собой две группы певчих птиц, которые являются, пожалуй, самыми известными представителями слитной манеры пения. Это камышевки и жаворонки. Их обоюдная приверженность слитной манере пения выглядит удивительной с учетом резких экологических и поведенческих различий между ними. Жаворонки и камышевки противоположны буквально во всех проявлениях своего образа жизни. Первые обитают на совершенно открытой местности и часто поют в воздухе во время сложных и длительных токовых полетов. Вторые, напротив, живут в гуще растительности, причем некоторые виды, обитающие в зарослях надводных макрофитов (тростника или рогоза), являются обитателями наиболее плотных растительных толщ, которые могут заселяться птицами. Поют камышевки, сидя на одном месте. Самцы большинства видов стараются располагаться для пения на открытых насестах, но тростниковые камышевки неизменно поют на закрытых позициях, располагаясь внутри густой поросли. Среди всех видов камышевок только у барсучка и вертлявой камышевки самцы в период размножения регулярно совершают короткие токовые полеты (Catchpole, 1980; Иваницкий и др., 2007).
Соответственно, различаются и факторы, влияющие на распространение звука. У жаворонков это, несомненно, ветер, который в местах их обитания дует практически непрерывно и, как правило, бывает сильным (временами чрезвычайно сильным). Для камышевок первостепенное значение приобретает деградация звука в процессе его прохождения сквозь густую растительность. Возможно, именно поэтому пение тростниковых камышевок на слух всегда воспринимается, как намного более тихое, чем у видов, обитающих по соседству и поющих обычно на открытых присадах – индийская или тонкоклювая камышевки (Иваницкий и др., 2006, 2007).
Физиологические и коммуникативные аспекты слитного и раздельного пения
Сравнение камышевок и жаворонков, приведенное выше, убеждает в том, что слитная песня служит эффективным средством коммуникации при разных условиях распространения звука, в том числе и при таких, которые в этом отношении можно назвать контрастными и притом, в известной мере, экстремальными. В свете этого неожиданным выглядит тот факт, что настоящая слитная рекламная песня, подобная песне тростниковой камышевки, барсучка, сверчков или полевого жаворонка, среди певчих птиц в целом встречается намного реже по сравнению с раздельной песней. Так, по приблизительным подсчетам, песни длиннее 6 с встречаются менее чем у 15% видов европейских певчих птиц (Bhattacharya et al., 2008). По данным, приведенным в диссертации Опаева (2021), среди 76 видов певчих птиц, представляющих 20 семейств мировой фауны, обнаружились всего 2 вида, продолжительность песен которых превышала 5 с. Как пишет автор: “типичная (“средняя”) воробьиная птица имеет дискретную манеру пения: песни длительностью 1–2 с разделены промежутками в 3–8 с”.
Факт безусловного преобладания раздельной манеры пения тем в большей степени заслуживает внимание, если учесть, что у певчих птиц имеются физиологические механизмы, обеспечивающие возможность слитного пения. Рекламные песни многих видов певчих птиц представляют собой сложные и продолжительные вокальные конструкции, воспроизведение которых требует, в частности, четкого взаимодействия нейронных и мышечных систем, обеспечивающих дыхание и фонацию. Одной из ключевых физиологических особенностей певчих птиц, непосредственно связанных с пением, является уникальная технология “мини-вдохов”, позволяющая вдыхать воздух в очень короткие промежутки между последовательно исполняемыми элементами песни (Hartley, Suthers, 1989). Эта особенность дает птицам возможность петь практически непрерывно, в течение длительного времени, и может, как мы полагаем, рассматриваться, как важная преадаптация к возникновению продолжительной и слитной песни.
Причины абсолютного преобладания у певчих птиц раздельной и притом относительно короткой рекламной песни – зачастую при наличии у многих видов умения петь слитно и длительно (при исполнении “пластичных”, “брачных” или “агрессивных” песен), не вполне понятны. В этой связи можно предположить, что при раздельном пении птица имеет больше возможностей для слухового сканирования окружающего пространства, поскольку в этом случае короткие эпизоды собственного пения правильным образом чередуются с паузами, позволяя тем самым вслушиваться в биологически важные звуки внешнего мира, например, в пение соседей. Правда, экспериментальные исследования, которые могли бы подтвердить или опровергнуть предположение о том, что звучание собственного голоса действительно затрудняет поющей птице восприятие внешних звуков, нам не известны. Тем не менее существование такой проблемы в современной нейрофизиологии слуха признается (Scott, 2013). Имеются экспериментальные свидетельства того, что собственная громкая речь понижает чувствительность слуховой коры головного мозга говорящего, вызывая задержку реакции нейронов на 10–21 мс и снижая ее интенсивность на 44–71% (Numminen et al., 1999). В качестве механизма, позволяющего ослабить реакцию на стимулы, возникающие в результате собственной активности, предложена модель “эфферентных копий” – особых импульсов (corollary discharge), которые посылаются в опережающем режиме на слуховые рецепторы и которые понижают их чувствительность к собственной вокализации. Работы с певчими птицами в этом направлении только начинаются (Prather et al., 2008), однако эффективность этого механизма была показана экспериментально на примере стридуляционного “пения” прямокрылых насекомых (Crapse, Sommer, 2008; Fukutomi, Carlson, 2020).
Отметим, что насекомые, у которых встреча полов обеспечивается почти исключительно за счет акустической сигнализации, могут служить хорошей иллюстрацией функциональных различий между слитной и раздельной песней в сфере коммуникации.
Так, например, слитная и длительная песня – в ее наиболее ярком и типичном исполнении – свойственна большинству видов певчих цикад (Cicadidae), а также многим видам сверчков (Gryllidae) и медведок (Gryllotalpidae). Наши наблюдения за этими насекомыми в Калмыкии, Предкавказье, в Южном Вьетнаме, а также просмотр сонограмм сделанных там записей убеждают в том, что пение сверчков и медведок представляет собой очень длительную, непрерывную и монотонную трель и может продолжаться десятки минут без перерыва. Известно, что самцы многих видов сверчков поют рядом со своими убежищами (норками), а самцы медведок – непосредственно в норах, которые имеют особое устройство и служат резонаторами. Цикады поют, сидя открыто на стволах деревьев. Их песни включают сложную амплитудную модуляцию, однако у всех известных нам видов они являются слитными и очень продолжительными. Самки цикад, сверчков и медведок в процессе сближения с самцом (фонотаксис) звуков не издают. Соответственно, акустические взаимодействия, требующие реципрокного слухового восприятия сигналов друг друга, на стадии сближения партнеров у этих насекомых отсутствуют (Жантиев, Корсуновская, 1973; Попов, 1985; Жантиев и др., 2003). Очевидно, что при этих условиях самец цикады, сверчка или медведки может петь непрерывно сколько угодно долго, не опасаясь пропустить какой-либо релевантный сигнал.
Иную картину мы видим у видов с более динамичной системой коммуникации, у которых самцы, не будучи привязаны к постоянным убежищам, относительно свободно перемещаются в пространстве, а фонотаксис и вокализация в той или иной мере присущи обоим партнерам. Как пишет Корсуновская (2009), акустическая коммуникация у листовых кузнечиков (Phaneropterinae) включает в себя регулярный обмен сигналами между половыми партнерами, а также, возможно, и между соседними самцами. Непременным условием встречи полов является установление акустического контакта, для чего требуется очень точная координация в системе “стимул–реакция”. В частности, “для установления устойчивого акустического контакта между потенциальными брачными партнерами ответ самки должен быть воспринят самцом в определенном видоспецифическом временно́м интервале после его собственного сигнала”. Очевидно, что в этой ситуации использование непрерывных и слитных сигналов, подобных трелям медведок или сверчков, едва ли возможно. Соответственно, акустическая коммуникация у листовых кузнечиков строится на использовании относительно коротких сигналов, разделенных четкими паузами сопоставимой, а иногда и значительно превышающей длительности (Корсуновская, 2008, 2009).
Возвращаясь к певчим птицам, мы можем теперь предположить, что, по всей видимости, и у них типичная раздельная песня также может быть более оперативным вариантом рекламной вокализации.
Прежде всего, как отмечалось выше, в этом случае пение предсказуемо чередуется с паузами, облегчающими слуховое сканирование окружающей среды. Благодаря этому складываются оптимальные условия для “перекличек” или “вокальных дуэлей” соседних самцов, которые, как полагают, имеют важное значение в регуляции их пространственно-территориальных взаимоотношений. Например, самцы американской певчей овсянки (Melospiza melodia), чей индивидуальный репертуар содержит обычно 6–8 дискретных типов песен, по–разному отвечают на пение соседа на разных стадиях размножения. Если на начальных этапах самец в этой ситуации обычно воспроизводит в ответ тот же самый тип песен, но позднее – один из типов песен, общих для репертуаров этих самцов. Примечательно, что самец избегает исполнять песни, отсутствующие в репертуаре соседа, даже если они имеются в его собственном репертуаре (Beecher et al., 2000). Если же у самца вообще нет общих типов песен с соседом, и в ответ на пение последнего он исполняет другие песни, то в этом случае территориальные взаимоотношения самцов являются более агрессивными (Wilson, Vehrencamp, 2001). Стимулом к агрессии во взаимоотношениях самцов южного соловья (L. megarhynchos), одновременно поющих по соседству друг с другом, может быть перекрывание отдельных песен (их наложение). При этом самцы, чьи песни накладываются на песни других самцов, вызывают более сильную агрессию по сравнению с самцами, чьи песни перекрываются другим исполнителем, причем принадлежность самцов к “перекрывающим” или к “не перекрывающим” отличается большим индивидуальным постоянством (Collins, 2004).
Понятно, что для всех взаимодействий такого рода предпочтительны короткие стереотипные песни. Как пишут Хультч и Тодт (Hultsch, Todt, 2004): “сигнал должен быть достаточно продолжительным для того, чтобы вместить всю необходимую информацию, но все же не настолько длинным, чтобы отсрочить ответную реакцию”. Сложные акустические взаимодействия между соседними самцами, такие как синхронизация или, наоборот, правильное чередование (альтерация) сигналов, возможны лишь при использовании достаточно коротких звуков (Greenfield, 1994).
К преимуществам раздельного пения можно отнести и то, что ритм чередования песен и пауз может выступать в качестве дополнительного средства кодирования информации, например, об уровне возбуждения поющей птицы. Наконец, четкий ритм чередования песен и пауз, сопоставимых по длительности и притом относительно коротких, выглядит менее затратным с энергетической точки зрения и, как можно думать, равномернее распределяет нагрузку на мышечную систему сиринкса по сравнению с длительным, безостановочным и монотонным пением. Заслуживают упоминания в этой связи работы, посвященные изучению феномена “вокального дрейфа”, под которым подразумевается постепенное увеличение продолжительности промежутков между одинаковыми песнями по ходу исполнения их длительных серий. Полагают, что такое увеличение свидетельствует о нарастании “усталости” мышц сиринкса при многократном исполнении одной и той же песни, что побуждает птицу переключиться на исполнение песни другого типа, после чего промежутки между песнями вновь сокращаются (Lambrechts, Dhondt, 1988; Poesel, Kempenaers, 2000). Отметим, однако, что все упомянутые работы выполнены на видах с раздельной песней (синицы рода Parus). Открытым остается вопрос о том, в какой мере можно говорить об “усталости” применительно к видам со слитной песней, например к сверчкам с их необычайно продолжительным и монотонным пением.
В то же время, слитная и продолжительная (“бесконечная”) песня также не лишена определенных коммуникативных достоинств. Например, за счет высокой избыточности она может, вероятно, повышать надежность трансляции сигналов в условиях, экстремальных с точки зрения распространения звука (при постоянном воздействии сильного ветра у жаворонков или реверберации в густой растительности у камышевок и сверчков). Представители кричащих воробьиных (Suboscines) огненные мухоловы (Pyrocephalus rubinus), живущие среди городского шума, исполняют почти исключительно длинные песни, тогда как за пределами города – и длинные, и короткие (Rios-Chelen et al., 2013). Тихоокеанские крапивники (Troglodytes pacificus) при наличии постоянного шума исполняют более длинные песни и используют для их построения более продолжительные ноты, чем при его отсутствии (Gough et al., 2014).
Можно также предположить, что слитная песня может служить эффективным средством “монополизации эфира” в сообществах с насыщенной звуковой средой и высоким уровнем акустической конкуренции. Например, слитную песню специализированных фрагмофилов – тростниковой камышевки и соловьиного сверчка – можно трактовать как адаптацию не только к физическим особенностям среды, усиливающим реверберацию, но и к мощному акустическому прессингу со стороны чрезвычайно громкоголосых и многочисленных дроздовидных камышевок, поющих в том же самом частотном диапазоне. Аналогичным образом можно допустить, что слитная песня речного и обыкновенного сверчков помогает им более успешно конкурировать за канал связи с их постоянными соседями по местообитаниям – восточным соловьем и садовой камышевкой, которые также отличаются очень громким голосом, повсеместно высокой численностью и – за счет ярко выраженной склонности к ночному пению – практически всегда поют одновременно со сверчками. Отметим, однако, что в этом акустическом сообществе имеет место значительно расхождение по частотным диапазонам (песни сверчков располагаются выше по спектру).
На роль межвидовой конкуренции за акустический канал связи в эволюции слитной манеры пения у насекомых – на примере сверчков и певчих цикад – обращает внимание Попов (1985). В многовидовых сообществах симбиотопических сверчков “лучшие и наибольшие участки занимают виды, сигналы которых имеют меньше пауз и поэтому являются большей помехой для коммуникации других видов” (Попов, 1985, с. 100). Вероятно всякий, кому приходилось бывать в тропическом лесу в пору массового пения цикад, может подтвердить, что создаваемый ими сплошной и притом необычайно мощный акустический фон буквально подавляет все прочие звуки, включая пение птиц и крики лягушек, которые вынуждены использовать “частотные и временны́е окна”, т.е. те участки частотного диапазона или же те часы суток, которые в минимальной степени наполнены пением цикад (Páez et al., 1993; Slabbekoorn, 2004; Slabbekoorn, Smith, 2002; Wollerman, Wiley, 2002; Hart et al., 2015).
Мы полагаем, что дихотомия слитной и раздельной вокализации представляет собой важную, но недостаточно изученную проблему, имеющую свои эволюционные, поведенческие и физиологические аспекты. Проявления такой дихотомии мы видим в самых разных группах животных, причем вне зависимости от их способности к вокальному обучению и особенностей механизмов звукопродукции. В особенности широким распространением пользуется дихотомия слитной и раздельной вокализации у певчих птиц. Преобладание раздельной песни у всех представителей подотряда Oscines в целом, а также в наиболее прогрессивных группах (овсянки, пеночки, дрозды, мухоловки и пр.), колонизировавших наиболее широкий спектр местообитаний, наводит на мысль о том, что раздельная манера исполнения рекламной песни имеет определенные преимущества, как более эффективное и оперативное средство коммуникации, но требует и более совершенного контроля за процессом вокализации со стороны исполнителя. Примечательно, что эпизоды слитного пения у видов с раздельной песней обычно приурочены к ситуациям, когда такой контроль затруднен. Причинами этого могут быть возрастное несовершенство вокализации (пластичная песня), интенсивная локомоция (пение в токовом полете), высокий уровень возбуждения (агрессивная и брачная песня). Мы полагаем, что такая вариативность вполне может выступать в роли эволюционного механизма сохранения слитной песни, благодаря которому, в частности, возможно появление относительно быстрых (например, на уровне близкородственных конгенеричных видов) эволюционных переходов между слитной и раздельной песней.
Список литературы
Жантиев Р.Д., 1981. Биоакустика насекомых. М.: Изд-во МГУ. 257 с.
Жантиев Р.Д., Корсуновская О.С., 1973. Звуковая сигнализация и некоторые характеристики слуховой системы медведок (Orthoptera, Grillotalpidae) // Зоологический журнал. Т. 52. № 12. С. 1789–1801.
Жантиев Р.Д., Корсуновская О.С., Сорокин Н.Н., Чуканов В.С., 2003. Звуковые сигналы медведок (Orthoptera, Grillotalpidae) фауны Восточной Европы // Зоологический журнал. Т. 82. № 11. С. 1339–1346.
Иваницкий В.В., Квартальнов П.В., Марова И.М., 2006. Акустическая сигнализация и поведение индийской камышевки, Acrocephalus agricola (Passeriformes, Sylviidae) // Зоологический журнал. Т. 85. № 8. С. 971–982.
Иваницкий В.В., Квартальнов П.В., Маркитан Л.В., Марова И.М., 2007. Камышевки (Acrocephalus, Sylviidae) на лиманах восточного Приазовья: механизмы экологической сегрегации и смена стаций в сообществе с высоким видовым разнообразием // Зоологический журнал. Т. 86. № 8. С. 966–977.
Иваницкий В.В., Бочкарева Е.Н., 2008. Рекламная песня восточной тонкоклювой камышевки (Acrocephalus melanopogon mimica, Sylviidae): структурно–функциональные и филогенетические аспекты // Зоологический журнал. Т. 87. № 3. С. 319–330.
Иваницкий В.В., Бочкарева Е.Н., Марова И.М., 2008а. На рубеже между раздельной и слитной песнями: рекламная вокализация чернобровой камышевки (Acrocephalus bistrigiceps, Sylviidae) // Зоологический журнал. Т. 87. № 11. С. 1348–1360.
Иваницкий В.В., Марова И.М., 2021. Синтаксическая организация песни птиц // Зоологический журнал. Т. 100. № 10. С. 1145–1158.
Иваницкий В.В., Марова И.М., Бочкарева Е.Н., 2009. Структура рекламной вокализации садовой камышевки (Acrocephalus dumetorum, Sylviidae): существует ли очередность в исполнении разных песен у видов с богатым репертуаром? // Зоологический журнал. Т. 88. № 3. С. 326–338.
Касумян А.О., 2009. Звуковая сигнализация у рыб. Учебное пособие. М.: Изд-во Московского университета. 157 с.
Корсуновская О.С., 2008. Звуковая сигнализация кузнечиковых (Orthoptera, Tettigonioidea). Сообщение 1 // Зоологический журнал. Т. 87. № 12. С. 1453–1471.
Корсуновская О.С., 2009. Звуковая сигнализация кузнечиковых (Orthoptera, Tettigonioidea). Сообщение 2 // Зоологический журнал. Т. 88. № 1. С. 18–22.
Корсуновская О.С., 2009а. Акустические системы связи кузнечиковых (Orthoptera, Tettigonioidea). Автореф. дис. … докт. биол. наук. М.: МГУ.
Никольский А.А., 1984. Звуковые сигналы млекопитающих в эволюционном процессе. М.: Наука. 199 с.
Опаев А.С., Иваницкий В.В., 2010. Рекламная вокализация туркестанской камышевки (Acrocephalus stentoreus, Sylviidae) // Зоологический журнал. Т. 37. № 2. С. 198–211.
Опаев А.С., 2021. Пение певчих воробьиных птиц (Passeri): структура, эволюция и роль в коммуникации. Дис. … докт. биол. наук. М. 337 с.
Панов Е. Н., 1978. Механизмы коммуникации у птиц. М.: Наука. 306 с.
Панов Е.Н., Опаев А.С., 2011. Акустическое поведение птиц: структура, функция, эволюция (на примере избранных семейств отряда Воробьинообразных). Электронный журнал “Этология и зоопсихология”. № 1 (3). http:// www. etholpsy.ru
Попов А.В., 1985. Акустическое поведение и слух насекомых. Л.: Наука. 256 с.
Рубцов А.С., Опаев А.С., 2012. Реконструкция филогении обыкновенной и белошапочной овсянок по песне и морфологическим признакам // Зоологический журнал. Т. 91. № 4. С. 577–586.
Симкин Г.Н., 1981. Песня восточного соловья как акустический маркер групповых и популяционных структур // Орнитология. Вып. 16. С. 73–83.
Alexander R.D., 1962. Evolutionary change in cricket acoustic communication // Evolution. V. 16. P. 443–467.
Alström P., C. Xia, P.C., Rasmussen U., Olsson B., Dai J., Zhao P.J., Leader G.J., Carey L., Dong T., Cai P.I., Holt H.L., Manh G., Song Y., Liu Y., Zhang Y., Lei F., 2015. Integrative taxonomy of the Russet bush warbler Locustella mandelli complex reveals a new species from central China // Avian Research. V. 6. P. 9–25.
Arbabi T., Gonzalez J., Wink M., 2014. A re-evaluation of phylogenetic relationships within reed warblers (Aves: Acrocephalidae) based on eight molecular loci and ISSR profiles // Molecular Phylogenetics and Evolution. V. 78. P. 304–313.
Balsby T.J.S., Dabelsteen T., 2001. The meaning of song repertoire size and song length to male whitethroats Sylvia communis // Behavioral Process. V. 56. P. 75–84.
Beecher M.D., Cambell E., Burt J.M., Hill C.E., Nordby J.C., 2000. Song-type matching between neighbouring song sparrows // Animal Behaviour. V. 59. P. 21–27.
Bhattacharya H., Cirillo J., Todt D., 2008. Universal features in the singing of birds uncovered by comparative research // Our Nature. V. 6. P. 1–14.
Bjerke T.K., Bjerke T.H., 1981. Song dialects in the redwing, Turdus iliacus // Ornis Scandinavica. V. 12. P. 40–50.
Blair W.F., 1958. Mating call in the speciation of anuran amphibians // American Naturalist. V. 42. P. 27–51.
Catchpole C.K., 1976. Temporal and sequential organization of song in the sedge warbler Acrocephalus schoenobaenus // Behaviour. V. 59. P. 226–246.
Catchpole C.K., 1980. Sexual selection and the evolution of complex songs among warblers of the genus Acrocephalus // Behaviour. V. 74. P. 149–166.
Catchpole C.K., Komdeur J., 1993. The song of the Seychells warbler A. sechellensis, an island endemic // Ibis. V. 135. P. 190–195.
Catchpole C.K., Slater P.J.B., 2008. Bird song. Biological Themes and Variations. N.Y.: Cambridge Univ. Press. 335 p.
Collins S., 2004. Vocal fighting and flirting: the function of birdsong // In Nature’s Music. The Science of Birdsong. London: Elsevier Academic Press. (eds P. Marler and H. Slabbecoorn).
Constantine M., 2006. The sound approach to birding. Utrecht. Netherlands. 192 p.
Crapse T.B., Sommer M.A., 2008. Corollary discharge across the animal kingdom // Nature Reviews Neuroscience. V. 9. P. 587–600.
Dabelsteen T., 1984. An analysis of the full song of the blackbird Turdus merula with respect to message coding and adaptations for acoustic communication // Ornis Scandinavica. V. 15. P. 227–239.
Darolova A., Kristofik J., Hoi H., Wink M., 2012 Song complexity in male marsh warblers: does it reflect male quality? // Journal of Ornithology. V. 153. P. 431–439.
Desutter–Grandcolas L., Robillard T., 2004. Acoustic evolution in crickets: need for phylogenetic study and a reappraisal of signal effectiveness // Anais da Academia Brasileira de Ciências. V. 76. P. 301–315.
Eens M., Pinxten R., Verheyen R.F., 1989. Temporal sequential organization of song bouts in the starling // Ardea. V. 77. P. 75–86.
Fregin S., Haase M., Olsson U., Alström P. 2009. Multi–locus phylogeny of the family Acrocephalidae (Aves: Passeriformes) the traditional taxonomy overthrown // Molecular Phylogenetics and Evolution. V. 55. P. 866–878.
Fukutomi M., Carlson B.A., 2020. A history of corollary discharge: contributions of mormyrid weakly electric fish // Frontiers in Integrative Neuroscience. V. 29. July 2020. https://doi.org/10.3389/fnint.2020.00042
Garland E.C., McGregor P.K., 2020. Cultural transmission, evolution, and revolution in displays: insights from bird and whale song. Frontiers in Psychology. V. 11. www.frontiersin.org
Geberzahn N., Aubin T., 2014. How a songbird with a continuous singing style modulates its song when territorially challenged // Behavioral Ecology and Sociobiology. V. 68. P. 1–12.
Gerhardt H.C., 1994. The evolution of vocalization in frogs and toads: the evolution of signal interactions // Annual Review Ecology and Systematics. V. 25. P. 293–324.
Greenfield M.D., 1994. Cooperation and conflict in the evolution of signal interactions // Annual Review Ecology and Systematics. V. 25. P. 97–126.
Greenfield M.D., 2016. Evolution of acoustic communication in insects // G.S. Pollack et al. (eds). Insect Hearing, Springer Handbook of Auditory Research 55. P. 17–47.
Gough D.C., Mennill D.J., Nol E., 2014. Singing seaside: pacific wrens (Troglodytes pacificus) change their songs in the presence of natural and anthropogenic noise // The Wilson Journal of Ornithology. V. 126. P. 269–278.
Hart P.J., Robert Hall R., Ray W., Beck A., Zook J., 2015. Cicadas impact on bird communication in a noisy tropical rainforest // Behavioral Ecology. V. 26. P. 839–842.
Hartley R.S., Suthers R.A., 1989. Airflow and pressure during canary song: direct evidence for mini-breaths // J. Comp. Physiol. V. 165. P. 15–26.
Hartshorne C., 1956. The monotony threshold in singing birds // Auk. V. 73. P. 176–192.
Hultsch H., Todt D., 2004. Learning to sing. In Nature’s Music. The Science of Birdsong. London: Elsevier Academic Press. P. 80–107.
Ivanitskii V.V., Marova I.M., Antipov V.A., 2017. Sequential organization in the song of thrush nightingale (Luscinia luscinia): clustering and sequential order of the song types // Bioacoustics. V. 26. P. 199–215.
Kennerley P., Pearson D., 2010. Reed and bush warblers. London: Cristopher Helm. 708 p.
Kroodsma D.E., 1982. Song repertoires: problems in their definition and use. In Acoustic communication in birds. New York: Academic Press. P. 125–146.
Lambrechts M., Dhondt A.A., 1988. The anti–exhaustion hypothesis: a new hypothesis to explain song performance and song switching in the great tit // Animal Behaviour. V. 36. P. 327–334.
Marler P., 2004. Bird calls: a cornucopia for communication. In Nature’s Music. The Science of Birdsong. London: Elsevier Academic Press. P. 132–176.
McGregor P. K., 1980. Song dialects in the corn bunting (Emberiza calandra) // Zeitschrift für Tierpsychologie. V. 54. P. 285–297.
Milder S.R., Schreider R.W., 1989. The vocalization of the Christmas Island warbler Acrocephalus aequinoctialis, an island endemic // Ibis. V. 131. P. 99–110.
Numminen J., Salmelin R., Hari R., 1999. Subject’s own speech reduces reactivity of the human auditory cortex // Neuroscience Letters. V. 265. P. 119–122.
Páez V.P., Bock B.C., Rand A.S., 1993. Inhibition of evoked calling of Dendrobates pumilio due to acoustic interference from cicada calling // Biotropica. V. 25. P. 242–245.
Petrusková T., Osiejuk T.S., Linhart P., Petrusek A., 2008. Structure and complexity of perched and flight songs of the tree pipit (Anthus trivialis) // Annals Zoology Fennici. V. 45. P. 135–148.
Podos J., Novicki S., 2004. Performance limits on bird song. In Nature’s Music – The Science of Birdsong. London: Elsevier Academic Press. P. 322–346.
Poesel1 A., Kempenaers B., 2000. When a bird is tired from singing: a study of drift during the dawn chorus // Etología. V. 8. P. 1–7.
Prather J.F., Peters S., Nowicki S., Mooney R., 2008. Precise auditory vocal mirroring in neurons for learned vocal communication // Nature. V. 451 (7176). P. 305–310.
Price J.J., Lanyon S.M., 2002. Reconstructing the evolution of complex bird song in the oropendolas // Evolution. V. 56. P. 1514–1530.
Rios-Chelen A.A., Quiros-Guerrero E., Gil D., Garcia C.M., 2013. Dealing with urban noise: vermilion flycatchers sing longer songs in noisier territories // Behavioral ecology and sociobiology. V. 67. P. 145–152.
Robillard T., Desutter-Grancolas L., 2011. Evolution of calling songs as multicomponent signals in crickets (Orthoptera: Grylloidea: Eneopterinae) // Behaviour. V. 148. P. 627–672.
Samotskaya V.V., Opaev A.S., Ivanitskii V.V., Marova I.M., Kvartalnov P.V., 2016. Syntax of complex bird song in the large–billed reed warbler (Acrocephalus orinus) // Bioacoustics. V. 25. P. 127–143.
Secondi J., Bretagnolle V., Cjmpagnon C., Faivre B., 2003. Species-specific song convergence in a moving hybrid zone between two passerines // Biological Journal of the Linnean Society. V. 80. P. 507–517.
Scott M., 2013. Corollary discharge provides the sensory content of inner speech // Psychological Science. V. 24. P. 1824–1830. https://doi.org/10.1177/0956797613478614
Slabbekoorn H., 2004. Habitat-dependent ambient noise: consistent spectral profiles in two African forest types // Journal of the Acoustical Society of America. V. 116. P. 3727–3733.
Slabbekoorn H., Smith T.B. 2002. Habitat–dependent song divergence in the little greenbul: An analysis of environmental selection pressures on acoustic signals // Evolution. V. 56. P. 1849–1858.
Slater P.J.B., Ince S.A., 1979. Cultural evolution in chaffinch song // Behaviour. V. 71. P. 146–166.
Stafford K.M., Sharon L. Nieukirk S.L., Fox C.G., 2001. Geographic and seasonal variation of blue whale calls in the North Pacific // J. Cetacean Res. Manage. V. 3. P. 65–76.
Tietze D.T., Martens J., Fischer B.S., Sun Y.H., Klussmann-Kolb A., Päckert M., 2015. Evolution of leaf warbler songs (Aves: Phylloscopidae) // Ecology and Evolution. V. 5. P. 781–798.
Vabishchevich A.P., Formozov N.A., 2010. Song variability in pied flycatchers Ficedula hypoleuca: impact of the sympatry with collared flycatchers F. albicollis // Acta Ornithologica. V. 45. P. 189–202.
Weary D.M., Lambrechts M.M., Krebs J.R., 1991. Does singing exhaust male great tits? // Animal Behaviour. V. 41. P. 540–542.
Wilson P., Vehrencamp S., 2001. A test of the deceptive mimicry hypothesis in song-sharing song sparrows // Animal Behaviour. V. 62. P. 1197–1205.
Wollerman L., Wiley R.H., 2002. Background noise from a natural chorus alters female discrimination of male calls in a Neotropical frog // Animal Behaviour. V. 63. P. 15–22.
Zhou Y.L., Qiu X., Fang X.B., Yang L.Y., Zhao Y., Fang T., Zheng W.H., Liu J.S., 2014. Acoustic characteristics of eight common Chinese anurans during the breeding season // Zoological Research. V. 35 (1). P. 42–50.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


