Зоологический журнал, 2022, T. 101, № 7, стр. 772-790
Особенности анатомии миниатюрных короткоусых двукрылых (Diptera, Sphaeroceridae, Ephydridae)
Е. Н. Веко a, *, А. А. Полилов a
a Биологический факультет Московского государственного университета
имени М.В. Ломоносова
119234 Москва, Россия
* E-mail: vekoegor@gmail.com
Поступила в редакцию 27.07.2021
После доработки 05.11.2021
Принята к публикации 06.11.2021
- EDN: EMWOZU
- DOI: 10.31857/S0044513422070133
Аннотация
Миниатюризация может сильно влиять на строение насекомых, и в разных группах обнаружены как общие, так и уникальные особенности. Однако исследований, направленных на изучение анатомии миниатюрных короткоусых двукрылых, ранее не было. В этой работе впервые детально описано внутреннее строение имаго двух миниатюрных короткоусых двукрылых Leptocera sp. (Diptera, Sphaeroceridae) и Hydrellia albilabris (Meigen 1830) (Diptera, Ephydridae), изученное по сериям гистологических срезов с использованием трехмерных компьютерных реконструкций. Несмотря на малый размер изученных миниатюрных двукрылых, все системы органов сохраняют сложный уровень организации, характерный для крупных представителей родственных групп. Даже трахейная система не имеет принципиального упрощения, которое ранее было показано для большинства миниатюрных насекомых. Проведен сравнительный анализ изменения относительных объемов систем органов. Показано, что общие закономерности аллометрии органов, выявленные ранее, справедливы и для миниатюрных двукрылых, однако половая система Leptocera sp. и Hydrellia albilabris занимает значительно меньший относительный объем по сравнению с таковой у миниатюрных насекомых из других отрядов.
Интерес к изучению миниатюризации насекомых появился в конце 40-х годов прошлого века (Rensch, 1948), а на данный момент существует целое направление исследований морфологии и анатомических особенностей у мельчайших членистоногих, в первую очередь насекомых (Polilov, 2016; Dunlop, 2019; Minelli, Fusco, 2019). При этом морфологические особенности двукрылых, связанные с миниатюризацией, изучены только на отдельных представителях длинноусых: Mayetiola destructor (Schneeberg et al., 2013) и Corynoneura scutellata (Веко, Полилов, 2020).
Одними из мельчайших двукрылых являются представители семейств Sphaeroceridae и Ephydridae. Наружное строение описано в таксономических работах, посвященных Sphaeroceridae (Marshall et al., 2011; Rohacek, 2012) и Ephydridae (Кривошеина, 1986, 1989, 2001, 2010; Mathis et al., 2014, 2015; Mathis, Zatwarnicki, 2019), а внутреннее строение представителей этих семейств остается неизученным. Род Leptocera (Diptera, Sphaeroceridae) состоит из мелких двукрылых с общей длиной тела имаго 0.8–2.5 мм (Пантелеева, Гапонов, 2016). Личинки развиваются в различных местах, богатых разлагающейся органикой. К таким субстратам относится опавшая листва, загнивающие плоды фруктов, чаще всего развитие происходит в навозе. Основной тип питания как личинок, так и имаго – сапрофагия. Мухи рода Hydrellia (Diptera, Ephydridae) – это небольшие насекомые с длиной тела от 1 до 10 мм (Deonier, 1971). Развитие протекает в биотопах, которые так или иначе связаны с водой или с местами с высокой влажностью. Личинки являются фитофагами, их развитие происходит внутри листовой пластинки ряски, взрослые особи питаются водорослями, детритом и микроорганизмами (Deonier, 1971).
Цель данной работы – детально изучить внутреннее строение Leptocera sp. и Hydrellia albilabris как миниатюрных представителей короткоусых двукрылых и выделить особенности, связанные с миниатюризацией.
МАТЕРИАЛ И МЕТОДИКА
Имаго Leptocera sp. (Diptera, Sphaeroceridae) и Hydrellia albilabris (Meigen 1830) (Diptera, Ephydridae) были собраны в Московской обл. в окрестностях поселка Володарского в августе–сентябре 2015 г.
Изучение внутреннего строения проведено по методике, описанной ранее (Веко, Полилов, 2020). Скелетные структуры были изучены с помощью сканирующего электронного микроскопа (СЭМ). Для изучения внутреннего строения использовали гистологические методы и трехмерное компьютерное моделирование (3D). В дополнении к методам, использованным ранее, была применена матричная томография. Серии срезов фотографировали на флуоресцентном микроскопе Olympus BX43 с камерой Tucsen TCC-6.1ICE, используя автофлуоресценцию в ультрафиолетовом канале, что позволило выявить трахеи и воздушные мешки. После этого срезы окрашивали толуидиновым синим и пиронином и повторно фотографировали. На основе обеих серий фотографий проводили трехмерную реконструкцию органов. Использованная морфологическая номенклатура описана ранее (Веко, Полилов, 2020).
РЕЗУЛЬТАТЫ
Общий план строения
Длина тела 0.88–0.93 мм (M = 0.90, n = 5) (рис. 1). Топография внутренних органов: бо́льшая часть головной капсулы занята объемными воздушными мешками, а мозг, вплотную примыкая к теменной области, занимает значительную часть оставшегося пространства. В груди находятся мощная мускулатура и крупные воздушные мешки. Практически все пространство в брюшке занято кишечником, образующим петли, а половая система занимает небольшое место в дистальной части брюшка, сердце находится на дорсальной стороне брюшка (рис. 2). Объем тела 43.8 нл.
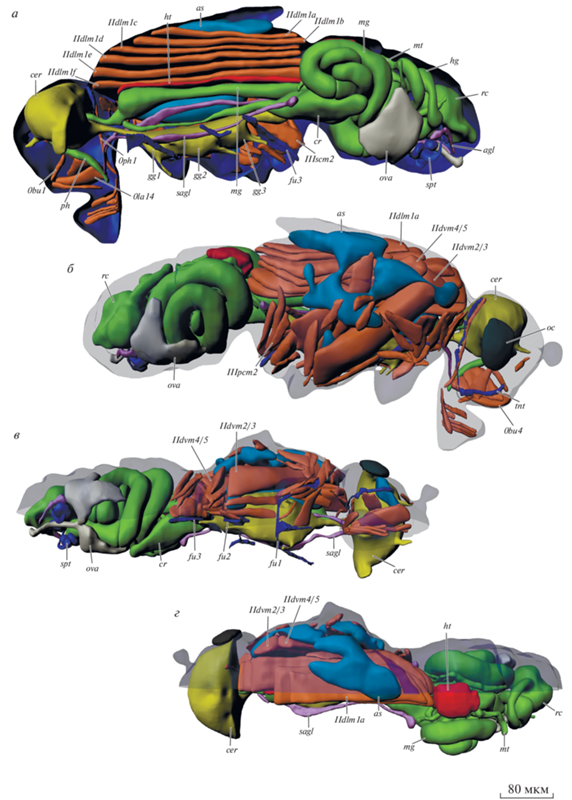
Рис. 2.
Внутреннее строение Leptocera sp., 3D-реконструкция. а – вид сбоку изнутри; б – вид снаружи, покровы полупрозрачные; в – вид снизу; г – вид сверху. agl – придаточные железы; as – воздушные мешки; cer – мозг; cr – зоб; fu1.2.3 – про-, мезо-, метафурка; gg1.2.3 – передне-, средне- и заднегрудной ганглий; hg – задняя кишка; ht – сердце; mg – средняя кишка; mt – мальпигиевы сосуды; ос – глаз; ova – яичник; ph – глотка; rc – прямая кишка; sagl – слюнная железа; spt – сперматека; tnt – тенториум. Обозначения мускулатуры см. в тексте.
Скелет
Головная капсула имеет форму полусферы, дистальная сторона практически ровная. Фронтальный и фронто-клипеальные швы хорошо развиты. Тенториум состоит из дорсальных и передних рук, которые соединены тенториальным мостом. Дорсальные руки намного короче передних и подходят к затылочной части головной капсулы. Передние руки самые длинные. Начинаясь от тенториального моста, они идут вдоль задней части головы, затем приближаются к латеральной части клипеуса.
Переднегрудь – самый маленький сегмент груди. Шея и пронотум с дорсальной стороны прикрыты затылочной областью головы. Однако на гистологических срезах можно проследить, что шея имеет две пары цервикальных склеритов. Первая пара небольшая и имеет форму треугольника, она соединяется со второй парой цервикальных склеритов, изогнутых в виде серпа. Переднеспинка (пронотум) представляет собой узкую полоску; огибая с боковых сторон грудь, она переходит в плейриты. Проплевральный гребень разделяет первый сегмент груди на проэпистернит и проэпимерит. Вдаваясь внутрь груди, гребень формирует проплевральные апофизы, которые служат местом прикрепления некоторых мышц. Проэпистернит простирается в виде очень узкой полосы до вентральной стороны груди, где он прерывается четким срединным гребнем. Впячиваясь внутрь, он образует профурку. Она состоит из одной короткой центральной руки и двух более длинных латеральных рук.
Среднегрудь – самый крупный сегмент груди. Среднеспинка разделена на прескутум, скутум, скутеллюм и постнотум. По латеральным сторонам прескутума формируются плечевые бугры в виде небольших вздутий. Эти бугры отделены от скутума коротким швом. Скутум и треугольный скутеллюм разделены скуто-скутеллярным швом. Постнотум выглядит как изогнутая поперечная полоса под задним краем скутеллюма, а сбоку образует пару больших выпуклостей. Тергит и плейрит среднегруди разделяются перпендикулярным нотоплевральным швом. В состав плейрита входит крупный мезоанэпистернит и ромбовидный мезоанэпимерит, вдоль которых проходит мезоплевральный гребень. От основания мезафурки отходят две тонкие руки, затем каждая из них образует V-образное разветвление.
Заднеспинка (метанотум) представлена узкой полоской. В состав плейрита входит метаэпистернит и метаэпимерит, которые разделяются коротким метаплевральным гребнем. Метаэпистернит расширяется в вентральном направлении и сочленяется с коксой. Небольшой метаэпимерит в фрме треугольника. Метафурка хороша развита. Она имеет массивный крупный ствол и короткие руки.
В состав брюшка самца входит 7 видимых сегментов. Тергиты и стерниты четко дифференцированы и хорошо склеротизированы, а мембранозные плейриты не имеют четких границ. Постабдомен состоит из гипандрия и эпандрия, к которому причленяются подвижные придатки – сурстили. Брюшко самок состоит из 8 сегментов. Последний генитальный сегмент несет одну пару церков и гипопрокт.
Толщина кутикулы от 1.14 до 4.14 мкм (М = = 2.05, n = 80). Объем скелета 1.91 нл, что составляет 4.35% от объема тела.
Пищеварительная и выделительная системы
Общая форма кишечника. Передняя кишка располагается в головной капсуле и имеет изогнутую форму. Часть средней кишки в груди имеет вид прямой трубки, а в брюшке закручивается в многочисленные петли. Задняя кишка почти прямая, дифференцируется на тонкую и прямую кишку (рис. 3а, 3б).
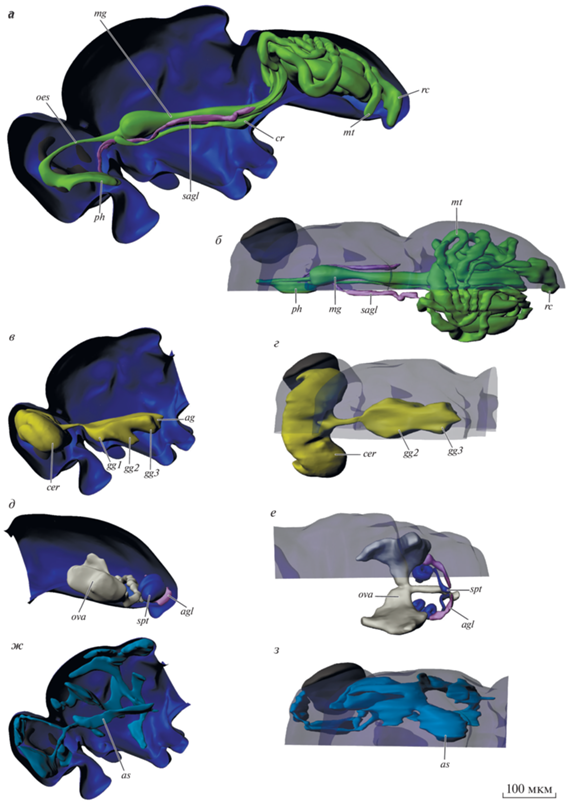
Рис. 3.
Строение пищеварительной и выделительной (а, б), ЦНС (в, г), половой (д, е), дыхательной систем (ж, з) Leptocera sp., 3D-реконструкция. ag – брюшной ганглий; agl – придаточные железы; as – воздушные мешки; cer – мозг; cr – зоб; gg1.2.3 – передне-, средне- и заднегрудной ганглий; hg – задняя кишка; mg – средняя кишка; mt – мальпигиевы сосуды; оes – пищевод; ova – яичник; ph – глотка; rc – прямая кишка; sagl – слюнная железа; soeg – подглоточный ганглий; spt – сперматека.

Передняя кишка. Ротовое отверстие находится на дистальном конце рострума. Затем оно переходит в глотку. Она имеет U-образную форму в поперечном сечении и идет в диагональном направлении ко лбу. В лобной части головной капсулы глотка изгибается и продолжается прямым пищеводом. Затем пищевод переходит в кардиальное расширение.
Зоб представляет собой слепое выпячивание, которое располагается вне морфологической оси кишечника. Он берет начало на границе пищевода и кардиального расширения, далее проходит тонким длинным протоком через большую часть груди, а на последней трети своей длины имеет мешковидную форму и своим концом заходит в брюшко.
Средняя кишка – это самая большая часть пищеварительного тракта. Морфологически ее можно разделить на три отдела. Первый отдел, находящийся в груди, имеет вид прямой трубки с однослойным эпителием из клеток неправильной формы. Второй отдел, располагающийся в первом сегменте брюшка, имеет в своем эпителии бокаловидные клетки. Стенка последнего отдела, находящегося во втором и третьем сегменте, толще двух предыдущих, эпителий представлен очень крупными клетками.
Задняя кишка состоит из короткой тонкой кишки и грушевидной формы прямой кишки, заканчивающейся анальным отверстием на последнем сегменте брюшка.
На границе средней и задней кишки берут начало четыре мальпигиевых сосуда. Они округлые в поперечном сечении и имеют однослойный эпителий. Мальпигиевы сосуды лежат в промежутках между петлями средней кишки.
Слюнные железы представляют собой две тонкие, неразветвленные прямые трубки с однослойным эпителием. Они заканчиваются на границе груди и брюшка, где каждая из них образует небольшое утолщение. В передней части груди они резко сужаются, образуя тонкие слюнные каналы, которые соединяются в области шеи в единый непарный проток. Непарный проток простирается к основанию хоботка и открывается в глотку.
Объем пищеварительной системы 4.91 нл (11.20% от объема тела), а мальпигиевых сосудов – 0.15 нл (0.34% от объема тела).
Ткани внутренней среды
Кровеносная система состоит из сердца и длинной аорты. Сердце округлой формы, лежит в I и II сегменте брюшка. Аорта начинается от сердца и продолжается в виде тонкой округлой трубки до основания головы.
Основная масса жирового тела залегает в брюшке между органами, в промежутках среди петель кишечника. Меньшее количество клеток располагается в груди, а в голове представлено единичными клетками.
Объем тканей внутренней среды 22.62 нл (51.61% от объема тела).
Трахейная система
Дыхательная система хорошо развита, представлена сетью стволов и ветвящихся трахей, а также системой воздушных мешков (рис. 3ж, 3з). Среднегрудные дыхальца располагаются в верхней части латеральной стороны мезанэпистернита, а заднегрудные дыхальца – дистальнее жужжалец. Каждое дыхальце по периферии окружено рядом микротрихий, которые защищают от попадания мелких частиц в трахею. На брюшке дыхальца располагаются на латеральных краях всех тергитов.
Система воздушных мешков состоит из четырех пар воздушных мешков, связанных друг с другом крупными стволами. Пара головных воздушных мешков занимает около трети головной капсулы (рис. 5). Они располагаются под мозгом и имеют конусовидную форму, с постепенно расширяющимся основанием к задней части головной капсулы. Оба воздушных мешка связаны друг с другом дугообразным стволом, который отходит от края левого и правого мешка. Второй крупный ствол головной капсулы идет к ротовому аппарату. Третий ствол связывает головной воздушный мешок с системой воздушных мешков грудного отдела. Имеется две пары грудных и шесть пар брюшных дыхалец.
Рис. 4.
Строение мускулатуры Leptocera sp., 3D-реконструкция. а - вид головы сбоку, б – вид фронтально, покровы полупрозрачные; в – вид груди сбоку; г – вид снаружи, покровы полупрозрачные; д – вид сверху; е – вид снизу. fu1.2.3 – про-, мезо-, метафурка; oes – пищевод; ph – глотка; tnt – тенториум. Обозначения мускулатуры см. в тексте.

Рис. 5.
Внутреннее строение Leptocera sp., гистология и автофлуоресценция. а – схема срезов, б–ж – поперечные срезы на разных уровнях. ag – брюшной ганглий; as – воздушные мешки; cer – мозг; cr – зоб; fu2.3 – мезо-, метафурка; gg1.2 – передне-, среднегрудной ганглий; lbp – нижнегубной щупик; mg – средняя кишка; mt – мальпигиевы сосуды; ос – глаз; oes – пищевод; ova – яичник; ph – глотка; ptr – псевдотрахеи; sagl – слюнная железа. Обозначения мускулатуры см. в тексте.

От второй пары дыхалец отходит небольшая ветвь, дающая начало самой большой и сложно устроенной паре грудных воздушных мешков. Воздушный мешок заходит своими частями в каждый сегмент груди: на дорсальной стороне воздушный мешок тянется вдоль скутеллюма и скутума, затем переходит на латеральную сторону груди и заканчивается в переднегруди булавовидным расширением. Этот воздушный мешок является местом отхождения трахейных стволов, идущих в дорсальные продольные мышцы, в крыловую мускулатуру и коксы вторых пар ног.
Третья пара грудных воздушных мешков имеет двояковыпуклую форму, одна часть находится непосредственно в коксе, а другая выходит в полость груди. От коксальной части воздушного мешка отходят крупные стволы, направляющиеся в коксы третьих пар ног, а также в грудной ганглий.
Четвертая пара воздушных мешков находится вдоль груди, мешки располагаются параллельно друг другу. От проксимальной части отходят два крупных ствола, один из которых направляется в коксу первой пары ног, а второй идет прямо вдоль груди и сливается с коксальной частью второй пары воздушных мешков.
В брюшке дыхательная система представлена единичными неветвящимися трахеями, крупные стволы отсутствуют.
Объем воздушных мешков 2.63 нл (6.01% от объема тела).
Нервная система
Центральная нервная система демонстрирует незначительную степень олигомеризации (рис. 3в, 3г). Мозг вместе с подглоточным ганглием компактно располагаются в головной капсуле. Два антеннальных нерва связывают антенны с дейтоцеребрумом. Оптические доли большие и составляют около трети объема мозга.
Между грудными ганглиями нет четких границ, с латеральной и дорсальной сторон они имеют вид единого ганглионарного комплекса без видимых морфологических границ. Однако каждый ганглий можно идентифицировать по компартментам нейропиля и по нервам, которые отходят от вентральной стороны ганглия и продолжаются до кокс. Так, в первом грудном сегменте располагается переднегрудной ганглий с парой вентральных нервов, во втором грудном сегменте находится среднегрудной ганглий, а также в среднегрудь смещается заднегрудной ганглий. В заднегруди находится синганглий, образованный всеми брюшными ганглиями.
Объем нервной системы 2.65 нл (6.04% от объема тела).
Мышечная система
Исследованы две функциональные группы мышц по способу их прикрепления к скелету насекомого: мышцы, отходящие от неподвижной аподемальной поверхности, к подвижной структуре скелета, и мышцы, соединяющие две подвижные скелетные структуры (Стекольников, 2008). При описании мышц использованы сокращения: O – origin – место отхождения мышцы, I – insertion – место прикрепления мышцы.
Мускулатура головы (рис. 4а, 4б)
0an2 (M. tentorioscapalis posterior): O, передние руки тенториума; I, задний край скапуса. 0bu1 (M. clypeobuccalis): О, центральная часть клипеуса; I, вентральная стенка глотки. 0bu4 (M. tentoriobuccalis lateralis): О, основание рук тенториума; I, основание глотки. 0ci1 (M. clypeopalatalis): О, дорсальная сторона клипеуса; I, крыша цибариума. 0la14 (M. praementopalpalis externus): О, базальная часть прементума; I, основание щупика нижней губы. 0ph1 (M. verticopharyngalis): O, затылочная область головы; I, дорсальная стенка глотки. 0ph2 (M. tentorio-pharyngealis): О, задние руки тенториума; I, вентральная сторона глотки.
Мускулатура груди (рис. 4в–4е)
Переднегрудь. Idvm2 (M. cervico-occipitalis medialis): O, медиальная часть шейного склерита; I, дорсолатеральная часть затылка. Idvm3 (M. cervico-occipitalis posterior): O, латеральная часть шейного склерита; I, медиальная часть затылка. Idvm4/6 (M. pronoto-cervicalis lateralis или M. pronotocervicalis medialis): O, пронотум; между Idvm15 и Idvm19; I – передняя часть первого шейного склерита. Idvm7 (M. pronoto-cervicalis posterior): O, медиальный край пронотума; I, дорсальная часть второго шейного склерита. Idvm15 (M. pronoto-trochantinocoxalis): O, передняя часть пронотума; I, передний край коксы, рядом с Ipcm5. Idvm19 (M. pronoto-trochanteralis): O, пронотум, область плечевых бугров; I, передний край вертлуга. Idlm1 (M. prophragma-occipitalis): O, терминальная часть срединной руки профурки; I, задняя часть затылка. Idlm2 (M. pronoto-occipitalis): O, задняя часть пронотума; I, дорсальная часть затылка. Ivlm1 (M. profurca-cervicalis): O, вентральная часть профурки; I, медиальный край шейного склерита. Ivlm3 (M. profurca-tentorialis): O, дорсальная часть профурки; I, задняя часть затылка. Ivlm7 (M. profurca-mesofurcalis): O, дорсальная часть профурки; I, медиальная часть мезофурки. Iscm1 (M. profurca-coxalis anterior): O, латеральная часть срединной руки профурки; I, передний край коксы. Iscm4 (M. profurca-coxalis lateralis): O, вентральная сторона рук профурки; I, латеральный край коксы. Iscm6 (M. profurca-trochanteralis): O, дорсальная сторона рук профурки; I, задний край вертлуга. Ipcm1 (M. procoxa-cervicalis): О, передний край коксы; I, дорсальная часть шейного склерита. Ipcm5 (M. propleuro-coxalis inferior): O, вентральная часть нотоплеврального гребня; I, передний край коксы.
Среднегрудь. IIdvm2/3 (M. mesonoto-trochantinalis anterior/posterior): O, латеральная сторона прескутума; I, базальный край проэпистернита. IIdvm4/5 (M. mesonoto-coxalis anterior/posterior): O, мезоскутум, между IIdlm2 и IIdvm2/IIdvm3; I, мезокатэпимер. IIdvm7 (M. mesonoto-trochanteralis): O, центральная часть мезоскутума; I, передний край вертлуга. IIdlm1 (M. prophragma-mesophragmalis): O, a-b: передняя часть мезоскутума; c-f: срединная часть прескутума; I, a–f: задняя часть постнотума. IIdlm2 (M. mesonoto-phragmalis): O, латеральная часть мезоскутума; I, латеральная часть метаэпимерита. IIvlm3 (M. mesofurca-metafurcalis): O, срединная часть мезофурки; I, метафурка, дорсальная часть коротких рук фурки. IIscm1 (M. mesofurca-coxalis anterior): O, латеральная часть мезофурки; I, медиальный край коксы. IIscm2 (M. mesofurca-coxalis posterior): O, вентральная часть мезофурки; I, задний край коксы. IIscm4 (M. mesofurca-coxalis lateralis): O, задняя поверхность мезофурки; I, вентральная сторона основания мезоплеврального гребня. IIscm6 (M. mesofurca-trochanteralis): O, вентральная сторона рук мезофурки; I, передний край вертлуга. IIspm1 (M. mesopleura-sternalis): O, латеральная сторона мезанэпистернита; I, основание базаляре. IIspm2 (M. mesofurca-pleuralis): O, латеральная часть мезофурки; I, латеральная сторона мезоплеврального гребня. IIpcm6 (M. mesanepisterno-coxalis posterior): O, передняя часть мезоплеврального гребня; I, вентральный ободок коксы. IItpm1 (M. prophragma-mesanepisternalis): О, нотоплевральный гребень; дистальная часть базаляре. IItpm3 (M. mesonoto-basalaris): O, латеральная сторона мезоанэпистернита; I, задняя часть мезоплеврального гребня. IItpm4 (M. mesonoto-pleuralis anterior): O, основание мезоплеврального гребня; I, первая аксиллярная пластинка. IItpm5 (M. mesonoto-pleuralis medialis): O, дорсальная часть мезоплеврального гребня; I, первая аксиллярная пластинка. IItpm6 (M. mesonoto-pleuralis posterior): O, мезоплевральная апофиза; I, четвертая аксиллярная пластинка. IItpm7 (M. mesanepisterno-axillaris): O, задняя часть анаплеврального гребня; I, третья аксиллярная пластинка. IItpm9 (M. mesepimero-axillaris tertius): O, задняя часть мезоплеврального гребня; I, третья аксиллярная пластинка.
Заднегрудь. IIIdvm7 (M. metanoto-trochanteralis): O, латеральная часть постфрагмы; I, передний край вертлуга. IIItpm4 (M. metanoto-pleuralis anterior): O, дорсальная часть метаплевральной апофизы; I, основание жужжалец. IIIspm1 (M. metapleura-sternalis): O, медиальная часть метафурки; I, основание жужжалец. IIIspm2 (M. metafurca-pleuralis): O, метафурка, дорсальная часть рук фурки; I, метаплевральная апофиза. IIIpcm2 (M. metabasalare-trochantinalis): O, дорсальная часть метэпистернита; I, дорсальный ободок коксы. IIIpcm4 (M. metanepisterno-coxalis posterior): O, передняя часть метаплеврального гребня; I, передний край коксы. IIIpcm6 (M. metapleura-trochanteralis): O, задняя часть метаплеврального гребня; I, задний край вертлуга. IIIvlm2 (M. metafurca-abdominosternalis): O, метафурка, дорсальная часть рук фурки; I, первый сегмент брюшка. IIIscm1 (M. metafurca-coxalis anterior): O, срединная часть метаэпимерита; I, передний край коксы. IIIscm2 (M. metafurca-coxalis posterior): O, проксимальная часть метафурки; I, задний край коксы. IIIscm6 (M. metafurca-coxalis medialis): O, вентральная часть метафурки; I, вентральный ободок коксы.
Мускулатура брюшка
Дорсальные продольные мышцы (Mm. dorsales), O, передняя фрагма; I, задняя фрагма. Вентральные продольные мышцы (Mm. ventrales), O, передний край сегмента; I, задний край сегмента. Дорсовентральные мышцы (Mm. dorsoventrales), O, боковая часть тергита; I, боковая часть стернита.
Объем мускулатуры 8.31 нл (18.96% от объема тела).
Половая система
Половая система самки представлена парными яичниками, двумя придаточными железами и тремя сперматеками (рис. 3д, 3е). От каждого яичника, состоящего из восьми овариол, отходят небольшие латеральный яйцеводы, которые сливаются в единый центральный яйцевод. Три хорошо склеротизованные сперматеки имеют двояковогнутую форму, причем сразу две из них открываются в единый проток, впадающий в центральный яйцевод, а третья сперматека имеет самостоятельный проток. Пара придаточных желез также открывается в центральный яйцевод. Каждая железа имеет продольную вытянутую форму с небольшим пузыревидным расширением на дистальном конце, в котором находятся секретирующие клетки.
Объем половой системы 0.65 нл (1.48% от объема тела).
АНАТОМИЯ HYDRELLIA ALBILABRIS
Строение во многом сходно с Leptocera sp., поэтому ниже будут приведены только различия в анатомии.
Общий план строения
Длина тела 1.12–1.23 мм (M = 1.19, n = 5) (рис. 6, 9). Объем тела 159.1 нл.
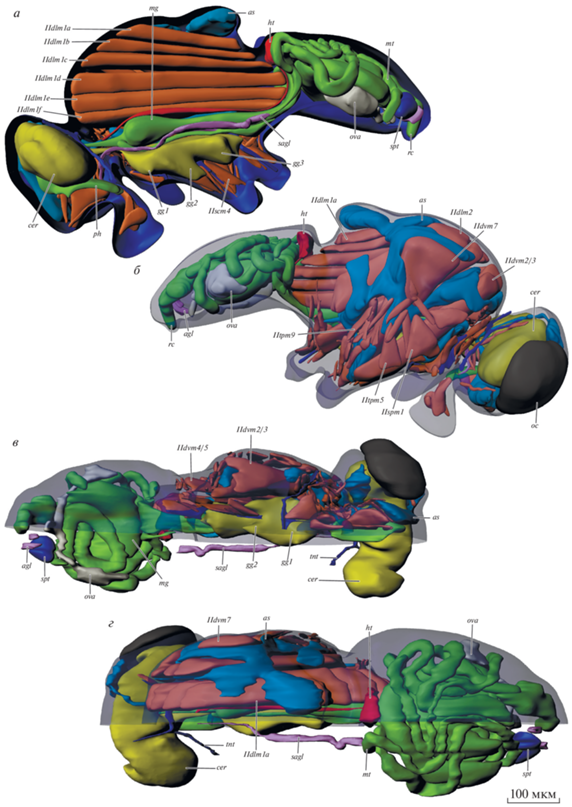
Рис. 6.
Внутреннее строение Hydrellia albilabris, 3D-реконструкция. а – вид сбоку изнутри, б – вид снаружи, покровы полупрозрачные, в – вид снизу, г – вид сверху. agl – придаточные железы; as – воздушные мешки; cer – мозг; gg1.2.3 – передне-, средне- и заднегрудной ганглий; ht – сердце; mg – средняя кишка; mt – мальпигиевы сосуды; ос – глаз; ova – яичник; ph – глотка; rc – прямая кишка; sagl – слюнная железа; soeg – подглоточный ганглий; spt – сперматека; tnt – тенториум. Обозначения мускулатуры см. в тексте.
Скелет
Брюшко самцов состоит из шести сегментов.
Толщина кутикулы от 2.01 до 4.28 мкм (М = = 3.40, n = 80). Объем скелета 7.13 нл, что составляет 4.48% от объема тела.
Пищеварительная и выделительная системы
У H. albilabris два мальпигиевых сосуда (рис. 7а–7б).
Рис. 7.
Строение пищеварительной и выделительной (а, б), ЦНС (в, г), половой (д, е), дыхательной систем (ж, з) Hydrellia albilabris, 3D-реконструкция. ag – брюшной ганглий; agl – придаточные железы; as – воздушные мешки; cer – мозг; cr – зоб; gg1.2.3 – передне-, средне- и заднегрудной ганглий; mg – средняя кишка; mt – мальпигиевы сосуды; оes – пищевод; ova – яичник; ph – глотка; rc – прямая кишка; sagl – слюнная железа; spt – сперматека.
Объем пищеварительной системы 11.31 нл (7.11% от объема тела), а мальпигиевых сосудов – 2.63 нл (1.65% от объема тела).
Трахейная система
Вдоль среднего кишечника проходит воздушный мешок, который в проксимальной части разделяется на две части (рис. 7ж, 7з). Одна из них спускается перпендикулярно вниз на вентральную сторону груди, а вторая идет к ее дорсальной стороне, располагаясь под скутумом и скутеллюмом.
Объем воздушных мешков 4.3 нл (9.81% от объема тела).
Нервная система
В сравнении с Leptocera sp., мозг H. albilabris имеет более вытянутую форму в поперечном направлении и напоминает по форме мозг крупных двукрылых (рис. 7в, 7г). У H. albilabris также значительно лучше развиты оптические доли в сопоставлении с Leptocera sp. У H. albilabris происходит слияние третьего грудного ганглия с брюшным синганглием.
Объем нервной системы 10.06 нл (5.17% от объема тела).
Мускулатура головы (рис. 8а, 8б)
Рис. 8.
Строение мускулатуры Hydrellia albilabris, 3D-реконструкция. а – вид головы сбоку, б – вид фронтально, покровы полупрозрачные, в – вид груди сбоку, г – вид снаружи, покровы полупрозрачные, д – вид сверху, е – вид снизу. fu1.2.3 – про-, мезо-, метафурка; ph – глотка; tnt – тенториум. Обозначения мускулатуры см. в тексте.

Рис. 9.
Внутреннее строение Hydrellia albilabris, гистология. а – схема срезов, б–г – продольные срезы на разных уровнях. ant – антенна; as – воздушные мешки; cer – мозг; fb – жировое тело; fu1.3 – про-, метафурка; gg1 – переднегрудной ганглий; mg – средняя кишка; mt – мальпигиевы сосуды; ос – глаз; ova – яичник; ph – глотка; rc – прямая кишка; sagl – слюнная железа. Обозначения мускулатуры см. в тексте.

Набор мускулатуры в головной капсуле у H. albilabris отличается от Leptocera sp. отсутствием двух мышц 0la14 (M. praementopalpalis externus), 0ph2 (M. tentoriopharyngealis).
Мускулатура груди (рис. 8в–8е)
Переднегрудь. В отличие от Leptocera sp., у H. albilabris отсутствует одна мышца – Ivlm7 (M. profurca-mesofurcalis), а присутствуют Idlm2 (M. pronoto-occipitalis), Idvm5 (M. pronoto-cervicalis anterior), Idvm18 (M. pronoto-coxalis lateralis), Ipcm4 (M. propleuro-coxalis superior), Iscm2 (M. profurca-coxalis posterior) и Iscm3 (M. profurca-coxalis medialis).
Среднегрудь. В сравнении с Leptocera sp. у H. albilabris присутствует IItpm2 (M. mesopleura-praealaris).
Заднегрудь. В отличие от Leptocera sp., у H. albilabris присутствует IIIscm3 (M. metafurca-coxalis medialis).
Объем мускулатуры 29.82 нл (18.74% от объема тела).
Половая система
Различие наблюдается лишь в количестве сперматек. У H. albilabris в яйцевод открывается единственная сперматека (рис. 7д, 7е).
Объем половой системы 1.15 нл (0.72% от объема тела).
ОБСУЖДЕНИЕ
Скелет
Тенториум Leptocera sp. и H. albilabris сохраняет сложное строение, характерное как для крупных представителей родственных групп двукрылых (Matsuda, 1965), так и для миниатюрных (Веко, Полилов, 2020). Эндоскелет груди Leptocera sp. и H. albilabris хорошо развит и представлен разветвленными фурками. Сходное строение про-, мезо- и метафурки описано и для более крупных двукрылых – Drosophilidae, Tabanidae, Muscidae, Tipulidae (Matsuda, 1970; Fabian et al., 2016). Внутренний скелет С. scutellata устроен сходным образом с Leptocera sp. и H. albilabris.
Пищеварительная система
Кишечник Leptocera sp. и H. albilabris устроен сходным образом. Относительный объем кишечника Leptocera sp. на 4% превосходит таковой H. albilabris.
Пищеварительная система крупных представителей родственных групп двукрылых имеет такое же строение, как и Leptocera sp. и H. albilabris (Alkassis, Schoeller, 1984; Pacheco et al., 2014).
У миниатюрных длинноусых двукрылых кишечник имеет вид прямой трубки и не образует сложных петель. Отсутствуют слюнные железы и зоб (Веко, Полилов, 2020). Такое простое устройство пищеварительной системы накладывает отпечаток и на ее объем. Кишечник C. scutellata в 4 раза меньше, чем у Leptocera sp. и в 6 раз меньше объема H. albilabris, в связи с тем, что оба рода короткоусых двукрылых являются активно питающимися сапрофагами, а это требует более развитой пищеварительной системы.
Пищеварительная система ранее изученных микронасекомых сходна по общему плану строения с Leptocera sp. и H. albilabris. Однако средняя кишка миниатюрных двукрылых имеет большее количество петель, в то время как у Liposcelidae (Полилов, 2016б), Thripidae (Polilov, Shmakov, 2016), Ptiliidae (Полилов, 2008) cредняя кишка образует одну небольшую петлю, располагающуюся в заднегруди или в брюшке. У Anaphes flavipes (Hymenoptera, Mymaridae) кишечник вовсе не образует петель, а имеет вид прямой трубки с небольшими изгибами в районе шеи и на границе груди и брюшка (Полилов, 2016). Сходство Leptocera sp. и H. albilabris с другими микронасекомыми проявляется в наличии слюнных желез. Они развиты у представителей Liposcelidae (Полилов, 2016б), Thripidae (Polilov, Shmakov, 2016), Ptiliidae (Полилов, 2008), но отсутствуют у Corylophidae (Polilov, 2016) и Trichogrammatidae (Полилов, 2016а).
У жесткокрылых при уменьшении размеров тела относительный объем пищеварительной системы снижается, а у перепончатокрылых того же размерного класса пищеварительная система меняется изометрически (Polilov, Makarova, 2017). Приблизительно равный объем кишечника имеют изученные миниатюрные двукрылые и жесткокрылые такого же размерного класса, однако этот показатель намного меньше, чем у Paraneoptera и больше, чем у перепончатокрылых (Polilov, Makarova, 2017).
У Leptocera sp. 4 мальпигиевых сосуда, а у H. albilabris – 2. Однако относительный объем мальпигиевых сосудов у Leptocera sp. в 5 раз меньше, чем у H. albilabris.
Количество мальпигиевых сосудов, наблюдаемое у Leptocera sp. и H. albilabris, также является типичным для большинства крупных представителей родственных групп двукрылых (Sohal, 1974; O’Donnell, Maddrell, 1995).
Выделительная система С. scutellata имеет сходное строение с Leptocera sp. и H. albilabris. На границе средней и задней кишки у С. scutellata располагается 4 мальпигиевых сосуда. Относительные объемы выделительной системы у миниатюрных короткоусых и длинноусых двукрылых между собой различаются несильно (Веко, Полилов, 2020).
Выделительная система всех изученных миниатюрных двукрылых сходна по строению и по набору мальпигиевых сосудов с ранее изученными миниатюрными насекомыми разных отрядов. У Liposcelidae (Полилов, 2016б), Thripidae (Polilov, Shmakov, 2016), Ptiliidae (Полилов, 2008), Corylophidae (Polilov, 2016) имеется 4 мальпигиевых сосуда, а у представителей Mymaridae (Полилов, 2016) и Trichogrammatidae (Полилов, 2016а) – 3.
Относительный объем выделительной системы H. albilabris превосходит аналогичный показатель у всех перепончатокрылых, Paraneoptera и большинства изученных жесткокрылых того же размерного класса, но относительный объем выделительной системы Leptocera sp. меньше, чем у Paraneoptera, но приблизительно равен таковому у Coleoptera и Hymenoptera (Polilov, Makarova, 2017).
Кровеносная система
У Leptocera sp. и H. albilabris кровеносная система устроена сходно и разительных различий не имеет.
Строение кровеносной системы крупных короткоусых двукрылых, представителей семейства Calliphoridae, слабо отличается от Leptocera sp. и H. albilabris (Wasserthal, 1999).
Стоит отметить, что сердце C. scutellata имеет вытянутую продольную форму и продолжается практически до конца брюшка, в то время как сердце Leptocera sp. и H. albilabris имеет округлую форму и намного короче (Веко, Полилов, 2020).
Вопреки миниатюризации, кровеносная система двукрылых сохраняет высокий уровень организации, при этом у микронасекомых из других отрядов выявлены редукции. У жесткокрылых Ptiliidae (Полилов, 2008) и Corylophidae (Polilov, 2016), у наездников Mymaridae (Полилов, 2016) и Trichogrammatidae (Полилов, 2016а) сердце и аорта вовсе отсутствуют, а функцию гемолимфы во многом выполняет жировое тело.
При уменьшении размеров тела относительный объем кровеносной системы и жирового тела уменьшается у жесткокрылых и увеличивается у перепончатокрылых и Paraneoptera того же размерного класса (Polilov, Makarova, 2017). Стоит отметить, что изученные в этой работе миниатюрные двукрылые обладают рекордным значением по этому показателю и превосходят все ранее изученные таксоны микронасекомых.
Дыхательная система
Во всех тагмах тела, включая брюшко, воздушные мешки имеются у Lucilia sp. и Calliphora sp. (Wasserthal, 1999). Таким образом, наблюдается принципиальные различия в строении миниатюрных и крупных двукрылых.
В отличие от Leptocera sp. и H. albilabris, дыхательная система C. scutellata представлена только крупными стволами и отходящими от них ветвящимися трахеями (Веко, Полилов, 2020). Воздушные мешки отсутствуют.
Сложная сеть трахей, воздушных мешков, а также соединяющих их крупных трахейных стволов впервые наблюдается у микронасекомых. У Liposcelidae во всех тагмах имеется система трахей, берущая начало от двух продольных трахейных стволов (Полилов, 2016б). Воздушные мешки отсутствуют. Дыхательная система Thripidae представлена только парой продольных стволов, от которых отходят слабо ветвящиеся трахеи (Polilov, Shmakov, 2016). Воздушные мешки отсутствуют. Трахейная система Ptiliidae обладает признаками сильного упрощения. Имеется лишь небольшое количество слабо ветвящихся трахей, связанных с дыхальцами (Полилов, 2008). Продольные и поперечные стволы и воздушные мешки отсутствуют. Миниатюрные жесткокрылые из семейства Corylophidae обладают сходной организацией дыхательной системы, однако у них в груди присутствуют продольные трахейные стволы, дающие начало слабо ветвящимся трахеям (Polilov, 2016). У Mymaridae и Trichogrammatidae в груди присутствуют лишь несколько слабо ветвящихся трахей, связанных с средне- и заднегрудными дыхальцами (Полилов, 2016а; Polilov, 2016). Трахейные стволы и воздушные мешки отсутствуют.
Нервная система
Нервная система Leptocera sp. и H. albilabris имеет среднюю степень олигомеризации ганглиев. У обоих видов происходит смещение заднегрудного ганглия во второй сегмент груди, а в заднегруди располагается брюшной синганглий, представленный целиком слитыми брюшными ганглиями. Относительные объемы нервной системы Leptocera sp. и H. albilabris слабо различаются между собой, Leptocera sp. по этому показателю менее чем на 1% превосходит H. albilabris.
Строение головного мозга детально изучено у Drosophila melanogaster (Rein et al., 2002) и Musca sp. (Strausfeld, 1976). Морфология мозга у Leptocera sp. и H. albilabris сходна с таковой у крупных представителей двукрылых. Брюшная нервная цепочка Leptocera sp. и H. albilabris также сохраняет общий план строения, характерный для представителей Dolichopodidae, Phoridae, Drosophilidae, Calliphoridae, Muscidae, Sarcophagidae, Tachinidae (Yeates et al., 2002).
У C. scutellata каждый грудной ганглий располагается в собственном грудном сегменте, брюшные ганглии не сливаются друг с другом и четко дифференцированы (Веко, Полилов, 2020). Значения относительных объемов нервной системы различаются незначительно. У C. scutellata этот показатель на 2 и 3% больше, чем у Leptocera sp. и H. albilabris соответственно.
Для всех микронасекомых характерны значительная олигомеризация и концентрация нервных ганглиев. Самая сильная степень олигомеризации характерна для имаго жесткокрылых, а наименьшая – для взрослых трипсов. Мозг Sericoderus lateralis вместе с подглоточным ганглием целиком смещаются в грудь, у Ptiliidae брюшной ганглий сливается с заднегрудным и смещается в грудь (Полилов, 2008; Polilov, 2016). Имаго жуков из трибы Nanosellini обладает непарным протоцеребрумом, также асимманетричен мозг личинок некоторых миниатюрных жесткокрылых, брюшной ганглий перепончатокрылых Mymaridae может смещаться на одну из сторон брюшка (Полилов, 2008; Polilov, 2016).
В изученных таксонах микронасекомых относительный объем ЦНС увеличивается при уменьшении размеров тела. Значения относительных объемов ЦНС микродвукрылых превосходят микрожесткокрылых того же размерного класса, но уступают перепончатокрылым, которые имеют самый большой относительный объем ЦНС (Polilov, Makarova, 2017). Похожая тенденция наблюдается и в объеме мозга. Относительный объем мозга приблизительно одинаков у двух изученных двукрылых, но Musca sp. обладает значительно меньшим относительным объемом мозга по сравнению с ними (Strausfeld, 1976). Миниатюрные Hymenoptera обладают самым большим относительным объемом мозга среди всех изученных микронасекомых (Polilov, Makarova, 2017).
Мускулатура
Все функциональные группы мышц представлены в головной капсуле Leptocera sp. и H. albilabris. Имеется мышца, движущая лабиальный щупик; cохраняется длинная глоточная мышца – 0ph1; глоткой движут несколько крупных мышц. За движение хоботка отвечают четыре мышцы – 0la5, 0la8, 0la16 и 0mx2 (Schneeberg et al., 2013). Основной отличительной чертой миниатюрных короткоусых двукрылых от крупных представителей родственных групп является уменьшение количества мышц, участвующих в движении антенны. К антеннам изученных микродвукрылых подходят лишь две мышцы – 0an1 и 0an2.
Переднегрудь Leptocera sp. и H. albilabris мало отличается по набору мускулатуры от аналогичной структуры крупных представителей родственных групп. В переднегруди Leptocera sp. расположено 17 мышц, а у H. albilabris в этом сегменте груди – 21 мышца. Различия наблюдаются в отсутствии небольших мышц, связанных с движением шеи. Таким образом, у микродвукрылых в первом грудном сегменте сохраняются все основные группы мышц. Во втором сегменте груди небольшие различия наблюдаются в количестве крыловых мышц прямого действия. У Leptocera sp. сохраняется лишь шесть из них, а у H. albilabris – семь мышц. Мускулатура заднегруди изученных миниатюрных двукрылых также слабо различается. В составе заднего грудного сегмента имеются все мышцы, участвующие в движении конечностей, а также крупные дорсо-вентральные мышцы.
Таким образом, два изученных микродвукрылых по количественному набору мускулатуры слабо различаются между собой, поскольку у Leptocera sp. во всей груди находится 50 мышц, у H. albilabris – 55 мышц. Мало различаются и относительные объемы мускулатуры Leptocera sp. и H. albilabris, эти значения практически равны.
В груди кровососущей мухи Crataerina pallida располагается 35 мышц (Liu et al., 2018). У C. pallida способность к полету минимальна, в связи с этим отсутствуют крыловые мышцы прямого и непрямого действия, которые присутствуют у большинства двукрылых, в том числе у Leptocera sp. и H. albilabris (Liu et al., 2018). Из-за потери большой группы крыловых мышц, в груди C. pallida освобождается пространство, доступное для увеличения мышц, участвующих в движении конечностей – Idvm15, Idvm18 и Idvm19, Iscm1-4, Iscm6, IIscm1-3, IIscm6 и IIIscm1-3, IIIscm6 (Liu et al., 2018). Многие из этих мышц конечностей отсутствуют у Leptocera sp., H. albilabris и D. melanogaster (Fabian et al., 2016). Возможно, увеличение количества мышц у кровососущих двукрылых повышает способность ног прикрепляться к покровам хозяина (Liu et al., 2018). Таким образом, в груди у миниатюрных двукрылых Leptocera sp. и H. albilabris и у крупных представителей родственных групп набор мускулатуры схож, различия наблюдаются лишь в редукции некоторых групп мышц, что связано с особенностями анатомии и образа жизни.
В сравнении с Leptocera sp. и H. albilabris значительных изменений в наборе мускулатуры С. scutellata не происходит (Веко, Полилов, 2020). Отличия проявляются лишь в отсутствии некоторых единичных мышц разных функциональных групп. Например, в среднегруди C. scutellata присутствуют три стерно-коксальные мышцы, а у Leptocera sp. и H. albilabris их четыре. Различаются относительные объемы мускулатуры у двукрылых. По этому показателю C. scutellata на 10% превосходит Leptocera sp. и H. albilabris.
Сравнение набора мускулатуры изученных микронасекомых и крупных представителей родственных групп выявляет лишь единичные изменения. У жуков-перокрылок Ptiliidae отсутствуют только три мышцы – 0hy9, 0st2, IIIscm4, а остальные мышцы присутствуют, как и у более крупных представителей родственных групп (Полилов, 2008). В груди у Corylophidae отсутствуют мышцы IItpm10, IIpcm6, IIvlm3, присутствующие у всех летающих представителей этого семейства (Polilov, 2016). Миниатюрные Trichogrammatidae отличаются от всех изученных хальцидоидов отсутствием 0lb2 и IIdvm1 (Полилов, 2016а). Заметное сокращение мускулатуры было выявлено только у Megaphragma mymaripenne, у которой отсутствуют 0ph1, IItpm10, IItpm11, IIspm1, IIIvlm2, IIIscm2, IIIscm5 и IIIscm6 (Polilov, 2017). Изученные представители Liposcelididae также имеют меньший набор мускулатуры по сравнению с другими сеноедами, но это является результатом их бескрылости (Полилов, 2016б). Также у Liposcelis bostrychophila отсутствуют 0hy5, Iscm5, IIdvm4, IIIpcm4 и IIIscm1, которые присутствуют у всех изученных сеноедов. Таким образом, у всех изученных микронасекомых отсутствует единая редукция мышцы или группы мышц. Поэтому можно сделать вывод, что миниатюризация слабо влияет на мускулатуру, в том числе это характерно и для миниатюрных двукрылых.
Объем мускулатуры у микронасекомых изменяется изометрически (Polilov, Makarova, 2017). Уменьшение относительного объема мышечных волокон при уменьшении размера тела обнаружено у жесткокрылых и Paraneoptera, однако эта тенденция не наблюдается у перепончатокрылых, у которых относительный объем мышц увеличивается. Этот показатель у двукрылых меньше, чем у перепончатокрылых и жесткокрылых того же размерного класса.
Половая система
Половая система изученных в этой работе миниатюрных двукрылых также не претерпевает сильных изменений. Она характеризуется типичным планом строения,и в составе половых желез имеется одинаковое количество овариол. Относительный объем половой системы Leptocera sp. в два раза больше, чем у H. albilabris.
В сравнение с крупными представителями двукрылых у Leptocera sp. и H. albilabris происходит уменьшение количества овариол. Суммарно в яичниках двух изученных двукрылых находится по 16 яйцевых трубочек, а для крупных представителей родственных групп, таких как Calliphora sp., их число равно 30 (Ananina et al., 2010).
В строении половой системы С. scutellata также не происходит значительных изменений (Веко, Полилов, 2020). Она представлена симметричными гонадами и придаточными железами. По относительному объему данная система всего на 1% больше, чем у Leptocera sp., но в то же время в три раза превышает относительный объем у H. albilabris.
Значительные изменения в организации половой системы обнаружены у Ptiliidae. Половая система жуков-перокрылок становится асимметричной – самки и самцы имеют непарные гонады (Полилов, 2008). У перепончатокрылых выявлено уменьшение числа овариол – в каждом яичнике самки Megaphragma mymaripenne находится всего лишь 4 овариолы, а в единственном яичнике микрожесткокрылых Ptiliidae – вовсе 2 (Полилов, 2008, 2016).
Объем половой системы у миниатюрных жесткокрылых и перепончатокрылых того же размерного класса изменяется аллометрически и увеличивается при уменьшении размера тела (Polilov, 2016). Все изученные нами двукрылые обладают наименьшим относительным объемом половой системы (Веко, Полилов, 2020).
Несмотря на миниатюрные размеры тела, Leptocera sp. и Hydrellia albilabris, как и изученная ранее C. scutellata, сохраняют высокий уровень организации строения, характерный для крупных представителей родственных групп. У миниатюрных короткоусых и длинноусых наблюдаются значительные различия в строении дыхательной системы, которая у длинноусых представлена только трахеями, а у короткоусых двукрылых – воздушными мешками со сложной сетью трахей. Также отличия отмечаются в более олигомеризованной ЦНС у короткоусых двукрылых.
Во влиянии миниатюризации на строение у двукрылых наблюдается ряд параллелизмов с морфологическими особенностями других микронасекомых, например олигомеризация и концентрация ганглиев нервной системы. С другой стороны, миниатюрные двукрылые отличаются от других микронасекомых хорошо развитой дыхательной и кровеносной системами, а также малым объемом половой системы.
Список литературы
Веко Е.Н., Полилов А.А., 2020. Влияние миниатюризации на анатомию Corynoneura scutellata Winnertz 1846 (Diptera, Chironomidae) – одного из мельчайших двукрылых // Зоологический журнал. Т. 99. Вып. 12. С. 1398–1410.
Кривошеина М.Г., 1986. Ревизия палеарктических видов мух-береговушек рода Dichaeta Mg. (Diptera, Ephydridae) // Зоологический журнал. Т. 65. Вып. 5. С. 809–813.
Кривошеина М.Г., 1989. Мухи-береговушки рода Halmopota (Diptera, Ephydridae) Палеарктики // Вестник зоологии. Т. 1. С. 18–24.
Кривошеина М.Г., 2001. Новые данные о палеарктических видах рода Coenia (Diptera, Ephydridae) // Зоологический журнал. Т. 80. Вып. 11. С. 1367–1371.
Кривошеина М.Г., 2010. Новый вид мух-береговушек рода Notiphila (Diptera, Ephydridae) из Таиланда // Зоологический журнал. Т. 89. Вып. 8. С. 1012–1015.
Пантелеева Н.Ю., Гапонов С.П., 2016. Новые сведения о сапрофагии личинок акалиптратных короткоусых двукрылых (Diptera, Brachycera, Acalyptratae) Среднего Подонья. II. Надсемейства Opomyzoidea, Chloropoidea, Carnoidea, Sphaeroceroidea и Ephydroidea // Вестник ВГУ. Серия: Химия. Биология. Фармация. Т. 1. С. 94–102.
Полилов А.А., 2008. Анатомия мельчайших жесткокрылых – жуков-перистокрылок трибы Nanosellini (Coleoptera, Ptiliidae) и пределы миниатюризации насекомых // Зоологический журнал. Т. 87. № 2. С. 181–188.
Полилов А.А., 2016. Особенности строения перепончатокрылых, связанные с миниатюризацией. 1. Анатомия мимариды Anaphes flavipes (Hymenoptera, Mymaridae) // Зоологический журнал. Т. 95. № 5. С. 567–578.
Полилов А.А., 2016а. Особенности строения перепончатокрылых, связанные с миниатюризацией. 2. Анатомия Trichogramma evanescens (Hymenoptera, Trichogrammatidae) // Зоологический журнал. Т. 95. № 6. С. 699–711.
Полилов А.А., 2016б. Анатомия имаго и нимфы первого возраста сеноеда Liposcelis bostrychophila (Psocoptera, Liposcelididae) // Зоологический журнал. Т. 95. № 11. С. 1305–1321.
Стекольников А.А., 2008. Морфологические принципы эволюции мускулатуры насекомых. СПб.: Изд-во С.-Петербургского ун-та. 180 с.
Alkassis W., Schoeller J., 1984. Ultrastructure of the Malpighian tubules of blow fly larva, Calliphora erythtrocephala Meigen (Diptera: Calliphoridae) // International Journal of Insect Morphology and Embryology. V. 13. P. 215–231.
Ananina T., Vedernikov A., Khodzhanov A., Stegnii V., 2010. Development of ovarioles and nurse-cell cytoskeleton in Calliphora erythrocephala Mg (Diptera: Calliphoridae) // Cell and Tissue Biology. V. 4. P. 192–198.
Deonier D.L., 1971. A systematic and ecological study of Nearctic Hydrellia (Diptera: Ephydridae) // Smithsonian Contributions to Zoology. V. 68. 147 p.
Dunlop J.A., 2019. Miniaturisation in Chelicerata // Arthropod Structure & Development. V. 48. P. 20–34.
Fabian B., Schneeberg K., Beutel R.G., 2016. Comparative thoracic anatomy of the wild type and wingless (wg1cn1) mutant of Drosophila melanogaster (Diptera) // Arthropod Structure & Development. V. 45. P. 611–636.
Liu S.P., Petersen D.S., Friedrich F., Busse S., 2018. The thoracic anatomy of the swift lousefly Crataerina pallida (Diptera) – functional implications and character evolution in Hippoboscoidea // Zoological Journal of the Linnean Society. V. 185. P. 111–131.
Marshall S., Rohacek J., Dong H., Buck M., 2011. The state of Sphaeroceridae (Diptera: Acalyptratae): a world catalog update covering the years 2000-2010, with new generic synonymy, new combinations, and new distributions // Acta Entomologica Musei Natioalis Pragae. T. 51. P. 217–298.
Mathis W., Marinoni L., Costa D., 2014. A review of Scatellini (Diptera: Ephydridae) from Brazil // Zoologia (Curitiba). V. 31. P. 561–576.
Mathis W., Costa D., Marinoni L., 2015. A review of Mimapsilopa Cresson (Diptera: Ephydridae) from Brazil // Zootaxa. V. 3926. P. 499–522.
Mathis W., Zatwarnicki T., 2019. New taxonomic twists in shore flies as revealed in discovery of Neozealides, a new genus from New Zealand (Diptera: Ephydridae) // Zootaxa. V. 4656. P. 487–500.
Matsuda R., 1965. Morphology and evolution of the insect head // Memoirs of the American Entomological Institute. V. 4. 334 p.
Matsuda R., 1970. Morphology and evolution of the insect thorax // The Memoirs of the Entomological Society of Canada. V. 102. 431 p.
Minelli A., Fusco G., 2019. No limits: Breaking constrains in insect miniaturization // Arthropod Structure & Development. V. 48. P. 4–11.
O’Donnell M.J., Maddrell S.H., 1995. Fluid reabsorption and ion transport by the lower Malpighian tubules of adult female Drosophila //Journal of Experimental Biology. V. 198. P. 1647–1653.
Pacheco C.A., Chaboli Alevi K.C., Ravazi A., Oliveira M.T., 2014. Review: Malpighian Tubule, an Essential Organ for Insects // Entomology, Ornithology & Herpetology. V. 3 (2). P. 1–3.
Polilov A.A., 2016. At the Size Limit – Effects of Miniaturization in Insects. // Springer International Publishing. Switzerland. 325 p.
Polilov A.A., Shmakov A.S., 2016. The anatomy of the thrips Heliothrips haemorrhoidalis (Thysanoptera, Thripidae) and its specific features caused by miniaturization // Arthropod Structure & Development. V. 45. P. 496–507.
Polilov A.A., 2017. Anatomy of adult Megaphragma (Hymenoptera: Trichogrammatidae), one of the smallest insects, and new insight into insect miniaturization // PloS one. V. 12. № 5. P. 1–20.
Polilov A.A., Makarova A.A., 2017. The scaling and allometry of organ size associated with miniaturization in insects: A case study for Coleoptera and Hymenoptera // Scientific reports. V. 7. P. 1–7.
Rein K., Zöckler M., Mader M., Grübel C., Heisenberg M., 2002. The Drosophila standard brain // Current Biology. V. 12. P. 227–231.
Rensch B., 1948. Histological changes correlated with evolutionary changes of body size // Evolution. V. 2. P. 218–230.
Rohacek J., 2012. Wing polymorphism in European species of Sphaeroceridae (Diptera) // Acta Entomologica Musei Natioalis Pragae. V. 52. P. 535–558.
Schneeberg K., Polilov A., Harris M.O., Beutel R.G., 2013. The Adult Head Morphology of the Hessian Fly Mayetiola destructor (Diptera, Cecidomyiidae) // Journal of morphology. V. 274. P. 1299–1311.
Sohal R.S., 1974. Fine structure of the Malpighian tubules in the housefly, Musca domestica // Tissue and Cell. V. 6. P. 719–728.
Strausfeld N., 1976. Atlas of an Insect Brain. Switzerland: Springer International Publishing. 222 p.
Wasserthal L.T., 1999. Functional morphology of the heart and of a new cephalic pulsatile organ in the blowfly Calliphora vicina (Diptera: Calliphoridae) and their roles in hemolymph transport and tracheal ventilation // International Journal of Insect Morphology. V. 28. P. 111–129.
Yeates D.K., Merritt D.J., Baker C.H., 2002. The adult ventral nerve cord as a phylogenetic character in brachyceran Diptera // Organisms Diversity & Evolution. V. 2. P. 89–96.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал



