Зоологический журнал, 2022, T. 101, № 7, стр. 805-818
Многолетняя динамика численности гнездящихся морских птиц западной части Белого моря
В. Ю. Семашко a, *, Е. В. Семашко b, **, Г. М. Тертицкий b, ***, А. Е. Черенков c, ****, Е. В. Шутова d, *****, Е. Л. Толмачёва d, ******
a Образовательный центр “Экосистема”
125475 Москва, Россия
b Институт географии РАН
119017 Москва, Россия
c Соловецкий филиал Беломорской биостанции Московского государственного университета
имени М.В. Ломоносова
164070 Архангельская область, поселок Соловецкий, Россия
d Кандалакшский государственный природный заповедник
184042 Мурманская область, Кандалакша, Россия
* E-mail: simakovw@mail.ru
** E-mail: jsemashko@yandex.ru
*** E-mail: tertitski@igras.ru
**** E-mail: chersol@mail.ru
***** E-mail: shutovakand@gmail.com
****** E-mail: tolmacheva-e@list.ru
Поступила в редакцию 20.06.2021
После доработки 14.08.2021
Принята к публикации 14.08.2021
- EDN: QDYWKW
- DOI: 10.31857/S004451342207011X
Аннотация
Представлены результаты сравнения многолетней динамики численности морских птиц, гнездящихся в западной части Белого моря на охраняемых и незащищенных островах. Периоды, в течение которых проводились серии наблюдений, составили более 50 лет в Кандалакшском государственном природном заповеднике и более 30 лет на Соловецком архипелаге. Для шести видов, встречающихся в обоих исследуемых районах, была проанализирована динамика гнездовой части популяции. Динамика численности оказалась разнородной в исследованных районах для разных видов. Обыкновенная гага (Somateria mollissima), серебристая чайка (Larus argentatus) и атлантический чистик (Cepphus grylle) показали схожую динамику численности, а кулик-сорока (Haematopus ostralegus), сизая чайка (Larus canus) и камнешарка (Arenaria interpres) – различную. Совпадающая динамика численности обусловлена сходными природными условиями гнездования и зимовок птиц на Соловецком архипелаге и в Кандалакшском заливе. Различия в основном связаны с различными режимами защиты на островах, территорию которых птицы используют в гнездовой период, и с возросшим в последние десятилетия давлением хищников на колонии морских птиц.
Изучение долгосрочных изменений численности животных невозможно без проведения ежегодного мониторинга. Многолетние учеты птиц проводятся в первую очередь в заповедниках и отражают динамику популяций в условиях минимального антропогенного воздействия. В Кандалакшском государственном природном заповеднике (КГПЗ, далее в тексте Кандалакшский заповедник) учеты численности всех морских птиц проводятся с 1960-х годов (Бианки, 1967, 1975, 1996; Карпович, 1972, 1979, 1987; Корякин, 2012; Корякин и др., 1989). На неохраняемых территориях подобные исследования, охватывающие несколько десятилетий непрерывных наблюдений, крайне редки, а исследований, выполненных в одно и то же время и в одном регионе, как на особо охраняемых природных территориях (ООПТ), так и вне их, практически нет в России.
Различные сочетания природных и антропогенных факторов формируют неоднородную среду даже в близко расположенных районах обитания вида. В связи с этим популяционная динамика одного вида на сопредельных территориях может иметь разнонаправленный характер. В настоящей работе проанализированы данные учетов гнездящихся морских птиц в сходных природных условиях для заповедной территории и для островов вне ООПТ.
На Белом море наиболее высокие показатели численности морских птиц и их видового разнообразия характерны для его западной части, и, прежде всего, для Кандалакшского и Онежского заливов (Бианки, 1967; Бианки и др., 1993; Черенков и др., 2014). В 2012 г. была опубликована статья Корякина (2012) о многолетней динамике численности морских птиц Кандалакшского заповедника, а в 2014 г. вышла монография о птицах Соловецкого архипелага (Черенков и др., 2014), где представлены аналогичные данные. В настоящей статье приводится сравнительный анализ многолетней динамики популяций морских птиц в этих соседних регионах, включая данные, полученные в последние годы.
МАТЕРИАЛЫ И МЕТОДЫ, РАЙОН ИССЛЕДОВАНИЙ
Данные о численности морских птиц собраны на заповедных островах Кандалакшского залива и на Соловецком архипелаге Онежского залива (рис. 1). В этих районах Белого моря расположено более тысячи островов, бóльшая часть из которых является местом гнездования морских птиц. Значительная часть островов включена в несколько ООПТ федерального и регионального уровня, но реальная охрана всех компонентов морских экосистем осуществляется только в Кандалакшском заповеднике, который в нынешних границах существует уже более 50 лет. В Онежском заливе для большинства островов нет запрета на посещение, а Соловецкий архипелаг в летнее время является основным туристическим центром западной части Белого моря.
В настоящем исследовании не анализируется динамика численности всей популяции вида. Оценить ее очень сложно, особенно в период гнездования, когда неразмножающиеся птицы диффузно распределены по акватории или побережьям островов и материка. Мы оценивали только ту часть популяции, которая размножалась в данном сезоне и сохранила гнезда или птенцов на момент наших учетов, поэтому можно предположить, что общая численность видов не испытывает таких резких колебаний, как это видно на некоторых графиках. Результаты массового индивидуального мечения показали, что для части изучаемых видов характерен высокий уровень гнездового консерватизма. Окольцованных гнездящихся особей обыкновенной гаги, чаек и кулика-сороки ежегодно наблюдали в одних и тех же районах. В то же время, в Онежском заливе мы никогда не встречали на гнездовании птиц, помеченных взрослыми в КГПЗ, и, наоборот, птицы, окольцованные на Соловецких о-вах, не встречены на колониях Кандалакшского залива. Расселение происходит за счет молодых особей, поэтому ухудшение условий гнездования в одних районах не приводит к быстрому росту численности вида в других.
В Кандалакшском заповеднике количество островов, охваченных учетами, было непостоянным. До 1967 г. оно увеличивалось за счет присоединения к заповеднику новых территорий, с 1986 по 1998 гг. учеты проводились практически на всех заповедных островах (300–336 островов). Позднее по разным причинам количество обследованных островов сокращалось и в 2013–2019 гг. составляло 170–190 островов (рис. 2). Обычно из учетов выводились острова, на которых гнездовые колонии существенно деградировали. С другой стороны, в последние годы обследован ряд островов залива, на которых зарегистрирована высокая численность морских птиц и которые не входят в состав заповедника (Малый, Половинницы и др.). Таким образом, многолетние исследования, проводимые в КГПЗ, не только в полной мере отражают динамику численности видов, но и достаточно достоверно показывают общую численность морских птиц во всем Кандалакшском заливе.
В Онежском заливе первые попытки оценки численности морских птиц относятся к началу 1960-х годов (Бианки, 1963). Планомерные работы на Соловецких о-вах начаты в середине 1980-х годов, а с середины 1990-х годов ежегодными учетами охвачен весь архипелаг, т.е. немногим более 100 островов (рис. 2). Кроме того, с 1991 г. учеты морских птиц проводятся один раз в несколько лет и в других районах залива. Всего здесь обследовано около 460 островов, но треть из них, в основном с низкой численностью морских птиц, обследованы однократно. Таким образом, для Онежского залива мы располагаем ежегодными данными о динамике численности птиц на Соловецком архипелаге за 25–30 лет, а общая их численность в заливе определена на уровне экспертной оценки (Черенков и др., 2014). Соловецкие учеты не включают в себя данные о численности морских птиц на трех крупнейших островах архипелага (Большой Соловецкий, Анзер и Большая Муксалма). Это связано со сложностью оценки абсолютной численности для столь больших территорий и с почти полным отсутствием на них гаги, крупных чаек и чистика. Для этих территорий, как и для залива в целом, имеется экспертная оценка численности (Черенков и др., 2014).
Учеты морских птиц в Кандалакшском заливе проводились в гнездовой период с 10 мая по 10–15 июля, а на Соловецком архипелаге с 1 по 25 июня. Численность обыкновенной гаги определялась по количеству найденных гнезд. Численность куликов и чаек определялась как по количеству найденных гнезд, так и по присутствию птиц с гнездовым поведением. Количество пар чистика считалось равным половине учтенных особей на камнях и на воде вокруг острова. Полученная численность является минимальной, т.к. мы не знаем, сколько птиц осталось на гнездах во время нашего учета.
Используемый в работе термин “морские птицы” относится в данном случае не только к обыкновенной гаге, чайкам и чистиковым, но и нескольким видам куликов, предпочитающим на Белом море гнездиться на морских островах. К массовым видам морских птиц в западной части Белого моря относятся: обыкновенная гага (Somateria mollissima (L. 1758)), кулик-сорока (Haematopus ostralegus L. 1758), серебристая чайка (Larus argentatus Pontoppidan, 1763), клуша (Larus fuscus fuscus L. 1758), сизая чайка (Larus canus L. 1758), полярная крачка (Sterna paradisaea Pontoppidan 1763), атлантический чистик (Cepphus grylle (L. 1758)) и гагарка (Alca torda L. 1758). Реже встречаются большой баклан (Phalacrocorax carbo (L. 1758)), камнешарка (Arenaria interpres (L. 1758)), короткохвостый поморник (Stercorarius parasiticus (L. 1758)) и морская чайка (Larus marinus L. 1758). Из перечисленных видов большой баклан, клуша, короткохвостый поморник и гагарка гнездятся в Кандалакшском заливе в незначительном количестве, поэтому сравнение по этим видам не проводилось. Также нам представляется нецелесообразным анализировать данные по полярной крачке, т.к. для нее характерны периодические смены районов гнездования (Белопольский, 1957; Бианки, Хляп, 1970; Краснов и др., 1995), а ее численность в Онежском заливе многократно выше, чем в Кандалакшском и зависит от состояния нескольких крупных колоний (Bianki, Isaksen, 2000; Черенков и др., 2014). Таким образом, мы будем анализировать численность обыкновенной гаги, камнешарки, кулика-сороки, атлантического чистика, серебристой, сизой и морской чаек.
На Соловецких о-вах до 1997 г. мы не проводили регулярных учетов на лесных островах Долгой губы, где в последние годы гнездится много обыкновенной гаги, поэтому долговременный тренд мы отслеживаем по 75 островам, посещаемым ежегодно с конца 1980-х годов. Как показали последующие учеты, динамика численности вида на этих 75 островах соответствует динамике на всем архипелаге.
Обработка данных проводилась в Microsoft Excel. Для построения графиков данные аппроксимировались с помощью полиномиальных функций разной степени. Степени полиномов подбиралась таким образом, чтобы, с одной стороны, значение r 2 было максимальным, но с другой – количество экстремумов на линии тренда было минимальным. Статистические расчеты проводились в STATISTICA 12.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
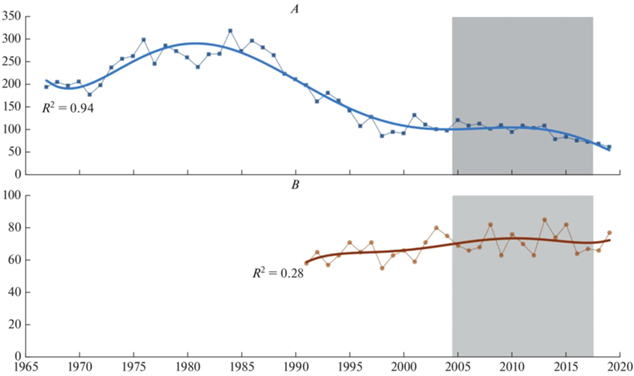
Обыкновенная гага, гнездящаяся на Белом море, образует эндемичную популяцию, обитающую здесь круглый год (Бианки, 1991). В Кандалакшском заповеднике в ХХ веке были отмечены циклические изменения численности гнездящихся самок с интервалом около 20 лет (Карпович, 1987; Корякин, 2012). Максимумы отмечены в середине 1950-х, 1970-х и 1990-х годов (рис. 3).
Рис. 3.
Динамика численности обыкновенной гаги в КГПЗ (A) и на 75 островах Соловецкого архипелага (B). Здесь и на рис. 4, 5 и 7–10 серым цветом выделены периоды, когда тренд численности в исследуемых районах был однонаправленным. R2 – коэффициент детерминации полиномиального тренда.

Цикличность прослеживается и в Онежском заливе. Начало работ на Соловецких о-вах пришлось на период низкой численности, после чего этот показатель увеличился более чем вдвое к середине–концу 1990-х годов (рис. 3). В это же время была отмечена наиболее высокая численность гаги и в Онежском заливе в целом (5500 гнездящихся самок). Затем численность, на фоне ежегодных колебаний, снизилась в 2009–2014 гг. и выросла к 2018–2019 гг. Графики тренда численности и для Соловецких о-вов, и для Кандалакшского залива показывают, что цикличные изменения с периодом около 20 лет продолжились и в XXI веке, но с уменьшением амплитуды колебаний. Кроме того, соловецкий цикл несколько сдвинут во времени по сравнению с кандалакшским.
Цикличность гнездовой численности гаги отмечена не только на Белом море, но и в других частях гнездового ареала. Например, в восточных районах Балтики пик зарегистрирован в 1985 г., а продолжительность цикла составляет 26 лет (Hario, Rintala, 2006). В Норвегии на островах Норвежского моря циклы значительно короче – 13–16 лет, а на островах Баренцева моря динамика численности гаги имеет сглаженный характер (Fauchald et al., 2015). Причины этих циклов не ясны. На Белом море природные абиотические (характер зимы) и биотические (наличие кормовой базы, эпизоотии, активность хищников), а также антропогенные (браконьерство, беспокойство) факторы, несомненно, играют роль в этих циклах, но не объясняют более чем двукратные колебания численности вида.
Факторы, лимитирующие численность только самок, действуют в период гнездования. В первую очередь это заметная активизация хищников на прибрежных островах в летнее время. Это относится, прежде всего, к орлану-белохвосту (Haliaeetus albicilla (L. 1758)), численность которого в последних два десятилетия заметно возросла. В XXI веке он ежегодно добывает не менее 4–5% от гнездовой популяции обыкновенной гаги на Соловецком архипелаге и около 10% в Кандалакшском заповеднике (Koryakin, Boyko, 2006; Корякин, Бойко, 2010; Черенков и др., 2014). С начала 2000-х годов колонии гаги на прибрежных островах регулярно разоряет бурый медведь (Ursus arctos L. 1758), численность которого выросла в Карелии за последние 15 лет (Состояние охотничьих ресурсов … http://www.ohotcontrol.ru/ resource/Resources_2008-2013/Бурый медведь.pdf ).
Негативное влияние на численность вида и на успех размножения на неохраняемой территории оказывает также деятельность человека. В 2000-х годах у местного населения и туристов появились надежные и быстроходные маломерные суда, и даже самые удаленные острова стали легко доступными. Имеет место и прямое преследование (охота, сбор яиц), и фактор беспокойства в период размножения.
Существенное влияние на численность обыкновенной гаги в отдельных районах оказали разливы нефтепродуктов. Вероятно, такие инциденты в районе Кандалакши в 1981, 1983 и 1986 гг. усилили депрессию в период и без того низкой численности. На севере Онежского залива за время наших работ разливов нефтепродуктов отмечено не было, но авария в 2003 г. на юге залива оказала сильное негативное влияние на численность вида в этом районе в последующие три года (Черенков и др., 2005).
Положительное влияние на динамику численности оказывает многолетнее снижение ледовитости западной части Белого моря (Ледовые условия в Белом море http://193.7.160.230/web/esimo/ beloe/ice/ice_bel.php), где расположены основные зимовки всей беломорской популяции (Краснов и др., 2010).
Большая часть беломорской популяции обыкновенной гаги зимует в северной части Онежского залива. В марте 2009 г. по данным авиаучетов в полыньях и разводьях держалось около 50 тысяч особей (Аарвак и др., 2011). Значительно меньше птиц остается на зимовку в Кандалакшском заливе на незамерзающих Еремеевском и Городецком порогах в проливе Великая Салма у о-ва Великий (Корякин и др., 2012). В конце марта 2019 г. здесь было учтено 944 особи обыкновенной гаги (Е.Д. Краснова, М.В. Мардашова, Д.А. Воронов, устное сообщение).
Еще один фактор, оказывающий положительное влияние на численность гаги – это отсутствие эпизоотий последние 40 лет. С конца 1970-х годов не отмечено массовой гибели птенцов от гельминтозов, наблюдавшихся в прошлом в популяциях с высокой плотностью выводков (Кулачкова, 1979; Корякин, 2012).
В результате разнонаправленного влияния вышеперечисленных факторов произошло уменьшение амплитуды колебаний численности гнездящихся самок в первую очередь на заповедной территории.
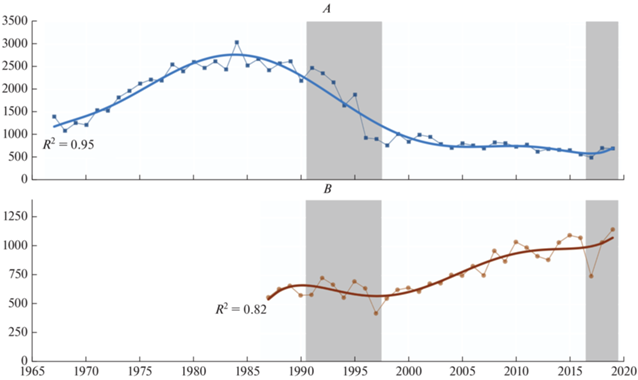
Численность камнешарки в Кандалакшском заповеднике была высокой (более 250 пар) на протяжении 1970–1980-х годов. Затем менее чем за десять лет она снизилась почти втрое до 90–100 пар. При этом падение численности началось за 12 лет до сокращения количества островов, на которых проводились учеты (рис. 2 и 4). Затем был период относительной стабильности, но с 2013 г. вновь проявилась негативная тенденция. Некоторое снижение численности в начале XXI века по сравнению с последним десятилетием XX века отмечено и на островах Онежского залива, за исключением Соловецкого архипелага. Наоборот, здесь на фоне ежегодных колебаний численности наблюдается слабая положительная тенденция (рис. 4).
Разнонаправленность изменения численности труднообъяснима, скорее всего, ее причины следует искать не на Белом море, а в районах зимовок и миграционных путей. Известно, что беломорские камнешарки зимуют на морских побережьях Западной Европы и Западной Африки (Корякин, 2016), но детали распределения птиц из разных районов на местах зимовок и их остановок на пролете изучены недостаточно.
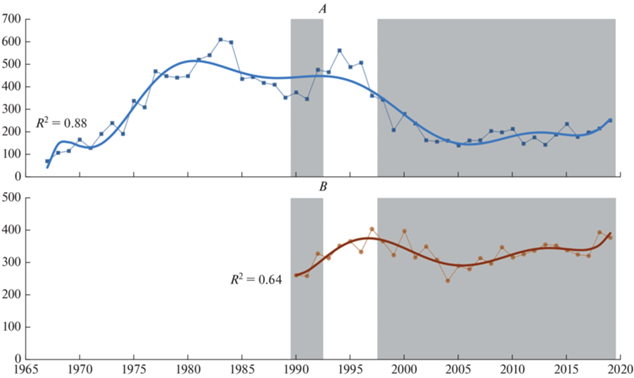
На первый взгляд сходная картина наблюдается и при сравнении динамики численности кулика-сороки в Кандалакшском и Онежском заливах. Тренды разнонаправлены: в Кандалакшском заповеднике учеты показывают примерно трехкратное снижение численности в период с середины 1990-х годов по настоящее время, а на Соловецком архипелаге прослеживается тенденция ее увеличения (рис. 5).
Причины разнонаправленности трендов не совсем ясны. Следует учесть, что кулик-сорока – один из самых широко распространенных видов на островах Белого моря: в Онежском заливе он заселяет около 70% (на Соловецком архипелаге почти 90%), а в Кандалакшском заливе – 70–75% обследованных островов. При этом часто на острове гнездятся лишь 1–2 пары этих куликов. Таким образом, результаты учетов этого вида напрямую (в КГПЗ за период 1995–2019 гг. корреляция Спирмена ρ = 0.92 при уровне p < 0.05) связаны с количеством обследованных островов. Реальное снижение численности на островах КГПЗ было не столь значительным, как показывают данные учетов, хотя и имело место, т.к. снизилось среднее количество гнездящихся пар на один обследованный остров (рис. 6).
Рис. 6.
Динамика среднего числа пар кулика-сороки, гнездящихся на каждом из обследованных островов в КГПЗ (А) и на Соловецких островах (В).

Возможно, на островах Кандалакшского залива по сравнению с Соловецким архипелагом из-за их близости к материку сильнее сказывается роль наземных хищников: бурого медведя, лисицы (Vulpes vulpes L. 1758), норок Mustela lutreola L. 1761 и Neovison vison (Schreber 1777) (Корякин, 2012). В 2015–2020 гг. и в Кандалакшском, и в Онежском заливах численность кулика-сороки на фоне ежегодных относительно небольших колебаний стабилизировалась. В Кандалакшском заповеднике – на низком, а на Соловецком архипелаге – на относительно высоком уровне.
Для серебристой чайки динамика изменения численности на островах Кандалакшского и Онежского заливов за последние 50 лет имеет сходные тренды (корреляция Спирмана ρ = 0.81 при уровне p < 0.05). В начале 1960-х годов общая численность вида на островах Онежского залива была оценена в 650 пар (Бианки, 1963), а на заповедных островах Кандалакшского залива гнездилось около 750 пар. С начала 1970-х годов в КГПЗ и в Онежском заливе начался стабильный и довольно быстрый рост численности, так что к 1990-м годам этот показатель на островах Онежского залива вырос более чем в 8 раз, а в Кандалакшском заповеднике – в 6 раз (рис. 7).
С середины 1990-х годов в Кандалакшском заливе и несколько позже в Онежском началось снижение численности серебристой чайки. Особенно резко оно проявилось в Кандалакшском заливе, где примерно за 10 лет количество гнездящихся пар снизилось до уровня 1960-х годов, т.е. почти в 5 раз. В Онежском заливе, в том числе и на Соловецких о-вах, снижение было не столь катастрофично, примерно в 1.5–1.7 раз. В последние 10 лет во всей западной части Белого моря численность вида стабилизировалась на относительно низком уровне.
Причины резкого роста и последующего падения численности серебристой чайки связаны как с ситуацией на Белом море (возможно, и на Мурмане), так и на местах зимовки в Западной Европе. Рост популяции был обусловлен ослаблением антропогенной нагрузки на колонии из-за расширения заповедных территорий на островах Кандалакшского залива и, особенно в 1980–1990-х годах, из-за экономических проблем местного населения, затруднивших использование маломерных судов на море и браконьерство на островах. Основной причиной снижения численности вида послужил дефицит естественных кормов не только в Белом море, но и в соседних частях ареала. В это же время отмечаются сильное обеднение литорали Мурмана и изменение кормовой базы крупных чаек в Баренцевом море, где они в значительной степени перешли на питание пищевыми отходами вблизи населенных пунктов (Краснов, 1989; Татаринкова, 1989, 1989а; Краснов и др., 1995; Lorentsen, Tatarinkova, 2000). Аналогичная динамика численности серебристой чайки отмечена в Финляндии, где рост популяции в 1978–1985 гг. (Kilpi, 1990) сменился ее последующим снижением. На Айновых о-вах пик численности серебристой чайки отмечен в середине 1970-х годов, после чего ее численность стала сокращаться, и к 2010 г. количество гнездящихся пар снизилась в 6 раз (Горяев и др., 2011). На норвежском побережье Баренцева моря численность серебристой чайки с 1980 по 2013 г. сократилась в 5 раз. В Норвегии, на побережье Северного моря, популяция вида увеличивалась до уровня 1997 г., но затем также начала уменьшаться (Fauchald et al., 2015).
Снижение численности серебристой чайки началось, скорее всего, из-за развития в Европе программ по утилизации отходов, что привело к ухудшению кормовой базы в зимний период. Основные зимовки чаек находятся в странах ЕС, где еще в конце 1990-х годов была принята программа сокращения биоразлагаемых отходов. В настоящее время доля этих отходов, направляемых на свалки, находится в пределах 1–2% (Никуличев, 2017). Таким образом, меры, направленные на улучшение экологической ситуации, могут приводить к негативным последствиям для видов, ориентированным на корма антропогенного происхождения хотя бы на одном из этапов своего жизненного цикла. Одновременно на Белом море в районах гнездования усилился пресс хищников, прежде всего орлана-белохвоста и бурого медведя, что оказалось особо значимым для Кандалакшского залива. В последние годы усилилось и антропогенное влияние на колонии, особенно в Онежском заливе.
Морская чайка – относительно редкий вид на Белом море, ее численность на порядок ниже, чем серебристой. В Кандалакшском заливе в динамике этих двух видов прослеживается определенное сходство – с 1970-х до середины 1990-х годов происходил заметный рост численности (с 5–10 до 135 пар), затем последовали ее спад, хотя и не такой значительный, как у серебристой чайки, и относительная стабилизация численности на среднем (75–90 пар) уровне. В Онежском заливе рост популяции морской чайки начался намного позже, чем в Кандалакшском. В 1960-х годах ее здесь не встретили (Бианки, 1963), а в конце 1990-х годов было учтено немногим более 100 пар, из них 25 пар на Соловецких о-вах. В начале XXI века численность морской чайки здесь еще продолжала увеличиваться, но в последние 10 лет стабилизировалась на уровне 130–140 пар во всем заливе и 40–45 пар на Соловецком архипелаге. Снижения численности этого вида в Онежском заливе за период наших наблюдений не было, поэтому тренды за последние 25 лет разнонаправлены (рис. 8). На побережье Баренцева моря, где вид традиционно был многочислен, с 1980 по 2013 гг. численность морской чайки постоянно уменьшалась, как в России, так и в Норвегии (Горяев и др., 2011; Fauchald et al., 2015).
Причины, влияющие на динамику численности морской чайки те же, что и у серебристой, но в целом она меньше страдает от хищников и человека, поскольку на Белом море гнездится преимущественно отдельными парами. В конкурентной борьбе морская чайка имеет преимущество перед серебристой, что проявляется и на местах гнездования (на небольших островах морская чайка порой вытесняет серебристую), и, возможно, на зимовках.
Сходно с крупными чайками изменялась в Кандалакшском заповеднике и популяция сизой чайки (рис. 9). Изначально она была здесь самой многочисленной из чаек, и численность ее достигла максимальных значений в конце 1980-х годов, в т.ч. и за счет включения в учеты новых островов. Но в середине 1990-х годов закончился пятнадцатилетний период стабильно высокой численности, и за три года численность вида сократилась более чем в два раза. Отчасти это связано с прекращением учетов на Кемь-лудах, где гнездилось до 20% кандалакшских сизых чаек, но сокращением территории, на которых проводились учеты, нельзя полностью объяснить такое резкое падение численности вида. С конца 1990-х годов и по настоящее время численность вида в КГПЗ держится на низком уровне со слабо выраженной тенденцией к понижению. В Онежском заливе с 1960-х годов, когда была дана первая количественная оценка популяции сизой чайки (Бианки, 1963), численность к 1990-м годам увеличилась в 8–9 раз, а в последующие годы несколько понизилась или осталась на близком уровне. На Соловецком архипелаге за время наших наблюдений на фоне ежегодных колебаний прослеживается четкая положительная динамика, т.е. тенденция заметно отличается от кандалакшской (корреляция Спирмана ρ = –0.72 при уровне p < 0.05).
Причина разнонаправленной динамики численности вида в Кандалакшском заливе и на Соловецком архипелаге неясна. Очевидно, что негативные факторы, воздействующие на крупных чаек в районах зимовок и гнездования, о чем говорилось выше, влияют и на сизую чайку, но она, вероятно, меньше зависит от антропогенных источников пищи зимой и более пластична в выборе островов для гнездования. В частности, она легче меняет места размножения и избегает влияния хищников, в т.ч. и за счет гнездования вблизи поселений человека. Снижение численности сизой чайки в КГПЗ, возможно, связано с перераспределением местных чаек в пределах района, в том числе переселение на не заповедные территории ближе к населенным пунктам. Некоторые заповедные районы были почти полностью оставлены птицами. Так, например, в заливе Бабье море, расположенном между о-вом Великий и материковым берегом, где непосредственное воздействие человека практически отсутствует, падение численности было связано с тем, что медведи начали регулярно посещать колонии на прибрежных островах, а орланы-белохвосты практически разорили колонии на мористых островах. Птицы с островов Бабьего Моря переместились на острова Ковдской губы, примыкающей к данному участку заповедника с севера. Здесь, вне заповедника, люди достаточно часто посещают акватории и крупные лесные острова, поэтому орланы и медведи в этом районе появлялись редко (Корякин, 2012). В 1990-х годах определенную роль в исчезновении колоний сизой чайки на заповедных островах (и, вероятно, их перемещении на другие территории) сыграла конкуренция с серебристой чайкой, численность которой в те годы была максимальной. Серебристые чайки не только нападали на гнезда и птенцов, но и вытесняли сизых чаек с удобных мест гнездования.
В КГПЗ период высокой численности атлантического чистика продолжался с начала 1980-х до конца 1990-х годов прошлого столетия с пиками в середине этих десятилетий, а периоды депрессии пришлись на 1960–1970-е годы и начало ХХI века. Амплитуда колебаний в эти периоды была более чем трехкратной. Отчасти снижение численности вида в последние 20 лет связано с исключением из учетов ряда островов залива (Кемь-луды, о-в Вачев), где гнездилось около 30% кандалакшских чистиков.
На Соловецком архипелаге максимальные колебания численности атлантического чистика не столь сильны, их тренд за последние 30 лет в некоторой степени (корреляция Спирмана ρ = 0.29 при уровне p < 0.05) совпадает с динамикой популяции вида в Кандалакшском заповеднике и в обоих районах проявляется слабозаметный 20-летний цикл (рис. 10).
Беломорские атлантические чистики так же как и беломорские обыкновенные гаги обитают здесь круглый год (Бианки, 1967), зимуя на полыньях. Условия зимовки – один из основных факторов, определяющих динамику популяций этих видов (Корякин, 1988). В связи с этим можно было бы ожидать сходных трендов в изменении их численности. В реалии же четкой корреляции не прослеживается ни в Кандалакшском заповеднике, ни на Соловках. Вероятно, другие факторы (например, различия кормовой базы, условий гнездования, эпизоотии) оказывают на динамику видов не меньшее влияние, особенно при отсутствии экстремально холодных зим.
ВЫВОДЫ
Очевидно, что на популяции морских птиц, гнездящихся в Онежском и Кандалакшском заливах, при относительной близости их расположения и сходстве природных условий должны оказывать влияние сходные факторы, особенно на те виды, которые не только размножаются, но и зимуют на Белом море. Тем не менее изменения численности за несколько последних десятилетий у большей части видов разнонаправлены. У птиц Кандалакшского заповедника, как правило, проявляется негативная тенденция, у соловецких позитивная.
Одна из возможных причин – историческая. Заповедник долгое время был охраняемым “оазисом”, который обеспечивал на своей территории лучшие условия гнездования и привлекал птиц из всех окружающих районов. Плотность гнездования морских птиц на его территории приблизилась к предельным для данного региона величинам. Одновременно, благодаря охранным мероприятиям, в т.ч. международным, выросла численность хищников, как наземных, так и пернатых, и массовые поселения морских птиц оказались для них доступной кормовой базой, тем более что многие заповедные острова располагаются вблизи материкового побережья. Заповедник, достаточно эффективно защищавший морских птиц от влияния человека, защиту от хищников обеспечивать не призван.
В это же время резко изменилась экономическая ситуация. После кризиса 1990-х годов большинство рыболовецких совхозов и предприятий по сбору водорослей закрылись или сократили свою добычу в разы. Началось сокращение численности населения, вследствие эмиграции и естественной убыли. Качество снабжения значительно ухудшилось, вначале дефицит, а потом высокие цены сделали ГСМ почти недоступными для местных жителей. Общая мобильность населения значительно упала. Посещаемость отдаленных островов резко сократилась, что не могло не повлиять положительно на колонии морских птиц вне охраняемой территории. Заповедные острова в какой-то мере утратили свою привлекательность, и для некоторых видов, вероятно, оказалось выгоднее распределиться шире по региону, что привело к оттоку птиц с охраняемых территорий.
Распределение колоний морских птиц в Онежском заливе определялось иными факторами. Залив больше по размерам и богаче кормовыми ресурсами (Наумов, Федяков, 1993). Здесь не было территорий, на которых осуществлялась реальная охрана биоты. Расположение колоний в основном было связано с наличием кормовых ресурсов и труднодоступностью для человека и наземных хищников. Значительная доля от общей численности морских птиц Онежского залива гнездится на Соловецком архипелаге и других островах, находящихся на большом удалении от материка. Постоянное антропогенное воздействие препятствовало достижению предельных величин плотности гнездования. Поэтому рост численности большинства видов морских птиц начался при снижении антропогенного воздействия, а ее колебания не имеют столь выраженной амплитуды.
Список литературы
Аарвак Т., Краснов Ю.В., Гаврило М.В., Шавыкин А.А., 2011. Зимовки морских уток в Баренцевом и Белом морях: размещение и численность // Глобальные климатические процессы и их влияние на экосистемы арктических и субарктических регионов. Тез. Междунар. науч. конференции. Апатиты: Изд-во КНЦ РАН. С. 7–8.
Белопольский Л.О., 1957. Экология морских колониальных птиц Баренцева моря. М.–Л.: Изд-во АН СССР. 460 с.
Бианки В.В., 1963. Численность и размещение массовых морских птиц в западной части Белого моря // Проблемы использования промысловых ресурсов Белого моря и внутренних водоемов Карелии. Вып. 1. М.–Л.: Наука. С. 161–167.
Бианки В.В., 1967. Кулики, чайки и чистиковые Кандалакшского залива // Труды Кандалакшского гос. заповедника. Вып. 6. Мурманск: Мурманское книжное изд-во. 364 с.
Бианки В.В., 1975. Изменения численности птиц в вершине Кандалакшского залива // Места гнездования колониальных околоводных птиц и их охрана. М. С. 9–11.
Бианки В.В., 1991. Птицы // Океанографические условия и биологическая продуктивность Белого моря. Мурманск: Изд‑во ПИНРО. С. 1–115.
Бианки В.В., 1996. Об изменении численности птиц, гнездящихся в Кандалакшских шхерах // I Международный семинар “Рациональное использование прибрежной зоны Северных морей”. Материалы докладов. Кандалакша. С. 31–33.
Бианки В.В., Коханов В.Д., Корякин А.С., Краснов Ю.В., Панева Т.Д., Татаринкова И.П., Чемякин Р.Г., Шкляревич Ф.Н., Шутова Е.В., 1993. Птицы Кольско-Беломорского региона // Русский орнитологический журнал. Т. 2. Вып. 4. С. 491–586.
Бианки В.В., Хляп Л.А., 1970. Опыт изучения гнездового консерватизма и смертности взрослых полярных крачек // Материалы 7-й Прибалтийской орнитологической конференции. Т. 1. Рига. С. 25–30.
Горяев Ю.И., Горяева А.А., Татаринкова И.П., 2011. Крупные чайки в антропогенных ландшафтах Западного Мурмана (Кольский полуостров) // Беркут. Т. 20. Вып. 1–2. С. 90–110.
Карпович В.Н., 1972. Изменения численности обыкновенной гаги в Кандалакшском заповеднике за период с 1965 по 1971 г. // Материалы 2-го межведомственного совещания по изучению, охране и воспроизводству обыкновенной гаги. Кандалакша. С. 7–9.
Карпович В.Н., 1979. Изменения численности обыкновенной гаги в Кандалакшском заповеднике и их возможная связь с общей динамикой гагачьих популяций на севере и северо-западе Европы // Экология и морфология гаг в СССР. М.: Наука. С. 46–60.
Карпович В.Н., 1987. О возможной цикличности в динамике численности обыкновенной гаги // Проблемы изучения и охраны природы Прибеломорья. Мурманск: Мурманское книжное изд‑во. С. 55–64.
Корякин А.С., 1988. Ледовитость моря и динамика численности гнездящихся обыкновенных гаг в Кандалакшском заливе // XII Прибалтийская орнитологическая конференция. Вильнюс. Институт зоологии и паразитологии АН Литовской ССР. С. 99–101.
Корякин А.С., 2012. Мониторинг морских птиц в Кандалакшском заливе Белого моря (1967–2010 гг.) // Зоологический журнал. Т. 91. № 7. С. 800–808.
Корякин А.С., 2016. Камнешарка Arenaria interpres // Миграции птиц Северо-Запада России. Неворобьиные. Отв. ред. Носков Г.А., Рымкевич Т.А., Гагинская А.Р. СПб.: Изд-во АНО ЛА “Профессионал”. С. 349–352.
Корякин А.А., Бианки В.В., Шкляревич Ф.Н., Коханов В.Д., 1989. Размещение обыкновенных гаг на островах Кандалакшского залива // Растительный и животный мир заповедных островов. М.: ЦНИЛ Главохоты РСФСР. С. 56–73.
Корякин А.С., Бойко Н.С., 2010. Орлан-белохвост и обыкновенная гага в Кандалакшском заливе, Белое море // Проблемы изучения, рационального использования и охраны природных ресурсов Белого моря (Материалы XI Всероссийской конференции с международным участием. 9–11 ноября 2010 г.). С.-Петербург: ЗИН РАН. С. 87–88.
Корякин А.С., Толмачева Е.Л., Краснова Е.Д., Парфей-Карпович О.А., 2012. Зимовка гусеобразных в Кандалакшском заливе Белого моря // Экологические проблемы северных регионов и пути их решения. Материалы IV Всерос. науч. конференции с международным участием. Т. 2. КНЦ РАН. Апатиты. С. 121–126.
Краснов Ю.В., 1989. Состав пищи и особенности поведения чайковых птиц в условиях многолетнего дефицита рыбного корма // Экология птиц морских островов и побережий Кольского Севера. Мурманск: Мурманское книжное изд-во. С. 11–26.
Краснов Ю.В., Гаврило М.В., Шавыкин А.А., Ващенко П.С., 2010. Орнитофауна Белого моря в зимний период (результаты авианаблюдений в марте 2009 г.) // Природа морской Арктики: современные вызовы и роль науки: Тезисы докладов международной научной конференции. Апатиты: Изд-во КНЦ РАН. С. 238–239.
Краснов Ю.В., Матишов Г.Г., Галактионов К.В., Савинова Т.Н., 1995. Морские колониальные птицы Мурмана. СПб.: Наука. 224 с.
Кулачкова В.Г. 1979. Гельминты как причина смертности обыкновенной гаги в вершине Кандалакшского залива // Экология и морфология гаг в СССР. М.: Наука. С. 119–125.
Ледовые условия в Белом море // Единая государственная система информации об обстановке в мировом океане. Режим доступа: http://193.7.160.230/ web/esimo/beloe/ice/ice_bel.php
Наумов А.Д., Федяков В.В, 1993. Вечно живое Белое море. СПб.: Изд-во Санкт-Петербургского гор. дворца творчества юных. 335 с.
Никуличев Ю.В., 2017. Управление отходами. Опыт Европейского союза. Аналитический обзор. РАН. ИНИОН. Центр научно-информационных исследований глобальных и региональных проблем. Отел проблем европейской безопасности. М. 55 с.
Состояние охотничьих ресурсов в Российской Федерации в 2008–2013 гг. // ФГБУ “Федеральный центр развития охотничьего хозяйства”. Режим доступа: http://www.ohotcontrol.ru/resource/Resources_ 2008-2013/Resources_2008-2013.php
Татаринкова И.П., 1989. Кормовые биотопы крупных чаек на Айновых островах в различной экологической обстановке // Растительный и животный мир заповедных островов. М.: ЦНИЛ Главохоты РСФСР. С. 33–43.
Татаринкова И.П., 1989а. Зависимость временного баланса крупных чаек от состояния кормовой базы в период гнездования // Экология птиц морских островов и побережий Кольского Севера. Мурманск: Мурманское книжное изд-во. С. 5–11.
Черенков А.Е., Семашко В.Ю., Тертицкий Г.М., 2005. Гибель морских уток от разлива мазута на юге Онежского залива осенью 2003 года // Гусеобразные птицы Северной Евразии. СПб. С. 279–280.
Черенков А.Е., Семашко В.Ю., Тертицкий Г.М., 2014. Птицы Соловецких островов и Онежского залива Белого моря (1983–2013 гг.). Архангельск. 383 с.
Bianki V.V., Isaksen K., 2000. Arctic Tern Sterna paradisaea // The status of marine birds breeding in the Barents Sea region. T. Anker-Nilssen, V. Bakken, H. Strom, A.N. Golovkin, V.V. Bianki, I.P. Tatarinkova (eds). Tromsø: Norsk Polarinstitutt Rapportserie 113. P. 131–136.
Fauchald P., Anker-Nilssen T., Barrett R.T., Bustnes J.O., Bårdsen B.J. et al., 2015. The status and trends of seabirds breeding in Norway and Svalbard. Tromsø. NINA Report 1151. 84 p.
Hario M., Rintala J., 2006. Fledgling production and population trends in Finnish common eiders (Somateria mollissima mollissima) – evidence for density dependence // Canadian Journal of Zoology. V. 84. P. 1038–1046. https://doi.org/10.1139/Z06-077
Kilpi M., 1990. Breeding biology of Herring Gull Larus argentatus in the northern Baltic // Ornis Fennica. V. 67. P. 130–140.
Koryakin A.S., Boyko N.S., 2006. The White-tailed Sea Eagle Haliaeetus albicilla and the Common Eider Somateria mollissima in the Gulf of Kandalaksha, White Sea // Status of raptor populations in Eastern Fennodcandia. Proceedings of the Workshop. P. Koskimies, N.V. Lapshin (eds). Petrozavodsk: KarRC RAS. P. 49–55.
Lorentsen S.-H., Tatarinkova I.P., 2000. Herring gull Larus argentatus // The status of marine birds breeding in the Barents Sea region. T. Anker-Nilssen, V. Bakken, H. Strom, A.N. Golovkin, V.V. Bianki, I.P. Tatarinkova (eds). Tromsø: Norsk Polarinstitutt Rapportserie 113. P. 76–78.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал