Нефтехимия, 2020, T. 60, № 6, стр. 781-785
Моделирование термического разложения метана и образования твердых углеродных частиц
И. В. Кудинов 1, А. А. Пименов 1, Г. В. Михеева 1, *
1 Самарский государственный технический университет
443100 Самара, Россия
* E-mail: galinn21@list.ru
Поступила в редакцию 03.07.2020
После доработки 05.07.2020
Принята к публикации 10.07.2020
Аннотация
Выполнена разработка и верификация математических моделей разложения метана при его пиролизе, включающих нестационарные уравнения диффузии с учетом и без учета конвективной составляющей процесса разложения. Получены их точные аналитические решения, которые были использованы при исследовании математической модели образования твердых углеродных частиц, возникающих при прогреве метана до температуры пиролиза. В ходе исследований скорости и интенсивности образования твердых углеродных частиц показано, что частицы наименьших размеров получаются при более высоких температурах разложения и за более короткое время.
Разложение метана посредством пиролиза используется для получения водорода и наночастиц углерода (нанотрубки, фуллерены, карбин и др.). Преимущество этого способа заключается в том, что процесс пиролиза в данном случае не сопровождается выбросом в атмосферу углекислого газа [1–5]. Наиболее перспективным методом пиролиза является нагрев метана путем его пропускания через слой расплавленного металла (олово, свинец, алюминий и др.). В зависимости от эффективности применяемых катализаторов, температура пиролиза может превышать 1000°С. Исследование математических моделей процессов разложения метана и образования твердых углеродных частиц представляет научный и практический интерес ввиду их использования как при проектировании установок для пиролиза, так и при выполнении экспериментальных исследований.
МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ ПРОЦЕССА ТЕРМИЧЕСКОГО РАЗЛОЖЕНИЯ МЕТАНА
Реакция термического разложения метана описывается уравнением [6, 7]:
где $С$ – объемная концентрация метана, кг/м3; $t$ – время, с; $k$ – константа скорости реакции, 1/с; $E$ – энергия активации, Дж/моль; $R$ – универсальная газовая постоянная, ${{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {{\text{(моль}}\,\,{\text{K)}}}}} \right. \kern-0em} {{\text{(моль}}\,\,{\text{K)}}}}{\text{;}}$ $T$ – температура, К.Разделяя переменные в уравнении (1) и интегрируя, находим:
где ${{С}_{1}}$ – константа интегрирования.Соотношение (2) можно представить в виде
(3)
$\begin{gathered} C(t) = exp\left[ { - kexp\left( { - \frac{E}{{RT}}} \right)t + {{C}_{1}}} \right] = \\ = {{C}_{{2\,}}}exp\left[ { - kexp\left( { - \frac{E}{{RT}}} \right)t} \right], \\ \end{gathered} $ИССЛЕДОВАНИЕ ПРОЦЕССА РАЗЛОЖЕНИЯ МЕТАНА С УЧЕТОМ СКОРОСТИ ЕГО ТЕЧЕНИЯ
В уравнении (1) учитывается лишь временно́е разложение метана без учета скорости его течения по пространственной переменной. Учет скорости приводит к следующему диффузионному уравнению:
где $x$ – координата, м; $W$– скорость течения метана в направлении координаты x, м/с.Решение уравнения (5) будем находить при краевых условиях
Следуя методу разделения переменных [8‒10], решение задачи (5)–(7) принимается в виде:
где $\varphi (t)$ и $\psi \,(x)$ – неизвестные функции (времени и пространственной переменной).Подставляя (8) в (5), находим:
где $\nu $ – некоторая постоянная.Интегрируя уравнения (9), (10), получаем:
где ${{С}_{1}}{\text{,}}$ ${{С}_{2}}$ – константы интегрирования.Подставляя (11), (12) в (8), обозначив C3 = C1C2, находим:
Соотношение (13) содержит две неизвестные постоянные ${{C}_{3}}$ и ν. Для их определения используем краевые условия (6), (7). Подставляя (13) в (6), (7), относительно ${{C}_{3}}$ и $\nu $ получаем систему двух трансцендентных уравнений, из решения которой находим:
Подставляя (14), (15) в (13), после некоторых преобразований получаем:
Соотношение (16) представляет точное аналитическое решение задачи (5)–(7).
ИССЛЕДОВАНИЕ ИНТЕНСИВНОСТИ ОБРАЗОВАНИЯ ТВЕРДЫХ УГЛЕРОДНЫХ ЧАСТИЦ
Оценку интенсивности образования твердых углеродных частиц будем выполнять на основе методики, изложенной в [6, 7]. Рассмотрим ее применение для полученных выше решений (4), (16). Согласно этой методике изменение объема сферической частицы за время протекания процесса будет:
где $V = {{4\pi {{r}^{3}}} \mathord{\left/ {\vphantom {{4\pi {{r}^{3}}} 3}} \right. \kern-0em} 3}$ – объем сферической частицы, м3; $t$ – время, с; $S = 4\pi {{r}^{2}}$ – площадь поверхности сферической частицы, м2; $j = \beta (C - C{\kern 1pt} ')$ – удельный массовый поток вещества газовой фазы на поверхность частицы площадью $S,$ кг/(м2 с); $\beta $ – коэффициент массоотдачи (массовый коэффициент диффузии), м/с; $r$ – радиус сферической частицы, м; $C$ – концентрация газа в потоке, ${{{\text{кг}}} \mathord{\left/ {\vphantom {{{\text{кг}}} {{{{\text{м}}}^{{\text{3}}}}}}} \right. \kern-0em} {{{{\text{м}}}^{{\text{3}}}}}}{\text{;}}$ $C{\kern 1pt} '$ – концентрация газа вблизи поверхности частицы, ${{{\text{кг}}} \mathord{\left/ {\vphantom {{{\text{кг}}} {{{{\text{м}}}^{{\text{3}}}}}}} \right. \kern-0em} {{{{\text{м}}}^{{\text{3}}}}}}{\text{;}}$ ${{\rho }_{{\text{C}}}}$ – плотность углерода, ${{{\text{кг}}} \mathord{\left/ {\vphantom {{{\text{кг}}} {{{{\text{м}}}^{{\text{3}}}}}}} \right. \kern-0em} {{{{\text{м}}}^{{\text{3}}}}}}.$Так как объем частицы зависит от радиуса, то, следовательно,
(18)
$\frac{{dV}}{{dt}} = \frac{{dV}}{{dr}}\frac{{dr}}{{dt}} = 4\pi {{r}^{2}}\frac{{dr}}{{dt}} = S\frac{{dr}}{{dt}}.$Сравнивая (17) и (18), будем иметь:
Полагая, что образование твердого вещества на поверхности частицы является реакцией первого порядка, находим [6]
где ${{K}_{S}}{\text{,}}$ м/с – кинетический коэффициент поверхностной реакции, описывающий реакцию осаждения углерода из метана, находящегося вблизи поверхности частицы и определяемый по формуле АррениусаОбъединяя формулы для $j{\text{,}}$ находим:
Выражая $C{\kern 1pt} '$ из (21) и подставляя в (20), получаем:
где $K_{S}^{ * } = {{{{K}_{S}}\beta } \mathord{\left/ {\vphantom {{{{K}_{S}}\beta } {({{K}_{S}} + \beta )}}} \right. \kern-0em} {({{K}_{S}} + \beta )}}$ $C(t)$ ‒ находится по формуле (4).Подставляя (22) в (19) с учетом (4), находим:
(23)
$\frac{{dr}}{{dt}} = \frac{{K_{S}^{ * }}}{{{{{\rho }}_{{\text{C}}}}}}exp\left[ { - kexp\left( { - \frac{E}{{RT}}} \right)t} \right].\frac{{{{\partial }^{2}}\Omega }}{{\partial {{u}^{2}}}}$Интегрируя уравнение (23) получаем:
(24)
$r(t) = \frac{{K_{S}^{ * }}}{{{{\rho }_{{\text{C}}}}Kexp\left( { - \frac{E}{{RT}}} \right)}}exp\left[ { - kexp\left( { - \frac{E}{{RT}}} \right)t} \right] + {{C}_{1}},$(25)
${{C}_{1}} = \frac{{k_{S}^{ * }}}{{{{\rho }_{{\text{C}}}}kexp\left( { - \frac{E}{{RT}}} \right)}}.$Соотношение (24) с учетом (25) принимает вид:
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исходные данные для решения задачи были следующие:
(27)
$\begin{gathered} k = 4.5 \times {{10}^{{13}}}\,\,{1 \mathord{\left/ {\vphantom {1 {\text{с}}}} \right. \kern-0em} {\text{с}}};\,\,\,\,E = 381{\kern 1pt} {\kern 1pt} 000\,\,{{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}; \\ R = 8.314\,\,{{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {{\text{(моль}}\,\,{\text{K}})}}} \right. \kern-0em} {{\text{(моль}}\,\,{\text{K}})}}. \\ \end{gathered} $Результаты расчетов по формуле (4) при различных значениях температуры приведены на рис. 1. Из их анализа следует, что при $T > 1500\,\,{\text{K}}$ время реакции разложения метана составляет менее 0.1 с.
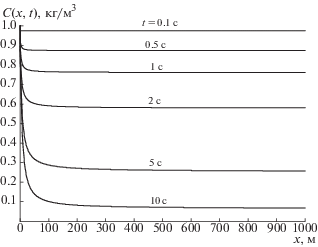
Результаты расчетов по формуле (16) при исходных данных (27) для различных температур и скоростей течения среды приведены на рис. 2–4. Из их анализа следует, что при достаточно высокой для пиролиза метана температуре $T = 1400\,\,{\text{K}}$ за время $t = 10\,{\text{c}}$ более 90% метана разлагается (рис. 2).
Рис. 2.
Зависимость концентрации метана по длине канала от времени при $T = 1400\,\,{\text{K}},$ $W = 2\,\,{{\text{м}} \mathord{\left/ {\vphantom {{\text{м}} {\text{с}}}} \right. \kern-0em} {\text{с}}}.$
При уменьшении температуры процесса пиролиза до $1200\,{\text{K}}$ процесс разложения метана происходит гораздо медленнее, причем количество разлагаемого метана составляет менее 50% (рис. 3).
Рис. 3.
Зависимость концентрации метана по длине канала от времени при $T = 1200\,\,{\text{K}},$ $W = 2\,\,{{\text{м}} \mathord{\left/ {\vphantom {{\text{м}} {\text{с}}}} \right. \kern-0em} {\text{с}}}.$

Однако, при уменьшении скорости течения газа с 2 до 0.1 м/с количество разлагаемого метана можно увеличить вплоть до 100% (рис. 4), но реакция будет протекать намного медленнее (10 000 с), чем при $T = 1400\,\,{\text{K}}.$
Рис. 4.
Зависимость концентрации метана по длине канала от времени при $T = 1200\,\,{\text{K}},$ $W = 0.1\,\,{{\text{м}} \mathord{\left/ {\vphantom {{\text{м}} {\text{с}}}} \right. \kern-0em} {\text{с}}}.$

Результаты расчетов по формуле (26) при исходных данных (27), а также при $\beta = 0.2$ м/с и ${{\rho }_{{\text{C}}}} = 1900\,\,{{{\text{кг}}} \mathord{\left/ {\vphantom {{{\text{кг}}} {{{{\text{м}}}^{3}}}}} \right. \kern-0em} {{{{\text{м}}}^{3}}}},$ приведены на рис. 5.
Рис. 5.
Зависимость радиуса образующихся твердых углеродных частиц при различных температурах пиролиза от времени.

Из их анализа следует, что с увеличением температуры пиролиза радиус образовывающихся углеродных частиц уменьшается. Обнаружено замедление роста углеродных частиц с уменьшением температуры пиролиза. Максимально возможный радиус углеродных частиц при любых температурах не превышает 0.5 мм. Отметим что в данном случае рассмотрен лишь диффузионный режим изменения размеров частиц, то есть, когда ${{K}_{S}} \gg \beta $ и скорость роста частиц в основном определяется величиной β.
ЗАКЛЮЧЕНИЕ
1. Разработаны математические модели процесса разложения метана при его пиролизе, включающие нестационарные уравнения диффузии с учетом и без учета его движения. Получены их точные аналитические решения и выполнен детальный анализ, из которого следует, что глубина разложения метана существенно зависит от температуры пиролиза и скорости течения метана.
2. На основе решений выполнены исследования скорости и интенсивности образования твердых углеродных частиц. В частности, показано, что частицы наименьших размеров получаются при более высоких температурах разложения и за более короткое время.
Список литературы
Баранов Н.Н. Нетрадиционные источники и методы преобразования энергии. М.: Издательский дом МЭИ, 2012. 384 с.
Фортов В.Е., Попель О.С. Энергетика в современном мире. Долгопрудный: Издательский дом “Интеллект”, 2011. 167 с.
Ячиков И.М., Миронова Г.А., Петин С.Н. // Приложение математики в экономических и технических исследованиях. 2007. № 1. С. 170.
Serban M., Lewis M.A., Marshall C.L., Doctor R.D. // Energy&Fuels. 2003. V. 17. P. 705.
Upham D.C., Agarwal V., Khechfe A., Snodgrass Z.R., Gordon M.J. Metiu H., McFarland E.W. // Science. 2017. V. 358. № 6365. P. 917.
Харин А.А., Яновский Л.С. // Вестник Самарского государственного аэрокосмического университета. Технические науки. 2002. № 1. С. 110.
Франк-Каменецкий Д.А. Основы макрокинетики. Диффузия и теплопередача в химической кинетике. Долгопрудный: Издательский Дом “Интеллект”, 2008. 408 с.
Kudinov I.V., Kudinov V.A. // Mechanics of Solids. 2014. V. 49. № 5. P. 531. https://doi.org/10.3103/S0025654414050057
Kudinov I.V., Kudinov V.A., Gavrilova T.E. // Internat. J. of Heat and Mass Transfer. 2019. V. 138. P. 326. https://doi.org/10.1016/j.ijheatmasstransfer.2019.04.011
Kudinov I.V., Eremin A.V., Kudinov V.A., Dovgyallo A.I., Zhukov V.V. // Internat. J. of Solids and Structures. 2020. V. 200–201. P. 231. https://doi.org/10.1016/j.ijsolstr.2020.05.018.2020
Дополнительные материалы отсутствуют.



