Неорганические материалы, 2023, T. 59, № 2, стр. 150-161
Синтез оксидных композитов титана и марганца, исследование их физико-химических и фотокаталитических свойств
М. Л. Беликов 1, *, С. А. Сафарян 1, П. А. Корнейкова 1
1 Институт химии и технологии редких элементов и минерального сырья им. И.В. Тананаева – обособленное подразделение Федерального исследовательского центра “Кольский научный центр Российской академии наук”
184209 Мурманская обл., Апатиты, Академгородок, 26а, Россия
* E-mail: masim-bek@mail.ru
Поступила в редакцию 15.06.2022
После доработки 06.12.2022
Принята к публикации 08.12.2022
- EDN: YCJMPL
- DOI: 10.31857/S0002337X23020021
Аннотация
Синтезированы фотокаталитически активные материалы на основе титана и марганца. Изучены особенности формирования полученных материалов, их физико-химические и фотокаталитические свойства. Показано, что модифицирование TiO2 марганцем приводит к получению нанодисперсных порошков (4.8–2550 нм) со свободной удельной поверхностью от 0.56 до 479 м2/г. Синтезированные порошки обладают высокой фотокаталитической активностью (ФКА) при облучении видимым светом, превышающей ФКА немодифицированного TiO2 схожего генезиса и промышленного диоксида титана Р-25 фирмы Degussa. Повышенный уровень ФКА наблюдается для образцов, модифицированных марганцем, одновременно содержащих анатаз и рутил, без обособления отдельных фаз марганца.
ВВЕДЕНИЕ
Диоксид титана как фотокаталитически активный материал, особое внимание привлек в начале семидесятых годов двадцатого столетия, после публикации Fujishima и Honda [1], в которой была показана возможность фотокаталитического расщепления воды в его присутствии. TiO2, обладая высокой фотокаталитической активностью (ФКА), оказался высокоэффективным при деградации многих органических загрязнителей [2–5], в т.ч. различной микробиоты [6–8].
Помимо TiO2, в качестве фотокатализаторов (ФК) рассматриваются и находят применение различные полупроводниковые материалы: ZnO, WO3, Fe2O3, CdSe, SrTiO3, SiC, CdS, GaP, GaAs и др. [9–21]. Тем не менее, из множества ФК-материалов лишь диоксид титана одновременно обладает рядом необходимых характеристик: высокой ФКА, физической, химической и биологической устойчивостью, доступностью, нетоксичностью [2, 22].
Обладая многими преимуществами, чистый диоксид титана вследствие достаточно высокой энергии запрещенной зоны (Eg = 3.2 эВ для анатаза и 3.0 эВ для рутила) проявляет ФК-свойства лишь при облучении ультрафиолетовым светом, что приводит к дополнительным энергетическим тратам, т.к. доля УФ-света в солнечном спектре составляет всего около 3–7% [23–26]. Применение TiO2 как ФК при облучении светом с λ > 400 нм ограничено. Расширения спектра фотовосприимчивости диоксида титана в длинноволновую область можно достичь путем введения различных модифицирующих добавок, уменьшающих его Eg [27]. Так, например, Eg оксида марганца составляет 1.25 эВ против 3.2 эВ у диоксида титана.
Известна повышенная ФКА композитов на основе поликристаллического диоксида титана, модифицированного ионами Mn2+, в разложении анилинового синего при облучении УФ-светом [28]. Показано, что модифицирование ионами Mn2+ промотирует превращение анатаза в рутил и приводит к сдвигу края фотопоглощения TiO2 в видимую область. Присутствие ионов Mn2+ (0.06 ат. %) в TiO2 вызывало повышение его ФКА, которое объяснено эффектом синергизма фаз анатаза и рутила [29].
В работах [30, 31] показано, что при росте содержания оксида марганца в диоксиде титана (от 0 до 5 мас. %) происходит уменьшение его Eg, что должно приводить к смещению его фотовосприимчивости в длинноволновую область.
Модифицирование TiO2 вольфрамом [32] приводило к повышению его электропроводности на два порядка. Увеличение электропроводности оксидного материала вследствие внедрения модифицирующей добавки может говорить и об увеличении его ФКА. Так, в работе [33] показано, что увеличение степени модифицирования TiO2 иновалентным металлом приводит к росту удельной проводимости материала, что коррелирует с данными по ФКА.
Было показано [34], что модифицирование марганцем промышленного диоксида титана Р-25 (фирмы Degussa) приводит к увеличению его ФКА.
Авторы полагают, что с помощью простого и эффективного метода совместного щелочного гидролиза водорастворимых солей титана и марганца могут быть получены ФК с широким интервалом модифицирования марганцем (от 1 до 30 мас. %).
Цель работы – синтез фотокаталитически активных материалов на основе Mn-модифицированного диоксида титана, изучение их физико-химических и ФК-свойств при облучении видимым светом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ФК-материалы получали в процессе совместного щелочного гидролиза солей титана (TiCl4 или TiOSO4‧xH2O) и MnCl2 в растворе NH4OH (120 г/л) по методике [35, 36]. Разогрев раствора в процессе гидролиза не превышал 40°С. Все используемые реактивы были квалификации “х.ч.”.
После отстаивания суспензии отделенный осадок промывали большим количеством дистиллированной воды. Варьируемыми параметрами являлись степень модифицирования диоксида титана марганцем (1–30 мас. %) и температура термообработки (от 80 до 800°С) полученных осадков на воздухе в течение 1 ч. Скорость нагрева/охлаждения – 15°С/мин, и выдержка при заданной температуре – 60 мин.
Продукты синтеза были охарактеризованы методами низкотемпературной адсорбции азота (метод БЭТ (FlowSorb II 2300; TriStar 3020 V1. 03)), термогравиметрии (ТГ) в атмосфере аргона при скорости нагревания 10°С/мин в сосуде Степанова с изолированной Pt–PtRh-термопарой (NETZSCH STA 409 PC/PG), химического анализа, рентгенофазового анализа (РФА; дифрактометр ДРОН-2, CuKα-излучение).
ФКА (Е, %) оценивали фотоколориметрически с помощью спектрофотометра СФ-56 по степени обесцвечивания растворов анилина (Сисх = = 100 мг/л), ферроина (Сисх = 100 мг/л) или метиленового синего (МС) (Сисх = 50 мг/л) при облучении видимым светом. Значение освещенности, определенное комбинированным прибором (люксометр + УФ-радиометр) ТКА-ПКМ (06), составило 2300 лк. Эффективность разрушения красителей как меру ФКА (Е, %) рассчитывали по уравнению
(1)
$E = \left[ {\left( {{{C}_{0}} - {{C}_{{\text{к}}}}} \right){\text{/}}{{C}_{0}}} \right] \times 100\% ,$Образцами сравнения служили: TiO2 аналогичного с модифицированным марганцем TiO2 генезиса и промышленный TiO2 фирмы Degussa – P-25 (Degussa AG, Франкфурт, Германия), предложенный ранее в качестве стандарта сравнения [37]. Маркировка образцов, например 800-Мn-5, содержит данные о температуре термообработки – 800°С, модифицирующем металле – Мn и его содержании в продукте – 5 мас. %.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В табл. 1–4 и на рис. 1–7 суммированы экспериментальные данные об изменении химического и фазового состава (РФА), удельной поверхности (S, м2/г), средней крупности частиц (d, нм), объема (V, см3/г), глубины (h, нм) и диаметра (D, нм) пор в зависимости от условий термообработки (t, °C) и содержания Mn (мас. %) в конечном продукте, а также о степени ФКА (Е, %) в реакции деструкции красителя(ей) при облучении видимым светом.
Таблица 1.
Физико-химические свойства TiO2 и его Mn-модифицированных образцов
| Образец | t, °C |
С, мас. % | РФА | S, м2/г | d, нм | |||
|---|---|---|---|---|---|---|---|---|
| TiO2 | Cl– | ${\text{NH}}_{{\text{4}}}^{ + }$ | Mn3+ | БЭТ | ||||
| 80-TiO2 | 80 | 79.8 | 1.06 | 2.84 | 0 | ам | 270.0 | 8.54 |
| 300-TiO2 | 300 | – | – | – | – | ам | 258.8 | 8.9 |
| 400-TiO2 | 400 | 98.5 | 0.06 | 0.42 | 0 | ам | 155.4 | 9.90 |
| 500-TiO2 | 500 | – | – | – | – | а | 52.4 | 29.4 |
| 600-TiO2 | 600 | 99.8 | н/о | 0.02 | 0 | а | 34.2 | 45.0 |
| 700-TiO2 | 700 | – | н/о | н/о | 0 | 80% а, 20% р | 22.1 | 72.6 |
| 800-TiO2 | 800 | – | – | – | – | 34% а, 66% р | 3.17 | 450.6 |
| P-25 | 1200 | – | н/о | 0 | 0 | р | 48.4 | 29.5 |
| 80-Mn-1 | 80 | 78.8 | – | 5.21 | 0.83 | ам | 386 | 6.0 |
| 400-Mn-1 | 400 | – | – | – | – | ам | 247 | 9.3 |
| 500-Mn-1 | 500 | – | – | – | – | 69.3% а, 30.7% р | 125 | 12 |
| 600-Mn-1 | 600 | 98.7 | н/о | н/о | 1.02 | 66% а, 34% р | 16 | 94 |
| 800-Mn-1 | 800 | – | – | – | – | р | 0.90 | 1590 |
| 80-Mn-5 | 80 | – | – | – | – | ам | 430 | 5.4 |
| 400-Mn-5 | 400 | – | – | – | – | ам | 272 | 8.5 |
| 500-Mn-5 | 500 | – | – | – | – | р | 160 | 8.9 |
| 600-Mn-5 | 600 | 93.2 | н/о | н/о | 5.24 | р, следы MnTiO3 | 3.29 | 430 |
| 800-Mn-5 | 800 | – | – | – | – | р, Mn2O3 | 0.56 | 2550 |
| 80-Mn-30 | 80 | – | – | – | – | ам | 479 | 4.8 |
| 400-Mn-30 | 400 | – | – | – | – | ам | 276 | 8.4 |
| 500-Mn-30 | 500 | – | – | – | – | ам | 202 | 11.4 |
| 550-Mn-30 | 550 | – | – | – | – | р | 120 | 11.9 |
| 600-Mn-30 | 600 | 615 | н/о | н/о | 29.83 | р, Mn2O3 | 40 | 36 |
| 800-Mn-30 | 800 | – | – | – | – | р, Mn2O3 | 5.37 | 266 |
Рис. 1.
Зависимости содержания Mn (C) (1) в образцах и его извлечения в осадок (Q) (2) при аммиачном гидролизе.

Гидролиз хлорида марганца с образованием осадка в аммиачной воде при одновременно протекающем формировании осадка гидроксида титана протекает достаточно эффективно. Степень извлечения марганца в совместный рентгеноаморфный осадок при степени модифицирования Mn 1–5 мас. % составляет 99.9%, а при 30 мас. % снижается до 96% (рис. 1).
По данным РФА и термического анализа (табл. 1, рис. 2–4), в процессе гидролиза в системе TiСl4–MnCl2–NH4OH–Н2О формируются рентгеноаморфные продукты, сохраняющие свою аморфность до 400°С. Модифицирование TiO2 1–30 мас. % Mn обеспечивает получение нанодисперсных порошков с размерами частиц от 2.6 до 7.6 нм со свободной удельной поверхностью от 876 до 303 м2/г соответственно.
Рис. 2.
Дифрактограммы Mn-модифицированного диоксида титана в зависимости от температуры обработки (цифры у кривых, °С) и содержания Mn (предел допускаемой аппаратурной погрешности измерения скорости счета импульсов рентгеновского излучения не более ±0.5%).
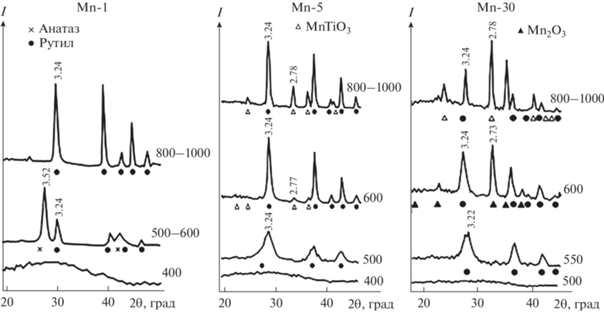
Фазообразование. Повышение температуры термообработки продуктов гидролиза ведет к сокращению удельной поверхности порошков (рис. 5), особенно ускоренному процессами кристаллизации анатаза и затем рутила, оксида марганца и метатитаната марганца, а также агрегацией и агломерацией кристаллитов.
Термический анализ воздушно-сухих (~20°С) продуктов гидролиза (рис. 3, табл. 2) демонстрирует схожие с чистым оксогидроксидом титана кривые ДСК с одним эндотермическим и одним значимым экзотермическим эффектами. Дегидратация продуктов гидролиза, сопровождаемая самой большой потерей массы, во всех случаях отмечена эндотермическими эффектами с минимумами в небольшом диапазоне температур 134.9–139.9°С.
Рис. 3.
Результаты термического анализа TiO2 и Mn-модифицированных образцов TiO2 в зависимости от содержания марганца (предел допускаемой относительной погрешности измерения температуры в интервале от 30 до 770 К ±1.5%, предел допускаемой относительной погрешности измерения массы ±1%).

Таблица 2.
Термические эффекты и данные РФА в системе Ti–O–Mn
| Образец | tmin, °C | tmax, °C | ∆M, % по ТГ при tmax |
d, Å при tmax | Фазовый состав |
|---|---|---|---|---|---|
| ДСК | РФА | ||||
| TiO2 | 145.8 | 412.2 | –23.3 | 3.52, 2.36 | Анатаз |
| 700 | – | 3.24, 2.49 | Рутил | ||
| – | – | – | а = 4.559, | ||
| с = 2.959 | |||||
| MnO2 [22, 23] | 575 | – | –14.1 | – | Mn2O3 |
| 900 | – | –4.2 | – | Mn3O4 | |
| Mn-1 | 139.9 | 469.7 | –23.8 | 3.52, 2.36 | Анатаз |
| – | – | 3.24, 2.49 | Рутил | ||
| 787.1 | – | 3.24, 2.49 | Рутил | ||
| – | – | – | а = 4.559, | ||
| с = 2.959 | |||||
| Mn-5 | 137.2 | 508.1 | –23.63 | 3.24, 2.49 | Рутил |
| – | – | – | а = 4.59, с = 2.959 | ||
| 550.0 | +0.50 | 3.24, 2.49 | Рутил | ||
| 600 | 3.76, 2.76, 2.56 | MnTiO3 следы | |||
| 800 | 3.24, 2.49 | Рутил | |||
| – | 3.85, 2.73, 2.49 | Mn2O3 | |||
| 923 | –0.69 | 3.24, 2.49 | Рутил | ||
| – | – | 3.76, 2.76, 2.56 | MnTiO3 | ||
| Mn-30 | 134.9 | 559.1 | –19.96 | 3.22, 2.47 | Рутил |
| – | – | – | а = 4.548, | ||
| 600 | +1.18 | – | с = 2.946 | ||
| – | – | 3.85, 2.73, 2.49 | Рутил | ||
| – | – | – | а = 4.59, | ||
| 932.7 | –2.91 | – | с = 2.959 | ||
| – | – | 3.76, 2.78, 2.56 | Mn2O3 Рутил MnTiO3 |
||
По данным химического анализа порошков после термообработки при 80°С их основу составляет оксогидроксид титана TiO(OH)2, теряющий от 19 до 22% воды и захваченных с маточным раствором летучих компонентов (NH4OH, HCl) по мере дальнейшего повышения температуры термообработки вплоть до образования и кристаллизации TiO2 анатазной и/или рутильной модификаций. С увеличением степени модифицирования от 1 до 5 и 30 мас. % Mn температура первого фазового перехода, отмеченная соответственно максимумами экзотермических эффектов, повышается от 459.7 до 508.1 и 559.1°С (рис. 3, табл. 2).
При этом единственный и значимый экзоэффект, по данным РФА (рис. 2, табл. 1), соответствует у образца Mn-1 образованию смеси анатаза и рутила, а при модифицировании ≥5 мас. % Mn – образованию рутила и оксида марганца Mn2O3. В этой области фазообразования на кривых ТГ можно различить небольшую область увеличения массы образцов, указывающую на окислительные процессы, а затем ее уменьшение, что можно связать с окислением марганца и последующей потерей кислорода его оксидами [38–40]. На кривых ДСК для образцов Mn-5 и Mn-30 (рис. 3, табл. 2) можно различить вторые относительно небольшие эндотермические эффекты с минимумами при 923.0 и 932.7°С. Для чистого диоксида марганца наблюдаемые эндотермические эффекты при 575 и 900°С [41] связаны с потерей именно кислорода и окислением самого марганца от Mn2+ до Mn3+ и Mn4+ в результате цепочки превращений
Для изучаемых композитов эндотермические эффекты могут указывать на потерю кислорода при образовании метатитаната марганца MnTiO3, что подтверждается данными РФА (рис. 2, табл. 2), а также заметной потерей массы образцов в этой области температур на кривой ТГ.
Последовательность превращений фазовых состояний марганца в составе композита может выглядеть следующим образом [30]:
Следует отметить, что в высокомодифицированном образце Mn-30 первоначально формируется более сжатая кристаллическая решетка рутила (3.22 Å) с параметрами а = 4.548, с = 2.946 Å против а = 4.559, с = 2.959 Å у рутила (3.24 Å), до которой она и восстанавливается после обособления фаз марганца: Mn2O3 и MnTiO3.
Полученные данные подтверждают промотирующее действие катионов марганца [29] на трансформацию анатаза в рутил (табл. 2). Так, в образцах Mn-1 рутил наряду с анатазом обнаруживается при термообработке рентгеноаморфной массы уже при 500°С, в то время как в чистом продукте гидролиза TiCl4 аналогичного генезиса фаза рутила обнаруживается только при температурах выше 700°С. Полное превращение анатаза в рутил происходит при температуре 800°С. В продуктах, содержащих ≥5 мас. % Mn, рутил формируется из рентгеноаморфной массы, минуя метастабильное состояние анатаза. Одновременно начинают выкристаллизовываться и фазы оксидов марганца (Mn2O3 при 600°С, MnTiO3 при 800°С).
Таким образом, особенностью продуктов синтеза в системе Ti–O–Mn является формирование нескольких полифазных зон в зависимости от модифицирования и температуры термообработки (рис. 4) с возможными фазовыми переходами: рентгеноаморфная масса → анатаз → рутил + + Mn2O3 → рутил + MnTiO3. В высокомодифицированных продуктах замечены следующие фазовые переходы: рентгеноаморфная масса → рутил + следы MnTiO3 → рутил + Mn2O3 → рутил + MnTiO3.
Рис. 4.
Фазовый состав Mn-модифицированных порошков диоксида титана, обработанных при температурах до 1000°С (предел допускаемой аппаратурной погрешности измерения скорости счета импульсов рентгеновского излучения не более ±0.5%).

Рис. 5.
Зависимости удельной поверхности TiO2 и его Mn-модифицированных образцов от содержания марганца и от температуры термообработки (предел допускаемой относительной погрешности измерения удельной площади поверхности ±5%).

Текстура. Удельная поверхность Mn-модифицированных продуктов, как и чистого диоксида титана, с увеличением температуры термообработки закономерно снижается (рис. 5, табл. 1). Развитой поверхностью 202–479 м2/г и наноразмерным 11.4–4.8 нм характером частиц обладают рентгеноаморфные порошки. С началом образования фаз анатаза и рутила при температурах 500–550°С поверхность порошков сокращается до 120–160 м2/г при размерах кристаллитов 8.9–11.9 нм. По окончании формирования рутила и с обособлением Mn-содержащих фаз Mn2O3 или MnTiO3 при температурах 600–800°С удельная поверхность сокращается до 0.56–40 м2/г.
Из рис. 5 видно, что все образцы композитов TiO2/Mn обладают более развитой поверхностью, чем чистый TiO2 подобного генезиса.
Изотермы сорбции как рентгеноаморфных, так и кристаллических образцов, полученных в температурном интервале термообработки 20–500°С, представляют собой абсорбционно-десорбционные кривые S-образной формы с хорошо выраженными гистерезисными петлями (рис. 6), что указывает по классификации ИЮПАК [41] на мезопористый характер полученных продуктов.
Рис. 6.
Изотермы сорбции для Mn-модифицированных образцов диоксида титана, содержащих 1 (а), 5 (б), 30 мас. % Mn (в), прокаленных при различных температурах (цифры на кривых, °С) (предел допускаемой относительной погрешности ±5%).

Температурные зависимости объема (V), глубины (h) и диаметра (D) пор имеют довольно экстремальный характер (табл. 3). Максимальные значения h наблюдаются в области 600°С, а D – при 800°С. Глубина и диаметр пор у образцов с термической обработкой до 500°С имеют сопоставимые размеры. С повышением температуры более 600°С происходит опережающее увеличение диаметра пор относительно их глубины, что указывает на сглаживание поверхности.
Таблица 3.
Зависимость текстурных характеристик композитов на основе TiO2 и Mn от содержания марганца и температуры термообработки
| Образец | Фазовый состав (РФА) | S, м2/г | V, см3/г | h, нм | D, нм |
|---|---|---|---|---|---|
| 20-Mn-1 | ам | 303 | 0.2577 | 3.40 | 3.79 |
| 80-Mn-1 | ам | 395 | 0.2875 | 2.91 | 3.75 |
| 400-Mn-1 | ам | 250 | 0.272 | 4.41 | 4.14 |
| 500-Mn-1 | 69% а, 31% р | 125 | 0.269 | 8.59 | 7.22 |
| 600-Mn-1 | 66% а, 34% р | 16 | 0.041 | 10.44 | 11.44 |
| 800-Mn-1 | р | 0.9 | 0.0015 | 6.55 | 27.16 |
| 20-Mn-5 | ам | 458 | 0.3777 | 3.30 | 3.65 |
| 80-Mn-5 | ам | 430 | 0.3294 | 3.06 | 3.51 |
| 400-Mn-5 | ам | 272 | 0.317 | 4.67 | 4.27 |
| 500-Mn-5 | р | 160 | 0.3256 | 8.15 | 6.87 |
| 600-Mn-5 | р, MnTiO3 следы | 3.29 | 0.0078 | 9.47 | 16.55 |
| 800-Mn-5 | р, Mn2O3 | 0.56 | 0.00082 | 5.84 | 28.38 |
| 20-Mn-30 | ам | 876 | 0.9302 | 4.25 | 4.82 |
| 80-Mn-30 | ам | 479 | 0.5668 | 4.73 | 5.03 |
| 400-Mn-30 | ам | 276 | 0.507 | 7.35 | 6.61 |
| 500-Mn-30 | ам | 202 | 0.5179 | 10.28 | 8.84 |
| 600-Mn-30 | р, Mn2O3 | 40 | 0.151 | 15.26 | 16.93 |
| 800-Mn-30 | р, Mn2O3 | 5.37 | 0.0787 | 5.86 | 18.13 |
Зависимость изменения V микропор от температуры аналогична изменению удельной поверхности, что, вероятно, является следствием интенсивного удаления воды из оксогидроксидных продуктов гидролиза. В рентгеноаморфных продуктах (до 500°С) V составляет 0.25–0.93 см3/г, при этом он возрастает с увеличением содержания марганца и дисперсности порошка. С дальнейшим повышением температуры V резко сокращается, что связано с процессами кристаллизации, агрегации и, наконец, агломерации при температурах выше 800°С. Так, у образца 500-Mn-1 объем микропор составляет 0.2690 см3/г, а у 800-Mn-1 – всего 0.0015 см3/г. В то же время можно заметить, что повышение содержания Mn стабилизирует размеры микропор при повышенных температурах.
Таким образом, в системе Ti–O–Mn мезопористой структурой обладают как рентгеноаморфные, так и кристаллические полифазные композиты с удельной поверхностью от 49 до 876 м2/г. Мезопористые материалы рассматриваются как многообещающие катализаторы для превращений объемных органических молекул, так как наличие мезоразмерных пор поможет преодолеть ограничения по диффузии, характерные для микроразмерных пор.
ФКА изучена для образцов, термообработанных при 400–800°С, когда в большинстве случаев кристаллические фазы уже сформированы, S остается относительно высокой.
Введенный в диоксид титана марганец определяет его спектральную сенсибилизацию в видимую область света. Так, установлено, что все полученные материалы показывают более высокую ФКА, чем промышленный ФК (Р-25).
Представленные в табл. 4 и на рис. 7 изменения ФКА отражают совокупное влияние содержания модификатора, сочетания структурных компонентов и текстуры порошков, нелинейно зависящих от условий термообработки и объекта деградации. Например, не всегда высокие значения ФКА определяются более развитой поверхностью образцов, термообработанных при температуре 500 по сравнению с 600 и даже 800°С, что особенно наглядно проявляется на примере деградации анилина (рис. 7).
Таблица 4.
ФКА (E) композитов на основе TiO2 и Mn
| Образец | Фазовый состав | S, м2/г | Е, % при λ > 400 нм по | ||
|---|---|---|---|---|---|
| ферроину | МС | анилину | |||
| Р25 | 85% а, 15% р | 48.4 | 0 | 1.2 | 1.2 |
| 400-Mn-1 | ам | 246.9 | 25.9 | 58.6 | 8.3 |
| 500-Mn-1 | 69.3% а, 30.7% р | – | 3.5 | 3.2 | – |
| 600-Mn-1 | 66% а, 34% р | 16.0 | 2.5 | 3.6 | 34.1 |
| 800-Mn-1 | р | 0.90 | 6.9 | 0.8 | 45.9 |
| 400-Mn-5 | ам | 271.9 | 18.5 | 62.2 | 19.8 |
| 500-Mn-5 | р | – | 3.8 | 2.6 | – |
| 600-Mn-5 | р, MnTiO3 следы | 3.29 | 1.5 | 1.0 | 30.4 |
| 800-Mn-5 | р, Mn2O3 | 0.56 | 7.1 | 0.4 | 61.23 |
| 400-Mn-30 | ам | 276 | 16.5 | 41.6 | 10.1 |
| 500-Mn-30 | ам | – | 14.8 | 49.6 | – |
| 550-Mn-30 | р | – | 10.3 | – | |
| 600-Mn-30 | р, Mn2O3 | 39.7 | 3.6 | 2.2 | 14.21 |
| 800-Mn-30 | р, Mn2O3, MnTiO3 | 5.37 | 6.1 | 2.2 | 32.56 |
Рис. 7.
Зависимости ФКА (Е) Mn-модифицированных порошков диоксида титана от содержания Mn при различных температурах: а – ферроин, б – МС, в – анилин (пределы допускаемой абсолютной погрешности спектрофотометра при измерении коэффициентов направленного пропускания ±1%).

ФКА синтезированных продуктов сильно различается в зависимости от природы объектов разрушения. Так, степень деградации ферроина и МС при температуре термообработки >500°С не превышает 3.6%, тогда как в аналогичных условиях анилин разрушается практически полностью до 61%.
При этом отмечены следующие закономерности.
При температуре термообработки 400 оС ФКА в процессе деградации ферроина и МС (табл. 4, рис. 7) имеет довольно высокие значения, которые резко снижаются при увеличении температуры термообработки, исключением является образец, содержащий 30 мас. % Mn, ФКА которого сохраняется при 500–600°С. Напротив, при ФК-деструкции анилина все образцы проявляют низкую ФКА при температуре термообработки 400°С, увеличивающуюся с повышением температуры, с максимальными значениями при 800°С.
ФКА исследованных материалов носит селективный характер по отношению к различным красителям, что согласуется с данными [42–44]. Это с большой долей вероятности связано с различными значениями редокс-потенциалов разлагаемых объектов [45–47]. Заряд применяемых в качестве ФК материалов также различен. Влияние этих параметров на селективность и эффективность ФКА нуждается в дополнительных исследованиях.
Стоит также отметить, что синтезированные ФК-материалы на основе диоксида титана, модифицированного марганцем, согласно работе [32], могут быть перспективны в качестве анодного материала литий-ионных аккумуляторов, обладающих высокой обратимой и удельной емкостью.
ЗАКЛЮЧЕНИЕ
Синтезированы ФК-материалы на основе диоксида титана, модифицированного марганцем. Исследованы их физико-химические и фотокаталитические свойства, меняющиеся при изменении содержания марганца от 1 до 30 мас. % и температуры термообработки от 400 до 800°С.
Полученные ФК обладают более высокой ФКА в сравнении с промышленным фотокатализатором Р-25 фирмы Degussa при облучении видимым светом.
ФКА исследованных материалов носит избирательный характер в отношении различных красителей, что определяется, по-видимому, поверхностным зарядом материалов, а также редокс-потенциалами красителей.
Отмечена довольно высокая ФКА полученных материалов по отношению к анилину, увеличивающаяся по мере роста температуры термообработки синтезированных материалов.
Список литературы
Fujishima A., Honda K. Electrochemical Photolysis of Water at a Semiconductor Electrode // Nature. 1972. V. 238. № 5358. P. 37–38. https://doi.org/10.1038/238037a0
Dong H., Zeng G., Tang L., Fan C., Zhang C., He X. An Overview on Limitations of TiO2-Based Particles for Photocatalytic Degradation of Organic Pollutants and the Corresponding Countermeasures // Water. Res. 2015. V. 79. P. 128–146. https://doi.org/10.1016/j.watres.2015.04.038
Jiang L., Wang Y., Feng C. Application of Photocatalytic Technology in Environmental Safety // Procedia Eng. 2012. V. 45. P. 993–997. https://doi.org/10.1016/j.proeng.2012.08.271
Tasbihi M., Călin I., Šuligoj A., Fanetti M., Lavrenčič Štangar U. Photocatalytic Degradation of Gaseous Toluene by using TiO2 Nanoparticles Immobilized on Fiberglass Cloth // J. Photochem. Photobiol., A. 2017. V. 336. P. 89–97. https://doi.org/10.1016/j.jphotochem.2016.12.025
Bhattacharyya A., Kawi S., Ray M.B. Photocatalytic Degradation of Orange II by TiO2 Catalysts Supported on Adsorbents // Catal. Today. 2004. V. 98. № 3. P. 431–439. https://doi.org/10.1016/j.cattod.2004.08.010
Jacoby W.A., Maness P.C., Wolfrum E.J., Blake D.M., Fennell J.A. Mineralization of Bacterial Cell Mass on a Photocatalytic Surface in Air // Environ. Sci. Technol. 1998. V. 32. № 17. P. 2650–2653. https://doi.org/10.1021/es980036f
Caballero L., Whitehead K.A., Allen N.S., Verran J. Inactivation of Escherichia coli on Immobilized TiO2 Using Fluorescent Light // J. Photochem. Photobiol., A. 2009. V. 202. № 2. P. 92–98. https://doi.org/10.1016/j.jphotochem.2008.11.005
Liu H.-L., Yang Thomas C.-K. Photocatalytic Inactivation of Escherichia coli and Lactobacillus helveticus by ZnO and TiO2 Activated with Ultraviolet Light // Process Biochem. 2003. V. 39. № 4. P. 475–481. https://doi.org/10.1016/S0032-9592(03)00084-0
Burton P., Peterson E., Boyle T. et al. Synthesis of High Surface Area ZnO(0001) Plates as Novel Oxide Supports for Heterogeneous Catalysts // Catal. Lett. 2010. V. 139. № 1. P. 26–32. https://doi.org/10.1007/s10562-010-0405-1
Bignozzi C.A., Caramori S., Cristino V. et al. Nanostructured Photoelectrodes Based on WO3: Applications to Photooxidation of Aqueous Electrolytes // Chem. Soc. Rev. 2013. V. 42. № 6. P. 2228–2246. https://doi.org/10.1039/c2cs35373c
Tian L., Ye L., Liu J. et al. Solvothermal Synthesis of CNTs–WO3 Hybrid Nanostructures with High Photocatalytic Activity under Visible Light // Catal. Commun. 2012. V. 17. P. 99–103. https://doi.org/10.1016/j.catcom.2011.10.023
Franking R., Li L., Lukowski M.A. et al. Facile Post-Growth Doping of Nanostructured Hematite Photoanodes for Enhanced Photoelectrochemical Water Oxidation // Energy Environ. Sci. 2013. V. 6. № 2. P. 500–512. https://doi.org/10.1039/C2EE23837C
Bang J.U., Lee S.J., Jang J.S. et al. Geometric Effect of Single or Double Metal-Tipped CdSe Nanorods on Photocatalytic H2 Generation // J. Phys. Chem. Lett. 2012. V. 3. № 24. P. 3781–3785. https://doi.org/10.1021/jz301732n
Wang J., Yin S., Zhang Q. et al. Mechanochemical Synthesis of Fluorine-Doped SrTiO3 and Its Photo-Oxidation Properties // Chem. Lett. 2003. V. 32. № 6. P. 540–541. https://doi.org/10.1246/cl.2003.540
Kirovskaya I.A., Timoshenko O.T., Karpova E.O. The Catalytic and Photocatalytic Properties of InP-CdS and ZnTe-CdS System Components // Russ. J. Phys. Chem. A. 2011. V. 85. № 4. P. 557–560. https://doi.org/10.1134/S0036024411030186
Phuruangrat A., Sakhon T., Kuntalue B. et al. Characterization of Visible-Light-Induced BiVO4 Photocatalyst Synthesized by Chemical Combustion Method Fueled by Tartaric Acid // Russ. J. Inorg. Chem. 2021. V. 66. P. 1829–1836. https://doi.org/10.1134/S0036023621120135
Chomkitichai W., Jansanthea P., Channei D. Photocatalytic Activity Enhancement in Methylene Blue Degradation by Loading Ag Nanoparticles onto α-Fe2O3 // Russ. J. Inorg. Chem. 2021. V. 66. P. 1995–2003. https://doi.org/10.1134/S0036023621130027
Dongmei He, Du L., Wang K. et al. Efficient Process of ALD CuO and Its Application in Photocatalytic H2 Evolution // Russ. J. Inorg. Chem. 2021. V. 66. P. 1986–1994. https://doi.org/10.1134/S0036023621130040
Dumrongrojthanath P., Phuruangrat A., Sakhon T. et al. Effect of Gd Dopant on Visible-Light-Driven Photocatalytic Properties of CeO2 Nanowires Synthesized Microwave-Assisted Hydrothermal Method // Russ. J. Inorg. Chem. 2022. V. 67. P. 1880–1887. https://doi.org/10.1134/S0036023622600757
Shtareva A.V., Shtarev D.S., Balanov M.I. et al. Bismuthyl Carbonate Heterostructures Are a Way to Enhance the Photocatalytic Activity of Alkaline-Earth Bismuthates // Russ. J. Inorg. Chem. 2022. V. 67. P. 1375–1385. https://doi.org/10.1134/S0036023622090157
Shtarev D.S., Shtareva A.V., Petrova A.Y. Effects of the Dopant Type and Concentration on the Photocatalytic Activity of Strontium Bismuthate Sr2Bi2O5 // Russ. J. Inorg. Chem. 2022. V. 67. P. 1368–1374. https://doi.org/10.1134/S0036023622090145
Bhatkhande D.S., Pangarkar V.G., Beenackers A.A.C.M. Photocatalytic Degradation for Environmental Applications – a Review // J. Chem. Technol. Biotechnol. 2002. V. 77. № 1. P. 102–116. https://doi.org/10.1002/jctb.532
Yu J.C., Ho W., Yu J., Yip H., Wong P.K., Jincai Z. Efficient Visible-Light-Induced Photocatalytic Disinfection on Sulfur-Doped Nanocrystalline Titania // Environ. Sci. Technol. 2005. V. 39. № 4. P. 1175–1179. https://doi.org/10.1021/es035374h
Wang W., Huang G., Yu J.C., Wong P.K. Advances in Photocatalytic Disinfection of Bacteria: Development of Photocatalysts and Mechanisms // J. Environ. Sci. 2015. V. 34. P. 232–247. https://doi.org/10.1016/j.jes.2015.05.003
Karvinen S.M. The Effects of Trace Element Doping on the Optical Properties and Photocatalytic Activity of Nanostructured Titanium Dioxide // Ind. Eng. Chem. Res. 2003. V. 42. № 5. P. 1035–1043. https://doi.org/10.1021/ie020358z
Szczepanik B. Photocatalytic Degradation of Organic Contaminants over Clay-TiO2 Nanocomposites: A Review // Appl. Clay Sci. 2017. V. 141. P. 227–239. https://doi.org/10.1016/j.clay.2017.02.029
Khan H., Berk D. Synthesis, Physicochemical Properties and Visible Light Photocatalytic Studies of Molybdenum, Iron and Vanadium Doped Titanium Dioxide // React. Kinet. Mech. Catal. 2014. V. 111. № 1. P. 393–414. https://doi.org/10.1007/s11144-013-0637-3
Devi L.G., Nagaraju K., Murthy B.N., Girish K.S. Enhanced Photocatalytic Activity of Transition Metal Ions Mn2+, Ni2+ and Zn2+ Doped Polycrystalline Titania for the Degradation of Aniline Blue under UV/Solar Light // J. Mol. Catal. A. 2010. V. 328. № 1–2. P. 44–52. https://doi.org/10.1016/j.molcata.2010.05.021
Anpo M. Use of visible Light. Second-Generation Titanium Oxide Photocatalysts Prepared by the Application of an Advanced Metal Ion-Implantation Method // Pure Appl. Chem. 2000. V. 72. № 9. P. 1787–1792. https://doi.org/10.1351/pac200072091787
Brus V.V., Kovalyuk Z.D., Maryanchuk P.D. Optical Properties of TiO2–MnO2 thin Films Prepared by Electron-Beam Evaporation // Tech. Phys. 2012. V. 57. № 8. P. 1148–1151. https://doi.org/10.1134/S1063784212080063
Ivanova T., Harizanova A. Characterization of TiO and TiO–MnO Oxides Prepared by Sol–gel Method // Solid State Ionics. 2001. V. 138. P. 227–232. https://doi.org/10.1016/S0167-2738(00)00798-0
Опра Д.П., Гнеденков С.В., Синебрюхов С.Л. и др. Легированный марганцем диоксид титана с улучшенными электрохимическими характеристиками для литий-ионных аккумуляторов // Электрохимическая энергетика. 2019. Т. 19. № 3. С. 123–140. https://doi.org/10.18500/1608-4039-2019-19-3-123-140
Беликов М.Л., Седнева Т.А., Локшин Э.П. Адсорбционные и фотокаталитические свойства диоксидa титана, модифицированного вольфрамом // Неорган. материалы. 2021. Т. 47. № 2. С. 154–162. https://doi.org/10.31857/S0002337X21020020
Jin Q., Arimoto H., Fujishima M., Tada H. Manganese Oxide-Surface Modified Titanium (IV) Dioxide as Environmental Catalyst // Catalysts. 2013. V. 3. № 2. P. 444–454. https://doi.org/10.3390/catal3020444
Седнева Т.А., Локшин Э.П., Беликов М.Л., Калинников В.Т. Способ получения фотокаталитического нанокомпозита, содержащего диоксид титана: Пат. № 2435733 РФ. 2011. БИ № 34.
Седнева Т.А., Локшин Э.П., Беликов М.Л., Беляевский А.Т. Синтез и исследования фотокаталитических оксидных композитов титана(IV) и кобальта(II) // Хим. технология. 2015. Т. 16. № 7. С. 398–407.
Matthews R.W., McEvoy S.R. Destruction of Phenol in Water with Sun, Sand, and Photocatalysis // Sol. Energy. 1992. V. 49. № 6. P. 507–513. https://doi.org/10.1016/0038-092X(92)90159-8
Иванова В.П., Касатов Б.К., Красавина Т.Н., Розинова Е.Л. Термический анализ минералов и горных пород. Л.: Недра, 1974. С. 47.
Liptay G. Atlas of Thermoanalytical Curves. Budapest: Academiai Kiado, 1973. V. 2. P. 78.
Казенас К.Е., Цветков Ю.В. Испарение оксидов. М.: Наука, 1997. 543 с.
Грег С., Синг К. Адсорбция. Удельная поверхность, пористость. М.: Мир, 1984. 306 с.
Parida K.M., Sahu N. Visible Light Induced Photocatalytic Activity of Rare Earth Titania Nanocomposites // J. Mol. Catal. A. 2008. V. 287. № 1–2. P. 151–158. https://doi.org/10.1016/j.molcata.2008.02.028
Агафонов А.В., Редозубов А.А., Козик В.В., Краев А.С. Фотокаталитическая активность нанопорошков диоксида титана, полученных золь-гель методом при различных значениях рН // Журн. неорган. химии. 2015. Т. 60. № 8. С. 1001–1008. https://doi.org/10.7868/S0044457X15080024
Степанов А.Ю., Сотникова Л.В., Владимиров А.А. и др. Синтез и исследование фотокаталитических свойств материалов на основе TiO2 // Вестн. Кемеровского гос. ун-та. 2013. Т. 1. № 2. С. 249–255.
Sabnis R.W., Ross E., Köthe J., Naumann R. et al. Indicator Reagents // Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley, 2009. V. 19. P. 9–53. https://doi.org/10.1002/14356007.a14_127.pub2
Наянова Е.В., Елипашева Е.В., Сергеев Г.М., Сергеева В.П. Редокс-свойства метиленового голубого как перспективного фотометрического реагента для определения галогенных окислителей // Аналитика и контроль. 2015. Т. 19. № 2. С. 154–160. https://doi.org/10.15826/analitika.2015.19.2.005
Вакулин И.В., Бугаец Д.В., Зильберг Р.А. Анализ точности расчета Rеd/Оx потенциалов замещенных фенолов, хинонов, и анилинов полуэмпирическими методами АМ1, RM1 и РM7 // Бутлеровские сообщения. 2017. Т. 52. № 11. С. 53–59. https://doi.org/10.37952/ROI-jbc-01/17-52-11-53
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


