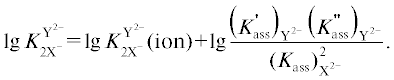Журнал аналитической химии, 2020, T. 75, № 6, стр. 496-501
Анионообменная экстракция двухзарядных анионов растворами высших четвертичных аммониевых солей с различной стерической доступностью обменного центра
Ю. В. Матвейчук a, *, Д. В. Станишевский a
a Белорусский государственный университет, химический факультет
220030 Минск, ул. Ленинградская, 14, Беларусь
* E-mail: Yu_Matveychuk@mail.ru
Поступила в редакцию 14.12.2018
После доработки 21.04.2019
Принята к публикации 05.11.2019
Аннотация
Установлено, что увеличение стерической доступности обменного центра четвертичных аммониевых солей (ЧАС) приводит к существенному возрастанию константы обмена для большинства изученных двухзарядных анионов (сульфат-, сульфит-, молибдат-, вольфрамат-, гидрофосфат-, селенат-), достигающему для “чисто” анионообменных систем более чем 5 порядков. Обнаружен эффект нивелирования анионообменного сродства при введении в органическую фазу сольватирующей добавки – гептилового эфира п-трифторацетилбензойной кислоты. Эффект стерической доступности утрачивается не полностью, что обусловлено сохранением заряда у сольвата. Введение сольватирующей добавки позволяет существенно (до 6.5 порядков) улучшить сродство анионов к фазе ЧАС. Обнаружено влияние размера аниона на величину эффекта стерической доступности обменного центра для сульфат-, сульфит-, тиосульфат-ионов. Для тетратионат-иона обнаружена обратная зависимость, т.е. с уменьшением стерической доступности обменного центра ЧАС происходит ослабление анионообменной экстракции, что обусловлено большим размером иона ${{{\text{S}}}_{{\text{4}}}}{\text{O}}_{6}^{{2-}}.$
Анионообменная экстракция высшими четвертичными аммониевыми солями находит широкое применение в технологии цветных металлов, редких и рассеянных элементов и др. областях. Высшие ЧАС также зарекомендовали себя как перспективные аналитические реагенты для экстракционно-фотометрических определений гидрофобных анионов, включая металлокомплексные, и создания анионселективных электродов [1–4].
Известно, что анионообменная экстракция двухзарядных анионов высшими ЧАС протекает незначительно [5], в связи с чем экстрагенты данного класса редко используют для их выделения и определения. Поиск экстрагентов для гидрофильных двухзарядных анионов, которые с трудом концентрируются и определяются, – актуальная задача.
Одним из путей улучшения экстракционных характеристик анионообменных систем на основе высших ЧАС является использование нейтральных переносчиков кислотного характера. Известно [6, 7], что трифторацетилпроизводные проявляют высокую сольватирующую способность по отношению к карбонат- и карбоксилат-ионам, их также используют и при изучении возможности экстракции и других анионов [1, 8, 9]. Влияние концентрации гексилового эфира п-трифторацетилбензойной кислоты на анионообменную экстракцию сульфат-, ацетат-, бензоат-, оксалат-, карбонат-, о-бромбензоат-, о-бензоилбензоат-ионов изучали в работах [5, 10, 11].
Целенаправленное использование анионообменных экстракционных систем как в аналитических, так и в прикладных целях должно основываться на ряде анионообменного сродства, в котором анионы расположены в соответствии с величинами констант обмена на стандартный анион, в качестве которого обычно используют хлорид. Однако некоторые двухзарядные анионы отсутствуют в ряде Гофмейстера: ${\text{ClO}}_{4}^{--}$ > SCN– > ${\text{BF}}_{4}^{--}$ > I– > ${\text{NO}}_{3}^{--}$ > Br–> Cl > > Ac– > ${\text{SO}}_{4}^{{2--}}$ > F– > ${{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{4}^{--}$ > ${{{\text{С}}}_{{\text{2}}}}{\text{О}}_{4}^{{2--}}$ > ${\text{НСО}}_{3}^{--}$ > > ${\text{HPO}}_{4}^{{2--}}$ > ${\text{СО}}_{3}^{{2--}}$ > ${\text{PO}}_{4}^{{3--}}$ > ОН– [12, 13].
Для определения констант обмена ранее предложен метод промежуточного аниона [14, 15], в качестве которого используют подходящий кислотный краситель, например метиловый красный (МК) в солевой (натриевой) форме (МК–Na+).
Цель данной работы – изучить влияние стерической доступности обменного центра высших ЧАС на анионообменное сродство двухзарядных анионов (сульфат-, сульфит-, тиосульфат-, тетратионат-, молибдат-, вольфрамат-, гидрофосфат-, селенат-ионов) на хлорид-ион методом промежуточного иона как в “чисто” анионообменных системах, так и в присутствии сольватирующей добавки – гептилового эфира п-трифторацетилбензойной кислоты. Кроме того, рассмотрен вопрос влияния размера двухзарядного неорганического аниона на величину эффекта стерической доступности обменного центра ЧАС.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Экстракцию изучали при температуре 298 ± 1 К. Использовали следующие высшие ЧАС, синтез которых описан в работах [16, 17], а графические структурные формулы представлены на схеме 1 : – бромиды R-трибутиламмония, R-триэтиламмония, R-триметиламмония, где R – 3,4,5-трис(додецилокси)бензил; иодид тринонилоктадециламмония; хлорид 4-(3,4-дицетоксифенил)бутилтриметиламмония.
Схема 1 . Структурные формулы катионов четвертичных аммониевых солей: тринонилоктадециламмония (ТНОДА), 3,4,5-трис(додецилокси)бензилтрибутиламмония (ТБ), 3,4,5-трис(додецилокси)бензилтриэтиламмония (ТЭ), 3,4,5-трис(додецилокси)бензилтриметиламмоний (ТМ), 4-(3,4-дицетоксифенил)бутилтриметиламмония (ДЦФБТМ).
Все высшие ЧАС очищали в экстракционной системе гексан–ацетонитрил/изопропиловый спирт. Выбранные ЧАС существенно отличаются по стерической доступности обменного центра (четвертичного атома азота), так как содержат при нем углеводородные радикалы различной длины от С1 до С9.
Использовали метиловый красный ч. д. а., толуол ч. д. а., NaCl х. ч., NaOH (фиксанал), (NH4)2SO4 х. ч., Na2SO4 ч. д. а., Na2SO3 ч. д. а., Na2S2O3 ⋅ 5H2O ч. д. а., Na2S4O6 (синтезирован по методике [18]), Na2MoO4 ⋅ 2H2O х. ч., Na2WO4 ⋅ 2H2O х. ч., Na2HPO4 ⋅ 12H2O ч. д. а., Na2SeO4 ч., аммиак водный ос. ч.
Гептиловый эфир п-трифторацетилбензойной кислоты (ГЭ п-ТФАБК), был синтезирован на кафедре аналитической химии БГУ по методике [16].
Экстракцию проводили в пробирках с пришлифованными пробками. Органическая фаза экстракционной системы представляла собой растворы ЧАС+МК– (с = 0.001 М) в толуоле, водная фаза – растворы соответствующих солей с концентрацией от 5 × 10–4 до 1.0 М. рН в растворах всех солей поддерживали на уровне 9.8 ± 0.1, так как предварительно было установлено, что коэффициент распределения Р для МК в системе толуол–вода имеет постоянное значение 2 × 103 при рН > 9.5.
После установления концентрационного равновесия и расслаивания фазы экстракционной системы анализировали на содержание красителя фотометрически (спектрофлуориметр Solar СМ2203) при 410 и 435 нм для органической и водной фаз соответственно. Значение молярного коэффициента поглощения для водного раствора МК составляет 2 × 104, для толуольного раствора ЧАС+МК– – (6.2 ± 0.2) × 103.
Перевод ЧАС в форму ЧАС+МК– осуществляли следующим образом: 100 мл 0.001 М толуольного раствора ЧАС+Cl– обрабатывали несколько раз по 100 мл 0.005 М раствора МК–Na+ в делительной воронке (полноту перевода ЧАС в форму ЧАС+МК– контролировали фотометрически до постоянства оптической плотности). Если ЧАС находились в бромидной или иодидной формах, то 100 мл их толуольных растворов предварительно обрабатывали 4 раза по 20 мл 5 М раствора NaCl, а затем промывали три раза по 100 мл дистиллированной воды.
Основная реакция анионообменной экстракции описывается уравнением:
(1)
${\text{2ЧА}}{{{\text{С}}}^{ + }}{\text{М}}{{{\text{К}}}^{--}} + {\text{A}}{{{\text{n}}}^{{{\text{2}}--}}} \leftrightarrow {{\left( {{\text{ЧА}}{{{\text{С}}}^{ + }}} \right)}_{{\text{2}}}}{\text{A}}{{{\text{n}}}^{{{\text{2}}--}}} + {\text{2М}}{{{\text{К}}}^{--}}.$Константы обмена анионов на стандартный хлорид-ион рассчитывали по соотношению:
(2)
$K_{{{\text{2C}}{{{\text{l}}}^{ - }}}}^{{{\text{A}}{{{\text{n}}}^{{{\text{2}} - }}}}} = \frac{{{{{{\text{[(}}{{{\text{R}}}_{{\text{3}}}}{\text{R}}{\kern 1pt} {\text{'}}{{{\text{N}}}^{{\text{ + }}}}{{{\text{)}}}_{{\text{2}}}}{\text{A}}{{{\text{n}}}^{{{\text{2}} - }}}{\text{]}}}}_{{{\text{org}}}}}{\text{[C}}{{{\text{l}}}^{ - }}{\text{]}}_{{{\text{aq}}}}^{{\text{2}}}}}{{{\text{[}}{{{\text{R}}}_{{\text{3}}}}{\text{R}}{\kern 1pt} {\text{'}}{{{\text{N}}}^{{\text{ + }}}}{\text{C}}{{{\text{l}}}^{ - }}{\text{]}}_{{{\text{aq}}}}^{{\text{2}}}{{{{\text{[A}}{{{\text{n}}}^{{{\text{2}} - }}}{\text{]}}}}_{{{\text{aq}}}}}}}.$Существует возможность комплексообразования катионов натрия и двухзарядных анионов. Так, рK комплекса ${\text{NaSO}}_{4}^{--}$ равен 0.72, а комплекса ${\text{Na}}{{{\text{S}}}_{{\text{2}}}}{\text{O}}_{3}^{--}$ – 1.08 [19]. В связи с этим провели предварительные исследования, в которых варьировали концентрации двухзарядных анионов, особенно сульфата и тиосульфата. В работе [20] для изучения анионообменных равновесий с участием сульфат-ионов использовали их постоянную концентрацию 0.9 M. Установлено, что при одинаковых концентрациях сульфата натрия и сульфата аммония (например, 0.1 М) в случае (NH4)2SO4 сульфат-ионами вытесняется в 1.5–2 раза больше ионов МК– из органической фазы по сравнению с Nа2SO4. По данным [3], комплексный ион ${\text{NaSO}}_{4}^{--}$ практически не экстрагируется ЧАС. Данных по константам нестойкости комплексов катиона аммония с изучаемыми анионами не найдено.
Установлено, что постоянные значения констант обмена K(An2–/2Cl–) достигаются для концентраций ионов An2– менее 5 × 10–3 М, что обусловлено уменьшением эффекта комплексообразования и, соответственно, увеличением активности обменивающихся анионов (следует отметить, что заметное влияние ионной силы на константы обмена для однозарядных ионов отсутствует [3]).
Зависимость константы обмена (для сульфат-ионов) от концентрации соли (ионной силы раствора, μ) описывается уравнением [3]:
(3)
$\lg K_{{{\text{2C}}{{{\text{l}}}^{ - }}}}^{{{\text{'SO}}_{{\text{4}}}^{{2 - }}}} = \lg K_{{{\text{2C}}{{{\text{l}}}^{ - }}}}^{{{\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}}} + 2.27\frac{{\sqrt {\mu } }}{{1 + \sqrt {\mu } }},$В настоящей работе мы приводим концентрационные константы обмена, не учитывающие изменение концентраций двухзарядных ионов за счет образования комплексов Na+ с An2–, поскольку значения констант нестойкости комплексов Na+ с An2–, возможно, не являются достоверными (или таковые отсутствуют). Видимо, эти константы рассчитаны по изменению общей активности частиц в растворах соответствующих сульфатов или тиосульфатов [19]. Кроме того, сложно учитывать коэффициенты активности Na+, ${\text{SO}}_{4}^{{2--}},$ ${{{\text{S}}}_{{\text{2}}}}{\text{O}}_{3}^{{2--}},$ ${\text{NaSO}}_{4}^{--}$ и др. на фоне комплексообразования.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Константы обмены двухзарядных анионов на хлорид-ион для “чисто” анионообменных систем. Значения констант обмена K(Cl–/МК–) для различных ЧАС представлены ниже (с(Cl–) = 0.001 М):
В табл. 1 представлены значения констант обмена K(An2–/2Cl–) в зависимости от природы высшей ЧАС. Как видно, константы обмена сильно зависят от природы ЧАС, используемой в качестве анионообменника. Все ЧАС имеют радикалы достаточной длины для предотвращения их растворения в воде. В связи с этим зависимость K(An2–/2Cl–) от природы ЧАС нельзя объяснить изменением концентрации экстрагента или продукта экстракции.
Таблица 1.
Значения логарифмов констант обмена K(An2–/2Cl–) для различных высших четвертичных аммониевых солей (${{c}_{{{\text{A}}{{{\text{n}}}^{{2 - }}}}}}$ = 0.001 М)
| Анион | ТНОДА | ТБ | ТЭ | ТМ | ДЦФБТМ |
|---|---|---|---|---|---|
| ${\text{SO}}_{4}^{{2 - }}$ | –2.4 | –2.0 | –0.3 | 1.2 | 2.0 |
| ${\text{SO}}_{3}^{{2 - }}$ | –3.5 | –3.0 | –0.8 | 1.0 | 1.9 |
| ${{{\text{S}}}_{2}}{\text{O}}_{3}^{{2 - }}$ | –2.1 | –1.9 | –0.9 | 0.2 | 0.6 |
| ${{{\text{S}}}_{4}}{\text{O}}_{6}^{{2 - }}$ | –1.9 | –2.2 | –2.9 | –3.3 | –3.6 |
| ${\text{MoO}}_{4}^{{2 - }}$ | –3.9 | –3.7 | –2.7 | –1.4 | –1.0 |
| ${\text{WO}}_{4}^{{2 - }}$ | –5.0 | –4.8 | –4.0 | –3.1 | –2.6 |
| ${\text{HPO}}_{4}^{{2 - }}$ | –3.0 | –2.7 | –1.1 | 0.4 | 0.8 |
| ${\text{SeO}}_{4}^{{2 - }}$ | –2.9 | –2.5 | –0.1 | 1.6 | 2.2 |
Наблюдаемые эффекты можно объяснить особенностями ионной ассоциации катионов ЧАС с обменивающимися анионами [4, 20–22]. Для однозарядных анионов процесс ассоциации протекает в соответствии с уравнением:
(4)
${{{\text{R}}}_{{\text{4}}}}{{{\text{N}}}^{{\text{ + }}}}{\text{ + }}{{{\text{X}}}^{ - }}\overset {{{{{\text{(}}{{K}_{{{\text{ass}}}}}{\text{)}}}}_{{{{{\text{X}}}^{ - }}}}}} \longleftrightarrow {{{\text{R}}}_{{\text{4}}}}{{{\text{N}}}^{{\text{ + }}}}{{{\text{X}}}^{ - }}.$Для двухзарядных анионов процесс ассоциации идет в две стадии:
(5)
${{{\text{R}}}_{{\text{4}}}}{{{\text{N}}}^{{\text{ + }}}}{\text{ + }}{{{\text{Y}}}^{{2 - }}}\overset {{{{\left( {K_{{{\text{ass}}}}^{{\text{'}}}} \right)}}_{{{{{\text{Y}}}^{{{\text{2}} - }}}}}}} \longleftrightarrow {{{\text{(}}{{{\text{R}}}_{{\text{4}}}}{{{\text{N}}}^{{\text{ + }}}}{{{\text{Y}}}^{{2 - }}}{\text{)}}}^{ - }},$(6)
${{{\text{(}}{{{\text{R}}}_{{\text{4}}}}{{{\text{N}}}^{{\text{ + }}}}{{{\text{Y}}}^{{2 - }}}{\text{)}}}^{ - }}{\text{ + }}\,{{{\text{R}}}_{{\text{4}}}}{{{\text{N}}}^{{\text{ + }}}}\overset {{{{(K_{{{\text{ass}}}}^{{''}})}}_{{{{{\text{Y}}}^{{{\text{2}} - }}}}}}} \longleftrightarrow {{{\text{(}}{{{\text{R}}}_{{\text{4}}}}{\text{N)}}}_{{\text{2}}}}{{{\text{Y}}}^{{2 - }}},$Тогда с учетом протекания процессов ассоциации константу обмена однозарядных анионов на двухзарядные можно записать в виде:
Согласно теории Фуосса значения констант ионной ассоциации зависят от зарядов ассоциирующих ионов (z), их эффективных размеров (a) и диэлектрической проницаемости растворителя (ε):
(8)
$\lg {{K}_{{{\text{ass}}}}} = {{2.6 + 243\left| {{{z}_{{{\text{A}}{{{\text{n}}}^{{{\text{2}} - }}}}}}{{z}_{{{{{\text{R}}}_{{\text{4}}}}{{{\text{N}}}^{ + }}}}}} \right|} \mathord{\left/ {\vphantom {{2.6 + 243\left| {{{z}_{{{\text{A}}{{{\text{n}}}^{{{\text{2}} - }}}}}}{{z}_{{{{{\text{R}}}_{{\text{4}}}}{{{\text{N}}}^{ + }}}}}} \right|} {{\varepsilon }a + 3\lg a}}} \right. \kern-0em} {{\varepsilon }a + 3\lg a}}.$Анализ уравнения (8) позволяет объяснить влияние природы катиона ЧАС на относительную эффективность взаимодействия с одно- и двухзарядными анионами. Согласно данным [4] в случае контактных ионных пар, когда между ассоциированными ионами отсутствуют молекулы растворителя, значения параметров ближайшего подхода а между катионом ЧАС и анионом обычно находятся в пределах 4–8 Å. Таким образом, в растворителях с низкой ε (2.4 для толуола) определяющий вклад в величину константы ионной ассоциации вносит второе слагаемое уравнения (8). В результате улучшение стерической доступности обменного центра ЧАС, сопровождающееся уменьшением параметра ближайшего подхода а, должно приводить к возрастанию констант ионной ассоциации. Из уравнения (8) также следует, что при сопоставимых размерах одно- и двухзарядных анионов влияние стерической доступности обменного центра ЧАС на величину первой константы ассоциации катиона ЧАС с двухзарядным анионом $(K_{{{\text{ass}}}}^{'})_{{\text{Y}}}^{{{\text{2}} - }}$ должно быть гораздо сильнее, чем на величину константы ассоциации с однозарядным анионом $({{K}_{{{\text{ass}}}}})_{{\text{X}}}^{ - }$ из-за большей величины заряда zY2-.
При использовании ЧАС с четырьмя длинноцепочечными заместителями ионная ассоциация
с двухзарядным анионом по второй стадии (уравнение (6)) существенно затруднена в силу стерических препятствий. Улучшение стерической доступности
обменного центра должно сопровождаться резким уменьшением параметра ближайшего подхода
второго катиона ЧАС к отрицательно заряженному ассоциату [ЧАС+Y2–]–. В результате возрастание второй константы ассоциации  может оказаться более значительным, чем увеличение $({{K}_{{{\text{ass}}}}})_{{\text{X}}}^{ - }$ для однозарядных анионов, для которых стерическая доступность обменного центра ЧАС
в меньшей степени влияет на величину а.
может оказаться более значительным, чем увеличение $({{K}_{{{\text{ass}}}}})_{{\text{X}}}^{ - }$ для однозарядных анионов, для которых стерическая доступность обменного центра ЧАС
в меньшей степени влияет на величину а.
Поскольку параметр ближайшего подхода а является в первом приближении аддитивной функцией радиусов аниона и катиона [22], очевидно, что влияние стерической доступности обменного центра ЧАС на величины констант ассоциации определяется размерами ассоциирующих анионов [23]. В частности, на примере однозарядных анионов показано [4], что более выраженные эффекты изменения величин констант ассоциации наблюдаются в случае анионов меньшего размера [23], что обусловливает нивелирование констант обмена.
Константы обмены двухзарядных анионов на хлорид-ион для анионообменных систем, содержащих сольватирующую добавку – гептиловый эфир п-трифторацетилбензойной кислоты. Значения констант обмена К(Cl–/МК–) для различных высших ЧАС (растворитель – толуол, с(ГЭ п-ТФАБК) = 1 × 10–2 М) представлены ни-же:
в табл. 2 представлены значения констант обмена к(an2–/2cl–) в зависимости от природы высшей час. видно, что введение сольватирующей добавки приводит, с одной стороны, к существенному увеличению констант обмена, а с другой, к их сильному нивелированию. например, для сульфит-, молибдат-, вольфрамат-ионов увеличение констант обмена достигает 5.5, 5.9, 6.5 порядков величины соответственно (ионообменник – тнода).
Таблица 2.
Значения констант обмена K(An2–/2Cl–) для различных высших четвертичных аммониевых солей (сГЭп-ТФАБК = 0.002 М)
| Анион | ТНОДА | ТБ | ТЭ | ТМ | ДЦФБТМ |
|---|---|---|---|---|---|
| ${\text{SO}}_{4}^{{2 - }}$ | 2.6 | 2.7 | 3.2 | 3.6 | 3.9 |
| ${\text{SO}}_{3}^{{2 - }}$ | 2.0 | 2.3 | 3.1 | 3.4 | 3.6 |
| ${{{\text{S}}}_{2}}{\text{O}}_{3}^{{2 - }}$ | 1.7 | 1.9 | 2.4 | 2.6 | 2.6 |
| ${{{\text{S}}}_{4}}{\text{O}}_{6}^{{2 - }}$ | –0.5 | –0.7 | –1.0 | –1.3 | –1.3 |
| ${\text{MoO}}_{4}^{{2 - }}$ | 2.0 | 2.0 | 2.4 | 2.6 | 2.6 |
| ${\text{WO}}_{4}^{{2 - }}$ | 1.5 | 1.5 | 1.8 | 2.0 | 2.1 |
| ${\text{HPO}}_{4}^{{2 - }}$ | 2.2 | 2.2 | 2.5 | 2.8 | 2.9 |
| ${\text{SeO}}_{4}^{{2 - }}$ | 2.8 | 2.9 | 3.4 | 3.8 | 4.2 |
Так, например, для сульфит-ионов в ряду ТНОДА–ТБ–ТЭ–ТМ–ДЦФБТМ константа обмена увеличивается на 1.4 порядка (табл. 2), тогда как в отсутствие ГЭ п-ТФАБК в органической фазе эффект стерической доступности достигает 5.4 порядков (табл. 1). Видимо, образование сольватной оболочки вокруг каждого из изучаемых анионов приводит к нивелированию эффекта стерической доступности ЧАС. Вместе с тем эффект проявляется, что обусловлено сохранением заряда сольвата –2.
Влияние размера двухзарядного неорганического аниона на величину эффекта стерической доступности высших четвертичных аммониевых солей. Данные табл. 1 и 2 также отражают влияние размера двухзарядного аниона на эффект стерической доступности обменного центра ЧАС. Ниже приведены радиусы серосодержащих двухзарядных анионов [23–25]:
| Ион | ${\text{SO}}_{{\text{3}}}^{{{\text{2}}--}}$ | ${\text{SO}}_{{\text{4}}}^{{{\text{2}}--}}$ | ${{{\text{S}}}_{{\text{2}}}}{\text{O}}_{{\text{3}}}^{{{\text{2}}--}}$ | ${{{\text{S}}}_{{\text{4}}}}{\text{O}}_{{\text{6}}}^{{{\text{2}}--}}$ |
|---|---|---|---|---|
| Радиус, нм | 0.204 | 0.218 | 0.251 | 0.325 |
Видно, что в ряду анионов ${\text{SO}}_{{\text{3}}}^{{{\text{2}}--}}$–${\text{SO}}_{{\text{4}}}^{{{\text{2}}--}}$–${{{\text{S}}}_{{\text{2}}}}{\text{O}}_{{\text{3}}}^{{{\text{2}}--}}$ происходит нивелирование эффектов, связанных с увеличением стерической доступности обменного центра как для “чисто” анионообменных систем (табл. 1), так и в присутствии в органической фазе сольватирующей добавки (табл. 2). Например, в ряду ТНОДА–ТБ–ТЭ–ТМ–ДЦФБТМ для сульфит-иона константа обмена увеличивается на 5.4 порядка, для сульфат-иона – на 4.4 порядка, для тиосульфат-иона – на 2.7 порядка (табл. 1).
Для ${{{\text{S}}}_{{\text{4}}}}{\text{O}}_{{\text{6}}}^{{{\text{2}}--}}$-иона обнаружена обратная зависимость: при переходе от ТНОДА к ДЦФБТМ происходит ослабление анионообменной экстракции, что обусловлено большим размером иона ${{{\text{S}}}_{{\text{4}}}}{\text{O}}_{{\text{6}}}^{{{\text{2}}--}},$ который, согласно теории Фуосса, должен проявлять более высокое анионообменное сродство к стерически затрудненным ЧАС. Проявление такого анионообменного сродства тетратионат-ионами аналогично поведению больших по размеру металлокомплексных анионов [25–27].
Список литературы
Matveichuk Yu., Rakhman’ko E., Akayeu Ya., Stanishevskii D. Ion-selective electrodes based on long-chain quaternary ammonium salts with enhanced steric accessibility, and their application for determination of hydrophilic double-charged inorganic anion // Chem. Papers. 2018. V. 72. № 3. P. 731.
Матвейчук Ю.В., Рахманько Е.М. Высшие четвертичные аммониевые соли со стерически затрудненным обменным центром: применение в разработке ионселективных электродов, обратимых к тиоцианатным комплексам металлов // Журн. аналит. химии. 2018. Т. 73. № 12. С. 922.
Рахманько Е.М., Слобода Н.А., Лагунович С.А. Анионообменная экстракция сульфат-ионов четвертичными и бис-четвертичными аммониевыми солями // Журн. неорг. химии. 1990. Т. 35. № 9. С. 2409.
Егоров В.В., Рахманько Е.М., Помеленок Е.В., Окаев Е.Б. Влияние стерической доступности обменного центра высших четвертичных аммониевых солей на анионообменную экстракцию двухзарядных анионов // Журн. физ. химии. 2006. Т. 80. № 6. С. 1104.
Рахманько Е.М., Гулевич А.Л., Подтероб А.П., Слобода Н.А., Цвирко Г.А., Сенин П.В. Анионообменная экстракция двухзарядных анионов растворами высших четвертичных аммониевых солей // Весцi акадэмii навук Беларусi. 1997. № 4. С. 9.
Гулевич А.Л., Рахманько Е.М., Кийко Т.Н. Тригалогенацетатселективные электроды на основе гексилового эфира п-трифторацетилбензойной кислоты // Журн. аналит. химии. 2001. Т. 56. № 5. С. 523.
Рахманько Е.М., Матвейчук Ю.В., Станишев-ский Л.С., Ясинецкий В.В. Оксалатселективный электрод и его применение в анализе // Журн. аналит. химии. 2015. Т. 70. № 7. С. 758.
Lomako S.V., Astapovich R.I., Nozdrin-Plotnitskaya O.V., Pavlova T.E., Lei S., Nazarov V.A., Okaev E.B., Rakhman’ko E.M., Egorov V.V. Sulfate-selective and its application for sulfate determinations in aqueous solutions // Anal. Chim. Acta. 2006. V. 562. №2. P. 216.
Matveichuk Yu.V., Rakhman’ko E.M. Influence of the QAS nature and size of a doubly charged hydrophilic inorganic ions on the analytical characteristics of ${{{\text{S}}}_{{\text{4}}}}{\text{O}}_{{\text{6}}}^{{{\text{2}}--}},$ ${\text{SO}}_{{\text{4}}}^{{{\text{2}}--}},$ ${\text{SO}}_{{\text{3}}}^{{{\text{2}}--}},$ S2–, ${{{\text{S}}}_{2}}{\text{O}}_{{\text{3}}}^{{{\text{2}}--}}$ selective electrodes // Anal. Chem. Lett. 2017. V. 7. № 5. P. 647.
Рахманько Е.М., Гулевич А.Л., Подтероб А.П., Сенин П.В. Сольватирующие свойства гексилового эфира п-трифторацетилбензойной кислоты и его аналогов в анионообменных экстракционных системах // Журн. аналит. химии. 1998. Т. 53. № 6. С. 585.
Гулевич А.Л., Рахманько Е.М., Подтероб А.П. Изучение сольватации гидрофильных анионов гексиловым эфиром п-трифторацетилбензойной кислоты методом анионообменной экстракции // Журн. физ. химии. 1996. Т. 70. № 12. С. 2191.
Merenbloom S.I., Flick T.G., Daly M.P., Williams E.R. Effects of select anions from the Hofmeister series on the gas-phase conformations of protein ions measured with traveling-wave ion mobility spectrometry/mass spectrometry // J. Am. Soc. Mass Spectrom. 2011. V. 22. № 11. P. 1978.
Xie W.J., Liu C.W., Yang L.J., Gao Y.Q. On the molecular mechanism of ion specific Hofmeister series // Sci. China Chem. 2014. V. 57. № 1. P. 36.
Старобинец Г.Л., Рахманько Е.М., Сорока Ж.С. Применение кислотных красителей для определения констант анионообменных экстракционных равновесий // Журн. неорг. химии. 1978. Т. 23. № 6. С. 1628.
Цыганов А.Р., Рахманько Е.М., Старобинец Г.Л. Анионообменная экстракция кислотных красителей солями тринонилоктадециламмония // Весцi акадэмii навук Беларусi. 1997. № 4. С. 9.
Матвейчук Ю.В., Рахманько Е.М., Окаев Е.Б. Ионоселективные электроды на основе высших четвертичных аммониевых солей, обратимые к двухзарядным неорганическим анионам. Минск: БГУ, 2018. 239 с.
Окаев Е.Б. Синтез новых высоколипофильных четвертичных аммониевых солей с регулируемой стерической доступностью катионного центра // Весці НАН Беларусі. Серыя хім. навук. 2005. № 1. С. 53.
Леснова Е.В. Практикум по неорганическому синтезу. М.: Высшая школа, 1977. 168 с.
Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1989. 448 с.
Рахманько Е.М., Егоров В.В., Окаев Е.Б., Помеле-нок Е.В. Высшие четвертичные аммониевые соли с повышенной стерической доступностью обменного центра – селективные обменники двухзарядных анионов // Доклады НАН Беларуси. 2003. Т. 47. № 6. С. 50.
Fuoss R.M. Ionic association. The equilibrium between ion pairs and free ions // J. Am. Chem. Soc. 1958. V. 80. P. 5059.
Berns S., Fuoss R.M. Electrolyte-solvent interaction. Tetra-alkylammonium tetraphenylborides in acetonitrile-carbon tetrachloride mixtures at 25° // J. Am. Chem. Soc. 1960. V. 82. P. 5585.
Roobotton H.K., Jenkins H.D.B. Thermochemical radii of complex ions // J. Chem. Educ. 1999. V. 76. № 11. P. 1570.
Marcus Yi. Ionic Radii in Aqueous Solutions // Chem. Rev. 1988. V. 88. P. 1475.
Рахманько Е.М., Матвейчук Ю.В., Ясинецкий В.В., Станишевский Л.С. ${\text{Zn}}({\text{NCS}})_{4}^{{2 - }}$-селективные электроды на основе высших четвертичных аммониевых солей (ЧАС) // Журн. аналит. химии. 2013. Т. 68. № 4. С. 355.
Егоров В.В., Рахманько Е.М., Гулевич А.Л., Ломако С.В., Ратько А.А. Комплексные соединения металлов как перспективные ионофоры для создания анион-селективных электродов // Коорд. химия. 2002. Т. 28. № 10. С. 754.
Рахманько Е.М., Качанович И.В., Таразевич М.Я. Анионообменная экстракция роданидных комплексов цинка четвертичными аммониевыми солями различного строения // Журн. неорг. химии. 2006. Т. 51. № 10. С. 1773.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии