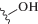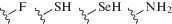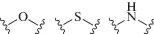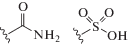Биоорганическая химия, 2021, T. 47, № 1, стр. 76-105
Направленная доставка с применением углеводных систем: ожидания и реальность
Е. С. Щегравина 1, А. А. Сачкова 1, С. Д. Усова 1, А. В. Нючев 1, Ю. А. Грачева 1, А. Ю. Федоров 1, *
1 Нижегородский государственный университет им. Н.И. Лобачевского
603950 Нижний Новгород, просп. Гагарина, 23, Россия
* E-mail: afedorovNN@yandex.ru
Поступила в редакцию 24.07.2020
После доработки 05.08.2020
Принята к публикации 07.08.2020
Аннотация
В конце ХХ века мир вступил в эру высокотехнологичной и персонализированной медицины, которая характеризуется внедрением в клиническую практику таргетных препаратов. Селективная доставка лекарственных средств признана одним из самых эффективных методов повышения результативности и безопасности терапии. Данный обзор посвящен изучению возможностей использования углеводов для селективной доставки лекарственных средств, в частности в терапии онкологических заболеваний. Проанализированы работы, в которых исследовались возможности применения моно- и олигосахаридов в качестве векторных лигандов для взаимодействия с опухоль- и тканеспецифичными рецепторами, описаны примеры конъюгирования углеводов с химиотерапевтическими агентами, агентами фотодинамической терапии, субстратами для in vitro и in vivo имиджинга. Отдельные разделы данного обзора сфокусированы на возможности использования полисахаридов в качестве наноконтейнеров для селективной доставки активных веществ, в том числе нуклеиновых кислот, а также использованию углеводов в иммунотерапии опухолей. Рассмотрены проблемы и перспективы биомедицинского применения углеводов и их миметиков в качестве векторов для адресной доставки.
ВВЕДЕНИЕ
Системы адресной доставки лекарств обладают значительным потенциалом для улучшения диагностических и терапевтических свойств препаратов, а также уменьшения их побочных эффектов [1]. Таргетные лекарственные средства могут избирательно доставлять терапевтические агенты в больные клетки, что способствует снижению неспецифического поглощения, приводящего к увеличению системной токсичности препарата. Это позволяет использовать терапевтические молекулы, которые неэффективны при введении в интактном, немодифицированном виде в максимально переносимой дозе. И, наконец, нацеливающие векторы можно одновременно использовать и для создания сопутствующего диагностического агента, который даст возможность отбирать пациентов с гиперэкспрессированными целевыми рецепторами на патологических клетках.
Углеводные лиганды и гликомиметики, наряду с пептидами и антителами, являются одними из самых перспективных векторов для направленной доставки [2]. Много десятилетий назад углеводы рассматривались преимущественно с позиций энергетического обмена клеток, но к настоящему времени установлено, что они играют одну из ключевых ролей в клеточном сигналинге, распознавании и коммуникации клеток с внеклеточными компонентами и друг с другом, а также являются неотъемлемыми участниками посттрансляционных изменений белковых структур [3]. В отличие от других биополимеров – белков или нуклеиновых кислот – углеводы могут иметь нелинейную структуру [4]. Их ветвление происходит за счет наличия нескольких гидроксильных групп, что существенно увеличивает разнообразие возможных структур.
В качестве векторных компонентов углеводы имеют ряд преимуществ перед остальными природными и синтетическими материалами: 1) благодаря своему огромному структурному разнообразию, олигосахариды и их миметики обладают удивительной селективностью к белковым рецепторам; 2) структура углеводов может быть относительно легко определена; 3) они являются биосовместимыми и биоразлагаемыми материалами; 4) существует большое количество природных источников углеводов; 5) благодаря наличию множества гидроксильных групп, биосовместимые олигосахариды способны защищать терапевтические агенты или наночастицы от нежелательного взаимодействия с белками, например, предотвращать опсонизацию; 6) углеводы характеризуются хорошей растворимостью в воде и не склонны к агрегации, что является преимуществом при создании лекарств для внутривенного введения [4]. Несмотря на указанные преимущества, одной из ключевых задач остается оптимальный дизайн векторных конструкций для эффективного биологического распознавания углеводного лиганда [5].
Целью данного обзора является обобщение наиболее ярких примеров систем адресной доставки с применением лигандов, содержащих моносахаридные звенья, углеводных наночастиц, а также таргетирования лектинов углеводами и гликомиметиками.
ОБЩАЯ ХАРАКТЕРИСТИКА МОНОСАХАРИДОВ ЖИВОТНОГО ПРОИСХОЖДЕНИЯ
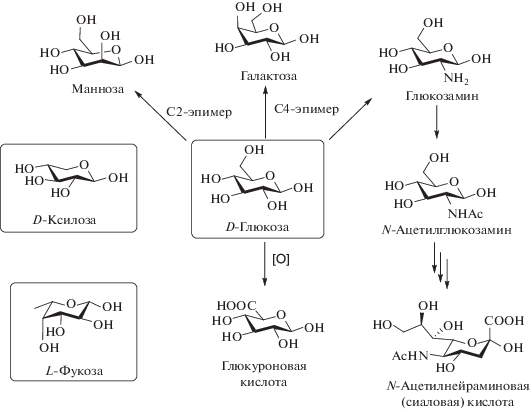
В клетках млекопитающих присутствуют девять основных моносахаридов, из которых построена большая часть природных олиго- и полисахаридов: D-глюкоза, D-глюкозамин, N-ацетил-D-глюкозамин, D-галактоза, D-манноза, D-ксилоза, L-фукоза, глюкуроновая кислота и N-ацетилнейраминовая кислота, относящаяся к сиаловым кислотам (рис. 1) [6, 7]. Большинство указанных моносахаридов могут быть как получены из экзогенных источников с использованием транспортеров семейства SLC2A, так и синтезированы de novo из глюкозы.
Функции моносахаридов разнообразны. Например, D-глюкоза − основной источник энергии [8], а также субстрат для гликозилирования. D-Глюкуроновая кислота в организме человека задействована в биоконъюгировании с целью детоксикации и выведения ксенобиотиков [9]. D-Манноза участвует в синтезе гликозилфосфатидилинозитола (GPI anchor) – “якоря”, помогающего белкам закрепиться в плазматической мембране. D‑Галактоза, образующая многие гликоконъюгаты, важна для роста и развития новорожденных [7]. N‑Ацетил-D-глюкозамин задействован в биосинтезе гиалуроновой кислоты, выполняющей функции формирования структуры тканей и взаимодействия с различными молекулами и рецепторами [10]. Также он вовлечен в синтез сиаловых кислот [11]. Алкилфосфатные производные N-ацетил-D-глюкозамина обладают антибактериальной и противотуберкулезной активностью [12].
Манноза [13–15], галактоза [15–17] и фукоза [15, 18] исследуются в качестве лекарственных средств при лечении врожденных нарушений гликозилирования [15, 19, 20]. При онкологических заболеваниях существует возможность химиотерапии с использованием маннозы [21], эффект которой, вероятно, основан на накоплении в клетках D-маннозо-6-фосфата (Man-6P), ослабляющего гликолиз и вызывающего “голодание” клеток и их смерть [22]. Применение D-галактозы исследуют при стероид-резистентном нефротическом синдроме (СРНС) [23]. При муковисцидозе проведение ингаляций смесью галактозы и фукозы снижает заражение легких синегнойной палочкой (Pseudomonas aeruginosa) при отсутствии значительных побочных эффектов [24].
GalNAc-СОДЕРЖАЩИЕ ЛИГАНДЫ В АДРЕСНОЙ ДОСТАВКЕ ТЕРАПЕВТИЧЕСКИХ АГЕНТОВ
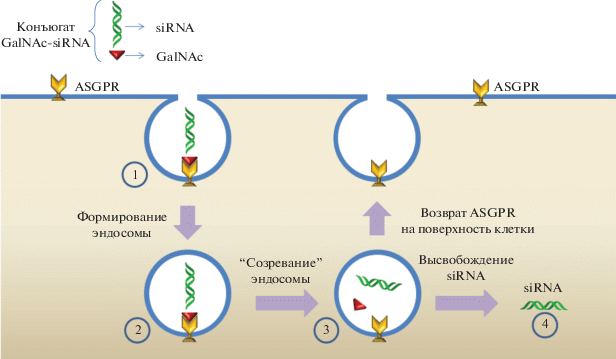
Некоторые лиганды, содержащие в составе моносахаридные звенья, рассматриваются в качестве векторов для доставки терапевтических агентов [23–28]. В частности, возможность направленной доставки обусловлена способностью фрагмента N-ацетил-D-галактозамина (GalNAc) к избирательному связыванию с асиалогликопротеиновыми рецепторами (ASGPR) [29]. Это рецепторы лектинов типа С, расположенные в плазматических мембранах гепатоцитов [30]. На рис. 2 приведен механизм действия биоконъюгатов GalNAc с олигонуклеотидами (ON). Достигая мембраны гепатоцита, конъюгат GalNAc–ON связывается с ASGPR (1) и оказывается в ранней эндосоме (2) через клатрин-зависимый механизм [31]. При дальнейшем “созревании” эндосомы и снижении рН происходят диссоциация комплекса G-alNAc–ASGPR и распад конъюгата GalNAc–ON (3), после чего олигонуклеотид покидает эндосому (4) (рис. 2) [29, 32, 33].
Рис. 2.
Взаимодействие конъюгата GalNAc–ON с асиалогликопротеиновыми рецепторами гепатоцитов (ASGPR) [32].
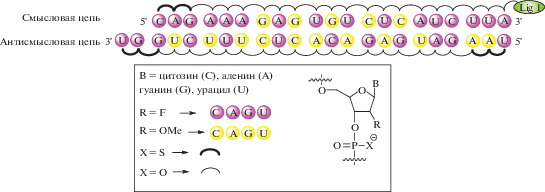
Чаще всего GalNАc входит в состав биоконъюгатов в “трехантенной” форме (Tris-GalNАc), присоединенной к 3′- или к 5′-концу ON посредством фосфодиэфирной связи (рис. 3). Также GalNАc может быть включен в нуклеотидную последовательность как ненуклеозидный мономер [33, 34].
В настоящее время значительный интерес представляют конъюгаты GalNАc с такими ON, как антисмысловые ДНК (ASO), интерферирующие и малые интерферирующие РНК (RNAi и siRNA) [33]. ASO и RNAi представляют собой олигонуклеотидные последовательности, комплементарные гену, экспрессию которого необходимо подавить [35]. В состав биоконъюгатов входят модифицированные siRNA, где 2′-OH-группы рибозы замещаются на фтор (2′-F) либо метоксигруппы (2′-OMe) с целью защиты siRNA от действия нуклеаз [36, 37].
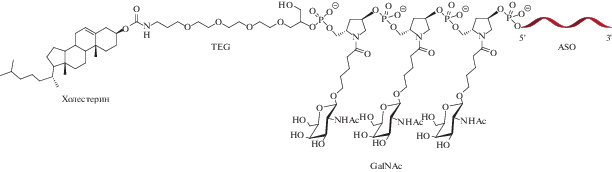
Эффективным методом влияния на свойства конъюгатов GalNАc–ON служит двойное конъюгирование. Иллюстрацией к этому может являться создание амфифильного конъюгата [38], где 5′-конец ASO модифицирован при помощи GalNАc и холестерина, связанных между собой триэтиленгликолевым мостиком (рис. 4). Подобные конъюгаты направлены на подавление экспрессии гена аполипопротеина B (ApoB), что служит терапией при гомозиготной семейной гиперхолестеринемии [39]. Применение конъюгата холестерин–GalNАc–ASO несколько снизило активность ASO в подавлении гена apoB по сравнению с конъюгатом GalNАc–ASO. Однако такой подход позволил уменьшить накопление ASO в почках, что является перспективной стратегией снижения нефротоксичности ASO.
Рис. 4.
Строение двойного конъюгата холестерин–GalNAc–ASO [38]. TEG – триэтиленгликоль, ASO – антисмысловая ДНК.
Активность биоконъюгата можно повысить путем увеличения числа siRNA, переносимых одной единицей Tris-GalNАc. Это достигается использованием “мультимерной” формы siRNA, содержащей несколько связанных между собой нуклеотидных последовательностей. Brown et al. [40] удалось создать не только конъюгаты с множественными копиями одной siRNA, но и конъюгаты, содержащие разные олигонуклеотидные последовательности, что обеспечивает подавление экспрессии нескольких генов одновременно. Был получен гетеротример, содержащий сразу три siRNA, действующие на гены фактора свертывания крови (FVII), аполипопротеина B (ApoB) и транстиретина (TTR). Эффект “нокдауна”, оказываемый одной единицей конъюгата гетеротримера с GalNАc, сопоставим с суммарным эффектом от применения трех конъюгатов, нацеленных отдельно на FVII, ApoB и TTR [40].
В настоящее время в разработку препаратов на основе конъюгатов GalNАc–ON вовлечено несколько фармацевтических компаний [30, 41–43], среди которых Arrowhead, Dicerna, Silence и Ionis. Компания Alnylam, ставшая первопроходцем в области препаратов на основе siRNA, перешла от исследования липосомальных частиц к конъюгатам GalNAc–ON в качестве средств доставки олигонуклеотидов к клеткам печени [41]. В 2019 г. FDA (Food and Drug Administration, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, США) одобрило первый препарат на основе конъюгата GalNAc–siRNA – Гивосиран (Givosiran, GIVLAARITM) [44, 45]. Он является вторым одобренным FDA препаратом на основе siRNA и используется при лечении острой печеночной порфирии (AHP). Гивосиран выпускается в форме натриевой соли двухцепочечной siRNA, где 3'-конец смысловой цепи связан с лигандом, содержащим фрагмент GalNAc (рис. 5). Наличие тиофосфатных линкеров между двумя крайними субъединицами в 5′-конце смысловой цепи и 3'-, 5'-концах антисмысловой цепи способствует дополнительной защите от действия ферментов и стабильности siRNA при подкожном введении [46, 47].
Проводятся доклинические и клинические испытания препаратов [32, 41–43, 48–50], направленных на борьбу с такими заболеваниями, как гепатит В (ARO-HBV, VIR-2218, AB-729 [51]), гемофилия (Fitusiran), талассемия (IONIS-TMPRSS6-LRx, SLN124), транстиретиновый амилоидоз (Revusiran, ALN-TTRSC02) (табл. 1, данные на 01.09.2020, полная версия таблицы и структуры терапевтических агентов приведены в дополнительном файле). Перспективы применения конъюгатов GalNAc–ON в лечении локализованных в печени раковых опухолей пока неясны [52, 53]. Несмотря на некоторый прогресс в данной области [52, 54–56], возможности препаратов ограничиваются тем, что клетки опухоли слабо дифференцированы. Число рецепторов ASGPR в клетках гепатоцеллюлярной карциномы зачастую существенно ниже, чем в здоровых гепатоцитах, что снижает эффективность адресной доставки [57, 58]. Также стоит отметить, что для многих препаратов на основе GalNAc–ON остаются актуальными задачи повышения стабильности, эффективности и снижения токсического влияния на организм.
Таблица 1.
Данные о клинических испытаниях препаратов на основе конъюгатов олигонуклеотидов с лигандами направленной доставки, содержащих фрагменты GalNAc
| Мишень | Заболевание | Препарат | Номер фазы испытаний, состояние | Номер испытания/ ссылка |
|---|---|---|---|---|
| Вирус гепатита В (HBV) | Гепатит В | VIR-2218 | 1, 2, активны | NCT03672188 |
| α-1-Антитрипсин (AAT) | Дефицит α-1-антитрипсина | ALN-AAT02 | 1, 2, активны | NCT03767829 |
| ARO-AAT | 2, 3, идет набор пациентов | NCT03945292 | ||
| Липопротеин (a) (Lp(a)) | Сердечно-сосудистые заболевания |
AMG 890 | 1, активна, нет набора | NCT03626662 |
| 2, идет набор | NCT04270760 | |||
| Пропротеиновая конвертаза субтилизин-кексинового типа 9 (PCSK9) |
Гиперхолестеринемия | Inclisiran (ALN-PCSSC) | 3, завершена | NCT03397121 |
| Ангиотензин (AGT) | Гипертензия | IONIS-AGT-LRx | 2, активна | NCT04083222 |
Таким образом, моносахариды сами по себе не обладают векторными свойствами, однако включение их в состав адресных лигандов для последующей конъюгации с терапевтическими агентами позволило получить ряд перспективных молекул, одна из которых уже применяется в клинической практике (препарат Гивосиран).
УГЛЕВОДНЫЕ НАНОЧАСТИЦЫ ДЛЯ АДРЕСНОЙ ДОСТАВКИ ТЕРАПЕВТИЧЕСКИХ АГЕНТОВ
Одним из распространенных методов адресной доставки является инкапсулирование терапевтического агента в наночастицы, в качестве которых могут выступать липосомы [59–64], полимерные частицы природного или синтетического происхождения [65–73], углеродные нанотрубки [74–77], дендримеры [78–83], “металлические” [84–88] и вирусоподобные частицы [89, 90].
Дизайн наночастиц может являться одним из ключевых факторов успеха терапии. Основные требования для создания наночастиц включают инертность, нетоксичность и стабильность. Размер частиц и модификация их поверхности играют важную роль в механизме биотрансформации и утилизации наночастиц в организме [91, 92].
Частицы размером до 30 нм утилизируются преимущественно в почках, частицы большего размера претерпевают биодеградацию в печени либо захватываются фагоцитами [93].
Доставка инкапсулированных лекарственных средств может происходить по механизмам активного и пассивного таргетирования. Пассивная доставка наночастиц к опухолевым клеткам реализуется за счет проникновения через расширенные (100−600 нм) поры эндотелия сосудов (EPR-эффект) [94]. Активная доставка основана на связывании молекулы-лиганда, которым модифицирована поверхность наночастиц, с рецепторами, повышенно экспрессируемыми на мембранах опухолевых клеток [95–100].
Олиго- и полисахариды являются популярными скаффолдами для создания наноразмерных систем доставки различных терапевтических агентов. Созданию углеводных наночастиц посвящен ряд обзоров [4, 76, 101–103], поэтому в рамках данной статьи мы не будем останавливаться на всех вариантах углеводных наноконтейнеров и их биомедицинских приложений. На рис. 6 приведены наиболее распространенные поли- и олигосахаридные системы, применяемые для дизайна систем адресной доставки. По механизмам пассивного таргетирования функционируют системы доставки на основе хитозана, циклодекстрина, альгината, целлюлозы и декстрана. Активными векторными свойствами обладают гликозаминогликаны, в частности гиалуроновая кислота и хондроитинсульфат.
Рис. 6.
Структура олиго- и полисахаридов, применяемых для создания систем адресной доставки лекарств.

Подавляющее большинство таких частиц обладает высокой биосовместимостью ввиду природного происхождения. Некоторые полисахариды (например, альгинат, пектин, целлюлоза, циклодекстрины) могут быть получены из растений. Ряд распространенных полисахаридов (хитозан, гиалуроновая кислота, гепарин, хондроитинсульфат) имеют животное происхождение. Амфифильность углеводов создает возможность для инкапсулирования как гидрофильных, так и липофильных субстанций. Наличие функциональных групп позволяет проводить модификацию наноконтейнеров, например, конъюгировать их с векторами селективной доставки. Разнообразие природных полисахаридов обеспечивает широкий спектр структур частиц (линейные полимеры, разветвленные, циклические), различную химическую композицию (различные моносахариды или α/β-формы в составе одного полимера), диапазон молекулярных масс и вариативность заряда частиц (положительные, отрицательные или нейтральные).
УГЛЕВОДНЫЕ НАНОЧАСТИЦЫ НА ОСНОВЕ ХИТОЗАНА, ГЛИКОЗАМИНОГЛИКАНОВ И ЦИКЛОДЕКСТРИНОВ, КОВАЛЕНТНО СВЯЗАННЫЕ С ТЕРАПЕВТИЧЕСКИМИ АГЕНТАМИ
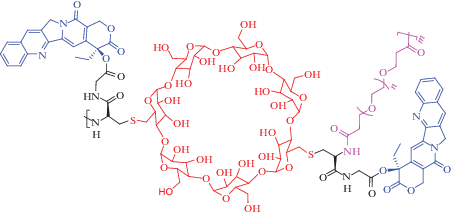
На начальном этапе разработки наноразмерных углеводных систем доставки акцент был сделан на создании ковалентных конъюгатов “полисахарид – активное соединение”. В качестве терапевтических фрагментов в конъюгатах использовали доксорубицин [101, 104, 105], паклитаксел [106], доцетаксел [102, 103], цисплатин, метотрексат [107], меркаптопурин [108] и многие другие цитотоксические и цитостатические препараты и агенты фотодинамической терапии (ФДТ) [109–112]. Единственным примером подобных углеводных наночастиц, в настоящее время проходящих клинические испытания, является система доставки камптотецина, в которой он ковалентно сконъюгирован с ПЭГ-модифицированным циклодекстрином [113] (рис. 7).
Рис. 7.
Система доставки каптотецина, конъюгированного с ПЭГ-функционализированным циклодекстрином, предназначенная для терапии онкозаболеваний.
Повышенная концентрация частиц в пораженных тканях (уровень наночастиц и высвобожденного каптотецина через 24 и 48 ч после введения был на 4 порядка выше, чем для модельного соединения) достигается за счет пассивного таргетирования, обусловленного EPR-эффектом. Данные наночастицы продемонстрировали высокую эффективность на in vivo моделях и к настоящему моменту завершили 2-ю стадию клинических испытаний (ClinicalTrials.gov: NCT00333502, NCT01612546).
АДРЕСНАЯ ДОСТАВКА ТЕРАПЕВТИЧЕСКИХ АГЕНТОВ, ИНКАПСУЛИРОВАННЫХ В УГЛЕВОДНЫЕ НАНОЧАСТИЦЫ ЗА СЧЕТ НЕКОВАЛЕНТНЫХ ВЗАИМОДЕЙСТВИЙ
Существуют многочисленные примеры нековалентного включения малых молекул в полисахаридные наночастицы. Для увеличения способности к инкапсулированию и мицеллообразованию в водной среде прибегают к модификации частиц при помощи малых молекул [114–119] (стероидов [120–123], длинноцепочечных алкильных заместителей [124–129], ароматических или гетероароматических фрагментов, фолиевой кислоты [130–134]) либо синтетических или природных полимеров [135–139] (полилактид, полияблочная кислота, ПЭГ [140, 141], CPP-пептиды (cell penetrating peptides) и др.). Такая модификация позволяет решить несколько задач:
− создать участки гидрофобности на поверхности полимера, за счет чего частицы приобретают амфифильный характер и самопроизвольно образуют мицеллы в водных средах;
− увеличить время циркуляции частиц и замедлить их опсонизацию;
− производить разгрузку активного соединения в очаге патологии под действием специфических внешних стимулов: рН среды, локальное повышение температуры, магнитное или УФ-воздействие, энзиматическое расщепление;
− увеличить захват клеткой наночастиц за счет CPP-пептидов или векторов адресной доставки;
− образовать полиэлектролитные комплексы, способные к захвату и переносу заряженных молекул.
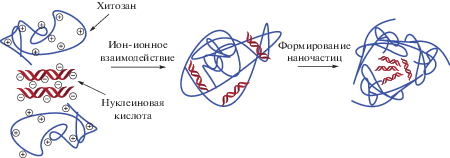
Наиболее подходящую область биомедицинских приложений для конкретного полисахарида можно определить исходя из строения, состава и заряда макромолекулы. Например, модифицированный (тиолсодержащий) хитозан способен увеличивать проницаемость клеточных мембран, как полагают, из-за их способности к разрушению плотных межклеточных контактов (tight junctions) за счет взаимодействия с цистеиновыми аминокислотными фрагментами, входящими в состав мембранных каналов [142]. Это свойство модифицированного хитозана оказалось полезным для доставки в клетки субстратов АТФ-связывающих кассетных белков [143]. Таким образом, не обладая прямыми свойствами векторной молекулы, хитозан, применяемый в качестве носителя для активных молекул, может способствовать их доставке посредством иных механизмов. Кроме того, хитозановые наноконтейнеры ввиду наличия положительно заряженных аминогрупп активно применяют для доставки генного материала [144–147], например, плазмидной ДНК, антисмысловой РНК или олигонуклеотидов. Хитозан способен к образованию полиэлектролитных комплексов с молекулами нуклеиновых кислот (рис. 8).
На эффективность таких систем влияет множество факторов, таких как молекулярная масса хитозана, степень его деацетилирования, степень загрузки ДНК/РНК, рН среды, взаимодействие с компонентами плазмы. Более подробно эти особенности рассмотрены в ряде обзоров [145, 148–150].
Напротив, отрицательно заряженные гликозаминогликаны не применяются в интактном виде для доставки олигонуклеотидов, но, образуя полиэлектролитные комплексы с хитозаном или другими положительно заряженными полимерными молекулами (полиэтиленимин, полигистидин), способны доставлять генный материал [151].
Циклодекстрины представляют особый интерес ввиду способности к образованию комплексов по типу “хозяин–гость” [152]. Их преимуществом является высокий процент загрузки активного компонента и способность к самосборке в водной среде. Молекулы, играющие роль “гостя”, обычно конъюгируют с различными гидрофобными фрагментами, рН-чувствительными или редокс-чувствительными молекулами.
Привлекательным направлением является инкапсулирование фрагментов нуклеиновых кислот в полость циклодекстрина [153, 154]. Установлены основные закономерности эффективности трансфекции в зависимости от размера макроцикла, количества формируемых водородных связей между нуклеиновой кислотой и циклодекстрином, декорирования макроциклов векторными и другими молекулами [155]. В 2014 г. была разработана четырехкомпонентная система (CALAA-01) на основе адамантан-ПЭГ-модифицированного циклодекстрина для доставки siРНК (рис. 9) [156]. В качестве вектора селективной доставки авторами был предложен белок трансферрин человека (hTf), связывающийся с hTf-рецепторами на поверхности опухолевых клеток, при этом циклодекстрины выполняют функцию молекул-носителей, способных к образованию мицелл в водном растворе. В настоящий момент эта разработка находится на 2-й стадии клинических испытаний.
Рис. 9.
Система селективной доставки siRNA на основе циклодекстринов. hTf –трансферрин человека, Ad-PEG – адамантилполиэтиленгликоль.

Гиалуроновая кислота [157, 158] и хондроитинсульфат могут быть использованы для адресной доставки к опухолевым клеткам с повышенной экспрессией рецепторов CD44 и CD168 [159–162]. Как правило, гиперэкспрессия этих белков наблюдается при опухолях толстого кишечника, желудка и яичников. Помимо указанных рецепторов было идентифицировано несколько белков для потенциального таргетирования гиалуроновой кислотой, например, рецептор гиалуронат-опосредованной подвижности (RHAMM), HA-рецептор эндоцитоза (HARE) и эндотелиальный рецептор-1 лимфатических сосудов (LYVE-1) [163]. В свою очередь, модифицированный гепарин способен эффективно ингибировать процессы опухолевого ангиогенеза, метастазирования и роста [164, 165]. Однако сами носители в роли векторов не всегда бывают эффективны ввиду их неспецифического взаимодействия с компонентами плазмы крови. Поэтому разрабатываются более сложные системы, зачастую нацеленные на одновременное взаимодействие с несколькими типами рецепторов для адресной доставки и контролируемого высвобождения активного соединения [166–168]. Одним из таких примеров является создание систем для тераностики (фотодинамическая или фототермическая терапия совместно с флуоресцентным имиджингом) на основе золотых наночастиц, покрытых гиалуроновой кислотой и содержащих рН- и редокс-чувствительные фрагменты (рис. 10). Указанные системы показали себя особенно эффективными для терапии HER2-положительного рака молочной железы [169].
Рис. 10.
Дизайн рН- и редокс-чувствительных комбинированных наночастиц (НЧ) для фотодинамической терапии (ФДТ) и имиджинга.

Менее популярными материалами для доставки активных препаратов являются целлюлоза [170, 171], декстраны [109, 172, 173] и альгинаты [174]. Их ограниченное применение, в частности, связано с недостаточной растворимостью целлюлозы и разветвленных декстранов в воде, а также непостоянством количественного состава указанных полисахаридов. Несмотря на немногочисленные примеры использования этих материалов для таргетной доставки по сравнению с другими полисахаридами, вышеперечисленные вещества находят применение в биомедицине и фармацевтике для предотвращения тромбообразования и поддержания давления в периферических сосудах [175], для производства мембран и оболочек таблетированных лекарственных средств [176], а также для комбинированной терапии гастроэзофагеальной рефлюксной болезни [177] и в качестве энтеросорбента.
Таким образом, вопреки обилию работ, посвященных созданию углеводных наночастиц, их использование в направленной доставке терапевтических агентов весьма ограничено и сводится в основном к пассивному накоплению за счет EPR-эффекта. Полагаем, что более перспективным является использование наночастиц или наноконтейнеров, содержащих адресные углеводные векторы (рассмотрены в следующем разделе).
ИСПОЛЬЗОВАНИЕ ЛИГАНДОВ ЛЕКТИНОВ В КАЧЕСТВЕ ВЕКТОРОВ ДЛЯ НАПРАВЛЕННОЙ ДОСТАВКИ
Лектины – белки, которые с очень высокой специфичностью распознают и связывают углеводные лиганды, присоединенные к белкам и липидам, на клеточной поверхности или внутри клеток [178]. Высокоселективное связывание углеводов с лектинами возможно благодаря наличию в их полипептидных цепях домена распознавания углеводов (Carbohydrate Recognition Domain, CRD). Несмотря на то что лектины не проявляют энзиматической активности, они обладают широким спектром функций, включая регулирование межклеточных и клеточно-матричных взаимодействий в нормальных и опухолевых тканях.
Лектины могут быть классифицированы в различные семейства [178]. К С-типу относят обширный класс лектинов, которым требуются ионы Са2+ для связывания с белками. Например, для таргетирования селектинов (Е-, L-, P-селектинов), относящихся к семейству лектинов С-типа, в качестве “наименьшей углеводной единицы” необходимы Sialyl Lewis X (sLeX) и Sialyl Lewis А (sLeА). К S-типу лектинов относятся белки, которым для стабилизации необходимы свободные тиолы. Они имеют значительную аффинность к β-галактазидам, и в современной химии их часто называют галектинами, причем не все они являются тиолзависимыми. Лектины, распознающие остатки Man-6-P, называют лектинами Р-типа. В 1990-е гг. было установлено, что иммуноглобулины способны распознавать углеводы, что привело к открытию лектинов I-типа, которые являются частью суперсемейства иммуноглобулинов и важны для иммунной системы. В этом семействе I‑лектинов белки, способные распознавать остатки сиаловых кислот, назвали сиглеками (Siglecs – sialic acid-binding immunoglobulin-type lectins). Благодаря своим паттернам экспрессии, эндоцитическим свойствам и способности модулировать передачу сигналов рецепторами сиглеки стали привлекательными мишенями для клеточно-направленной терапии. Следует отметить, что в настоящее время, ввиду большого разнообразия, не существует единой и универсальной классификации лектинов.
Известны две основные стратегии использования лектинов для нацеливания лекарственных агентов на терапевтические мишени, связанные с применением олигосахаридов или самих лектинов в качестве фрагментов систем адресной доставки [179]. Подход с применением обратного таргетирования лектинами предполагает оснащение систем адресной доставки экзогенными лектинами, которые затем связываются с комплементарными гликопротеинами или гликолипидами, экспрессированными на поверхности соответствующих клеток. Как правило, для этих целей используются лектины, получаемые из растительных источников [180].
Прямое таргетирование лектинов или гликотаргетирование, интересующее нас в большей степени в рамках данного обзора, заключается в декорировании систем адресной доставки углеводными векторами, которые распознаются и интернализируются эндогенными лектинами, расположенными на поверхности клеток.
К примеру, высокая экспрессия галектина-1 в опухолевых клетках положительно коррелирует с метастатическим фенотипом и слабо дифференцированной морфологией, при этом экспрессия галектина-3 сильно варьируется на разных стадиях развития многих опухолей [181]. Многочисленные сообщения подтверждают прямую корреляцию экспрессии галектина-3 с карциномами толстой кишки, молочной железы, желудка, эндометрия, языка и щитовидной железы. Не стоит забывать, что галектины-1 и 3 экспрессируются также и в нормальных клетках, но в значительно меньшей степени по сравнению с опухолевыми [97].
КОНЪЮГАТЫ ГАЛЕКТИНОВЫХ ЛИГАНДОВ С ТЕРАПЕВТИЧЕСКИМИ АГЕНТАМИ, ОБЛАДАЮЩИЕ СВОЙСТВОМ АДРЕСНОЙ ДОСТАВКИ
Недавно были созданы разнообразные углеводные конъюгаты терапевтических агентов с высокой аффинностью к галектинам-1 и 3 (рис. 11). Например, галектин-специфичный лактозилированный стероид (I) при системном введении существенно увеличивает выживаемость мышей с привитой лимфомой или нейробластомой человека [182, 183]. Галактозилированные комплексы платины (II), так же как и цисплатин и его аналоги, обладают высокой противоопухолевой активностью [184, 185]. Использование полигалактозилированных хлоринов, порфиринов и фталоцианинов (например, соединения (III) и (IV)), обладающих аффинностью к галектину-1, приводит к повышению эффективности лечения опухолей методом ФДТ по сравнению с использованием негликозилированных фотосенсибилизаторов [186–188]. Синтезированы неогликопротеины (V) (рис. 11), имеющие высокую аффинность к галектину-3 человека [189].
Существует множество вариантов адресных гликоконъюгатов, нацеленных и на другие типы и семейства лектинов [190], однако такое таргетирование является далеко не “идеальным” ввиду того, что в подавляющем большинстве случаев лектины экспрессируются не только “пораженными”, но и здоровыми клетками, как и в случае с фолатными рецепторами, EGFR, VEGF и другими “опухолевыми” мишенями [191–194].
ПРИМЕНЕНИЕ Sialyl Lewis X И Sialyl Lewis А ДЛЯ НАПРАВЛЕННОЙ ДОСТАВКИ
Хорошие перспективы имеет таргетирование селектинов с использованием sLeХ (Sialyl Lewis X) и sLeА (Sialyl Lewis А) – изомерных тетрасахаридов, состоящих из N-ацетилглюкозамина, галактозы, нейраминовой кислоты и фукозы (рис. 12).
В организме человека sLeХ и sLeА выполняют важные функции в работе иммунной системы. Они участвуют в инфильтрации лейкоцитов, нейтрофилов и моноцитов в очаг воспаления за счет взаимодействия между E-селектином, экспрессируемым на активированных эндотелиальных клетках кровеносных сосудов, и лигандами sLeХ и sLeА, находящимися на поверхности циркулирующих клеток [195].
Одним из наиболее развитых биомедицинских приложений для указанных олигосахаридов является их использование в качестве маркеров диагностики некоторых аутоиммунных заболеваний и различных типов рака [196–199].
Способность sLeХ и sLeА связываться с селектинами была использована при создании векторных липосом для направленной доставки малых молекул, таких как дексаметазон [200, 201], комбретастатин А4 [202], мелфалан [203, 204], метотрексат [205–207], цисплатин [208], моногалактозилдиацилглицерол [209], доксорубицин [210], а также антисмысловых олигонуклеотидов [211] и протеинов [212]. Общая структура таргетных липосом представлена на рис. 13, а вид липидного производного sLeХ может варьироваться.
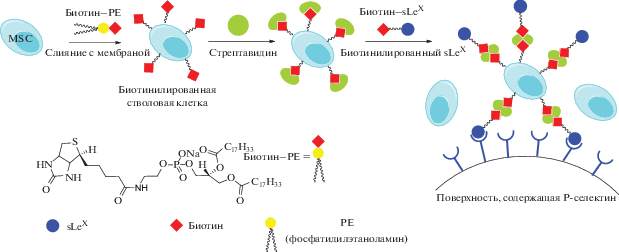
Кроме того, векторные свойства sLeХ были использованы для доставки мультипотентных мезенхимальных стволовых клеток (MSCs) для регенерации тканей [213]. MSCs были соединены с биотинилированными липидными везикулами, что способствовало прививке биотина на поверхность стволовых клеток. Последующее биоконъюгирование с sLeХ проводилось посредством создания прочных нековалентных комплексов остатков биотина в MSC-модифицированных клетках и в производных sLeХ–биотин при добавлении в систему белка стрептавидина [214, 215] (рис. 14). Этот пример иллюстрирует возможность эффективной иммобилизации адгезивных лигандов и потенциального нацеливания sLeХ-декорированных клеток, системно вводимых в область воспаления.
Помимо указанных областей, sLeХ являются основой для разработки TACA-вакцин [216–218] для иммунотерапии опухолей, однако ни одна из них к настоящему времени не одобрена FDA [219].
ИСПОЛЬЗОВАНИЕ ФУКОИДАНОВЫХ ЛИГАНДОВ Р-СЕЛЕКТИНОВ В ТЕРАПИИ РАКА И НЕИНВАЗИВНОМ ИМИДЖИНГЕ
Р-селектин – мембранный протеин, является адгезионной молекулой и экспрессируется на поверхности эндотелия при атеротромботических поражениях. Установлено [220], что природный сульфированный полисахарид фукоидан (рис. 15), строение которого может варьироваться в зависимости от природного источника [221, 222], проявляет высокое сродство к Р-селектину и может применяться в качестве вектора адресной доставки.
Рис. 15.
Типы основных цепей фукоиданов, выделенных из бурых водорослей. Гомофукозный скелет молекулы может быть представлен в виде 1→3 звеньев фукозы либо содержит чередующиеся остатки 1→3 и 1→4. Символами R обозначены места для углеводных заместителей и сульфогрупп [222].

Так, фукоидан был использован для доставки противоопухолевых агентов, например, доксорубицина и паклитаксола, являясь одновременно как носителем, так и векторной компонентой [223]. Помимо онкологических приложений, фукоидан применялся в качестве вектора для создания диагностических контрастеров при атеротромбических поражениях и инфаркте миокарда [220, 224]. Наночастицы, содержащие фукоидан и нацеленные на Р-селектин, демонстрируют значительный потенциал для терапии острых тромбозов, причем используемые наночастицы не вызывают нежелательных иммунных реакций [225]. Меченный технецием-99 фукоидан оказался эффективен при диагностике тромбоза брюшной аорты и эндокардита. Клинические испытания данного препарата были завершены в 2019 г. и показали его безопасность [226, 227]. Необходимо отметить, что фукоидан и сам по себе проявляет противоопухолевую активность [228]. В связи с этим исследуется эффективность его использования в качестве поддерживающей терапии при лечении различных типов рака (Clinicaltrials.gov: NCT04066660, NCT03130829, NCT04342949, данные на 01.09.2020).
Разработка методов синтеза линейных и разветвленных несульфатированных [229] и сульфатированных олигосахаридов [230–232], родственных цепям фукоиданов, открывает возможность для получения векторов, отвечающих требованиям производства GMP, что проблематично в случае гетерогенных смесей низкомолекулярных фукоиданов.
ЛИГАНДЫ СИГЛЕКОВ ДЛЯ НАПРАВЛЕННОЙ ДОСТАВКИ В ОПУХОЛЕВЫЕ КЛЕТКИ И ИММУНОТЕРАПИИ
Эффекторные клетки, такие как естественные киллеры (natural killer, NK-клетки) или Т-киллеры, могут обнаруживать молекулы, иммунологически чуждые хозяину, и уничтожают их, чтобы защитить организм-хозяин. Опухолевые клетки экспрессируют аберрантные белки на поверхности клеток, которые могут распознаваться специфическими иммунными эффекторами, что приводит к разрушению злокачественных образований, поэтому иммунная система может играть критическую роль в подавлении первоначального образования опухоли. Тем не менее злокачественные опухоли обладают способностью избегать иммунного ответа [97, 233].
Особую роль в функционировании иммунной системы играют сиглеки – связывающие сиаловую кислоту лектины иммуноглобулинового типа, которые экспрессируются на большинстве белых кровяных клеток иммунной системы и критически важны для передачи сигналов иммунных клеток. Благодаря распознаванию гликанов, содержащих сиаловую кислоту в качестве лигандов, они помогают иммунной системе осуществлять дифференцирование “свой/чужой” [234]. Сиглеки экспрессируются на инфильтрирующих опухоль Т-клетках, NK-клетках, дендритных клетках, макрофагах и тем самым функционируют в качестве мишеней для иммунного контроля. Это свойство сиглеков может быть использовано при разработке терапевтических средств, направленных на усиление противоопухолевого иммунного ответа [235, 236]. Гиперсиалилирование раковых клеток является признаком плохого прогноза, и считается, что оно помогает опухолевым клеткам выходить из-под иммунного надзора [237]. Сиаловые кислоты, являющиеся лигандами для ингибирования сиглеков, могут рекрутировать сиглеки для подавления иммунных реакций. Для восстановления функций иммунных клеток необходимо вытеснение сиаловых кислот из сайта связывания с ингибиторными сиглеками с применением специфических лигандов.
Лиганд-опосредованное тагретирование сиглеков используется для доставки диагностических или терапевтических агентов в различные иммунные клетки [238–240]. Ключевой проблемой этой стратегии является идентификация лектиновых лигандов, способных с высокой аффинностью таргетировать целевой сиглек. Природные сиалилированные гликановые лиганды сиглеков имеют различную селективность и, как правило, весьма низкую аффинность [241]. При этом они могут служить отправной точкой для разработки более эффективных синтетических лигандов. Скрининг больших библиотек гликановых аналогов привел к разработке ряда синтетических лигандов к различным сиглекам – “точечно” модифицированных олигосахаридов, обладающих высокой аффинностью [242–244].
Например, синтетические разветвленные “трехантенные” лиганды (VII–IX) (рис. 16) демонстрируют на 3 порядка большую аффинность по отношению к СD22 (hCD22) или сиглеку-2 человека по сравнению с природным “моноантенным” модифицированным по С9 трисахаридным (Neu5Acα2–6Galβ1–4GlcNAc) лигандом СD22 (VI) или природным олигосахаридом SGP (рис. 16) [244]. Важным структурным элементом этих лигандов является модифицированный бензоатный амид в положении С9 и/или С5 сиаловой кислоты, наличие которого приводит к существенному увеличению авидности и селективности по отношению к СD22 [242, 243, 245].
Рис. 16.
Химическая структура лигандов CD22 – “точечно” модифицированных производных Neu. BPC – бифенилкарбоксамид, MPB – м-феноксибензамид, SGP – асиагликопротеин природного происхождения.

Такая высокая аффинность “трехантенных” лигандов, очевидно, обусловлена одновременным связыванием различных ветвей с СD22-рецепторами на поверхности клеток. Для такого мультивалентного взаимодействия необходимо, чтобы сайты связывания лиганда с двумя молекулами CD22 находились друг от друга на расстоянии, не превышающем 30–50 Å [246].
Лиганды (VII–IX) (рис. 16) являются более эффективными по сравнению с эндогенными гликанами [244]. Показано, что они способны связываться и эндоцитироваться с помощью hCD22 с клетками лимфомы Дауди В, которые экспрессируют природные лиганды CD22, предотвращающие связывание слабых экзогенных лигандов с рецепторами hCD22 [247]. Конъюгаты лиганда (IX) с токсинами сапорином и ауристатином обладают цитотоксичностью в субнаномолярных концентрациях по отношению к клеткам лимфомы Дауди В и на несколько порядков превосходят эффективность конъюгатов токсинов с моноантенными лигандами или с сиаловой кислотой [244]. К сожалению, данных по исследованиям лигандов (VII–IX) in vivo в цитируемых работах не приводится.
Более современным подходом в противоопухолевой терапии является нацеливание иммунных клеток на опухолевые ткани. Так, использование химерных Т-клеток (CAR-T) является прорывной технологией для лечения рака [248, 249]. Тем не менее CAR-T-терапия имеет ряд ограничений: 1) необходимость выделить собственные Т-клетки пациента, модифицировать их генетически рецептором химерного антигена для распознавания опухоли с последующим введением обратно в организм пациента; 2) высокая стоимость CAR-T-терапии (~500 000 долларов США на одного пациента); 3) невозможность получить достаточное количество аутологичных Т-клеток для генерации CAR-T у пациентов после химио- и радиотерапии; 4) невозможность лечения пациентов с быстро прогрессирующими онкологическими заболеваниями [250].
NK-клетки представляют собой другой тип цитотоксических иммунных клеток, которые способны убивать опухолевые клетки, являясь альтернативой Т-клеточной терапии [250]. Они могут быть получены в больших масштабах и легко доступны для пациентов. К сожалению, NK-клетки не обладают врожденными способностями нацеливания на раковые клетки. Для преодоления этого недостатка NK-клетки были генетически декорированы химерными антигенными рецепторами CAR–NK [251], что, однако, привело к невысокой экспрессии трансгена ввиду того, что NK-клетки неблагоприятно влияют на поглощение эндогенных генов [252].
В 2020 г. опубликована первая работа, посвященная декорированию NK-клеток углеводными лигандами сиглека-2 (CD22) − маркера В-клеточной лимфомы – путем метаболической инженерии либо инкорпорирования гликополимеров [111]. В качестве лигандов CD22 использовались производные на основе 9-O-модифицированной сиаловой кислоты (X) и (XI) или амфифильный полимер, содержащий трисахарид (XII) (~100 трисахаридных фрагмента на полимерную цепь), который может непосредственно вставляться в мембрану NK-92, придавая клеткам NK-92 таргетную способность по отношению к рецепторам CD22 (рис. 17).
Рис. 17.
Модификация клеток NK-92 лигандами CD22 (X–XII) с помощью гликоинженерии, приводящая к повышению способности нацеливания и связывания клеток NK-92 с CD22-позитивными клетками, что приводит к более эффективному лизису раковых клеток-мишеней.

Модифицированные таким образом NK-клетки проявляли значительно возросшую цитотоксичность по отношению к CD22-зависимым клеткам лимфомы CD22+. С помощью сконструированных NK-клеток можно более эффективно ингибировать не только клеточные линии лимфомы CD22+, но и клетки первичной лимфомы. И, наконец, применение модифицированных углеводными векторами NK-клеток для лечения мышей с привитой В-клеточной лимфомой демонстрировало значительно большую выживаемость животных по сравнению с контрольными группами. Таким образом, метаболическая гликоинженерия NK-клеток может быть расценена как перспективный подход для лечения онкологических заболеваний и хорошее дополнение к генной инженерии при создании химерных антигенных рецепторов.
МОДИФИЦИРОВАННЫЙ ГЛЮКОЗАМИН – СЕЛЕКТИВНЫЙ ЛИГАНД ДЛЯ СВЯЗЫВАНИЯ С КЛЕТКАМИ ЛАНГЕРГАНСА ЧЕЛОВЕКА
Клетки Лангерганса (КЛ) представляют собой подвид дендритных клеток. Кожа содержит несколько наборов дендритных клеток − иммунных клеток, которые специализируются на интернализации патогенов для индуцирования Т-клеточных ответов [253]. КЛ составляют подвид дендритных клеток, находящихся во всех слоях кожи. После активации КЛ мигрируют в дренирующие лимфатические узлы, вызывая системные иммунные ответы [254]. Благодаря своей локализации в эпидермисе и способности перекрестно представлять экзогенные антигены цитотоксическим Т-клеткам, дендритные клетки стали перспективными мишенями для стратегий трансдермальной противоопухолевой вакцинации [255, 256]. Важно отметить, что индукция защитного Т-клеточного иммунитета этими вакцинами требует эффективной и специфичной доставки как опухолевых антигенов, так и адъювантов.
Для таргетирования клеток Лангерганса предложено сульфамидное производное глюкозамина (XIII) (рис. 18), способное с высокой аффинностью связываться с лангергином (CD207) – рецептором лектина С-типа [257, 258]. На основе этого лиганда был синтезирован соответствующий гликолипид (XIV), что позволило создать адресные липосомальные наночастицы, нагруженные белковыми антигенами. Показано, что полученные липосомы адресно доставляются в КЛ, интернализуются в эндосомах и лизосомах, после чего происходит разгрузка наночастиц.
Эти факты демонстрируют применимость иммунолипосом, содержащих адресные углеводные векторы, для создания белковых вакцин [258].
Приведенные выше примеры показывают, что конъюгирование с олигосахаридами и гликанами может с успехом использоваться в противоопухолевой терапии, как и конъюгирование с антителами.
ГЛИКОМИМЕТИКИ И МОДИФИЦИРОВАННЫЕ УГЛЕВОДЫ
Несмотря на огромное структурное разнообразие углеводных скаффолдов и практически неограниченные возможности для их использования в качестве селективных векторов для молекулярного распознавания, углеводные лиганды имеют ряд недостатков. Поскольку между углеводами и белками реализуются только низкоэнергетические взаимодействия (водородные связи, хелатирование металлов, солевые мостики и слабые гидрофобные контакты), эффективное связывание с лектинами (белками) обычно возможно в высоком микромолярном–миллимолярном диапазоне концентраций [259, 260]. Эти слабые взаимодействия не могут компенсировать энтальпийные потери, возникающие при десольватации полярного лиганда и сайта связывания, поэтому мультивалентные взаимодействия с лектинами, как правило, более выигрышны. Легкость, с которой растворитель способен вытеснять углеводный лиганд из белкового сайта, приводит к серьезному уменьшению времени циркуляции – попав в кровоток, углеводы очень быстро подвергаются почечной экскреции.
И, наконец, природные углеводные лиганды ограниченно применимы в пероральной терапии, поскольку они имеют низкую способность к проникновению через слой энтероцитов в кишечнике. Такое пассивное проникновение характерно для молекул с низкой молекулярной массой, ограниченной полярной поверхностью и небольшим количеством доноров и акцепторов Н-связи (правила Липинского и Вебера) [261]. Исходя из этого, перспективным направлением является создание гликомиметиков и/или “точечно” модифицированных углеводов – соединений, способных имитировать структуру и функциональные группы природных углеводов при связывании с белковыми мишенями [229, 235], что было продемонстрировано в предыдущем разделе. По сравнению с природными углеводными лигандами, хорошо сконструированные гликомиметики имеют повышенную аффинность к мишени, большую биодоступность и длительные периоды полувыведения из организма. Эффективность этого подхода подтверждается успешными примерами клинического использования ряда препаратов. Например, осельтамивир (Tamiflu) и занамивир (Relenza) являются гликомиметическими ингибиторами нейраминидазы гриппа (рис. 19). Они способны ингибировать расщепление концевых остатков сиаловой кислоты (Neu5Ac) на клетках-хозяевах, останавливая тем самым размножение вируса [262, 263]. Миглустат − ингибитор глюкозилцерамидсинтетазы, используется при лечении болезни Гоше I типа для предотвращения накопления глюкозилцерамида [264]. Успешным семейством терапевтических гликомиметиков являются ингибиторы α-глюкозидазы (миглитол b, воглибоза), которые применяются для лечения диабета и лизосомальных нарушений [265].
Гликомиметики используются в качестве антигенов в углеводно-конъюгатных вакцинах [266]. Установлено, что синтетические гликомиметические структуры усиливают иммуногенность и при правильном дизайне могут вызывать выработку антител, которые перекрестно реагируют с природными гликанами.
ДИЗАЙН ГЛИКОМИМЕТИКОВ И МОДИФИЦИРОВАННЫХ УГЛЕВОДОВ
Уменьшение площади полярной поверхности лиганда, как правило, усиливает связывание лиганда с мишенью путем создания новых гидрофобных контактов с белком, а также благодаря снижению энтальпийного вклада, обусловленного эффектами десольватации [267]. Удаление полярных функциональных групп, не вовлеченных в связывание с белками, чаще всего гидроксильных групп, усиливает эти взаимодействия. Для улучшения аффинности при создании гликомиметиков на основе углеводных молекул очень часто используют концепцию биоизостерного замещения функциональных групп (табл. 2).
Например, фторированные миметики гликопептидов (XV) на основе MUC-1 перекрестно реагируют с сывороточными антителами мышей, которые были вакцинированы природным антигеном (рис. 20) [268]. Атом фтора также можно использовать в качестве подходящей замены атома водорода благодаря небольшому размеру и относительной гидрофобности; замена аксиального C3-протона на фтор в сиаловой кислоте (Neu5Ac) позволяет получить модифицированный моносахарид (XVI) − эффективный ингибитор сиалилтрансферазы [269].
Введение гидрофобной группы в “несвязывающее” положение лиганда нарушает сольватацию лиганда водой и, как следствие, уменьшает энтальпию десольватации [270]. Для лектинов с хорошо структурированными сайтами введение гидрофобных фрагментов часто создает термодинамически благоприятные возможности связывания. Например, модифицированные моносахариды − лиганды сиглека-2 (CD22), содержащие C9-амидный ароматический фрагмент, C4-ацильный заместитель и н-алкил в C2-положении Neu5Ac (соединения (XVIII), (XIX) и (XX)), обладают на несколько порядков большей аффинностью по отношению к белковым рецепторам по сравнению с лигандом (XVII) (рис. 20) [271].
Еще одной стратегией, используемой при создании гликомиметиков, является конструирование ковалентных ингибиторов [272, 273]. Например, модифицированный моносахарид (XXI) (рис. 20) эффективно таргетирует LecA Pseudomonas aeruginosa, ковалентно связываясь с Cys62, при этом увеличивается время циркуляции лиганда [274].
И, наконец, для улучшения эффективности связывания используются лиганды, способные имитировать мультивалентные взаимодействия, характерные для природных углеводных лигандов, как, например, в случае конструирования антагонистов DC-SIGN – производных соединения (XXII), эффективных в наномолярных концентрациях (рис. 21) [275, 276].
Применение гликомиметиков и модифицированных моно- и олигосахаридов вместо природных углеводов позволяет не только увеличить аффинность связывания таргетного вектора с белковой мишенью, но также улучшить фармакокинетические свойства лиганда: предотвратить его ферментативный гидролиз, улучшить биодоступность, увеличить времена выведения и циркуляции от секунд и минут (в случае природных углеводов) до часов (при использовании миметиков и “точечно” модифицированных углеводов) [270].
Таким образом, парадигма дизайна адресных углеводных или углеводоподобных лигандов, нацеленных на белковые мишени, сводится к поиску сложного набора компромиссов между селективностью, аффинностью и фармакокинетическими параметрами создаваемых векторов. Природные углеводные лиганды обладают несомненным преимуществом, обусловленным высокой селективностью по отношению к белковым рецепторам, причем различные олигосахариды способны предпочтительно таргетировать один сайт связывания при наличии множества структурно похожих рецепторов. При этом они обладают, как правило, невысокой аффинностью и неудовлетворительными фармакокинетическими профилями. Углеводные миметики и модифицированные углеводы, напротив, при некоторой потере селективности выигрывают благодаря аффинности связывания и улучшенным фармакокинетическим параметрам.
ЗАКЛЮЧЕНИЕ И ПЕРСПЕКТИВЫ
Использование углеводных молекул, модифицированных углеводов и гликомиметиков не только в качестве векторов адресной доставки, но и в виде “независимых” терапевтических агентов может рассматриваться как одно из перспективных направлений медицинской химии. Эти соединения обладают уникальными способностями селективно и с высокой аффинностью связываться с белковыми рецепторами, имеют хорошую растворимость в воде, проявляют высокую биосовместимость и обеспечивают хорошую стабильность инкапсулирования. Приведенные в этом обзоре данные по адресной доставке с применением моносахаридов, углеводных наночастиц, а также использованию олигосахаридов, гликомиметиков и точечно модифицированных углеводов в таргетировании лектиновых мишеней и иммунотерапии подчеркивают привлекательность и несомненную практическую востребованность этого направления исследований. При этом стоит учитывать, что несмотря на неоспоримые достоинства углеводных адресных систем, эта научная область таит в себе многие “подводные рифы”, о которые “разбиваются мечты” о создании идеального таргетного препарата для персонализированной медицины.
Так, учитывая уникальные таргетные способности векторов, содержащих фрагменты GalNAc, биоконъюгаты GalNAc–ON и GalNАc–siRNA для лечения заболеваний печени заняли свое место на фармацевтическом рынке, а также проходят клинические испытания для терапии гепатита В, гемофилии, сердечно-сосудистых заболеваний, тромбоза и ряда других болезней. Наряду с этим нужно помнить, что моносахариды, как и другие малые терапевтические молекулы, обладают токсичностью и рядом побочных эффектов (например, галактоза наносит существенный вред больным с галактоземией [277], конъюгаты GalNАc–ON в некоторых случаях нефротоксичны [38, 278], D-галактозамин способен поражать клетки печени [279]).
В случае дизайна адресных углеводных наночастиц предложен ряд привлекательных концепций доставки терапевтических агентов к целевым тканям и органам. При этом к нерешенным проблемам относится преодоление механизмов выведения ксенобиотиков из организма, что приводит к неудовлетворительным временам циркуляции наноконтейнеров, нагруженных терапевтическими агентами. Большинство углеводных наночастиц обеспечивает доставку за счет пассивного, а не активного транспорта, обладая низкой адресностью нацеливания, при этом также наблюдается низкая воспроизводимость экспериментов ввиду неоднородности состава полисахаридов, формирующих наноструктуру, и проблемы с масштабированием. Отдельным вызовом в этой области является отсутствие релевантных биологических моделей для оценки эффективности препаратов, инкапсулированных в наночастицы. Из-за вышеупомянутых сложностей за последние 15 лет на клинические испытания было выведено только 13 наносистем с активным таргетированием для доставки лекарств, причем только одна из них на основе углеводов, а именно на основе ПЭГ-функционализированных циклодекстринов, инкапсулирующих siRNA [280]. Хорошей альтернативой углеводным наноконтейнерам являются неуглеводные наночастицы, декорированные адресными углеводными лигандами или точечно модифицированными сахаридами.
Известно множество успешных примеров терапевтических гликоконъюгатов, способных таргетировать различные семейства лектинов. Это направление исследований, несомненно, имеет существенный потенциал развития, однако нужно учитывать, что в подавляющем большинстве случаев лектины экспрессируются не только “пораженными”, тканями, но и здоровыми клетками.
Еще одна сложность заключается в том, что вопреки высокой селективности углеводных лигандов к целевому рецептору, они, как правило, обладают низкими значениями аффинности и неудовлетворительными фармакокинетическими профилями. Эта проблема может эффективно решаться применением вместо природных углеводов гликомиметиков или модифицированных углеводов, которые, как правило, при некоторой потере селективности выигрывают благодаря значительно большей аффинности связывания и улучшенным фармакокинетическим параметрам. Кроме того, современные методы олигосахаридного синтеза позволяют осуществлять стереоконтролируемое построение гликозидных связей [281] и получать как пиранозидные, так и фуранозидные производные [282], что открывает возможности для создания углеводных векторов практически любой сложности [283]. Приведенные в обзоре примеры показывают, что конъюгирование терапевтического агента с “точечно” модифицированными углеводами может использоваться в противоопухолевой терапии, как минимум, не менее эффективно, чем конъюгирование с антителами.
Лечение многих болезней может быть направлено на контрольные иммунные точки, которые не дают иммунной системе вызывать сильный ответ против соответствующего патогена. В последнее десятилетие был достигнут большой прогресс в понимании роли сиглеков в функционировании иммунных клеток в качестве контрольных точек иммунитета, выполняющих важную роль при развитии различных видов рака, болезни Альцгеймера, аутоиммунных заболеваний и аллергии [234]. Поэтому появившееся в 2020 г. сообщение о возможности нацеливания NK-клеток на опухолевые ткани с применением модифицированных сахаридов – лигандов сиглека CD22 – является новым трендом в химии углеводов [111], и это направление, с нашей точки зрения, ожидает динамичное развитие в ближайшие годы.
И, наконец, при лечении рака возникает вопрос: как именно происходят посттрансляционные модификации опухолевых белков, включая их гликозилирование в ответ на иммунный отклик организма или на применение терапевтических средств? С развитием заболевания могут меняться профили опухолевых гликопротеиновых рецепторов, поэтому эффективные на первом этапе лечения опухоли таргетные гликоконъюгаты могут оказаться бесполезными по мере ее роста. Можно ли как-то прогнозировать изменения, происходящие с опухолевыми рецепторами и своевременно разрабатывать новые системы их таргетирования? Очевидно, эти вопросы будут являться основными для медицинской химии углеводов в ближайшие годы.
Список литературы
Lu Z.-R., Qiao P. // Mol. Pharm. 2018. V. 15. P. 3603–3616. https://doi.org/10.1021/acs.molpharmaceut.8b00037
Yoo J., Park C., Yi G., Lee D., Koo H. // Cancers (Basel). 2019. V. 11. P. 640. https://doi.org/10.3390/cancers11050640
Costa A.F., Campos D., Reis C.A., Gomes C. // Trends Cancer. 2020. V. 6. P. 757–766. https://doi.org/10.1016/j.trecan.2020.04.002
Kang B., Opatz T., Landfester K., Wurm F.R. // Chem. Soc. Rev. 2015. V. 44. P. 8301–8325. https://doi.org/10.1039/C5CS00092K
Ananikov V.P., Eremin D.B., Yakukhnov S.A., Dilman A.D., Levin V.V., Egorov M.P., Karlov S.S., Kustov L.M., Tarasov A.L., Greish A.A., Shesterkina A.A., Sakharov A.M., Nysenko Z.N., Sheremetev A.B., Stakheev A.Yu., Mashkovsky I.S., Sukhorukov A.Yu., Ioffe S.L., Terent’ev A.O., Vil’ V.A., Tomilov Y.V., Novikov R.A., Zlotin S.G., Kucherenko A.S., Ustyuzhanina N.E., Krylov V.B., Tsvetkov Y.E., Gening M.L., Nifantiev N.E. // Mendeleev Commun. 2017. V. 27. P. 425–438. https://doi.org/10.1016/j.mencom.2017.09.001
Varki A., Cummings R.D., Esko J., Stanley P., Hart G.W., Aebi M., Darvill A.G., Kinoshita T., Packer N.H., Prestegard J.H., Schnaar R.L, Seeberger P.H. eds. Essentials of Glycobiology, 3rd edition // New York. Cold Spring Harbor, 2017.
Sosicka P., Ng B.G., Freeze H.H. // Biochemistry. 2020. V. 59. P. 3064–3077. https://doi.org/10.1021/acs.biochem.9b00565
Kleczkowski L.A., Decker D., Wilczynska M. // Plant Physiol. 2011. V. 156. P. 3–10. https://doi.org/10.1104/pp.111.174706
Iwamura A., Watanabe K., Akai S., Nishinosono T., Tsuneyama K., Oda S., Kume T., Yokoi T. // Drug Metab. Dispos. 2016. V. 44. P. 888–896. https://doi.org/10.1124/dmd.116.069575
Vigetti D., Karousou E., Viola M., Deleonibus S., De Luca G., Passi A. // Biochim. Biophys. Acta. 2014. V. 1840. P. 2452–2459. https://doi.org/10.1016/j.bbagen.2014.02.001
Li Y., Chen X. // Appl. Microbiol. Biotechnol. 2012. V. 94. P. 887–905. https://doi.org/10.1007/s00253-012-4040-1
Шарипова Р.Р., Гарифуллин Б.Ф., Сапунова А.С., Волошина А.Д., Кравченко М.А., Катаев В.Е. // Биоорг. химия. 2019. V. 45. P. 315–325. [Sharipova R.R., Garifullin B.F., Sapunova A.S., Voloshina A.D., Kravchenko M.A., Kataev V.E. // Russ. J. Bioorg. Chem. 2019. V. 45. P. 155–164.] https://doi.org/10.1134/S1068162019020110
Niehues R., Hasilik M., Alton G., Körner C., Schiebe-Sukumar M., Koch H.G., Zimmer K.P., Wu R., Harms E., Reiter K., Figura K., Freeze H.H., Harms H.K., Marquardt T. // J. Clin. Invest. 1998. V. 101. P. 1414–1420. https://doi.org/10.1172/JCI2350
Mention K., Lacaille F., Valayannopoulos V., Romano S., Kuster A., Cretz M., Zaidan H., Galmiche L., Jaubert F., de Keyzer Y., Seta N., de Lonlay P. // Mol. Genet. Metab. 2008. V. 93. P. 40–43. https://doi.org/10.1016/j.ymgme.2007.08.126
Péanne R., de Lonlay P., Foulquier F., Kornak U., Lefeber D.J., Morava E., Pérez B., Seta N., Thiel C., Van Schaftingen E., Matthijs G., Jaeken J. // Eur. J. Med. Genet. 2018. V. 61. P. 643–663. https://doi.org/10.1016/j.ejmg.2017.10.012
Wong S.Y.-W., Gadomski T., van Scherpenzeel M., Honzik T., Hansikova H., Holmefjord K.S.B., Mork M., Bowling F., Sykut-Cegielska J., Koch D., Hertecant J., Preston G., Jaeken J., Peeters N., Perez S., Nguyen D.D., Crivelly K., Emmerzaal T., Gibson K.M., Raymond K., Abu Bakar N., Foulquier F., Poschet G., Ackermann A.M., He M., Lefeber D.J., Thiel C., Kozicz T., Morava E. // Genet. Med. 2017. V. 19. P. 1226–1235. https://doi.org/10.1038/gim.2017.41
Dörre K., Olczak M., Wada Y., Sosicka P., Grüneberg M., Reunert J., Kurlemann G., Fiedler B., Biskup S., Hörtnagel K., Rust S., Marquardt T. // J. Inherit. Metab. Dis. 2015. V. 38. P. 931–940. https://doi.org/10.1007/s10545-015-9828-6
Wild M.K., Lühn K., Marquardt T., Vestweber D. // Cells Tissues Organs. 2002. V. 172. P. 161–173. https://doi.org/10.1159/000066968
Ng B.G., Freeze H.H. // Trends Genet. 2018. V. 34. P. 466–476. https://doi.org/10.1016/j.tig.2018.03.002
Ivanov D.O., Novikova V.P., Pokhlebkina A.A. // Pediatrician (St. Petersburg). 2018. V. 9. P. 5–15. https://doi.org/10.17816/PED935-15
Gonzalez P.S., O’Prey J., Cardaci S., Barthet V.J.A., Sakamaki J., Beaumatin F., Roseweir A., Gay D.M., Mackay G., Malviya G., Kania E., Ritchie S., Baudot A.D., Zunino B., Mrowinska A., Nixon C., Ennis D., Hoyle A., Millan D., McNeish I.A., Sansom O.J., Edwards J., Ryan K.M. // Nature. 2018. V. 563. P. 719–723. https://doi.org/10.1038/s41586-018-0729-3
Wood F.C., Cahill G.F. // J. Clin. Invest. 1963. V. 42. P. 1300–1312. https://doi.org/10.1172/JCI104814
Sgambat K., Banks M., Moudgil A. // Pediatr. Nephrol. 2013. V. 28. P. 2131–2135. https://doi.org/10.1007/s00467-013-2539-z
Hauber H.-P., Schulz M., Pforte A., Mack D., Zabel P., Schumacher U. // Int. J. Med. Sci. 2008. V. 5. P. 371–376. https://doi.org/10.7150/ijms.5.371
Baenziger J.U., Fiete D. // Cell. 1980. V. 22. P. 611–620. https://doi.org/10.1016/0092-8674(80)90371-2
Rensen P.C.N., van Leeuwen S.H., Sliedregt L.A.J.M., van Berkel T.J.C., Biessen E.A.L. // J. Med. Chem. 2004. V. 47. P. 5798–5808. https://doi.org/10.1021/jm049481d
Hangeland J.J., Levis J.T., Lee Y.C., Tso P.O.P. // Bioconjug. Chem. 1995. V. 6. P. 695–701. https://doi.org/10.1021/bc00036a006
Juliano R.L., Ming X., Carver K., Laing B. // Nucleic Acid Ther. 2014. V. 24. P. 101–113. https://doi.org/10.1089/nat.2013.0463
Prakash T.P., Graham M.J., Yu J., Carty R., Low A., Chappell A., Schmidt K., Zhao C., Aghajan M., Murray H.F., Riney S., Booten S.L., Murray S.F., Gaus H., Crosby J., Lima W.F., Guo S., Monia B.P., Swayze E.E., Seth P.P. // Nucleic Acids Res. 2014. V. 42. P. 8796–8807. https://doi.org/10.1093/nar/gku531
Yu R.Z., Graham M.J., Post N., Riney S., Zanardi T., Hall S., Burkey J., Shemesh C.S., Prakash T.P., Seth P.P., Swayze E.E., Geary R.S., Wang Y., Henry S. // Mol. Ther. Nucleic Acids. 2016. V. 5. P. e317. https://doi.org/10.1038/mtna.2016.26
Li Z., Kruijt J.K., van der Sluis R.J., Berkel T.J.C. Van, Hoekstra M. // Physiol. Genomics. 2013. V. 45. P. 268–275. https://doi.org/10.1152/physiolgenomics.00151.2012
Springer A.D., Dowdy S.F. // Nucleic Acid Ther. 2018. V. 28. P. 109–118. https://doi.org/10.1089/nat.2018.0736
Benizri S., Gissot A., Martin A., Vialet B., Grinstaff M.W., Barthélémy P. // Bioconjug. Chem. 2019. V. 30. P. 366–383. https://doi.org/10.1021/acs.bioconjchem.8b00761
Girelli D., Busti F., Marchi G., Martinelli N., Olivieri O. // Intern. Emerg. Med. 2018. V. 13. P. 313–318. https://doi.org/10.1007/s11739-018-1810-5
Bennett C.F., Swayze E.E. // Annu. Rev. Pharmacol. Toxicol. 2010. V. 50. P. 259–293. https://doi.org/10.1146/annurev.pharmtox.010909. 105654
Allerson C.R., Sioufi N., Jarres R., Prakash T.P., Naik N., Berdeja A., Wanders L., Griffey R.H., Swayze E.E., Bhat B. // J. Med. Chem. 2005. V. 48. P. 901–904. https://doi.org/10.1021/jm049167j
Nair J.K., Attarwala H., Sehgal A., Wang Q., Aluri K., Zhang X., Gao M., Liu J., Indrakanti R., Schofield S., Kretschmer P., Brown C.R., Gupta S., Willoughby J.L.S., Boshar J.A., Jadhav V., Charisse K., Zimmermann T., Fitzgerald K., Manoharan M., Rajeev K.G., Akinc A., Hutabarat R., Maier M.A. // Nucleic Acids Res. 2017. V. 45. P. 10969–10977. https://doi.org/10.1093/nar/gkx818
Wada F., Yamamoto T., Ueda T., Sawamura M., Wada S., Harada-Shiba M., Obika S. // Nucleic Acid Ther. 2018. V. 28. P. 50–57. https://doi.org/10.1089/nat.2017.0698
Yamamoto T., Wada F., Harada-Shiba M. // J. Atheroscler. Thromb. 2016. V. 23. P. 1011–1025. https://doi.org/10.5551/jat.RV16001
Brown J.M., Dahlman J.E., Neuman K.K., Prata C.A.H., Krampert M.C., Hadwiger P.M., Vornlocher H.-P. // Nucleic Acid Ther. 2019. V. 29. P. 231–244. https://doi.org/10.1089/nat.2019.0782
Weng Y., Xiao H., Zhang J., Liang X.-J., Huang Y. // Biotechnol. Adv. 2019. V. 37. P. 801–825. https://doi.org/10.1016/j.biotechadv.2019.04.012
Hu B., Zhong L., Weng Y., Peng L., Huang Y., Zhao Y., Liang X.-J. // Signal Transduct. Target. Ther. 2020. V. 5. P. 101. https://doi.org/10.1038/s41392-020-0207-x
Craig K., Abrams M., Amiji M. // Expert Opin. Drug Deliv. 2018. V. 15. P. 629–640. https://doi.org/10.1080/17425247.2018.1473375
Al Shaer D., Al Musaimi O., Albericio F., de la Torre B.G. // Pharmaceuticals. 2020. V. 13. P. 40. https://doi.org/10.3390/ph13030040
de Paula Brandão P.R., Titze-de-Almeida S.S., Titze-de-Almeida R. // Mol. Diagn. Ther. 2020. V. 24. P. 61–68. https://doi.org/10.1007/s40291-019-00438-6
Janas M.M., Harbison C.E., Perry V.K., Carito B., Sutherland J.E., Vaishnaw A.K., Keirstead N.D., Warner G. // Toxicol. Pathol. 2018. V. 46. P. 735–745. https://doi.org/10.1177/0192623318792537
Shen X., Corey D.R. // Nucleic Acids Res. 2018. V. 46. P. 1584–1600. https://doi.org/10.1093/nar/gkx1239
Zimmermann T.S., Karsten V., Chan A., Chiesa J., Boyce M., Bettencourt B.R., Hutabarat R., Nochur S., Vaishnaw A., Gollob J. // Mol. Ther. 2017. V. 25. P. 71–78. https://doi.org/10.1016/j.ymthe.2016.10.019
Cedillo I., Dana C., Engle E., Chen L., McPherson A., Rodriguez A. // Molecules. 2017. V. 22. P. 1356. https://doi.org/10.3390/molecules22081356
Setten R.L., Rossi J.J., Han S. // Nat. Rev. Drug Discov. 2019. V. 18. P. 421–446. https://doi.org/10.1038/s41573-019-0017-4
Soriano V. // AIDS Rev. 2018. V. 20. P. 125–127.
Kim Y., Jo M., Schmidt J., Luo X., Prakash T.P., Zhou T., Klein S., Xiao X., Post N., Yin Z., M-acLeod A.R. // Mol. Ther. 2019. V. 27. P. 1547–1557. https://doi.org/10.1016/j.ymthe.2019.06.009
Zuckerman J.E., Davis M.E. // Nat. Rev. Drug Discov. 2015. V. 14. P. 843–856. https://doi.org/10.1038/nrd4685
Yang B., Ming X., Cao C., Laing B., Yuan A., Porter M.A., Hull-Ryde E.A., Maddry J., Suto M., Janzen W.P., J-uliano R.L. // Nucleic Acids Res. 2015. V. 43. P. 1987–1996. https://doi.org/10.1093/nar/gkv060
To K.K.W., Fong W., Tong C.W.S., Wu M., Yan W., Cho W.C.S. // Expert Opin. Drug Discov. 2020. V. 15. P. 63–83. https://doi.org/10.1080/17460441.2020.1690449
Cai L., Gu Z., Zhong J., Wen D., Chen G., He L., Wu J., Gu Z. // Drug Discov. Today. 2018. V. 23. P. 1126–1138. https://doi.org/10.1016/j.drudis.2018.02.009
Witzigmann D., Quagliata L., Schenk S.H., Quintavalle C., Terracciano L.M., Huwyler J. // Hepatol. Res. 2016. V. 46. P. 686–696. https://doi.org/10.1111/hepr.12599
Shi B., Abrams M., Sepp-Lorenzino L. // J. Histochem. Cytochem. 2013. V. 61. P. 901–909. https://doi.org/10.1369/0022155413503662
Bunker A., Magarkar A., Viitala T. // Biochim. Biophys. Acta. 2016. V. 1858. P. 2334–2352. https://doi.org/10.1016/j.bbamem.2016.02.025
Lee Y., Thompson D.H. // Wiley Interdiscip. Rev. Nanomed. Nanobiotechnol. 2017. V. 9. P. e1450. https://doi.org/10.1002/wnan.1450
El-Hammadi M.M., Arias J.L. // Expert Opin. Ther. Pat. 2019. V. 29. P. 891–907. https://doi.org/10.1080/13543776.2019.1679767
Basha S.A., Salkho N., Dalibalta S., Husseini G.A. // Mini Rev. Med. Chem. 2019. V. 19. P. 961–969. https://doi.org/10.2174/1389557519666190408155251
Olusanya T., Haj Ahmad R., Ibegbu D., Smith J., Elkordy A. // Molecules. 2018. V. 23. P. 907. https://doi.org/10.3390/molecules23040907
Scheideler M., Vidakovic I., Prassl R. // Chem. Phys. Lipids. 2020. V. 226. P. 104 837. https://doi.org/10.1016/j.chemphyslip.2019.104837
Salatin S., Jelvehgari M., Maleki-Dizaj S., Adibkia K. // Ther. Deliv. 2015. V. 6. P. 1017–1029. https://doi.org/10.4155/tde.15.28
Karimi M., Bahrami S., Ravari S.B., Zangabad P.S., Mirshekari H., Bozorgomid M., Shahreza S., Sori M., Hamblin M.R. // Expert Opin. Drug Deliv. 2016. V. 13. P. 1609–1623. https://doi.org/10.1080/17425247.2016.1193149
Neek M., Kim T.I., Wang S.-W. // Nanomedicine. 2019. V. 15. P. 164–174. https://doi.org/10.1016/j.nano.2018.09.004
Liu K., Jiang X., Hunziker P. // Nanoscale. 2016. V. 8. P. 16 091–16 156. https://doi.org/10.1039/c6nr04489a
Deirram N., Zhang C., Kermaniyan S.S., Johnston A.P.R., Such G.K. // Macromol. Rapid Commun. 2019. V. 40. P. e1 800 917. https://doi.org/10.1002/marc.201800917
Zhao K., Li D., Shi C., Ma X., Rong G., Kang H., Wang X., Sun B. // Curr. Drug Deliv. 2016. V. 13. P. 494–499. https://doi.org/10.2174/156720181304160521004609
Ulbrich K., Holá K., Šubr V., Bakandritsos A., Tuček J., Zbořil R. // Chem. Rev. 2016. V. 116. P. 5338–5431. https://doi.org/10.1021/acs.chemrev.5b00589
Jaimes-Aguirre L., Gibbens-Bandala B.V., Morales-Avila E., Ocampo-García B.E., Seyedeh-Fatemeh M., Amirhosein A. // Curr. Pharm. Des. 2016. V. 22. P. 2886–903. https://doi.org/10.2174/1381612822666160217125028
Kuznetsova N.R., Svirshchevskaya E.V., Sitnikov N.S., Abodo L., Sutorius H., Zapke J., Velder J., Thomopoulou P., Oschkinat H., Prokop A., Schmalz H.-G., Fedorov A.Yu., Vodovozov E.L. // Биоорг. химия. 2013. V. 39. P. 609–618. [Kuznetsova N.R., Svirshchevskaya E.V., Sitnikov N.S., Abodo L., Sutorius H., Zapke J., Velder J., Thomopoulou P., Oschkinat H., Prokop A., Schmalz H.-G., Fedorov A.Yu., Vodovozov E.L. // Russ. J. Bioorg. Chem. 2013. V. 39. P. 543–552.] https://doi.org/10.1134/S1068162013050105
Guo Q., Shen X., Li Y., Xu S. // Curr. Med. Sci. 2017. V. 37. P. 635–641. https://doi.org/10.1007/s11596-017-1783-z
Pardo J., Peng Z., Leblanc R. // Molecules. 2018. V. 23. P. 378. https://doi.org/10.3390/molecules23020378
Martincic M., Tobias G. // Expert Opin. Drug Deliv. 2015. V. 12. P. 563–581. https://doi.org/10.1517/17425247.2015.971751
Rode A., Sharma S., Mishra D.K. // Curr. Drug Deliv. 2018. V. 15. P. 620–629. https://doi.org/10.2174/1567201815666171221124711
Chauhan A. // Molecules. 2018. V. 23. P. e938. https://doi.org/10.3390/molecules23040938
Ray S., Li Z., Hsu C.-H., Hwang L.-P., Lin Y.-C., Chou P.-T., Lin Y.-Y. // Theranostics. 2018. V. 8. P. 6322–6349. https://doi.org/10.7150/thno.27828
Huang D., Wu D. // Mater. Sci. Eng. C Mater. Biol. Appl. 2018. V. 90. P. 713–727. https://doi.org/10.1016/j.msec.2018.03.002
Sharma A.K., Gothwal A., Kesharwani P., Alsaab H., Iyer A.K., Gupta U. // Drug Discov. Today. 2017. V. 22. P. 314–326. https://doi.org/10.1016/j.drudis.2016.09.013
Wang H., Huang Q., Chang H., Xiao J., Cheng Y. // Biomater. Sci. 2016. V. 4. P. 375–390. https://doi.org/10.1039/C5BM00532A
Hsu H.-J., Bugno J., Lee S., Hong S. // Wiley Interdiscip. Rev. Nanomed. Nanobiotechnol. 2017. V. 9. P. e1409.https://doi.org/10.1002/wnan.1409
Cabuzu D., Cirja A., Puiu R., Grumezescu A. // Curr. Top. Med. Chem. 2015. V. 15. P. 1605–1613. https://doi.org/10.2174/1568026615666150414144750
Daraee H., Eatemadi A., Abbasi E., Fekri Aval S., Kouhi M., Akbarzadeh A. // Artif. Cells Nanomed. Biotechnol. 2016. V. 44. P. 410–422. https://doi.org/10.3109/21691401.2014.955107
Kong F.-Y., Zhang J.-W., Li R.-F., Wang Z.-X., Wang W.-J., Wang W. // Molecules. 2017. V. 22. P. E1445. https://doi.org/10.3390/molecules22091445
Connor D.M., Broome A.-M. // Adv. Cancer Res. 2018. V. 139. P. 163–184. https://doi.org/10.1016/bs.acr.2018.05.001
Gholipourmalekabadi M., Mobaraki M., Ghaffari M., Zarebkohan A., Omrani V.F., Urbanska A.M., Seifalian A. // Curr. Pharm. Des. 2017. V. 23. P. 2918–2929. https://doi.org/10.2174/1381612823666170419105413
Alemzadeh E., Dehshahri A., Izadpanah K., Ahmadi F. // Colloids Surf. B Biointerfaces. 2018. V. 167. P. 20–27. https://doi.org/10.1016/j.colsurfb.2018.03.026
Shahgolzari M., Pazhouhandeh M., Milani M., Khosroushahi A.Y., Fiering S. // Wiley Interdiscip. Rev. Nanomed. Nanobiotechnol. 2020. P. e1629. https://doi.org/10.1002/wnan.1629
Sadauskas E., Wallin H., Stoltenberg M., Vogel U., Doering P., Larsen A., Danscher G. // Part. Fibre Toxicol. 2007. V. 4. P. 10. https://doi.org/10.1186/1743-8977-4-10
Nel A.E., Mädler L., Velegol D., Xia T., Hoek E.M. V., Somasundaran P., Klaessig F., Castranova V., Thompson M. // Nat. Mater. 2009. V. 8. P. 543–557. https://doi.org/10.1038/nmat2442
Longmire M., Choyke P.L., Kobayashi H. // Nanomedicine. 2008. V. 3. P. 703–717. https://doi.org/10.2217/17435889.3.5.703
Golombek S.K., May J.-N., Theek B., Appold L., Drude N., Kiessling F., Lammers T. // Adv. Drug Deliv. Rev. 2018. V. 130. P. 17–38. https://doi.org/10.1016/j.addr.2018.07.007
Musumeci F., Radi M., Brullo C., Schenone S. // J. Med. Chem. 2012. V. 55. P. 10 797–10 822. https://doi.org/10.1021/jm301085w
Cheung A., Bax H.J., Josephs D.H., Ilieva K.M., Pellizzari G., Opzoomer J., Bloomfield J., Fittall M., Grigoriadis A., Figini M., Canevari S., Spicer J.F., Tutt A.N., Karagiannis S.N. // Oncotarget. 2016. V. 7. P. 52 553–52 574. https://doi.org/10.18632/oncotarget.9651
Raz A., Nakahara S. // Anticancer Agents Med. Chem. 2008. V. 8. P. 22–36. https://doi.org/10.2174/187152008783330833
Du J., Lane L.A., Nie S. // J. Control. Release. 2015. V. 219. P. 205–214. https://doi.org/10.1016/j.jconrel.2015.08.050
Zhou L., Wang H., Li Y. // Theranostics. 2018. V. 8. P. 1059–1074. https://doi.org/10.7150/thno.22679
Tang Q., Yu B., Gao L., Cong H., Song N., Lu C. // Curr. Med. Chem. 2018. V. 25. P. 1837–1866. https://doi.org/10.2174/0929867325666180111095913
Park J.H., Cho Y.W., Son Y.J., Kim K., Chung H., Jeong S.Y., Choi K., Park C.R., Park R.-W., Kim I.-S., Kwon I.C. // Colloid Polym. Sci. 2006. V. 284. P. 763–770. https://doi.org/10.1007/s00396-005-1438-7
Ai S., Zhen S., Liu Z., Sun F., He X., Chu F., Guan W., Wang J. // RSC Adv. 2018. V. 8. P. 30 012–30 020. https://doi.org/10.1039/C8RA05071F
Khatun Z., Nurunnabi M., Reeck G.R., Cho K.J., Lee Y. // J. Control. Release. 2013. V. 170. P. 74–82. https://doi.org/10.1016/j.jconrel.2013.04.024
Son Y. // J. Control. Release. 2003. V. 91. P. 135–145. https://doi.org/10.1016/S0168-3659(03)00231-1
Park J. H., Kwon S., Lee M., Chung H., Kim J.-H., Kim Y.-S., Park R.-W., Kim I.-S., Seo S.B., Kwon I.C., Jeong S.Y. // Biomaterials. 2006. V. 27. P. 119–126. https://doi.org/10.1016/j.biomaterials.2005.05.028
Lee E., Lee J., Lee I.-H., Yu M., Kim H., Chae S.Y., Jon S. // J. Med. Chem. 2008. V. 51. P. 6442–6449. https://doi.org/10.1021/jm800767c
Fattahi A., Asgarshamsi M., Hasanzadeh F., Varshosaz J., Rostami M., Mirian M., Sadeghi-aliabadi H. // J. Mater. Sci. Mater. Med. 2015. V. 26. P. 119. https://doi.org/10.1007/s10856-015-5407-5
Gong X.-Y., Yin Y.-H., Huang Z.-J., Lu B., Xu P.-H., Zheng H., Xiong F.-L., Xu H.-X., Xiong X., Gu X.-B. // Int. J. Pharm. 2012. V. 436. P. 240–247. https://doi.org/10.1016/j.ijpharm.2012.06.043
Huang S., Huang G. // Drug Deliv. 2019. V. 26. P. 252–261. https://doi.org/10.1080/10717544.2019.1580322
Tran T.H., Bae B., Lee Y., Na K., Huh K.M. // Carbohydr. Polym. 2013. V. 92. P. 1615–1624. https://doi.org/10.1016/j.carbpol.2012.10.075
Wang X., Lang S., Tian Y., Zhang J., Yan X., Fang Z., Weng J., Lu N., Wu X., Li T., Cao H., Li Z., Huang X. // ACS Cent. Sci. 2020. V. 6. P. 382–389. https://doi.org/10.1021/acscentsci.9b00956
Han J., Park W., Park S., Na K. // ACS Appl. Mater. Interfaces. 2016. V. 8. P. 7739–7747. https://doi.org/10.1021/acsami.6b01664
Svenson S., Wolfgang M., Hwang J., Ryan J., Eliasof S. // J. Control. Release. 2011. V. 153. P. 49–55. https://doi.org/10.1016/j.jconrel.2011.03.007
Shahriari M., Taghdisi S.M., Abnous K., Ramezani M., Alibolandi M. // Int. J. Pharm. 2019. V. 572. P. 118 835. https://doi.org/10.1016/j.ijpharm.2019.118835
Lee J.-Y., Lee H.S., Kang N.-W., Lee S.Y., Kim D.H., Kim S., Yoon I.-S., Cho H.-J., Kim D.-D. // Carbohydr. Polym. 2020. V. 230. P. 115 568. https://doi.org/10.1016/j.carbpol.2019.115568
Gotov O., Battogtokh G., Ko Y.T. // Mol. Pharm. 2018. V. 15. P. 4668–4676. https://doi.org/10.1021/acs.molpharmaceut.8b00640
Cadete A., Olivera A., Besev M., Dhal P.K., Gonçalves L., Almeida A.J., Bastiat G., Benoit J.-P., de la Fuente M., Garcia-Fuentes M., Alonso M.J., Torres D. // Sci. Rep. 2019. V. 9. P. 11 565. https://doi.org/10.1038/s41598-019-47995-8
Liu J., Liang N., Li S., Han Y., Yan P., Kawashima Y., Cui F., Sun S. // J. Biomater. Appl. 2020. V. 34. P. 1458–1469. https://doi.org/10.1177/0885328220905256
Li H., Zhang P., Luo J., Hu D., Huang Y., Zhang Z.-R., Fu Y., Gong T. // ACS Nano. 2019. V. 13. P. 9386–9396. https://doi.org/10.1021/acsnano.9b04166
Zhou H., Yu W., Guo X., Liu X., Li N., Zhang Y., Ma X. // Biomacromolecules. 2010. V. 11. P. 3480–3486. https://doi.org/10.1021/bm100989x
Kim J.-H., Kim Y.-S., Park K., Lee S., Nam H.Y., Min K.H., Jo H.G., Park J.H., Choi K., Jeong S.Y., Park R.-W., Kim I.-S., Kim K., Kwon I.C. // J. Control. Release. 2008. V. 127. P. 41–49. https://doi.org/10.1016/j.jconrel.2007.12.014
Hwang H.-Y., Kim I.-S., Kwon I.C., Kim Y.-H. // J. Control. Release. 2008. V. 128. P. 23–31. https://doi.org/10.1016/j.jconrel.2008.02.003
Deng L., Wang G., Ren J., Zhang B., Yan J., Li W., Khashab N.M. // RSC Adv. 2012. V. 2. P. 12 909–12 914. https://doi.org/10.1039/c2ra21888g
You J., Hu F.-Q., Du Y.-Z., Yuan H. // Biomacromolecules. 2007. V. 8. P. 2450–2456. https://doi.org/10.1021/bm070365c
Hu F.-Q., Ren G.-F., Yuan H., Du Y.-Z., Zeng S. // Colloids Surf. B Biointerfaces. 2006. V. 50. P. 97–103. https://doi.org/10.1016/j.colsurfb.2006.04.009
Hu F.-Q., Wu X., Du Y.-Z., You J., Yuan H. // Eur. J. Pharm. Biopharm. 2008. V. 69. P. 117–125. https://doi.org/10.1016/j.ejpb.2007.09.018
You J., Li X., de Cui F., Du Y.-Z., Yuan H., Hu F.Q. // Nanotechnology. 2008. V. 19. P. 045 102. https://doi.org/10.1088/0957-4484/19/04/045102
Qin Y., Chen J., Bi Y., Xu X., Zhou H., Gao J., Hu Y., Zhao Y., Chai Z. // Acta Biomater. 2015. V. 17. P. 201–209. https://doi.org/10.1016/j.actbio.2015.01.026
Tan Y., Liu C.-G. // Colloids Surf. B Biointerfaces. 2009. V. 69. P. 178–182. https://doi.org/10.1016/j.colsurfb.2008.11.026
Cao J., Huang S., Chen Y., Li S., Li X., Deng D., Qian Z., Tang L., Gu Y. // Biomaterials. 2013. V. 34. P. 6272–6283. https://doi.org/10.1016/j.biomaterials.2013.05.008
Gao C., Liu T., Dang Y., Yu Z., Wang W., Guo J., Zhang X., He G., Zheng H., Yin Y., Kong X. // Carbohydr. Polym. 2014. V. 111. P. 964–970. https://doi.org/10.1016/j.carbpol.2014.05.012
Zhang P., Wu J., Xiao F., Zhao D., Luan Y. // Med. Res. Rev. 2018. V. 38. P. 1485–1510. https://doi.org/10.1002/med.21485
Tao Y., Han J., Dou H. // J. Mater. Chem. 2012. V. 22. P. 8930–8937. https://doi.org/10.1039/c2jm30290j
Liang D.-S., Su H.-T., Liu Y.-J., Wang A.-T., Qi X.-R. // Biomaterials. 2015. V. 71. P. 11–23. https://doi.org/10.1016/j.biomaterials.2015.08.035
Zhao Z., He M., Yin L., Bao J., Shi L., Wang B., Tang C., Yin C. // Biomacromolecules. 2009. V. 10. P. 565–572. https://doi.org/10.1021/bm801225m
Gref R., Minamitake Y., Peracchia M., Trubetskoy V., Torchilin V., Langer R. // Science. 1994. V. 263. P. 1600–1603. https://doi.org/10.1126/science.8128245
Vernaez O., Neubert K.J., Kopitzky R., Kabasci S. // Polymers (Basel). 2019. V. 11. P. 1939. https://doi.org/10.3390/polym11121939
Ibrahim A.G. // Am. J. Polym. Sci. Technol. 2019. V. 5. P. 55–62. https://doi.org/10.11648/j.ajpst.20190502.13
Bhattacharya A., Rawlins J.W., Ray P., eds. Polymer grafting and crosslinking // Hoboken, NJ, USA. John Wiley & Sons, Inc. 2008. https://doi.org/10.1002/9780470414811
Choi K.Y., Yoon H.Y., Kim J.-H., Bae S.M., Park R.-W., Kang Y.M., Kim I.-S., Kwon I.C., Choi K., Jeong S.Y., Kim K., Park J.H. // ACS Nano. 2011. V. 5. P. 8591–8599. https://doi.org/10.1021/nn202070n
Han H.S., Lee J., Kim H.R., Chae S.Y., Kim M., Saravanakumar G., Yoon H.Y., You D.G., Ko H., Kim K., Kwon I.C., Park J.C., Park J.H. // J. Control. Release. 2013. V. 168. P. 105–114. https://doi.org/10.1016/j.jconrel.2013.02.022
Werle M., Bernkop-Schnürch A. // J. Pharm. Pharmacol. 2008. V. 60. P. 273–281. https://doi.org/10.1211/jpp.60.3.3001
Werle M., Hoffer M. // J. Control. Release. 2006. V. 111. P. 41–46. https://doi.org/10.1016/j.jconrel.2005.11.011
Kamra M., Moitra P., Ponnalagu D., Karande A.A., Bhattacharya S. // ACS Appl. Mater. Interfaces. 2019. V. 11. P. 37 442–37 460. https://doi.org/10.1021/acsami.9b09485
Cao Y., Tan Y.F., Wong Y.S., Liew M.W.J., Venkatraman S. // Mar. Drugs. 2019. V. 17. P. 381. https://doi.org/10.3390/md17060381
Wang B., He C., Tang C., Yin C. // Biomaterials. 2011. V. 32. P. 4630–4638. https://doi.org/10.1016/j.biomaterials.2011.03.003
Serrano-Sevilla I., Artiga Á., Mitchell S.G., De Matteis L., de la Fuente J.M. // Molecules. 2019. V. 24. P. 2570. https://doi.org/10.3390/molecules24142570
Mao S., Sun W., Kissel T. // Adv. Drug Deliv. Rev. 2010. V. 62. P. 12–27. https://doi.org/10.1016/j.addr.2009.08.004
Chen C.-K., Huang P.-K., Law W.-C., Chu C.-H., Chen N.-T., Lo L.-W. // Int. J. Nanomedicine. 2020. V. 15. P. 2131–2150. https://doi.org/10.2147/IJN.S222419
Wang Y., Ye M., Xie R., Gong S. // Bioconjug. Chem. 2019. V. 30. P. 325–337. https://doi.org/10.1021/acs.bioconjchem.8b00749
Dosio F., Arpicco S., Stella B., Fattal E. // Adv. Drug Deliv. Rev. 2016. V. 97. P. 204–236. https://doi.org/10.1016/j.addr.2015.11.011
Jacob S., Nair A.B. // Drug Dev. Res. 2018. V. 79. P. 201–217. https://doi.org/10.1002/ddr.21452
Zhao F., Yin H., Li J. // Biomaterials. 2014. V. 35. P. 1050–1062. https://doi.org/10.1016/j.biomaterials.2013.10.044
Novikov B.N., Grimsley J.K., Kern R.J., Wild J.R., Wales M.E. // J. Control. Release. 2010. V. 146. P. 318–325. https://doi.org/10.1016/j.jconrel.2010.06.003
Díaz-Moscoso A., Le Gourriérec L., Gómez-García M., Benito J., Balbuena P., Ortega-Caballero F., Guilloteau N., Di Giorgio C., Vierling P., Defaye J., Mellet C.O., Fernández J.M.G. // Chemistry. J. 2009. V. 15. P. 12 871–12 888. https://doi.org/10.1002/chem.200901149
Zuckerman J.E., Gritli I., Tolcher A., Heidel J.D., Lim D., Morgan R., Chmielowski B., Ribas A., Davis M.E., Yen Y. // Proc. Natl. Acad. Sci. USA. 2014. V. 111. P. 11 449–11 454. https://doi.org/10.1073/pnas.1411393111
Huang G., Huang H. // J. Control. Release. 2018. V. 278. P. 122–126. https://doi.org/10.1016/j.jconrel.2018.04.015
Bachar G., Cohen K., Hod R., Feinmesser R., Mizrachi A., Shpitzer T., Katz O., Peer D. // Biomaterials. 2011. V. 32. P. 4840–4848. https://doi.org/10.1016/j.biomaterials.2011.03.040
Mattheolabakis G., Milane L., Singh A., Amiji M.M. // J. Drug Target. 2015. V. 23. P. 605–618. https://doi.org/10.3109/1061186X.2015.1052072
Spadea A., Rios de la Rosa J.M., Tirella A., Ashford M.B., Williams K.J., Stratford I.J., Tirelli N., Mehibel M. // Mol. Pharm. 2019. V. 16. P. 2481–2493. https://doi.org/10.1021/acs.molpharmaceut.9b00083
Yang C., Li C., Zhang P., Wu W., Jiang X. // Theranostics. 2017. V. 7. P. 1719–1734. https://doi.org/10.7150/thno.18340
Miyazaki M., Yuba E., Hayashi H., Harada A., Kono K. // Bioconjug. Chem. 2018. V. 29. P. 44–55. https://doi.org/10.1021/acs.bioconjchem.7b00551
Jiang D., Liang J., Noble P.W. // Physiol. Rev. 2011. V. 91. P. 221–264. https://doi.org/10.1152/physrev.00052.2009
Casu B., Lindahl U. // In: Advances in Carbohydrate Chemistry and Biochemistry. Elsevier, 2001. P. 159–206. https://doi.org/10.1016/S0065-2318(01)57017-1
Garg H.G., Linhardt R.J., Hales C.A., eds. Chemistry and Biology of Heparin and Heparan Sulfate. Elsevier, 2005. https://doi.org/10.1016/B978-0-08-044859-6.X5000-X
Xu W., Qian J., Zhang Y., Suo A., Cui N., Wang J., Yao Y., Wang H. // Acta Biomater. 2016. V. 33. P. 131–141. https://doi.org/10.1016/j.actbio.2016.01.027
Fu H.-G., Chen Y., Yu Q., Liu Y. // ACS Med. Chem. Lett. 2020. V. 11. P. 1191–1195. https://doi.org/10.1021/acsmedchemlett.0c00040
Cai Z., Zhang H., Wei Y., Cong F. // Biomacromolecules. 2017. V. 18. P. 1677–1696. https://doi.org/10.1021/acs.biomac.7b00424
Xu W., Qian J., Hou G., Wang Y., Wang J., Sun T., Ji L., Suo A., Yao Y. // Acta Biomater. 2019. V. 83. P. 400–413. https://doi.org/10.1016/j.actbio.2018.11.026
Ernsting M.J., Tang W.-L., MacCallum N., Li S.-D. // Bioconjug. Chem. 2011. V. 22. P. 2474–2486. https://doi.org/10.1021/bc200284b
Dai L., Si C. // Curr. Med. Chem. 2019. V. 26. P. 2410–2429. https://doi.org/10.2174/0929867324666170711131353
Huang G., Huang H. // Nanomedicine. 2018. V. 13. P. 3149–3158. https://doi.org/10.2217/nnm-2018-0331
Varshosaz J. // Expert Opin. Drug Deliv. 2012. V. 9. P. 509–523. https://doi.org/10.1517/17425247.2012.673580
Severino P., da Silva C.F., Andrade L.N., de Lima Oliveira D., Campos J., Souto E.B. // Curr. Pharm. Des. 2019. V. 25. P. 1312–1334. https://doi.org/10.2174/1381612825666190425163424
The Danish Enoxaparin Study Group // Arch. Intern. Med. 1991. V. 151. P. 1621–1624. https://doi.org/10.1001/archinte.151.8.1621
Kucera S.U., DiNunzio J.C., Kaneko N., McGinity J.W. // Drug Dev. Ind. Pharm. 2012. V. 38. P. 341–350. https://doi.org/10.3109/03639045.2011.604328
Leiman D.A., Riff B.P., Morgan S., Metz D.C., Falk G.W., French B., Umscheid C.A., Lewis J.D. // Dis. Esophagus. 2017. V. 30. P. 1–8. https://doi.org/10.1111/dote.12535
Lavín de Juan L., García Recio V., Jiménez López P., Girbés Juan T., Cordoba-Diaz M., Cordoba-Diaz D. // J. Drug Deliv. Sci. Technol. 2017. V. 42. P. 126–133. https://doi.org/10.1016/j.jddst.2017.05.018
Ensign L.M., Cone R., Hanes J. // Adv. Drug Deliv. Rev. 2012. V. 64. P. 557–570. https://doi.org/10.1016/j.addr.2011.12.009
Li H., Dong W., Zhou J., Xu X., Li F. // Int. J. Pharm. 2013. V. 449. P. 37–43. https://doi.org/10.1016/j.ijpharm.2013.04.008
Cousin J., Cloninger M. // Int. J. Mol. Sci. 2016. V. 17. P. 1566. https://doi.org/10.3390/ijms17091566
Ingrassia L., Nshimyumukiza P., Dewelle J., Lefranc F., Wlodarczak L., Thomas S., Dielie G., Chiron C., Zedde C., Tisnès P., van Soest R., Braekman J.C., Darro F., Kiss R. // J. Med. Chem. 2006. V. 49. P. 1800–1807. https://doi.org/10.1021/jm050971v
Daniotti J.L., Lardone R.D., Vilcaes A.A. // Front. Oncol. 2016. V. 5. P. 300. https://doi.org/10.3389/fonc.2015.00300
Wu M., Li H., Liu R., Gao X., Zhang M., Liu P., Fu Z., Yang J., Zhang-Negrerie D., Gao Q. // Eur. J. Med. Chem. 2016. V. 110. P. 32–42. https://doi.org/10.1016/j.ejmech.2016.01.016
Chen F., Huang G., Huang H. // Future Med. Chem. 2020. V. 12. P. 161–171. https://doi.org/10.4155/fmc-2019-0114
Singh S., Aggarwal A., Thompson S., Tomé J.P.C., Zhu X., Samaroo D., Vinodu M., Gao R., Drain C.M. // Bioconjug. Chem. 2010. V. 21. P. 2136–2146. https://doi.org/10.1021/bc100356z
Pereira P.M.R., Rizvi W., Bhupathiraju N.V.S.D.K., Berisha N., Fernandes R., Tomé J.P.C., Drain C.M. // Bioconjug. Chem. 2018. V. 29. P. 306–315. https://doi.org/10.1021/acs.bioconjchem.7b00636
Otvagin V.F., Kuzmina N.S., Krylova L.V., Volovetsky A.B., Nyuchev A.V., Gavryushin A.E., Meshkov I.N., Gorbunova Y.G., Romanenko Y.V., Koifman O.I., Balalaeva I.V., Fedorov A.Yu. // J. Med. Chem. 2019. V. 62. P. 11 182–11 193. https://doi.org/10.1021/acs.jmedchem.9b01294
Böcker S., Laaf D., Elling L. // Biomolecules. 2015. V. 5. P. 1671–1696. https://doi.org/10.3390/biom5031671
Yuan S.S., Li M.L., Chen J.S., Zhou L., Zhou W. // ChemMedChem. 2018. V. 13. P. 764–778. https://doi.org/10.1002/cmdc.201700762
Parker N., Turk M.J., Westrick E., Lewis J.D., Low P.S., Leamon C.P. // Anal. Biochem. 2005. V. 338. P. 284–293. https://doi.org/10.1016/j.ab.2004.12.026
Low P.S., Kularatne S.A. // Curr. Opin. Chem. Biol. 2009. V. 13. P. 256–262. https://doi.org/10.1016/j.cbpa.2009.03.022
Wee P., Wang Z. // Cancers (Basel). 2017. V. 9. P. 52. https://doi.org/10.3390/cancers9050052
Salomon D.S., Brandt R., Ciardiello F., Normanno N. // Crit. Rev. Oncol. Hematol. 1995. V. 19. P. 183–232. https://doi.org/10.1016/1040-8428(94)00144-I
Jin F., Wang F. // Glycoconj. J. 2020. V. 37. P. 277–291. https://doi.org/10.1007/s10719-020-09912-4
Scarà S., Bottoni P., Scatena R. In: Scatena R., ed. Advances in cancer biomarkers. advances in experimental medicine and biology // Dordrecht. Springer. 2015. P. 247–260. https://doi.org/10.1007/978-94-017-7215-0_15
Trinchera M., Aronica A., Dall’Olio F. // Biology (Basel). 2017. V. 6. P. 16. https://doi.org/10.3390/biology6010016
Awad S., Alkashash A.M., Amin M., Baker S.J., Rose J.B. // Front. Oncol. 2020. V. 10. P. 620. https://doi.org/10.3389/fonc.2020.00620
Ferreira I., Carrascal M., Mineiro A., Bugalho A., Borralho P., Silva Z., Dall’olio F., Videira P. // Int. J. Oncol. 2019. V. 55. P. 1033–1048. https://doi.org/10.3892/ijo.2019.4886
Hashida N., Ohguro N., Yamazaki N., Arakawa Y., Oiki E., Mashimo H., Kurokawa N., Tano Y. // Exp. Eye Res. 2008. V. 86. P. 138–149. https://doi.org/10.1016/j.exer.2007.10.004
Arakawa Y., Hashida N., Ohguro N., Yamazaki N., Onda M., Matsumoto S., Ohishi M., Yamabe K., Tano Y., Kurokawa N. // Biomed. Res. 2007. V. 28. P. 331–334. https://doi.org/10.2220/biomedres.28.331
Moiseeva E.V., Kuznetsova N.R., Svirshchevskaya E.V., Bovin N.V., Sitnikov N.S., Shavyrin A.S., Beletskaya I.P., Combes S., Fedorov A.Y., Vodovozova E.L. // Biochem. Moscow Suppl. Ser. B. 2011. V. 5. P. 276. https://doi.org/10.1134/S1990750811030073
Kuznetsova N.R., Stepanova E.V., Peretolchina N.M., Khochenkov D.A., Boldyrev I.A., Bovin N.V., Vodovozova E.L. // J. Drug Target. 2014. V. 22. P. 242–250. https://doi.org/10.3109/1061186X.2013.862805
Alekseeva A., Kapkaeva M., Shcheglovitova O., Boldyrev I., Pazynina G., Bovin N., Vodovozova E. // Biochim. Biophys. Acta. 2015. V. 1848. P. 1099–1110. https://doi.org/10.1016/j.bbamem.2015.01.016
Vodovozova E.L., Moiseeva E.V., Grechko G.K., Gayenko G.P., Nifant’ev N.E., Bovin N.V., Molotkovsky J.G. // Eur. J. Cancer. 2000. V. 36. P. 942–949. https://doi.org/10.1016/S0959-8049(00)00029-0
Кузнецова Н.Р., Гаенко Г.П., Хайдуков С.В., Бовин Н.В., Водовозова Е.Л. // Биоорг. химия. 2009. V. 35. P. 542−549. [Kuznetsova N.R., Gaenko G.P., Haidukov S.V., Bovin N.V., Vodovozova E.L. // Russ. J. Bioorg. Chem. 2009. V. 35. P. 490–496.] https://doi.org/10.1134/S1068162009040116
Kuznetsova N.R., Sevrin C., Lespineux D., Bovin N.V., Vodovozova E.L., Mészáros T., Szebeni J., Grandfils C. // J. Control. Release. 2012. V. 160. P. 394–400. https://doi.org/10.1016/j.jconrel.2011.12.010
Kishimoto S., Fujitani N., Ohnishi T., Aoki H., Suzuki R., Fukushima S. // Anticancer Res. 2017. V. 37. P. 6055–6061. https://doi.org/10.21873/anticanres.12053
Mizushina Y., Hada T., Yoshida H. // Oncol. Rep. 2012. V. 28. P. 821–828. https://doi.org/10.3892/or.2012.1893
Tsuruta W., Tsurushima H., Yamamoto T., Suzuki K., Yamazaki N., Matsumura A. // Biomaterials. 2009. V. 30. P. 118–125. https://doi.org/10.1016/j.biomaterials.2008.09.009
Stahn R., Grittner C., Zeisig R., Karsten U., Felix S.B., Wenzel K. // Cell. Mol. Life Sci. 2001. V. 58. P. 141–147. https://doi.org/10.1007/PL00000774
Yamada Y., Kobayashi H., Iwasa M., Sumi S., Ushikoshi H., Aoyama T., Nishigaki K., Takemura G., Fujiwara T., Fujiwara H., Kiso M., Minatoguchi S. // Am. J. Physiol. Circ. Physiol. 2013. V. 304. P. H1124–H1133. https://doi.org/10.1152/ajpheart.00707.2012
Ansboro S., Greiser U., Barry F., Murphy M. // Eur. Cells Mater. 2012. V. 23. P. 310–319. https://doi.org/10.22203/eCM.v023a24
Hudak J.E., Bertozzi C.R. // Chem. Biol. 2014. V. 21. P. 16–37. https://doi.org/10.1016/j.chembiol.2013.09.010
Sarkar D., Vemula P.K., Zhao W., Gupta A., Karnik R., Karp J.M. // Biomaterials. 2010. V. 31. P. 5266–5274. https://doi.org/10.1016/j.biomaterials.2010.03.006
Heimburg-Molinaro J., Lum M., Vijay G., Jain M., Almogren A., Rittenhouse-Olson K. // Vaccine. 2011. V. 29. P. 8802–8826. https://doi.org/10.1016/j.vaccine.2011.09.009
Feng D., Shaikh A.S., Wang F. // ACS Chem. Biol. 2016. V. 11. P. 850–863. https://doi.org/10.1021/acschembio.6b00084
Guo J., Jiang W., Li Q., Jaiswal M., Guo Z. // Carbohydr. Res. 2020. V. 492. P. 107 999. https://doi.org/10.1016/j.carres.2020.107999
Mettu R., Chen C.-Y., Wu C.-Y. // J. Biomed. Sci. 2020. V. 27. P. 9. https://doi.org/10.1186/s12929-019-0591-0
Saboural P., Chaubet F., Rouzet F., Al-Shoukr F., Azzouna R., Bouchemal N., Picton L., Louedec L., Maire M., Rolland L., Potier G., Guludec D.L., Letourneur D., Chauvierre C. // Mar. Drugs. 2014. V. 12. P. 4851–4867. https://doi.org/10.3390/md12094851
Barbosa A.I., Coutinho A.J., Costa Lima S.A., Reis S. // Mar. Drugs. 2019. V. 17. P. 654. https://doi.org/10.3390/md17120654
Cumashi A., Ushakova N.A., Preobrazhenskaya M.E., D’Incecco A., Piccoli A., Totani L., Tinari N., Morozevich G.E., Berman A.E., Bilan M.I., Usov A.I., Ustyuzhanina N.E., Grachev A.A., Sanderson C.J., Kelly M., Rabinovich G.A., Iacobelli S., Nifantiev N.E. // Glycobiology. 2007. V. 17. P. 541–552. https://doi.org/10.1093/glycob/cwm014
Shamay Y., Elkabets M., Li H., Shah J., Brook S., Wang F., Adler K., Baut E., Scaltriti M., Jena P.V., Gardner E.E., Poirier J.T., Rudin C.M., Baselga J., Haimovitz-Friedman A., Heller D.A. // Sci. Transl. Med. 2016. V. 8. P. 345ra87. https://doi.org/10.1126/scitranslmed.aaf7374
Forero Ramirez L.M., Gobin E., Aid-Launais R., Journe C., Moraes F.C., Picton L., Le Cerf D., Letourneur D., Chauvierre C., Chaubet F. // Carbohydr. Polym. 2020. V. 245. P. 116 457. https://doi.org/10.1016/j.carbpol.2020.116457
Juenet M., Aid-Launais R., Li B., Berger A., Aerts J., Ollivier V., Nicoletti A., Letourneur D., Chauvierre C. // Biomaterials. 2018. V. 156. P. 204–216. https://doi.org/10.1016/j.biomaterials.2017.11.047
Fitton H.J., Stringer D.S., Park A.Y., Karpiniec S.N. // Mar. Drugs. 2019. V. 17. P. 571. https://doi.org/10.3390/md17100571
Zheng K.H., Kaiser Y., Poel E., Verberne H., Aerts J., Rouzet F., Stroes E., Letourneur D., Chauvierre C. // Atherosclerosis. 2019. V. 287. P. e143. https://doi.org/10.1016/j.atherosclerosis.2019.06.425
Hsu H., Hwang P. // Clin. Transl. Med. 2019. V. 8. P. e15. https://doi.org/10.1186/s40169-019-0234-9
Khatuntseva E.A., Ustuzhanina N.E., Zatonskii G.V., Shashkov A.S., Usov A.I., Nifant’ev N.E. // J. Carbohydr. Chem. 2000. V. 19. P. 1151–1173. https://doi.org/10.1080/07328300008544140
Krylov V.B., Kaskova Z.M., Vinnitskiy D.Z., Ustyuzhanina N.E., Grachev A.A., Chizhov A.O., Nifantiev N.E. // Carbohydr. Res. 2011. V. 346. P. 540–550. https://doi.org/10.1016/j.carres.2011.01.005
Ustyuzhanina N., Krylov V., Grachev A., Gerbst A., Nifantiev N. // Synthesis (Stuttg). 2006. V. 2006. P. 4017–4031. https://doi.org/10.1055/s-2006-950333
Vinnitskiy D.Z., Krylov V.B., Ustyuzhanina N.E., Dmitrenok A.S., Nifantiev N.E. // Org. Biomol. Chem. 2016. V. 14. P. 598–611. https://doi.org/10.1039/C5OB02040A
Batzke K., Büchel G., Hansen W., Schramm A. // Int. J. Mol. Sci. 2018. V. 19. P. 718. https://doi.org/10.3390/ijms19030718
Duan S., Paulson J.C. // Annu. Rev. Immunol. 2020. V. 38. P. 365–395. https://doi.org/10.1146/annurev-immunol-102419-035900
Daly J., Carlsten M., O’Dwyer M. // Front. Immunol. 2019. V. 10. P. 1047. https://doi.org/10.3389/fimmu.2019.01047
Wang J., Sun J., Liu L.N., Flies D.B., Nie X., Toki M., Zhang J., Song C., Zarr M., Zhou X., Han X., Archer K.A., O’Neill T., Herbst R.S., Boto A.N., Sanmamed M.F., Langermann S., Rimm D.L., Chen L. // Nat. Med. 2019. V. 25. P. 656–666. https://doi.org/10.1038/s41591-019-0374-x
Perdicchio M., Ilarregui J.M., Verstege M.I., Cornelissen L.A.M., Schetters S.T.T., Engels S., Ambrosini M., Kalay H., Veninga H., den Haan J.M.M., van Berkel L.A., Samsom J.N., Crocke P.R., Sparwasser T., Berod L., Garcia-Vallejo J.J., van Kooyk Y., Unger W.W.J. // Proc. Natl. Acad. Sci. USA. 2016. V. 113. P. 3329–3334. https://doi.org/10.1073/pnas.1507706113
Edgar L.J., Kawasaki N., Nycholat C.M., Paulson J.C. // Cell Chem. Biol. 2019. V. 26. P. 131–136.e4. https://doi.org/10.1016/j.chembiol.2018.10.006
Spence S., Greene M.K., Fay F., Hams E., Saunders S.P., Hamid U., Fitzgerald M., Beck J., Bains B.K., Smyth P., Themistou E., Small D.M., Schmid D., O’Kane C.M., Fitzgerald D.C., Abdelghany S.M., Johnston J.A., Fallon P.G., Burrows J.F., McAuley D.F., Kissenpfennig A., Scott C.J. // Sci. Transl. Med. 2015. V. 7. P. 303ra140. https://doi.org/10.1126/scitranslmed.aab3459
Sun Y., Hong S., Xie R., Huang R., Lei R., Cheng B., Sun D., Du Y., Nycholat C.M., Paulson J.C., Chen X. // J. Am. Chem. Soc. 2018. V. 140. P. 3592–3602. https://doi.org/10.1021/jacs.7b10990
Dam T.K., Gerken T.A., Brewer C.F. // Biochemistry. 2009. V. 48. P. 3822–3827. https://doi.org/10.1021/bi9002919
Angata T., Nycholat C.M., Macauley M.S. // Trends Pharmacol. Sci. 2015. V. 36. P. 645–660. https://doi.org/10.1016/j.tips.2015.06.008
Büll C., Heise T., Adema G.J., Boltje T.J. // Trends Biochem. Sci. 2016. V. 41. P. 519–531. https://doi.org/10.1016/j.tibs.2016.03.007
Peng W., Paulson J.C. // J. Am. Chem. Soc. 2017. V. 139. P. 12 450–12 458. https://doi.org/10.1021/jacs.7b03208
Macauley M.S., Crocker P.R., Paulson J.C. // Nat. Rev. Immunol. 2014. V. 14. P. 653–666. https://doi.org/10.1038/nri3737
Peng W., de Vries R.P., Grant O.C., Thompson A.J., McBride R., Tsogtbaatar B., Lee P.S., Razi N., Wilson I.A., Woods R.J., Paulson J.C. // Cell Host Microbe. 2017. V. 21. P. 23–34. https://doi.org/10.1016/j.chom.2016.11.004
Schweizer A., Wöhner M., Prescher H., Brossmer R., Nitschke L. // Eur. J. Immunol. 2012. V. 42. P. 2792–2802. https://doi.org/10.1002/eji.201242574
Fesnak A.D., June C.H., Levine B.L. // Nat. Rev. Cancer. 2016. V. 16. P. 566–581. https://doi.org/10.1038/nrc.2016.97
June C.H., O’Connor R.S., Kawalekar O.U., Ghassemi S., Milone M.C. // Science. 2018. V. 359. P. 1361–1365. https://doi.org/10.1126/science.aar6711
Mehta R.S., Rezvani K. // Front. Immunol. 2018. V. 9. P. 283. https://doi.org/10.3389/fimmu.2018.00283
Tang X., Yang L., Li Z., Nalin A.P., Dai H., Xu T., Yin J., You F., Zhu M., Shen W., Chen G., Zhu X., Wu D., Yu J. // Am. J. Cancer Res. 2018. V. 8. P. 1083–1089.
Matosevic S. // J. Immunol. Res. 2018. V. 2018. P. 4 054 815. https://doi.org/10.1155/2018/4054815
Banchereau J., Steinman R.M. // Nature. 1998. V. 392. P. 245–252. https://doi.org/10.1038/32588
Clausen B.E., Stoitzner P. // Front. Immunol. 2015. V. 6. P. 534. https://doi.org/10.3389/fimmu.2015.00534
Prausnitz M.R., Langer R. // Nat. Biotechnol. 2008. V. 26. P. 1261–1268. https://doi.org/10.1038/nbt.1504
Zaric M., Lyubomska O., Poux C., Hanna M.L., M-cCrudden M.T., Malissen B., Ingram R.J., Power U.F., Scott C.J., Donnelly R.F., Kissenpfennig A. // J. Invest. Dermatol. 2015. V. 135. P. 425–434. https://doi.org/10.1038/jid.2014.415
Wamhoff E.-C., Schulze J., Bellmann L., Rentzsch M., Bachem G., Fuchsberger F.F., Rademacher J., Hermann M., Del Frari B., van Dalen R., Hartmann D., van Sorge N.M., Seitz O., Stoitzner P., Rademacher C. // ACS Cent. Sci. 2019. V. 5. P. 808–820. https://doi.org/10.1021/acscentsci.9b00093
Schulze J., Rentzsch M., Kim D., Bellmann L., Stoitzner P., Rademacher C. // Biochemistry. 2019. V. 58. P. 2576–2580. https://doi.org/10.1021/acs.biochem.9b00402
Quiocho F.A. // Biochem. Soc. Trans. 1993. V. 21. P. 442–448. https://doi.org/10.1042/bst0210442
Schoen A., Freire E. // Biochemistry. 1989. V. 28. P. 5019–5024. https://doi.org/10.1021/bi00438a017
Veber D.F., Johnson S.R., Cheng H.-Y., Smith B.R., Ward K.W., Kopple K.D. // J. Med. Chem. 2002. V. 45. P. 2615–2623. https://doi.org/10.1021/jm020017n
McClellan K., Perry C.M. // Drugs. 2001. V. 61. P. 263–283. https://doi.org/10.2165/00003495-200161020-00011
von Itzstein M., Wu W.-Y., Kok G.B., Pegg M.S., Dyason J.C., Jin B., Van Phan T., Smythe M.L., White H.F., Oliver S.W., Colman P.M., Varghese J.N., Ryan D.M., Woods J.M., Bethell R.C., Hotham V.J., Cameron J.M., Penn C.R. // Nature. 1993. V. 363. P. 418–423. https://doi.org/10.1038/363418a0
Cox T., Lachmann R., Hollak C., Aerts J., van Weely S., Hrebícek M., Platt F., Butters T., Dwek R., Moyses C., Gow I., Elstein D., Zimran A. // Lancet. 2000. V. 355. P. 1481–1485. https://doi.org/10.1016/S0140-6736(00)02161-9
Chen X., Zheng Y., Shen Y. // Curr. Med. Chem. 2006. V. 13. P. 109–116. https://doi.org/10.2174/092986706789803035
Hevey R., Ling C.-C. // Future Med. Chem. 2012. V. 4. P. 545–584. https://doi.org/10.4155/fmc.11.193
Hevey R. // Pharmaceuticals. 2019. V. 12. P. 55. https://doi.org/10.3390/ph12020055
Oberbillig T., Mersch C., Wagner S., Hoffmann-Röder A. // Chem. Commun. 2012. V. 48. P. 1487–1489. https://doi.org/10.1039/C1CC15139H
Bull C., Boltje T.J., Wassink M., de Graaf A.M.A., van Delft F.L., den Brok M.H., Adema G.J. // Mol. Cancer Ther. 2013. V. 12. P. 1935–1946. https://doi.org/10.1158/1535-7163.MCT-13-0279
Magnani J.L., Ernst B. // Discov. Med. 2009. V. 8. P. 247–252.
Gao J., Qiao S., Whitesides G.M. // J. Med. Chem. 1995. V. 38. P. 2292–2301. https://doi.org/10.1021/jm00013a005
Prescher H., Schweizer A., Kuhfeldt E., Nitschke L., Brossmer R. // ACS Chem. Biol. 2014. V. 9. P. 1444–1450. https://doi.org/10.1021/cb400952v
Prescher H., Schweizer A., Kuhfeldt E., Nitschke L., Brossmer R. // ChemBioChem. 2017. V. 18. P. 1216–1225. https://doi.org/10.1002/cbic.201600707
Wagner S., Hauck D., Hoffmann M., Sommer R., Joachim I., Müller R., Imberty A., Varrot A., Titz A. // Angew. Chemie Int. Ed. Engl. 2017. V. 56. P. 16 559–16 564. https://doi.org/10.1002/anie.201709368
Ordanini S., Varga N., Porkolab V., Thépaut M., Belvisi L., Bertaglia A., Palmioli A., Berzi A., Trabattoni D., Clerici M., Fieschi F., Bernardi A. // Chem. Commun. 2015. V. 51. P. 3816–3819. https://doi.org/10.1039/C4CC09709B
Berzi A., Ordanini S., Joosten B., Trabattoni D., Cambi A., Bernardi A., Clerici M. // Sci. Rep. 2016. V. 6. P. 35 373. https://doi.org/10.1038/srep35373
Berry G.T. In: Adam M.P., Ardinger H.H., Pagon R.A., Eds. GeneReviews® // Seattle (WA). 1993
Yamamoto T., Harada-Shiba M., Nakatani M., Wada S., Yasuhara H., Narukawa K., Sasaki K., Shibata M.-A., Torigoe H., Yamaoka T., Imanishi T., Obika S. // Mol. Ther. Nucleic Acids. 2012. V. 1. P. e22. https://doi.org/10.1038/mtna.2012.16
Keppler D., Lesch R., Reutter W., Decker K. // Exp. Mol. Pathol. 1968. V. 9. P. 279–290. https://doi.org/10.1016/0014-4800(68)90042-7
Pearce A.K., O’Reilly R.K. // Bioconjug. Chem. 2019. V. 30. P. 2300–2311. https://doi.org/10.1021/acs.bioconjchem.9b00456
Komarova B.S., Tsvetkov Y.E., Nifantiev N.E. // Chem. Rec. 2016. V. 16. P. 488–506. https://doi.org/10.1002/tcr.201500245
Krylov V.B., Argunov D.A., Vinnitskiy D.Z., Verkhnyatskaya S.A., Gerbst A.G., Ustyuzhanina N.E., Dmitrenok A.S., Huebner J., Holst O., Siebert H.-C., Nifantiev N.E. // Chemistry. 2014. V. 20. P. 16 516–16 522. https://doi.org/10.1002/chem.201405083
Токатлы А.И., Винницкий Д.З., Устюжанина Н.Е., Нифантьев Н.Э. // Биоорг. химия. 2021. Т. 47. С. 57–75. [Tokatly A.I., Vinnitskiy D.Z., Ustuzhanina N.E., Nifantiev N.E. // Russ. J. Bioorg. Chem. 2021. V. 47. P. 52–68.] https://doi.org/10.31857/S0132342321010255
Дополнительные материалы
- скачать ESM.docx
- Данные о клинических испытаниях препаратов на основе конъюгатов олигонуклеотидов с лигандами направленной доставки, содержащих фрагменты GalNAc
Рис. 1. - Рис. 7.
Инструменты
Биоорганическая химия