Биоорганическая химия, 2022, T. 48, № 4, стр. 486-494
Новые гибридные молекулы на основе серосодержащих никотинонитрилов: синтез, анальгетическая активность in vivo в тесте уксуснокислых корчей и молекулярный докинг
Д. С. Кривоколыско 1, В. В. Доценко 2, 3, *, Е. Ю. Бибик 1, А. А. Самокиш 1, Ю. С. Венидиктова 1, К. А. Фролов 4, С. Г. Кривоколыско 4, А. А. Панков 4, Н. А. Аксенов 3, И. В. Аксенова 3
1 Луганский государственный медицинский университет имени Святителя Луки
91045 Луганск, кв. 50-летия Обороны Луганска, 1г, ЛНР, Украина
2 Кубанский государственный университет
350040 Краснодар, ул. Ставропольская, 149, Россия
3 Северо-Кавказский федеральный университет
355009 Ставрополь, ул. Пушкина, 1-А, Россия
4 Луганский государственный университет им. Владимира Даля
91034 Луганск, кв. Молодежный, 20-А/7, ЛНР, Украина
* E-mail: victor_dotsenko_@mail.ru
Поступила в редакцию 23.08.2021
После доработки 22.09.2021
Принята к публикации 26.09.2021
- EDN: ZKMPBU
- DOI: 10.31857/S0132342322030101
Аннотация
Синтезированы новые гибридные молекулы, содержащие фурановый и 1,4-дигидроникотинонитрильный (либо 1,4,5,6-тетрагидроникотинонитрильный) фрагменты. Проведено исследование анальгетической активности in vivo на крысах в тесте уксуснокислых корчей. Выявлены соединения, активность которых превосходит таковую для референтного препарата (метамизол натрия). Для всех соединений проведен молекулярный докинг к циклооксигеназе-1 и циклооксигеназе-2, а также докинг с целью поиска наиболее вероятных протеиновых мишеней.
ВВЕДЕНИЕ
В современном мире особое внимание уделяется хроническому болевому синдрому, который часто возникает как следствие различных патологических процессов. Так, боль – неотъемлемый спутник более чем у 60% онкологических больных, особенно при наличии распространенного опухолевого процесса [1–3]. Среди существующих в настоящее время лекарственных средств нестероидного происхождения наиболее мощной противовоспалительной активностью обладают индометацин, кеторолак, ибупрофен и диклофенак [4–6]. Однако вызываемая ими гастропатия в ряде случаев ограничивает длительное применение этих препаратов (см., например, работу Varrassi et al. [7]). По этой причине на сегодняшний день остро стоит вопрос разработки, исследования и введения в клиническую практику новых высокоэффективных, безопасных и доступных низкомолекулярных анальгетиков нового поколения [8–10]. Особый интерес с этой точки зрения представляют частично насыщенные производные никотинонитрила (3-цианопиридина) – синтетически доступные соединения, для которых недавно была выявлена высокая активность в отношении вирусов рода Flavivirus (вирус клещевого энцефалита, вирус Повассан [11]), выраженные противовоспалительные [12] и аналептические эффекты [13], адаптогенное [14] и анальгетическое действие [15]. Несмотря на достаточно хорошую изученность никотинонитрилов (обзорные работы [16–19]), частично гидрированные аналоги исследованы в недостаточной мере, особенно в плане их биологической активности.
В последние годы весьма популярное направление дизайна лекарственных средств – синтез так называемых гибридных, или мультимодальных, молекул [20–25]. Данная концепция основана на соединении в одной молекуле фрагментов с различным фармакотерапевтическим профилем, связанных непосредственно либо через гибкий спейсер. Следствием такой “конъюгации” может быть усиление действия препарата за счет более эффективного связывания с протеиновой мишенью, возникновение новых видов активности, устранение побочных эффектов или снижение резистентности к препарату.
Цель настоящей работы – создание гибридных молекул, связывающих фармакофорные субъединицы – фрагменты частично гидрированного пиридинового цикла и 2-фурильный остаток, и изучение анальгетической активности полученных соединений in vivo в тесте уксуснокислых корчей. Частично насыщенные пиридиновые субъединицы относятся к группе привилегированных скаффолдов [26, 27]. Выбор фуранового фрагмента обусловлен биологической значимостью производных фурана [28–31] и препаративным удобством введения 2-фурильного заместителя.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Скрининг соединений. С использованием программных сервисов OSIRIS Property Explorer [32], SwissADME [33], admetSAR [34] и GUSAR [35] проведена оценка параметров ADMET (Absorption, Distribution, Metabolism, Excretion, Toxicity) и соответствия критериям биодоступности для базы соединений из 170 синтезированных нами ранее новых серосодержащих производных 1,4‑ди- и 1,4,5,6-тетрагидропиридинов, содержащих 2-фурильный заместитель в положении 4 пиридинового цикла. Оценивались следующие параметры: молекулярная масса соединения, липофильность как сLogP – логарифм коэффициента распределения между н-октанолом и водой log(coctanol/cwater), TPSA (топологическая полярная площадь поверхности), число акцепторов и доноров водородных связей, растворимость (logS), ряд токсикологических характеристик (расчетный мутагенный потенциал по Эймсу, острая токсичность и др.), возможность гастроинтестинальной абсорбции и проникновения через гематоэнцефалический барьер, общая оценка фармакологического потенциала соединения (drug score) (см. дополнительные материалы, табл. S1 и S2 ). По результатам анализа из библиотеки были отобраны пять соединений (I–V) (схема 1 ), которые по большей части соответствуют критериям пероральной биодоступности, не обнаруживают прогнозируемого риска токсичных эффектов и имеют достаточно высокие предсказанные значения показателя фармакологического потенциала соединения (drug score). Расчетная оценка острой токсичности позволяет отнести соединения (I–V) к IV и V классам опасности согласно критериям OECD [36]. С помощью онлайн-сервиса Swiss Target Prediction [37, 38] также проведена предварительная оценка биомишеней.
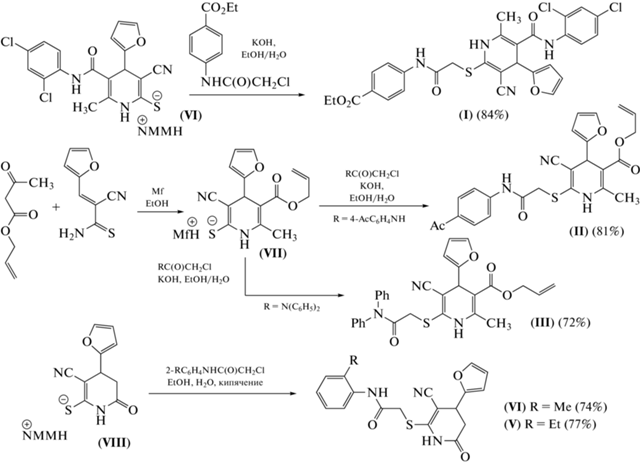
Cхема 1. Синтез 4-(2-фурил)-1,4-дигидропиридин-3-карбонитрилов (I–III) и 4-(2-фурил)-1,4,5,6-тетрагидропиридин-3-карбонитрилов (IV) и (V). NMM – N-метилморфолин, Mf – морфолин.
Отобранные с помощью программ виртуального биоскрининга пять образцов серосодержащих ди- и тетрагидропиридинов наиболее перспективны с учетом предполагаемых биомишеней для фармакокоррекции болевого синдрома. Возможными мишенями для соединений (I–V), по предварительным оценкам, могут быть циклооксигеназы COX-1 и COX-2.
Синтез соединений (I–V). Исходный 6-метил-4-(2-фурил)-5-[(2,4-дихлорфенил)карбамоил]-3-циано-1,4-дигидропиридин-2-тиолат N-метилморфолиния (VI), необходимый для получения соединения (I), был синтезирован по общей процедуре, описанной в работах [39–41] (схема 1 ). Соединение (I) синтезировано последующим S-алкилированием исходного тиолата (VI) N-хлорацетильным производным бензокаина в водно-спиртовой среде в присутствии 10%-ного раствора КОН. Необходимый для получения 1,4-дигидроникотинонитрилов (II) и (III) 5-[(аллилокси)карбонил]-6-метил-4-(2-фурил)-3-циано-1,4-дигидропиридин-2-тиолат морфолиния (VII) был получен по описанным в литературе процедурам [42, 43]. Серосодержащие дигидропиридины (II) и (III) были получены алкилированием тиолата (VII) соответствующими α-хлорацетамидами. При нагревании 1,4,5,6-тетрагидропиридин-2-тиолата (VIII) [44–46] в водном спирте с орто-R-замещенными хлорацетанилидами получали целевые соединения (IV) и (V) (схема 1 ).
Строение соединений (I–V) подтверждено данными ИК- и ЯМР-спектроскопии на ядрах 1Н и 13С. Данные спектров приведены в дополнительных материалах.
Анальгетическая активность соединений (I–V) in vivo в тесте уксуснокислых корчей. Определение анальгетической активности соединений проводили на модели уксуснокислых корчей, основанной на сокращении абдоминальной мускулатуры вследствие раздражения серозной оболочки введенным внутрибрюшинно раствором уксусной кислоты. Критерием анальгетической активности в этом тесте считается достоверное уменьшение числа корчей в получавшей лекарственное средство группе животных относительно контрольной группы при условии отсутствия у соединения миорелексантного действия [47, 48].
Опыты проводили на половозрелых крысах-самцах (n = 70) в осенне-зимний период согласно рекомендациям [49–51]. Крыс разделили на семь групп (n = 10): контрольную (с моделируемой перитовисцеральной болью без фармакокоррекции), референтную (группа сравнения – анальгин) и пять опытных групп по количеству исследуемых соединений (I–V). Крысам референтной группы вводили анальгин (7 мг/кг), животным опытных групп – соединения (I–V) (внутрижелудочно, 5 мг/кг) за 1.5 ч до введения альгогена. Альгоген (уксусную кислоту) вводили внутрибрюшинно в объеме 1.0 мл 7%-ного раствора однократно [47–49], через 20 мин подсчитывали число уксуснокислых корчей за 15-минутный интервал.
Полученные экспериментальные данные, зафиксированные в процессе наблюдения за подопытными животными контрольной группы, в цифровом выражении по количеству уксуснокислых корчей приведены в табл. 1. Так, результаты анализа полученного массива данных показали, что спустя 20 мин после внутрибрюшинного введения 1 мл 7%-ной уксусной кислоты крысы начинали оттягивать задние конечности кзади, переднюю брюшную стенку они прижимали ко дну клетки. При этом все крысы этой группы испытывали жажду. На протяжении 15 мин наблюдения количество уксуснокислых корчей составило 23.0. Использование нестероидного противовоспалительного препарата (НПВП) метамизола натрия (анальгина) (референтная группа) за 1.5 ч до инъекции альгогена (раствора уксусной кислоты) способствовало уменьшению числа корчей на 8.7% (до 21.0).
Таблица 1.
Дисперсионный анализ показателей анальгетической активности соединений (I–V) in vivo на крысах в тесте уксуснокислых корчей
| Группа животных | Доза, мг/кг | Среднее арифметическое, а | Дисперсия, σ2 | Среднеквадратич-ное отклонение, σ | Коэффициент вариации, V |
|---|---|---|---|---|---|
| Контроль | – | 23.0 | 2.22 | 1.49 | 6.48 |
| Анальгин | 7 | 21.0 | 1.78 | 1.33 | 6.35 |
| (I) | 5 | 18.8 | 0.84 | 0.91 | 4.89 |
| (II) | 5 | 14.9 | 0.99 | 0.99 | 6.70 |
| (III) | 5 | 17.6 | 1.15 | 1.07 | 6.11 |
| (IV) | 5 | 15.3 | 0.9 | 0.95 | 6.20 |
| (V) | 5 | 10.3 | 1.34 | 1.16 | 11.26 |
Как видно из приведенных в табл. 1 данных, все исследуемые соединения (I–V), вводимые внутригастрально, способны уменьшать число уксуснокислых корчей у крыс опытных групп после внутрибрюшинной инъекции 1 мл 7%-ного раствора уксусной кислоты в большей степени, чем препарат сравнения. Так, у лабораторных животных, получавших соединение (I) за 90 мин до введения альгогена, установлено уменьшение уксуснокислых корчей в сравнении с контрольной группой крыс на 18.3%. В опытной группе животных, получавших с целью фармакокоррекции острого болевого синдрома 1,4-дигидропиридин (III), выявлено снижение уксуснокислых корчей на 23.5% в сравнении с крысами контрольной группы. Тетрагидропиридин (IV) еще более эффективен как анальгетик – в этой группе зарегистрировано снижение изучаемого количественного показателя на 33.5% в сравнении с крысами контрольной группы без фармакокоррекции (эффективнее анальгина на 27.1%).
Наиболее значимые результаты в эксперименте были зарегистрированы в опытных группах крыс, получавших 1,4-дигидроникотинонитрил (II) и тетрагидроникотинонитрил (V). Соединение (II), содержащее в своей структуре фрагмент пара-аминобензойной кислоты, способно на 35.2% уменьшать число уксуснокислых корчей при сопоставлении с показателями в контрольной группе. Сравнение с крысами референтной группы показало, что соединение (II) в 1.4 раза эффективнее анальгина устраняет острый болевой синдром. Введение соединения (V) привело к уменьшению числа уксуснокислых корчей на 55.2% по сравнению с контрольной группой. При этом его анальгетическая активность превышает таковую у анальгина в 2.04 раза.
Молекулярный докинг. Молекулярный докинг соединений (I–V) проводили с использованием веб-сервиса Webina 1.0.3 (https://durrantlab.pitt.edu/webina/) – онлайн-приложения для запуска AutoDock Vina в браузере [52]. Кристаллографические модели целевых белков – циклооксигеназ COX-1 (PDB ID 1HT5) и COX-2 (PDB ID 1CX2) – были взяты из Protein Data Bank (www.rcsb.org) и подготовлены с использованием Autodock Tools (https://autodock.scripps.edu/). В качестве соединений сравнения использовали НПВП из группы неселективных ингибиторов COX-1 (ибупрофен, диклофенак, индометацин, кеторолак, аспирин), а также селективных ингибиторов COX-2 (мелоксикам, нимесулид, вальдекоксиб). 3D-структуры препаратов сравнения были взяты из базы Drugbank (https://go.drugbank.com/). В табл. 2 приведены значения рассчитанных скоринг-функций связывания соединений (I–V) и референтных препаратов с активными сайтами циклооксигеназ COX-1 и COX-2.
Таблица 2.
Значения скоринг-функций для соединений (I–V) и препаратов сравнения
| Соединение | Рассчитанное значение скоринг-функции, ккал/моль | |
|---|---|---|
| COX-1 (PDB ID 1HT5) | COX-2 (PDB ID 1CX2) | |
| (I) | –10.1 | –7.3 |
| (II) | –8.2 | –6.6 |
| (III) | –9.4 | –7.0 |
| (IV) | –8.9 | –6.8 |
| (V) | –9.0 | –7.2 |
| Анальгин | –7.7 | –6.3 |
| Ибупрофен | –6.4 | –5.9 |
| Диклофенак | –7.1 | –6.1 |
| Индометацин | –9.2 | –7.4 |
| Кеторолак | –7.2 | –6.5 |
| Аспирин | –5.7 | –6.1 |
| Мелоксикам | –9.6 | –9.7 |
| Нимесулид | –8.2 | –9.0 |
| Валдекоксиб | –8.5 | –8.5 |
Исходя из результатов, приведенных в табл. 2, наибольшую аффинность к циклооксигеназам COX-1 и COX-2 проявляют соединения (I), (III) и (V). При этом все соединения (I–V) обнаруживают большее сродство к COX-1 и COX-2 в сравнении с НПВП из числа неселективных ингибиторов COX-1. Cелективные ингибиторы COX-2 из числа референтных соединений (особенно мелоксикам) показывают бóльшую аффинность к COX-2, нежели исследуемые соединения, тогда как для COX-1 результаты можно считать сопоставимыми.
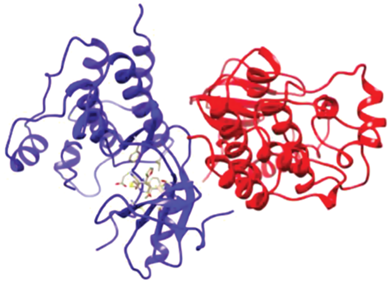
С целью определения других возможных протеиновых мишеней для соединений (I–V) был проведен поиск с использованием нового протокола протеин-лигандного докинга GalaxySagittarius [53] на базе веб-сервера GalaxyWeb [54, 55]. 3D-структуры соединений были предварительно оптимизированы средствами молекулярной механики в силовом поле ММ2 для выбора геометрии, соответствующей минимуму энергии. Молекулярный докинг с использованием протокола GalaxySagittarius проводили в режимах Binding compatability prediction и Re-ranking using docking. В табл. S3 (см. дополнительные материалы) представлены результаты докинга по каждому из соединений (I–V) для 20 комплексов “протеин–лиганд” с минимальным значением свободной энергии связывания ΔGbind и наилучшей итоговой оценкой протеин-лигандного взаимодействия. Прогнозируемые протеиновые мишени указаны с помощью ID-идентификаторов в Protein Data Bank (PDB) и в базе данных UniProt. В целом можно отметить, что общие мишени для соединений (I–V) – фактор свертывания крови Ха (PDB ID 2P95), рецептор эпидермального фактора роста (EGFR, PDB ID 3BEL), активируемый пероксисомными пролифераторами рецептор-гамма (hPPARgamma, PDB ID 2VV0), рецептор-1 свободных жирных кислот (GPR40, PDB ID 5TZR), Х-рецептор печени (LXRβ, PDB ID 5JY3) и ряд других. Тетрагидропиридины (IV) и (V) – вероятные лиганды для протеинкиназы А (PDB ID 4UJA), первого бромодомена бромодомен-содержащего белка 4 (BRD4, PDB ID 5D3S), мутантной Bcr-AblT315I тирозинкиназы (PDB ID 4TWP), играющей ключевую роль в патогенезе хронического миелоидного лейкоза, а также для тирозин-протеинкиназы ITK (PDB ID 4PQN). Следует отметить более высокое сродство к протеиновым мишеням производных 1,4-дигидропиридина (I–III) в сравнении с 1,4,5,6-тетрагидропиридинами (IV) и (V). На рис. 1 и 2 представлены 3D-визуализации отдельных комплексов “лиганд–рецептор” для соединений (I) и (V).
Рис. 1.
Прогнозируемая структура протеин-лигандного комплекса дигидропиридина (I) и фактора свертывания крови XIa (PDB ID 4X6O).
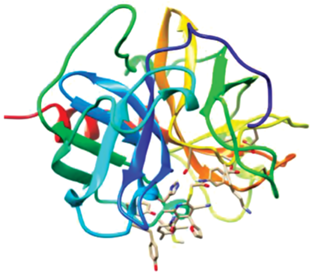
Рис. 2.
Прогнозируемая структура протеин-лигандного комплекса тетрагидропиридина (V) и протоонкогенной серин-треониновой протеинкиназы B-raf (PDB ID 4MBJ).
В целом по результатам докинга соединения (I–V) представляют интерес для дальнейшего скрининга с целью поиска антитромботических, противоопухолевых агентов, средств для лечения аутоиммунных заболеваний.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование и общие условия идентификации соединений. Спектры ЯМР 1Н и 13С регистрировали на спектрометре 400/MR (Agilent, США; 400 и 100 МГц соответственно) в растворе ДМСО-d6, в качестве стандарта использовали остаточные сигналы растворителя (δ 2.49, 39.50 м.д., ДМСО). ИК-спектры получали на спектрофотометре Vertex 70 (Bruker, Германия) с приставкой НПВО на кристалле алмаза, погрешность ± 4 см–1. Элементный анализ проводили на приборе Elementar Vario Microcube (Elementar, Германия). Индивидуальность полученных образцов контролировали методом ТСХ на пластинах Сорбфил-А (ООО “Имид”, Краснодар, Россия), элюент ‒ ацетон‒гексан, 1 : 1, проявитель – пары иода, УФ-детектор.
Этиловый эфир 4-(2-((6-метил-4-(2-фурил)-5-((2,4-дихлорфенил)карбамоил)-3-циано-1,4-дигидропиридин-2-ил)тио)ацетамидо)бензойной кислоты (I). 1,4-Дигидропиридин-2-тиолат N-метилморфолиния (VI) [41] (0.6 г, 1.18 ммоль) суспендировали в 5 мл EtOH, добавляли при перемешивании 0.65 мл (1.25 ммоль) 10%-ного водного КОН. Полученный раствор через бумажный фильтр прибавляли к теплому (40–50°С) раствору этилового эфира 4-(2-хлорацетамидо)бензойной кислоты (0.29 г, 1.18 ммоль) в 3 мл EtOH. Смесь перемешивали и нагревали (40–50°С), в течение 5 мин образовывался осадок, который через 12 ч отфильтровывали, промывали водным EtOH и высушивали при 60°С. Белый порошок, выход 0.61 г (84%).
Аллиловые эфиры 6-[(2-(R-амино-2-оксоэтил)-тио]-2-метил-4-(2-фурил)-5-циано-1,4-дигидропиридин-3-карбоновой кислоты (II), (III). Общая методика. 1,4-Дигидропиридин-2-тиолат морфолиниия (VII) [42, 43] (0.75 г, 1.93 ммоль) суспендировали в 8 мл EtOH, добавляли при перемешивании 1.0 мл (1.93 ммоль) 10%-ного водного КОН и перемешивали до растворения. Полученный раствор через бумажный фильтр медленно прибавляли к раствору соответствующего α-хлорацетамида (1.95 ммоль) в EtOH (5–6 мл). Смесь перемешивали в течение 3 ч, осадок отфильтровывали, промывали водным EtOH и высушивали при 60°С.
Аллиловый эфир 6-{[2-(4-ацетилфенил)амино-2-оксоэтил]тио}-2-метил-4-(2-фурил)-5-циано-1,4-дигидропиридин-3-карбоновой кислоты (II). Белый порошок, выход 81%.
Аллиловый эфир 2-метил-6-{[2-(дифениламино)-2-оксоэтил]тио}-4-(2-фурил)-5-циано-1,4-дигидропиридин-3-карбоновой кислоты (III). Бежевый порошок, выход 72%.
2-{[6-Оксо-4-(2-фурил)-3-циано-1,4,5,6-тетрагидропиридин-2-ил]тио}-N-(2-R-фенил)ацетамиды (IV), (V). Общая методика. Тетрагидропиридин-2-тиолат N-метилморфолиния (VIII) [44–46] (0.5 г, 1.6 ммоль) растворяли при нагревании в 60%-ном EtOH (7 мл). Полученный раствор через бумажный фильтр добавляли к теплому (40–50°С) раствору соответствующего орто-R-замещенного хлорацетанилида (1.6 ммоль) в EtOH (3–4 мл) при перемешивании. Выпавший осадок через 48 ч отфильтровывали, промывали 60%-ным EtOH и петролейным эфиром, высушивали при 60°С.
N-(2-Метилфенил)-2-{[6-оксо-4-(2-фурил)-3-циано-1,4,5,6-тетрагидропиридин-2-ил]тио}ацетамид (IV). Бежевый порошок, выход 74%.
2-{[6-Оксо-4-(2-фурил)-3-циано-1,4,5,6-тетрагидропиридин-2-ил]тио}-N-(2-этилфенил)ацетамид (V). Бежевый порошок, выход 77%.
Данные спектров и элементного анализа соединений (I–V) приведены в дополнительных материалах.
Анальгетическое действие соединений (I–V) in vivo на крысах в тесте уксуснокислых корчей. Опыты проведены на белых беспородных крысах-самцах (n = 70) массой 220–250 г половозрелого возраста (6 месяцев) из вивария ГУ ЛНР “Луганский государственный медицинский университет имени Святителя Луки” в осенне-зимний период согласно рекомендациям [49–51]. Перед началом эксперимента проводили тщательный осмотр всех крыс, учитывали их вес, возраст, двигательную активность и состояние шерстяного покрова. Экспериментальные группы, состоящие из 10 крыс, формировали методом случайного отбора. Крысы были распределены на семь групп: контрольную (с моделируемой перитовисцеральной болью без фармакокоррекции), референтную (группа сравнения – анальгин) и пять опытных групп по количеству исследуемых соединений (I–V). Альгоген (уксусную кислоту) вводили в объеме 1.0 мл 7%-ного раствора однократно, согласно классическим фармакологическим методикам [47–49]. В качестве препарата сравнения для референтной группы крыс использовали анальгин (метамизол натрия, ОАО “Фармстандарт”, Россия) в дозе 7 мг/кг. Соединения (I–V) вводили внутрижелудочно в дозе 5 мг/кг за 1.5 ч до введения используемого альгогена. Количественная экспериментальная характеристика в работе – число уксуснокислых корчей за 15-минутный интервал через 20 мин после введения альгогена (1.0 мл 7%-ного раствора уксусной кислоты внутрибрюшинно).
Cтатистическую обработку полученных результатов проводили на основе рекомендаций [49–51] и по известным формулам и методам математической статистики, характеризующим количественную изменчивость. При обработке экспериментальных данных определяли следующие показатели: среднее арифметическое числа чесательных движений а, дисперсия значений σ2 вокруг среднего арифметического, среднеквадратическое отклонение σ, коэффициент вариации V. Достоверность различий между референтной и опытными группами оценивали в сравнении с контрольной группой по t-тесту Стьюдента.
Молекулярный докинг. Молекулярный докинг к циклооксигеназам COX-1 и COX-2 выполняли с помощью сервиса Webina 1.0.3 (https://durrantlab.pitt.edu/webina/), молекулярный докинг с целью поиска новых вероятных протеиновых мишеней – с использованием сервиса GalaxySagittarius [53] на базе веб-сервера GalaxyWeb [54, 55]. Молекулярную графику обрабатывали и визуализировали с использованием программного комплекса UCSF Chimera [56, 57].
ЗАКЛЮЧЕНИЕ
В соответствии с критериями биодоступности и оценкой параметров ADMET из библиотеки 170 производных пиридина отобраны синтезированные нами в лаборатории “Химэкс” пять соединений – производные 4-(2-фурил)-1,4-дигидроникотинонитрила и 4-(2-фурил)-1,4,5,6-тетрагидроникотинонитрила. Исследовано in vivo анальгетическое действие указанных соединений в тесте уксуснокислых корчей на крысах. Все исследованные соединения проявили анальгетическую активность различных степеней выраженности, превышающую таковую у метамизола натрия. Анальгетическое действие тетрагидропиридина (V) более чем в 2 раза превышает таковое для препарата сравнения (анальгин). Проведен молекулярный докинг соединений по отношению к COX-1 и COX-2, а также докинг с целью поиска других вероятных мишеней. Результаты докинга показывают, что наибольшим сродством к активным центрам COX-1 и COX-2 обладают соединения (I), (III) и (V).
Новые соединения представляют интерес для дальнейших исследований в области поиска противовоспалительных средств и средств фармакотерапии болевого синдрома.
Список литературы
Mitra R., Jones S. // Am. J. Hospice Palliat. Med. 2012. V. 29. P. 70–79. https://doi.org/10.1177/1049909111413256
van den Beuken-van Everdingen M.H., de Graeff A., Jongen J.L., Dijkstra D., Mostovaya I., Vissers K.C., National Guideline Working Group “Diagnosis Treatment of Cancer Pain” // Pain Practice. 2017. V. 17. P. 409–419. https://doi.org/10.1111/papr.12459
Magee D.J., Jhanji S., Poulogiannis G., Farquhar-Smith P., Brown M.R.D. // Brit. J. Anaesth. 2019. V. 123. P. e412–e423. https://doi.org/10.1016/j.bja.2019.02.028
Lucas S. // Headache. 2016. V. 56. P. 436–446. https://doi.org/10.1111/head.12769
Wakai A., Lawrenson J.G., Lawrenson A.L., Wang Y., Brown M.D., Quirke M., Ghandour O., McCormick R., Walsh C.D., Amayem A., Lang E., Harrison N. // Cochrane Database Syst. Rev. 2017. CD009781. https://doi.org/10.1002/14651858.CD009781.pub2
Wiffen P.J., Xia J. // Curr. Med. Res. Opin. 2020. V. 36. P. 637–650. https://doi.org/10.1080/03007995.2020.1716703
Varrassi G., Pergolizzi J.V., Dowling P., Paladini A. // Adv. Therap. 2020. V. 37. P. 61–82. https://doi.org/10.1007/s12325-019-01144-9
Díaz-González F., Sánchez-Madrid F. // Eur. J. Immunol. 2015. V. 45. P. 679–686. https://doi.org/10.1002/eji.201445222
Yousefifard M., Zali A., Zarghi A., Madani Neishaboori A., Hosseini M., Safari S. // Int. J. Clin. Pract. 2020. V. 74. P. e13557. https://doi.org/10.1111/ijcp.13557
Machado G.C., Maher C.G., Ferreira P.H., Day R.O., Pinheiro M.B., Ferreira M.L. // Ann. Rheumat. Diseases. 2017. V. 76. P. 1269–1278. https://doi.org/10.1136/annrheumdis-2016-210597
Osolodkin D.I., Kozlovskaya L.I., Dueva E.V., Dotsenko V.V., Rogova Y.V., Frolov K.A., Krivokolysko S.G., Romanova E.G., Morozov A.S., Karganova G.G., Palyulin V.A., Pentkovski V.M., Zefirov N.S. // ACS Med. Chem. Lett. 2013. V. 4. P. 869–874. https://doi.org/10.1021/ml400226s
Бибик Е.Ю., Ярошевская О.Г., Девдера А.В., Деменко А.В., Захаров В.В., Фролов К.А., Доценко В.В., Кривоколыско С.Г. // Хим.-фарм. журн. 2017. Т. 51. С. 16–19. [Bibik E.Yu., Yaroshevskaya O.G., Devdera A.V., Demenko A.V., Zakharov V.V., Frolov K.A., Dotsenko V.V., Krivokolysko S.G. // Pharm. Chem. J. 2017. V. 51. P. 648–651.] https://doi.org/10.1007/s11094-017-1669-1
Bibik E.Yu., Saphonova A.A., Yeryomin A.V., Frolov K.A., Dotsenko V.V., Krivokolysko S.G. // Res. Results Pharmacol. 2017. V. 3. P. 20–25. https://doi.org/10.18413/2313-8971-2017-3-4-20-25
Бибик Е.Ю., Некраса И.А., Деменко А.В., Фролов К.А., Доценко В.В., Кривоколыско С.Г. // Бюлл. сиб. мед. 2019. Т. 18. С. 21–28. [Bibik E.Yu., Nekrasa I.A., Demenko A.V., Frolov K.A., Dotsenko V.V., Krivokolysko S.G. // Bull. Sib. Med. 2019. V. 18. P. 21–28.] https://doi.org/10.20538/1682-0363-2019-3-21-28
Bibik I.V., Bibik E.Yu., Dotsenko V.V., Frolov K.A., Krivokolysko S.G., Aksenov N.A., Aksenova I.V., Shcherbakov S.V., Ovcharov S.N. // Russ. J. Gen. Chem. 2021. V. 91. P. 154–166. https://doi.org/10.1134/S107036322102002X
Litvinov V.P. // Russ. Chem. Rev. 2006. V. 75. P. 577–599. https://doi.org/10.1070/RC2006v075n07ABEH003619
Salem M.A., Helel M.H., Gouda M.A., Ammar Y.A., El-Gaby M.S.A. // Synth. Commun. 2018. V. 48. P. 345–374. https://doi.org/10.1080/00397911.2017.1394468
Gouda M.A., Hussein B.H., Helal M.H., Salem M.A. // J. Heterocycl. Chem. 2018. V. 55. P. 1524–1553. https://doi.org/10.1002/jhet.3188
Gouda M.A., Attia E., Helal M.H., Salem M.A. // J. Heterocycl. Chem. 2018. V. 55. P. 2224–2250. https://doi.org/10.1002/jhet.3298
Decker M. // Mini Rev. Med. Chem. 2007. V. 7. P. 221–229. https://doi.org/10.2174/138955707780059817
Shaveta, Mishra S., Singh P. // Eur. J. Med. Chem. 2016. V. 124. P. 500–536. https://doi.org/10.1016/j.ejmech.2016.08.039
Auti P.S., George G., Paul A.T. // RSC Adv. 2020. V. 10. P. 41353–41392. https://doi.org/10.1039/d0ra06642g
Ivasiv V., Albertini C., Gonçalves A.E., Rossi M., Bolognesi M.L. // Curr. Top. Med. Chem. 2019. V. 19. P. 1694–1711. https://doi.org/10.2174/1568026619666190619115735
Prasher P., Sharma M., Aljabali A.A.A., Gupta G., Negi P., Kapoor D.N., Singh I., Zacconi F.C., de Jesus Andreoli Pinto T., da Silva M.W., Bakshi H.A., Chellappan D.K., Tambuwala M.M., Dua K. // Drug Dev. Res. 2020. V. 81. P. 837–858. https://doi.org/10.1002/ddr.21704
Panda P., Chakroborty S. // ChemistrySelect. 2020. V. 5. P. 10187–10199. https://doi.org/10.1002/slct.202002790
Yet L. // Privileged Structures in Drug Discovery: Medicinal Chemistry and Synthesis, 1st ed. JohnWiley & Sons Inc.: Hoboken, NJ, USA, 2018.
Welsch M.E., Snyder S.A., Stockwell B.R. // Curr. Opin. Chem. Biol. 2010. V. 14. P. 347–361. https://doi.org/10.1016/j.cbpa.2010.02.018
Lukevits É., Demicheva L. // Chem. Heterocycl. Compd. 1993. V. 29. P. 243–267. https://doi.org/10.1007/BF00531499
Barros M.R., Menezes T.M., da Silva L.P., Pires D.S., Princival J.L., Seabra G., Neves J.L. // Int. J. Biol. Macromol. 2019. V. 136. P. 1034–1041. https://doi.org/10.1016/j.ijbiomac.2019.06.120
Chiurchiù E., Gabrielli S., Ballini R., Palmieri A. // Molecules. 2019. V. 24. P. 4575. https://doi.org/10.3390/molecules24244575
Ali H., Jabeen A., Maharjan R., Nadeem-ul-Haque M., Aamra H., Nazir S., Khan S., Olleik H., Maresca M., Shaheen F. // Biomolecules. 2020. V. 10. P. 1684. https://doi.org/10.3390/biom10121684
Sander T. // OSIRIS Property Explorer. http://www.organic-chemistry.org/prog/peo/
Daina A., Michielin O., Zoete V. // Sci. Rep. 2017. V. 7. P. 42717. https://doi.org/10.1038/srep42717
Cheng F., Li W., Zhou Y., Shen J., Wu Z., Liu G., Lee P.W., Tang Y. // J. Chem. Inf. Model. 2012. V. 52. P. 3099–3105. https://doi.org/10.1021/ci300367a
Lagunin A., Zakharov A., Filimonov D., Poroikov V. // Mol. Inform. 2011. V. 30. P. 241–250. https://doi.org/10.1002/minf.201000151
OECD Environment, Health and Safety Publications. Series on Testing and Assessment. No. 24 // Guidance Document on Acute Oral Toxicity Testing. Paris: OECD, 2001. https://www.oecd.org/officialdocuments/publicdisplaydocumentpdf/?cote=env/jm/mono(2001)4&doclanguage=en
Daina A., Michielin O., Zoete V. // Nucl. Acids Res. 2019. V. 47. P. W357–W364. https://doi.org/10.1093/nar/gkz382
Swiss Target Prediction. http://www.swisstargetprediction.ch/
Кривоколыско С.Г., Дяченко В.Д., Литвинов В.П. // Журн. орг. химии. 1997. Т. 33. С. 1088–1093. [Krivokolysko S.G., Dyachenko V.D., Litvinov V.P. // Russ. J. Org. Chem. 1997. V. 33. P. 1018–1023.]
Дяченко В.Д., Кривоколыско С.Г., Литвинов В.П. // Журн. орг. химии. 1998. Т. 34. С. 927. [Dyachenko V.D., Krivokolysko S.G., Litvinov V.P. // Russ. J. Org. Chem. 1998. V. 34. P. 876–881.]
Osolodkin D.I., Kozlovskaya L.I., Dueva E.V., Dotsenko V.V., Rogova Y.V., Frolov K.A., Krivokolysko S.G., Romanova E.G., Morozov A.S., Karganova G.G., Palyulin V.A., Pentkovski V.M., Zefirov N.S. // ACS Med. Chem. Lett. 2013. V. 4. P. 869–874. https://doi.org/10.1021/ml400226s
Калашник И.Н., Дяченко В.Д. // Журн. общ. химии. 2020. Т. 90. С. 371–381. [Kalashnik I.N., Dyachenko V.D. // Russ. J. Gen. Chem. 2020. V. 90. P. 357–366.] https://doi.org/10.1134/S1070363220030068
Дяченко В.Д. // Журн. орг. химии. 2007. Т. 43. С. 278–282. [Dyachenko V.D. // Russ. J. Org. Chem. 2007. V. 43. P. 271–275.] https://doi.org/10.1134/S1070428007020194
Dotsenko V.V., Frolov K.A., Pekhtereva T.M., Papaianina O.S., Suykov S.Y., Krivokolysko S.G. // ACS Comb. Sci. 2014. V. 16. P. 543–550. https://doi.org/10.1021/co5000807
Dotsenko V.V., Lebedeva I.A., Krivokolysko S.G., Povstyanoi M.V., Povstyanoi V.M., Kostyrko E.O. // Chem. Heterocycl. Compd. 2012. V. 48. P. 462–469. https://doi.org/10.1007/s10593-012-1016-0
Dotsenko V.V., Bushmarinov I.S., Goloveshkin A.S., Chigorina E.A., Frolov K.A., Krivokolysko S.G. // Phosphorus Sulfur Silicon Relat. Elem. 2017. V. 192. P. 47–52. https://doi.org/10.1080/10426507.2016.1224877
Koster R.M., Anderson M., De Beer E.J. // Fedn. Proc. 1959. V. 18. P. 412–417.
Collier H.O.J., Dinneen L.C., Johnson C.A., Schneider C. // Br. J. Pharmacol. Chemother. 1968. V. 32. P. 295–310. https://doi.org/10.1111/j.1476-5381.1968.tb00973.x
Миронов А.Н. // Руководство по проведению доклинических исследований лекарственных средств. М.: Гриф и К., 2012. 941 с.
Наркевич А.Н., Виноградов К.А. // Соц. аспекты здоровья населения. 2019. Т. 65. № 6. С. 10.
Агаянц И.М. // Азы статистики в мире химии: обработка экспериментальных данных. Санкт-Петербург: НОТ, 2015. 618 с.
Kochnev Y., Hellemann E., Cassidy K.C., Durrant J.D. // Bioinformatics. 2020. V. 36. P. 4513–4515. https://doi.org/10.1093/bioinformatics/btaa579
Yang J., Kwon S., Bae S.H., Park K.M., Yoon C., Lee J.H., Seok C. // J. Chem. Inf. Model. 2020. V. 60. P. 3246–3254. https://doi.org/10.1021/acs.jcim.0c00104
GalaxyWEB. A web server for protein structure prediction, refinement, and related methods. Galux Inc., Computational Biology Lab, Department of Chemistry, Seoul National University, S. Korea. http://galaxy.seoklab.org/index.html
Ko J., Park H., Heo L., Seok C. // Nucleic Acids Res. 2012. V. 40. P. W294–W297. https://doi.org/10.1093/nar/gks493
Pettersen E.F., Goddard T.D., Huang C.C., Couch G.S., Greenblatt D.M., Meng E.C., Ferrin T.E. // J. Comput. Chem. 2004. V. 25. P. 1605–1612. https://doi.org/10.1002/jcc.20084
UCSF Chimera – an Extensible Molecular Modeling System. https://www.rbvi.ucsf.edu/chimera/
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Инструменты
Биоорганическая химия