Биоорганическая химия, 2022, T. 48, № 6, стр. 714-720
Рибофлавин как один из возможных компонентов биолюминесцентной системы грибных комаров рода Keroplatus (Insecta: Diptera: Keroplatidae)
А. А. Котлобай 1, *, М. А. Дубинный 1, А. В. Полевой 2, С. И. Ковальчук 1, З. М. Каськова 1, 3, **
1 ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
2 Институт леса Карельского научного центра РАН
185910 Петрозаводск, ул. Пушкинская, 11, Россия
3 Российский национальный исследовательский медицинский университет имени Н.И. Пирогова
117997 Москва, ул. Островитянова, 1, Россия
* E-mail: alexey_kotlobay@ibch.ru
** E-mail: zkaskova@ibch.ru
Поступила в редакцию 04.05.2022
После доработки 09.06.2022
Принята к публикации 17.06.2022
- EDN: QSSUZX
- DOI: 10.31857/S0132342322060161
Аннотация
Личинки некоторых видов грибных комаров рода Keroplatus семейства Keroplatidae (Diptera, Bibionomorpha) способны испускать свечение синего цвета. Биолюминесценция Keroplatidae наименее изучена среди всех наземных насекомых, и на данный момент известны лишь единичные факты о биологии и биохимии этого процесса. В данной работе мы приводим первые результаты изучения биохимии светящихся личинок Keroplatus testaceus, содержащих рибофлавин в достаточно высокой концентрации. Мы предполагаем, что рибофлавин может быть одним из участников процесса биолюминесценции Keroplatus spp.
ВВЕДЕНИЕ
Биолюминесценция, или способность излучать свет, среди насекомых встречается у представителей трех отрядов: Жесткокрылые, Двукрылые и Коллемболы. Механизмы биолюминесценции жесткокрылых хорошо изучены, в то время как знаний о молекулярных основах свечения двукрылых недостаточно. Отряд двукрылых включает в себя только одну группу видов, обладающих биолюминесценцией, – это грибные комары семейства Keroplatidae, к которым относятся ~1000 видов, объединенных в 100 родов [1]. Среди них способны светиться лишь представители нескольких отдельных видов – это виды рода Arachnocampa (Edwards, 1924) из подсемейства Arachnocampinae (Австралия и Новая Зеландия) [2], вид Orfelia fultoni (Fisher, 1940) подсемейства Keroplatinae (триба Orfeliini) (Северная Америка) [3] и, наконец, виды рода Keroplatus (Bosc, 1792) (Европа и северная часть Азии), а также недавно открытый вид Neoceroplatus betaryensis (Falaschi, Johnson & Stevani, 2019) (Бразилия) подсемейства Keroplatinae, триба Keroplatini [4].
Светоизлучение у насекомых Keroplatidae основано на каталитическом окислении молекулы люциферина при участии фермента люциферазы [5, 6], однако в морфологии, физиологии и химической природе биолюминесценции двукрылых разных подсемейств мало общего [7]. У личинок Arachnocampa spp. светится брюшко, а в излучении света участвуют мальпигиевы сосуды [8]. Биолюминесцентная система Arachnocampa luminosa относится к АТР-зависимым, а молекула люциферина, по всей видимости, состоит из остатков тирозина и ксантуреновой кислоты [9]. У личинок O. fultoni светятся пять передних сегментов и брюшко [10], сама реакция биолюминесценции не зависит от кофакторов и, вероятно, имеет схожий с видами Keroplatini механизм [11]. У представителей Keroplatus spp. за счет белковых гранул жирового тела светится все тело личинки [12]. Сами личинки создают слизистую паутину под древесными грибами и излучают синий свет (λmax = 460 нм) [13]. Биолюминесценция личинок Keroplatus впервые была описана в середине XIX в. [14] на примере K. tipuloides (Bosc, 1792) (=K. sesioides Wahlberg, 1839) и несколько раз подтверждалась уже позднее [3, 15, 16]. Биохимия биолюминесценции Keroplatus, а также ее биологическая и экологическая функции до сих пор остаются одними из наименее изученных аспектов биологии среди всех светящихся насекомых. В данной работе мы сообщаем о рибофлавине (витамине B2) как об одном из флуоресцентных соединений, обнаруженных в относительно высокой концентрации [17] в личинках Keroplatus testaceus. Мы предполагаем, что рибофлавин может иметь отношение к химизму свечения этого вида Keroplatidae.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для данного исследования личинки Keroplatus были собраны c нижней поверхности трутовиков на территории Государственного природного заповедника “Кивач” в Карелии (рис. 1) в июне– июле 2020 г. Для сохранения компонентов биолюминесцентной системы биоматериал сразу после сбора замораживали в алюминиевой фольге с помощью сухого льда, а затем перемещали в лабораторную морозильную камеру для дальнейшего хранения при температуре –70°C. Несколько незамороженных живых личинок были перевезены в лабораторию для определения вида. Как мы и предполагали изначально, собранные личинки принадлежали к виду K. testaceus, наиболее распространенному в данном регионе.
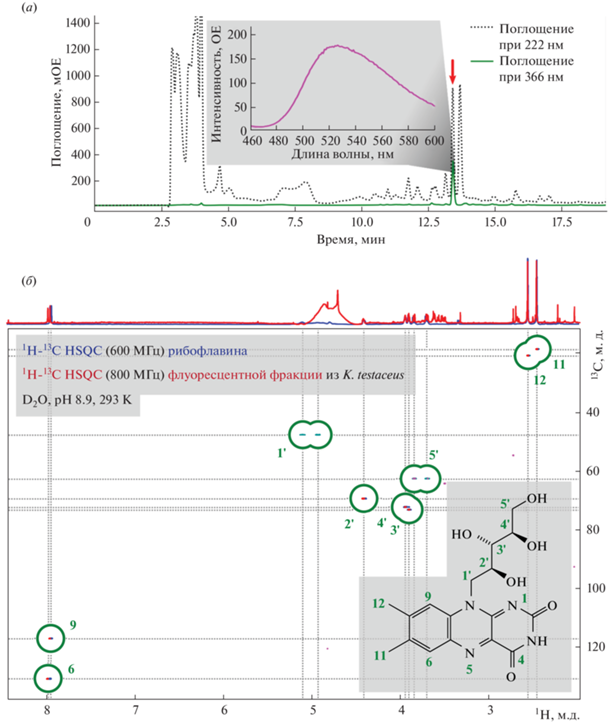
Для первичного исследования биолюминесцентной системы Keroplatus мы сосредоточились на выделении флуоресцентных компонентов из экстрактов личинок, которые могли бы быть возможными молекулами оксилюциферина [18]. Среди ряда полученных экстрактов (в этаноле, ацетоне, гексане, водных буферах и др.), приготовленных из замороженных личинок K. testaceus, водные экстракты проявляли наиболее интенсивную флуоресценцию (рис. 2a, врезка). Оптимизация условий экстракции (включая выбор оптимальной температуры и состава буфера) позволила получить флуоресцентный экстракт, который затем фильтровали с помощью ультрафильтрационной мембраны для удаления высокомолекулярных примесей. В результате все флуоресцентные компоненты оказывались исключительно в фильтрате. Далее полученный образец подвергали процедуре очистки методом ВЭЖХ (рис. 2a). Фракции, содержащие флуоресцентные соединения, идентифицировали путем измерения флуоресценции и поглощения при 366 нм, собирали отдельно, лиофильно высушивали и использовали для дальнейшего анализа. Последовательная серия хроматографических экспериментов позволила выделить из биомассы личинок K. testaceus ~3.5 опт. ед. индивидуального флуоресцентного соединения. Полученный образец анализировали методом ЯМР-спектроскопии и масс-спектрометрии высокого разрешения. Комбинацией ЯМР-экспериментов (рис. 2б; рис. S1 и табл. S1 в дополнительных материалах) и ВЭЖХ-анализа полученного образца в сравнении с коммерчески доступным рибофлавином (витамин B2) была показана идентичность данных соединений. Масс-спектрометрией высокого разрешения было установлено наличие в природном образце молекулярных ионов рибофлавина при положительном и отрицательном режимах съемки. Концентрация рибофлавина в биомассе личинок Keroplatus testaceus достаточно высока – 3.4 опт. ед. на 1 г биомассы, что соответствует 83 мкг рибофлавина на 1 г биомассы.
Рис. 2.
Очистка и определение структуры флуоресцентного вещества – рибофлавина (витамина B2) – из личинок Keroplatus spp.: (a) – хроматографический профиль водного экстракта из лиофилизированных личинок Keroplatus spp. Красной стрелкой отмечена флуоресцентная фракция. Врезка – спектр флуоресценции водного экстракта из замороженных личинок Keroplatus spp. (возбуждение при 366 нм); (б) – 1H-13C HSQC ЯМР-спектр с редактированием в соответствии с мультиплетностью сигналов для флуоресцентного соединения из личинок Keroplatus (красный и розовый), наложенный на ЯМР-спектр стандартного образца рибофлавина (синий и голубой) при тех же условиях. Врезка – условия проведения ЯМР-экспериментов (более подробную информацию см. в “Эксперим. части”) и химическая структура рибофлавина с нумерацией атомов (зеленый), совпадающей с метками пиков и химическими сдвигами в табл. S1 (см. дополнительные материалы).
Биологическое и экологическое значение биолюминесценции двукрылых до сих пор изучено мало. Личинки Arachnocampa luminosa – хищники, обитают в темных пещерах. Предположительно, они используют светоизлучение для привлечения добычи в липкие нити создаваемых ими охотничьих сетей [19]. Хищные Orfelia fultoni также используют свечение для привлечения и захвата добычи в липкую паутину [20].
В то же время о биологии, и особенно о биохимии и экологической функции биолюминесценции Keroplatus известно очень мало. Свечение Keroplatus было впервые описано более ста лет назад [14], а представители этого рода очень редки. На данный момент существуют предложения использовать Keroplatus в качестве биоиндикатора состояния лесных экосистем, в том числе для отслеживания изменений экологического состояния конкретных биотопов и охраны природы [21]. Личинки Keroplatus spp. питаются грибными спорами и мелкими беспозвоночными [22]. Они испускают видимый свет с самой короткой длиной волны излучения среди всех наземных членистоногих. Возможно, он используется для привлечения потенциальной добычи, как и у других Keroplatidae. Поскольку личинки склонны избегать солнечного света, существует гипотеза о том, что биолюминесценция может иметь защитную функцию [23]. По другому предположению, свет может быть направлен на гриб, чтобы он произвел больше спор [23]. Биолюминесцентная система Keroplatus уникальна и выступает одной из наименее изученных среди представителей всех наземных видов насекомых. Любые новые данные могут быть полезны для дальнейшего понимания природы и химизма биолюминесценции Keroplatidae.
Рибофлавин (витамин В2) – исходное соединение в биосинтезе коферментов флавинмононуклеотида (FMN) и флавинадениндинуклеотида (FAD). Биосинтез рибофлавина осуществляется в клетках бактерий, грибов и растений, но не в клетках животных [24]. Высокая концентрация витамина B2 в личинках Keroplatus указывает на то, что особи накапливают его по какой-то определенной причине. В качестве витамина рибофлавин необходим для трансформации насекомого из стадии личинки в стадию имаго. Также мы предполагаем, что он может иметь отношение к биолюминесценции Keroplatus, но для определения точной роли рибофлавина в свечении личинок требуется установление структуры всех участников данного процесса. Известно, что рибофлавин и FMN – это светоизлучатели в бактериальной биолюминесцентной системе [25–27], и их спектры эмиссии могут изменяться в результате ковалентного связывания с белком. Интересно, что недавние эксперименты с родственной биолюминесцентной системой вида Orfelia fultoni показали наличие в “горячих” экстрактах флуоресцентного зелено-желтого пигмента неизвестной структуры с максимумом флуоресценции в области 543 нм [11], который также может быть рибофлавином, однако данное предположение требует дополнительного подтверждения. Для установления потенциальной роли рибофлавина или его метаболитов в реакции биолюминесценции Keroplatus необходимы дальнейшие исследования.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Сбор биоматериала. Личинок Keroplatus testaceus собирали с нижней стороны грибов трутовиков, растущих на упавших деревьях, в Государственном природном заповеднике “Кивач” с разрешения администрации. Заповедник “Кивач” находится на расстоянии 27 км от г. Кондопога и 80 км от г. Петрозаводск. Географические координаты: N 62.16126 E 33.58969. Адрес: 186220, Республика Карелия, Кондопожский район, пос. Кивач, ул. Заповедная, 14. Собранных личинок помещали в алюминиевую фольгу (по 2–3 личинки на лист площадью 12–14 см2) и замораживали с помощью сухого льда для транспортировки и дальнейшего хранения в лаборатории в морозильной камере при температуре –70°C. Несколько незамороженных живых личинок перевезли в лабораторию для определения вида.
Определение вида. Род Keroplatus в Карелии представлен тремя близкими видами: K. testaceus (Dalman, 1918), K. dispar (Dufour, 1839) и K. tuvensis (Zaitzev, 1991) [28]. Все виды имеют схожий внешний вид и могут быть достоверно идентифицированы по различиям в строении гениталий самцов, а именно по форме вентрального отростка гонококситов [22]. По нашим предположениям, собранные личинки принадлежат к наиболее распространенному в данном регионе виду K. testaceus. Достоверное определение до видового уровня на личиночных стадиях развития в данной группе практически невозможно, поэтому 28.06.2020 г. несколько живых личинок были помещены в камеру для выведения имаго. В результате 09.07.2020 г. была получена одна взрослая самка. Самки K. testaceus отличаются от K. dispar особенностями жилкования крыльев (субкоста заканчивается примерно на уровне конца отрезка слияния радиальной и медиальной жилок) и формой церок (наибольшая толщина приходится на среднюю часть) [29, 30]. Идентификация, которую проводили по ключу Matile [29], подтвердила, что данная особь принадлежит к виду K. testaceus (рис. S2 в дополнительных материалах). Учитывая тот факт, что личинки были собраны на достаточно ограниченной территории, на сходных субстратах и в одно и то же время, мы предполагаем, что все они принадлежат к одному виду.
Получение экстрактов из биомассы. Две–три замороженные личинки K. testaceus (~0.2 г) перетирали в жидком азоте с помощью ступки и пестика. Полученный в результате измельчения порошок переносили в 1 мл TBS-буфера (50 мM Tris-HCl, 2 мM ЭДTA, pH 7.5) и инкубировали 30 мин на ледяной бане при постоянном перемешивании. Затем образец центрифугировали в течение 15 мин при 4°C и 15 000 g. Полученный в результате надосадочный раствор, содержащий исследуемые соединения, переносили в отдельную пробирку и использовали для процедуры ультрафильтрации перед дальнейшим разделением или лиофильно высушивали для хранения при температуре –70°C.
Ультрафильтрация. Раствор экстракта биомассы переносили в ультрафильтрационную ячейку 3 kDa Amicon® Ultra Centrifugal Filter Unit (Merck Millipore, Германия) и осуществляли процедуру ультрафильтрации согласно инструкции производителя. Проводили детекцию флуоресценции: флуоресценция наблюдалась только в профильтрованных образцах, которые в дальнейшем использовали для исследования методом обращенно-фазовой хроматографии.
ВЭЖХ-анализ. Для анализа образца методом обращенно-фазовой хроматографии использовали колонку Luna 5 µм C18(2) 100 Å (4.6 × 250 мм; Phenomenex, США), установленную на хроматографическую систему (Shimadzu Corporation, Япония). Состав растворов подвижной фазы был следующим: раствор А – 0.1%-ный водный раствор трифторуксусной кислоты, раствор Б – 0.08%-ный раствор трифторуксусной кислоты в ацетонитриле. Разделение проводили в линейном градиенте раствора Б от 25 до 45% в течение 20 мин при скорости потока 1 мл/мин. Во время разделения детектировали поглощение выходившего после колонки раствора при длине волны проходящего света 222 и 366 нм. Фракции, содержащие исследуемые соединения, собирали по отдельности и затем лиофильно высушивали.
Регистрация спектров флуоресценции. Для регистрации спектров флуоресценции использовали спектрометр Cary Eclipse Fluorescence Spectrometer (Agilent Technologies, США). Для проведения измерения лиофильно высушенный образец растворяли в 1 мл TBS-буфера (50 мM Tris-HCl, 2 мM ЭДTA, pH 7.5). Коррекцию фона производили по измерению флуоресценции чистого TBS-буфера.
ЯМР-спектроскопия. ЯМР-спектры регистрировали на ЯМР-спектрометре Avance III 800 МГц (Bruker, Германия), снабженном криодатчиком 5 мм CPTCI. Для этого лиофилизированную флуоресцентную фракцию растворяли в D2O (330 мкл), значение pH 8.9 определяли с использованием настольного pH-метра Orion 2-star (Thermo Scientific, США). Образец переносили в 5-мм ЯМР-ампулу Shigemi со стеклянным плунжером для максимальной концентрации и повышенной ЯМР-чувствительности. 1D и 2D ЯМР-спектры регистрировали при 20°C. Получили спектры 1D 1H-ЯМР с предварительным насыщением сигнала воды, 2D 1H-13C-HSQC с редактированием спектра в соответствии с мультиплетностью сигналов (рис. 2б) и 2D DQF-COSY (рис. S1 в дополнительных материалах). Полученных данных было достаточно для однозначной идентификации рибофлавина как единственного вещества в образце. Его идентичность была подтверждена сравнением со стандартом рибофлавина (Sigma-Aldrich, США), аналогичные спектры были получены для образца стандарта в D2O при pH 8.9 и температуре 20°C на ЯМР-спектрометре Avance III 600 МГц (Bruker, Германия), снабженном криодатчиком 5 мм CPTXI. Величины химических сдвигов нормировали относительно сигнала HOD (4.826 м.д. при 20°C [31]). Отнесение ЯМР-сигналов рибофлавина соответствовало данным, полученным из SDBS (Spectral Database for Organic Compounds), номер соединения 2254 (https://sdbs.db.aist.go.jp).
Масс-спектрометрический анализ. Масс-спектрометрический анализ высокого разрешения для очищенных образцов проводили на масс-спектрометре QExactive Plus Orbitrap (Thermo Fisher Scientific, США). Образцы разделяли на хроматографе Ultimate 3000 RSLCnano (Thermo Fisher Scientific, США) и подавали в масс-спектрометр через источник ионизации электроспреем. Разделение образцов проводили на колонке Zorbax C8 2 × 150 мм (Agilent, США) в линейном градиенте раствора Б от 15 до 99% в течение 8 мин при скорости потока 200 мкл/мин. В качестве буферов для разделения использовали 0.1%-ный раствор муравьиной кислоты, 10 мM формиат аммония в воде (раствор А); 0.1%-ный раствор муравьиной кислоты, 10 мM формиат аммония в 90%-ном ацетонитриле, 10% воды (раствор Б). Данные получали в режиме зависимых сканирований (DDA – Data Dependent Acquisition) с регистрацией спектров в позитивном и негативном режимах ионизации в диапазоне масс 250–2000 а.е.м. и разрешении 35K для спектров MS1. MS2-спектры получали при разрешении 17.5K с использованием ступенчатой энергии ионизации (N)CE 15, 30, 45 и окном изоляции родительских ионов шириной 1.4 m/z. Для выделенного из биомассы соединения были детектированы m/z 377.1470 ([M + H]+) и 375.1285 ([M – H]–) при вычисленной массе для молекулы с атомарным составом C17H20N4O6 для ионов ([M + H]+) m/z = 377.1456 и ([M – H]–) m/z = 375.1310.
ЗАКЛЮЧЕНИЕ
В связи с редкостью, небольшими размерами и скрытным образом жизни изучение грибных комаров Keroplatus spp. очень затруднено, и на сегодняшний день о биохимии их биолюминесценции известно очень мало. Мы проанализировали водные экстракты личинок K. testaceus и обнаружили, что одно из выделенных из личинок флуоресцентных веществ – это рибофлавин (витамин В2). Мы предполагаем, что рибофлавин может участвовать в биолюминесценции этих представителей Keroplatidae, однако точную роль данного соединения в процессе свечения личинок еще предстоит установить.
Список литературы
Mantič M., Sikora T., Burdíková N., Blagoderov V., Kjærandsen J., Kurina O., Ševčík J. // Insects. 2020. V. 11. P. 348. https://doi.org/10.3390/insects11060348
Baker C. // In Bioluminescence in Focus – a Collection of Illuminating Essays / Ed. Meyer-Rochow V.B. Res. Signpost, Kerala, India, 2009. P. 305–324.
Sivinski J.M. // Fla. Entomol. 1998. V. 81. P. 282–292.
Falaschi R.L., Amaral D.T., Santos I., Domingos A.H.R., Johnson G.A., Martins A.G.S., Viroomal I.B., Pompéia S.L., Mirza J.D., Oliveira A.G., Bechara E.J.H., Viviani V.R., Stevani C.V. // Sci. Rep. 2019. V. 9. P. 11291. https://doi.org/10.1038/s41598-019-47753-w
Viviani V.R. // Cell. Mol. Life Sci. 2002. V. 59. P. 1833–1850. https://doi.org/10.1007/PL00012509
Ševčík J., Kaspřák D., Mantič M., Fitzgerald S., Ševčíková T., Tóthová A., Jaschhof M. // PeerJ. 2016. V. 4. P. e2563. https://doi.org/10.7717/peerj.2563
Viviani V.R., Hastings J.W., Wilson T. // Photochem. Photobiol. 2002. V. 75. P. 22–27. https://doi.org/10.1562/0031-8655(2002)0750022TB DTNA2.0.CO2
Green L.F.B. // Tissue Cell. 1979. V. 11. P. 457–465. https://doi.org/10.1016/0040-8166(79)90056-9
Watkins O.C. Sharpe M.L., Perry N.B., Krause K.L. // Sci. Rep. 2018. V. 8. P. 3278. https://doi.org/10.1038/s41598-018-21298-w
Bassot J.M. // Comptes Rendus Hebd. Seances Ser. D. Sci. Nat. 1978. V. 268. P. 623–626.
Viviani V.R., Silva J.R., Amaral D.T., Bevilaqua V.R., Abdalla F.C., Branchini B.R., Johnson C.H. // Sci. Rep. 2020. V. 10. P. 9608. https://doi.org/10.1038/s41598-020-66286-1
Baccetti B., Crovetti A., Santini L. // Int. J. Insect Morphol. Embryol. 1987. V. 16. P. 169–176. https://doi.org/10.1016/0020-7322(87)90016-X
Oba Y., Branham M.A., Fukatsu T. // Zoolog. Sci. 2011. V. 28. P. 771–789. https://doi.org/10.2108/zsj.28.771
Wahlberg P. // Stett. Entomol. Ztg. 1849. V. 10. P. 120–123.
Pfeiffer H., Stammer H.J. // Z. Für Morphol. Ökol. Tiere. 1930. V. 20. P. 136–171. https://doi.org/10.1007/BF00407647
Stammer H.-J. // Z. Für Morphol. Ökol. Tiere. 1932. V. 26. P. 135–146. https://doi.org/10.1007/BF00446392
Kouřimská L., Adámková A. // NFS J. 2016. V. 4. P. 22–26. https://doi.org/10.1016/j.nfs.2016.07.001
Kotlobay A.A., Dubinnyi M.A., Purtov K.V., Guglya E.B., Rodionova N.S., Petushkov V.N., Bolt Y.V., Kublitski V.S., Kaskova Z.M., Ziganshin R.H., Nelyubina Y.V., Dorovatovskii P.V., Eliseev I.E., Branchini B.R., Bourenkov G., Ivanov I.A., Oba Y., Yampolsky I.V., Tsarkova A.S. // Proc. Natl. Acad. Sci. USA. 2019. V. 116. P. 18911–18916. https://doi.org/doi.org/10.1073/pnas.1902095116
Broadley R.A., Stringer I.A.N. // Biolumin. Focus. Collect. Illum. Essays Kerala Res. Signpost. 2009. P. 325–355.
Fulton B.B. // Ann. Entomol. Soc. Am. 1941. V. 34. P. 289–302. https://doi.org/10.1093/aesa/34.2.289
Speight M.C. // Les Invertébrés Saproxyliques et Leur Protection. Conseil de l’Europe, 1989.
Зайцев А.И. // Бюлл. Моск. общества испытателей природы. Отд. биол. 1991. Т. 96. № 3. С. 39–47.
Osawa K., Sasaki T., Meyer-Rochow V. // Entomologie Heute. 2014. V. 26. P. 139–149.
Merrill A.H., McCormick D.B. // Present Knowl. Nutr. Basic Nutr. Metab. 11th ed. / Eds. Marriott B.P., Birt D.F., Stallings V.A., Yates A.A. Cambridge: Elsevier, 2020.
Daubner S.C., Astorga A.M., Leisman G.B., Baldwin T.O. // Proc. Natl. Acad. Sci. USA. 1987. V. 84. P. 8912–8916. https://doi.org/10.1073/pnas.84.24.8912
Macheroux P., Schmidt K.U., Steinerstauch P., Ghisla S., Colepicolo P., Buntic R., Hastings J.W. // Biochem. Biophys. Res. Commun. 1987. V. 146. P. 101–106. https://doi.org/10.1016/0006-291x(87)90696-6
Petushkov V.N., Gibson B.G., Lee J. // Biochem. Biophys. Res. Commun. 1995. V. 211. P. 774–779. https://doi.org/10.1006/bbrc.1995.1880
Полевой А.В. // Грибные комары (Diptera: Bolitophilidae, Ditomyiidae, Keroplatidae, Diadocidiidae, Mycetophilidae) Карелии / Под ред. Яковлева E.Б. Карельский НЦ РАН, Петрозаводск, 2000. 84 с.
Matile L. // Mémoires du Muséum National d’Histoire Naturelle. Série A, Zoologie. 1990. V. 148. P. 1–682.
Økland B., Søli G.E., Serie B. // Fauna Norv. Ser. B. Citeseer. 1992. V. 39. P. 85–88.
Gottlieb H.E., Kotlyar V., Nudelman A. // J. Org. Chem. 1997. V. 62. P. 7512–7515. https://doi.org/10.1021/jo971176v
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Рис. S1. DQF-COSY ЯМР-спектры рибофлавина
Рис. S2. Детали морфологии самки Keroplatus testaceus
Табл. S1. Химические сдвиги ЯМР рибофлавина, наблюдаемые в спектрах ЯМР 1H, DQF-COSY и 1H-13C HSQC
Инструменты
Биоорганическая химия



