Биология внутренних вод, 2023, № 2, стр. 210-223
Особенности распределения массовых видов ракообразных на прибрежном склоне Ладожского озера
Ю. А. Зуев *
Санкт-Петербургский филиал Всероссийского научно-исследовательского института рыбного хозяйства
и океанографии
Санкт-Петербург, Россия
* E-mail: yzuyev@yandex.ru
Поступила в редакцию 04.01.2022
После доработки 18.05.2022
Принята к публикации 21.06.2022
- EDN: BUWNJS
- DOI: 10.31857/S0320965223020298
Аннотация
Выявлены видовой состав и распределение пяти видов ракообразных Asellus aquaticus (Linnaeus, 1758), Monoporeia affinis (Lindström, 1855), Pallaseopsis quadrispinosa (G.O. Sars, 1867), Mysis relicta Lovén, 1862 и Gmelinoides fasciatus (Stebbing, 1899) в диапазоне глубин 1–25 м на подводном склоне о. Валаам в Ладожском озере. Ракообразных исследовали с использованием поршневого пробоотборника, подводных видеокамер и драги. Впервые описано горизонтальное распределение натурализовавшейся байкальской амфиподы G. fasciatus, показаны особенности еe совместного существования с аборигенными видами. Распределение этого вселенца связано с воздействием комплексных внешних факторов: достоверно различаются его количественные характеристики на участках с разной интенсивностью волнения, в различных диапазонах глубины и с разными грунтами. Обилие наиболее массового аборигенного вида Pallaseopsis quadrispinosa достоверно выше в сублиторали, где он образует скопления. Влияния грунтов на распределение нативных ракообразных на прибрежном свале не обнаружено. Аборигенные виды образуют с вселенцем сообщества, но у них выше устойчивость к волновому воздействию по сравнению с Gmelinoides fasciatus. Поэтому участки открытых побережий служат естественными убежищами, сохраняющими разнообразие аборигенных видов. Полученные данные о пространственном распределении ракообразных позволяют характеризовать донные сообщества малоисследованных частей литорали и сублиторали и, как следствие, базу питания рыб-бентофагов.
ВВЕДЕНИЕ
Во многих крупнейших озерах Евразии значительная часть бентоса прибрежного склона представлена ракообразными (Стальмакова, 1968; Särkkä, Meriläinen, Hynynen, 1990; Барышев и др., 2021 и др.). Существенное значение этой группы беспозвоночных для понимания фундаментальных и прикладных аспектов функционирования экосистем озер требует как мониторинговых, так и специфических исследований. Подвижность ракообразных снижает уловистость исследовательских орудий сбора (O’Malley et al., 2018). Их экологическая пластичность позволяет обитать в широком диапазоне глубин и различных субстратов. Это предполагает разработку и использование различных методик и способов исследований. Так, методические подходы для исследования распространения и распределения ракообразных существенно отличаются в прибойной полосе, в открытой части водоема и на различных типах грунта (Стальмакова, 1968; Панов, Павлов, 1986; Распопов и др., 1998; Барков, 2006; Барбашова, Курашов, 2011). При этом, из поля зрения гидробиологов, как правило, почти полностью исключается прибрежный склон с его сложным рельефом и разнообразием грунтов.
К методической сложности исследований ракообразных на прибрежном склоне озер в последние десятилетия добавилась и общая проблема пресноводной гидробиологии и экологии: изменения местных сообществ вследствие инвазий. В Ладожском озере произошло значительное изменение состава сообществ зообентоса после вселения байкальских (Gmelinoides fasciatus (Stebbing, 1899), Micruropus possolskii Sowinsky, 1915) и понто-каспийских (Pontogammarus robustoides Sars, 1894, Chelicorophium curvispinum (Sars, 1895)) амфипод (Berezina et al., 2009; Barbashova et al., 2021). Успешно натурализовавшийся байкальский вид Gmelinoides fasciatus получил повсеместное распространение, и кроме Ладожского озера (Berezina et al., 2009) был обнаружен во многих водоемах, включая крупные озера Онежское (Сидорова, 2013) и Псковско-Чудское (Lake…, 2001).
Ладожское озеро – крупнейшее озеро Европы. Значительную роль в его экосистеме играет фауна ракообразных, представленных как группой ледниковых реликтов (Gammaracanthus loricatus (Sabine, 1824), Monoporeia affinis (Lindström, 1855), Mysis relicta Lovén, 1862, Pallaseopsis quadrispinosa (G.O. Sars, 1867), Saduria entomon (Linnaeus, 1758)), так и обычных широко распространенных в европейских водоемах видов Asellus aquaticus (Linnaeus, 1758) и Pontastacus leptodactylus (Eschscholtz, 1823). Большинство исследований ракообразных в этом озере ограничивалось изучением зообентоса в пологой части подводного свала с мягкими грунтами, где использовали дночерпатели, или верхним метром литорали, где можно работать, стоя в воде (Стальмакова, 1968; Барбашова, Слепухина, 2002; Барков, 2006; Barbasheva et al., 2021 и др.). Таким образом, наблюдается очевидная нехватка современных знаний о видовом составе, распределении и экологии ракообразных на береговом склоне Ладожского озера.
Цель работы – выявить закономерности пространственного распределения и дать оценку обилия массовых видов ракообразных на участках прибрежного склона Валаамского архипелага Ладожского озера.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
В северной части Ладожского озера исследовали подводные склоны о. Валаам в бухте Малая Никоновская и зал. Крестовый. Малая Никоновская бухта – глубокая (≤27 м) закрытая часть акватории зал. Малый Никоновский (Степанова и др., 2016). Это относительно небольшая бухта с участками со скалистой литоралью, продолженной крутыми валунными склонами в сублиторали и илистой котловиной в профундали (рис. 1). В зал. Крестовый наблюдения проводили в полузамкнутой бухте с глубинами ≤10 м и на подводном склоне открытого побережья до глубин 25 м (рис. 2).
Рис. 1.
Схема рельефа и грунтов Малой Никоновской бухты и расположение разрезов. 1 – суша, 2 – скала, 3 – обломки скал, 4 – валуны, 5 – песок, 6 – ил, 7 – песчаный ил, 8 – растительный детрит, 9 – изобаты, 10 – разрез со станциями (31‒33 – номера разрезов, черные кружки – станции).

Рис. 2.
Схема рельефа и грунтов залива Крестового и расположение разрезов. Разрезы 3, 10 и 19 проходят через мелководную полузакрытую бухту. Разрезы 25 и 27 расположены на cвале открытого побережья. Остальные обозначения, как на рис. 1.

Для исследованных акваторий характерен переход с прибрежных скал и крупных валунов до зоны аккумуляции наносов – песка, в менее промываемой Малой Никоновской бухте – ила. Влияние ветрового волнения оценивали по карте как угол, с которого волна может заходить на станцию.
Материал собирали в июле 2017 г. и 2018 г. Перпендикулярно урезу воды вдоль дна натягивали размеченный трос (Голиков, Скарлато, 1978). Вдоль него водолазы подробно описывали рельеф и тип грунта, далее составляли их подробную схему (рис. 1, рис. 2). Также вдоль разреза на каждом типе субстрата отбирали пробы зообентоса в двух повторностях.
Для сбора проб использовали поршневой пробоотборник (Зуев, Зуева, 2013), изготовленный из пластиковой трубы с внутренним диаметром 10 см, ходом поршня 41 см, объемом 4 л. На горловину трубы надевается мешок из газа размером ячеи 0.4 мм. Пробоотборник прижимается к субстрату, водолаз вытягивает поршень и затягивает все организмы, находящиеся у устья трубы. Складка газового мешка, находящегося на горле трубы, накрывает грунт вокруг пробоотборника и ограничивает сечением трубы площадь, с которой собирают беспозвоночных. Данная конструкция позволяет исследовать беспозвоночных на неровном твердом рельефе. Всего обследовано 22 станции с глубинами 1– 24 м (табл. 1). Станции находились в трех лимнических зонах: литораль (<8 м), сублитораль (8–16 м) и профундаль (>16 м).
Таблица 1.
Результаты теста Краскела–Уоллиса и парного теста Вилкоксона с поправкой Бонферрони на достоверность различий численности (N) и биомассы (В) ракообразных в разных условиях
| Матрица | Показатель | Тест Краскела–Уоллиса | Тест Вилкоксона | ||
|---|---|---|---|---|---|
| χ2 (df) | p-value | пары | p-value | ||
| Gmelinoides fasciatus | |||||
| N, экз./м2 | Зоны | 10.66 (2) | 0.005** | Литораль ≠ профундаль | 0.004** |
| Грунты1 | 13.26 (3) | 0.004** | Скалы ≠ валуны | 0.054 | |
| Валуны ≠ песок | 0.030* | ||||
| Волнение | 13.69 (2) | 0.001*** | <45° ≠ 90°–180° | >0.001*** | |
| 45°–90° ≠ 90°–180° | 0.007** | ||||
| B, г/м2 | Зоны | 10.02 (2) | 0.007** | Литораль ≠ профундаль | 0.004** |
| Грунты1 | 13.90 (3) | 0.003* | Валуны ≠ песок | 0.007** | |
| Волнение | 13.68 (2) | 0.001*** | <45° ≠ 90°–180° | >0.001*** | |
| 45°–90° ≠ 90°–180° | 0.007** | ||||
| Asellus aquaticus | |||||
| N и B | Зоны | –2 | n.s. | –2 | – |
| Грунты1 | – | n.s. | – | – | |
| Волнение | – | n.s. | – | – | |
| Pallaseopsis quadrispinosa | |||||
| N | Зоны | 8.12 (2) | 0.017* | Литораль ≠ сублитораль | 0.017* |
| Грунты | 13.01 (5) | 0.023* | Скалы ≠ песок | 0.048* | |
| Волнение | – | n.s. | – | – | |
| B | Зоны | 6.22 (2) | 0.044* | Литораль ≠ сублитораль | 0.036* |
| Грунты | – | n.s. | – | – | |
| Волнение | – | n.s. | – | – | |
Примечание. χ2 – значение статистики Краскела–Уолиса, df – степени свободы. Уровни значимости: *** – p-value <0.005; **– p <0.01; * – p <0.05; выделенное значение – p ~ 0.05; n.s. – не значим. Волнение (угол захода волны): <45°; 45°–90°; 90°–180°. Грунты: скалы, валуны, галька, смешанные (валуны и песок), песок, ил. 1 – влияние грунтов оценивали в диапазоне распространения вида. Лимнические зоны в условиях арх. Валаам: литораль – 0.9–8.0 м, сублитораль – 8.1–16.0 м, профундаль – 16.1–25.0 м. 2 – при незначимом тесте (p >0.05) значения статистики и попарного теста не приводятся.
Исследования сопровождала подводная видеофиксация. Размеченный трос в кадре позволял оценить по видеозаписям плотность мизид и крупных амфипод на разных глубинах. Каждую видеозапись синхронизировали с положением станций отбора проб.
Помимо работы на станциях для исследования ракообразных на относительно ровных участках использовали драгу с площадью сечения 30 × 15 см. Драгирование проводили по изобате со скоростью 3.5–4.0 км/ч. Расстояние и скорость прохода драги фиксировали с помощью GPS-навигатора. По расстоянию, пройденному драгой, и ширине полосы сбора рассчитывали плотность поселения и биомассу крупных подвижных ракообразных. Отобранные пробы промывали через газовое сито (размер ячеи 0.4 мм) и фиксировали 4%-ным формалином.
Ранговый аналог дисперсионного анализа – метод Краскела–Уоллиса применяли в качестве альтернативы ANOVA. Внутригрупповые различия анализировали с помощью парного критерия Вилкоксона.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В исследованном районе обнаружено пять видов раков из трех отрядов: разноногие раки (Amphipoda) Gmelinoides fasciatus, Monoporeia affinis, Pallaseopsis quadrispinosa, равноногие раки (Isopoda) Asellus aquaticus и мизиды (Mysidacea) Mysis relicta. К гляциальным реликтам района относятся Monoporeia affinis, Pallaseopsis quadrispinosa и Mysis relicta.
Амфипода Pallaseopsis quadrispinosa встречена на глубинах от 1 м до максимальной исследованной 25 м (рис. 3–5). Наибольшие численность и биомасса вида отмечены в полузакрытой бухте: на валунном склоне на глубине 3.5 м (340 экз./м2 и 6.00 г/м2) и на песчаном подножье склона на 5.1 м (2378 экз./м2 и 2.39 г/м2). На склоне открытого побережья максимумы зарегистрированы на 6.8 м на валунах (1529 экз./м2 и 2.43 г/м2) и на 17.1 м на песке (594 экз./м2 и 2.25 г/м2). Среднее обилие в сублиторали (293 ± 54 экз./м2 и 0.63 ± 0.17 г/м2) было значимо выше, чем в литорали (207 ± 73 экз./м2 и 0.45 ± 0.17 г/м2) (табл. 1). Кроме того, на пологих участках глубже прибрежного склона (17–27 м) вид присутствовал в драге.
Рис. 3.
Численность (а) и биомасса (б) зообентоса в бухте Малая Никоновская. 1 – Monoporeia affinis, 2 – Pallaseopsis quadrispinosa, 3 – Asellus aquaticus, 4 – Gmelinoides fasciatus.

Рис. 4.
Численность (а) и биомасса (б) зообентоса в бухте зал. Крестовый. 1 – Pallaseopsis quadrispinosa, 2 – Asellus aquaticus, 3 – Gmelinoides fasciatus.

Рис. 5.
Численность (а) и биомасса (б) зообентоса на свале открытого побережья зал. Крестовый. Обозначения, как на рис. 3.
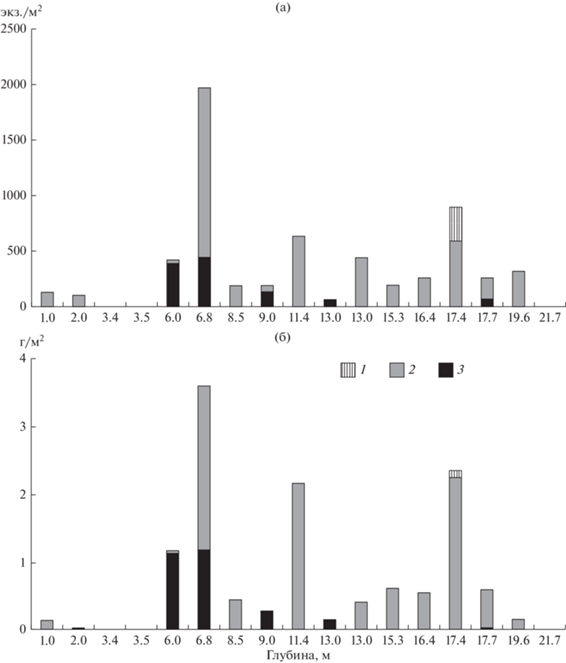
На склонах открытого побережья и полузакрытой бухты, где существует волнение, P. quadrispinosa выявлен на глубинах ≥1 м, в закрытой бухте – только на глубинах >4.5 м. Несмотря на значительные различия в обилии вида на литорали открытого побережья с углами захода волны 90°–180° (57 ± 46 экз./м2 и 0.06 ± 0.05 г/м2) и более закрытых участков: углы 45°–90° (263 ± ± 200 экз./м2 и 0.57 ± 0.32 г/м2) и углы <45° (207 ± ± 87 экз./м2 и 0.46 ± 0.23 г/м2), достоверных различий обилия вида на участках с разной интенсивностью волнения не выявлено (табл. 1).
Monoporeia affinis зарегистрирована на склоне с глубинами ≥4.5 м. Максимумы обилия (297 экз./м2 и 0.21 г/м2) наблюдали на глубине >15 м (рис. 3). Поскольку вид отмечен лишь на некоторых станциях, анализа связи его обилия с факторами среды не проводили. Бокоплав выявлен в небольшом количестве на валунах, высоких значений численности и биомассы достигает на песчаных, илисто-песчаных и илистых грунтах подножьев свала. На малых глубинах встречается только в условиях закрытой бухты (рис. 3, рис. 4).
Байкальский вселенец Gmelinoides fasciatus отмечен на глубинах 0.9–9.0 м, и лишь на одной станции на глубине 15 м (рис. 3). Максимальные значения численности и биомассы зарегистрированы на свале полузакрытой бухты (8217 экз./м2 и 10.44 г/м2, соответственно) (рис. 4). Основные скопления вселенца приходятся на литораль (821 ± 272 экз./м2 и 1.31 ± 0.42 г/м2) (рис. 3–5). По численности и биомассе различия в обилии вида на литорали и профундали достоверны (табл. 1). На прибрежном склоне зарегистрирован на всех типах грунта. Обилие амфиподы на песке (1528 ± 333 экз./м2 и 5.08 ± ± 1.38 г/м2) достоверно выше, чем на валунах (699 ± 506 экз./м2 и 0.72 ± 0.49 г/м2). На скале амфиподы многочисленнее и мельче (2621 ± 1301 экз./м2 и 2.51 ± 1.34 г/м2), чем на валунах и даже песке, но достоверных различий в обилии не обнаружено. Кроме того, численность и биомасса G. fasciatus достоверно различались между станциями открытого побережья (угол захода волны >90°) и всеми остальными (табл. 1).
С глубины >15 м на всех участках и на всех типах рельефа и грунтах отмечены мизиды Mysis relicta. Расшифровка фото и видеозаписей показала, что плотность мизид составляет ~2 экз./м2 в бухте Малая Никоновская и ~4–8 экз./м2 для открытого побережья.
По результатам работы драги на ровных песчаных участках зал. Крестовый в пробах отмечено два вида крупных ракообразных – M. relicta и Pallaseopsis quadrispinosa (Доп. мат. рис. S1). Мизиды на всех глубинах (17, 20, 25 м) встречались с плотностью 0.5 экз./м2. Крупные P. quadrispinosa отмечены единично.
Asellus aquaticus зарегистрирован на склонах с глубинами 1–18 м. Наибольшей численности и биомассы (2737 экз./м2 и 5.60 г/м2) вид достигал в диапазоне 1–7 м. Встречался на всех типах грунтов и на склонах побережья разной степени открытости. Связь обилия этой изоподы с факторами среды не выявлена (табл. 1).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Во время исследований подводных склонов о. Валаам обнаружено пять видов ракообразных, из них четыре относятся к гляциальным реликтам. В последние годы в Ладожском озере отмечено несколько видов чужеродных ракообразных (Barbashova et al., 2021). В обследованных нами сообществах зафиксирован только наиболее широко распространенный байкальский вселенец Gmelinoides fasciatus. Другие виды-вселенцы, в том числе, получивший широкое распространение на мелководьях южной и западной частей Ладожского озера Micruropus possolskii Sowinsky, 1915, а также менее распространенные Pontogammarus robustoides Sars, 1894 и Chelicorophium curvispinum (Sars, 1895) в пробах не обнаружены. Это связано с изолированностью о. Валаам от остального побережья озера.
Распределение видов. В Ладожском и Псковско-Чудском озерах Pallaseopsis quadrispinosa считается типичным обитателем песчаных участков сублиторали (Стальмакова, 1968; Распопов и др., 1990, 1998; Lake…, 2001). Однако наши исследования прибрежного склона Ладожского озера показали, что присутствие вида на всех исследованных глубинах (от 1 м и глубже). Это отмечено и для озер северной Швеции (Hill, 2006). Присутствие амфиподы на всех типах грунтов при активных гидродинамических условиях (табл. 1, рис. 4, рис. 5) свидетельствует о ее хорошей приспособленности к условиям литорали Ладожского озера.
Mоnoporeia affinis встречался на отдельных станциях на прибрежном свале. В наиболее масштабном исследовании сообществ Ладоги (Стальмакова, 1968) вид отмечен на глубине 3 м. В нашей работе большинство находок M. affinis зафиксировано на глубинах >15 м и только в закрытой бухте – с 4.5 м. По-видимому, вид предпочитает участки без активного гидродинамического воздействия, т.е. встречается преимущественно в профундали.
На глубинах >20 м в южных и восточных районах Ладожского озера M. affinis может иметь высокую биомассу в скоплениях (Тихомирова, 1975). О распространении этого вида можно судить, в основном, из анализа питания сигов, поскольку они в значительной степени питаются этими реликтовыми ракообразными (Федорова, 1977; Тихомирова, Федорова, 1979; Федорова, Приймак, 1987). Для питания сига в скоплениях, имеющих промысловое значение, требуются весьма высокие численность и биомасса M. affinis на значительных по площади участках.
Вселенец Gmelinoides fasciatus массово распространен только в пределах литорали (рис. 6). Вид встречается на всех типах грунтов за исключением ила (ил на исследованных участках расположен глубже 15 м). Наличие этой амфиподы на различных литоральных биотопах продемонстрировано и в работах (Бекман, 1962; Барков, 2006; Курашов и др., 2011). Причем, на прибрежном свале показано достоверное увеличение количественных показателей вида на песке (табл. 1). По-видимому, это связано с тем, что участки аккумуляции песка более пологие, чем сложенные валунами свалы. Следовательно, в прибрежье на песчаных участках происходит также аккумуляция детрита, в котором вселенец образует особенно многочисленные скопления. Для скальных участков характерны скопления молоди амфипод этого вида. Средняя масса одного экземпляра (0.9 × × 10–3 г/экз.) здесь меньше, чем на песке и даже на валунах (3.3 × 10–3 г/экз. и 1.1 × 10–3 г/экз., соответственно). Достоверных различий количественных характеристик на скалах не выявлено, возможно из-за сильных различий рельефа и гидрологических условий в верхней литорали, где располагались станции на скалах (рис. 1, рис. 2).
Рис. 6.
Вертикальное распределение ракообразных на прибрежном склоне: (•) – глубина отдельных находок, (⚪) – выбросы, (│) – минимальное и максимальное значения; каждый боксплот включает три горизонтальные линии, которые обозначают 25, 50 (медиана) и 75% данных.

Волнение оказывает значительное воздействие на распределение вселенца (табл. 1). На склоне открытого побережье, где сильное волнение, вид не встречается (рис. 5). Очевидно, поэтому в полузакрытой бухте, для которой характерно умеренное волнение, G. fasciatus уходит на бóльшую глубину (рис. 4), чем в закрытой бухте (рис. 3). Другой причиной выхода амфиподы за пределы литорали (до 9 м) могут быть скопления растительного детрита, что наблюдали у нижней границы валунного свала бухты зал. Крестовый (рис. 4).
На глубинах ≥16 м даже на плоских участках дна не выявлены скопления ракообразных в исследованиях, проведенных стандартными методами (Стальмакова, 1968; Барбашова, Слепухина, 2002; Суслопарова и др., 2011). В пробах, взятых дночерпателем с ровного песчаного дна, нечасто отмечаются амфиподы и почти полностью отсутствуют мизиды. Здесь, в отличие от прибрежного склона, почти нет укрытий для них. Вероятно, ракообразные уплывают при приближении исследователя или орудия сбора. Более чем восьмикратная разница в плотности поселения Mysis relicta между подсчетами по видео (4–8 экз./м2) и при сборе драгой (0.5 экз./м2) позволяет предположить, что использовавшаяся скорость (~4 км/ч) недостаточна для ловли cтоль подвижных организмов. Это подтверждает опыт водолазного лова мизид сачком: они совершают резкие “скачки” в разных направлениях. Такое поведение позволяет им избегать медленных орудий сбора, в том числе и драг. Из-за отсутствия стратегии для учета M. relicta и других подвижных ракообразных недоучитывается ресурс, который может быть существенной частью биомассы зообентоса в этом диапазоне глубин. Такой пробел в знаниях требует для его устранения специальных методов (O’Malley et al., 2018) и характерен для большинства стандартных гидробиологических работ.
Максимум плотности мизид (382 экз./м2) отмечен на глубине 19.2 м в Малой Никоновской бухте. Такие высокие плотности объясняются использованием пробоотборника с малой площадью сечения для редкого и неравномерно распределенного вида. Совместный анализ с материалами видеозаписи показывает, что плотность и биомасса мизид полученные с помощью пробоотборника, сильно завышены.
Сравнение полученного в работе распределения ракообразных у прибрежного свала с данными ежегодных мониторинговых наблюдений (Стальмакова, 1968; Лаврентьева и др., 2009; Суслопарова и др., 2011, 2014) в открытой части озера показало, что распределение ракообразных у прибрежного свала отличается большей амплитудой по глубине. Ранее установлено, что амфиподы и мизиды могут совершать вертикальные миграции в ночное время (Grönholm, Hakala, 1990; Karnaukhov et al., 2016). В Ладожском озере подъём к поверхности в небольших количествах совершает Gmelinoides fasciatus (Карнаухов, Курашов, 2020). Также, возможно, что ракообразные способны на довольно большие горизонтальные миграции (Дудакова и др., 2015), которые не выходят за пределы их обычного вертикального распространения. Из вышесказанного можно сделать вывод, что дневное распределение в значительной степени позволяет описать запасы и распространение ракообразных на прибрежном свале.
Сосуществование чужеродных и аборигенных видов. Байкальский вселенец G. fasciatus образует значительные скопления в верхнем метре литорали, потребляя органические вещества, поступающие с литорали (Панов, 1994; Барков, Курашов, 2005; Курашов и др., 2018; Barbashova et al., 2021). Из-за своей многочисленности он считается объектом, увеличившим кормовую базу рыб-бентофагов (Барков, 2006; Березина, Панов, 2004; Berezina et al, 2009; Курашов и др., 2011) и даже может стать объектом промысла (Барышев и др., 2021). Однако глубже 1 м для всех ракообразных распределение и границы распространения на прибрежном свале Ладоги не были неизвестны.
Выводы об изменении количественных характеристик сообществ в верхнем метре под воздействием вселенцев сделать сложно, поскольку последовательные исследования начались уже после инвазии (Барбашова, Курашов, 2011). После натурализации вселенца G. fasciatus из литорали Ладожского озера исчез Gammarus lacustris G.O. Sars, 1863 (Barbashova et al., 2021). Также высказывались предположения о существенной элиминации многих аборигенных видов и даже об изменении кормовой базы ценных промысловых видов рыб. Наши исследования позволяют детализировать некоторые особенности распределения и совместного проживания ракообразных на прибрежном склоне.
Так, Asellus aquaticus повсеместно встречается в водоемах северо-запада. Этот вид достигает высокого обилия в литорали (рис. 6) даже в условиях максимально благоприятных для Gmelinoides fasciatus (растительные остатки, детрит, близость водных макрофитов). Обилие Asellus aquaticus снизилось в верхнем метровом слое литорали (Курашов и др., 2011), при этом на глубинах >5 м вид часто составляет большую часть обилия (рис. 3–5). В условиях полузакрытой бухты A. aquaticus может образовывать максимум численности и биомассы на почти не занятых вселенцем мелководных станциях (<3.5 м). Также он успешно сосуществует и даже создает значительную часть биомассы на станциях в диапазоне глубин 4–9 м, где наблюдается максимум обилия вселенца (рис. 4). На исследованном склоне открытого побережья A. aquaticus доминирует на некоторых станциях литорали (рис. 5).
Амфипода Pallaseopsis quadrispinosa успешно соседствует с вселенцем в закрытых и полузакрытых бухтах, не образуя большинства. На всех участках этот вид образует максимумы обилия на глубинах, где нет массовых скоплений вселенца. На литорали аборигенная амфипода образует высокие биомассы на участках, находящихся под воздействием волнения выше максимумов численности и биомассы G. fasciatus, а в условиях закрытой бухты – ниже литорали и скоплений этого чужеродного вида (рис. 3, 5). На прибрежном склоне (3–4 м – в полузакрытой бухте и 10–12 м – в закрытой) распространены наиболее крупные экземпляры P. quadrispinosa, а на склоне открытого побережья самые крупные экземпляры (≥50 мг) попадались в драгу на глубинах >15 м.
Можно сделать вывод, что аборигенные виды успешно конкурируют с вселенцем за пространство. Плотные совместные скопления вселенца и аборигенных видов выявляются при сборе проб поршневым пробоотборником, который имеет сравнительно малую площадь сбора. Кроме того, на большинстве участков скопления растительного детрита находятся глубже 5 м (перелом свала полузакрытой бухты, крупные валуны закрытой и открытой бухт). В этих условиях более половины численности и биомассы ракообразных образуют аборигенные виды Asellus aquaticus и Pallaseopsis quadrispinosa (рис. 3–5). Растительный детрит занимает существенную долю питания у всех этих видов (Сущеня, Семенченко, Вежновец, 1986; Vitagliano et al., 1991 и др.). Поэтому, при весьма ограниченном развитии водных макрофитов у открытых побережий северной части Ладоги (Степанова и др., 2020), кроме естественной пространственной конкуренции, может присутствовать и пищевая. Вертикальное распределение реликтовых видов не изменилось по сравнению с диапазонами, описанными для озер Фенноскандии (Särkkä, Meriläinen, Hynynen, 1990) и Польши (Zmudzinski, 1990) без вселенца. Asellus aquaticus успешно конкурирует с вселенцем в наиболее благоприятных для последнего условиях в литорали, но встречается на большей глубине. Pallaseopsis quadrospinosa постепенно замещает вселенца с глубиной.
В условиях открытого побережья Gmelinoides fasciatus отсутствует из-за воздействия прибоя (рис. 5). Здесь высока роль аборигенных видов Pallaseopsis quadrospinosa и Аsellus aquaticus (рис. 5). Это означает, что на большом пространстве распределение и влияние Gmelinoides fasciatus ограничено не только глубиной, но и особенностью Ладожского озера – активной гидродинамикой. Побережье озера на довольно большом протяжении (все, за исключением шхер в северной части и мелководных участков, заросших водной растительностью) характеризуется высокой открытостью. Следовательно, можно предположить, что открытые побережья ограничивают распространение вселенца и поддерживают фауну аборигенных ракообразных Ладожского озера. Это подтверждается наблюдениями, показывающими, что влияние волнения крайне значимо (Распопов и др., 1990) и часто сильнее антропогенного воздействия (Cai et al., 2017).
В подобных условиях, на открытом скалистом склоне бухты зал. Крестовый еще в 2012 г. было найдено несколько экземпляров G. lacustris (Зуев, Зуева, 2013). Вполне возможно, вид еще сохранился в небольших количествах на участках открытых побережий, где на большой площади условия некомфортны для вселенца.
Самый узкий диапазон на прибрежном свале характерен для G. fasciatus, который встречается от уреза воды до глубины 9 м (в пределах литорали) (рис. 6). Единичная находка вида на глубине 15 м выглядит артефактом. Аналогичным образом в пределах литорали распространен Asellus aquaticus, однако его отдельные находки зарегистрированы до глубины 17 м. Pallaseopsis quadrispinosa встречается во всем диапазоне исследованных нами глубин. Мonoporeia affinis и Mysis relicta образуют скопления на больших глубинах, чем были нами исследованы (Стальмакова, 1968). Отдельные находки Мonoporeia affinis начинаются с глубины 4.5 м, а Mysis relicta с 9 м (рис. 6).
Наиболее ценные промысловые рыбы Ладожского озера – сиги Coregonus lavaretus (Linnaeus, 1758) и палия Salvelinus lepechini (Gmelin, 1789) – питаются и образуют промысловые скопления глубже 20 м (Смирнов, 1964; Федорова, 1977; Тихомирова, Федорова, 1979; Федорова, Приймак, 1987). По нашим данным, на прибрежном свале амфипода Gmelinoides fasciatus не распространяется глубже 10 м. На удаленных от берегов станциях в Ладожском озере диапазон глубин, в котором она встречаются еще меньше – до 5–7 м (Суслопарова и др., 2011, 2014). Исходя из этих данных о распространении рыб и чужеродной амфиподы можно сделать вывод, что появление G. fasciatus не увеличило кормовую базу сигов и палии, поскольку диапазоны глубин, на которых встречаются рыбы и амфипода, не перекрываются. Напротив, амфиподы, увеличили потребление органического вещества в верхней литорали и снизили его потоки к более глубоководным ракообразным (Курашев и др., 2011). Их расселение привело к увеличению кормовой базы только бентосоядных рыб литорали (окуневых и карповых), как это произошло в Онежском озере (Калинкина и др., 2016; Lobanova et al., 2017; Георгиев и др., 2019). Диапазон глубин встречаемости G. fasciatus в этом озере (Сидорова, 2013) сходен с таковыми в Ладожском озере.
Побережье Валаамского архипелага естественным образом изолировано от побережья остальной Ладоги. Поэтому крайне важно зафиксировать состояние донных сообществ после натурализации массового байкальского вселенца G. fasciatus, но до проникновения других чужеродных видов. Это позволит получить представление об исходном состоянии сообществ, для оценки влияния изменений.
Выводы. Исследование диапазонов распространения в пределах прибрежного свала пяти наиболее массовых видов ракообразных показало, что на мелководье и в пределах литорали образуют скопления Gmelinoides fasciatus и Asellus aquaticus, преимущественно в профундали – Monoporeia affinis и Mysis relicta. Pallaseopsis quadrospinosa встречается на прибрежном свале во всем исследованном диапазоне глубины. Байкальский вселенец Gmelinoides fasciatus приурочен к закрытым от волн берегам. Выявленные закономерности дают возможность оценить состояние наиболее массовой и ценной кормовой группы беспозвоночных на основании данных о рельефе и степени открытости побережья. Данные по распределению ракообразных показали, что влияние массового G. fasciatus на аборигенные виды ограничено. Вселенец G. fasciatus не может формировать существенную часть кормовых ресурсов ценных промысловых рыб Ладожского озера из-за распространения на мелководье.
Полученные результаты исследования дополнят знания о распределении и обилии ракообразных, дадут информацию для прогноза динамики донных сообществ озера и кормовой базы рыб-бентофагов, в том числе и из-за последствий масштабных инвазий.
Список литературы
Барбашова М.А., Слепухина Т.Д. 2002. Макрозообентос литоральной зоны заливов шхерного района озера // Ладожское озеро – прошлое, настоящее, будущее. Санкт-Петербург: Наука.
Барбашова М.А., Курашов Е.А. 2011. Макрофауна литоральной зоны Ладожского озера // Литоральная зона Ладожского озера. Санкт-Петербург: Наука.
Барков Д.В. 2006. Экология и биология байкальского вселенца Gmelinoides fasciatus (Stebbing, 1899) и его роль в экосистеме Ладожского озера: Автореф. дис. … канд. биол. наук. Санкт-Петербург.
Барков Д.В., Курашов Е.А. 2005. Значение байкальской амфиподы Gmelinoides fasciatus (Stebb.) в структуре макрозообентоса литорали о. Валаам (Ладожское озеро) // Эл. науч. журн. “Исследовано в России”. 79. С. 820.
Барышев И.А., Сидорова А.И., Георгиев А.П., Калинкина Н.М. 2021. Биомасса популяции, продукция за вегетационный период и биоресурсное значение инвазивного Gmelinoides fasciatus (Сrustacea: Amphipoda) в Онежском озере // Биология внутр. вод. № 4. С. 433. https://doi.org/10.31857/S0320965221040057
Бекман М.Ю. 1962. Экология и продукция Micruropus possolskii Sow и Gmelinoides fasciatus Stebb. // Систематика и экология ракообразных Байкала. Труды Лимнол. ин-та СО АН СССР. Т. 2. Ч. 1. С. 141.
Березина Н.А., Панов В.Е. 2004. Популяции амфипод в прибрежных зонах эстуария р. Невы и крупных озер бассейна Балтийского моря // Закономерности гидробиологического режима водоемов разного типа. Москва: Научный мир. С. 179.
Георгиев А.П., Сидорова А.И., Шустов Ю.А., Лесонен М.А. 2019. Байкальская амфипода Gmelinoides fasciatus (Amphipoda, Crustacea) в питании окуня литоральной зоны Онежского озера (возрастной и сезонный аспекты) // Зоол. журн. Т. 98. № 7(98). С. 749. https://doi.org/10.1134/S0044513419070055
Голиков А.Н., Скарлато О.А. 1965. Гидробиологические исследования в заливе Посьет с применением водолазной техники // Исследования фауны морей СССР. № 3(9). С. 5.
Дудакова Д.С., Родионова Н.В., Протопопова Е.В. и др. 2015. Состав и динамика гидробионтов литорали бухты Петрокрепость Ладожского озера // Тр. Карельск. науч. центра РАН. № 2. Сер. Экологические исследования. С. 53. https://doi.org/10.17076/eco42
Зуев Ю.А., Зуева Н.В. 2013. Опыт исследования макрозообентоса каменистой литорали Ладожского озера // Уч. зап. Российского гос. гидрометеорол. ун-та. № 30. С. 134.
Калинкина Н.М., Сидорова А.И., Полякова Т.Н. и др. 2016. Снижение численности глубоководного макрозообентоса Онежского озера в условиях многофакторного воздействия // Принципы экологии. № 2. С. 43. https://doi.org/10.15393/j1.art.2016.5182
Карнаухов Д.Ю., Курашов Е.А. 2020. К вопросу о ночных вертикальных миграциях амфипод в Ладожском озере // Тр. Карельск. науч. центра РАН. № 4. С. 115. https://doi.org/10.17076/lim1140
Курашов Е.А., Барбашова М.А., Барков Д.В. и др. 2011. Виды-вселенцы в литоральной зоне Ладожского озера. Литоральная зона Ладожского озера. Санкт-Петербург: Наука. С. 279.
Курашов Е.А., Барбашова М.А., Дудакова Д.С. и др. 2018. Экосистема Ладожского озера: современное состояние и тенденции ее изменения в конце XX–начале XXI в. // Биосфера. № 2(10). С. 65. https://https://doi.org/10.24855/BIOSFERA.V10I2.439
Лаврентьева Г.М., Мицкевич О.И., Огородникова В.А., Терешенкова Т.В. 2009. Сравнительная оценка сообществ планктона и бентоса Онеги и Ладоги в многолетнем аспекте: (90-е гг. ХХ в. и первое десятилетие ХХI в.) // Рыбохозяйственное исследование больших озер Северо-Запада европейской части России: сборник научных трудов. Санкт-Петербург: Изд-во ДЕАН. Вып. 334. С. 228.
Панов В.Е. 1994. Байкальская эндемичная амфипода Gmelinoides fasciatus Stebb. в Ладожском озере // Докл. Академии наук. Т. 336. № 2. С. 279.
Панов В.Е., Павлов А.М. 1986. Методика количественного учета водных беспозвоночных в зарослях камыша и тростника // Гидробиол. журн. Т. 22. № 6. С. 87.
Распопов И.М., Воронцов Ф.Ф., Слепухина Т.Д. и др. 1990. Роль волнения в формировании биоценозов бентоса больших озер. Ленинград: Наука.
Распопов И.М., Андроникова И.Н., Слепухина Т.Д. и др. 1998. Прибрежно-водные экотоны больших озер. Санкт-Петербург: РТП ИК “Синтез”.
Сидорова А.И. 2013. Структурно-функциональные характеристики популяции байкальского вселенца Gmelinoides fasciatus Stebbing (Crustacea: Amphipoda) на северной границе ареала (Онежское озеро): Автореф. дис. … канд. биол. наук. Петрозаводск.
Смирнов А.Ф. 1964. Морфологическая и биологическая характеристика лудной и ямной палии Ладожского озера // Рыбное хозяйство Карелии. Петрозаводск: Карельское книжное издательство. Вып. 8. С. 130.
Стальмакова Г.А. 1968. Зообентос Ладожского озера // Биологические ресурсы (зоология) Ладожского озера. Ленинград: Наука. С. 4.
Степанова А.Б., Бабин А.В., Зуева Н.В. и др. 2016. Анализ антропогенного воздействия на водную систему Валаамского архипелага. Экосистемы Валаамского архипелага (Ладожское озеро) на рубеже 20 и 21 веков. Черты уникальности и современное состояние. Атлас. Санкт-Петербург: Рос. гос. гидрометеорол. ун-т. С. 32.
Степанова А.Б., Воякина Е.Ю., Бабин А.В. и др. 2020. Результаты исследований прибрежной зоны Ладожского озера в районе Валаамского архипелага (1998–2019 гг.) // Гидрометеорология и экология. № 60. С. 325. https://doi.org/10.33933/2074-2762-2020-60-325-350
Суслопарова О.Н., Мицкевич О.И., Огородникова В.А., Терешенкова Т.В. 2011. Сезонные и межгодовые изменения основных компонентов экосистемы (фито-, зоопланктон, макрозообентос) Южной Ладоги по результатам исследований в 2009–2010 гг. // Исследование экосистем крупных рыбопромысловых водоемов Северо-Запада России: Сб. науч. тр. Вып. 341. Санкт-Петербург: Нестор-История. С. 201.
Суслопарова О.Н., Терешенкова Т.В., Огородникова В.А. и др. 2014. Изменения летних гидробиоценозов южной Ладоги по материалам многолетних исследований ГосНИОРХ // Рыбохозяйственные исследования на водных объектах Европейской части России: Сб. науч. работ, посвященный 100-летию ГосНИОРХ. Санкт-Петербург. С. 238.
Сущеня Л.М., Семенченко В.П., Вежновец В.В. 1986. Биология и продукция реликтовых ракообразных. Минск: Наука и техника.
Тихомирова Л.П. 1975. Питание ладожских сигов // Рыбохозяйственное изучение внутренних водоемов. № 16. С. 14.
Тихомирова Л.П., Федорова Г.В. 1979. Рационы сигов Ладожского озера // Изв. ГосНИИ озер. и реч. рыб. хоз-ва. Ленинград: ГосНИОРХ. Т. 141. С. 152.
Федорова Г.В. 1977. Биологическая характеристика и численность ладожского озерного сига. // Изв. ГосНИОРХ. Т. 125. С. 11.
Федорова Г.В., Приймак Л.Я. 1987. Питание ладожского озерного сига Coregonus lavaretus baeri n. ladoga Pravdin // Сб. науч. тр. ГосНИОРХ. Вып. 266. С. 11.
Barbashova M.A., Trifonova M.S., Kurashov E.A. 2021. Features of the Spatial Distribution of Invasive Amphipod Species in the Littoral of Lake Ladoga // Rus. J. Biol. Invasions. V. 12. P. 136. https://doi.org/10.1134/S207511172102003X
Berezina N.A., Zhakova L.V., Zaporozhets N.V., Panov V.E. 2009. Key role of the amphipod Gmelinoides fasciatus in reed beds of Lake Ladoga // Boreal Environ. Res. V. 14. P. 404.
Cai Y., Xu H., Vilmi A. et al. 2017. Relative roles of spatial processes, natural factors and anthropogenic stressors in structuring a lake macroinvertebrate metacommunity // Science of the Total Environment. P. 601. 1702. https://doi.org/10.1016/j.scitotenv.2017.05.264
Grönholm L., Hakala I. 1990. Annual and diurnal vertical migrations and the food of Mysis relicta in Lake Pääjärvi, Southern Finland // Ann. zool. fenn. V. 27. P. 265.
Hill C. 2006. Life cycle and spatial distribution of the amphipod Pallasea quadrispinosa in a lake in northern Sweden // Ecography. V. 89(4). P. 298. https://https://doi.org/10.1111/j.1600-0587.1988.tb00813.x
Karnaukhov D.Y., Kaus A., Sartoris L. et al. 2016. Behavior of lake Baikal amphipods as a part of the night migratory complex in the Kluevka settlement region (south-eastern Baikal) // Crustaceana. V. 89(4). P. 419. https://doi.org/10.1163/15685403-00003530
Lobanova A.S., Shustov Y.A., Alaytsev D.P. et al. 2017. The role of invasive amphipod Gmelinoides fasciatus (Stebbing) in the feeding of perch Perca fluviatilis L. in the littoral zone of Lake Onega // Rus. J. Biol. Invasions. V. 8(3). P. 261. https://doi.org/10.1134/S2075111717030092
Lake Peipsi. Flora and Fauna. Zoobenthos. 2001. Tartu: Sulemees Publ. P. 82.
O’Malley B.P., Dillon R.A., Paddock R.W. et al. 2018. An underwater video system to assess abundance and behavior of epibenthic Mysis // Limnol., Oceanogr.: Methods. V. 16(12). P. 868. https://doi.org/10.1002/lom3.10289
Särkkä J., Meriläinen J.J., Hynynen J. 1990. The distribution of relict crustaceans in Finland: new observations and some problems and ideas concerning relicts // Ann. Zool. Fenn. V. 27. P. 221.
Vitagliano G., Fano E.A., Marchetti E. et al. 1991. Importance of longevity, growth, and diapause in the evolution of Asellus aquaticus // Bolletino di zoologia. V. 3. P. 125.
Zmudzinski L. 1990. Past and recent occurrence of Malacostraca glacial relicts in Polish lakes // Ann. zool. fenn. V. 27. P. 227.
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Рис. S1. Скопления ракообразных на дне. Открытая часть залива Крестового
Инструменты
Биология внутренних вод


