Цитология, 2019, T. 61, № 10, стр. 837-844
Особенности метилирования ДНК и гистона Н3 в мозге крыс в ответ на тяжелую гипобарическую гипоксию и гипоксическое посткондиционирование
О. В. Ветровой 1, 2, Е. И. Тюлькова 1, *, В. А. Стратилов 1, К. А. Баранова 1, М. О. Самойлов 1
1 Институт физиологии им. И.П. Павлова РАН
199034 Санкт-Петербург, Россия
2 Биологический факультет Санкт-Петербургского государственного университета
199034 Санкт-Петербург, Россия
* E-mail: etyulkova@yandex.ru
Поступила в редакцию 23.04.2019
После доработки 17.05.2019
Принята к публикации 18.05.2019
Аннотация
В оригинальной модели тяжелой гипобарической гипоксии (ТГ) и гипоксического посткондиционирования (ПостК) исследованы уровни метилирования гистона Н3 по Lys4 (meН3К4), по Lys9 (meН3К9), а также метилирования ДНК (meDNA) в нейронах гиппокампа и неокортекса крыс. Показано, что в поле СА1 гиппокампа через сутки после ТГ повышается содержание meН3К4 и снижается уровень meDNA, а в дальнейшем снижается количество meН3К9 и повышается содержание meDNA. ПостК вызывает увеличение meН3К4, нормализует уровень meН3К9 и снижает уровень meDNA в поле СА1 гиппокампа крыс, переживших ТГ. В неокортексе достоверные изменения обнаруживаются только на 1–2 сут после ТГ и заключаются в стимуляции процессов метилирования гистона Н3 на фоне уменьшения meDNA. Таким образом, в ответ на ТГ наблюдался сложный паттерн изменений статуса метилирования Н3 и ДНК как в гиппокампе, так и в неокортексе, однако протективный эффект ПостК сопровождался коррекцией лишь гиппокампальных реакций, в то время как уровень метилирования в неокортексе возвращался к исходному вне зависимости от сеансов ПостК.
Поиск путей повышения устойчивости мозга к гипоксии (ишемии) представляет собой одну из важнейших задач современной биологии и медицины. Среди наиболее перспективных подходов для решения этой задачи можно выделить разработку лекарственных средств и использование немедикаментозных способов мобилизации эндогенных защитных механизмов (Самойлов, Рыбникова, 2012). Из таких немедикаментозных способов особого внимания заслуживает посткондиционирование (ПостК) – экспозиция особей, перенесших тяжелое повреждающее воздействие, экстремальным факторам умеренной интенсивности (Zhao et al., 2003). В работах нашей лаборатории убедительно показано, что такое немедикаментозное воздействие как трехкратная умеренная гипобарическая гипоксия (УГГ) в режиме ПостК нивелирует структурно-функциональные нарушения мозга, вызываемые тяжелой гипобарической гипоксией (ТГ) (Ветровой и др., 2017). ПостК предотвращает отсроченную клеточную гибель в уязвимых структурах мозга, вызываемую тяжелыми гипоксическими воздействиями, нормализует процессы перекисного окисления липидов, улучшает поведенческие характеристики (Rybnikova et al., 2012; Vetrovoy et al., 2017). ПостК реализует нейропротекторные эффекты через повышение экспрессии антиапоптотических факторов (Bcl-2), нейротрофинов (BDNF), модификацию активности ряда транскрипционных факторов, в частности HIF-1 (фактора, чувствительного к гипоксии) в гиппокампе (Ветровой и др., 2014а, 2014б, 2018; Vetrovoy et al., 2019).
Активация (ингибирование) транскрипционных факторов, а также возможность реализации их действия на геном зависят от эпигенетического статуса хроматина и контролируются механизмами эпигенетической регуляции. Процессы эпигенетической регуляции активности генома включают метилирование CpG-островков ДНК, вовлечение некодирующих РНК и активацию (инактивацию) ферментов, осуществляющих посттрансляционные модификации гистонов. Их согласованное действие необходимо для структурно-функциональной модификации активности хроматина. Показано, в частности, что HIF-1-управляемый транскрипционный ответ в условиях гипоксии зависит от статуса метилирования ДНК в регуляторных областях генов-мишеней (Cimmino et al., 2019), однако вопрос о роли эпигенетических процессов в адаптации к гипоксии и компенсации ее повреждающего действия далек от своего решения.
Как известно, метилирование (деметилирование) ДНК является важнейшим механизмом в регуляции активности генов (Bhutani et al., 2011). Основная функция метилирования ДНК заключается в том, чтобы ингибировать транскрипцию генов (Freitag, Selker, 2005; Weber et al., 2007). В свою очередь, метилирование гистонов изменяет структуру хроматина, что определяет доступ транскрипционных факторов к регуляторным сайтам ДНК (Suganuma, Workman, 2011). Как известно, метилированные формы гистона Н3 по Lys4 (meH3k4), также как ацетилированные формы гистона Н3, способствуют активации генов, а по Lys9 (meH3k9) – их торможению (Perez-Perri et al., 2011).
Настоящее исследование направлено на изучение процессов эпигенетической регуляции активности генома при ТГ и ПостК. В задачи исследования входило изучение характера вовлечения процессов метилирования (деметилирования) ДНК и гистона Н3 нейронов наиболее уязвимых образований мозга (новой коры больших полушарий, гиппокампа) при предъявлении повреждающей ТГ и ТГ в сочетании с ПостК. Как уже отмечалось выше, эффективность нейропротекции, индуцируемой применяемым режимом ПостК, доказана в наших предыдущих работах (Ветровой и др., 2017; Rybnikova et al., 2012; Vetrovoy et al., 2017).
МАТЕРИАЛ И МЕТОДИКА
Работа с животными. При проведении экспериментов соблюдали требования, сформулированные в Директивах Совета Европейского сообщества (86/609/ЕЕС) об использовании животных для экспериментальных исследований. Протоколы экспериментов были утверждены Комиссией по гуманному обращению с животными ФГБУН Института Физиологии им. И.П. Павлова РАН.
Работа проведена на животных, предоставленных ЦКП “Биоколлекция ИФ РАН”. Использовали самцов белых крыс линии Вистар в возрасте 80–90 сут весом 230–260 г. В течение всего периода проведения экспериментов крыс содержали при режиме свет : темнота 12 : 12 ч, температуре 20–23°С и при постоянном доступе к воде и пище. Для создания условий ТГ крыс помещали в барокамеру проточного типа при температуре от 20 до 25°С и ступенчато понижали давление до 180 мм рт. ст. (5% О2, продолжительность воздействия – 3 ч). Смертность животных в барокамере стандартно составляла 50% (Строев и др., 2011). ПостК осуществлялись путем трехкратного 2-часового воздействия УГГ (давление в барокамере 360 мм. рт. ст., эквивалентно 10% О2). Воздействия УГГ осуществляли через 24 ч после ТГ с суточными интервалами между сеансами. Животные контрольной группы, не подвергавшиеся гипоксическому воздействию, проходили соответствующие процедуры пребывания в барокамере.
Декапитацию животных проводили через 1, 2 и 4 сут после ТГ и через 1 сут после последнего сеанса ПостК (группа ТГ + 3ПостК). Параллельно осуществляли забой крыс контрольной группы. В каждой группе было 6 животных. После декапитации вскрывали череп, извлекали мозг, отрезали мозжечок и помещали мозг в фиксатор. Далее образцы ткани мозга обрабатывали согласно стандартному гистологическому протоколу: фиксировали в молекулярном фиксаторе FineFix (разведение: 28 мл фиксатора + 72 мл этанола 96%; Milestone, Италия) в течение 24 ч при температуре 4°C. Затем образцы промывали в проточной воде в течение 2 ч и обезвоживали, проводя через этанол возрастающих концентраций (50 → 70 → 80 → 96 → 96% по 1 ч в каждом). На ночь оставляли в бутаноле. Затем материал проводили через 2 порции ксилола (по 30–40 мин), помещали в парафин (2 смены парафина, по 1 ч в каждой) в термостате при температуре 56°C и изготавливали парафиновые блоки. На ротационном микротоме (Reichert, Австрия) изготавливали серийные срезы мозга во фронтальной плоскости толщиной 7 мкм на уровне 2.8–3.6 мм от брегмы. Полученные срезы монтировали на предметные стекла, обработанные полилизином.
Далее срезы депарафинизировали в ксилоле (2 смены по 5 мин) и подвергали регидратации в спиртах (96 → 96 → 96 → 70% по 5 мин в каждом). Для оценки степени метилирования ДНК и гистона Н3 использовали иммуногистохимический метод. Основные этапы метода: 1) инкубация с первичными антителами против антигенов интереса (поликлональными кроличьими антителами к гистону Н3, метилированному по Lys4 (meН3К4), (антитела: ab8580, Abcam, США; разведение1 : 500) или Lys9 (meН3К9) (антитела: ab8898, Abcam, США; разведение 1 : 500), либо с моноклональными мышиными антителами к метилированному цитидину ДНК (meDNA), (sc-56615, SantaCruz, США; разведение 1 : 200); 2) инкубация с вторичными биотинилированными противокроличьими либо противомышиными антителами (Vectastein ABC kit, Vector Laboratories, Inc., США, 1 : 200); 3) инкубация с комплексом авидина и биотинилированной пероксидазы (ABC, Vector Laboratories, Inc., США, разведение реагентов А и В 1 : 100); 4) визуализация реакции с помощью диаминобензидинового набора DAB substrate kit for peroxidase (Vector Laboratories, Inc., США): буфер (1 капля), 3,3-диаминобензидин (2 капли), Н2О2 (1 капля) на 2.5 мл Н2О. Для исключения артефакта времени проведения пероксидазной реакции на каждом из окрашиваемых стекол присутствовали срезы контрольной и экспериментальных групп.
Анализ препаратов проводили с помощью морфометрической установки, состоящей из светового микроскопа Jenaval (Carl Zeiss, Германия), цифровой камеры Baumer CX05c (Baumer Optronic, Германия) и компьютера IBM PC с программным обеспечением ВидеоТест Мастер Морфология (разработка ООО Видео Тест, Санкт-Петербург). Измерения проводили в поле зрения площадью 460 × 340 мкм при увеличении объектива 40×. Определяли величину средней оптической плотности клеток (для поля СА1 гиппокампа – 70 клеток, для II и V слоев неокортекса – по 100 клеток), в усл. ед. уровня серого, обратно пропорциональных единицам яркости. Для анализа проводили иммуногистохимическую реакцию на 4-х гистологических препаратах от каждого животного, усредняя значения для каждой области мозга c одного поля зрения конкретной области мозга на срезе. Результаты обрабатывали с помощью пакетов анализа данных STATISTICA 7.0 Stat Soft, Inc и Microsoft Excel’2003, использовали непараметрический критерий Манн–Уитни (Mann–Whitney U-test). Изменения считали достоверными при P ≤ 0.05. Все результаты представлены в виде среднего арифметического и его ошибки. Результаты выражены в процентах от контроля, принятого за 100%.
РЕЗУЛЬТАТЫ
Метилирование Н3 по Lys4 (meH3k4). Количественный анализ показал, что ТГ через 24 ч после воздействия приводит к значимому повышению уровня meН3К4 по сравнению с контролем во всех исследованных областях мозга (до 118 ± 4% в поле СА1 гиппокампа, до 126 ± 7 и 127 ± 5% во II и V слоях неокортекса соответственно). В неокортексе уровень meH3k4 оставался повышенным и через 2 сут после воздействия ТГ (118 ± 6 и 124 ± 8% во II и V слоях неокортекса соответственно). К 4-м сут после воздействия ТГ степень метилирования гистона Н3 по Lys4 постепенно нормализуется во всех исследованных областях мозга (рис. 1). На рис. 2 (meH3k4) представлены репрезентативные микрофотографии иммуногистохимической реакции по метилированному гистону Н3 по Lys4 клеток в поле СА1 гиппокампа и неокортексе (II и V слои) контрольных крыс и крыс, подвергавшихся действию ТГ без и с последующим применением УГГ в режиме ПостК.
Рис. 1.
Средняя оптическая плотность (D) иммунопозитивных к meН3к4, meН3к9 и meDNA клеток поля СА1 гиппокампа (СА1), V слоя неокортекса (НеоV) и II слоя неокортекса (НеоII) контрольных крыс (Контроль) и крыс, переживших тяжелую гипобарическую гипоксию (ТГ), либо тяжелую гипоксию в сочетании с посткондиционированием (ПостК) умеренной гипобарической гипоксией (ТГ+ПостК). D выражена в % от контроля. Различия с контролем (*) и с ТГ (#) статистически достоверны при Р ≤ 0.05.
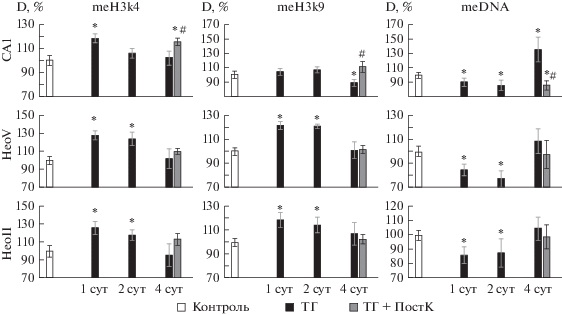
Рис. 2.
Микрофотографии поля СА1 гиппокампа (СА1), V (НеоV) и II (НеоII) слоя неокортекса контрольных крыс и крыс, переживших тяжелую гипобарическую гипоксию (ТГ), либо тяжелую гипоксию в сочетании с посткондиционированием умеренной гипобарической гипоксией (ТГ + ПостК).
meН3к4 и meН3к9 – Иммуногистохимическая реакция на гистон Н3, метилированный соответственно по Lys4 и по Lys9; meDNA – иммуногистохимическая реакция на метилирование ДНК. Об.: 40×. Масштабная линейка: 100 мкм.

В области СА1 гиппокампа УГГ в режиме ПостК приводила к тому, что уровень meН3К4 оставался выше контроля (116 ± 6%) и превышал значения после ТГ без ПостК. В отличие от этого, в исследованных слоях неокортекса ПостК не вызывало значимых изменений уровня метилирования гистона Н3 по Lys4.
Метилирование Н3 по Lys9 (meH3k9). В отличие от meH3k4, не выявлено значимых изменений при исследовании иммунореактивности к meH3k9 в поле СА1 гиппокампа крыс через 1 и 2 сут после воздействия ТГ (рис. 1). Однако через 4 сут после ТГ наблюдали достоверное снижение уровня meH3k9 (88 ± 5% от контроля) в данной структуре мозга. В неокортексе крыс этой экспериментальной группы наблюдали увеличение уровня meH3K9 на протяжении 2 сут после ТГ (118 ± 7 и 114 ± 6% от контроля во II слое, 122 ± 3 и 121 ± 2% от контроля в V слое через 1 и 2 сут после ТГ соответственно), после чего этот показатель возвращался к контрольным значениям. В то же время ни в гиппокампе, ни в неокортексе крыс, подвергавшихся ТГ в сочетании с сеансами ПостК, не выявлено изменений количества meH3K9 по сравнению с контролем. Репрезентативные микрофотографии иммуногистохимической реакции к meH3k9 в поле СА1 гиппокампа и неокортексе (II и V слои) контрольных крыс и крыс, подвергавшихся действию ТГ без и с последующим применением УГГ в режиме ПостК, представлены на рис. 2 (meH3k9) .
Метилирование ДНК (meDNA). Через 1-2 сут после воздействия ТГ уровень meDNA был достоверно снижен по сравнению с контролем во всех исследованных областях мозга (89 ± 6 и 85 ± 8% от контроля в поле СА1 гиппокампа, 86 ± 6 и 88 ± 10% от контроля во II слое, 84 ± 5 и 77 ± 7% от контроля в V слое через 1 и 2 сут после ТГ соответственно) (рис. 1). К 4-м сут после ТГ средняя оптическая плотность клеток, иммунопозитивных к meDNA, возвращалась к контрольному уровню во II и V слоях неокортекса, а в поле СА1 гиппокампа даже превышала контрольные значения (136 ± 17% от контроля). Применение трехкратных сеансов УГГ после ТГ приводило к снижению уровня meDNA в области СА1 гиппокампа (85 ± 7% от контроля), но не в неокортексе. Репрезентативные микрофотографии иммуногистохмического окрашивания по метилированной ДНК в поле СА1 гиппокампа и неокортексе (II и V слои) контрольных крыс и крыс, подвергавшихся воздействию ТГ и ТГ с последующей УГГ в режиме ПостК, представлены на рис. 2 (meDNA).
ОБСУЖДЕНИЕ
Предполагают, что модуляция посттрансляционных модификаций гистонов, прежде всего, ацетилирования и метилирования гистонов Н3 и Н4 представляет собой один из механизмов адаптации к гипоксии (Costa et al., 2005; Chen et al., 2006; Johnson et al., 2008; Xia et al., 2009; Yang et al., 2009; Watson et al., 2010; Perez-Perri et al., 2011; Mimura et al., 2012). Ранее нами показано, что тяжелая гипобарическая гипоксия приводит к отсроченному статистически значимому повышению ацетилированной формы гистона Н3 (Н3асК24) в клетках неокортекса, что очевидно отражает запуск процессов реабилитации нервной ткани (Ветровой и др., 2018). Это подтверждается результатами наших более ранних исследований о влиянии гипоксии в различных режимах на экспрессию белков, ответственных за механизмы выживания нейронов, нейрональную пластичность, в частности нейротрофинов (BDNF) и антиапоптотических факторов (Bcl-2) в гиппокампе и неокортексе крыс (Чурилова и др. 2014; Samoilov et al. 2014).
В данной работе воздействие управляемой гипобарической гипоксией в различных режимах (повреждение клеток вследствие ТГ, восстановление их жизнеспособности после применения трехкратной УГГ в режиме ПостК) показало, что характер метилирования гистона Н3 в клетках неокортекса и гиппокампа различается в зависимости от гипоксического режима и структуры мозга. Интересно, что повреждающая ТГ (180 мм рт. ст.) индуцирует существенное увеличение содержания в неокортексе (но не гиппокампе) как meH3k4, так и meH3k9, причем это происходит уже в первые 2 сут после воздействия, тогда как в отдаленный период после воздействия возвращается к контрольному уровню. По всей видимости, в период реоксигенации запускаются конкурентные механизмы восстановления (нарушения) функциональной активности клеток мозга, вследствие перенесенного воздействия ТГ (Costa et al., 2005; Chen et al., 2006; Xia et al., 2009.). Это подтверждается и литературными данными. В частности, на примере нескольких линий раковых опухолей человека и мыши описано индуцированное гипоксией увеличение как активирующих, так и репрессивных метилирований гистонов (Johnson et al., 2008; Zhou et al., 2010; Tausendschon et al., 2011; Prickaerts et al., 2016; Chen et al., 2006; Olcina et al., 2013). В последнее время также было показано, что изменения в архитектуре хроматина, вызываемые гипоксией, обратимы при реоксигенации и пополнении питательных веществ (Kirmes et al., 2015). В нашей работе также установлено, что к 4-м сут после окончания сеанса ТГ происходит восстановление уровня метилирования гистона Н3 по Lys4 и Lys9 во всех исследованных структурах мозга.
В отличие от неокортекса, в гиппокампе в ответ на ТГ наблюдаются разнонаправленные изменения двух модификаций метилирования гистона Н3. Так, на ранних сроках отмечается повышение уровня meH3k4, а на поздних – снижение количества meH3k9. При этом ПостК способствует увеличению содержания meH3k4 по крайней мере на протяжении до 4 сут, однако нормализует уровень meH3k9. Принимая во внимание традиционные представления о влиянии исследуемых эпигенетических модификаций на активность генома, можно сделать предположение, что экспозиция ТГ способствует увеличению транскрипционной активности хроматина в нейронах гиппокампа, а ПостК пролонгирует этот эффект, одновременно способствуя восстановлению ингибиторных влияний.
Метилирование ДНК – фундаментальный эпигенетический механизм контроля экспрессии генов у млекопитающих, связанный, в основном, с репрессией транскрипции, который заключается в присоединении метильной группы к углероду в 5-м положении молекулы цитозина с образованием 5-метилцитозина. В работах нашей лаборатории показано увеличение уровня meDNA в первые часы после действия ТГ (Самойлов и др., 2016), в то же время обнаружено, что повреждающая ТГ существенно снижает уровень регуляторной α-субъединицы фактора HIF1 (HIF1α) в неокортексе и гиппокампе крыс (Самойлов и др., 2015). Другими авторами также показано, что усиление метилирования ДНК подавляет экспрессию HIF1α (Koslowski et al., 2011; Walczak-Drzewiecka et al., 2010), который является основным медиатором транскрипционных ответов на гипоксию, способствующим формированию гипоксически-индуцируемого фенотипа (Watson et al., 2010). В то же время показана обратная зависимость между базовым уровнем HIF1α в нейронах неокортекса и генетически запрограммированной толерантностью организма к гипоксии (Кирова, 2012). В настоящей работе показано, что через 24–48 ч после ТГ уровень meDNA в клетках гиппокампа ниже контрольных уровней, что согласуется с повышением экспрессии HIF1α в области СА1 гиппокампа крыс через 24 ч после предъявления ТГ (Vetrovoy et al., 2019). Кроме того, отдаленное (4 сут) снижение meDNA также коррелирует с повышением экспрессии HIF1α в эти же сроки.
ПостК снижало уровень meDNA в гиппокампе по сравнению с таковым после ТГ и контролем, что также находится в обратной корреляции с экспрессией HIF1α после воздействия ТГ в сочетании с ПостК, а именно: ПостК приводило к значительной стимуляции экспрессии HIF1α после ТГ (Vetrovoy et al., 2019). Это еще раз подтверждает наличие связи между гипоксия-чувствительным транскрипционным фактором HIF1α и метилированием ДНК, а также, вероятно, модификацией meH3k4. При этом наблюдается противоположный эффект ПостК на эти функционально разнонаправленные модификации, и наблюдаемые изменения должны способствовать активации экспрессии генов.
В дополнение следует еще раз подчеркнуть, что эффект ПостК проявлялся лишь в гиппокампе, но не в неокортексе. На этом основании, очевидно, можно предположить, что модификация процессов метилирования гистона Н3 и ДНК именно в гиппокампе, но не неокортексе, вносит вклад в реализацию нейропротекторного действия ПостК.
Таким образом, проведенные исследования в дополнение к ранее опубликованным данным по изменению ацетилирования гистона Н3 в ответ на ТГ и ТГ в сочетании с ПостК демонстрируют важную роль эпигенетических факторов в реакциях наиболее уязвимых нейронов мозга на различные режимы гипоксии, а также в повышении резистентности мозга к неблагоприятным факторам среды. Полученные сведения могут быть использованы при разработке новых средств профилактики и лечения неврологических заболеваний.
Список литературы
Ветровой О.В., Рыбникова Е.А., Самойлов М.О. 2017. Церебральные механизмы гипоксического/ишемического прекондиционирования (Обзор). Биохимия. 82(3) : 542–551 (Vetrovoy O.V., Rybnikova E.F., Samoilov M.O. 2017. Cerebral mechanisms of hypoxic/ischemic postconditioning. Biochemistry (Moscow). 82(3): 392-400.)
Ветровой О.В., Рыбникова Е.А., Глущенко Т.С., Баранова К.А., Самойлов М.О. 2014а. Умеренная гипобарическая гипоксия в режиме посткондиционирования повышает экспрессию HIF-1α и эритропоэтина в СА1 поле гиппокампа крыс, переживших тяжелую гипоксию. Нейрохимия. 31(2) : 134–139. (Vetrovoy O.V., Rybnikova E.A., Glushchenko T.S., Baranova K.A., Samoilov M.O. 2014. Mild hypobaric hypoxic postconditioning increases the expression of HIF-1 α and erythropoietin in the CA1 field of the hippocampus of rats that survive after severe hypoxia. Neurochemical J. 8(2) : 103–108.)
Ветровой О.В., Рыбникова Е.А., Глущенко Т.С., Самойлов М.О. 2014б. Влияние гипоксического посткондиционирования на экспрессию противоапоптотического белка BCL-2 и нейротрофина BDNF в поле СА1 гиппокампа крыс, переживших тяжелую гипоксию. Морфология. 145(2) : 16–20. (Vetrovoy O.V., Rybnikova Ye.A, Glushchenko T.S. Samoilov M.O. 2014. Effect of hypoxic postconditioningon on the expression of antyapoptotic protein BCL-2 and neuroprotein BDNF in CA1 hippocampal field of rats surviving severe hypoxia. Morfologia. 145(2) : 16–20. (in Russian).)
Ветровой О.В., Глущенко Т.С., Сариева К.В., Тюлькова Е.И., Арамисова Р.М., Самойлов М.О. 2018. Ацетилирование гистона Н3 по Lys24 сопровождается отсроченной экспрессией нейропротекторных белков Bcl-2 и BDNF в неокортексе крыс, переживших тяжелую гипоксию. эффект гипоксического посткондиционирования. Нейрохимия. 35(3) : 233–240. (Vetrovoy O.V., Glushchenko T.S., Sarieva K.V., Tyulkova E.I., Aramisova R.M., Samoilov M.O. 2018. The acetylation of histone H3 at Lys24 is accompanied by delayed expression of neuroprotective proteins Bcl-2 and BDNF in the neocortex of rats exposed to severe hypoxia: The effect of postconditioning. Neurochem. J. 12(3) : 241–247.)
Кирова Ю.И. 2012. Влияние гипоксии на динамику содержания HIF-1a в коре головного мозга и формирование адаптации у крыс с различной резистентностью к гипоксии. Патол. физиол. экспер. терапия. 56(3) : 51–55. (Kirova Yu.I. 2012. Impact of hypoxia on dynamics of the post-hypoxia HIF-1a level in neocortex and adaptation forming in rats with different resistance to hypoxia. Pathol. Physiol. Exper. Therapy. 56(3) : 51–55 (in Russian).)
Самойлов М.О., Рыбникова Е.А. 2012. Молекулярно-клеточные и гормональные механизмы индуцированной толерантности мозга к экстремальным факторам среды. Рос. физиол. журн. им. И.М. Сеченова. 98(1) : 108—126. (Samoilov M.O., Rybnikova E.A. 2013. Molecular-cellular and hormonal mechanisms of induced tolerance of the brain to extreme environmental factors. Neurosci. Behav. Physiol. 43(7) : 827–837.)
Самойлов М.О., Сидорова М.В., Глущенко Т.С. 2015. Паттерн экспрессии гипоксия-индуцибельного фактора HIF-1α в неокортексе и гиппокампе крыс при предъявлении различных режимов гипобарической гипоксии. Нейрохимия. 32(4) : 322–329. (Samoilov M.O., Sidorova M.V., Glushchenko T.S. 2015. The pattern of the expression of hypoxia-inducible factor (HIF-1α) in the neocortex and hippocampus of rats after the presentation of different modes of hypobaric hypoxia. Neurochem. J. 9(4) : 299–305.)
Самойлов М.О., Чурилова А.В., Глущенко Т.С., Рыбникова Е.А. 2016. Особенности влияния различных режимов гипобарической гипоксии на содержание эпигенетических факторов в нейронах неокортекса крыс. Бюллетень экспер. биол. мед. 162(12) : 686–690. (Samoilov M.O., Churilova A.V., Glushchenko T.S., Rybnikova E.A. 2017. Effects of different modes of hypobaric hypoxia on the content of epigenetic factors in the rat in neurons of rat neocortex. Bull. Exp. Biol. Med. 162(6) : 722–725.)
Строев С.А., Тюлькова Е.И., Ватаева Л.А., Самойлов М.О., Пельто-Хуикко М.Т. Влияние пренатальной гипоксии на экспрессию тиоредоксина-1 в гиппокампе крыс на разных строках постнатального онтогенеза. 2011. Нейрохимия. 28 (3) : 226–231. (Stroev S.A., Pelto-Huikko M.T., Tyul’kova E.I., Samoilov M.O., Vataeva L.A. 2011. Effects of prenatal hypoxia on expression of thioredoxin-1 in the rat hippocampus at different stages of postnatal ontogeny. Neurochem. J. 5(3) : 200-204.)
Чурилова А.В., Глущенко Т.С., Самойлов М.О. 2014. Изменение экспрессии антиапоптотического белка Bcl-2 в неокортексе и гиппокампе у крыс под влиянием различных режимов гипобарической гипоксии посткондиционированием. Морфология. 146(5) : 7–13. (Churilova A., Glushchenko T.S., Samoilov M.O. 2014. Changes in the expression of BCL-2 antiapoptotic protein in rat neocortex and hippocampus under the influence of various modes of hypobaric hypoxia. Morfologia. 146(5) : 7–13. (in Russian).)
Bhutani N., Burns D.M., Blau H.M. 2011. DNA demethylation dynamics. Cell. 146 : 866–872.
Chen H., Yan Y., Davidson T.L., Shinkai Y., Costa M. 2006. Hypoxic stress induces dimethylated histone H3 lysine 9 through histone methyltransferase G9a in mammalian cells. Cancer Res. 66 : 9009–9016.
Cimmino F., Avitabile M., Lasorsa V.A., Montella A., Pezone L., Cantalupo S., Visconte F., Corrias MV., Iolascon A., Capasso M. 2019. HIF-1 transcription activity: HIF1A driven response in normoxia and in hypoxia. BMC Med. Genet. 20 : 37. https://doi.org/10.1186/s12881-019-0767-1
Costa M., Davidson T.L., Chen H., Ke Q., Zhang P., Yan Y., Huang C., Kluz T. 2005. Nickel carcinogenesis: Epigenetics and hypoxia signaling. Mutat. Res. 592 : 79–88.
Freitag M., Selker E.U. 2005. Controlling DNA methylation: Many roads to one modification. Curr. Opin. Genet. Dev. 15 : 191–199.
Johnson A.B., Denko N., Barton M.C. 2008. Hypoxia induces a novel signature of chromatin modifications and global repression of transcription. Mutat. Res. 640 : 174–179.
Kirmes I., Szczurek A., Prakash K., Charapitsa I., Heiser C., Musheev M., Schock F., Fornalczyk K., Ma D., Birk U. 2015. A transient ischemic environment induces reversible compaction of chromatin. Genome Biol. 16 : 246. https://doi.org/10.1186/s13059-015-0802-2
Koslowski M., Luxemburger U., Tureci O., Sahin U. 2011. Tumor-associated CpG demethylation augments hypoxia-induced effects by positive autoregulation of HIF-1alpha. Oncogene. 30 : 876–882.
Mimura I., Nangaku M., Kanki Y., Tsutsumi S., Inoue T., Kohro T., Yamamoto S., Fujita T., Shimamura T., Suehiro J., Taguchi A., Kobayashi M., Tanimura K., Inagaki T., Tanaka T., Hamakubo T., Sakai J., Aburatani H., Kodama T., Wada Y. 2012. Dynamic change of chromatin conformation in response to hypoxia enhances the expression of GLUT3 (SLC2A3) by cooperative interaction of hypoxia-inducible factor 1 and KDM3A. Mol. Cell Biol. 32 : 3018–3032.
Olcina M.M., Foskolou I.P., Anbalagan S., Senra J.M., Pires I.M., Jiang Y., Ryan A.J., Hammond E.M. 2013. Replication stress and chromatin context link ATM activation to a role in DNA replication. Mol. Cell. 52 : 758–766.
Perez-Perri J.I., Acevedo J.M., Wappner P. 2011.Epigenetics: New questions on the response to hypoxia. Int. J. Mol. Sci. 12 : 4705–4721.
Rybnikova E., Vorobyev M., Pivina S., Samoilov M. 2012. Postconditioning by mild hypoxic exposures reduces rat brain injury caused by severe hypoxia. Neursci. Lett. 513 : 100–105.
Samoilov M., Churilova A., Gluschenko T., Rybnikova E. 2014. Neocortical pCREB and BDNF expression under different modes of hypobaric hypoxia: Role in brain hypoxic tolerance in rats. Acta Histochem. 116 : 949–957.
Suganuma T., Workman J.L. 2011. Signals and combinatorial functions of histone modifications. Annu. Rev. Biochem. 80 : 473–499.
Tausendschon M., Dehne N., Brune B. 2011. Hypoxia causes epigenetic gene regulation in macrophages by attenuating Jumonji histone demethylase activity. Cytokine. 53 : 256–262.
Prickaerts P., Adriaens M.E., Beucken T.V., Koch E., Dubois L., Dahlmans V.E., Gits C., Evelo C.T., Chan-Seng-Yue M., Wouters B.G. 2016. Hypoxia increases genome-wide bivalent epigenetic marking by specific gain of H3K27me3. Epigenetics Chromatin. 9 : 46. https://doi.org/10.1186/s13072-016-0086-0
Vetrovoy O.K., Sarieva O., Galkina N., Eschenko A., Lyanguzov T., Gluschenko E., Tyulkova E., Rybnikova E. 2019. Neuroprotective mechanism of hypoxic post-conditioning involves HIF1-associated regulation of the pentose phosphate pathway in rat brain. Neurochem. Res. https://doi.org/10.1007/s11064-018-2681-x
Vetrovoy O., Tulkova E., Sarieva K., Kotryahova E., Zenko M., Rybnikova E. 2017. Neuroprotective effect of hypobaric hypoxic postconditioning is accompanied by dna protection and lipid peroxidation changes in rat hippocampus. Neurosci. Lett. 639 : 49–52.
Walczak-Drzewiecka A., Ratajewski M., Pulaski L., Dastych J. 2010. DNA methylationdependent suppression of HIF1A in an immature hematopoietic cell line HMC-1. Biochem. Biophys. Res. Commun. 39 : 1028–1032.
Watson J.A., Watson C.J., McCann A., Baugh J. 2010. Epigenetics, the epicenter of the hypoxic response. Epigenetics. 5 : 293–296.
Weber M., Hellmann I., Stadler M.B., Ramos L., Pääbo S., Rebhan M., Schübeler D. 2007. Distribution, silencing potential and evolutionary impact of promoter DNA methylation in the human genome. Nat. Genet. 39 : 457–466.
Xia X., Lemieux M.E., Li W., Carroll J.S., Brown M., Liu X.S., Kung A.L. 2009. Integrative analysis of HIF binding and transactivation reveals its role in maintaining histone methylation homeostasis. Proc. Natl. Acad. Sci. USA. 106: 4260–4265.
Yang J., Ledaki I., Turley H., Gatter K.C., Montero J.C., Li J.L., Harris A.L. 2009. Role of hypoxia-inducible factors in epigenetic regulation via histone demethylases. Ann. N. Y. Acad. Sci. 1177 : 185–197.
Zhao Z-Q., Corvera J., Halkos M. 2003. Inhibition of myocardial injury by ischemic postconditioning during reperfusion: Comparison with ischemic preconditioning. Am. J. Physiol. Heart Circ. Physiol. 285 : H579–H588.
Zhou X., Sun H., Chen H., Zavadil J., Kluz T., Arita A., Costa M. 2010. Hypoxia induces trimethylated H3 lysine 4 by inhibition of JARID1A demethylase. Cancer Res. 70 : 4214–4221.
Дополнительные материалы отсутствуют.


