Цитология, 2019, T. 61, № 10, стр. 823-836
Влияние Бисфенола А на митотическую активность в клеточных линиях человека различного происхождения
Н. И. Дергачева 1, И. О. Сучкова 1, *, Л. К. Сасина 1, Е. М. Нониашвили 1, А. В. Стасовская 1, Т. В. Баранова 1, Г. А. Софронов 1, Е. Л. Паткин 1, **
1 Институт экспериментальной медицины
197376 Санкт-Петербург, Россия
* E-mail: irsuchkova@mail.ru
** E-mail: elp44@mail.ru
Поступила в редакцию 16.05.2019
После доработки 02.07.2019
Принята к публикации 15.07.2019
Аннотация
Бисфенол А (БФА) – ксеноэстроген, обладающий генетической и эпигенетической токсичностью. Вопрос о механизмах, посредством которых БФА оказывает негативное влияние на организм, остается открытым. В данной работе проведен сравнительный анализ влияния БФА в четырех дозах (0.25, 0.5, 1 и 10 мкМ) на митотическую активность клеточных линий человека различного происхождения (HEK293, HepG2, IMR32, FetMSC). Обнаружены изменения митотической активности в линиях HEK293, HepG2 и IMR32, в которых в зависимости от типа клеток, дозы и продолжительности воздействия БФА наблюдали либо повышение, либо снижение митотического индекса (МИ), либо отсутствие влияния БФА на пролиферацию. По сравнению с этими тремя линиями мезенхимные стволовые клетки костного мозга эмбриона (линия FetMSC) оказались более устойчивы к действию БФА в исследованных дозах, в которых не выявили изменений МИ по сравнению с контролем. Это может указывать на существование в эмбриональных стволовых клетках дополнительных (возможно, эпигеномных) защитных механизмов, участвующих в регуляции клеточного цикла, тогда как в клетках опухолевого происхождения такой механизм, по-видимому, нарушен или менее устойчив к действию ксеноэстрогенов.
Бисфенол А (БФА) с 50-х годов прошлого века активно применяется в промышленности при производстве пластиковых изделий, полистирольных смол и различных покрытий. В настоящее время этот токсический продукт в большом количестве попадает в окружающую среду, воду и продукты питания из-за возросшего объема использования пластмассовых изделий и различных упаковочных материалов, содержащих БФА (Иванов и др., 2013; Corrales et al., 2015). В связи с тем, что БФА по своей структуре имеет сходство с женскими половыми гормонами и является ксеноэстрогеном, на протяжении нескольких десятилетий во всем мире активно проводятся исследования влияния БФА на живые организмы. Обнаружено, что он обладает гепатотоксичностью, может приводить к онкологическим заболеваниям, патологиям нервной, сердечно-сосудистой, эндокринной и репродуктивной систем. Воздействие БФА может быть одной из причин хронических респираторных заболеваний, остеопороза, а также задержек развития и психических расстройств (Паткин и др., 2013; Паткин, Софронов, 2015; vom Saal et al., 2007). Однако вопрос о механизмах, посредством которых БФА оказывает негативное влияние на организм человека и животных, остается открытым.
В настоящее время широкое применение в биохимико-токсикологических исследованиях находят методы оценки биологической активности веществ с использованием культур клеток человека и животных. В мире собраны значительные коллекции культур клеток, отличающихся по своему происхождению, морфологии, цитологическим, генетическим и биохимическим свойствам. Поскольку в основе защитных и адаптационных реакций клеток на воздействие различных факторов лежат единые фундаментальные механизмы, приводящие к сходным изменениям на морфологическом и молекулярном уровнях, то использование разного типа клеточных культур дает возможность экстраполировать полученные результаты на организм в целом (Еропкин, 2004).
Факторы, способные нарушать структуру ДНК и влиять на различные генетические процессы, относят к генотоксическим. Особая опасность генотоксикантов состоит в том, что их воздействие не вызывает гибели организма, а приводит к нарушениям, передающимся по наследству. Одним из основных показателей генотоксичности служит изменение пролиферативной активности клеток. Величина митотической активности является интегральным показателем негативного воздействия факторов на организм. Изменение митотической активности сказывается в итоге не только на пролиферации клеток, но и на репродуктивной способности на уровне организма в целом. Вхождение клеток в митоз, продолжительность митоза, соотношение отдельных фаз митоза зависят от большого числа факторов (как генетических, так и негенетических). Митотоксичность принято относить к группе генотоксических эффектов, т. к. в нарушении клеточного цикла большую роль играет генетическая компонента (Прохорова и др., 2003). Хотя на современном этапе не следует забывать о существенном вкладе эпигенетических механизмов в регуляцию этого процесса (Macaluso et al., 2005; Silva et al., 2012; Havranek et al., 2013; Fritz et al., 2019).
БФА с полным правом относят к генотоксикантам. Установлено, что он обладает гено- и цитотоксичностью, вызывает генные, хромосомные и геномные мутации, приводит к нарушению клеточного цикла и апоптозу (Bouskine et al., 2009; Havranek et al., 2013). Однако все еще недостаточно информации о влиянии средних (мкМ) и низких (нМ и пМ) доз БФА на клетки в зависимости от их типа и продолжительности воздействия на них токсиканта, не ясны и молекулярные механизмы, лежащие в основе гено- и цитотоксичности БФА в клетках разного происхождения (Chepelev et al., 2013; Strong et al., 2016; Senyildiz et al., 2017; Xiong et al., 2017). Публикации в этой области относительно влияния сверхнизких (“гомеопатических”, фМ) доз БФА в настоящее время отсутствуют, хотя, например, для многих физиологически активных химических веществ были выявлены биоэффекты в ряду сверхнизких доз (Булатов и др., 2002; Bellavite et al., 2007).
Цель настоящего исследования заключалась в сравнительном анализе влияния четырех доз БФА (0.25, 0.5, 1 и 10 мкМ) на митотическую активность клеток человека различного происхождения после 48- и 72-часового воздействия. В работе были исследованы три иммортализованные (HEK293, HepG2, IMR32) и одна неиммортализованная (FetMSC) клеточные линии. Все эти линии имеют различное эмбриональное и тканевое происхождение. HepG2 получена из печени, которая у всех позвоночных возникает из энтодермального эпителия зачатка двенадцатиперстной кишки. IMR32 представляет собой клеточную линию нейробластомы человека, полученную из брюшной массы, которая имитирует большие проекции коры головного мозга. Нейробластома возникает в эмбриональный период из симпатогониев – незрелых клеток-предшественников симпатической нервной системы. Эмбриональным источником для симпатической нервной системы служит ганглиозная пластинка, производная эктодермы. Клетки ганглиозной пластинки являются также и предшественниками эктомезенхимы, в отличие от мезенхимы, развивающейся из мезодермы. Линия HEK293 получена из клеток почки, которая имеет мезодермальное происхождение, как и линия FetMSC (мезенхимные стволовые клетки костного мозга). Линии HEK293 и HepG2 относятся к эпителиоподобным, а FetMSC и IMR32 к фибробластноподобным клеточным культурам. Кроме того, IMR32 является еще и нейробластоподобной линией (Токин, 1987; Полянская и др., 2018).
Поскольку БФА обладает эстроген-подобными свойствами, одним из механизмов воздействия которого на клетки является инициация эстрогенного пути активации транскрипции эстроген-чувствительных генов и эстроген-зависимой пролиферации, то многие исследования эффектов БФА преимущественно проводятся на ER-положительных (т.е. имеющих рецепторы к эстрогену) клеточных линиях. В тоже время механизм действия БФА на ER-негативные клетки до сих пор до конца не ясен. В наше исследование в сравнительный анализ были включены клетки обоих типов. ER-негативная клеточная линия – HEK293 (Yin et al., 2014). ER-положительные клетки – FetMSC (Strong et al., 2016), HepG2 (Xu et al., 2015; Shen, Shi, 2016) и IMR32. Хотя необходимо подчеркнуть, что в IMR32 не экспрессируются ERα-рецепторы (Su et al., 2012), а в клетках печени уровень мРНК рецепторов ERβ несколько ниже, чем ERα, и некоторые авторы даже относят HepG2 к ER-негативной линии (Kelly et al., 2014). Следует отметить, что эти линии имеют не только различное эмбриональное происхождение и по-разному экспрессируют рецепторы к эстрогену, но и отличаются по “полу”: линии HepG2, IMR32 и FetMSC имеют мужской генотип, а линия HEK293 – женский. В связи с этим интересно было проверить и предположение о возможном “зависимом от пола” клеточном ответе (по пролиферативной активности) на воздействие БФА.
МАТЕРИАЛ И МЕТОДИКА
Использованные реактивы. БФА (2,2-бис(4-гидроксифенил) пропан, 4,4'-изопропилидендифенол), 1000-кратный раствор БФА (10 мМ), который готовили на 20%-ном диметилсульфоксиде (ДМСО) и хранили в стеклянном флаконе при температуре −20°С (Sigma-Aldrich, США); ДМСО, колхицин и фосфатно-солевой буферный раствор (PBS) (БиолоТ, Россия); метанол (карбинол), ледяная уксусная кислота и хлорид калия (Вектон, Санкт-Петербург, Россия).
Культуры клеток человека. Линии клеток HEK293, HepG2, IMR32 и FetMSC были приобретены в ЦКП “Коллекция культур клеток позвоночных” Института цитологии РАН (Санкт-Петербург, Россия). Подробная информация о клеточных культурах позвоночных представлена в каталоге Института цитологии (Полянская и др., 2018), а также находится в открытом доступе на сайте European Collection of Authenticated Cell Cultures (http://www.phe-culturecollections.org.uk/products).
Культивирование монослойных клеточных линий. Все клетки культивировали в культуральных вентилируемых флаконах (25 см2; Orange scientific, Бельгия) при 37°С в СО2-инкубаторе в атмосфере 5% CO2 в 4 мл среды DMEM (а FetMSC – в среде DMEM/F12) (БиолоТ, Россия), содержащей 10% эмбриональной бычьей сыворотки (БиолоТ, Россия), 20 ед/мл антимикотиков (Thermo Fischer Scientific, США), 100 ед/мл пенициллина (БиолоТ, Россия) и 100 мкг/мл стрептомицина (БиолоТ, Россия) в течение 24 часов до достижения клетками 25–30% конфлюентности. Затем к экспериментальным образцам добавляли БФА, растворенный в ДМСО до конечной концентрации 0.25, 0.5, 1 или 10 мкМ (конечная концентрация ДМСО составляла 0.02%) и продолжали культивирование еще в течение 48 и 72 ч. Контрольные образцы (интактные клетки и клетки в присутствии 0.02% ДМСО) также культивировали в течение 48 и 72 ч. Состояние клеток периодически оценивали визуально под фазово-контрастным инвертированным микроскопом Axiovert35 (Zeiss, Германия). Для исследованных линий было проведено по три независимых эксперимента для вариантов с воздействием БФА в течение 48 и 72 ч.
Клеточные культуры не были синхронизированы по клеточному делению. За 2 ч до снятия клеток во флаконы вносили колхицин (БиолоТ, Россия) до конечной концентрации 0.2 мкг/мл. Клетки снимали с флаконов с помощью раствора трипсин-Версена (1 : 3) (БиолоТ, Россия) и переносили в пластиковые пробирки 5 мл (Axigen, США).
Цитологические препараты и оценка митотической активности клеток. Для получения постоянных препаратов ядер и метафазных хромосом суспензию клеток центрифугировали 5 мин при 800 g. Надосадочную жидкость удаляли и добавляли теплый гипотонический раствор (0.5% KCl), который составлял 7–10 объемов от размера осадка. Клетки ресуспендировали и инкубировали при 37°С в течение 30 мин. Центрифугировали 5 мин при 800 g. Гипотонический раствор удаляли и добавляли по 2 мл холодного фиксатора (смесь метанола и ледяной уксусной кислоты, 3 : 1). Инкубировали 30 мин при 4°С. Центрифугировали 5 мин при 800 g. Смену фиксатора проводили трижды. Суспензию фиксированных ядер раскапывали на влажные охлажденные стекла. Препараты высушивали на воздухе при комнатной температуре. Микроскопию проводили с использованием фазово-контрастного микроскопа Axio Lab.A1 (Zeiss, Германия) (объектив 20×, окуляр 10×). Для оценки пролиферативной активности вычисляли митотический индекс (МИ) – долю (%) делящихся клеток от общего числа проанализированных клеток. В каждом из исследуемых вариантов (контроль и эксперимент) анализировали по 3 препарата (минимум по 10 полей зрения на препарат). МИ определяли, как минимум, на 2000 зарегистрированных клеток.
Статистическая обработка. Доверительные интервалы (ДИ, 95%) для частот и долей (МИ) вычисляли по методу Уилсона без корректировки на непрерывность с помощью бесплатных онлайн-калькуляторов (https://measuringu.com/wald/ и http://vassarstats.net/prop1.html) (Гржибовский, 2008а). Оценку статистической значимости различий МИ между экспериментом (варианты с воздействия БФА) и контролем (0.02% ДМСО) проводили с помощью таблицы сопряженности 2 × 2 (Гржибовский, 2008б), используя критерий Хи2 Пирсона (http://vassarstats.net/) и точный критерий Фишера (https://www.cog-genomics.org/software/stats). Различия считали статистически значимыми при P < 0.05 (с поправкой на множественность сравнений P < 0.008). Для количественной оценки влияния различных доз БФА на МИ вычисляли относительный риск (ОР) с 95%-ным ДИ (http://vassarstats.net/) (Гржибовский, 2008б). ОР – это отношение частоты возникновения определенного события (в нашем случае митоза) среди опытных образцов, на которых оказывал влияние изучаемый фактор (в нашем случае БФА), к частоте данного события среди контрольных образцов, не подвергавшихся влиянию этого фактора. Данный параметр используется для сравнения вероятности появления исследуемого события в зависимости от наличия фактора риска (в данном случае БФА) или продолжительности его воздействия (в данном случае 48 и 72 ч). ОР показывает во сколько раз в одной группе событие развивается чаще или реже чем в другой (http://medstatistic.ru/theory/relative_risk.html).
Для проверки гипотезы о существовании зависимости и определении характера связи между дозой БФА и изменениями митотической активности клеток проводили корреляционный и регрессионный анализы с помощью онлайн-сервисов (http://astatsa. com/CorrelationTest/, http://vassarstats.net и http:// mathhelpplanet.com/static.php?p=onlayn-mnk-i-reg-ressionniy-analiz). Для оценки тесноты связи между исследованными параметрами использовали непараметрические показатели связи – коэффициент корреляции Спирмена (rs) и Кендалла (τ). В нашем случае не было выявлено линейной зависимости между исследуемыми параметрами, поэтому вычисляли индекс корреляции (Ixy) и индекс детерминации $\left( {I_{{xy}}^{2}} \right)$, используя уравнения полиномиальной регрессии. Для того чтобы выбрать наиболее адекватную полиномиальную модель, описывающую характер связи между дозой БФА и МИ, вычисляли среднюю ошибку аппроксимации (MAE – mean approximation error). Значимость модели регрессии проверяли с использованием F-критерия Фишера. Модель считали адекватной при MAE < 7% и P < 0.05 (Воскобойников, 2005; Гржибовский, 2008в; Репова, 2010).
Диаграммы построены с использованием Microsoft Excel.
РЕЗУЛЬТАТЫ
Выявлены изменения митотической активности в линиях HEK293, HepG2 и IMR32, где в зависимости от типа клеток, дозы и продолжительности воздействия БФА наблюдалось либо увеличение, либо снижение МИ, либо отсутствие влияния БФА на пролиферацию (рис. 1, табл. 1–3). По сравнению с этими тремя линиями клетки FetMSC оказались более устойчивы к действию исследованных доз БФА. У них не выявили изменений МИ по сравнению с контролем (0.02% ДМСО, использованного в качестве растворителя БФА) (P > 0.05) (табл. 4), поэтому экспериментальные данные по FetMSC на рис. 1 не представлены. Необходимо отметить, что в клетках всех исследованных линий воздействие БФА в указанных дозах не вызвало видимых морфологических изменений, что наблюдали и авторы многих подобных работ (Kelly et al., 2014; Yin et al., 2014; Xu et al., 2015; Strong et al., 2016; Xiong et al., 2017).
Рис. 1.
Изменение митотической активности в культурах клеток человека различного происхождения после воздействия бисфенола А (БФА) в течение 48 и 72 ч. На гистограмме отражены значения митотического индекса (МИ) с границами 95%-ного доверительного интервала (ДИ). Статистически значимые различия указаны по сравнению с контролем “0.02% ДМСО”: *Р < 0.001 и **Р < 0.01. Горизонтальной квадратной скобкой отмечены пары сравнения – МИ после культивирования в течение 3 сут (48 ч в присутствии БФА) и через 4 сут (72 ч в присутствии БФА), для которых выявлены различия МИ.
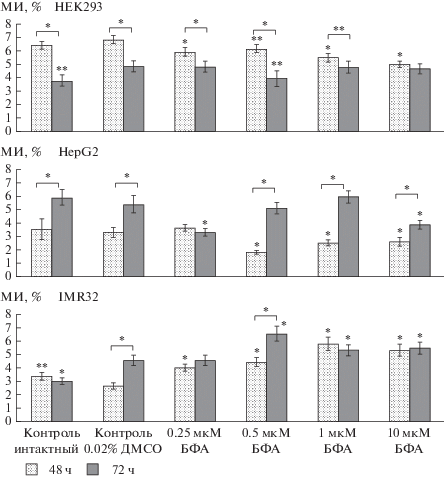
Таблица 1.
Митотическая активность клеток человека линии HEK293 после воздействия бисфенола А (БФА) в течение 48 и 72 ч
| Условия | Всего клеток | МИ, % (95% ДИ) |
ОР (95% ДИ) |
Уровень значимости Pа | |
|---|---|---|---|---|---|
| Хи2 Пирсона |
точный критерий Фишера | ||||
| БФА, 48 ч | |||||
| Контроль интактный | 25 339 | 6.55 (6.25–6.86) |
1.06 (0.99–1.14) |
0.067 | 0.682 |
| Контроль 0.02% ДМСО | 24 398 | 6.96 (6.65–7.29) |
– | – | – |
| 0.25 мкМ БФА | 22 769 | 6.06 (5.76–6.38) |
1.15 (1.07–1.23) |
<0.001* | <0.001* |
| 0.5 мкМ БФА | 27 813 | 6.30 (6.02–6.59) |
1.10 (1.04–1.18) |
0.003* | 0.003* |
| 1 мкМ БФА | 27 969 | 5.61 (5.35–5.89) |
1.24 (1.16–1.33) |
<0.001* | <0.001* |
| 10 мкМ БФА | 23 000 | 5.13 (4.85–5.42) |
1.36 (1.26–1.46) |
<0.001* | <0.001* |
| БФА, 72 ч | |||||
| Контроль интактный | 8172 | 3.82 (3.43–4.26) |
1.29 (1.12–1.48) |
<0.001* | <0.001* |
| Контроль 0.02% ДМСО | 10 328 | 4.92 (4.52–5.35) |
– | – | – |
| 0.25 мкМ БФА | 7783 | 4.92 (4.46–5.42) |
1.00 (0.88–1.14) |
1.000 | 1.000 |
| 0.5 мкМ БФА | 3958 | 3.99 (3.42–4.65) |
1.23 (1.04–1.47) |
0.019* | 0.019* |
| 1 мкМ БФА | 7507 | 4.89 (4.42–5.40) |
1.01 (0.88–1.15) |
0.920 | 0.944 |
| 10 мкМ БФА | 10 876 | 4.744 (4.36–5.16) |
1.04 (0.92–1.17) |
0.554 | 0.564 |
Примечание к табл. 1–4. ДИ – доверительный интервал, МИ – митотический индекс, ОР – относительный риск. Значения ОР указывают, во сколько раз изменилась (снизилась или возросла) (рис. 1) митотическая активность клеток по сравнению с контролем “0.02% ДМСО”. а Статистически значимые различия по сравнению с контролем “0.02% ДМСО” показаны звездочкой. Клетки культивировали 24 ч, затем добавляли БФА или ДМСО и культивировали еще 48 или 72 ч.
Таблица 2.
Митотическая активность клеток человека линии HepG2 после воздействия БФА в течение 48 и 72 ч
| Условия | Всего клеток | МИ, % (95% ДИ) |
ОР (95% ДИ) |
Уровень значимости P а | |
|---|---|---|---|---|---|
| Хи2 Пирсона | точный критерий Фишера | ||||
| БФА, 48 ч | |||||
| Контроль интактный | 2135 | 3.51 (2.81–4.38) |
1.07 (0.83–1.37) |
0.617 | 0.639 |
| Контроль 0.02% ДМСО | 8914 | 3.30 (2.95–3.69) |
– | – | – |
| 0.25 мкМ БФА | 17 082 | 3.64 (3.37–3.93) |
1.10 (0.96–1.27) |
0.154 | 0.157 |
| 0.5 мкМ БФА | 22 688 | 1.80 (1.63–1.93) |
1.83 (1.58–2.13) |
<0.001* | <0.001* |
| 1 мкМ БФА | 10 236 | 2.50 (2.21–2.82) |
1.32 (1.12–1.56) |
0.001* | 0.001* |
| 10 мкМ БФА | 8728 | 2.61 (2.30–2.97) |
1.26 (1.07–1.50) |
0.001* | 0.008* |
| БФА, 72 ч | |||||
| Контроль интактный | 5940 | 5.93 (5.36–6.56) |
1.09 (0.93–1.28) |
0.271 | 0.284 |
| Контроль 0.02% ДМСО | 4411 | 5.42 (4.79–6.13) |
– | – | – |
| 0.25 мкМ БФА | 12 969 | 3.31 (3.02–3.63) |
1.64 (1.40–1.91) |
<0.001* | <0.001* |
| 0.5 мкМ БФА | 7802 | 5.15 (4.68–5.66) |
1.05 (0.90–1.23) |
0.527 | 0.527 |
| 1 мкМ БФА | 9338 | 5.98 (5.52–6.48) |
1.11 (0.95–1.13) |
0.192 | 0.197 |
| 10 мкМ БФА | 12 407 | 3.93 (3.60–4.29) |
1.38 (1.19–1.61) |
<0.001* | <0.001* |
Таблица 3.
Митотическая активность клеток человека линии IMR32 после воздействия БФА в течение 48 и 72 ч
| Условия | Всего клеток | МИ, % (95% ДИ) |
ОР (95% ДИ) |
Уровень значимости P а | |
|---|---|---|---|---|---|
| Хи2 Пирсона |
точный критерий Фишера | ||||
| БФА, 48 ч | |||||
| Контроль интактный | 13 784 | 3.37 (3.08–3.68) |
1.25 (1.09–1.44) |
0.001* | 0.001* |
| Контроль 0.02% ДМСО | 12 599 | 2.69 (2.42–2.99) |
– | – | – |
| 0.25 мкМ БФА | 22 674 | 4.03 (3.78–4.29) |
1.50 (1.33–1.69) |
<0.001* | <0.001* |
| 0.5 мкМ БФА | 14 462 | 4.44 (4.12–4.79) |
1.65 (1.45–1.88) |
<0.001* | <0.001* |
| 1 мкМ БФА | 8977 | 5.76 (4.97–5.67) |
2.14 (1.87–2.45) |
<0.001* | <0.001* |
| 10 мкМ БФА | 10 032 | 5.30 (5.04–5.91) |
1.97 (1.72–2.25) |
<0.001* | <0.001* |
| БФА, 72 ч | |||||
| Контроль интактный | 17 133 | 2.99 (2.75–3.26) |
1.52 (1.37–1.70) |
<0.001* | <0.001* |
| Контроль 0.02% ДМСО | 17 954 | 4.56 (4.26–4.87) |
– | – | – |
| 0.25 мкМ БФА | 8434 | 4.55 (4.15–5.02) |
1.00 (0.89–1.13) |
1.000 | 1.000 |
| 0.5 мкМ БФА | 8363 | 6.55 (6.04–7.10) |
1.44 (1.29–1.60) |
<0.001* | <0.001* |
| 1 мкМ БФА | 15 820 | 5.31 (5.30–6.26) |
1.16 (1.06–1.28) |
0.002* | 0.002* |
| 10 мкМ БФА | 10 577 | 5.46 (4.88–5.76) |
1.20 (1.08–1.33) |
<0.001* | <0.001* |
Таблица 4.
Митотическая активность клеток человека линии FetMSC после воздействия БФА в течение 48 и 72 ч
| Условия | Всего клеток | МИ, % (95% ДИ) |
ОР (95% ДИ) |
Уровень значимости Pа | |
|---|---|---|---|---|---|
| Хи2 Пирсона |
точный критерий Фишера | ||||
| БФА, 48 ч | |||||
| Контроль интактный | 2250 | 1.11 (0.76–1.64) |
1.06 (0.63–1.80) |
0.823 | 0.892 |
| Контроль 0.02%ДМСО | 2965 | 1.05 (0.74–1.48) |
– | – | – |
| 0.25 мкМ БФА | 2834 | 0.95 (0.65–1.38) |
1.10 (0.66–1.83) |
0.718 | 0.792 |
| 0.5 мкМ БФА | 5319 | 0.88 (0.66–1.17) |
1.18 (0.75–1.86) |
0.462 | 0.478 |
| 1 мкМ БФА | 2100 | 0.91 (0.58–1.40) |
1.16 (0.65-2.04) |
0.617 | 0.667 |
| 10 мкМ БФА | 3010 | 1.26 (0.92–1.73) |
1.21 (0.75–1.93) |
0.431 | 0.469 |
| БФА, 72 ч | |||||
| Контроль интактный | 4130 | 1.16 (0.88–1.53) |
1.04 (0.66–1.66) |
0.863 | 0.867 |
| Контроль 0.02% ДМСО | 2508 | 1.12 (0.78–1.61) |
– | – | – |
| 0.25 мкМ БФА | 3752 | 1.09 (0.80–1.48) |
1.02 (0.63–1.65) |
0.920 | 1.000 |
| 0.5 мкМ БФА | 4704 | 0.85 (0.62–1.16) |
1.31 (0.81–2.12) |
0.266 | 0.306 |
| 1 мкМ БФА | 4616 | 0.80 (0.58–1.10) |
1.40 (0.86–2.27) |
0.182 | 0.193 |
| 10 мкМ БФА | 2535 | 1.54 (1.13–2.10) |
1.38 (0.85–2.23) |
0.191 | 0.219 |
Влияние 0.02% ДМСО на пролиферацию клеток HEK293, HepG2, IMR32 и FetMSC. Результаты проведенного исследования показали, что по сравнению с интактным контролем присутствие 0.02% ДМСО в культуральной среде не влияло на МИ клеток HepG2 и FetMSC (табл. 2 и 4). Тогда как в линии HEK293 присутствие 0.02% ДМСО в течение 72 ч усиливало пролиферацию, но при этом не изменяло МИ через 48 ч воздействия (рис. 1, табл. 1 и 5). В тоже время в клетках IMR32 через 48 ч воздействия 0.02% ДМСО наблюдали снижение митотической активности, а через 72 ч, наоборот, клеточная пролиферация усиливалась (рис. 1, табл. 3 и 5).
Таблица 5.
Степень (уровень) изменений митотической активности клеток в течение 1 сут в культурах клеток человека, подвергшихся воздействию БФА и ДМСО
| Условия | ОР (95% ДИ) |
Уровень значимости Pа | ОР (95% ДИ) |
Уровень значимости Pа | ||
|---|---|---|---|---|---|---|
| Хи2 Пирсона |
точный критерий Фишера | Хи2 Пирсона |
точный критерий Фишера | |||
| HEK293 | HepG2 | |||||
| Контроль интактный | 1.72 (1.52–1.93) |
<0.001* | <0.001* | 1.68 (1.32–2.15) |
<0.001* | <0.001* |
| Контроль 0.02% ДМСО | 1.42 (1.29–1.56) |
<0.001* | <0.001* | 1.64 (1.39–1.94) |
<0.001* | <0.001* |
| 0.25 мкМ БФА | 1.23 (1.10–1.37) |
<0.001* | <0.001* | 1.101 (0.98–1.24) |
0.119 | 0.121 |
| 0.5 мкМ БФА | 1.58 (1.35–1.85) |
<0.001* | <0.001* | 2.87 (2.50–3.28) |
<0.001* | <0.001* |
| 1 мкМ БФА | 1.15 (1.03–1.28) |
0.015* | 0.015* | 2.39 (2.07–2.76) |
<0.001* | <0.001* |
| 10 мкМ БФА | 1.08 (0.98–1.20) |
0.129 | 0.122 | 1.50 (1.29–1.75) |
<0.001* | <0.001* |
| IMR32 | FetMSC | |||||
| Контроль интактный | 1.12 (0.99–1.27) |
0.063 | 0.067 | 1.05 (0.65–1.69) |
0.863 | 0.903 |
| Контроль 0.02% ДМСО | 1.70 (1.50–1.92) |
<0.001* | <0.001* | 1.07 (0.64–1.78) |
0.807 | 0.795 |
| 0.25 мкМ БФА | 1.13 (1.00–1.27) |
0.041 | 0.041 | 1.15 (0.71–1.86) |
0.578 | 0.624 |
| 0.5 мкМ БФА | 1.48 (1.32–1.65) |
<0.001* | <0.001* | 1.04 (0.68–1.58) |
0.863 | 0.914 |
| 1 мкМ БФА | 1.09 (0.98–1.21) |
0.135 | 0.139 | 1.13 (0.65–1.96) |
0.663 | 0.665 |
| 10 мкМ БФА | 1.03 (0.92–1.15) |
0.632 | 0.643 | 1.22 (0.78–1.90) |
0.380 | 0.421 |
Примечание. ОР – относительный риск, ДИ – доверительный интервал. Значения МИ в исследованных группах 4-х клеточных линий человека после 48- и 72-часового воздействия ДМСО и БФА) показаны в табл. 1–4. Здесь значения ОР указывают, во сколько раз изменилась (снизилась или возросла) (рис. 1) митотическая активность клеток в течение 1 сут в исследуемой линии (как без, так и при воздействии токсикантов). аЗвездочкой отмечены статистически значимые различия параметра ОР в парах сравнения: 48 ч и 72 ч воздействия (т.е. 3 и 4 сут культивирования).
Влияние БФА на митотическую активность клеток HEK293. Воздействие БФА во всех исследованных дозах в течение 48 ч привело к снижению пролиферации клеток по сравнению с контролем (0.02% ДМСО), тогда как 72-часовое воздействие снизило МИ только при дозе 0.5 мкМ (рис. 1, табл. 1). Следует отметить, что в случае всех исследованных доз БФА (за исключением 10 мкМ) наблюдали следующее снижение МИ на 4-е сут культивирования (72 ч воздействия) по сравнению с МИ на 3-и сут (48 ч воздействия): примерно в 1.7 раз для интактного контроля, в 1.5 раз для 0.02% ДМСО и 1.5 мкМ БФА и в 1.2 раза для 0.25 и 1 мкМ БФА (табл. 5).
Корреляционно-регрессионный анализ результатов для клеток HEK293 показал отсутствие линейной зависимости МИ от дозы БФА в случае обоих сроков воздействия (48 и 72 ч). Через 48 ч: rs[5] = ‒0.90, 95%-ный ДИ: –0.99...0.09, Р = 0.08; τ[5] = –0.80, 95%-ный ДИ: –0.99...0.23, Р = 0.08. Через 72 ч: rs[5] = –0.60, 95%-ный ДИ: –0.87...0.90, Р = 0.35; τ[5] = –0.4, 95%-ный ДИ: –0.60...0.97, Р = 0.48. Для этой линии клеток не удалось подобрать математическую модель (уравнение полиномиальной регрессии), описывающую наблюдаемую немонотонную зависимость “доза–эффект”, что, возможно, объясняется небольшим количеством исследованных доз БФА.
Влияние БФА на митотическую активность клеток HepG2. Для этих клеток так же, как и клеток HEK293, было выявлено ослабление пролиферативной активности для некоторых из исследованных доз БФА (рис. 1, табл. 2). Во всех исследованных группах (за исключением группы с дозой 0.25 мкМ БФА) наблюдали следующее повышение МИ на 4 сут культивирования (72 ч воздействия) по сравнению с МИ на 3 сут культивирования (48 ч воздействия): в 1.6 раза для контролей (интактного и 0.02% ДМСО), а для БФА – в 2.9, 2.4 и 1.5 раза для дозы 0.5, 1 и 10 мкМ соответственно (табл. 5).
Как и в случае HEK293 для клеток HepG2 не подтвердился линейный характер зависимости между дозой БФА и пролиферативной активностью клеток для случая и 48-, и 72-часового воздействия. Через 48 ч действия БФА: rs[5] = –0.50, 95%-ный ДИ: ‒0.68...0.96, Р = 0.45; τ[5] = –0.20, 95%-ный ДИ: ‒0.82...0.92, Р = 0.82. Через 72 ч: rs[5] = 0.0, 95%-ный ДИ: –0.88...0.88, Р = 1.0; τ[5] = 0.0, 95%-ный ДИ: ‒0.88...0.88, Р = 1.0. Для наблюдаемой немонотонной зависимости “доза–эффект” подобрать уравнение полиномиальной регрессии также не удалось.
Влияние БФА на митотическую активность клеток IMR32. В отличие от клеток HEK293 и HepG2 в линии IMR32 действие БФА усилилo проли-фератив-ную активность (рис. 1, табл. 3). При сравнении митотической активности клеток IMR32 на 4‑е и 3-и сут культивирования наблюдали повышение МИ только для вариантов 0.02% ДМСО (в 1.7 раза) и 0.5 мкМ БФА (в 1.5 раза) (табл. 5). В норме скорость удвоения клеток IMR32 составляет 48 ч и теоретически мы должны были выявить усиление пролиферации в контроле через 4 сут культивирования (как это было обнаружено для линии HepG2), но, вероятно, в данном случае произошло некоторое смещение в клеточном цикле. Как и в двух предыдущих рассмотренных клеточных культурах в IMR32 не выявлено линейной связи между дозой БФА и МИ. Через 48 ч действия БФА: rs[5] = 0.90, 95%ДИ: 0.09–0.99, Р = 0.08; τ[5] = 0.80, 95%ДИ: 0.28–0.99, Р = 0.08. Через 72 ч: rs[5] = 0.60, 95%ДИ: –0.60...0.97, Р = 0.35; τ[5] = 0.40, 95%ДИ: –0.75...0.95, Р = 0.48.
В отличие от клеток, рассмотренных выше, только для клеток линии IMR32 и только для экспериментального варианта с воздействием БФА в течение 48 ч удалось с помощью регрессионного анализа подобрать математическую модель, описывающую характер зависимости между дозой БФА (переменная Х) и митотической активностью клеток (переменная Y). Наблюдаемую зависимость можно описать уравнением квадратичной регрессии: Y = –0.298x2 + 3.215x + + 2.921 (Ixy = 0.986, 95%-ный ДИ: 0.80–1.0, $I_{{xy}}^{2}$ = 0.972, MAE = 3.670%, Fэксп. = 33.62, F(0.05, 2, 2) = = 19, Р = 0.029). Поскольку индекс корреляции Ixy равен 0.99, то это указывает на существование сильной связи между этими двумя параметрами.
ОБСУЖДЕНИЕ
В данном исследовании в клеточных линиях человека HEK293, HepG2, IMR32 и FetMSC, подвергшихся воздействию ксеноэстрогена БФА, оценивал-cя МИ, как основной показатель, характеризующий жизнеспособность организма. Многие авторы показали, что БФА вызывает нарушения клеточного цикла как в митозе, так и мейозе. Воздействие БФА, например, приводит к анеуплоидии и (или) усилению пролиферации в ER-негативной линии SHE (эмбриональные клетки сирийского хомячка), ER-позитивной линии MCF-7 (аденокарцинома молочных желез человека), а также в клетках HepG2 (карцинома печени человека), HT29 (аденокарцинома толстой кишки человека) и V79 (фибробласты легкого китайского хомячка) (Tsutsui et al., 1998; Xu et al., 2015). В клетках линий MCF-7, HEK293 и GC-2 (сперматоциты мыши) БФА вызывал повреждения ДНК и апоптоз. При этом он индуцировал повреждения ДНК преимущественно в ER-позитивной линии MCF-7, а не ER-негативной HEK293 (Havranek et al., 2013; Yin et al., 2014).
Авторы отмечают, что выявленные аномалии не всегда коррелировали с эстрогенностью БФА, и это во многом было обусловлено клеточным типом и дозой БФА. В одних случаях усиление пролиферативной активности было ассоциировано с классическими ядерными рецепторами к эстрогену ERα и ERβ (Ricupito et al., 2009; Xu et al., 2015), в других – с транс-мембранным рецептором эстрогена (G protein-coupled estrogen receptor 1 – GPR30, GPER), который, обладает большим сродством к БФА, чем ядерные ER, особенно при ответе на низкую дозу (Liu et al., 2015; Shen, Shi, 2016). Кроме того, было обнаружено, что БФА через GPR30 повышает экспрессию сцепленного с Х-хромосомой гена ингибитора апоптоза (XIAP), активация которого стимулирует синтез оксида азота (Liu et al., 2015). А активные формы кислорода и азота, как предполагается, являются модуляторами пролиферации клеток, остановки клеточного цикла и апоптоза (Li, 2016).
Следует отметить, что в Х-хромосоме локализован ген MAGE-B2, экспрессия которого усиливает пролиферацию опухолевых клеток p53-независимым путем (Peche et al., 2015). В Y-хромосоме также обнаружен локус (GBY) предрасположенности к раку – гонадобластоме (Quintana-Murci, Fellous, 2001) и четыре некодирующих Y-РНК (hY1, hY3, hY4 и hY5), важных для репликации ДНК и пролиферации клеток. Оказалось, что деградация РНК hY1 и hY3 в клеточных линиях человека приводит к значительному цитостатическому ингибированию пролиферации клеток (Christov et al., 2008). В связи с этим нельзя исключать возможного “пол-специфического” влияния БФА на пролиферативную активность клеток. В ряде работ уже было показано, что БФА способен изменять экспрессию генов (Chepelev et al., 2013; Yin et al., 2014; Liu et al., 2015; Xu et al., 2015), в том числе и генов, регулирующих клеточный цикл (Ptak et al., 2011).
В нашей работе выявлены изменения МИ в зависимости не только от дозы и продолжительности воздействия БФА, но и от клеточного типа (рис. 2). Так, в эпителиоподобных клетках HEK293 и HepG2 для большинства исследованных доз БФА наблюдали снижение, а в нейробластоподобных клетках IMR32, наоборот, повышение МИ по сравнению с контролем, тогда как в фибробластоподобных клетках FetMSC БФА не вызвал значимых изменений пролиферативной активности. При этом более чувствительными к воздействию БФА оказались именно опухолевые клетки HEK293, HepG2 и IMR32. В тоже время неиммортализованные мезенхимные стволовые клетки костного мозга FetMSC оказались устойчивы к воздействию исследованных доз БФА.
Рис. 2.
Обобщенная схема характера изменений митотической активности клеток человека 4-х линий разного происхождения после воздействия БФА в зависимости от типа и происхождения клеток. Стрелка вверх и вниз – соответственно снижение и увеличение митотического индекса (МИ). На схеме отмечено наличие (отсутствие) вариантов ядерных рецепторов эстрогенов (ER) в исследованных линиях клеток человека: рецепторы альфа (ERα) и бета (ERβ)
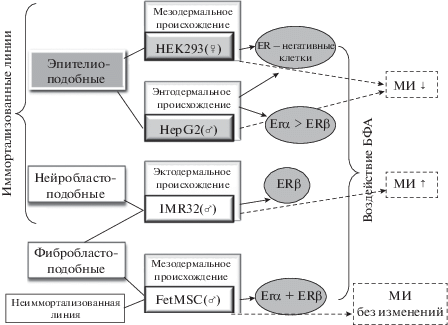
Следует отметить, что в нашем случае эмбриональное происхождение исследованных в работе линий клеток человека, скорее всего, не имело существенного влияния на изменение митотической активности после воздействия БФА. Так, снижение МИ наблюдали как в клетках HEK293 мезодермального происхождения, так и в HepG2 эндодермального происхождения, тогда как в FetMSC мезодермального происхождения БФА не повлиял на пролиферацию клеток, а в клетках IMR32 эктодермального происхождения БФА повышал МИ. По-видимому, в нашем случае и генотип клеток по половым хромосомам также не повлиял на изменение митотической активности после воздействия БФА.
Можно предположить, что изменения регуляции клеточной пролиферации в результате 48- и 72-часового воздействия БФА в клетках IMR32 происходили с вовлечением рецептора к эстрогенам ERβ и туморогенных белков, активно экспрессирующихся в ней (Su et al., 2012; Zaatiti et al., 2018) и (или) через активацию сигналов NF-κB/IL-6 (Xiong et al., 2017). А в клетках HEK293 и HepG2 снижение митотической активности могло происходить ER-независимым путем, например, через транс-мембранный рецептор эстрогена GPER (Liu et al., 2015) и (или) активацию сигнальных путей Nrf1/2-ARE (Chepelev et al., 2013), MAPK/ERK (Fremin et al., 2009), либо через протеинкиназы PKA, PKG (Bouskine et al., 2009), JNK, а также транскрипционные факторы CREB и р53 (Liu et al., 2013). Возможно, в клетках HepG2 и IMR32 исследованные в нашей работе дозы БФА повлияли на экспрессию глипикан-3 (GPC3) – гена-супрессора опухолевого роста, поскольку в клетках гепатомы и нейробластомы ранее была выявлена сверх-экспрессия GPC3 (Sung et al., 2003). В клетках IMR32 и HEK293 воздействие БФА могло повлиять на пролиферацию клеток также и через сигнальный путь Wnt/β-катенин (Reischmann et al., 2015; Tiwari et al., 2015).
Поскольку установлено, что именно через ERα-рецепторы регулируются многие гены клеточного цикла, то особого внимания заслуживают наши результаты для ER-позитивных клеток FetMSC, которые, теоретически, должны были “отреагировать” на воздействие БФА через ER-зависимый путь (Kim et al., 2017) или MAPK/ERK сигнальный путь (Strong et al., 2016). Но мы не выявили статистически значимых различий пролиферативной активности клеток после воздействия БФА по сравнению с контролем. Возможно, это было связано с особым экспрессионным профилем эмбриональных стволовых клеток FetMSC и существованием неких внутриклеточных (в том числе эпигенетических) защитных механизмов, которые отсутствуют в опухолевых клетках.
Результаты многолетних исследований указывают на то, что негативные эффекты БФА на живые организмы могут быть связаны с отклонениями в эпигенетической регуляции активности генов, причем различные клетки, ткани и органы часто различаются по своему эпигенетическому ответу на воздействие БФА. Так, влияние БФА на метилирование ДНК, модификации гистонов и компактизацию хроматина было выявлено в клетках нейробластомы человека SH-SY5Y (Senyildiz et al., 2017). На культурах клеток печени мыши Hepa1-6, трофобластных клеток человека BeWo выявили уменьшение уровня экспрессии ДНК-метилтрансфераз и гипометилирование генов, связанных с синтезом липидов (Wang et al., 2015; Ke et al., 2016).
Ранее мы обнаружили, что воздействие БФА влияет на метилирование ДНК и компактизацию хроматина сестринских хроматид в зависимости от происхождения и степени дифференцированности клеток (Patkin et al., 2015, 2017). На культурах клеток человека HEK293, HepG2, IMR32 и FetMSC было показано, что в зависимости от клеточного типа, дозы и продолжительности воздействия БФА изменяет уровень полногеномного метилирования ДНК и степень компактизации хроматина, при этом характер выявленной зависимости “доза–эффект” во всех четырех исследованных линиях был немонотонный (Suchkova et al., 2019). Немонотонная зависимость “доза−эффект”, выявленная нами для клеток линий HEK293, HepG2 и IMR32 после воздействия ВФА, также описана в литературе (Lagarde et al., 2015). Авторы делают вывод, что немонотонная зависимость обусловлена сложной природой ответной реакции организма на действие токсикантов, на которую одновременно влияют несколько параметров. Поскольку экспрессия генов, регулирующих клеточный цикл, модулируется эпигенетическими механизмами, которые могут нарушаться при действии БФА (Macaluso et al., 2005; Silva et al., 2012; Havranek et al., 2013; Fritz et al., 2019), то наблюдаемые нами изменения МИ в клетках HEK293, HepG2, IMR32, возможно, обусловлены эпигеномными изменениями, вызванными этим токсикантом.
Отдельно хочется обратить внимание и на результаты, полученные нами после воздействия растворителя БФА, а именно 0.02% ДМСО, где тоже был обнаружен специфичный для клетки ответ. Так, культивирование клеток в присутствии 0.02% ДМСО не повлияло на митотическую активность FetMSC и HepG2. Тогда как в клетках IMR32 через 48 ч действия наблюдали снижение, а через 72 ч, наоборот, повышение МИ. В тоже время в клетках HEK293 МИ повышался только после воздействия в течение 72 ч. Во многих работах проводили исследования влияния различных доз ДМСО на выживаемость и пролиферативную активность различных типов клеток. Было обнаружено, что высокие дозы ДМСО (более 0.1%) снижают жизнеспособность и пролиферацию клеток, а также синтез TNF-α, IFN-γ и IL-2 цитокинов (de Abreu Costa et al., 2017), тогда как низкие дозы (от 0.05 до 0.2%) могут повышать пролиферативную активность (Singh et al., 2017). В нашей работе использована доза меньшая, чем упомянуто в этих публикациях, и одинаковая для всех четырех клеточных линий человека, но при этом в одних клетках мы наблюдали изменение МИ (повышение либо снижение), тогда как в других нет. Эти результаты косвенно указывают на то, что в клетка-специфичном ответе на воздействие токсиканта значительная роль отводится не только генотипу клетки, но и ее эпигенотипу (эпигеномным модификациям).
ЗАКЛЮЧЕНИЕ
Результаты проведенного исследования показали, что в исследованных клеточных культурах человека БФА мог нарушить экспрессию генов, отвечающих за регуляцию клеточного цикла. Поскольку линия FetMSC по сравнению с HEK293, HepG2 и IMR32 оказалась более устойчивой к действию исследованных доз БФА по показателю митотической активности, это может говорить о существовании в эмбриональных стволовых клетках дополнительных (возможно, эпигеномных) защитных механизмов, участвующих в регуляции клеточного цикла, тогда как в клетках опухолевого происхождения такой механизм, по-видимому, нарушен или менее устойчив к действию ксеноэстрогенов. Выявленные немонотонные зависимости доза–ответ, связанные с воздействием БФА, указывают на необходимость проведения дополнительных исследований для того, чтобы понять сложные функциональные последствия БФА-ассоциированных эффектов на живые организмы.
Список литературы
Булатов В.В., Хохоев Т.Х., Дикий В.В., Заонегин С.В., Бабин В.Н. 2002. Проблема малых и сверхмалых доз в токсикологии. Фундаментальные и прикладные аспекты. Рос. хим. ж. (Ж. Рос. хим. общ-ва им. Д.И. Менделеева). XLVI (6) : 58–62. (Bulatov V.V., Khokhoyev T.KH., Dikiy V.V., Zaonegin S.V., Babin V.N. 2002. Problema malykh i sverkhmalykh doz v toksikologii. Fundamental’nyye i prikladnyye aspekty. Ros. khim. zh. (ZH. Ros. khim. obshch-va im. D.I. Mendeleyeva). XLVI (6): 58–62.)
Воскобойников Ю.Е. 2005. Эконометрика в EXCEL. Часть 1 (парный и множественный регрессионный анализ). Учеб. пособие. Новосибирск: НГАСУ (Сибстрин). 156 с. (Voskoboynikov Yu.Ye. 2005. Ekonometrika v EXCEL. Chast’ 1 (parnyy i mnozhestvennyy regressionnyy analiz). Ucheb. posobiye. Novosibirsk: NGASU (Sibstrin). 156 p.)
Гржибовский А.М. 2008а. Доверительные интервалы для частот и долей. Экология человека. 5 : 57–60. (Grzhibovskiy A.M. 2008a. Doveritel’nyye intervaly dlya chastot i doley. Ekologiya cheloveka. 5: 57–60.)
Гржибовский А.М. 2008б. Анализ номинальных данных (независимые наблюдения). Экология человека. 6 : 58–68. (Grzhibovskiy A.M. 2008b. Analiz nominal’nykh dannykh (nezavisimyye nablyudeniya). Ekologiya cheloveka. 6 : 58–68.)
Гржибовский А.М. 2008в. Корреляционный анализ. Экология человека. 9 : 50–60. (Grzhibovskiy A.M. 2008с. Korrelyatsionnyy analiz. Ekologiya cheloveka. 9 : 50–60.)
Еропкин М.Ю. 2004. Культуры клеток как модельная система в биохимико-токсикологических исследованиях. Автреф. ... докт. дис. СПб. 36 с. (Yeropkin M.Y. 2004. Kul’tury kletok kak model’naya sistema v biokhimiko-toksikologicheskikh issledovaniyakh: avtoref. Doctor Thesis. St. Petersburg. 36 p.)
Иванов А.В., Давлетова Н.Х., Тафеева Е.А. 2013. Анализ современных представлений о миграции полимерных веществ из упаковки в питьевую воду при хранении и влиянии их на живые организмы. Гигиена и санитария. 2 : 25–29. (Ivanov A.V., Davletova N.KH., Tafeyeva Ye.A. 2013. Analiz sovremennykh predstavleniy o migratsii polimernykh veshchestv iz upakovki v pit’yevuyu vodu pri khranenii i vliyanii ikh na zhivyye organizmy. Gigiyena i sanitariya. 2 : 25–29).
Паткин Е.Л., Павлинова Л.И., Софронов Г.А. 2013. Влияние экотоксикантов на эмбриогенез и гаметогенез млекопитающих: эпигенетические механизмы. Биосфера. 5(4) : 450–472. (Patkin E.L., Pavlinova L.I., Sofronov G.A. 2013. Vliyanie ekotoksikantov na embriogenez i gametogenez mlekopitayushchikh: epigeneticheskie mekhanizmy. Biosfera. 5(4) : 450–472.)
Паткин Е.Л., Софронов Г.А. 2015. Эколого-зависимые заболевания человека. Эпигенетические механизмы возникновения и наследования. Медицинский акад. журнал. 15(3) : 7–23. (Patkin E.L., Sofronov G.A. 2015. Ekologo-zavisimye zabolevaniya cheloveka. Epigeneticheskie mekhanizmy vozniknoveniya i nasledovaniya. Med. Akad. Zhurnal. 15(3) : 7–23.)
Полянская Г.Г., Сакута Г.А., Еропкин М.Ю., Смирнова Т.Д., Подчерняева Р.Я., Михайлова Г.Р., Дьяконов Л.П., Гальнбек Т.В., Глинских Н.П., Бахарев А.А. 2018. Российская коллекция клеточных культур позвоночных (РККК П). СПб: ИНЦ РАН. 155 с. (Polyanskaya G.G., Sakuta G.A., Yeropkin M.Y., Smirnova T.D., Podchernyayeva R.Y., Mikhaylova G.R., D’yakonov L.P., Gal’nbek T.V., Glinskikh N.P., Bakharev A.A. 2018. Rossiyskaya kollektsiya kletochnykh kul’tur pozvonochnykh (RKKK P). St. Petersburg. 155 s. (http://www.cytspb.rssi.ru/rkkk/katalog_rccc_v_2018_rus.pdf)
Прохорова И.М., Ковалева М.И., Фомичева А.Н. 2003. Оценка митотического и мутагенного действия факторов окружающей среды. Метод. указания. Ярославль: Гос. Ун-т. 32 с. (Prokhorova I.M., Kovaleva M.I., Fomicheva A.N. 2003. Otsenka mitoticheskogo i mutagennogo deystviya faktorov okruzhayushchey sredy: Metod. Ukazaniya. Yaroslavl’: Gos. Univeritet. 32 p.)
Репова М.Л. 2010. Эконометрика: метод, указания и задания к выполнению контрольной работы. Архангельск: Архангельский. гос. техничнеский. ун-т. 32 с. (Repova M.L. 2010. Ekonometrika: metod, ukazaniya i zadaniya k vypolneniyu kontrol’noy raboty. Arkhangel’sk: Arkhang. Gos. Tekhnicheskii Universitet. 32 p.)
Токин Б.П. 1987. Общая эмбриология. М.: Высшая. школа. 480 c. (Tokin B.P. 1987. Obshchaya embriologiya. M: Vysshaya. Shkola. 480 p.)
Bellavite P., Ortolani R., Pontarollo F., Pitari G., Conforti A. 2007. Immunology and homeopathy. 5. The rational of the “Simile”. Evid. Based Complement Alternat. Med. 4 : 149–163.
Bouskine A., Nebout M., Brücker-Davis F., Benahmed M., Fenichel P. 2009. Low doses of bisphenol A promote human seminoma cell proliferation by activating PKA and PKG via a membrane G-protein-coupled estrogen receptor. Environ. Health Perspect. 117 : 1053–1058.
Chepelev N.L., Enikanolaiye M.I., Chepelev L.L., Almohaisen A., Chen Q., Scoggan K.A., Coughlan M.C., Cao X.L., Jin X., Willmore W.G. 2013. Bisphenol A activates the Nrf1/2-antioxidant response element pathway in HEK 293 cells. Chem. Res. Toxicol. 26 : 498–506.
Christov C.P., Trivier E., Krude T. 2008. Noncoding human Y RNAs are overexpressed in tumours and required for cell proliferation. British J. Cancer. 98 : 981–988.
Corrales J., Kristofco L.A., Steele W.B., Yates B.S., Breed C.S., Williams E.S., Brooks B.W. 2015. Global assessment of bisphenol A in the environment: Review and analysis of its occurrence and bioaccumulation. Dose-Response. 13 : 1 559 325 815 598 308. https://doi.org/10.1177/1559325815598308
De Abreu Costa L., Henrique Fernandes Ottoni M., Dos Santos M.G., Meireles A.B., Gomes de Almeida V., de Fátima Pereira W., Alves de Avelar-Freitas B., Eustáquio Alvim Brito-Melo G. 2017. Dimethyl sulfoxide (DMSO) decreases cell proliferation and TNF-α, IFN-γ, and IL-2 cytokines production in cultures of peripheral blood lymphocytes. Molecules. 22. pii : E1789.
Fremin C., Bessard A., Ezan F., Gailhouste L., Regeard M., Le Seyec J., Gilot D., Pagès G., Pouysségur J., Langouët S., Baffet G. 2009. Multiple division cycles and long-term survival of hepatocytes are distinctly regulated by extracellular signal-regulated kinases ERK1 and ERK2. Hepatology. 49 : 930–939
Fritz A.J., Gillis N.E., Gerrard D.L., Rodriguez P.D., Hong D., Rose J.T., Ghule P.N., Bolf E.L., Gordon J.A., Tye C.E., Boyd J.R., Tracy K.M., Nickerson J.A., van Wijnen A.J., Imbalzano A.N., Heath J.L., Frietze S.E., Zaidi S.K., Carr F.E., Lian J.B., Stein J.L., Stein G.S. 2019. Higher order genomic organization and epigenetic control maintain cellular identity and prevent breast cancer. Genes Chromosomes Cancer. 58 : 484–499.
Havranek T., Macho L., Fickova M. 2013. Bisphenol-A modulates proliferation of human breast adenocarcinoma cells (MCF-7) by modulating apoptosis and cyclin-A. Endocrine Abstracts. 32 : 502.
Ke Z.H., Pan J.X., Jin L.Y., Xu H.Y., Yu T.T., Ullah K., Rahman T.U., Dong X.Y., Sheng J.Z., Huang H.F. 2016. Bisphenol A exposure may induce hepatic lipid accumulation via reprogramming the DNA methylation patterns of genes involved in lipid metabolism. Sci. Rep. 6 : 31331.
Kelly L.A., Seidlova-Wuttke D., Wuttke W., Leary J.J.O., Norris L.A. 2014. Estrogen receptor alpha augments changes in hemostatic gene expression in HepG2 cells treated with estradiol and phytoestrogens. Phytomed. 21 : 155–158.
Kim J.-Y., Choi H.-G., Lee H.-M., Lee G.-A., Hwang K.-A., Choi K.-C. 2017. Effects of bisphenol compounds on the growth and epithelial mesenchymal transition of MCF-7 CV human breast cancer cells. J. Biomed Res. 31 : 358–369.
Lagarde F., Beausoleil C., Belcher S.M., Belzunces L.P., Emond C., Guerbet M., Rousselle C. 2015. Non-monotonic dose-response relationships and endocrine disruptors: a qualitative method of assessment. Environ Health. 14 : 13.
Li P. 2016. In vitro evaluation of HepG2 cell proliferation altered by reactive oxygen and nitrogen species. J. Adenocarcinoma. 1 : 2–8.
Liu J., Jin X., Zhao N., Ye X., Ying C. 2015. Bisphenol A promotes X-linked inhibitor of apoptosis protein-dependent angiogenesis via G protein-coupled estrogen receptor pathway. J. Appl. Toxicol. 35 : 1309–1317.
Liu R., Xing L., Kong D., Jiang J., Shang L., Hao W. 2013. Bisphenol A inhibits proliferation and induces apoptosis in micromass cultures of rat embryonic midbrain cells through the JNK, CREB and p53 signaling pathways. Food Chem. Toxicol. 52 : 76–82.
Macaluso M., Montanari M., Cinti C., Giordano A. 2005. Modulation of cell cycle components by epigenetic and genetic events. Semin. Oncol. 32 : 452–457.
Patkin E.L., Grudinina N.A., Sasina L.K., Noniashvili E.M., Pavlinova L.I., Suchkova I.O., Kustova M.E., Sofronov G.A. 2015. DNA methylation differs between sister chromatids, and this difference correlates with the degree of differentiation potential. Mol. Reprod. Dev. 82 : 724–725.
Patkin E.L., Grudinina N.A., Sasina L.K., Noniashvili E.M., Pavlinova L.I., Suchkova I.O., Kustova M.E., Kolmakov N.N., Truong T.V., Sofronov G.A. 2017. Asymmetric DNA methylation between sister chromatids of metaphase chromosomes in mouse embryos upon bisphenol A action. Reprod. Toxicol. 74 : 1–9.
Peche L.Y, Ladelfa M.F., Toledo M.F., Mano M., Laiseca J.E., Schneider C., Monte M. 2015. Human MageB2 protein expression enhances E2F transcriptional activity, cell proliferation, and resistance to ribotoxic stress. J. Biol. Chem. 290 : 29652–29662.
Ptak A., Wrobel A., Gregoraszczuk E.L. 2011. Effect of bisphenol-A on the expression of selected genes involved in cell cycle and apoptosis in the OVCAR-3 cell line. Toxicol. Lett. 202 : 30–35.
Quintana-Murci L., Fellous M. 2001. The human Y chromosome: The biological role of a “functional wasteland”. J. Biomed. Biotechnol. 1 : 18–24.
Reischmann P., Fiebeck J., von der Weiden N., Müller O. 2015. Measured effects of wnt3a on proliferation of HEK293T cells depend on the applied assay. Int. J. Cell Biol. : 928502.
Ricupito A., Del Pozzo G., Diano N., Grano V., Portaccio M., Marino M., Bolli A., Galluzzo P., Bontempo P., Mita L., Altucci L., Mita D.G. 2009. Effect of bisphenol A with or without enzyme treatment on the proliferation and viability of MCF-7 cells. Environ. Int. 35 : 21–26.
Senyildiz M., Karaman E.F., Baş S.S., Pirincci P.A., Ozden S. 2017. Effects of BPA on global DNA methylation and global histone 3 lysine modifications in SH-SY5Y cells: An epigenetic mechanism linking the regulation of chromatin modifying genes. Toxicol. In Vitro. 44 : 313–321.
Shen M., Shi H. 2016. Estradiol and estrogen receptor agonists oppose oncogenic actions of leptin in HepG2 cells. PLoS One. 11 : e0151455.
Silva M.C.C., Bodor D.L., Stellfox M.E., Martins N.M.C., Hochegger H., Foltz D.R., Jansen L.E.T. 2012. Cdk activity couples epigenetic centromere inheritance to cell cycle progression. Dev. Cell. 22 : 52–63.
Singh M., McKenzie K., Ma X. 2017. Effect of dimethyl sulfoxide on in vitro proliferation of skin fibroblast cells. J. Biotech Res. 8 : 78–82.
Strong A.L., Miller D.F.B., Buechlein A.M., Fang F., Glowacki J. McLachlan J.A., Nephew K.P., Burow M.E., Bunnell B.A. 2016. Bisphenol A alters the self-renewal and differentiation capacity of human bone-marrow-derived mesenchymal stem cells. Endocrine Disruptors. 4 : e1200344.
Su C., Rybalchenko N., Schreihofer D.A., Singh M., Abbassi B., Cunningham R.L. 2012. Cell models for the study of sex steroid hormone neurobiology. J. Steroids Horm. Sci. S2 : pii 003.
Suchkova I.O., Sasina L.K., Dergacheva N.I., Sofronov G.A., Patkin E.L. 2019. The influence of low dose Bisphenol A on whole genome DNA methylation and chromatin compaction in different human cell lines. Toxicol. In Vitro. 58 : 26–34.
Sung Y.K., Hwang S.Y., Faroog M., Kim J.C., Kim M.K. 2003. Growth promotion of HepG2 hepatoma cells by antisensemediated knockdown of glypican-3 is independent of insulin-like growth factor 2 signaling. Exp. Mol. Med. 35 : 257–262.
Tiwari S.K., Agarwal S., Seth B., Yadav A., Ray R.S., Mishra V.N., Chaturvedi R.K. 2015. Inhibitory effects of bisphenol-A on neural stem cells proliferation and differentiation in the rat brain are dependent on Wnt/β-catenin pathway. Mol. Neurobiol. 52 : 1735–1757.
Tsutsui T., Tamura Y., Yagi E., Hasegawa K., Takahashi M., Maizumi N., Yamaguchi F., Barrett J.C. 1998. Bisphenol-A induces cellular transformation, aneuploidy and DNA adduct formation in cultured Syrian hamster embryo cells. Int. J. Cancer. 75 : 290–294.
Vom Saal F.S., Akingbemi B.T., Belcher S.M., Birnbaum L.S., Crain D.A., Eriksen M., Farabollini F., Guillette L.J.Jr, Hauser R., Heindel J.J., Ho S.M., Hunt P.A., Iguchi T., Jobling S., Kanno J., Keri R.A., Knudsen K.E., Laufer H., LeBlanc G.A., Marcus M., McLachlan J.A., Myers J.P., Nadal A., Newbold R.R., Olea N., Prins G.S., Richter C.A., Rubin B.S., Sonnenschein C., Soto A.M., Talsness C.E., Vandenbergh J.G., Vandenberg L.N., Walser-Kuntz D.R., Watson C.S., Welshons W.V., Wetherill Y., Zoeller R.T. 2007. Chapel Hill bisphenol A expert panel consensus statement: Integration of mechanisms, effects in animals and potential to impact human health at current levels of exposure. Reprod. Toxicol. 24 : 131–138.
Wang Z.Y., Lu J., Zhang Y.Z., Zhang M., Liu T., Qu X.L. 2015. Effect of bisphenol A on invasion ability of human trophoblastic cell line BeWo. Int. J. Clin. Exp. Pathol. 8 : 14 355–14 364.
Xiong S., Wang Y., Li H., Zhang X. 2017. Low dose of bisphenol A activates NF-κB/IL-6 signals to increase malignancy of neuroblastoma cells. Cell Mol. Neurobiol. 37 : 1095–1103.
Xu B.L., Zhao Q.Z., Gao X.Y., Hou G.J. 2015. Effect of estradiol and bisphenol A on human hepatoblastoma cell viability and telomerase activity. Braz. J. Med. Biol. Res. 48 : 1004–1009.
Yin R., Gu L., Li M., Jiang C., Cao T., Zhang X. 2014. Gene expression profiling analysis of bisphenol A-induced perturbation in biological processes in ER negative HEK293 cells. PLoS One. 9 : e98635.
Zaatiti H., Abdallah J., Nasr Z., Khazen G., Sandler A., Abou-Antoun T.J. 2018. Tumorigenic proteins upregulated in the MYCN-amplified IMR-32 human neuroblastoma cells promote proliferation and migration. Int. J. Oncol. 52 : 787–803.
Дополнительные материалы отсутствуют.


