Цитология, 2019, T. 61, № 10, стр. 797-805
Реактивные изменения эндокринных клеток эпителия слизистой оболочки кишки при введении мелатонина или доксиламина сукцината (электронно-микроскопическое исследование)
М. Л. Чуркова *
Северо-Западный государственный медицинский университет им. И.И. Мечникова
195067 Санкт-Петербург, Россия
* E-mail: mariya.churkova@szgmu.ru
Поступила в редакцию 03.06.2019
После доработки 11.06.2019
Принята к публикации 20.06.2019
Аннотация
С помощью метода электронной микроскопии исследовано строение эндокриноцитов эпителия слизистой оболочки двенадцатиперстной, ободочной и прямой кишки крыс линии Wistar после ежедневного введении на протяжении 1 мес. мелатонина или доксиламина сукцината. Показано, что через 1 сут после последнего введения изучаемых веществ в эндокринных клетках наблюдаются морфологические признаки усиления их функциональной активности, которое нередко сопровождается явлениями внутриклеточной регенерации. В первую очередь подвергаются изменениям митохондрии эндокриноцитов. Кроме того, в эпителии кишки крыс, подвергавшихся экспериментальному воздействию, было отмечено большое количество малодифференцированных эндокринных клеток, что свидетельствует об активации камбиальных элементов эпителия. Во всех исследованных случаях наиболее часто в эпителии встречались D1‑клетки, по сравнению с другими типами эндокриноцитов.
Популярными сомнологическими лекарственными средствами являются гормон мелатонин (препарат “Мелаксен”) (Hack et al., 2003; Lemoine, Zisapel 2012) и доксиламин сукцинат – блокатор Н-1-гистаминовых рецепторов (препарат “Донормил”) (Vande Griend, Anderson, 2003; Левин, 2008). Также мелатонин используется при лечении заболеваний органов пищеварения (Konturek et al., 2011; Ермаченков и др., 2012). Было показано, что мелатонин и доксиламин сукцинат могут приводить к возникновению нарушений в работе пищеварительной системы (тошнота, рвота, диарея, копростаз) (Hausser-Hauw et al, 1995; Hack et al., 2003; Videla et al., 2013). Функционирование органов пищеварения тесным образом связано с активностью эндокринных клеток эпителия слизистой оболочки кишки и регулируется гормонами, продуцируемыми данными клетками. Нарушения, наблюдаемые у пациентов, принимавших мелатонин или доксиламин сукцинат перорально, возможно, связаны с изменением эндокриноцитов эпителия слизистой оболочки пищеварительной системы, в частности тонкой и толстой кишки. Однако какие-либо данные по этому вопросу в опубликованных к настоящему времени работах отсутствуют.
Целью настоящей работы являлось исследование реактивных изменений в эндокринных клетках эпителия слизистой оболочки двенадцатиперстной, ободочной и прямой кишки крыс при ведении мелатонина и доксиламина сукцината.
МАТЕРИАЛ И МЕТОДИКА
Исследовали образцы слизистой оболочки двенадцатиперстной, ободочной, прямой кишки 20 крыс-самцов линии Wistar. Всего было поставлено 2 серии экспериментов (по 5 крыс в каждой экспериментальной группе и по 5 крыс в каждой соответствующей контрольной группе).
Животным из экспериментальных групп в течение 1 мес. ежедневно внутрижелудочно вводили с помощью зонда растворы мелатонина (первая серия экспериментов) или доксиламина сукцината (вторая серия экспериментов). Мелатонин вводили в дозе 0.5 мг/кг веса животного (по 0.83 мл раствора мелатонина на средний вес животного 500 мг). В данной серии экспериментов использовали препарат “Мелаксен” (UNIPHARM Inc., США): 1 таблетку, содержащую 3 мг мелатонина, растворяли в 10 мл физиологического раствора. Доксиламин сукцинат вводили в дозе 13 мг/кг веса животного (по 0.97 мл раствора доксиламина сукцината на средний вес животного 500 мг). В данной серии экспериментов использовали препарат “Донормил” (UPSA, SAS, Франция): 1 таблетку, содержащую 15 мг доксиламина сукцината, растворяли в 10 мл физиологического раствора. В контрольных группах крысам вводили физиологический раствор в соответствующем объеме.
На следующие сутки после последнего введения мелатонина или доксиламина сукцината (32 день от начала эксперимента) проводили эвтаназию, в соответствии с европейской директивой 2010/63: крыс ингаляционно усыпляли раствором фторотана (0.5%), а затем осуществляли декапитацию. Протоколы экспериментов утверждены локальным этическим комитетом ФГБОУ ВО СЗГМУ им И.И. Мечникова Минздрава России (Протокол № 3 от 14.03.2018).
Образцы кишки фиксировали в 2.5%-ном глутаральдегиде на фосфатном буфере (рН 7.4) (Sigma-Aldrich, Швейцария) в течение 2 ч при 4°С, промывали в 0.01 М фосфатном буфере (3 раза по 30 минут), дофиксировали 1%-ной четырехокисью осмия по протоколу Колфильда (pH фиксатора 7.4, время фиксации – 1 ч при комнатной температуре) и заливали в аралдит М (Fluka, Швейцария) (1 сут – при 37°С, 3 сут – при 56°С).
Ультратонкие серийные срезы (40–60 нм), полученные с помощью ультрамикротома LKB III (BROMMA, Швеция), контрастировали цитратом свинца по Рейнольдсу, приготовленного из азотнокислого свинца (II) (ЛенРеактив, Россия), и уранилацетатом (ГРАНХИМ, Россия), и изучали в электронном микроскопе JEM-100 S (JEOL, Япония).
Морфометрический анализ размера (диаметр) секреторных гранул эндокринных клеток проводили на электронномикроскопических фотографиях, при увеличении 20 000× и 28 000×. Тип эндокринных клеток определяли по размеру, форме и строению секреторных гранул на основе международной классификации эндокринных клеток (Solcia et al., 1981). Проводили оценку и сравнение размера (диаметр) секреторных гранул у крыс из экспериментальных и контрольных групп. Статистическую обработку полученных данных проводили с помощью Statistica 10 (StatSoftInc.); для оценки достоверности различий между группами использовали критерий Манна–Уитни (p < 0.05).
РЕЗУЛЬТАТЫ
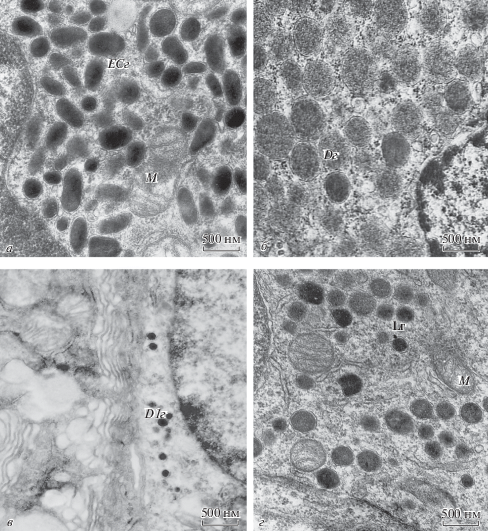
Эндокринная часть эпителия слизистой оболочки двенадцатиперстной, ободочной и прямой кишки представлена в основном следующими типами эндокриноцитов: EC-клетки, синтезирующие серотонин и мелатонин; L-клетки – кишечный глюкагон; D-клетки – соматостатин и D1-клетки – вазоактивный интестинальный пептид. Другие типы эндокринных клеток встречались крайне редко. У контрольных животных эндокриноциты имели типичное строение, описанное ранее (Solcia et al., 1981). В EC-клетках (рис. 1а) эндокринные гранулы (диаметр 130 ± 5 нм) имели неправильную форму и содержали электронноплотный секреторный материал, окруженный плотно прилежащей к нему мембраной, которая прослеживалась не на всем ее протяжении. D-клетки (рис. 1б) содержали крупные, округлой формы секреторные гранулы (диаметр 202 ± ± 10 нм). Секреторный материал гранул – электронноплотный, мелко гранулированный, окруженный плотно прилежащей к нему мембраной. D1-клетки содержали самые мелкие (диаметр 109 ± 11 нм) эндокринные гранулы овальной формы и мелко гранулированный секреторный материал, окруженный прерывистой мембраной, отделенной от него на значительное расстояние (рис. 1в). Гранулы L-клеток (диаметр 168 ± 7 нм) – круглой формы электронноплотные, секреторный материал окружен мембраной, отделенной от него узким светлым промежутком (рис. 1г). В эндокриноцитах животных из контрольных групп секреторные гранулы занимают значительный объем цитоплазмы. Другие органеллы (митохондрии, гранулярная эндоплазматическая сеть, полисомы, комплекс Гольджи) немногочисленны и локализованы одиночно между гранулами.
Рис. 1.
Секреторные гранулы в эндокринных клетках эпителия слизистой оболочки двенадцатиперстной кишки контрольных животных. а – ЕС-клетки, б – D-клетки, в – D1-клетки, г – L-клетки. Dг – секреторная гранула D-клетки, D1г – секреторная гранула D1-клетки, ЕСг – секреторная гранула ЕС-клетки, Lг – секреторная гранула L-клетки, М – митохондрия.
В составе эпителия кишки крыс из экспериментальных групп эндокринные клетки встречались редко и располагались одиночно среди экзокриноцитов, соединяясь с ними при помощи десмосом. Ультраструктура разных типов эндокринных клеток во всех исследованных отделах кишки (введение мелатонина или доксиламина сукцината) характеризовалась сходными изменениями, которые различались степенью выраженности. Размеры секреторных гранул, содержащихся в цитоплазме разных типов эндокриноцитов животных из экспериментальных и контрольных групп, были сопоставимы. На функциональную активность эндокринных клеток, развитие в них процессов регенерации или деструкции у животных, подвергавшихся экспериментальным воздействиям, указывает уменьшение количества секреторных гранул, изменение количества полисом, митохондрий, цистерн гранулярной эндоплазматической сети, появление значительных просветленных участков цитоплазмы. Отсутствие каких-либо отличий ультраструктуры эндокриноцитов животных из экспериментальных групп по сравнению с контролем свидетельствует о нахождении клеток в состоянии покоя.
При введении мелатонина или доксиламина сукцината в некоторых эндокриноцитах цитоплазма была заполнена многочисленными секреторными гранулами, в которых окружающая их мембрана отделена от секреторного материала светлым промежутком. Митохондрии, гранулярная эндоплазматическая сеть, полисомы были немногочисленны, без выраженных изменений, и располагались между гранулами. В цитоплазме были видны пучки тонофиламентов (показано на рис. 2а, на примере EC-клетки). Ядра клеток имели овальную форму с ровными контурами и содержали узкий ободок гетерохроматина вблизи ядерной оболочки, а также в виде небольших скоплений в его средней части.
Рис. 2.
Эндокринные клетки эпителия слизистой оболочки ободочной (а), прямой (б), двенадцатиперстной (в, г) кишки после ежедневного введения в течение месяца мелатонина (а–в) или доксиламина сукцината (г). а – ЕС-клетка; б, г – L-клетка; в – эндокриноцит, обращает на себя внимание расширение гранулярной ЭПС. Д – десмосома, Т – тонофиламенты, ЕСг – секреторная гранула ЕС-клетки, Lг – секреторная гранула L-клетки, ГЭС – гранулярная эндоплазматическая сеть, М – митохондрия, СГ – секреторная гранула, Я – ядро.
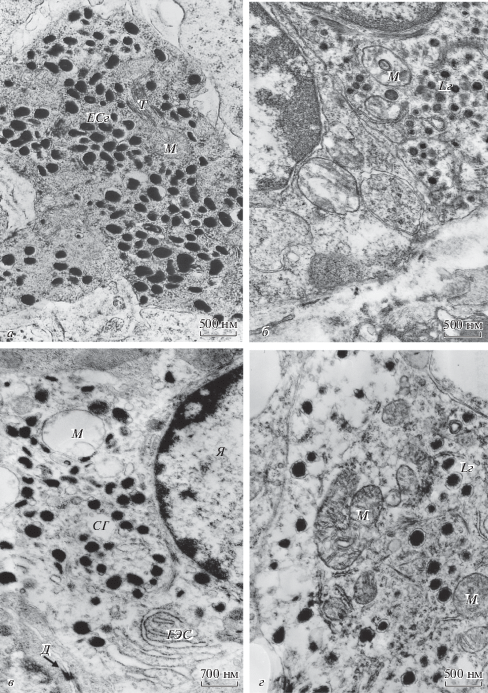
В других эндокринных клетках (показано на рис. 2б, на примере L-клетки) секреторные гранулы также занимают большую часть цитоплазмы. В клетках отмечены немногочисленные митохондрии с выраженными признаками набухания, измененными кристами (уменьшенными в количестве, фрагментированными), часто с миелиноподобными структурами. Данные изменения в митохондриях свидетельствуют о начальном этапе развития в них деструктивных изменений. Цистерны гранулярной эндоплазматической сети узкие, без изменений. Тонофиламенты в цитоплазме эндокриноцитов были единичны. Ядра клеток без изменений по сравнению с контролем.
В большинстве эндокринных клеток наблюдали визуальное уменьшение содержания в цитоплазме секреторных гранул (рис. 2в, 2г). Между гранулами располагались набухшие митохондрии с редуцированными или единичными кристами (при введении доксиламина сукцината более часто в отдельных митохондриях кристы не прослеживались). В строении гранулярной эндоплазматической сети были отмечены изменения разной степени выраженности (чаще при введении мелатонина): наблюдали визуальное расширение цистерн и увеличение площади поверхности органелл, при неравномерном распределении связанных с ее мембраной рибосом (рис. 2в).
Преимущественно при введении доксиламина сукцината встречались эндокринные клетки, в которых значительные участки цитоплазмы были сильно разрежены и содержали только единичные секреторные гранулы (рис. 2г). Уменьшение содержания в цитоплазме клеток эндокринных гранул, строение митохондрий и гранулярной цитоплазматической сети, наряду с выявлением единичных полисом свидетельствуют о нахождении клеток в состоянии повышенной функциональной активности.
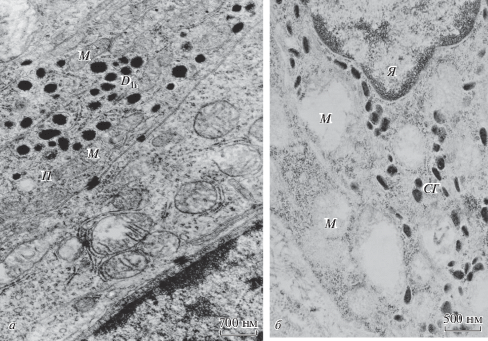
В обеих сериях экспериментов из всех исследованных типов эндокриноцитов наиболее часто встречались D1-клетки. Данные клетки находились в состоянии повышенной функциональной активности. Кроме того, в эпителии довольно часто были обнаружены эндокриноциты, значительная часть цитоплазмы которых при сниженном содержании секреторных гранул была заполнена митохондриями с хорошо развитыми поперечно ориентированными кристами, узкими цистернами гранулярной эндоплазматической сети, полисомами (рис. 3а). Иногда эндокринные клетки образовывали группы (скопления клеток), соединенных десмосомами. Эти клетки содержали единичные гранулы, многочисленные полисомы и набухшие митохондрии. Подобное строение и групповое распределение эндокриноцитов свидетельствует об образовании их из камбиальных клеток. Особенностью ультраструктуры эндокриноцитов после введения доксиламина сукцината (рис. 3б) являлась относительно более высокая частота выявления деструктивных изменений в митохондриях. В результате набухания размер этих органелл резко увеличен, единичные кристы едва просматриваются, наружные мембраны не выявляются.
Рис. 3.
Дифференцированные эндокриноциты в эпителии слизистой оболочки двенадцатиперстной (а) и ободочной (б) кишки после введения мелатонина (а) и доксиламина сукцината (б). D1г – секреторная гранула D1-клетки, СГ − секреторная гранула, М – митохондрия, П – полисомы.
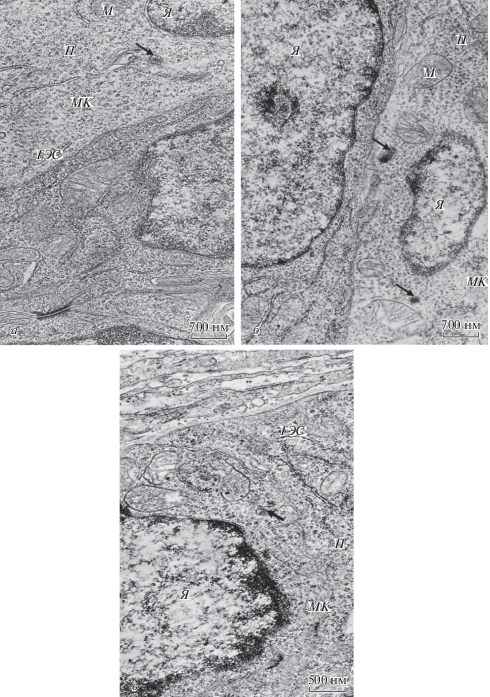
При введении мелатонина или доксиламина сукцината в эпителии слизистой оболочки всех отделов кишки выявлялись камбиальные клетки. В цитоплазме данных клеток основными структурами были многочисленные полисомы, среди которых располагались овальные, мелкие митохондрии с хорошо развитыми, правильно ориентированными кристами. Кроме того в эпителии были обнаружены многочисленные малодифференцированные эндокриноциты, которые нередко располагались группами. В данных клетках ядра с неровными контурами занимали значительную часть цитоплазмы и содержали равномерно распределенный хроматин с узкой полоской гетерохроматина вблизи ядерной оболочки. В некоторых малодифференцированных клетках (рис. 4а–4в) наблюдали единичные или небольшие группы эндокринных гранул, тип которых на данной стадии дифференцировки трудно установить. В отдельных подобных эндокриноцитах митохондрии находились в состоянии набухания.
Рис. 4.
Малодифференцированные клетки (МК), образующие эндокринные гранулы (стрелки), в эпителии слизистой оболочки двенадцатиперстной (а, б) и ободочной (в) кишки после введения мелатонина (а, б) или доксиламина сукцината (в). Обозначения см. рис. 1–3.
ОБСУЖДЕНИЕ
Изучение реактивных изменений в эндокринных клетках эпителия слизистой оболочки кишки крыс при воздействии доксиламина сукцината или мелатонина проводили после введения этих лекарственных сомнологических препаратов в терапевтических дозах – промежуточных между используемыми в клинической практике для лечения ребенка и взрослого человека (Левин, 2008; Lemoine, Zisapel, 2012; Толмачева, 2019). Выбор дозы был обусловлен тем, что, как предполагается, эффект доксиламина гидрогенсукцината на организм пропорционален терапевтическому диапазону дозы 12.5–25 мг (Videla et al., 2013), а также тем, что в зависимости от дозы мелатонин по-разному влияет на моторику двенадцатиперстной кишки, стимулируя или замедляя транзит химуса (Drago et al., 2002; Sommansson et al., 2013).
В результате проведенного электронно-микроскопического изучения эпителия слизистой оболочки изучаемых отделов кишки, было установлено, что после введения мелатонина или доксиламина сукцината в большей части эндокриноцитов наблюдались изменения: в строении митохондрий, гранулярной эндоплазматической сети, уменьшение содержания в цитоплазме секреторных гранул. Отмеченные в эндокриноцитах животных из экспериментальных групп набухание митохондрий, расширение цистерн гранулярной эндоплазматической сети, появление большего числа полисом являются “ответом” клеток на экспериментальное воздействие (мелатонина или доксиламина сукцината). Подобные ультраструктурные преобразования описаны ранее в эпителии слепой кишки при экспериментальном эшерихиозе (Бархина и др., 1992), в эпителии двенадцатиперстной кишки крыс при воздействии фторорганических соединений (Пузырев и др., 1997), в эпителии двенадцатиперстной и прямой кишки крыс при голодании (Иванова и др., 2009) и рассматриваются как морфологические признаки внутриклеточных регенераторных процессов (Иванова, 2013).
Дистрофические изменения разной степени выраженности, которые были чаще обнаружены при введении доксиламина сукцината, вначале появлялись в митохондриях эндокриноцитов и сопровождались не только просветлением матрикса, дезорганизацией крист, но и их разрушением. Подобное строение митохондрий в клетках эпителия ободочной кишки было описано при экспериментальном введении адъюванта Фрейнда (убитые туберкулезные микобактерии, суспензированные в масляно-водной эмульсии, моделирование артрита) (Каладзе, 2013). Выраженные ультраструктурные изменения эндокриноцитов при введении доксиламина сукцината у крыс можно расценивать как морфологические основания возможного нарушения работы пищеварительной системы у животных. По-видимому, обнаруженные нами различия в изменении ультраструктуры эндокриноцитов в разных сериях экспериментов (с введением мелатонина – гормона или доксиламина сукцината – блокатора гистаминовых рецепторов) (табл. 1) связаны с тем, что вводимые вещества имеют разный механизм действия.
Таблица 1.
Сравнение изменений ультраструктуры эндокриноцитов после введения мелатонина или доксиламина сукцината
| Наблюдаемые изменения | Введение мелатонина | Введение доксиламина сукцината |
|---|---|---|
| Уменьшение числа митохондрий | + | + |
| Набухание митохондрий | + | + |
| Фрагментирование крист митохондрий и уменьшение их количества | + | +++ |
| Просветление матрикса митохондрий | + | + |
| Уменьшение числа секреторных гранул | + | ++ |
| Расширение цистерн гранулярной эндоплазматической сети, увеличение площади поверхности, неравномерное распределение связанных с ее мембраной рибосом | ++ | + |
| Появление значительных просветленных участков в цитоплазме клеток | – | + |
| Уменьшение содержания полисом | + | + |
Кроме измененных дифференцированных эндокриноцитов в эпителии слизистой оболочки изучаемых отделов кишки были обнаружены многочисленные малодифференцированные клетки. Возможно, причины, повлиявшие на развитие реактивных изменений в строении эндокринных клеток при введении мелатонина или доксиламина сукцината, способствовали активации “ниши стволовых клеток” крипт кишки (Нимирицкий, 2018). Активация клеток “ниши”, в свою очередь, приводила к появлению в эпителии большого числа малодифференцированных клеток. Малодифференцированные эндокринные клетки с многочисленными полисомами при сниженном содержании других органелл были описаны ранее в эпителии органов пищеварения при голодании (Иванова и др., 2009). Появление этих клеток свидетельствует о развитии в ткани регенераторных процессов в ответ на введение мелатонина или доксиламина сукцината.
Таким образом, после ежедневного введения в течение месяца крысам мелатонина или доксиламина сукцината в эндокринных клетках эпителия слизистой оболочки кишки имело место повышение функциональной активности, которое в некоторых случаях приводило к развитию в них деструктивных изменений. В первую очередь на вводимые вещества реагировали митохондрии. Более выраженные реактивные изменения в строении эндокриноцитов всех изучаемых отделов кишки наблюдали при воздействии доксиламина сукцината.
Список литературы
Бархина Т.Г., Али-Риза А.Е., Пархоменко Ю.Г. 1992. Ультраструктурные особенности эндокринных клеток нормальной слепой кишки мыши и при экспериментальном эшерихиозе. Бюлл. эксп. биол. и мед. 114(10) : 429–432. (Barkhina T.G., Ali–Riza A.E., Parkhomenko Iu.G. 1992. The ultrastructural characteristics of the endocrine cells of the normal murine cecum and in experimental escherichiosis. Biull. Eksp. Biol. Med. 114(10) : 429–432.)
Ермаченков М.Н., Гуляев А.В., Анисимов В.Н. 2012. Мелатонин и рак толстой кишки: повышение эффективности стандартного лечения. Вестник Северо-Западного государственного медицинского университета им. И.И. Мечникова. 4(1) : 78–83 (Ermachenkov M.N., Guliaev A.V., Anisimov V.N. 2012. Melatonin and colorectal cancer: the rise of standart treatment efficacy. Herald of the Northwestern State Medical University named after I.I. Mechnikov. 4 (3) : 78–83.)
Иванова В.Ф. 2013. Регенерация эндокринной гастроэнтеропанкреатической системы при экспериментальной и клинической патологии: становление концепции и современные проблемы. Морфология. 144(6) : 73–84. (Ivanova V.F. 2013. Regeneration of endocrine gastroenteropancreatic system in experimental and clinical pathology: concept development and current problems. Morfologiia. 144(6) : 73–84.)
Иванова В.Ф., Пузырев А.А., Костюкевич С.В., Драй Р.В. 2009. Структурные изменения в стенке кишки крыс при голодании. Морфология. 2009. 136(6) : 62–68. (Ivanova V.F., Puzyriov A.A., Kostiukevitch S.V., Drai R.V. 2009. Structural changes in rat intestinal wall during starvation. Morfologiia. 136(6) : 62–68.)
Каладзе Н.Н., Филоненко Т.Г., Сизова О.А. 2013. Особенности ультраструктурных изменений слизистой толстого кишечника при экспериментальном моделировании адъювантного артрита. Здоровье ребенка. 44(1) : 18–21. (Kaladze N.N., Filonenko T.G., Sizova O.A. 2013. Features of ultrastructural changes in colonic mucosa in experimental modeling of adjuvant arthritis. The Child Health. 44 (1) : 18–21.)
Левин Я.И. 2008. Радости и печали сна. Российский медицинский журнал. 16 (30) : 27–31. (Levin Ya.I. 2008. Joy and sadness of sleep. Russ. Med. J. 16(30) : 27–31.)
Нимирицкий Π.П., Сагарадзе Г.Д., Ефименко А.Ю., Макаревич П.И., Ткачук В.А. 2018. Ниша стволовой клетки. Цитология. 60(8) : 575–586. (Nimiritsky P.P., Sagaradze G.D., Efimenko A.Yu., Makarevich P.I., Tkachuk V.A. 2018. The stem cell niche. Tsitologiya. 60(8) : 575–586.)
Пузырев А.А., Иванова В.Ф., Маймулов В.Г. 1997. Адаптация организма к действию экологических факторов на клеточном и субклеточном уровнях. Морфология. 1997. 112 (4) : 23–28. (Puzyrev A.A., Ivanova V.F., Maymulov V.G. 1997. Adaptation of the organism to the action of environmental factors at the cellular and subcellular levels. Morphologiia. 112(4) : 23–28.)
Толмачева Е.А. (ред.). 2019. Справочник Видаль. Лекарственные препараты в России. Видаль Рус. 1200 c. (Tolmatscheva E.A. 2019. The Vidal Directory. Medicinal products in Russia. Vidal Rus. 1200 p.)
Drago F., Macauda S., Salehi S. 2002. Small doses of melatonin increase intestinal motility in rats. Dig. Dis. Sci. 47 : 1969–1974.
Hack L.M., Lockley S.W., Arendt J., Skene D.J. 2003.The effects of low-dose 0.5-mg melatonin on the free-running circadian rhythms of blind subjects. J. Biol. Rhythms. 18 : 420–429.
Hausser Hauw C., Fleury B., Scheck F., Pello J.Y., Lebeau B. 1995. Effect on sleep architecture and residual effect of a dose of 15 mg of Doxylamine in healthy volunteers. Sep. Hop. Paris. 71 : 742–750.
Konturek P.C., Brzozowski T., Konturek S.J. 2011. Stress and the gut: Pathophysiology, clinical consequences, diagnostic approach and treatment options. J. Physiol. Pharmacol. 62 : 591–599.
Lemoine P., Zisapel N. 2012. Prolonged-release formulation of melatonin (Circadin) for the treatment of insomnia. Expert. Opin. Pharmacother. 13 : 895–905.
Solcia E., Capella C., Buffa R., Usellini L., Fiocca R., Frigerio B., Tenti P., Sessa F. 1981. The diffuse endocrine-paracrine system of the gut in health and disease: Ultrastructural features. Scand. J. Gastroenterol Suppl. 70 : 25–36.
Sommansson A., Nylander O., Sjöblom M. 2013. Melatonin decreases duodenal epithelial paracellular permeability via a nicotinic receptor-dependent pathway in rats in vivo. J. Pineal Res. 54 : 282–291.
Vande Griend J.P., Anderson S.L. 2012. Histamine-1 receptor antagonism for treatment of insomnia. J. Am. Pharm. Assoc. (2003). 52 : 210–219.
Videla S., Cebrecos J., Lahjou M., Wagner F., Guibord P., Xu Z., Cabot A., Encabo M., Encina G., Sicard E., Sans A. 2013. Pharmacokinetic dose proportionality between two strengths (12.5 mg and 25 mg) of Doxylamine hydrogen succinate film-coated tablets in fasting state: A single-dose, randomized, two-period crossover study in healthy volunteers. Drugs R D. 13 : 129–135.
Дополнительные материалы отсутствуют.


