Цитология, 2019, T. 61, № 10, стр. 817-822
Влияние предсердного натрийуретического пептида на реорганизацию актинового цитоскелета и миграцию мезенхимных стволовых клеток человека
А. В. Ревитцер 1, *, В. И. Чубинский-Надеждин 1, Ю. А. Негуляев 1, 2
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Санкт-Петербургский политехнический университет Петра Великого
195251 Санкт-Петербург, Россия
* E-mail: eetytnet@gmail.com
Поступила в редакцию 20.06.2019
После доработки 16.07.2019
Принята к публикации 18.07.2019
Аннотация
Предсердный натрийуретический пептид (ANP) принимает участие в регуляции многих процессов в организме, в том числе он способен оказывать влияние на механозависимые функции и актиновый цитоскелет различных клеток. В настоящее время активно изучается действие ANP на эндотелиальные клетки человека, но мало изучено его влияние на характеристики мезенхимных стволовых клеток (МСК). Культивирование МСК в присутствии различных биологически активных веществ имеет огромное значение для регенеративной медицины, так как эти вещества способны влиять на свойства клеток, улучшая результаты терапии. Ранее показаны изменения миграционного потенциала МСК, выделенных из периренального жира крысы, с помощью культивирования в присутствии ANP. В настоящей работе исследовали влияние ANP на актиновые структуры и миграцию МСК, полученных из костного мозга 5–6-недельного эмбриона человека (линия FetMSC). Мы показали в этих клетках экспрессию рецепторов А и С типа, связывающих ANP. Кроме того, обнаружили, что культивирование в присутствии низких концентраций ANP (10 нМ) в течение 24 ч перед экспериментом вызывают сборку актинового цитоскелета и замедление движения клеток FetMSC, оцененное методом зарастания раны. При высокой концентрации ANP (1000 нМ) мы не наблюдали изменений цитоскелета и клеточной подвижности по сравнению с контролем. Таким образом, культивирование в присутствии ANP способно вызывать реорганизацию актинового цитоскелета и влиять на миграционный потенциал МСК.
Предсердный натрийуретический пептид (ANP, atrial natriuretic peptide) является частью системы натрийуретических пептидов, включающей в себя три пептида и три рецептора (Daniels, Maisel, 2007). Пептиды системы натрийуретических пептидов включают ANP, мозговой натрийуретический пептид и пептид С-типа. Рецепторы системы натрийуретических пептидов типа А (NPRA) и В спарены с G-белками, их активация приводит к синтезу вторичного посредника цГМФ. При связывании пептида с рецептором С-типа (NPRC) комплекс пептид−рецептор направляется на деградацию. ANP имеет наибольшее сродство к рецепторам А- и C-типа (Daniels, Maisel, 2007). У человека ANP секретируется в клетках предсердия и, в небольших количествах, в сосудистых эпителиальных клетках по всему организму (Potter et al., 2006). ANP регулирует кровяное давление и водно-солевой обмен в организме, расширяя артерии, усиливая экскрецию натрия в почках и замедляя сердцебиение (Boldt, Suttner, 2006). Рецепторы системы натирийуретических пептидов обнаружены не только в клетках сосудов и почечных канальцев, но и в других (мышечных, кардиомиоцитах, жировых, иммунных, клетках центральной нервной системы, а также в мезенхимных стволовых клетках (МСК) (Santhekadur et al., 2017; Elferink, Koster, 1995; Revittser et al., 2014). ANP в составе системы натрийуретических пептидов участвует во многих процессах организма: регулирует метаболизм жиров, функции мозга, рост длинных костей, антивоспалительные эффекты иммунной системы. Знания о роли ANP в организме только растут (Daniels, Maisel, 2007).
Стало известно, что ANP способен влиять на актиновый цитоскелет различных клеток, а это означает увеличение диапазона его эффектов, в связи с тем, что цитоскелет является неотъемлемым участником множества ключевых процессов и реакций клетки, включая подвижность и миграционный потенциал. Большинство исследований влияния ANP на актиновый цитоскелет и сопряженные процессы клеточной сигнализации проводятся на модели эндотелиальных клеток (Kuhn, 2012). Показано, что через рецепторы системы натрийуретических пептидов активируется полимеризация актина на периферии клетки (Chen et al., 2008), что ANP вызывает формирование стресс-фибрилл и влияет на миграционный потенциал клеток эндотелия (Kook et al., 2003).
Роль системы натрийуретических пептидов в МСК человека в противоположность клеткам эндотелия сосудов практически не изучена. Ранее нами было показано, что ANP усиливает способность к миграцию МСК, выделенных из периренального жира крысы (Ревитцер, Негуляев, 2018), поэтому возникает вопрос о влиянии ANP на подвижность МСК человека. Этот вопрос чрезвычайно актуален в контексте регенеративной медицины и возможностей увеличения количества клеток, мигрирующих к месту повреждения тканей в организме. В настоящее время активно исследуется влияние культивирования в присутствии различных биологически активных веществ на свойства и миграционный потенциал МСК in vitro и in vivo. Примерами таких веществ могут быть гормон окситоцин и хемокин SDF-1 (stromal cell-derived factor 1) (Chenxia, Lanjuan, 2018).
Таким образом, цель нашей работы заключалась в том, чтобы выяснить, способно ли культивирование в присутствии ANP оказывать влияние на реорганизацию цитоскелета и миграцию МСК человека. Объектом исследования служили МСК линии FetMSC, полученной из костного мозга 5–6-недельного эмбриона человека (Крылова и др., 2012).
МАТЕРИАЛ И МЕТОДИКА
Культивирование клеток FetMSC. Клетки FetMSC получены из Российской Коллекции клеточных культур позвоночных Института цитологии РАН (Санкт-Петербург). Клетки высевали в культуральную посуду при плотности 104 кл./см2 и постоянно культивировали в условиях 37°С, 5% СО2 и 90% влажности. В качестве питательной среды использовали DМЕМ (Биолот, Россия), содержащую 10% сыворотки плодов коровы (HyClone, США), 2 мМ L-глутамина, смесь пенициллина (50 Ед/мл) и стрептомицина (50 мкг/мл) (Биолот, Россия). Смену среды проводили 1 раз за 2–3 сут, клетки пересеивали при достижении монослоя.
Иммунофлуоресцентное окрашивание. Подготовку к окраске флуоресцентномеченными антителами проводили согласно рекомендациям производителя антител. Клетки фиксировали 4%-ным раствором параформальдегида в фосфатно-солевом буфере (PBS) в течение 10 мин при комнатной температуре, после чего проводили пермеабилизацию клеток 0.5%-ным тритон Х-100 в PBS в течение 5 мин. Перед инкубацией с первичными антителами проводили блокировку неспецифического связывания, инкубируя образцы 1 ч в 1%-ном растворе бычьего сывороточного альбумина.
Для выявления рецепторов системы натрийуретических пептидов клетки инкубировали с антителами к рецепторам NPRA, NPRC (Tocris, США; разведение 1 : 100) в течение 1 ч при 37°С, далее вторичными флуоресцентными антителами к NPRA (конъюгированный с Сy3), NPRC (конъюгированный с FITC) (Tocris, США, разведение 1 : 1000) в течение 1 ч в темноте при комнатной температуре.
Окрашивание F-актина. Клетки FetMSC инкубировали 15 мин при 37°С с родамином, конъюгированным с фаллоидином (TRITC-phalloidin, 1 мкг/мл; Sigma-Aldrich, Германия) после фиксаци и пермеабилизаци клеток.
Флуоресцентная микроскопия. Для окрашивания ядер клетки инкубировали 10 мин при комнатной температуре с красителем Hoechst 33342 (Sigma, США; 2 мкг/мл). Покровные стекла с клетками монтировали к предметному стеклу с помощью заключающего состава Vectashield (Vector Labs, США). Препараты визуализировали с помощью лазерного сканирующего конфокального микроскопа Olympus FV3000 (Оlympus Сorporation, Япония). Использовали лазеры, испускающие на длинах волн 561 нм (для выявления NPRA-Cy3 или актина, связанного с родамин-фаллоидином) или 488 нм (NPRC-FITC). Измерение относительной интенсивности флуоресценции (ИФ) проводили в программе ImageJ (США) с помощью функции Mean Grey Value. Значения относительной ИФ представлены средними значениями из 10 измерений (n = 10) и их стандартной ошибки, достоверность различий оценивали с помощью дисперсионного анализа с уровнем значимости Р < 0.05.
Выделение РНК и обратная транскрипция (ОТ). Образцы суммарной РНК получали из клеток Fet-MSC, достигших монослоя. Выделение РНК проводили с помощью набора RNeasyMiniKit (QIA-GEN, США) согласно рекомендациям производителя. Элюцию проводили в 30 мкл воды. Концентрацию выделенной РНК измеряли на спектрофотометре GeneQuant1300 (Biochrom, США), при этом оценивали чистоту образцов. Соотношения пиков поглощения при 260 и 280 нм (оценка примесей белков и аминокислот), а также при 260 и 230 нм (оценка примесей солей и фенола) находились в пределах 1.8–2. Синтез кДНК проводили с помощью набора для обратной транскрипции ОТ-1 (Синтол, Россия). Для реакции ОТ использовали 1 мкг РНК, 1 мкл праймера (Random-6 15 ОЕ/мл) и воду; общий объем реакции составлял 13 мкл. Далее эту смесь инкубировали при 65°С 10 мин и охлаждали 1 мин во льду. Затем добавляли 10 мкл 2.5-кратную реакционную смесь и 1 мкл обратной транскриптазы (MMLV-RT, 50 ед/мкл). Общую смесь инкубировали 75 мин при 37°С и 10 мин при 85°С. К полученной кДНК добавляли 75 мкл воды.
Полимеразная цепная реакция (ПЦР) после ОТ (ОТ-ПЦР). Праймеры для ПЦР были спроектированы с помощью программы PrimerBlast (США) с учетом базы данных нуклеотидной последовательности NCBI (The National Center for Biotechnology Information, США). Генами интереса выступали npr1 (кодирует рецептор системы натрийуретических пептидов типа А, NPRA) и npr3 (кодирует NPRС). Последовательности праймеров для npr1: прямой 5'-CGTGTGAACCGTAAACGCATT-3' и обратный 3'-CATTCTGCACATCCCGCATA-5' (размер ампликона 76 п.н.). Последовательности праймеров для npr3: прямой 5'-CCCAGGAGGTTATTGGTGATTATTT-3' и обратный 3'-ACATTCGGCCGCATTTCAA-5' (размер ампликона 61 п.н.). ПЦР проводили в объеме 10 мкл, в который входили: 4 мкл разведенной кДНК, по 0.5 мкМ прямого и обратного праймеров, 0.2 мМ дНТФ, 1.5 мМ MgCl2, Hot-Taq полимеразный буфер, 1 ед. Hot-Taq ДНК-полимеразы (Силекс, Россия). Амплификацию проводили в следующем режиме: 95°С – 5 мин (активация полимеразы), далее 35 2‑ста-дийных циклов (60°С – 50 с и 95°С – 15 с). Продукты ПЦР в объеме 8 мкл электрофоретически разделяли в 6%-ном ПААГ, затем окрашивали бромистым этидием. Фотографии были выполнены при ультрафиолетовом освещении. В качестве отрицательного контроля использовали реакционную смесь без полимеразы (в этих условиях экспрессия мРНК не была обнаружена).
Оценка миграции МСК. Использовали метод зарастания раны (wound healing assay). Перед началом экспериментов клетки FetMSC высевали в лунки культурального планшета при плотности 104 на 1 см2. После достижения ими монослоя питательную среду заменяли на свежую, при этом в экспериментальные лунки добавляли 10 или 1000 нМ ANP (Atrial natriuretic peptide (human); Tocris, США). В качестве контролей выступали лунки без ANP. Через 1 сут на монослой клеток всех образцов наносили рану (шириной приблизительно 550–600 мкм) с помощью стерильного наконечника (200 мкл), затем промывали фосфатно-солевым буфером для удаления открепившихся клеток. После промывки к клеткам добавляли питательную среду без ANP. C помощью микроскопа Axio Observer Z1 (Zeiss, Германия), оборудованного системой для поддержания 37°С, 5% СО2 и необходимой влажности, проводили цейтраферную съемку нативного препарата FetMSC с нанесенными ранами (1 кадр за 2.5 ч в течение 25 ч). Из полученных наборов изображений в программе ImageJ (NIH, США) измеряли площадь раны (Measure-Area). Полученные числовые значения обрабатывали в Exсel (Microsoft, США) – вычисляли изменение площади экспериментальной раны в процентах относительно начального значения площади.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Экспрессия мРНК и иммунофлуорецентная окраска рецепторов ANP. Мы показали, что в клетках FetMSC экспрессируются гены npr1 (кодирует NPRA) и npr3 (кодирует NPRC), Данные представлены на рис. 1а, б. Иммунофлуоресцентный анализ позволил подтвердить наличие соответствующих белков в этих клетках: они несут рецепторы, способные связываться с ANP A- и C-типа (рис. 1в и 1г соответственно). Полученные нами данные согласуются с полученными ранее: рецепторы системы натрийуретических пептидов А- и С-типа обнаружены в МСК, выделенных из костного мозга взрослых доноров (Revittser et al., 2014).
Рис. 1.
Экспрессия мРНК npr1 (a) и npr3 (б) рецепторов NPRA и NPRС клеток FetMSC и иммунофлуоресцентная окраска рецептора NPRA (в, красный цвет) и NPRС (г, зеленый цвет) с помощью соответствующих антител. а, б – По данным ОТ-ПЦР; ядра окрашены Hoechst. Масштабная линейка: 50 мкм.

Окрашивание F-актина. Известно, что родамин специфично связывается с F-актином, таким образом, качественная и количественная оценка окрашенных нитей актина может показывать сборку или разборку актинового цитоскелета. Мы провели окрашивание фибриллярного актинового цитоскелета клеток FetMSC с помощью родамин-фаллоидина в контроле и после культивирования клеток с ANP в течение 24 ч перед экспериментом (рис. 2а–в). В контрольных условиях все клетки имеют фибробластоподобную форму и ярко выраженные стресс-фибриллы, что типично для МСК. Мы выявили сборку актинового цитоскелета в FetMSC, культивируемых в присутствии 10 нМ ANP: среднее значение интенсивности флюоресценции (ИФ) родамин-фаллоидина, окрашивающего F-актин, составило 1.32 ± ± 0.16 отн. ед. (n = 10) относительно контрольных значений (1.00 ± 0.13 отн. ед., n = 10). При этом нами не было выявлено изменений значения ИФ в клетках, культивируемых в присутствии 1000 нМ ANP, (0.96 ± 0.11 отн. ед., n = 10). Полученные данные позволяют сделать вывод, что при воздействии ANP только в малой концентрации (10 нМ, рис. 2б) происходит сборка микрофиламентов, а при большой нет (1000 нМ, рис. 2в). Наши результаты для случая с 10 нМ ANP согласуются с данными, полученными для эндотелиальных клеток аорты (Chen et al., 2008), в которых при добавлении 10 нМ ANP в питательную среду происходила полимеризация актина. Мы предположили, что обнаруженная реорганизация цитоскелета, а именно сборка F-актина при действии 10 нМ ANP, может вносить вклад в миграционный потенциал клеток FetMSC, который мы оценили в следующей серии экспериментов.
Рис. 2.
Флуоресцентное окрашивание F-актина родамином, конъюгированным с фаллоидином (а, б, в) и динамика зарастания раны (г, д) в монослое клеток FetMSC после действия ANP в концентрации 10 и 1000 нМ в течение 24 ч. а – Контроль; б, в – ANP в концентрации соответственно 10 и 1000 нМ; ядра окрашены Hoechst. г – Интенсивность флуоресценции (ИФ) F-актина, окрашеного родамином-фаллоидином, относительно контроля, принятого за 1; представлены средние значения и стандартная ошибка среднего, звездочкой показана достоверность отличия от контроля при Р < 0.05. д – Результаты репрезентативного эксперимента по оценке динамики зарастания раны, нанесенной на монослой клеток FetMSC в контроле (кривая 1), после культивирования в течение 24 ч в присутствии ANP в концентрации 10 (кривая 2) и 1000 (кривая 3) нМ. Масштабная линейка: 100 мкм.
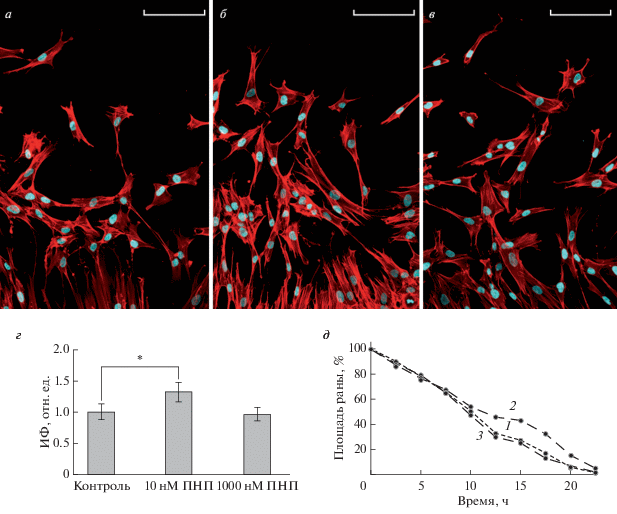
Миграция клеток FetMSC. Способность клеток к миграции оценивали по методу зарастания раны после культивирования в присутвии ANP. Эксперимент длился 24 ч. На рис. 2д приведены данные репрезентативного эксперимента, отображающие уменьшение площади раны относительно начального значения по мере культивирования клеток. В клетках, культивируемых в присутствии 10 нМ ANP, через 15 ч площадь раны составила 43.2% от первоначальной площади, в то время как значение относительной площади раны контрольных клеток FetMSC и культивируемых в присутствии 1000 нМ ANP составило 27.4 и 25.7% соответственно. Таким образом, мы обнаружили, что ANP в концентрации 10 нМ вызывает замедление движения клеток (рис. 2д, кривая 2), в то время как ANP в концентрации1000 нМ (рис. 2д, кривая 3) не изменяет динамику зарастания раны по сравнению с контролем (рис. 2д, кривая 1). Динамика зарастания экспериментальной раны согласуется с данными о реорганизации цитоскелета: сборка стресс-фибрилл, возникающая при 1000 нМ ANP, увеличивает адгезивные свойства клеток и затрудняет их подвижность, что приводит к замедлению зарастания экспериментальной раны.
Полученные нами данные принципиально отличны от ранее выявленных эффектов для МСК, выделенных из периренального жира крысы: культивирование в присутвии 10 нМ ANP ускоряло зарастание раны по сравнению с контролем (Ревитцер, Негуляев, 2018). Вероятно, мы можем связать это с разным происхождением клеток (от человек и крысы). В литературе тоже есть противоречивые результаты относительно влияния ANP на эндотелиальные клетки: показано, что 10 нМ ANP замедляет миграцию эндотелиальных клеток крысы (Ikeda et al., 1995), но ускоряет миграцию эндотелиальных клеток человека (Kook et al., 2003).
Известны биологически активные вещества, которые оказывают различные эффекты в малых и больших концентрациях. Например, эпидермальный фактор роста в малой концентрации (2 нг/мл) вызывает полимеризацию актина в фибробластах крысы, в то время как в большой концентрации (80 нг/мл) вызывает разборку стресс-фибрилл (Ojaniemi,Vuori, 1997).
В раковых клетках показана роль ANP в реорганизации актинового цитоскелета: активация NPRA, спаренного с G-белком, который в свою очередь передает сигнал через вторичный посредник цГМФ к Akt-киназе, вызывая Akt-зависимую реорганизацию актинового цитоскелета (Schwappacher et al., 2013). В то же время детальное исследование молекулярных сигнальных путей, определяющих влияние ANP на миграционный потенциал и актиновый цитоскелет в стволовых клетках ранее не проводили.
Итак, мы выявили экспрессию рецепторов типа А и С в клетках FetMSC и показали, что ANP в низкой концентрации (10 нМ) вызывает дополнительную сборку актинового цитоскелета и замедление зарастания экспериментальной раны, в то время как в высокой концентрации этот пептид (1000 нМ) не изменяет организацию актинового цитоскелета и динамику зарастания раны по сравнению с контролем. Таким образом, культивирование в присутствии ANP способно вызывать реорганизацию актинового цитоскелета и влиять на миграционный потенциал МСК.
Список литературы
Крылова Т.А., Кольцова А.М., Зенин В.В., Мусорина А.С., Яковлева Т.К., Полянская Г.Г. 2012. Сравнительные характеристики новых линий мезенхимных стволовых клеток, полученных из эмбриональных стволовых клеток, костного мозга и крайней плоти человека. Цитология. 54(1) : 5–16 (Krylova T.A., Koltsova A.M., Zenin V.V., Musorina A.S., Yakovleva T.K., Poljanskaya G.G. 2012. Comparative characteristics of new mesenchymal stem cell lines derived from human embryonic stem cells, bone marrow and foreskin. Tsitologiya. 54(1) : 5–16.)
Ревитцер А.В., Негуляев Ю.А. 2018. Влияние предсердного натрийуретического пептида на миграцию мезенхимных стволовых клеток, выделенных из периренального жира крысы. Цитология. 60(4) : 273–278 (A.V. Revittser, Yu. A. Neguliaev. 2018. Influence of atrial natriuretic peptide on migration of mechenchymal stem cells, gained from perirenal rat fat. Tsitologiya. 60(4) : 273–278.
Boldt J., Suttner S.W. 2006 Physiology and Pathophysiology of the Natriuretic Peptide System .Yearbook of Intensive Care and Emergency Medicine. 101–109.
Chen H., Levine C., Golan E., Michel T., Lin J. 2008. Atrial natriuretic peptide-initiated cGMP pathways regulate vasodilator-stimulated phosphoprotein phosphorylation and angiogenesis in vascular endothelium. J. Biol. Chem. 283 : 4439–4447.
Chenxia H., Lanjuan L. 2018. Preconditioning influences mesenchymal stem cell properties in vitro and in vivo. J. Cell Mol. Med. 22 : 1428–1442.
Daniels L., Maisel A. 2007. Natriuretic Peptides. J. Am. Col. Cardiol. 50 : 2357-2368.
Elferink J., Koster M. 1995. Atrial natriuretic factor stimulates migration by human neutrophils. Eur. J. Pharmacol. 288 : 335–340.
Ikeda M., Kohno M., Takeda T. 1995.Inhibition by Cardiac Natriuretic Peptides of Rat Vasc. Endothelial Cell Migration. Hypertension. 26 : 401–405.
Kook H., Itoh H., Choi B., Sawada N., Doi K., Hwang T., Kim K., Arai H., Baik Y., Nakao K. 2003. Physiological concentration of atrial natriuretic peptide induces endothelial regeneration in vitro. Am. J. Physiol. Heart Circ. Physiol. 284 : H1388–H1397
Kuhn M. 2012. Endothelial actions of atrial and B-type natriuretic peptides. Br. J. Pharmacol. 166 : 522–531.
Ojaniemi M., Vuori K. 1997. Epidermal growth factor modulates tyrosine phosphorylation of p130Cas. Involvement of phosphatidylinositol 3′-kinase and actin cytoskeleton. J. Biol. Chem. 272: 25993–25998.
Potter L., Abbey-Hosch S., Dickey D. 2006. Natriuretic peptides, their receptors, and cyclic guanosine monophosphate dependent signaling functions. Endocrine Reviews. 27 : 47–72.
Revittser A., Pivovarova O., Rudovich N., Pfeiffer A.F.H., Shlyakto E., Dmitrieva R. 2014. PPARg and natriuretic peptides (NP) pathway are alterated in adipose tissue from heart failure patients/mesenchymal stromal cells (MMSC) as a tool to study cardiovascular metabolic disorders in vitro. Cardivasc. Res. 103 : s105.
Santhekadur P., Kumar D., Seneshaw M., Mirshahi F., Sanyala A. 2017. The multifaceted role of natriuretic peptides in metabolic syndrome. Biomed Pharmacother. 92 : 826–835.
Schwappacher R., Rangaswami H., Su-Yuo J., Hassad A., Spitler R., Casteel1 D. 2013. cGMP-dependent protein kinase Iβ regulates breast cancer cell migration and invasion via interaction with the actin/myosin-associated protein caldesmon. J. Cell Sci. 126 : 1626–1636.
Дополнительные материалы отсутствуют.


