Цитология, 2019, T. 61, № 4, стр. 301-307
ПОЛУЧЕНИЕ С-КОНЦЕВОГО УЧАСТКА БЕЛКА PI31 ДЛЯ ИНГИБИРОВАНИЯ АКТИВНОСТИ 20S-ПРОТЕАСОМЫ IN VITRO
Е. Е. Дьяконов 1, Е. А. Малкина 1, 2, В. А. Куличкова 1, А. Н. Томилин 1, 3, А. С. Цимоха 1, *
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Российский государственный педагогический университет имени А.И. Герцена
191186 Санкт-Петербург, Россия
3 Институт трансляционной биомедицины, Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
* E-mail: atsimokha@incras.ru
Поступила в редакцию 09.11.2018
После доработки 16.01.2019
Принята к публикации 16.01.2019
Аннотация
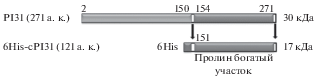
Белок PI31, ингибитор протеасомы, состоит из 271 аминокислотных остатков и содержит N-концевой глобулярный и богатый пролином C-концевой домен. Ингибирующая протеасому активность ассоциирована с С-концевым участком PI31. Сконструирована последовательность С-концевого участка гена PSMF1, кодирующего белок PI31 (151–271 а. к.), слитого на N-конце с последовательностью из шести гистидинов. Рекомбинантный С-концевой участок PI31 (6His-cPI31) экспрессировали в Escherichia coli и очищали с помощью металл-хелатной хроматографии. Рекомбинантный белок 6His-cPI31 ингибировал in vitro химотрипсин-подобную активность 20S-, но не 26S-протеасомы.
Большая часть регулируемого протеолиза в клетках эукариот осуществляется убиквитин-протеасомной системой (Konstantinova et al., 2008). Протеасома в клетках эукариот представляет собой протеолитический белковый комплекс, который формируется из протеолитического ядра – 20S-протеасомы и различных регуляторных компонентов (Demartino, Gillette, 2007). За убиквитин-зависимый протеолиз белков в клетке отвечает 20S-протеасома, которая состоит из 20S-протеасомы и одного или двух 19S-регуляторных комплексов (Collins, Goldberg, 2017). 20S-протеасома представляет собой полый цилиндр, состоящий из четырех сложенных в стопку гептамерных колец: два внешних кольца образованы субъединицами α-типа, два внутренних кольца – субъединицами β-типа. β-Субъединицы в составе β-колец формируют каталитическую полость 20S-протеасом, в которой три различные β-субъединицы (β1, β2 и β5) в каждом из двух внутренних колец специфически катализируют гидролиз пептидной связи (Groll et al., 1997). α-Cубъединицы в составе α-колец образуют “ворота”, тем самым регулируя доступ субстратов к протеолитической камере (Groll et al., 2000). В отсутствие регуляторных комплексов “ворота” конститутивно закрыты, что делает свободные 20S-протеасомы каталитически инертными (Groll et al., 1997). Однако связывание регуляторов с 20S-протеасомой приводит к открытию “ворот”, тем самым активируя полученный протеасомный комплекс (Stadtmueller, Hill, 2011). Помимо протеасомных активаторов 19S, PA200 и PA28 описан также протеасомный ингибитор PI31 (Li et al., 2014).
Известно, что белок PI31 содержит два домена (рис. 1): N-концевой глобулярный домен, который, возможно, ответственен за гомодимеризацию PI31 (Kirk et al., 2008) и богатый пролином C-концевой домен с нарушенной структурой, для которого показана ингибирующая активность по отношению к протеасоме (McCutchen-Maloney et al., 2000). При этом PI31 ингибирует преимущественно химотрипсин- и каспаза-подобные типы активности 20S протеасомы, но не трипсин-подобную (Zaiss et al., 1999). Интересен тот факт, что С-концевые остатки PI31 соответствуют мотиву HbYX (где Hb – гидрофобный аминокислотный остаток, Y – тирозин, X – любой аминокислотный остаток), характерному для активаторов протеасомы (Bader et al., 2011). Полагают, что ингибитор PI31 конкурирует за связывание с 20S протеасомой с активатором PA28 (Zaiss et al., 2002). Более того, оказалось, что PI31 активирует 20S-протеасомы in vitro и оказывает положительное влияние на функцию протеасом в интактных клетках. Согласно другим данным, PI31 блокирует АТФ-зависимую сборку 26S-протеасомы in vitro, но не оказывает влияния на активность in vitro уже собранной 26S-протеасомы (Li et al., 2014). Таким образом, поскольку данные о влиянии PI31 на активности протеасом in vitro достаточно противоречивы, роль PI31 в регуляции функции протеасом так и остается неясной.
В настоящей работe мы исследовали влияние PI31 на активность аффинно-очищенных 20S- и 26S-протеасом in vitro. Мы создали систему для экспрессии и очистки С-концевого участка PI31 – 6His-cPI31, позволяющую получить каталитически активный гомогенный препарат белка с высоким выходом. Мы сравнили активность рекомбинантного белка 6His-cPI31 по отношению к 20S- и 26S-протеасомам в системе in vitro и показали, что 6His-cPI31 ингибировал химотрипсин-подобную активность 20S-, но не 26S-протеасомы.
МАТЕРИАЛ И МЕТОДИКА
Клетки почки эмбриона человека линии HEK293, полученные из Российской коллекции клеточных культур (Институт цитологии РАН), культивировали при 37°С в среде DMEM, содержащей 10% эмбриональной телячьей сыворотки (Invitrogen, США), в присутствии пенициллина и стрептомицина (Биолот, Россия).
Экспрессионную конструкцию получили на основе вектора pET24d (Clontech Laboratores, США), в который по сайтам рестрикции NcoI и NotI мы вставили последовательность С-концевого участка белка PI31 (mPSMF1) (151–271 а. к.), которую амплифицировали с кДНК из клеток HEK293 с помощью следующих праймеров 5'-CATCCCATGGCAAACAGTCCTCCGAGGG-3' и 5'-TAATGTGCGGCCGCTCACAGGTACATGTCATC-3', включающих в себя сайты рестрикции для NcoI и NotI, соответственно. Наличие и точность вставки в векторе определяли с помощью рестрикции и итоговым секвенированием (Евроген, Россия).
Экспрессию С-концевого участка белка PI31 (6His-cPI31) проводили в клетках E. coli (BL-21(DE3)) в присутствии 0.4 мМ изопропил-β-D-1-тиогалактопиранозида (ИПТГ) в течение 4 ч. Клетки с наработанным рекомбинантным белком PI31 лизировали в PBS буфере с 0.1% NP-40, 0.5 мМ фенилметилсульфонилфторида и 1 мкг/мл лизоцима в течение 15 мин при 4°С. Клетки разрушали на ультразвуковом дезинтеграторе в следующем режиме: 6–8 циклов по 15 с при 75%-ной амплитуде с интервалами между циклами 1 мин. Гомогенат центрифугировали в течение 1 ч при 15000 g при 4°С. Наличие целевого рекомбинантного белка (17 кДa) в полученном лизате подтверждали с помощью специфических антител.
Очистку 6His-cPI31 проводили методом металл-хелатной хроматографии на Ni-агарозе. К клеточному лизату добавляли 5 мМ имидазола и Ni-агарозу, уравновешенную связывающим буфером (20 мM Tris-HCl, 500 мМ NaCl, 5 мM имидазол, pH 7.9) и инкубировали в течение ночи при 4°С при постоянном перемешивании. Далее белки в комплексе с Ni-агарозой осаждали центрифугированием и промывали последовательно 3 раза 4-мя объемами связывающего буфера и 3 раза 4-мя объемами промывочного буфера (10 мМ Tris-HCl, 250 мМ NaCl, 30 мM имидазол, pH 7.9). Далее белок элюировали с Ni-агарозы 4-мя объемами элюирующего буфера (10 мM Tris-HCl, 250 мМ NaCl, 500 мM имидазол, pH 7.9) в течение 5 мин при 4°С и концентрировали с применением центрифужных фильтров Amicon Ultra-0.5 (10К, Millipore, США). Концентрацию белка в пробах определяли в соответствии с классическим методом Брэдфорд (Bradford, 1976).
Протеасомы выделяли в соответствии с методикой, описанной ранее (Wang et al., 2007). Клеточный экстракт готовили из клеток HEK293, экспрессирующих меченый белок Rpn11-HTBH (любезно предоставлен доктором Л. Хуанг) и β7-HTBH (Артамонова и др., 2014). Клетки промывали холодным PBS и лизировали в буфере А (50 мМ Na-фосфат, pH 7.5, 100 мМ NaCl, 10% глицерин, 5 мМ АТP, 1 мМ DTT, 5 мМ MgCl2, 0.5% NP-40, ингибиторы протеаз) в течение 30 мин при 4°С. Клеточные фрагменты удаляли центрифугированием при 13 тыс. об./мин в течение 30 мин при 4°С. К клеточному экстракту добавляли стрептавидин-агарозу, уравновешенную буфером А, и инкубировали в течение ночи при 4°С при постоянном перемешивании. Далее белки в комплексе со стрептавидин-агарозой осаждали центрифугированием и промывали последовательно 20 объемами буфера А, 10 объемами буфера ТЕВ (50 мМ Tris-HCl, pH 7.5, 10% глицерин). Следующим этапом протеасомы элюировали со стрептавидин-агарозы двумя объемами буфера ТЕВ в присутствии 0.1% ТЕV-протеазы в течение 1 ч при температуре 30°С и концентрировали с применением центрифужных фильтров Amicon Ultra-0.5 (100К, Millipore, США). Для очистки 20S-протеасомных комплексов использовали метод, описанный ранее (Leggett et al., 2005), с некоторыми изменениями. Для этого перед элюированием протеасом со стрептавидин-агарозы с помощью TEV-протеазы были введены дополнительные серии промывок и дополнительная инкубация в буфере I (50 мМ Tris-HCl, pH 7.5, 1мМ EDTA, 1мМ ATP) в присутствии 500 мМ NaCl, что приводило к диссоциации комплекса 20S-протеасомы и регуляторных частиц. Для этого после промывки белков в комплексе со стрептавидин-агарозой 10 объемами TEB буфера комплекс последовательно промывали 10 объемами буфера I с 100 мM NaCl, 5 объемами буфера I с 500 мM NaCl, инкубировали в этом же буфере в течение 1 ч при 4°С при постоянном перемешивании, после чего промывали 50 объемами этого буфера. Далее 20S-протеасомы элюировали со стрептавидин-агарозы с помощью TEV-протеазы.
Вестерн-блот анализ белков проводили по стандартной методике. Белки фракционировали в денатурирующем 13%-ном ПААГ. Полученные фракции электрофоретически переносили на PVDF фильтры (BioRad Laboratories, США) в буфере, содержащем 25 мM Tris-HCl, 190 мM глицин, 0.05% SDS, 10% метанола, pH 7.3. Мембрану отмывали в буфере PBS и блокировали центры неспецифического связывания антител 5%-ным обезжиренным молоком в этом же буфере. Избыток блокирующего агента отмывали буфером PBS, и мембрану инкубировали c первичными антителами против белка PI31 (1 : 1000, Enzo, США). В качестве вторичных антител применяли конъюгированные с пероксидазой хрена козьи антитела, выработанные против иммуноглобулинов мыши (1 : 5000, Jackson Immunoresearch, США). Белки, связавшиеся с антителами, выявляли с помощью метода усиленной хемилюминесценции SuperSignal (Thermo, США). Для этого на мембрану наносили раствор ECL и, далее, регистрировали хемилюминесцентное излучение с помощью системы гель-документирования ChemiDoc Touch Imaging System (Bio-Rad, США).
Пептидазную активность протеасом химотрипсин-подобного типа определяли по гидролизу флуорогенного пептида Suc-Leu-Leu-Val-Tyr-AMC (Enzo, США). Для этого 0.4 мM субстрат инкубировали с 1 мкг протеасом в течение 60 мин при температуре 37°С в буферном растворе, содержащем 50 мМ Tris-HCl, pH 7.5, 1 мМ MgCl2, 10 мМ KCl, 1 мМ DTT, 5 мМ ATP. Концентрацию продукта гидролиза AMC определяли каждые 2 мин на флуориметре FLUOstar Omega (BMG Labtech, США), измеряя экстинкцию и эмиссию при длинах волн 365 и 440 нм, соответственно (Barrett, 1980).
Использованные реактивы: среда DMEM, глутамин, пенициллин-стрептомицин, трипсин, PBS (Биолот, Россия); сыворотка плодов коров, (Gibco, США); кумасси G-250 (Serva, Германия); Na-хлорацетат, метанол, этанол, соляная и уксусная кислоты, глицерин, KCl, NaOH, ферменты ДНК-рестрикции (Россия); акриламид, дитиотреитол, трис, глицин, додецилсульфат натрия, персульфат аммония, NaCl, метилен-бис-акриламид, ЭДТА, фенилметилсульфонилфторид, TEMED, Tween-20, NP-40, дезоксихолат натрия (Amresco, США); обезжиренное молоко (Sigma, США); Ni-агароза (Millipore, США); козьи антитела против иммуноглобулинов мыши, конъюгированные с пероксидазой хрена (Jackson Immunoresearch, США); набор SuperSignal, реагент TurboFect, маркеры молекулярных весов, рестриктазы, TEV-протеаза, стептавидин-агароза (Thermo, США); флуорогенный пептид Suc-Leu-Leu-Val-Tyr-AMC, антитела против PI31 (Enzo, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Известно, что ингибирующая протеасому активность белка PI31 ассоциирована с его богатым пролином С-концевым участком. Нуклеотидная последовательность, кодирующая этот участок белка PI31 (151–271 а. к.) была использована для конструирования соответствующего рекомбинантного белка 6His-cPI31, слитого на N-конце с последовательностью из шести гистидинов (рис. 1). Результаты электрофоретического анализа полученного рекомбинантного белка представлены на рис. 2а и 2б. Молекулярная масса 6His-cPI31 соответствовала расчетной 17 кДа.
Рис. 2.
Анализ экспрессии в клетках E. coli рекомбинантного белка 6His-cPI31 и его очистки. Денатурирующий электрофорез в 13%-ном ПААГ лизата клеток (15 мкг) до (1) и после (2) индукции экспрессии с помощью ИПТГ. Окраска геля Кумасси G-250 (а, в) и вестерн-блот анализ разделенных в системе денатурирующего электрофореза белков с помощью антител против PI31 (б). М − маркер молекулярных весов. На рис. в − левая дорожка − маркер молекулярных весов, правая дорожка − 6His-cPI31.
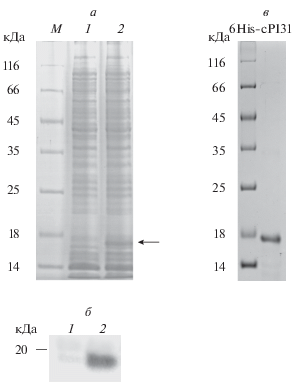
Для повышения уровня синтеза рекомбинантного белка 6His-cPI31 в клетках E. coli были использованы различные концентрации индуктора (ИПТГ) в диапазоне от 0.1 до 1 мМ. Количество белка 6His-cPI31 достигало максимума при концентрации ИПТГ 0.4 мМ и уже не менялось с дальнейшим повышением концентрации индуктора.
На следующем этапе были отработаны условия очистки белка 6His-cPI31. Поскольку белок 6His-cPI31 содержался в клетках E. coli в растворимой форме, при очистке методом металл-хелатной хроматографии с использованием Ni-агарозы была подобрана только концентрация имидазола (500 мМ), при которой большая часть белка элюировала с сорбента. Результаты электрофоретического анализа полученного рекомбинантного белка представлен на рис. 2в.
Следующим этапом работы стал анализ способности очищенного препарата рекомбинантного белка 6His-cPI31 ингибировать активность протеасомы. Для этого мы очищали 26S-протеасомы из клеток человека линии HEK293, экспрессирующих белок β7, меченый по С-концу пептидом HTBH. Этот пептид был разработан ранее для очистки функционально активного протеасомного комплекса (Wang et al., 2007). Эта сложная метка включает две последовательности из 6 гистидинов (H), специфический сайт расщепления TEV-протеазой (T) и сигнальную последовательность для биотинилирования in vivo (B). Данная метка, включенная в состав белка, позволяет осуществлять его очистку за счет связывания с Ni- или стрептавидин-агарозой и последующего элюирования c сорбента путем отщепления с помощью TEV-протеазы. Картина распределения протеасомных белков в системе электрофореза в присутствии SDS представлена на рис. 3а. Чтобы доказать ингибирующее влияния 6His-cPI31 на протеасому, мы определили пептидазную активность химотрипсинового типа 26S-протеасом, очищенных из клеток HEK293 β7-HTBH, по гидролизу флуорогенного олигопептида, специфичного для этого каталитического центра протеасомы. В реакции гидролиза флуорогенного олигопептида 50 нг 26S-протеасомы использовали разные концентрации 6His-cPI31. В первых экспериментах содержание 6His-cPI31 в реакционной смеси было в диапазоне 50–250 нг, и мы не наблюдали ингибирующего эффекта 6His-cPI31 на активность протеасомы (данные не представлены). В последующих экспериментах мы увеличили количество 6His-cPI31 в пептидазной реакции в диапазоне 0.5–1 мкг. В этом случае ингибирующее влияние 6His-cPI31 на протеасомы было очевидным (данные не представлены). На рис. 3б представлена диаграмма, демонстрирующая подавление активности протеасом в присутствии в реакционной смеси 0.5, 1 и 1.5 мкг 6His-cPI31. В качестве контроля специфичности пептидазной активности мы использовали протеасомный ингибитор MG132 (Enzo, США) в концентрации 1 мкМ. Важно отметить, что содержание белка 6His-cPI31 1.5 мкг в пептидазной реакции соответствовало концентрации 1 мкМ. Согласно полученным результатам, рекомбинантный белок 6His-cPI31 обладает сходной с MG132 ингибирующей активностью в той же концентрации.
Рис. 3.
Анализ ингибирующей протеасому активности рекомбинантного белка 6His-PI31. а – Электрофоретическое разделение белков 26S-протеасом, аффинно-очищенных из клеток HEK293 β7-HTBH; денатурирующий электрофорез в 13%-ном ПААГ 10 мкг очищенных протеасом; окраска геля Кумасси G-250. б – Ингибирование химотрипсин-подобной пептидазной активности 26S протеасом (ПС) в присутствии трех разных концентраций 6His-PI31. Для контроля специфичности протеасомной активности в реакцию добавлен ингибитор протеасомной активности MG132 в количестве 1 мкМ. Средние значения трех независимых определений флуоресценции освобожденного AMC (100 ед. флуоресценции соответствуют освобождению 50 пмоль продукта; концентрация протеасом в пробах составляет 50 нг). в – Электрофоретическое разделение белков 26S- и 20S-протеасом (дорожки 1 и 2 соответственно), аффинно-очищенных из клеток HEK293 β7-HTBH. Денатурирующий электрофорез в 13%-ном ПААГ 10 мкг очищенных протеасом. Окраска геля Кумасси G-250. г – Ингибирование химотрипсин-подобной пептидазной активности 26S- и 20S-протеасом (ПС) в присутствии 1 мкМ 6His-PI31. Для контроля специфичности ингибирующей активности 6His-PI31 в реакцию добавлен белок БСА в количестве 1 мкМ. Представлены средние значения и стандартные отклонения трех независимых определений флуоресценции освобожденного AMC (100 ед. флуоресценции соответствуют освобождению 50 пмоль продукта; содержание протеасом в пробах составляет 0.5 мкг).
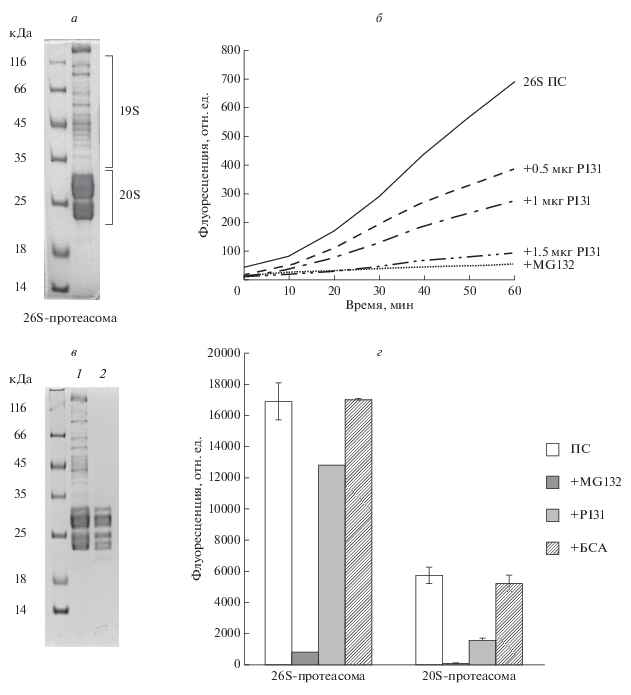
Далее мы оценили способность белка 6His-cPI31 ингибировать активность 20S-протеасомы. 20S-протеасомы были аффинно очищены из клеток HEK293 β7-HTBH (рис. 3в). В реакции гидролиза флуорогенного пептида активность 26S- и 20S-протеасом (7.5 нг/мкл) ингибировали в присутствии 1 мкМ 6His-cPI31. В качестве контроля специфичности ингибирующей активности белка 6His-PI31 использовали 1 мкМ БСА. Согласно диаграмме, представленной на рис. 3г, 6His-cPI31 ингибирует активность 26S- и 20S-протеасомы в 1.3 и в 3.7 раза. Таким образом, согласно нашим данным 6His-PI31 ингибирует in vitro активность как 20S-, так и 26S-протеасомы, что противоречит некоторым литературным данным (Bader et al., 2011; Li et al., 2014).
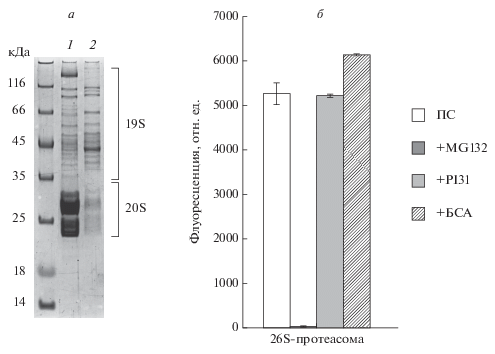
Однако следует отметить, что если 6His-PI31 всегда оказывал заметное влияние на активность 20S-протеасомы, то 26S-протеасому рекомбинантный белок ингибировал в разных реакциях по-разному, вплоть до отсутствия влияния (данные не представлены). Мы предположили, что объяснением этого наблюдения могут быть условия очистки 26S-протеасом. Так, известно, что протеасомы в клетке представлены набором различных субтипов, включая 26S-протеасомы, 20S-протеасомы, гибридные протеасомы, иммунопротеасомы, 20S-протеасомы в комплексе с альтернативными регуляторами (Селенина и др., 2017). Поэтому, если мы используем в качестве меченной для аффинной очистки субъединицу 20S-протеасомы (β7-HTBH), то мы очищаем все возможные субтипы протеасом, за исключением свободных 19S-комплексов. Напротив, если мы используем в качестве меченной для аффинной очистки субъединицу 19S-регулятора (Rpn11-HTBH), то мы очищаем лишь 26S- и гибридные протеасомы и теряем множество протеолитически активных протеасомных субтипов, в составе которых нет 19S-регулятора. Чтобы проверить предложенную гипотезу, мы аффинно очистили 26S-протеасомы из клеток HEK293 Rpn11-HTBH. Как можно заметить на рис. 4а, у очищенных из клеток HEK293 Rpn11-HTBH 26S-протеасом заметно меньше белков 20S-комплекса, в отличие от 26S-протеасом, очищенных из клеток HEK293 β7-HTBH, что подтверждает наше предположение. Анализ влияния 6His-cPI31 на пептидазную активность очищенных из клеток HEK293 Rpn11-HTBH 26S-протеасом не выявил ингибирующей активности рекомбинантного белка по отношению к 26S-протеасоме (рис. 4б). Следовательно, можно заключить, что 6His-cPI31 ингибирует активность in vitro 20S-протеасомы и не ингибирует 26S-комплексы, что может быть важно при исследовании функции внеклеточных протеасом, которые представлены исключительно 20S-комплексами (Kulichkova et al., 2017).
Рис. 4.
Анализ ингибирующей 26S протеасому активности рекомбинантного белка 6His-PI31. а – Электрофоретическое разделение белков 26S-протеасом (10 мкг), аффинно-очищенных из клеток HEK293 β7-HTBH (1) и HEK293 Rpn11-HTBH (2); окраска геля Кумасси G-250. б – Ингибирование химотрипсин-подобной пептидазной активности 26S-протеасом (ПС), аффинно очищенных из клеток HEK293 Rpn11-HTBH в присутствии 1 мкМ 6His-PI31. Для контроля специфичности ингибирующей активности 6His-PI31 в реакционную смесь добавляли 1 мкМ БСА. Представлены средние значения и стандартные отклонения трех независимых определений флуоресценции освобожденного AMC (100 ед. флуоресценции соответствуют освобождению 50 пмоль продукта; содержание протеасом в пробах составляет 0.5 мкг).
Список литературы
Артамонова Т.О., Ходорковский М.А., Цимоха А.С. 2014. Масс-спектрометрический анализ аффинно-очищенных протеасом из клеток миелогенной лейкемии человека линии К562. Биоорганическая химия. 40(6) : 1–15. (Artamonova T.O., Khodorkovskii M.A., Tsimokha A.S. 2014. Mass spectrometric analysis of affinity-purified proteasomes from the human myelogenous leukemia K562 cell line. Russ. J. Bioorg. Chem. 40(6) : 664–678.)
Селенина А.В., Цимоха А.С., Томилин А.Н. 2017. Протеасомы в регуляции белкового гомеостаза плюрипотентных стволовых клеток. Acta Naturae. 9(3) : 42–50. (Selenina A.V., Tsimokha A.S., Tomilin A.N. 2017. Proteasomes in protein homeostasis of pluripotent stem cells. Acta naturae. 9(3) : 39–47.)
Collins G.A., Goldberg A.L. 2017. The logic of the 26S proteasome. Cell. 169 : 792–806.
Bader M., Benjamin S., Wapinski O. L., Smith D.M., Goldberg A.L., Steller H. 2011. A conserved F-box regulatory complex controls proteasome activity in Drosophila. Cell. 145 : 371–382.
Barrett A.J. 1980. Fluorimetric assays for cathepsin B and cathepsin H with methylcoumarylamide substrates. Biochem. J. 187 : 909–912.
Bradford M.M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72 : 248–254.
Demartino G.N., Gillette T.G. 2007. Proteasomes: machines for all reasons. Cell. 129 : 659–662.
Groll M., Bajorek M., Kohler A., Moroder L., Rubin D.M., Huber R., Glickman M.H., Finley D. 2000. A gated channel into the proteasome core particle. Nat. Struct. Biol. 7 : 1062–1067.
Groll M., Ditzel L., Lowe J., Stock D., Bochtler M., Bartunik H.D., Huber R. 1997. Structure of 20S proteasome from yeast at 2.4 A resolution. Nature. 386 : 463–471.
Kirk R., Laman H., Knowles P.P., Murray-Rust J., Lomonosov M., Meziane el K., McDonald N.Q. 2008. Structure of a conserved dimerization domain within the F-box protein Fbxo7 and the PI31 proteasome inhibitor. J. Biol. Chem. 283 : 22 325–22 335.
Konstantinova I.M., Tsimokha A.S., Mittenberg A.G. 2008. Role of proteasomes in cellular regulation. Int. Rev. Cell Mol. Biol. 267 : 59–124.
Kulichkova V.A., Artamonova T.O., Lyublinskaya O.G., Khodorkovskii M.A., Tomilin A.N., Tsimokha A.S. 2017. Proteomic analysis of affinity-purified extracellular proteasomes reveals exclusively 20S complexes. Oncotarget. 8 : 102 134–102 149.
Leggett D.S., Glickman M.H., Finley D. 2005. Purification of proteasomes, proteasome subcomplexes, and proteasome-associated proteins from budding yeast. Methods Mol. Biol. 301 : 57–70.
Li X., Thompson D., Kumar B., DeMartino G.N. 2014. Molecular and cellular roles of PI31 (PSMF1) protein in regulation of proteasome function. J. Biol. Chem. 289 : 17 392–17 405.
McCutchen-Maloney S.L., Matsuda K., Shimbara N., Binns D.D., Tanaka K., Slaughter C.A., DeMartino G.N. 2000. cDNA cloning, expression, and functional characterization of PI31, a proline-rich inhibitor of the proteasome. J. Biol. Chem. 275 : 18 557–18 565.
Stadtmueller B.M., Hill C.P. 2011. Proteasome activators. Mol. Cell. 41 : 8–19.
Wang X., Chen C.F., Baker P.R., Chen P.L., Kaiser P., Huang L. 2007. Mass spectrometric characterization of the affinity-purified human 26S proteasome complex. Biochem. 46 : 3553–3565.
Zaiss D.M., Standera S., Holzhutter H., Kloetzel P., Sijts A.J. 1999. The proteasome inhibitor PI31 competes with PA28 for binding to 20S proteasomes. FEBS Lett. 457 : 333–338.
Zaiss D.M., Standera S., Kloetzel P.M., Sijts A.J. 2002. PI31 is a modulator of proteasome formation and antigen processing. Proc. Natl. Acad. Sci. USA. 99 : 14 344–14 349.
Дополнительные материалы отсутствуют.