Цитология, 2019, T. 61, № 4, стр. 308-318
Стеариламин вызывает образование нейтрофильных внеклеточных ловушек независимо от активных форм кислорода
Н. Ю. Лотош 1, *, С. О. Алясева 2, Р. Г. Василов 1, А. А. Селищева 1, 3
1 НИЦ “Курчатовский институт”
123098 Москва, Россия
2 Московский технологический университет (МИТХТ)
119571 Москва, Россия
3 Биологический факультет Московского государственного университета
119991 Москва, Россия
* E-mail: natalotosh@gmail.com
Поступила в редакцию 02.11.2018
После доработки 19.12.2018
Принята к публикации 25.01.2019
Аннотация
Нейтрофилы способны формировать внеклеточные ловушки, состоящие из хроматина и гранулярных белков, в которые, как в сети, попадают бактерии. Этот процесс, называемый нетозом и подробно изученный при воздействии на клетки форболового эфира (ФМА), протекает в течение 2–3 ч и зависит от активных форм кислорода, синтезируемых НАДФН-оксидазой (так называемый классический нетоз). Цель настоящей работы – изучение особенностей протекания нетоза, вызванного действием стеариламина (СА), растворенного в ДМСО или введенного в состав липосом из фосфатидилхолина (ФХ), по сравнению с нетозом, вызванным ФМА. Нейтрофилы человека инкубировали в присутствии 0.2 мг/мл СА (содержание ДМСО 2%) или с катионными липосомами из ФХ, содержащими СА (ФХ-СА-липосомы; концентрации ФХ и СА – соответственно 1.8 и 0.2 мг/мл). С помощью конфокальной флуоресцентной микроскопии на фиксированных препаратах нейтрофилов показали, что СА, как растворенный в ДМСО, так и в составе липосом, вызывает образование нейтрофильных внеклеточных ловушек. Кинетику протекания нетоза изучали на живых клетках в режиме реального времени с помощью флуоресцентно меченных ФХ-СА-липосом. Установили, что при добавлении к нейтрофилам ФХ-СА-липосомы сначала адсорбируются на отдельных участках цитоплазматической мембраны, а при увеличении времени воздействия – по всей ее поверхности. При этом происходит деконденсация хроматина и слияние содержимого ядра с цитоплазмой – стадии, общие с нетозом, индуцированным форболовым эфиром. Однако нетоз, вызванный СА, протекает со значительно большей скоростью (30–90 мин) по сравнению с нетозом, вызванным ФМА. Следует подчеркнуть, что при этом СА не индуцирует кислородный взрыв (в отличие от ФМА), что показано методом люминол-зависимой хемилюминесценции. На процесс образования ловушек нейтрофилами под действием ФХ-СА-липосом не влияли апоцинин и DPI (ингибиторы НАДФН-оксидазы) и каталаза, что также свидетельствует о том, что СА стимулирует АФК-независимое образование нейтрофильных внеклеточных ловушек.
В том случае, когда фагоцитоз оказывается неэффективным из-за большого размера или из-за большого количества патогенов, нейтрофилы защищают организм ценой собственной жизни, образовывая внеклеточные ловушки. Этот процесс, впервые поэтапно описанный группой Циклинского (Brinkmann et al., 2004), носит название нетоза (neutrophil extracellular traps, NETosis) или образования внеклеточных ловушек нейтрофилами. Нетоз вызывают многие индукторы: ФМА, вирусы, бактерии и компоненты бактериальной стенки (липополисахарид), цитокины IL-8 или TNFα, катионные липосомы (Ramos-Kichik et al., 2009; Goldmann, Medina, 2013; Воробьева, Пинегин, 2014; de Buhr et al., 2016; Hu et al., 2017; Лотош и др., 2018). При образовании ловушек клетка выбрасывает во внеклеточное пространство хроматин, с которым связаны бактерицидные белки и ферменты гранул. Ловушки выглядят как длинные нитеподобные или облакоподобные структуры, превышающие размер клетки в десятки раз. Именно они связывают грамположительные и грамотрицательные бактерии и грибы (Urban et al., 2006).
Нетоз, вызываемый ФМА, характеризуется зависимостью от АФК, синтезируемых НАДФН-оксидазой, и длительностью подготовки клетки к выбросу ДНК, составляющей 3–4 ч. Есть данные, которые свидетельствуют о том, что нетоз может развиваться по АФК-независимому механизму и значительно быстрее – за 10–30 мин (Pilsczek et al., 2010; Rochael et al., 2015; Díaz-Godínez et al., 2018). Механизм АФК-независимого нетоза, называемого ранним (быстрым) нетозом, изучен недостаточно. Ранее было показано, что стеариламин (СА), введенный в липосомы из фосфатидилхолина (ФХ-СА-липосомы), вызывает образование внеклеточных ловушек нейтрофилов (Лотош и др., 2018).
Цель данной работы – изучение динамики развития нетоза под действием СА, растворенного в ДМСО или включенного в состав липосом, и поэтапное сравнение его с нетозом, индуцированным ФМА.
МАТЕРИАЛ И МЕТОДИКА
Реагенты. В работе использовали: соевый ФХ (Lipoid GmbH, Германия); СА, ФМА, DPI (Sigma-Aldrich, Германия); апоцинин (4'-гидрокси-3'-метокси-ацетофенон; CarlRoth, Германия); люминол и акридиновый оранжевый (ДИАЭМ, Россия); раствор Хенкса, среду RPMI и фетальную сыворотку (Панэко, Россия), метанол (Lab-Scan, Таиланд), краситель Hoechst 33342 (Thermofisher, США), ДМСО (Факт, Россия), флуоресцентно меченый ФХ (1-Oleoyl-2-[12-[(7-nitro-2-1,3-benzoxadiazol-4-yl)amino]dodecanoyl]-sn-Glycero-3-Phosphocholine, 18 : 1–12 : 0 NBD PC (Avanti Polar Lipids, США).
Выделение нейтрофилов. После информированного согласия доноров была получена венозная кровь, нейтрофилы выделяли центрифугированием в градиенте плотности фиколла (1.077 и 1.119 г/см3) по описанной методике (Malech et al., 2012), далее клетки суспендировали в растворе Хенкса (содержащем глюкозу, соли Са2+ и Mg2+). Для микроскопического исследования проводили гипотонический лизис эритроцитов, клетки суспендировали в среде RPMI 1640, содержащей 1% фетальной сыворотки. Число клеток подсчитывали в камере Горяева. Получали (3–8) × 106 кл./мл.
Липосомы из ФХ в конечной концентрации 2 мг/мл (2.5 мМ) получали методом экструзии в фосфатном буфере, рН 7.4. Липосомы из смеси ФХ и СА (9 : 1 по весу) (ФХ-СА-липосомы) содержали соответственно 0.2 мг/мл СА (0.74 мМ СА). Размер липосом и дзета-потенциал определяли на приборе Zetasizer Nano (Malvern, Англия). Для создания флуоресцентно меченых липосом в их состав включали 5% ФХ, содержащего флуоресцентную метку NBD (ФХ-ФХ*-липосомы и ФХ-СА-ФХ*-липосомы; звездочка означает содержание в липосомах флуоресцентной метки).
Кислородный взрыв нейтрофилов оценивали методом люминол-зависимой ХЛ с помощью хемилюминометра Lum-1200 (ДИСофт, Россия). Нейтрофилы ((1–4) × 105) инкубировали в растворе Хенкса (37°С, 15 мин) с 0.2 мг/мл СА (растворен в ДМСО, содержание ДМСО в образце 2%) или 2% ДМСО в присутствии 10 мкМ люминола, затем клетки стимулировали ФМА (40 нМ) и оценивали хемилюминесценцию.
Флуоресцентная микроскопия. Нейтрофильные внеклеточные ловушки визуализировали с помощью флуоресцентного конфокального микроскопа FluoView Olympus 10i (Япония). Нейтрофилы ((2–5) × × 105 клеток) культивировали в среде RPMI 1640 в 96-луночном планшете (Медполимер, Россия) при 37°С в присутствии СА в конечной концентрации 0.2 мг/мл (содержание ДМСО 2%), или 40 нМ ФМА (содержание ДМСО 2%), или 2% ДМСО. Через определенные промежутки времени (30, 60, 90 и 120 мин) клетки отбирали, наносили на предметное стекло с L-полилизином, фиксировали метанолом. Ядра окрашивали с помощью акридинового оранжевого (0.1 мг/мл в PBS, pH 3.4). Микроскопию живых клеток проводили в режиме реального времени в чашках Петри для конфокальной микроскопии (SPL, Корея) в среде RPMI 1640 при температуре камеры микроскопа 37°С. В этом случае ядра окрашивали 10 мкМ Hoechst 33 342.
Ингибиторный анализ. Для ингибирования NADPH-оксидазы нейтрофилы предварительно инкубировали в среде RPMI 1640 (37°С, 15 мин) с 200 мкМ апоцинина или 10 мкМ DPI; для катализирования пероксида водорода – с каталазой. Во всех пробах присутствовало 10 мкМ люминола. Затем добавляли ФХ- или ФХ-СА-липосомы, или ФМА и исследовали клетки с помощью флуоресцентной микроскопии.
РЕЗУЛЬТАТЫ
Кислородный взрыв нейтрофилов. Использовали метод люминол-зависимой ХЛ. К выделенным нейтрофилам в растворе Хенкса добавляли СА в конечной концентрации 0.2 мг/мл (содержание ДМСО 2%) и люминол (10мкМ), инкубировали 15 мин при 37°С, затем клетки стимулировали ФМА (40 нМ).
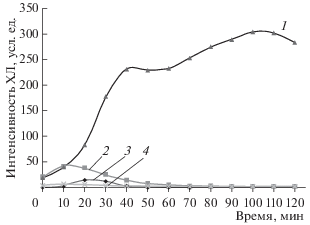
Таким же образом оценивали влияние СА на спонтанную ХЛ (без стимуляции ФМА). ДМСО (2%) не оказывал влияния на интенсивность кислородного взрыва, вызванного ФМА (данные не представлены). Исследование нейтрофилов, выделенных из 5 образцов крови здоровых добровольцев, показало, что СА в концентрации 0.2 мг/мл не оказывал стимулирующего действия на нейтрофилы, т.е. не вызывал кислородного взрыва. Кроме того, СА полностью подавлял как спонтанную ХЛ нейтрофилов, так и кислородный взрыв, вызванный ФМА. (рис. 1).
Рис. 1.
Влияние стеариламина (СА) на кислородный взрыв нейтрофилов, определяемый методом люминол-зависимой хемилюминесценции (ХЛ). Кривые: 1 – кислородный взрыв нейтрофилов, стимулированных 40 нМ ФМА, 2 – спонтанная ХЛ нейтрофилов (без стимуляции ФМА), 3 – кислородный взрыв нейтрофилов, стимулированных 40 нМ ФМА в присутствии 0.2 мг/мл СА, 4 – спонтанная ХЛ нейтрофилов в присутствии 0.2 мг/мл СА. Число клеток в каждой пробе 2 × 105, во всех пробах присутствует 2% ДМСО.
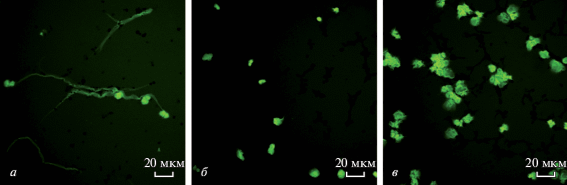
Нейтрофильные внеклеточные ловушки выявляли методом флуоресцентной микроскопии. Нейтрофилы инкубировали в среде RPMI 1640 при 37°C с СА, растворенным в ДМСО, в контрольных образцах содержалось 2% ДМСО. В качестве контрольной способности клеток к образованию ловушек использовали ФМА – известный индуктор классического нетоза (40 нм в присутствии 2% ДМСО). Присутствие 2% ДМСО в среде в течение 180 мин не приводило к разрушению клеток и их структурным и морфологическим изменениям (данные не представлены). Добавление 0.2 мг/мл СА во всех случаях вызывало образование внеклеточных ловушек нейтрофилами. В присутствии СА ловушки образовывались гораздо быстрее, чем при активации ФМА, и в их образовании участвовала большая процентная доля клеток. На рис. 2 представлены фотографии нейтрофилов, выделенных из крови двух доноров: рис. 2а, 2б – донор № 1, рис. 2в, 2г – донор № 2. В первом случае нейтрофилы инкубировали с СА 30 мин, во втором – 90 мин. Во всех случаях нейтрофилы, инкубированные с СА, образовывали ловушки которые имели вид длинных тонких нитей ДНК (рис. 2б, 2г).
Рис. 2.
Образование внеклеточных ловушек нейтрофилами в присутствии СА. Нейтрофилы выделены из крови двух доноров. Донор 1: а, б – клетки инкубировали 30 мин в присутствии 40 нМ ФМА (контроль) и 0.2 мг/мл СА соответственно. Донор 2: в, г – клетки инкубировали 90 мин в присутствии 40 нМ ФМА (контроль) и 0.2 мг/мл СА соответственно. Клетки инкубировали в среде RPMI 1640 при 37°С, во всех пробах присутствует 2% ДМСО. Масштабная линейка: 20 мкм.
На рис. 2б (донор № 1) видно, что за 30 мин действия СА практически все клетки образовали ловушки, в то время как в нейтрофилах, стимулированных ФМА, процесс нетоза развивался медленнее и через 30 мин он был еще незаметен, т.к. сохранялись целостность клеток и дольчатое строение ядра (рис. 2а). Из рис. 2в (донор № 2) следует, что действие ФМА в течение 90 мин вызывает образование ловушек в меньшей степени (участвует около 10% клеток), чем СА за то же время (участвует около 50% клеток) (рис. 2г). Аналогичные результаты – более быстрое образование ловушек нейтрофилами, инкубированными с СА, по сравнению со стимуляцией ФМА – были получены на нейтрофилах, выделенных из крови еще трех добровольцев.
Итак, при действии на нейтрофилы СА не происходит синтеза АФК, но развиваются ловушки. По сравнению с ФМА, ловушки в присутствии СА развиваются быстрее (90–180 и 30–90 мин соответственно) и в процессе их образования задействовано большее количество клеток.
ФХ-СА-липосомы вызывают образование нейтрофильных внеклеточных ловушек. Поскольку СА плохо растворим в воде, необходимо было оценить влияние его растворимой формы на образование ловушек. Для этого СА включали в состав липосом из ФХ. Использовали ФХ-СА-липосомы, содержащие 1.8 мг/мл ФХ и 0.2 мг/мл СА. В качестве контроля использовали “пустые” липосомы из ФХ (ФХ-липосомы). Диаметр липосом составлял 140 ± 49 нм. Дзета-потенциалы ФХ-липосом и ФХ-СА-липосом были равны –(1.74 ± 0.31) и 11.4 ± 0.44 мВ соответственно.
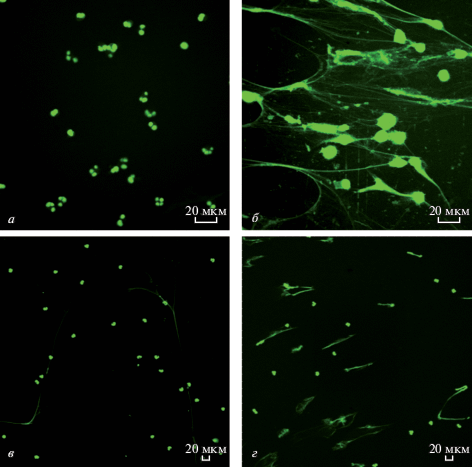
Нейтрофилы ((2–5) × 105 клеток) инкубировали с ФХ-СА- и ФХ-липосомами в среде RPMI 1640 в течение 30 или 90 мин при 37°С. Клеточную взвесь наносили на стекло с L-полилизином, фиксировали метанолом, ДНК окрашивали акридиновым оранжевым, клетки наблюдали с помощью флуоресцентной микроскопии. Установили, что присутствие в среде ФХ-СА-липосом, так же, как и с СА, растворенного в ДМСО, сопровождалось образованием нейтрофильных ловушек, в то время как ФХ-липосомы не приводили к каким-либо морфологическим изменениям клеток, как это было показано ранее (Лотош и др., 2018). На рис. 3а, 3б, 3в приводятся результаты исследования нейтрофилов, выделенных из крови трех добровольцев. На рис. 3г представлены результаты инкубирования клеток с ФХ-липосомами (контроль).
Рис. 3.
Образование внеклеточных ловушек нейтрофилами (от трех доноров) в присутствии липосом из фосфатидилхолина, содержащих СА (ФХ-СА-липосом) в течение 30 (а, б, донор 1, 2 соответственно) и 90 (в, донор 3) мин. г – Контроль, клетки инкубированы с ФХ-липосомами в течение 90 мин. Во всех случаях клетки инкубировали в среде RPMI 1640 при 37°С. Масштабная линейка: 20 мкм.
Итак, как и в случае с раствором СА в ДМСО (рис. 2б, 2г), ФХ-СА-липосомы вызывали быстрое (по сравнению с ФМА) образование нейтрофильных внеклеточных ловушек. Ловушки были в виде как длинных тонких нитей ДНК (рис. 3а, 3в), так и облакоподобных структур (рис. 3б). Из рис. 3а, 3б (два разных случая) видно, что через 30 мин взаимодействия с ФХ-СА-липосомами большинство нейтрофилов уже образовали ловушки. В третьем случае (рис. 3в) при большем времени наблюдения (90 мин) все клетки образовали нитеобразные ловушки, в то время как контрольные ФХ-липосомы такого действия не оказывали (рис. 3г).
Итак, СА, включенный в липосомы, действует на нейтрофилы так же, как и раствор СА в ДМСО – вызывает быстрый (по сравнению с ФМА) нетоз. Механизм действия СА отличен от механизма действия ФМА, поскольку СА не индуцирует кислородный взрыв.
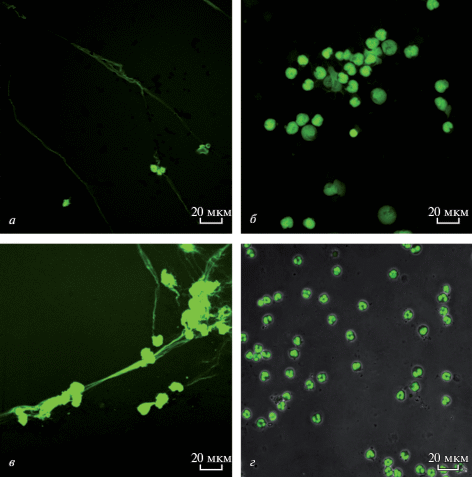
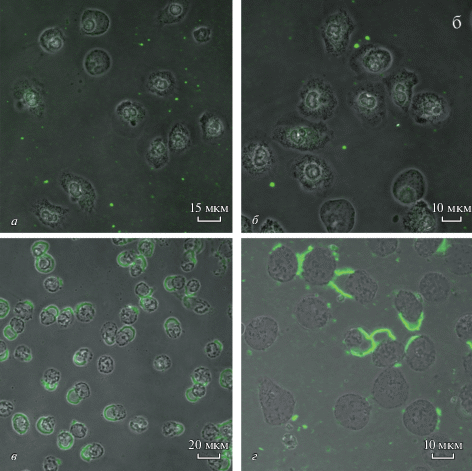
Чтобы визуализировать взаимодействие ФХ-СА-липосом с нейтрофилами, использовали флуоресцентно меченные липосомы, содержащие 5% ФХ, меченного флуоресцентным красителем NBD (ФХ-СА-ФХ*-липосомы (1.7 : 0.2 : 0.1)). В качестве контроля использовали флуоресцентно меченые ФХ-ФХ*-липосомы (0.9 : 0.1). Взаимодействие наблюдали на живых (т.е. не фиксированных) клетках в режиме реального времени с помощью конфокальной флуоресцентной микроскопии. Нейтрофилы в среде RPMI 1640, нанесенные на чашки Петри для конфокальной микроскопии, выдерживали 10 мин при 37°С для адсорбции клеток. Затем добавляли ФХ-СА-ФХ*-липосомы или ФХ-ФХ*-липосомы. Живые клетки фотографировали через определенные промежутки времени при температуре камеры микроскопа 37°С. На рис. 4 представлено взаимодействие липосом с нейтрофилами. На рис. 4а, 4б липосомы видны во внеклеточном пространстве в виде отдельных светящихся точек (зеленые), т.е. взаимодействие нейтрофилов с ФХ-ФХ*-липосомами отсутствует. Представленный снимок сделан через 120 мин после добавления ФХ-ФХ*-липосом, на протяжении этого времени взаимодействия, т.е. адсорбции липосом на цитоплазматической мембране клеток, не происходило, на основании чего можно сделать вывод о том, что контрольные липосомы из ФХ при инкубации с клетками остаются интактными. На рис. 4в, 4г представлено взаимодействие клеток с ФХ-СА-ФХ*-липосомами. На фотографиях видно, что ФХ-СА-ФХ*-липосомы адсорбируются на поверхности цитоплазматической мембраны, образуя окружность, т. о. происходит прямое взаимодействие положительно заряженных липосом, содержащих СА, с клеткой.
Рис. 4.
Взаимодействие с нейтрофилами липосом, не содержащими (а, б) и соодержащими (в, г) СА. Конфокальная флуоресцентная микроскопия. Клетки инкубировали в среде RPMI при 37°С 120 мин с флуоресцентно мечеными (ФХ*) липосомами (зеленое свечение): а, б – инкубация с ФХ-ФХ*-липосомами; в, г – инкубация с ФХ-СА-ФХ*-липосомами. Масштабная линейка: 15 (а), 10 (б, г) и 20 (в) мкм.
Далее изучали динамику связывания ФХ-СА-ФХ*-липосом и динамику развития нетоза. Клетки в среде RPMI 1640 сорбировали на чашках Петри для конфокальной микроскопии, затем среду удаляли и добавляли ДНК-краситель Hoechst 33 342 в среде RPMI 1640, инкубировали 10 мин при 37°С для окрашивания ДНК, затем добавляли ФХ-СА-ФХ*-липосомы. Живые клетки фотографировали через определенные промежутки времени при температуре камеры микроскопа 37°С. Динамика связывания таких липосом представлена на рис. 5, из которого видно, что ФХ-СА-ФХ*-липосомы адсорбируются на поверхности клеток постепенно, и их количество увеличивается с увеличением времени инкубации. Обращает на себя внимание тот факт, что сначала флуоресцентно-меченные липосомы адсорбируются локально, на отдельном сегменте клеточной мембраны, образуя флуоресцентные полуокружности. И только при увеличении времени инкубации до полутора часов флуоресцентные липосомы адсорбировались на всей окружности мембраны.
Рис. 5.
Развитие нетоза при взаимодействии нейтрофилов с липосомами, содержащими СА. Конфокальная флуоресцентная микроскопия в режиме реального времени. Клетки инкубировали с флуоресцентно мечеными ФХ-СА-ФХ*-липосомами (зеленое свечение) в течение 125 мин и фотографировали через определенные промежутки времени. Ядра окрашивали красителем Hoechst 33 342. Масштабная линейка: 20 мкм.
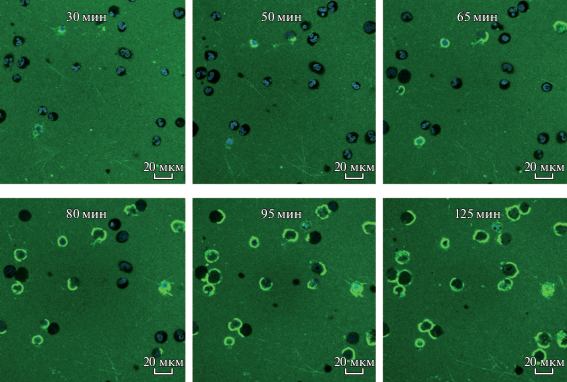
Наблюдая развитие нетоза в клетках, ядро которых было окрашено Hoechst 33342, установили, что уже через 30 мин клетки, инкубированные с ФХ-СА-липосомами, округлялись. В течение 40–65 мин хроматин деконденсировался и смешивался с содержимым цитоплазмы, которая равномерно окрашивалась красителем на ДНК. Через 80–95 мин все клетки претерпевали изменения, характерные для нетоза.
Из полученных результатов можно сделать вывод, что ФХ-липосомы, в отличие от СА-липосом, не взаимодействуют с плазматической мембраной и не индуцируют нетоз, а адсорбция СА-липосом происходит неравномерно, на отдельных участках мембраны нейтрофилов, и сопровождается развитием нетоза.
При сопоставлении литературных и собственных данных можно сделать вывод, что динамика развития ловушек и морфологические изменения в клетках схожи с описанными в литературе для ФМА, однако отсутствие кислородного взрыва указывает на реализацию иного механизма развития ловушек, отличного от АФК-зависимого (Goldmann, Medina, 2013). Для подтверждения этого предположения мы изучили действие известных блокаторов НАДФН-оксидазы (апоцинина и DPI) и фермента каталазы, катализирующего разложение пероксида водорода, на появление ловушек при инкубации нейтрофилов с ФХ-СА-липосомами. Нейтрофилы предварительно инкубировали (в растворе Хенкса для определения кислородного взрыва или в среде RPMI для выявления ловушек) с апоцинином (200 мкМ), или DPI (10 мкМ), или каталазой (2000 ед/мл) в течение 10 мин при 37°С, затем добавляли ФХ-СА-липосомы. В контрольных экспериментах подтвердили, что ингибиторы НАДФН-оксидазы и каталаза блокируют кислородный взрыв и образование ловушек под действием ФМА (данные не приводятся). В случае ФХ-СА-липосом результат оказался прямо противоположным: ни каталаза, ни апоцинин, ни DPI не подавляли образование ловушек, вызванных ФХ-СА-липосомами (рис. 6). Это подтверждает сделанное выше предположение о механизме развития ловушек, не требующем АФК, синтезируемых НАДФН-оксидазой. Это означает, что нетоз при действии ФХ-СА-липосом идет по NOX2-независимому механизму.
ОБСУЖДЕНИЕ
Для изучения нетоза наиболее часто используется химический активатор ФМА. Хронология нетоза, индуцированного ФМА, изучена довольно подробно. Есть даже видео этого процесса, которое сняли авторы, изучавшие нетоз, стимулированный ФМА, в течение 3 ч на живых клетках постадийно (Fuchs et al., 2007). Другими авторами было установлено, что через 10 мин после добавления стимула падает митохондриальный мембранный потенциал и начинается вакуолизация (Remijsen et al., 2011), далее в течение 1–1.5 ч после стимуляции клетки округляются, становятся плоскими, происходит смешение гетеро- и эухроматина, ядро теряет сегментированную структуру, хроматин деконденсируется, внутренний и внешний листки ядерной мембраны отделяются друг от друга, распадаются мембраны гранул цитоплазмы, в том числе азурофильных гранул, содержащих эластазу и миелопероксидазу (МПО). Через 2 ч действия ФМА ядерные мембраны формируют отдельные везикулы, через 3 ч ядерная оболочка распадается на многочисленные мелкие везикулы, вся клетка заполняется хроматином, нуклеоплазма и цитоплазма сливаются в гомогенную массу (Brinkmann, Zychlinsky, 2012). В присутствии ДНК-красителя вся клетка представляет собой равномерно окрашенное пятно и ядро не визуализируется. В завершение (через 3–4 ч) происходит прорыв клеточной мембраны и очень быстрый, в течение 3–5 мин, выброс внутриклеточного содержимого (Fuchs et al., 2007), т.е., образование внеклеточных ловушек, в составе которых находятся ДНК, гистоны, ферменты гранул, в том числе эластаза и МПО, бактерицидные пептиды (Воробьева, Пинегин, 2014). Они образуют во внеклеточном пространстве гелеобразную сеть из фибрилл, которые видны на электронных микрофотографиях (Brinkmann et.al., 2004).
Биологическая значимость этого процесса заключается в том, что бактерии задерживаются в образовавшейся сети из белков и нуклеиновых кислот за счет электростатического взаимодействия положительно заряженной структуры ловушек с отрицательно заряженными бактериями (Goldmann, Medina, 2013), благодаря чему блокируется их дальнейшее распространение по организму. Такие драматические изменения морфологии клетки являются следствием взаимосвязанных биохимических процессов: кислородного взрыва, повышения уровня Са2+, активации фермента PAD4 (Neeli et al., 2008), который в гистоне Н3 превращает аргинин в цитруллин (цитруллинирование гистонов), что приводит к ослаблению связи гистонов с ДНК и деконденсации хроматина.
Известно, что ФМА, непосредственно стимулирующий протеинкиназу С, вызывает образование АФК, а в присутствии антиоксидантов ингибируется как кислородный взрыв, так и развитие ловушек (Vorobjeva, Pinegin, 2016). Кроме того, такая форма АФК, как пероксид водорода, способна стимулировать образование ловушек даже нейтрофилами доноров с хронической гранулематозной болезнью, при которой нейтрофилы не способны к кислородному взрыву и нетозу (Goldmann, Medina, 2013). Присутствие эндогенной каталазы, разлагающей пероксид водорода, блокирует нетоз в клетках, стимулированных ФМА (Fuchs et.al., 2007). Ингибирование НАДФН-оксидазы DPI или апоцинином также предотвращает образование АФК и, соответственно, образование ловушек (Fuchs et al., 2007; Remijsen et al., 2011; Stoiber et al., 2015). Эти данные позволили сделать заключение, что АФК необходимы для развития нетоза, который протекает по так называемому NOX2-зависимому пути, называемому “классическим”. Пока механизм такого сопряжения неизвестен. Были высказаны разные предположения о роли АФК: они вызывают инактивацию каскада каспаз, что предотвращает развитие апоптоза (Goldmann, Medina, 2013) или способствуют выходу нейтрофильной эластазы из гранул и ее миграции в ядро, где эластаза расщепляет гистоны, способствуя деконденсации хроматина (Papayannopoulos et al., 2010).
Однако в последнее время появились данные об иных механизмах нетоза, отличных от классического, вызванного ФМА. В настоящей работе такой механизм обозначен как “неклассический” нетоз. Отличия от классического нетоза состоят в том, что выброс ДНК происходит значительно быстрее – через 5–60 мин, например, при стимуляция нейтрофилов катионными липосомами (Hwang et al., 2015), простейшими, ионофором кальция (Díaz-Godínez et al., 2018; Rochael et al., 2015), S. aureus (Pilsczek et al., 2010) или при активации тромбоцитами рецептора TLR4 нейтрофилов (Clark et al., 2007). Этот тип нетоза называют быстрым или ранним. Кроме того, описывается “витальный”, или “везикулярный” (против “суицидального” или “литического”) тип нетоза, при котором ядро быстро распадается на везикулы (de Buhr et al., 2016) и выбрасывается митохондриальная ДНК (Díaz-Godínez et al., 2018) с сохранением жизнеспособности клетки (Pilsczek et al., 2010; de Buhr et al., 2016).
Существенное отличие нетоза “неклассического” от “классического” в том, что он независим от АФК (Pilsczek et al., 2010; Yipp, Kubes, 2013; Rochael et al., 2015; Díaz-Godínez et al., 2018) и не блокируется апоцинином. Объединяет оба типа нетоза то, что клетка претерпевает схожие изменения морфологии ядра и гранул: эластаза мигрирует в ядро, происходит цитруллирование гистонов, ядро теряет сегментированность. В составе ловушек присутствуют эластаза, МПО, гистоны, антимикробные пептиды.
Таким образом, нетоз может происходить с помощью различных механизмов: 1) классического образования ловушек посредством клеточного лизиса; 2) везикулярного способа выброса ядерной ДНК с сохранением жизнеспособности клеток; и 3) высвобождения митохондриальной ДНК с сохранением жизнеспособности клеток (de Buhr, et al., 2016). Анализ литературных данных позволяет сделать заключение, что механизм нетоза варьирует в зависимости от способа стимуляции клеток (непосредственно через мембрану либо через какой-либо рецептор).
Анализ полученных результатов по образованию ловушек нейтрофилами под действием раствора СА в ДМСО и ФХ-СА-липосом позволяет утверждать, что в этом случае нетоз проходит те же выше описанные классические этапы: ядро теряет сегментацию, клетка округляется, ядро смешивается с компонентами цитозоля и вся клетка выглядит как равномерно окрашенная поверхность по окружности которой располагаются СА-ФХ-липосомы (рис. 5). В конце концов происходит прорыв клеточной мембраны и ядерный материал в виде длинных нитей или облаков секретируется наружу. Однако есть отличия: кислородный взрыв отсутствует (не регистрируется методом люминол-зависимой ХЛ), ингибиторы НАДФН-оксидазы (апоцинин и DPI) не блокируют нетоз, а сам процесс нетоза происходит значительно быстрее по сравнению с этим же процессом, индуцированным ФМА.
Механизм действия СА на нейтрофилы изучали ранее и авторы установили, что длинноцепочечные алкиламины, в том числе СА, ингибируют кислородный взрыв нейтрофилов за счет блокирования сборки НАДФН-оксидазы (Sawai et al., 1999). Следует учитывать, что СА представляет собой амфифильную молекулу, содержащую гидрофобную область – остаток насыщенной жирной кислоты (18 : 0) и свободную аминогруппу. Анализ литературы показал, что обе части молекулы могут участвовать во взаимодействии с нейтрофилами. С одной стороны, было установлено взаимодействие остатка жирной кислоты со специфическим рецептором на плазматической мембране нейтрофилов (Mena et al., 2016); связывание с этим рецептором ненасыщенных длинноцепочечных жирных кислот приводило к усилению фосфорилирования белков из-за активации ряда протеинкиназ, активации СОХ-2, экспрессии ИЛ-8 и секреции металлопротеиназы-9. Именно взаимодействием с рецептором можно объяснить образование флуоресцирующего слоя ФХ-СА-ФХ*-липосом на поверхности плазматической мембраны нейтрофилов.
С другой стороны, соединения, содержащие не только остаток жирной кислоты, но и свободную аминогруппу, также влияли на функциональную активность нейтрофилов. Так, показано, что независимо от стимула (хемотаксический пептид, диацилглицерин, ФMA, опсонизированный зимозан или арахидоновая кислота), сфинганин – алифатический спирт, содержащий насыщенную углеводородную цепь C18 и аминогруппу – блокирует кислородный взрыв нейтрофилов (Wilson et al., 1986). Предполагается, что блокирование происходит через протеинкиназу С, но не путем ингибирования НАДФН оксидазы. В этой же работе подчеркивается, что особенности структуры ингибиторов кислородного взрыва состоят в наличии длинной алифатической цепи и амина в головной группе.
Подводя итог полученным результатам, можно сделать вывод о том, что нетоз, индуцированный СА, развивается по АФК-независимому механизму.
Список литературы
Воробьева Н.В., Пинегин Б.В. 2014. Нейтрофильные внеклеточные ловушки: механизмы образования, роль в норме и при патологии. Биохимия. 79(12) : 1580–1591. (Vorobjeva N.V., Pinegin B.V. 2014. Neutrophil extracellular traps: mechanisms of formation and role in health and disease. Biochemistry. 79(12) : 1286–1580.)
Лотош Н.Ю., Алясева С.О., Малашенкова И.К., Сорокоумова Г.М., Василов Р.Г., Селищева А.А. 2018. Катионные липосомы вызывают кислородный взрыв нейтрофилов и образование внеклеточных ловушек. Биологические мембраны. 35(6) : 448–459. (Lotosh N.Y., Aliaseva S.O., Malashenkova I.K., Sorokoumova G.M., Vasilov R.G., Selischeva A.A. 2019. Cationic liposomes cause ros generation and release of neutrophil extracellular traps. Biochemistry (Moscow), Supplement Series A: Membrane Cell Biol. 13(1) : 40–49.)
Brinkmann V., Reichard U., Goosmann C., Fauler B., Uhlemann Y., Weiss D.S., Weinrauch Y., Zychlinsky A. 2004. Neutrophil extracellular traps kill bacteria. Science. 303 : 1532–1535.
Brinkmann V., Zychlinsky A. 2012. Neutrophil extracellular traps: is immunity the secondfunction of chromatin? J. Cell Biol. 198 : 773–783.
Clark S.R., Ma A.C., Tavener S.A., McDonald B., Goodarzi Z., Kelly M.M., Patel K.D., Chakrabarti S., McAvoy E., Sinclair G.D., Keys E.M., Allen-Vercoe E., Devinney R., Doig C.J., Green F.H., Kubes P. 2007. Platelet TLR4 acti-vates neutrophil extracellular traps to ensnare bacteria in septic blood. Nat. Med. 13 : 463–469.
De Buhr, von Köckritz-Blickwede N., von Köckritz-Blickwede M. 2016. How neutrophil extracellular traps become visible. J. Immunol. Res. 2016(3) : 1–13.
Díaz-Godínez C., Fonseca Z., Néquiz M., Laclette J.P., Rosales C., Carrero J.C. 2018. Entamoeba histolytica Trophozoites induce a rapid non-classical NETosis. Mechanism independent of NOX2-derived reactive oxygen species and PAD4 activity. Front. Cell. Infect. Microbiol. 8 : 184. doi https://doi.org/10.3389/fcimb.2018.00184
Fuchs T.A., Abed U., Goosmann C., Hurwitz R., Schulze I., Wahn V., Weinrauch Y., Brinkmann V., Zychlinsky A. 2007. Novel cell death program leads to neutrophil extracellular traps. J. Cell Biol. 176 : 231–241.
Goldmann O., Medina E. 2013. The expanding world of extracellular traps: not only neutrophils but much more. Front. Immunol. 3: 420. doi https://doi.org/10.3389/fimmu.2012.00420
Hu Z., Murakami T., Tamura H., Reich J., Kuwahara-Arai K., Iba T., Tabe Y., Nagaoka I. 2017. Neutrophil extracellular traps induce IL-1β production by macrophages in combination with lipopolysaccharide. Int. J. Mol. Med.39 : 549–558.
Hwang T.L., Hsu C.Y., Aljuffali I.A., Chen C.H., Chang Y.T., Fang J.Y. 2015. Cationic liposomes evoke proinflammatory mediator release and neutrophil extracellular traps (NETs) toward human neutrophils. Colloids. Surf. B Biointerfaces. 128 : 119–126.
Malech H.L., DeLeo F.R., Quinn M.T. 2012. The role of neutrophils in the immune system: An overview. In: Neutrophil methods and protocols. N.-Y. City: Humana Press. 3–13.
Mena S.J., Manosalva C., Carretta M.D., Teuber S., Olmo I., Burgos R.A., Hidalgo M.A. 2016. Differential free fatty acid receptor-1 (FFAR1/GPR40) signalling is associated with gene expression orgelatinase granule release in bovine neutrophils. Innate Immun. 22 : 479–489.
Neeli I., Khan S.N., Radic M. 2008. Histone deimination as a response to inflammatory stimuli in neutrophils. Immunol. 180 : 1895–902.
Papayannopoulos V., Metzler K.D., Hakkim A., Zychlinsky A. 2010. Neutrophil elastase and myeloperoxidase regulate the formation of neutrophil extracellular traps. J. Cell Biol. 191 : 677–691.
Pilsczek F.H., Salina D., Poon K.K., Fahey C., Yipp B.G., Sibley C.D., Robbins S.M., Green F.H., Surette M.G., Sugai M., Bowden M.G., Hussain M., Zhang K., Kubes P.J. 2010. A novel mechanism of rapid nuclear neutrophil extracellular trap formation in response to Staphylococcus aureus. J. Immunol. 185 : 7413–7425.
Ramos-Kichik V., Mondragon-Flores R., Mondragon-Castelan M., Gonzalez-Pozos S., Muniz-Hernandez S., Rojas-Espinosa O. 2009. Neutrophil extracellular traps are induced by Mycobacterium tuberculosis. Tuberculosis. 89 : 29–37.
Remijsen Q., Vanden Berghe T., Wirawan E., Asselbergh B., Parthoens E., De Ryck R., Noppen S., Delforge M., Willems J., Vandenabeele P. 2011. Neutrophil extracellular trap cell death requires bothautophagy and superoxide generation. Cell. Res. 21 : 290–304.
Rochael N.C., Guimarães-Costa A.B., Nascimento M.T., DeSouza-Vieira T.S., Oliveira M.P., Garcia e Souza L.F., Oliveira M.F., Saraiva E.M. 2015. Classical ROS-dependent and early/rapid ROS-independent release of neutrophil extracellular traps triggered by Leishmania parasites. Sci. Rep. 5 : 18 302. doi https://doi.org/10.1038/srep18302
Sawai T., Asada M., Nishizawa Y., Nunoi H., Katayama K. 1999. Inhibition by alkylamines of NADPH oxidase through blocking the assembly of enzyme components. Jpn. J. Pharmacol. 80 : 237–242.
Stoiber W., Obermayer A., Steinbacher P., Krautgartner W.D. 2015. The role of reactive oxygen species (ROS) in the formation of extracellular traps (ETs) in humans. Biomolecules. 5 : 702–723.
Urban C.F., Reichard U., Brinkmann V., Zychlinsky A. 2006. Neutrophil extracellular traps capture and kill Candida albicans yeast and hyphal forms. Cell. Microbiol. 8 : 668–676.
Vorobjeva N.V., Pinegin B.V. 2016. Effects of the antioxidants Trolox, Tiron and Tempol onneutrophil extracellular trap formation. Immunobiol. 221 : 208–219.
Wilson E., Olcott M.C., Bell R.M., Merrill A.H.Jr., Lambeth J.D. 1986. Inhibition of the oxidative burst in human neutrophils bysphingoid long-chain bases. Role of protein kinase C in activation of the burst. J. Biol. Chem. 261 : 12 616–12 623.
Yipp B.G., Kubes P. 2013. NETosis: how vital is it? Blood. 122 : 2784–2794.
Дополнительные материалы отсутствуют.