Цитология, 2019, T. 61, № 4, стр. 286-300
Влияние основного фактора роста фибробластов на сигнальные пути в клетках ретинального пигментного эпителия человека
А. В. Кузнецова 1, *, Л. А. Ржанова 1, А. М. Куринов 1, М. А. Александрова 1
1 Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, Россия
* E-mail: avkuzn@list.ru
Поступила в редакцию 15.10.2018
После доработки 29.12.2018
Принята к публикации 16.01.2019
Аннотация
Ретинальный пигментный эпителий (РПЭ) играет ключевую роль в развитии многих заболеваний глаз, проявляющихся нарушением зрения и даже слепотой. Использование клеточных культур для моделирования изменений РПЭ позволяет изучать стимулирующие их факторы и сигнальные пути, координирующие клеточные и молекулярные механизмы межклеточных взаимодействий в условиях патологии. Кроме того, появляется возможность определить мишени и разработать специфическую терапию, эффективно нацеленную на устранение патологических изменений в сетчатке. На основе результатов ранее полученных экспериментальных данных о понижении уровня дифференцировки клеток РПЭ в сторону нейроэпителия после однократного воздействия на них оФРФ было продолжено исследование в этом направлении и изучены изменения в Wnt-, BMP- и Notch-сигнальных путях, что необходимо для более глубокого понимания механизмов, понижающих уровень дифференцировки клеток РПЭ. Так, после добавления фактора в культуре отмечено снижение иммуноцитохимического окрашивания на β-катенин, усиление окрашивания на Wnt7a, ВМР2 и ВМР7 и изменение локализации ВМР4. Кроме того, методом количественной ПЦР в реальном времени в клетках РПЭ, обработанных оФРФ, выявлено увеличение экспрессии мРНК BMP2, снижение экспрессии мРНК CTNNB1, ВМР4, ВМPR2, а также мРНК генов Notch сигнального пути: JAG1, NOTCH1, HES1 и HEY1. Анализ полученных данных свидетельствует об инактивации Wnt/β-катенин- и Notch-сигнальных путей, активации неканонического Wnt/PCP-сигнального пути и модулировании ВМР-сигналинга в клетках РПЭ взрослого человека на ранних сроках действия оФРФ, что приводит к понижению уровня их дифференцировки. Таким образом, полученные результаты уточняют механизмы дедифференцировки клеток РПЭ под влиянием оФРФ.
Ретинальный пигментный эпителий (РПЭ) представляет собой монослой сильнопигментированных клеток, располагающихся между фоторецепторами сетчатки и сосудистой оболочкой глаза. У взрослых позвоночных клетки РПЭ относятся к окончательно дифференцированным, которые в нормальных условиях обладают крайне низкой митотической активностью (Al-Hussaini et al., 2008), однако при повреждении или экспериментальной активации способны к делению, что приводит к регенерации сетчатки у амфибий (Chiba et al., 2006) и является причиной разнообразных патологий зрения у человека (Yang et al., 2015). Установлено, что одним из факторов, высвобождаемым из клеток внутреннего ядерного слоя и ганглиозных клеток нейральной сетчатки при действии различных повреждающих факторов (гипоксии, нарушения метаболизма, травмы, повреждения лазером) является основной фактор роста фибробластов (оФРФ) (Wen et al., 1995; Cao et al., 1997). Освобожденный оФРФ активирует клетки РПЭ, они теряют контакты, пролиферируют, депигментируются, приобретают способность к миграции, экспрессируют нехарактерные белки, т.е. дедифференцируются, и у низших позвоночных дифференцируются в клетки нейральной сетчатки, регенерируя ее (Григорян и др., 2013; Luz-Madrigal et al., 2014), тогда как у человека подвергаются эпителио-мезенхимному переходу (ЭМП), участвуя в формировании эпиретинальных или субретинальных мембран, что приводит к нарушению зрения (Frank et al., 1996). Многие исследователи связывают такое поведение клеток РПЭ с их эволюционно консервативной пластичностью, в результате которой происходит активация свойств мультипотентных стволовых клеток (СК). Способность к изменению своего фенотипа клетки РПЭ сохраняют и in vitro (Кузнецова и др., 2011; Милюшина и др., 2011), что открывает возможность для исследования молекулярных механизмов де- и трансдифференцировки специализированных клеток. Эти сведения важны для раскрытия фундаментальных процессов развития и регенерации тканей глаза, а также патологических процессов в сетчатке.
оФРФ играет решающую роль в различных биологических процессах, включая рост клеток, выживание, миграцию и дифференцировку, поэтому его используют как конститутивную добавку к ростовой среде при культивировании различных типов СК (Ding et al., 2010; Blauwkamp et al., 2012; Lotz et al., 2013; Nowwarote et al., 2015). Экзогенный оФРФ поддерживает СК в недифференцированном состоянии, модулируя у них Wnt-сигналинг (Ding et al., 2010), что сопровождается увеличением экспрессии плюрипотентных маркеров (Ludwig et al., 2006; Lotz et al., 2013). Известно, что Wnt-сигнальный путь перекрестно взаимодействует с сигнальными путями ВМР и Notch (Urbán, Guillemot, 2014; Kuznetsova et al., 2016). Однако реакция Wnt-, ВМР- и Notch-сигнальных путей на оФРФ в РПЭ взрослого человека изучена мало.
Для изучения влияния экзогенных факторов на сигнальные пути, координирующие клеточные и молекулярные механизмы межклеточных взаимодействий в условиях патологии, используют клеточные модели. В настоящее время существует два основных источника клеток РПЭ человека для культивирования: постоянная линия пигментного эпителия ARPE-19, полученная в результате спонтанной трансформации, и клетки, выделенные из первичного материала (Kuznetsova et al., 2014). Однако иммортализованная клеточная линия РПЭ имеет значимые отличия от линий с ограниченным сроком жизни по поведению и молекулярно-генетическим свойствам клеток (Tian et al., 2005; Baldwin et al., 2014), что может быть связано с потерей важных характеристик, присущих первоисточнику.
Цель настоящей работы – выявить влияние оФРФ на регуляцию Wnt-, BMP- и Notch-сигнальных путей в клетках РПЭ взрослого человека in vitro.
МАТЕРИАЛ И МЕТОДИКА
Культура клеток. Использовали неиммортализованную клеточную линию РПЭ человека, выделенную из глазного яблока взрослого донора в возрасте 50 лет (Кузнецова и др., 2018). Для экспериментов использовали клетки РПЭ 4-го пассажа, которые высаживали на поверхность культуральных флаконов для адгезивных культур Т-25 Greiner CELLSTAR® (Greiner Bio-One GmbH, Германия) в концентрации 104 кл./см2 и культивировали в течение 24, 48 и 72 ч. Для оценки действия оФРФ его добавляли в количестве 20 нг/мл в ростовую среду, состоящую из культуральной среды DMEM/F12 (1 : 1), L-глутамина (2 мM, Sigma-Al-drich, США), 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина (Pan Biotech, Германия) и 1% ЭТС (Gibco, США), культивировали клетки при 37°С и 5% СО2. Контролем служили клетки, культивированные без оФРФ. В течение всего срока культивирования среду не меняли. Клетки фотографировали с помощью микроскопа Olympus (Япония) с цифровой камерой DP70 (Olympus, Япония).
Ранее нами выполнен морфометрический анализ для выявления различий клеток по размеру и форме (Кузнецова и др., 2018). В настоящей работе мы проанализировали размер ядер и ядерно-цитоплазматическое отношение (ЯЦО). Для этого в программе ImageJ1.51j8 (Wayne Rasband, National Institutes of Health, США) на изображениях случайных полей зрения (формат JPEG, размер изображения 1360 × 1024 пикселей), полученных при увеличении объектива микроскопа 20×, вручную с помощью мыши обводили каждую клетку, исключая двуядерные и те клетки, края которых соприкасались с границами изображения. Затем в тех же клетках обводили ядра. Для каждого срока культивирования анализировали от 30 до 60 клеток. Программа автоматически рассчитывала площади проекций клетки и ядра на подложке (далее площадь клетки и площадь ядра соответственно). Площади клетки и ядра были рассчитаны в пикселях без перевода в метрические единицы измерения, поскольку для анализа важны не абсолютные значения, а относительные. ЯЦО для каждой клетки каждого срока рассчитывали как отношение площади ядра к разнице между площадью клетки и площадью ядра (Терюкова и др., 2016). Статистическую обработку полученных показателей, вычисление средних значений, ошибки среднего и коэффициента детерминации (R2, достоверность аппроксимации) проводили с помощью программы Excel 2007 (Microsoft Corporation, США). Достоверность различий средних величин устанавливали с помощью t-критерия Стьюдента при уровне значимости P < 0.05.
Иммуноцитохимический (ИЦХ) анализ. Клетки высаживали на круглые покровные стекла (CellStar, Германия) в 24-луночные планшеты (Greiner Bio-One GmbH, Германия) в концентрации 104 кл./см2 и культивировали в течение 24, 48 и 72 ч в отсутствие (контроль) или в присутствии оФРФ, после чего фиксировали в течение 15 мин 4%-ным параформальдегидом (Sigma-Aldrich). В работе использовали первичные антитела (Abcam, Великобритания) к ВМР2 (ab14933, кроличьи, 1 : 150), ВМР7 (ab54904, мышиные, 1 : 150), β-катенину (ab32572, кроличьи, 1 : 200), и антитела Sigma-Aldrich к ВМР4 (SAB2700755, кроличьи, 1 : 100), Wnt7a (HPA015719, кроличьи, 1 : 100), разведенные в 0.1%-ном растворе БСА (Sigma-Aldrich, США). Препараты экспериментальной и контрольной групп клеток РПЭ обрабатывали параллельно для последующего проведения сравнительного анализа. ИЦХ-анализ препаратов включал: блокировку неспецифического связывания 1%-ным БСА в течение 20 мин, инкубацию с первичными антителами при 4°С в течение ночи, связывание первичных антител с соответствующими вторичными антителами, меченными Alexa Fluor® 488 или 594 флуорохромами, (Molecular Probes, США) в течение 40 мин при комнатной температуре, заключение в среду c ядерным красителем DAPI (Vectashield®, Vector Laboratories, США). Фотографирование препаратов проводили с помощью микроскопа Olympus (Япония) с цифровой камерой DP70 Olympus (Япония). Интенсивность флуоресцентного сигнала и число клеток (ядер) оценивали с помощью программы ImageJ (Wayne Rasband, National Institutes of Health, США) на цифровых изображениях препаратов (RGB, формат JPEG) с разрешением 1360 × 1024 пикселей. Для этого цветные изображения конвертировали в 8-битные, преобразовывая таким образом их в полутоновые с оттенками серого цвета (значения яркости таких изображений варьируют в диапазоне значений от 0 до 255, где черные пиксели имеют значение 0, а белые – 255), далее для сегментирования областей свечения устанавливали порог (Threshold) с помощью автоматического регулятора Triangle и выбирали темный фон (Dark background) (Takeuchi et al., 2012; Jensen, 2013). Затем для измерения суммы яркостей выделенных пикселей, характеризующих интенсивность флуоресценции, использовали величину Integrated Density (Штейн и др., 2016; Штейн, Кудрявцев, 2018). Для количественной оценки интенсивности флуоресценции по каждому маркеру анализировали не менее 300 клеток каждой группы для каждого срока, используя 7–20 микрофотографий независимых полей зрения, полученных при увеличении объектива микроскопа 20×. Статистическую обработку полученных показателей, вычисление средних значений и ошибки среднего проводили с помощью программы Excel 2007 (Microsoft Corporation, США). Для оценки статистической значимости различий между группами использовали t-критерий Стьюдента. Различия считали достоверными при уровне значимости P < 0.05.
Количественная ПЦР в реальном времени (кПЦР). Выделение тотальной РНК из культуры клеток проводили с TRI® Reagent (Sigma-Aldrich) в соответствии с инструкцией фирмы производителя. Для этого лизирующий раствор заливали во флаконы Т25 через 24, 48 и 72 ч после посадки клеток РПЭ в среду с оФРФ или без него (контроль) и их фотографирования. Синтез кДНК проводили с помощью набора RevertAid H Minus Kit (Fermentas, Литва) в объеме 20 мкл, используя 1 мкг тотальной РНК, обработанной ДНКазой.
С помощью кПЦР оценивали изменения уровня экспрессии мРНК следующих генов, кодирующих транскрипционные факторы и сигнальные белки: CTNNB1, GSK3B (праймеры и зонды от ДНК-Синтез, Россия), NOTCH1, JAGGED1 (JAG1), HEY1, HES1, NOGGIN, BMP2, BMP4, BMPR2 (Applied Biosystems, США). В качестве эндогенного контроля использовали глицеральдегид-3фосфатдегидрогеназу (GAPDH) (праймеры и зонд от ДНК-Синтез, Россия). Смесь реагентов для кПЦР (25 мкл) включала в себя 2 мМ MgCl2, 200 мкМ dNTPs, 1 ед Maxima HS Taq-полимеразы (Fermentas, Латвия), 5 мкл разведенной кДНК (эквивалентной 4 нг исходной тотальной РНК), 250 нM праймеров и 250 нM зонда (табл. 1). кПЦР проводили на приборе ABI Prism 7500 PCR system (Applied Biosystems, США). Программа для ПЦР включала: 1 цикл денатурации при 95°C 3 мин, 40 циклов денатурации при 95°C 15 с и совмещенный этап отжига-синтеза при 60°C 1 мин. Пороговый цикл определяли, применяя программное обеспечение 7500 Software v2.0.1 (Applied Biosystems, США). Экспрессию каждой мРНК определяли постановкой ПЦР в двух повторах. Обработка данных qPCR включала в себя усреднение значений Ct для повторных точек в эксперименте и расчет значений относительной экспрессии исследуемых генов методом ∆∆Ct для каждого образца с использованием значения Ct по гену GAPDH в качестве нормирующего. Результаты представлены как средние значения и их ошибка. Для оценки статистической значимости различий между группами использовали t-критерий Стьюдента. Различия считали достоверными при уровне значимости P < 0.05.
Таблица 1.
Список праймеров для количественной ПЦР в реальном времени
| Ген (номер по базе данных) | Последовательность праймеров прямого (F) и обратного (R); зонд или номер по каталогу | Размер ампликона, п. н. |
|---|---|---|
| GAPDH (NM_001289746) |
F: 5'-GAAGGT GAAGGTCGGAGTC-3' R: 5'-GAAGATGGTGATGGGATTTC-3' Зонд: 5’-FAM-CCATCAATGACCCCTTCATTGACC-BHQ1-3' |
220 |
| CTNNB1 (NM_001330729.1) |
F: 5'-CCTCTGATAAAGGCTACTGTTGG-3' R: 5'-GCACGAACAAGCAACTGAACT-3' Зонд: 5'-FAM-CGAAATCTTGCCCTTTGTCCCGC-BHQ1-3' |
115 |
| GSK3B (NM_001146156.1) |
F: 5'-CAAATTAAGGCACATCCTTGGA-3' R: 5'-GCAGACGGCTACACAGTGCA-3' Зонд: 5'-FAM-CTTCCGACCCCGAACTCCACC-BHQ1-3' |
78 |
| JAG1 (NM_000214.2) | Hs01070032_m1 | 72 |
| NOTCH1 (NM_017617.3) | Hs01062014_m1 | 80 |
| HEY1 (NM_001040708.1, NM_012258.3) | Hs01114113_m1 | 82 |
| HES1 (NM_005524.3) | Hs00172878_m1 | 78 |
| NOGGIN (NM_005450.4) |
Hs00271352_s1 | 88 |
| BMP2 (NM_001200.2) | Hs00154192_m1 | 60 |
| BMP4 (NM_001202.3, NM_130850.2, NM_130851.2) | Hs00370078_m1 | 58 |
| BMPR2 (NM_001204.6) | Hs00176148_m1 | 69 |
РЕЗУЛЬТАТЫ
Морфология клеток. Культуры клеток РПЭ 4-ого пассажа состояли из непигментированных и слабопигментированных полигональной формы эпителиоподобных и вытянутой формы фибробластоподобных клеток, что свидетельствует об их дедифференцировке in vitro (рис. 1а). После однократного воздействия оФРФ в клетках выявлялись морфологические отличия от контрольных клеток, которые имели место во всех временных точках. Значительную выраженность изменений культуры отмечали во временном интервале 48–72 ч, которая и заключалась в увеличении числа клеток вытянутой (фибробластоподобной) формы и формировании “рыхлых” колоний из хаотично расположенных клеток (рис. 1а).
Рис. 1.
Культура (а) и ядерно-цитоплазматическое отношение (ЯЦО, б) клеток ретинального пигментного эпителия (РПЭ) глаза взрослого человека в отсутствие (контроль) и в присутствии оФРФ через 24, 48 и 72 ч после начала его действия. Концентрация оФРФ 20 нг/мл. В течение всего срока культивирования среду не меняли. а – фазовый контраст, об.: 10×. б: черные столбики – контроль, светлые столбики – оФРФ; вертикальные отрезки – ошибки среднего; полиномиальный тип линии тренда второй степени в контроле (черная штриховая линия) и в присутствии оФРФ (светлая штриховая линия); коэффициент детерминации R2 = 1.
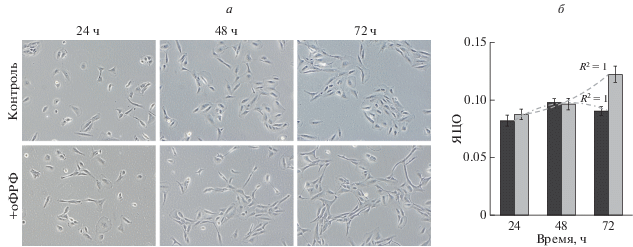
Результаты количественного анализа показали снижение средних значений площади и ядер клеток РПЭ по сравнению с контролем через 72 ч после воздействия оФРФ (табл. 2), что говорит в пользу появления клеток меньшего размера. Соотношение между площадью ядра и цитоплазмы в клетках РПЭ после воздействия оФРФ сдвигалось в сторону уменьшения части цитоплазмы (табл. 2). Коэффициент детерминации составил 100% (R2 = 1) в обеих группах, что свидетельствует о высокой достоверности аппроксимации и говорит о закономерной изменчивости показателей (рис. 1б). Степень влияния времени культивирования на ЯЦО в клетках РПЭ после воздействия оФРФ значительная и имеет разное направление: в контрольной группе она направлена на уменьшение ЯЦО, а в экспериментальной – на увеличение.
Таблица 2.
Морфометрические показатели клеток ретинального пигментного эпителия
| Группа | Время, ч | Площадь клеток, пиксели | Площадь ядер, пиксели | Соотношение ядра к цитоплазме |
|---|---|---|---|---|
| Контроль | 24 | 28 121.55 ± 1904.17 | 2125.05 ± 144.37 | 1 : 12 |
| 48 | 23 188.98 ± 1867.84 | 2059.34 ± 85.17 | 1 : 10 | |
| 72 | 26 228.15 ± 1831.32 | 2167.24 ± 108.23 | 1 : 11 | |
| +оФРФ | 24 | 24 321.65 ± 2197.15 | 1960.81 ± 102.75 | 1 : 11 |
| 48 | 22 393.10 ± 2687.68 | 1972.39 ± 108.26 | 1 : 10 | |
| 72 | 12 087.71 ± 1289.20а | 1320.11 ± 85.66а | 1 : 8 |
Влияния оФРФ на регуляцию Wnt-, Notch- и BMP-сигнальных путей в клетках РПЭ взрослого человека in vitro. Для этого провели ИЦХ-анализ и кПЦР на их основные маркеры.
Анализ маркеров Wnt-сигналинга. Исследование с антителами к β-катенину, белку адгезионных контактов и центральному медиатору канонического Wnt-сигнального пути, показало снижение интенсивности окрашивания по цитоплазматической мембране и цитоплазме экспериментальных клеток РПЭ через 24, 48 (данные не приведены) и 72 ч (рис. 2а) после воздействия оФРФ по сравнению с контрольными клетками тех же сроков, что говорит об ослаблении межклеточной адгезии и объясняет появление “рыхлых” колоний. Количественная оценка относительной интенсивности флуоресцентного сигнала подтвердила визуальную оценку и показала, что интенсивность сигнала была значительно ниже на сроке 24 ч (рис. 2б) по сравнению с контролем, затем во временном интервале 48–72 ч отмечали ее некоторое увеличение, которое не достигало контрольных значений (рис. 2б), при этом она была значимо ниже на сроке 72 ч.
Рис. 2.
Анализ маркеров Wnt-сигналинга в клетках РПЭ в контроле и после добавления в среду 20 нг/мл оФРФ. а – иммунофлуоресценция клеток РПЭ, окрашенных на β-катенин и Wnt7a через 72 ч после введения оФРФ, об.: 20×; б – интенсивность флуоресцентного сигнала (ИФ) на β-катенин и Wnt7a через 24 (столбец 1), 48 (2) и 72 (3) ч после добавления в среду оФРФ; в – экспрессия мРНК генов CTNNB1 и GSK3B, участников канонического сигнального пути Wnt/β-катенин, в те же сроки после добавления в среду оФРФ. Здесь и на рис. 3, 4: изменения ИФ (б) и экспрессии (в) показаны относительно контрольных клеток РПЭ (в отсутствии оФРФ) на тех же сроках культивирования; вертикальные отрезки – ошибки среднего; различия в исследуемых образцах РПЭ по сравнению с контролем считали значимыми по t-критерию Стьюдента при *P < 0.05.
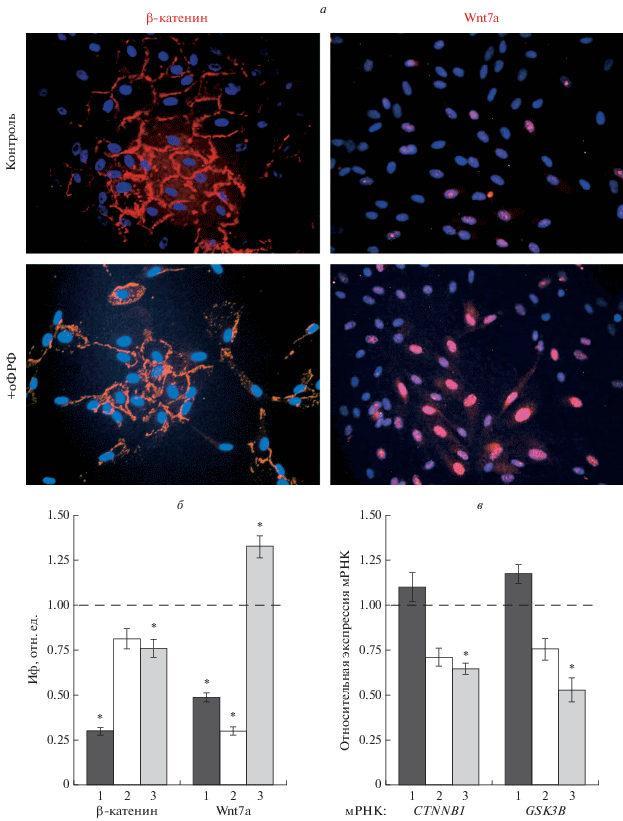
По данным кПЦР через 72 ч после воздействия оФРФ в клетках РПЭ отмечено снижение уровня мРНК CTNNB1 (ген β-катенина) более чем в 1.5 раза и снижение уровня мРНК GSK3B (ген киназы гликогенсинтазы-3β, GSK3β) в 1.9 раза по сравнению с контролем (рис. 2в).
Известно, что неканонический Wnt/РСР-сигнальный путь задействован в обеспечении и поддержании планарной клеточной полярности, он стимулируется под действием лигандов Wnt7a и Wnt11 (Куликова и др., 2012; Bikkavilli et al., 2015). В клетках РПЭ Wnt7a имел околоядерную цитоплазматическую локализацию. После воздействия оФРФ отмечено ослабление интенсивности свечения на Wnt7a во временном интервале 24–48 ч с последующим усилением интенсивности окрашивания на сроке 72 ч (рис. 2а, 2б) по сравнению с контролем (рис. 2а, 2б).
Анализ ВМР-сигнального пути. ИЦХ-исследование клеток РПЭ с антителами к костным морфогенетическим белкам BMP2, BMP4 и BMP7 показало, что все эти белки детектируются в цитоплазме контрольных клеток на всех сроках культивирования. На рис. 3а представлены данные окрашивания соответственно на BMP2, BMP4 и BMP7 контрольных клеток на сроке 72 ч. Количественная оценка относительной интенсивности флуоресцентного сигнала антител к белкам семейства BMP в экспериментальной группе в целом подтвердила визуальную оценку и показала, что под действием оФРФ интенсивность свечения антител к ВМР2 была значительно выше по сравнению с контролем в промежутке 48–72 ч (рис. 3б), тогда как интенсивность сигнала на BMP4 не изменялась (рис. 3б). При этом отмечали изменение локализации ВМР4 на околоядерную (рис. 3а). Относительная интенсивность флуоресцентного сигнала антител к BMP7 была ниже на сроке 24 ч (рис. 3б), затем она увеличивалась и через 72 ч была выше (рис. 3б) по сравнению с контрольными клетками.
Рис. 3.
Анализ маркеров ВМР-сигнального пути в клетках РПЭ в контроле и после добавления в среду 20 нг/мл оФРФ. а – Иммунофлуоресценция клеток РПЭ, окрашенных на BMP2, BMP4 и BMP7 через 72 ч после введения оФРФ, об.: 20×; б – интенсивность флуоресцентного сигнала (ИФ) на BMP2, BMP4 и BMP7 через 24 (столбец 1), 48 (2) и 72 (3) ч после добавления в среду оФРФ; в – экспрессия мРНК генов NOGGIN, BMP2, BMP4 и BMP2R в те же сроки после добавления в среду оФРФ.
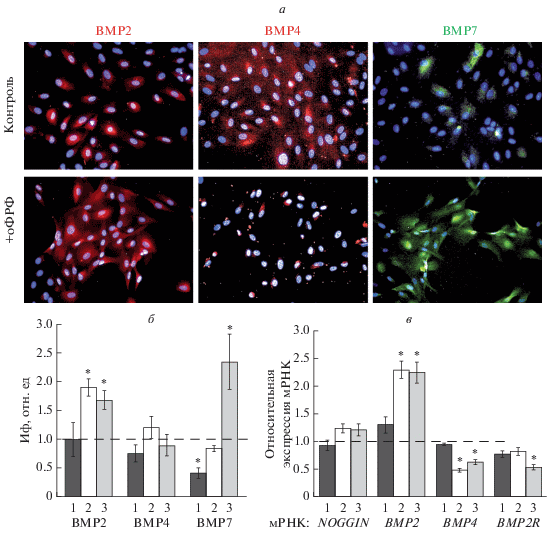
По данным кПЦР через 48 ч после воздействия оФРФ в клетках РПЭ отмечено увеличение уровня мРНК BMP2 в 2.3 раза и снижение уровня мРНК BMP4 в 2 раза по сравнению с контролем (рис. 3в). Через 72 ч тенденция изменения экспрессии мРНК указанных генов сохранялась: наблюдали увеличение мРНК BMP2 в 2.2 раза и снижение уровня мРНК BMP4 в 1.6 раза по сравнению с контролем (рис. 3в). Кроме того, в этот временной интервал отмечено снижение уровня мРНК BMPR2 в 1.9 раза (рис. 3в). Стоит отметить, что уровень экспрессии мРНК NOGGIN, кодирующего белок-антагонист лигандов ВМР, не изменялся на всех сроках культивирования (рис. 3в).
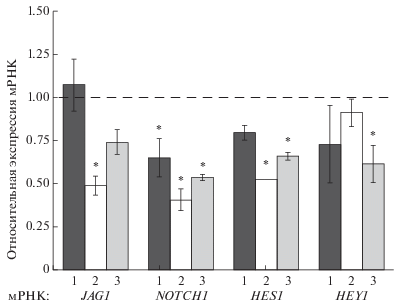
Анализ экспрессии генов Notch сигнального пути. По данным кПЦР через 24 ч после воздействия оФРФ в клетках РПЭ отмечено снижение уровня экспрессии мРНК NOTCH1, рецептора Notch сигнального пути, в 1.6 раза (рис. 4). Через 48 ч наблюдали снижение уровней мРНК лиганда JAG1 в 2 раза, NOTCH1 − в 2.5 раза и целевого гена HES1 (репрессора транскрипции) − в 1.9 раза (рис. 4). Через 72 ч снижались уровни мРНК рецептора NOTCH1 в 1.9 раза и целевых генов HES1 и HEY1 соответственно 1.5 и 1.6 раза (рис. 4).
ОБСУЖДЕНИЕ
Культуры клеток РПЭ человека дают большую возможность изучения на клеточном и молекулярном уровнях изменений, происходящих в РПЭ in vivo при повреждении, что позволит определить мишени и разработать специфическую терапию, эффективно нацеленную на устранение патологических изменений в сетчатке. Настоящая работа является продолжением исследования (Кузнецова и др., 2018), касающегося влияния оФРФ на клетки РПЭ взрослого человека in vitro. Ранее мы показали, что под действием оФРФ происходит понижение уровня дифференцировки клеток РПЭ по сравнению с контролем. Об этом свидетельствуют следующие результаты морфометрического анализа: постепенное уменьшение площади клеток РПЭ с течением времени культивирования (24–120 ч), а также повышение коэффициентов их поляризации (вытянутости) и распластывания в промежутке 48–96 ч. Изменения морфологии клеток РПЭ (по сравнению с контроле) сопровождаются снижением их пролиферативной активности на ранних (24–48 ч) и повышением на поздних сроках (120 ч) после воздействия оФРФ, а также подавлением их дифференцировочного статуса, а именно снижением через 48–72 ч экспрессии мРНК РПЭ специфичных генов (MITF, KRT18) при одновременном увеличении экспрессии мРНК гена прогениторных клеток (NES), с последующим увеличением на сроке 72–120 ч экспрессии маркера нейроэпителия (OTX2) и генов-маркеров плюрипотентности (KLF4, OCT4, NANOG). Кроме того, данные о снижении уровня дифференцировки клеток подтверждаются снижением уровня экспрессии мРНК белка внеклеточного матрикса (COL1A1), указывающего на понижение синтетической активности в период 48–120 ч после воздействия фактора. На основе результатов о понижении уровня дифференцировки клеток РПЭ в сторону нейроэпителия после однократного воздействия на них оФРФ было продолжено исследование в этом направлении и изучены изменения Wnt-, BMP- и Notch-сигнальных путей, что необходимо для более глубокого понимания механизмов, понижающих уровень дифференцировки клеток РПЭ.
Известно, что ФРФ- и Wnt-сигнальные пути пересекаются в различных клеточных процессах, протекающих в ходе эмбриогенеза, нейрогенеза, карциногенеза. Сигналы ФРФ передаются по трем сигнальным путям: PI3K/AKT, MAPK/ERK и PLCγ, а сигналы Wnt − по каноническому и неканоническим путям. Внутриклеточная серинтреониновая киназа GSK3β является ключевым компонентом регуляции ФРФ-зависимого PI3K/AKT- и канонического Wnt-сигнальных путей (Katoh, Katoh, 2006; Ding et al., 2010; Lee et al., 2016). Активация ФРФ-сигнального пути приводит к фосфорилированию β-катенина. Хотя точный механизм фосфорилирования β-катенина с помощью передачи сигналов ФРФ остается неясным, известно, что через PI3K/AKT-сигнальный путь происходит подавление E-кадгерина, что в свою очередь приводит к высвобождению β-катенина из комплекса E-кадгерин–β-катенин–α-катенин (Katoh, Katoh, 2006). Далее GSK3β в комплексе с белками APC–аксин–казеинкиназа I связывает и фосфорилирует β-катенин, что приводит впоследствии к его утилизации при помощи убиквитин-протеасом (Куликова и др., 2012; Исаева и др., 2015; Staal, 2016). Благодаря этому механизму в отсутствие Wnt-стимуляции цитоплазматическая концентрация β-катенина поддерживается на низком уровне (Исаева и др., 2015; Staal, 2016). В связи с этим наблюдаемое нами через 24 ч после воздействия оФРФ резкое снижение концентрации β-катенина в клетках РПЭ при отсутствии его ядерной локализации и сохранение экспрессии мРНК гена CTNNB1 свидетельствуют о деградации белка. Об отсутствии транслокации в ядро говорит и снижение пролиферативной активности клеток РПЭ, поскольку для активации транскрипции генов, чьи продукты участвуют в процессах деления, необходимо взаимодействие β-катенина с транскрипционными факторами (TCF/LEF) (Clevers, 2006; Cho et al., 2018). Снижение цитоплазматического окрашивания на β-катенин на сроке 24 ч после воздействия оФРФ согласуется со снижением окрашивания клеток на Wnt7a на этом же сроке, что поддерживается данными об участии Wnt7a в петле положительной обратной связи с экспрессией E-кадгерина (Ohira et al., 2003). Так, в ряде работ (Ohira et al., 2003; Bikkavilli et al., 2015; Kim et al., 2015) показано, что потеря Wnt7a в клетках рака легкого приводит к снижению экспрессии E-кадгерина, к переключению экспрессии на N-кадгерин и развитию ЭМП.
Далее во временном интервале 48–72 ч после воздействия оФРФ мы наблюдали в клетках некоторое увеличение концентрации β-катенина по сравнению с временной точкой 24 ч, но не достигавшее контрольного значения. Значимое снижение интенсивности свечения антител к β-катенину при одновременном снижении экспрессии мРНК CTNNB1 по сравнению с контролем на сроке 72 ч свидетельствует уже об изменении транскрипционной регуляции синтеза мРНК β-катенина. На этом же сроке после воздействия оФРФ отмечали усиление интенсивности окрашивания на Wnt7a, которое было выше, чем в контроле. Данные согласуются с работами из литературы (Ohira et al., 2003; Bikkavilli et al., 2015; Kim et al., 2015), в которых физиологические уровни Wnt7a положительно регулируют экспрессию E-кадгерина в клетках через усиление экспрессии β-катенина. Ранее нами на клеточных культурах РПЭ человека показано, что добавление в среду культивирования рекомбинантного белка человека Wnt7a приводило к кратковременному (до 24 ч) усилению экспрессии клетками Е-кадгерина и β-катенина (Кузнецова и др., 2015). В то же время следует отметить, что хотя Wnt7a и усиливает экспрессию β-катенина в клетках, передачу сигнала он осуществляет не через путь β-катенина (Ohira et al., 2003; Bikkavilli et al., 2015). Как уже было отмечено выше, Wnt7a является лигандом неканонического Wnt/РСР-сигнального пути, который контролирует активность малых ГТФ-аз Rac и Rho (Куликова и др., 2012; Bikkavilli et al., 2015). Rac-зависимый сигнальный каскад связан с индукцией киназной активности JNK, а Rho-зависимая ветвь сигнального каскада – с активацией Rho-ассоциированной киназы ROCK. Путь клеточной поляризации вовлечен в регуляцию процесса модификации структур актинового цитоскелета, благодаря чему оказывает значительное влияние на поляризацию и подвижность клеток (Куликова и др., 2012). С данным утверждением согласуется выявленное нами во временном промежутке 48–96 ч повышение средних значений коэффициентов поляризации (вытянутости) клеток (Кузнецова и др., 2018).
На сроке 72 ч после воздействия оФРФ по сравнению с контролем отмечено значимое снижение экспрессии мРНК GSK3B. Мультифункциональная киназа GSK3β регулирует многие разнообразные клеточные процессы, включая пролиферацию, дифференцировку и апоптоз. Ее активность регулируется сериновым (ингибирующим) и тирозиновым (стимулирующим) фосфорилированием (Medina, Wandosell, 2011). GSK3β регулирует активность многих разнообразных белков, включая метаболические и цитоскелетные белки, факторы трансдукции и транскрипции, и сама в свою очередь зависит от большого количества внеклеточных стимулов (Medina, Wandosell, 2011). GSK3β наиболее известна в качестве негативного регулятора канонического Wnt- и ФРФ-зависимого PI3K/AKT-сигнальных путей. На экспериментальной модели травматической пролиферативной витреоретинопатии, вызванной у кроликов с помощью интравитреальных инъекций клеток ARPE-19, показано подавление в сетчатке экспрессии GSK3β и активирование канонического Wnt- и PI3K/AKT-сигнальных путей, что способствовало последующей пролиферации фибробластов, метаболическим изменениям, синтезу коллагена и развитию ЭМП (Zhang et al., 2018). Показано, что через 48 ч после воздействия инсулиноподобного фактора роста в клетках ARPE-19 снижалась транскрипция и трансляции β-катенина и GSK3β с одновременным увеличением циклина D1 и пролиферации клеток, что авторы связывают с транслокацией β-катенина в ядра клеток и говорят об активации канонического Wnt-сигнального пути (Steindl-Kuscher et al., 2009). В связи со сказанным, в нашем исследовании наблюдаемые через 72 ч после воздействия оФРФ снижение экспрессии мРНК GSK3B и CTNNB1 и ослабление интенсивности флуоресцентного сигнала на β-катенин также можно связать с активацией канонического Wnt-сигнального пути на данном сроке. В пользу последнего утверждения говорят увеличение экспрессии генов-маркеров плюрипотентности (KLF4, OCT4, NANOG) на сроке 72–120 ч и пролиферативной активности клеток РПЭ (120 ч) (Кузнецова и др., 2018).
Известно, что в контроле и координации роста, размера и деления клеток, а также их количества, участвуют различные сигнальные пути, в том числе Wnt-сигнальный путь (Clevers, 2006; Cho et al., 2018) и такие оФРФ-опосредованные сигнальные каскады, как PI3K/AKT и MAPK/ERK (Li et al., 2015). В настоящей работе в клетках РПЭ через 72 ч после воздействия оФРФ выявлено снижение средних значений площади ядер клеток по сравнению с контролем, что дополнительно к ранее выявленному снижению средних значений площади клеток говорит в пользу появления клеток меньшего размера. Кроме того, расчет соотношения между площадью ядра и цитоплазмы в клетках РПЭ после воздействия оФРФ выявил сдвиг в сторону значимого уменьшения части цитоплазмы по сравнению с контролем, где, наоборот, наблюдали ее увеличение. Известно, что маленький размер клеток коррелирует со стволовостью и, наоборот, увеличение размера клеток положительно коррелирует с дифференцированным фенотипом (Li et al., 2015). Полученные данные вместе с ранее выявленными различиями размера и формы клеток, а также с результатами об увеличении количества клеток РПЭ на сроке 120 ч под действием оФРФ (Кузнецова и др., 2018) говорит об отложенном действии фактора на пролиферативную активность клеток.
Канонический Wnt-сигнальный путь вовлечен в регуляцию не только пролиферации, но и дифференцировки, а также в поддержание популяции СК (Clevers, 2006). Воздействие оФРФ в высокой дозе (100 нг/мл) на СК, изолированные из пульпы выпавших молочных зубов человека, способствовало через активацию сигналов ERK1/2 снижению в клетках экспрессии β-катенина, что приводило к подавлению их дифференцировки (Li et al., 2012). В другой работе (Blauwkamp et al., 2012) на клональных линиях эмбриональных СК (ЭСК) человека с интегрированным репортером TCF-GFP с использованием активатора и ингибитора канонического Wnt-сигнального пути продемонстрировано разнообразие клеток по эндогенной активности Wnt-сигналинга, уровень которой в отдельных клетках коррелировал с различиями клоногенного потенциала и склонности к дифференцировке. Так, ЭСК с высоким уровнем активности Wnt при дифференцировке преимущественно образовывали эндо- и мезодермальные клетки, тогда как ЭСК с низким уровнем – в первую очередь нейроэктодермальные клетки (Blauwkamp et al., 2012). Результаты этих авторов согласуются с данными работ, в которых инактивирование канонического Wnt-сигналинга или активирование MAPK/ERK-сигнального пути приводило к де- и трансдифференцировке РПЭ в нейральную сетчатку. Так, блокада Wnt/β-катенин сигнального пути у генетически модифицированных мышей приводила к трансдифференцировке клеток РПЭ в клетки нейральной сетчатки, что подтверждалось снижением РПЭ-специфичных маркеров (в частности, Mitf и Otx2) и эктопической экспрессией маркеров, специфичных для нейральной сетчатки (Chx10 и Rx) (Fujimura et al., 2009).
Эктопическая экспрессия аллели MEK-1 (MEKDD), непосредственного активатора киназы ERK в MAPK-сигнальном пути, в сетчатке куриного эмбриона in ovo также вызывала трансдифференцировку РПЭ в клетки подобные нейроэпителиальному слою сетчатки, что коррелировало c ингибированием экспрессии Mitf в презумптивном РПЭ (Galy et al., 2002). Схожие результаты получены и другими авторами (Zhu et al., 2014), которые после воздействия оФРФ на клетки РПЭ цыплят отмечали их де- и трансдифференцировку в клетки нейральной сетчатки, что сопровождалось потерей ядерного β-катенина. Наши данные согласуются с данными литературы. Как уже было сказано выше, добавление оФРФ в ростовую среду клеток РПЭ человека сопровождалось подавлением дифференцировочного статуса клеток, а именно снижением экспрессии мРНК РПЭ специфичных генов MITF и KRT18 через 48–72 ч после воздействия фактора (Кузнецова и др., 2018).
Как упоминалось, канонический Wnt-сигнальный путь вовлечен в поддержание популяции СК (Clevers, 2006). На недифференцированных ЭСК и индуцированных плюрипотентных клетках человека показано, что экзогенный оФРФ поддерживает клетки в недифференцированном состоянии, модулируя Wnt-сигналинг через активацию PI3K (Ding et al., 2010). PI3K через активацию нижестоящей мишени АКТ либо подавляет активность GSK3β (Katoh, Katoh, 2006), способствуя транслокации β-катенина в ядро, либо напрямую, без участия β-катенина, активирует TCF (Ding et al., 2010), приводя к активации генов плюрипотентности OCT3/4, NANOG, SOX2 (Ludwig et al., 2006; Ding et al., 2010; Lotz et al., 2013). Так, по нашим данным (Кузнецова и др., 2018) добавление оФРФ в ростовую среду клеток РПЭ человека сопровождалось увеличением во временном интервале 72–120 ч экспрессии генов-маркеров плюрипотентности (KLF4, OCT4, NANOG).
Таким образом, наши исследования свидетельствуют об инактивации сигнального пути Wnt/β-катенин на ранних сроках (24–72 ч) действия оФРФ, что приводит к подавлению пролиферации и понижению дифференцировочного статуса клеток РПЭ взрослого человека, и об активации его на более поздних сроках (72–120 ч), что ведет к усилению пролиферации малодифференцированных клеток.
Сигнальный путь костного морфогенетического белка (BMP), точнее трансформирующего фактора роста-бета (TGFβ)/BMP, участвует в подавляющем большинстве клеточных процессов и имеет фундаментальное значение в течение всей жизни млекопитающих и человека. Сигналы TGFβ/BMP передаются по каноническому (Smad-зависимому) и неканоническим – MAPK/ERK и Jagged/Notch-опосредованным путям (Chen et al., 2014). Таким образом, BMP- и ФРФ-сигнальные пути имеют общее влияние на клеточные процессы через MAPK/ERK-сигнальный путь (Katoh, Katoh, 2006; Ding et al., 2010; Chen et al., 2014).
Известно, что белки семейства BMP, в первую очередь ВМР4 и ВМР7, определяют раннюю специализацию клеток РПЭ из нейроэпителия (Wordinger, Clark, 2007). Так, генетическая делеция ВМР7 у мышей приводит к серьезным нарушениям развития глаз (Hogan, 1996). Увеличение окрашивания на ВМР7 на сроке 72 ч в нашем исследовании может свидетельствовать об его участии в поляризации клеток, поскольку существуют работы, демонстрирующие участие BMP7 в этом процессе. Так, ВМР7 способствует ингибированию ЭМП, что проявляется восстановлением эпителиального фенотипа клеток и увеличением экспрессии Е-кадгерина (Zeisberg et al., 2003; Rocher et al., 2012; Кузнецова и др., 2015).
Добавление экзогенных ВМР2 и BMP4 подавляло пролиферацию клеток ARPE-19, играя роль негативных регуляторов роста (Mathura et al., 2000). В другом исследовании (Qi et al., 2004) вырабатываемый фидерными клетками ВМР4 участвовал в подавлении активности внеклеточной рецепторной киназы ERK и р38 МАРК ЭСК мышей, что способствовало поддержанию клеток в плюрипотентном состоянии. В нашей работе увеличение экспрессии мРНК ВМР2 под воздействием оФРФ может свидетельствовать об участии эндогенного BMP2 в подавлении пролиферации клеток РПЭ. Об этом же свидетельствуют данные, полученные нами ранее, когда увеличение экспрессии мРНК ВМР2 сопровождалось снижением пролиферативной активности клеток РПЭ через 24 ч после добавление в среду культивирования рекомбинантного белка человека Wnt7a (Kuznetsova et al., 2016). Подавление экспрессии мРНК ВМР4 может свидетельствовать о понижении уровня дифференцировки клеток РПЭ в сторону нейроэпителия (Wordinger, Clark, 2007).
Таким образом, оФРФ модулирует экспрессию белков семейства BMP, в результате чего происходит подавление пролиферации, понижение уровня дифференцировки и поляризация клеток РПЭ на ранних сроках.
Роль Notch-сигнального пути в ЭМП клеток РПЭ, в отличие от других тканей, исследуется не так давно. Как уже сказано выше, регуляция ЭМП, кроме канонического TGFβ/BMP сигнального пути, осуществляется через его неканонические MAPK/ERK- и Jagged/Notch-опосредованные ветви (Chen et al., 2014). Блокирование Notch-сигнального пути в клетках ARPE-19 с нокаутом по Notch1 существенно подавляло экспрессию гена-мишени HES1, что сопровождалось ингибированием миграции и пролиферации клеток (Liu et al., 2013). Похожее действие на клетки ARPE-19 и РПЭ, полученные из индуцированных плюрипотентных клеток, вызывал трихостатин А (ингибитор гистоновой деацетилазы HDAC), он блокировал все три ветви TGFβ-сигнального пути, подавляя пролиферацию клеток и ЭМП (Xiao et al., 2014).
Известно, что Notch-сигнальный путь перекрестно взаимодействует с Wnt-сигнальным путем (Espinosa et al., 2003). Так, активация канонического Wnt-сигнального пути в гематопоэтических СК приводила к индукции роста in vitro и восстановлению их in vivo, что сопровождалось повышением экспрессии гена Notch1 (Reya et al., 2003). Установлено, что общим регулятором этих сигнальных путей является киназа GSK3β. Однако остается неясным, как последняя контролирует активность Notch1 (Zheng, Conner, 2018). Противоречивые данные предполагают, что GSK3β регулирует передачу сигналов Notch либо положительно (Guha et al., 2011), либо отрицательно (Espinosa et al., 2003) в культурах клеток грызунов. В нашем исследовании на культуре клеток РПЭ человека снижение экспрессии мРНК генов Notch сигнального пути (JAG1, NOTCH1, HES1 и HEY1) наблюдалось во временном промежутке 24–72 ч, при этом на сроке 24–48 ч экспрессия мРНК GSK3B не изменялась по сравнению с контролем, снижение же уровня мРНК GSK3B отмечалось лишь через 72 ч после воздействия фактора. Учитывая выше сказанное, наши данные свидетельствуют в пользу утверждения об отрицательной регуляции киназой GSK3β сигналов Notch (Espinosa et al., 2003; Zheng, Conner, 2018), что требует дальнейшего подтверждения на более поздних сроках наблюдения.
Таким образом, опираясь на полученные результаты и данные литературы, можно предположить, что снижениe экспрессии генов Notch сигнального пути в клетках РПЭ человека на ранних сроках связано с инактивацией канонического Wnt-сигналинга в результате воздействия оФРФ.
В заключение следует сказать, что однократное (кратковременное) воздействие оФРФ на дедифференцированные in vitro клетки РПЭ приводит к инактивации на ранних сроках сигнальных путей Wnt/β-катенин и Notch, активации неканонического сигнального пути Wnt/PCP и модулированию ВМР-сигналинга, что понижает уровень дифференцировки клеток. Полученные результаты уточняют механизмы дедифференцировки клеток РПЭ под влиянием оФРФ.
Список литературы
Григорян Э.Н., Маркитантова Ю.В., Авдонин П.П., Радугина Е.А. 2013. Исследование регенерации у амфибий в эпоху молекулярно-генетических подходов и методов. Генетика. 49(1) : 55–72. (Grigoryan E.N., Markitantova Y.V., Avdonin P.P., Radugina E.A. 2013. Study of regeneration in amphibians in age of molecular-genetic approaches and methods. Russ. J. Genet. 49(1) : 46–62.) doi https://doi.org/10.1134/S1022795413010043
Исаева А.В., Зима А.П., Шабалова И.П., Рязанцева Н.В., Васильева О.А., Касоян К.Т., Саприна Т.В., Латыпова В.Н., Березкина И.С., Новицкий В.В. 2015. β-Катенин: структура, функции и роль в опухолевой трансформации эпителиальных клеток. Вестник РАМН. 70(4) : 475–483. (Isaeva A.V., Zima A.P., Shabalova I.P., Ryazantseva N.V., Vasil’eva O.A., Kasoayn K.T., Saprina T.V., Latypova V.N. Berezkina I.S., Novitskii V.V. 2015. β-Catenin: structure, function and role in malignant transformation of epithelial cells. Vestnik Rossiiskoi Akademii Meditsinskikh Nauk (Annals of the Russian Academy of Medical Sciences). 70(4) : 475–483.)https://doi.org/ doi 10.15690/vramn.v70.i4.1415
Кузнецова А.В., Григорян Э.Н., Александрова М.А. 2011. Ретинальный пигментный эпителий глаза взрослого человека – потенциальный источник клеток для восстановления сетчатки. Цитология. 53(6) : 505–512. (Kuznetsova A.V., Grigoryan E.N., Aleksandrova M.A. 2011. Human adult retinal pigment epithelial cells as potential cell source for retina recovery. Cell Tissue Biol. (Tsitologiya). 5(5) : 495–502.)
Кузнецова А.В., Куринов А.М., Ржанова Л.А., Александрова М.А. 2018. Механизмы дедифференцировки клеток ретинального пигментного эпителия глаза взрослого человека in vitro. Морфологический и молекулярно-генетический анализ. Цитология. 60(12) : 996–1007. (Kuznetsova A.V., Kurinov A.M., Rzhanova L.A. Aleksandrova M.A. 2018. Mechanisms of dedifferentiation of the adult human retinal pigment epithelial cells in vitro: morphologi-cal and molecular-genetic analysis. Tsitologiya. 60(12) : 996–1007.)
Кузнецова А.В., Куринов А.М., Ченцова Е.В., Макаров П.В., Александрова М.А. 2015. Влияние hrWnt7a на клетки ретинального пигментного эпителия человека in vitro. Клет. техн. биол. мед. 2 : 78–84. (Kuznetsova A.V., Kurinov A.M., Chentsova E.V., Makarov P.V., Aleksandrova M.A. 2015. Effect of hrWnt7a on human retinal pigment epithelial cells in vitro. Bull. Exp. Biol. Med. 159(4) : 534–540.)
Куликова К.В., Кибардин А.В., Гнучев Н.В., Георгиев Г.П., Ларин С.С. 2012. Сигнальный путь Wnt и его значение для развития меланомы. Соврем. технол. мед. 3 : 107–112. (Kulikova K.V., Kibardin A.V., Gnuchev N.V., Georgiev G.P., Larin S.S. 2012. Wnt signaling pathway and its significance for melanoma development. Sovremennye Tehnologii v Medicine. 3 : 107–112.)
Милюшина Л.А., Кузнецова А.В., Григорян Э.Н. Александрова М.А. 2011. Фенотипическая пластичность клеток ретинального пигментного эпителия глаза взрослого человека in vitro. Клет. техн. биол. мед. 2 : 71–76. (Milyushina L.A., Kuznetsova A.V., Grigoryan E.N., Aleksandrova M.A. 2011. Phenotypic plasticity of retinal pigment epithelial cells from adult human eye in vitro. Bull. Exp. Biol. Med. 151(4) : 506–511.)
Терюкова Н.П., Сахенберг Е.И., Иванов В.А., Снопов С.А. 2016. Получение и характеристика клональных линий монослойной гепатомы зайдела с признаками опухолевых стволовых и прогениторных клеток. Цитология. 58(11) : 832–842. (Teryukova N.P., Sakhenberg E.I., Ivanov V.A., Snopov S.A. 2017. Establishment and characterization of clonal lines with cancer stem-and progenitor-cell properties from monolayer zajdela hepatoma. Cell Tiss. Biol. (Tsitologiya). 11(2) : 161–171.)
Штейн Г.И., Кудрявцев Б.Н. 2018. Использование конфокальной микроскопии для микрофлуориметрических исследований в клеточной биологии. Цитология. 60(9) : 686–692. doi https://doi.org/10.7868/S0041377118090047 (Shtein G.I., Kudryavtsev B.N. 2018. Use of confocal microscopy for microfluorimetric research in cell biology. Tsitologiya. 60(9) : 686–692.)
Штейн Г.И., Пантелеев В.Г., Кудрявцев Б.Н. 2016. Методические проблемы цифровой цитофотометрии. Цитология. 58(3) : 234–242. (Shtein G.I., Panteleyev V.G., Kudryavtsev B.N. 2016. Methodological problems of digital cytophotometry. Tsitologiya. 58(3) : 234–242.)
Al-Hussaini H., Kam J.H., Vugler A., Semo M., Jeffery G. 2008. Mature retinal pigment epithelium cells are retained in the cell cycle and proliferate in vivo. Mol. Vis. 14 : 1784–1791.
Baldwin A.K., Cain S.A., Lennon R., Godwin A., Merry C.L.R., Kielty C.M. 2014. Epithelial-mesenchymal status influences how cells deposit fibrillin microfibrils. J. Cell Sci. 127 : 158–171. doi https://doi.org/10.1242/jcs.134270
Bikkavilli R.K., Avasarala S., Van Scoyk M., Arcaroli J., Brzezinski C., Zhang W., Edwards M.G., Rathinam M.K.K., Zhou T., Tauler J., Borowicz S., Lussier Y.A., Parr B.A., Cool C.D., Winn R.A. 2015. Wnt7a is a novel inducer of β-catenin-independent tumor-suppressive cellular senescence in lung cancer. Oncogene. 34 : 5317–5328. doi https://doi.org/10.1038/onc.2015.2
Blauwkamp T.A., Nigam S., Ardehali R., Weissman I.L., Nusse R. 2012. Endogenous Wnt signalling in human embryonic stem cells generates an equilibrium of distinct lineage-specified progenitors. Nat. Commun. 3 : 1070. doi https://doi.org/10.1038/ncomms2064
Cao W., Wen R., Li F., Lavail M.M., Steinberg R.H. 1997. Mechanical injury increases bFGF and CNTF mRNA expression in the mouse retina. Exp. Eye Res. 65 : 241–248. doi https://doi.org/10.1006/exer.1997.0328
Chen X., Xiao W., Wang W., Luo L., Ye S., Liu Y. 2014. The complex interplay between ERK1/2, TGFβ/Smad, and Jagged/Notch signaling pathways in the regulation of epithelial-mesenchymal transition in retinal pigment epithelium cells. PLoS One. 9(5) : e96365. doi https://doi.org/10.1371/journal.pone.0096365
Chiba C., Hoshino A., Nakamura K., Susaki K., Yamano Y., Kaneko Y., Kuwata O., Maruo F., Saito T. 2006. Visual cycle protein RPE65 persists in new retinal cells during retinal regeneration of adult newt. J. Comp. Neurol. 495 : 391–407. doi https://doi.org/10.1002/cne.20880
Cho I.H., Park S.J., Lee S.H., Nah S.K., Park H.Y., Yang J.Y., Madrakhimov S.B., Lyu J., Park T.K. 2018. The role of Wnt/β-catenin signaling in the restoration of induced pluripotent stem cell-derived retinal pigment epithelium after laser photocoagulation. Lasers Med Sci. doi https://doi.org/10.1007/s10103-018-2631-5
Clevers H. 2006. Wnt/beta-catenin signaling in development and disease. Cell. 127 : 469–480. doi https://doi.org/10.1016/j.cell.2006.10.018
Ding V.M.Y., Ling L., Natarajan S., Yap M.G.S., Cool S.M., Choo A.B.H. 2010. FGF-2 modulates Wnt signaling in undifferentiated hESC and iPS cells through activated PI3-K/GSK3β signaling. J. Cell. Physiol. 225 : 417–428. doi https://doi.org/10.1002/jcp.22214
Espinosa L., Inglés-Esteve J., Aguilera C., Bigas A. 2003. Phosphorylation by glycogen synthase kinase-3β down-regulates Notch activity, a link for Notch and Wnt pathways. J. Biol. Chem. 278 : 32 227–32 235. doi https://doi.org/10.1074/jbc.M304001200
Frank R.N., Amin R.H., Eliott D., Puklin J.E., Abrams G.W. 1996. Basic fibroblast growth factor and vascular endothelial growth factor are present in epiretinal and choroidal neovascular membranes. Am. J. Ophthalmol. 122 : 393–403.
Fujimura N., Taketo M.M., Mori M., Korinek V., Kozmik Z. 2009. Spatial and temporal regulation of Wnt/beta-catenin signaling is essential for development of the retinal pigment epithelium. Dev. Biol. 334 : 31–45. doi https://doi.org/10.1016/j.ydbio. 2009.07.002
Galy A., Néron B., Planque N., Saule S., Eychène A. 2002. Activated MAPK/ERK kinase (MEK-1) induces transdifferentiation of pigmented epithelium into neural retina. Dev. Biol. 248 : 251–264.
Guha S., Cullen J.P., Morrow D., Colombo A., Lally C., Walls D., Redmond E.M., Cahill P.A. 2011. Glycogen synthase kinase 3 beta positively regulates Notch signaling in vascular smooth muscle cells: Role in cell proliferation and survival. Basic Res. Cardiol. 106 : 773–785. doi https://doi.org/10.1007/s00395-011-0189-5
Hogan B.L. 1996. Bone morphogenetic proteins in development. Curr. Opin. Genet. Dev. 6 : 432–438.
Jensen E.C. 2013. Quantitative analysis of histological staining and fluorescence using ImageJ. Anat. Rec. 296 : 378–381. doi https://doi.org/10.1002/ar.22641
Katoh M., Katoh M. 2006. Cross-talk of WNT and FGF signaling pathways at GSK3beta to regulate beta-catenin and SNAIL signaling cascades. Cancer Biol. Ther. 5 : 1059–1064.
Kim T.-H., Moon J.-Y., Kim S.-H., Paik S. S., Yoon H.J., Shin D.H., Park S.S., Sohn J.W. 2015. Clinical significance of aberrant Wnt7a promoter methylation in human non-small cell lung cancer in Koreans. J. Korean Med. Sci. 30 : 155–161. doi https://doi.org/10.3346/jkms.2015.30.2.155
Kuznetsova A.V., Aleksandrova M.A., Kurinov A.M., Chentsova E.V., Makarov P.V. 2016. Plasticity of adult human retinal pigment epithelial cells. Int. J. Clin. Exp. Med. 9 : 20 892–20 906.
Kuznetsova A.V., Kurinov A.M., Aleksandrova M.A. 2014. Cell models to study regulation of cell transformation in pathologies of retinal pigment epithelium. J. Ophthalmol. 2014 : 1–18. doi https://doi.org/10.1155/2014/801787
Lee H.C., Lim S., Han J.Y. 2016. Wnt/β-catenin signaling pathway activation is required for proliferation of chicken primordial germ cells in vitro. Sci. Rep. 6 : 34510. doi https://doi.org/10.1038/srep34510
Li B., Qu C., Chen C., Liu Y., Akiyama K., Yang R., Chen F., Zhao Y., Shi S. 2012. Basic fibroblast growth factor inhibits osteogenic differentiation of stem cells from human exfoliated deciduous teeth through ERK signaling. Oral Dis. 18 : 285–292. doi https://doi.org/10.1111/j.1601-0825.2011.01878.x
Li Q., Rycaj K., Chen X., Tang D.G. 2015. Cancer stem cells and cell size: A causal link? Semin. Cancer Biol. 35 : 191–199. doi https://doi.org/10.1016/j.semcancer.2015.07.002
Liu W., Jin G., Long C., Zhou X., Tang Y., Huang S., Kuang X., Wu L., Zhang Q., Shen H. 2013. Blockage of Notch signaling inhibits the migration and proliferation of retinal pigment epithelial cells. Sci. World J. 2013 : 178 708. doi https://doi.org/10.1155/2013/178708
Lotz S., Goderie S., Tokas N., Hirsch S.E., Ahmad F., Corneo B., Le S., Banerjee A., Kane R.S., Stern J.H., Temple S., Fasano C.A. 2013. Sustained levels of FGF2 maintain undifferentiated stem cell cultures with biweekly feeding. PLoS One. 8 : e56289. doi https://doi.org/10.1371/journal.pone.0056289
Ludwig T.E., Levenstein M.E., Jones J.M., Berggren W.T., Mitchen E.R., Frane J.L., Crandall L.J., Daigh C.A., Conard K.R., Piekarczyk M.S., Llanas R.A., Thomson J.A. 2006. Derivation of human embryonic stem cells in defined conditions. Nat. Biotechnol. 24 : 185–187. doi https://doi.org/10.1038/nbt1177
Luz-Madrigal A., Grajales-Esquivel E., McCorkle A., DiLorenzo A.M., Barbosa-Sabanero K., Tsonis P.A., Del Rio-Tsonis K. 2014. Reprogramming of the chick retinal pigmented epithelium after retinal injury. BMC Biol. 12 : 28. doi
Mathura J.R., Jafari N., Chang J.T., Hackett S.F., Wahlin K.J., Della N.G., Okamoto N., Zack D.J., Campochiaro P.A. 2000. Bone morphogenetic proteins-2 and -4: negative growth regulators in adult retinal pigmented epithelium. Invest. Ophthalmol. Vis. Sci. 41 : 592–600.
Medina M., Wandosell F. 2011. Deconstructing GSK-3: the fine regulation of its activity. Int. J. Alzheimers. Dis. 2011 : 479 249. doi https://doi.org/10.4061/2011/479249
Nowwarote N., Sawangmake C., Pavasant P., Osathanon T. 2015. Review of the role of basic fibroblast growth factor in dental tissue-derived mesenchymal stem cells. Asian Biomed. 9 : 271–283. doi https://doi.org/10.5372/1905-7415.0903.395
Ohira T., Gemmill R.M., Ferguson K., Kusy S., Roche J., Brambilla E., Zeng C., Baron A., Bemis L., Erickson P., Wilder E., Rustgi A., Kitajewski J., Gabrielson E., Bremnes R., Franklin W., Drabkin H.A. 2003. WNT7a induces E-cadherin in lung cancer cells. Proc. Natl. Acad. Sci. USA. 100 : 10429–1034. doi https://doi.org/10.1073/pnas.1734137100
Qi X., Li T.-G., Hao J., Hu J., Wang J., Simmons H., Miura S., Mishina Y., Zhao G.-Q. 2004. BMP4 supports self-renewal of embryonic stem cells by inhibiting mitogen-activated protein kinase pathways. Proc. Natl. Acad. Sci. USA 101 : 6027–6032. doi https://doi.org/10.1073/pnas.0401367101
Reya T., Duncan A.W., Ailles L., Domen J., Scherer D.C., Willert K., Hintz L., Nusse R., Weissman I.L. 2003. A role for Wnt signalling in self-renewal of haematopoietic stem cells. Nature. 423 : 409–414. doi https://doi.org/10.1038/nature01593
Rocher C., Singla R., Singal P.K., Parthasarathy S., Singla D.K. 2012. Bone morphogenetic protein 7 polarizes THP-1 cells into M2 macrophages. Can. J. Physiol. Pharmacol. 90 : 947–951. doi https://doi.org/10.1139/y2012-102
Staal F.J.T. 2016. Wnt signalling meets epigenetics. Stem Cell Investig. 3 : 38. doi https://doi.org/10.21037/sci.2016.08.01
Steindl-Kuscher K., Krugluger W., Boulton M.E., Haas P., Schrattbauer K., Feichtinger H., Adlassnig W., Binder S. 2009. Activation of the β-Catenin signaling pathway and its impact on RPE cell cycle. Investig. Opthalmol. Vis. Sci. 50 : 4471–4476. doi https://doi.org/10.1167/iovs.08-3139
Takeuchi A., Fukazawa S., Chida K., Taguchi M., Shirataka M., Ikeda N. 2012. Semi-automatic counting of connexin 32s immunolocalized in cultured fetal rat hepatocytes using image processing. Acta Histochem. 114 : 318–326. doi https://doi.org/10.1016/j.acthis.2011.06.008
Tian J., Ishibashi K., Honda S., Boylan S.A., Hjelmeland L.M., Handa J.T. 2005. The expression of native and cultured human retinal pigment epithelial cells grown in different culture conditions. Br. J. Ophthalmol. 89 : 1510–1517. doi https://doi.org/10.1136/bjo.2005.072108
Urbán N., Guillemot F. 2014. Neurogenesis in the embryonic and adult brain: same regulators, different roles. Front. Cell. Neurosci. 8 : 396. doi https://doi.org/10.3389/fncel.2014.00396
Wen R., Song Y., Cheng T., Matthes M.T., Yasumura D., LaVail M.M., Steinberg R.H. 1995. Injury-induced upregulation of bFGF and CNTF mRNAS in the rat retina. J. Neurosci. 15(11) : 7377–7385.
Wordinger R.J., Clark A.F. 2007. Bone morphogenetic proteins and their receptors in the eye. Exp. Biol. Med. (Maywood). 232 : 979–992. doi https://doi.org/10.3181/0510-MR-345
Xiao W., Chen X., Liu X., Luo L., Ye S., Liu Y. 2014. Trichostatin A, a histone deacetylase inhibitor, suppresses proliferation and epithelial-mesenchymal transition in retinal pigment epithelium cells. J. Cell. Mol. Med. 18 : 646–655. doi https://doi.org/10.1111/jcmm.12212
Yang S., Li H., Li M., Wang F. 2015. Mechanisms of epithelial-mesenchymal transition in proliferative vitreoretinopathy. Discov. Med. 20 : 207–217.
Zeisberg M., Hanai J., Sugimoto H., Mammoto T., Charytan D., Strutz F., Kalluri R. 2003. BMP-7 counteracts TGF-β1–induced epithelial-to-mesenchymal transition and reverses chronic renal injury. Nat. Med. 9 : 964–968. doi https://doi.org/10.1038/nm888
Zhang C., Su L., Huang L., Song Z.-Y. 2018. GSK3β inhibits epithelial-mesenchymal transition via the Wnt/β-catenin and PI3K/Akt pathways. Int. J. Ophthalmol. 11 : 1120–1128. doi https://doi.org/10.18240/ijo.2018.07.08
Zheng L., Conner S.D. 2018. Glycogen synthase kinase 3β inhibition enhances Notch1 recycling. Mol. Biol. Cell. 29 : 389–395. doi https://doi.org/10.1091/mbc.E17-07-0474
Zhu J., Luz-Madrigal A., Haynes T., Zavada J., Burke A.K., Del Rio-Tsonis K. 2014. β-Catenin inactivation is a pre-requisite for chick retina regeneration. PLoS One. 9(7) : e101748. doi https://doi.org/10.1371/journal.pone.0101748
Дополнительные материалы отсутствуют.