Цитология, 2019, T. 61, № 4, стр. 319-325
Перераспределение саркомерных белков миозина и α-актинина при перестройке сократительного аппарата кардиомиоцитов в культуре
Н. Б. Бильдюг 1, *, С. Ю. Хайтлина 1
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: nbildyug@gmail.com
Поступила в редакцию 10.01.2018
После доработки 28.01.2019
Принята к публикации 28.01.2019
Аннотация
В процессе культивирования кардиомиоцитов происходит обратимая перестройка их сократительного аппарата с преобразованием типичных миофибрилл в структуры, напоминающие стресс-фибриллы немышечных клеток. Такая перестройка сопровождается замещением сердечного актина – основного белка миофибрилл – на его гладкомышечную изоформу. В ходе настоящей работы было обнаружено, что смена изоформ актина сопровождается выходом ключевых структурных белков саркомеров из актинсодержащих структур и запасанием их в цитоплазме в виде не связанных с актином включений. Полученные данные указывают на несовместимость гладкомышечного актина с саркомерными изоформами этих белков и миофибриллярной организацией в целом.
Кардиомиоциты (КМЦ) являются мышечными клетками сердца, которые обеспечивают его сокращение благодаря высокодифференцированному сократительному аппарату. Сократительный аппарат КМЦ представлен миофибриллами, которые состоят из структурно-функциональных единиц – саркомеров. Фибриллярный актин формирует тонкие нити миофибрилл, тогда как миозин образует толстые нити и обеспечивает моторную функцию. Другим важным структурным белком миофибрилл является α-актинин – основной белок Z-дисков, образующий поперечные мостики между актиновыми нитями и, таким образом, связывающий отдельные саркомеры.
Миофибриллярный аппарат КМЦ считается стабильной системой, которая в целом не подвержена изменениям. Однако в ходе кардиогенеза миофибриллы формируются на основе динамичных структур цитоскелета, поскольку предшественниками КМЦ являются немышечные клетки. Кроме того, миофибриллярный аппарат КМЦ может перестраиваться при патологических процессах в сердце.
Несмотря на то, что процесс дифференцировки КМЦ, а также их патологические изменения описаны довольно хорошо, механизмы, лежащие в основе перестроек сократительного аппарата, в целом остаются мало изученными. В то же время их изучение может внести существенный вклад в понимание регуляции динамики сократительной системы КМЦ in vivo и позволить в дальнейшем контролировать ее перестройки.
Первичная культура КМЦ является хорошей моделью для изучения изменений сократительной системы in vitro, поскольку в процессе культивирования этих клеток происходит обратимая перестройка их сократительного аппарата с преобразованием типичных миофибрилл в неисчерченные структуры, напоминающие стресс-фибриллы немышечных клеток (Nag, Cheng, 1981; Борисов и др., 1989; Бильдюг, Пинаев, 2013; Bildyug et al., 2016).
Данные из литературы и результаты нашей предыдущей работы показывают, что перестройка сократительного аппарата КМЦ в процессе культивирования сопровождается сменой изоформ актина с временной экспрессией несаркомерного гладкомышечного α-актина (van Bilsen, Chien 1993; Schaub et al. 1997; Bildyug et al., 2016), который в норме характерен для гладкомышечных клеток и миофибробластов, а также экспрессируется в КМЦ в ходе эмбрионального развития (Vandekerckhove et al., 1986; Ruzicka, Schwartz, 1988; Handel et al., 1991; van Bilsen, Chien, 1993) и при патологических изменениях (Winegrad et al., 1990; Clément et al., 1999).
Поскольку в состав миофибрилл помимо актина входит множество взаимодействующих с ним белков, в ходе настоящей работы необходимо было определить распределение ключевых структурных белков миофибрилл – миозина и α-актинина – на стадиях, соответствующих исходной организации сократительного аппарата КМЦ и его максимальной перестройке с исчезновением миофибрилл и замещением сердечного актина на гладкомышечную изоформу.
МАТЕРИАЛ И МЕТОДИКА
Получение первичной культуры КМЦ. Работу проводили на беспородных лабораторных крысах. Все эксперименты на животных были проведены в соответствии с общепринятыми этическими принципами и международными нормами.
Клетки миокарда выделяли из желудочков сердец новорожденных 3–5-суточных животных. Крыс усыпляли эфиром, вскрывали грудную клетку, извлекали сердца и отсекали сосудистые пучки. Затем сердца промывали изотоническим фосфатным буферным раствором (PBS: 140 мМ NaCl, 50 мМ KCl, 10 мМ Na2HPO4, pH 7.4). При помощи скальпеля желудочки отделяли от предсердий в растворе PBS. Затем основной объем PBS удаляли и желудочки измельчали ножницами в небольшом объеме PBS. К измельченной ткани добавляли раствор трипсина (1 мг/мл; Биолот, Россия) в PBS и инкубировали в термостате при 37°C в течение 20 мин при постоянном перемешивании. Затем раствор трипсина с небольшим содержанием клеток (в основном поврежденных) удаляли и к оставшимся фрагментам ткани добавляли раствор протеолитических ферментов в PBS, содержащий коллагеназу I типа (коллагеназа краба 0.5 мг/мл; Биолот, Россия) и трипсин (1 мг/мл; Биолот, Россия). Ткань инкубировали в растворе ферментов 2 раза по 30 мин при 37°C при постоянном перемешивании. Для выхода клеток в суспензию смесь многократно пипетировали. Для инактивации ферментов в суспензию добавляли эмбриональную телячью сыворотку (Gibco, США) до концентрации 10% и полученную смесь центрифугировали при 200 g в течение 5 мин. Супернатант сливали и к осадку, содержащему клетки сердца, добавляли питательную среду DMEM (Биолот, Россия), содержащую 10% эмбриональной телячьей сыворотки (Gibco, США) и 50 мкг/мл гентамицина (Биолот, Россия). Суспензию снова центрифугировали при 200 g в течение 5 мин. Для освобождения полученной смеси от клеток эндотелия и клеток крови, которые являются более легкими по сравнению с КМЦ и большей частью фибробластов, суспензию снова разводили в полной питательной среде и центрифугировали при 150 g в течение 5 мин. Осадок ресуспендировали в среде DMEM с сывороткой и гентамицином и высевали в чашки Петри (Nunc, Дания).
Для данной работы было важно получить чистую культуру КМЦ, свободную от сердечных фибробластов. Для того чтобы отделить более адгезивные фибробласты от медленно прикрепляющихся КМЦ, использовали метод селективной адгезии. В соответствии с методом полученную суспензию клеток разводили в среде DMEM с сывороткой и гентамицином, наносили на чашку Петри и помещали в СО2-инкубатор на 20–30 мин. За это время значительная часть фибробластов успевала прикрепиться к поверхности чашки, в то время как КМЦ оставались в суспензии. Среду, содержавшую неприкрепившиеся клетки, осторожно собирали и переносили на новые чашки Петри. Процедуру повторяли 4–5 раз. Этого времени было достаточно для прикрепления практически всех фибробластов. В итоге получали суспензию, содержащую КМЦ в концентрации ~6 × 104 кл/см2, которые переносили на новые чашки Петри с покровными стеклами. Клетки культивировали в инкубаторе при 5% СО2 и температуре 37°С в питательной среде DMEM, содержащей 10% эмбриональной телячьей сыворотки и гентамицин (50 мкг/мл).
Даже после селективной адгезии незначительное количество фибробластов все-таки может попадать в культуру КМЦ. Поскольку фибробласты являются быстро пролиферирующими клетками, в отличие от неделящихся КМЦ, для предупреждения их возможной пролиферации на 2-е сут культивирования и далее при каждой второй смене среды в культуру добавляли 3 мкг/мл ингибитора синтеза ДНК цитозин-арабинозид (Sigma-Aldrich, США). Использование этого агента является общепринятым методом подавления пролиферирующих клеток. Смену среды производили каждые 2–3 сут. За состоянием клеток в процессе культивирования наблюдали с помощью инвертированного микроскопа (ЛОМО, Россия). Жизнеспособность клеток оценивали путем их окрашивания 0.1%-ным раствором трипанового синего (Биолот, Россия).
Выявление структур сократительного аппарата кардиомиоцитов. Клетки на покровных стеклах промывали PBS, фиксировали в 4%-ном растворе формальдегида на PBS в течение 10 мин, затем промывали несколько раз в PBS. Для проникновения красителя и антител через клеточную мембрану КМЦ обрабатывали 0.1%-ным раствором тритона Х-100 в течение 3 мин, затем многократно промывали PBS.
Для выявления cаркомерного α-актинина клетки обрабатывали моноклональными мышиными антителами против сердечного α-актинина (получены в Институте цитологии РАН, Санк-Петербург) в течение 45 мин. Затем стекла промывали один раз 0.5%-ным раствором Tween (на PBS) и несколько раз раствором PBS. Наносили поликлональные кроличьи антитела против IgG мыши (Sigma-Aldrich, США), конъюгированные с красителем FITC (Fluorescein Isothiocynate). Стекла промывали 0.5%-ным раствором Tween с последующей многократной промывкой PBS.
Для выявления саркомерного миозина клетки обрабатывали моноклональными мышиными антителами против тяжелой цепи сердечного миозина (Sigma-Aldrich, США) в течение 1 ч. Затем стекла промывали один раз 0.5%-ным раствором Tween (на PBS) и несколько раз раствором PBS. Наносили поликлональные кроличьи антитела против IgG мыши (Sigma-Aldrich, США), конъюгированные с красителем FITC. Стекла промывали 0.5%-ным раствором Tween с последующей многократной промывкой PBS.
Для окрашивания всех полимерных актиновых структур клетки обрабатывали раствором родамин-фаллоидина (Sigma-Aldrich, США) в разведении 1 : 30 в течение 15 мин в защищенном от света месте. Для отмывки несвязавшегося красителя клетки несколько раз промывали PBS.
Для стабилизации флуоресцентной метки все препараты клеток после окраски заключали в специальную среду Mounting medium (Pharmacia Biotech, Швеция) под покровным стеклом. Препараты хранили при 4°С в защищенном от света месте.
Конфокальная микроскопия. Готовые препараты анализировали с помощью лазерного сканирующего конфокального микроскопа LEICA TCS SL (Leica, Германия) при 40-кратном увеличении объектива. Флуоресценцию красителя FITC (зеленый цвет) возбуждали аргоновым лазером (длина волны 488 нм). Флуоресценцию родамин-фаллоидина (красный цвет) возбуждали He-Ne лазером (длина волны 543 нм). Оптические срезы обрабатывали с помощью программы Leica Confocal Software (Leica, Германия).
РЕЗУЛЬТАТЫ
Процесс перестройки сократительного аппарата КМЦ в культуре был подробно описан нами ранее (Бильдюг, Пинаев, 2013; Bildyug et al., 2016). Весь процесс занимает около 3 нед. и может быть разделен на несколько стадий, ключевыми из которых являются следующие: сохранение исходной миофибриллярной организации сократительного аппарата (2–3 сут культивирования); полное преобразование миофибрилл в неисчерченные структуры, напоминающие стресс-фибриллы немышечных клеток (8–13 сут культивирования); восстановление исходной миофибриллярной организации (19–22 сут культивирования) (Бильдюг, Пинаев, 2013; Bildyug et al., 2016).
Для выявления организации сократительных структур КМЦ и распределения саркомерных белков при перестройке сократительного аппарата клетки фиксировали и окрашивали на 3 и 10 сут культивирования (до перестройки и во время перестройки сократительного аппарата соответственно).
Характер организации сократительного аппарата оценивали путем окраски клеток родамин-фаллоидином, который выявляет все полимерные актиновые структуры, независимо от изоформы актина. По результатам окрашивания через 3 сут культивирования сократительный аппарат КМЦ был представлен исчерченными миофибриллами (рис. 1а, рис. 2а), что соответствует его исходной организации и согласуется с полученными ранее данными (Бильдюг, Пинаев, 2013; Bildyug et al., 2016). Через 10 сут культивирования КМЦ родамин-фаллоидин выявлял неисчерченные структуры, напоминающие стресс-фибриллы немышечных клеток (рис. 1а', рис. 2а'), что соответствует стадии перестройки сократительного аппарата КМЦ и также согласуется с полученными ранее данными (Бильдюг, Пинаев, 2013; Bildyug et al., 2016).
Рис. 1.
Распределение саркомерного миозина в кардиомиоцитах (КМЦ) на разных стадиях перестройки их сократительного аппарата – на 3 (а–в) и 10 (а'–в') сут культивирования. а – Полимерные актиновые структуры (окраска родамин-фаллоидином), видна миофибриллярная организация сократительного аппарата КМЦ; б – периодичное распределение сердечного миозина (FITC-меченные антитела) в миофибриллах КМЦ; а' – неисчерченные актиновые структуры (окраска родамин-фаллоидином) в КМЦ; б' – распределение сердечного миозина (FITC-меченные антитела) в виде не связанных с актином включений в цитоплазме КМЦ. в, в' – Наложение изображений от двух красителей. Масштабные отрезки: 10 мкм.
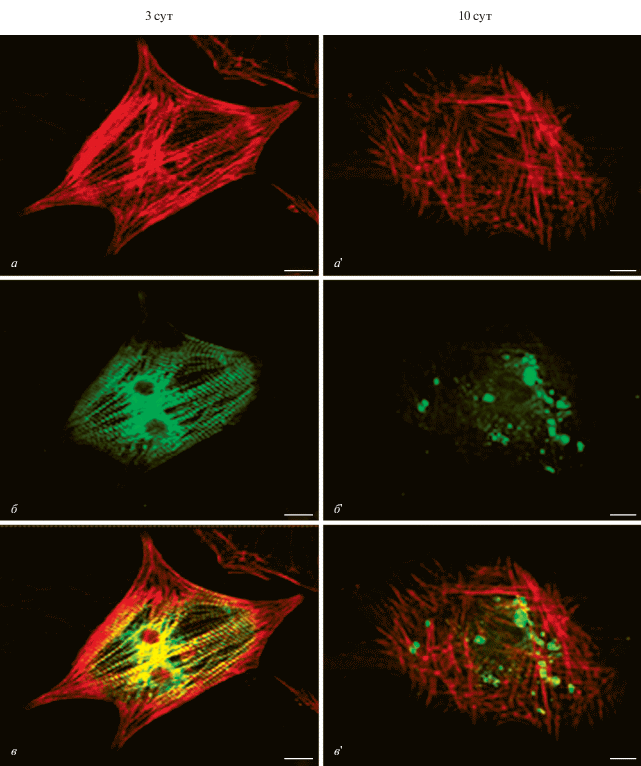
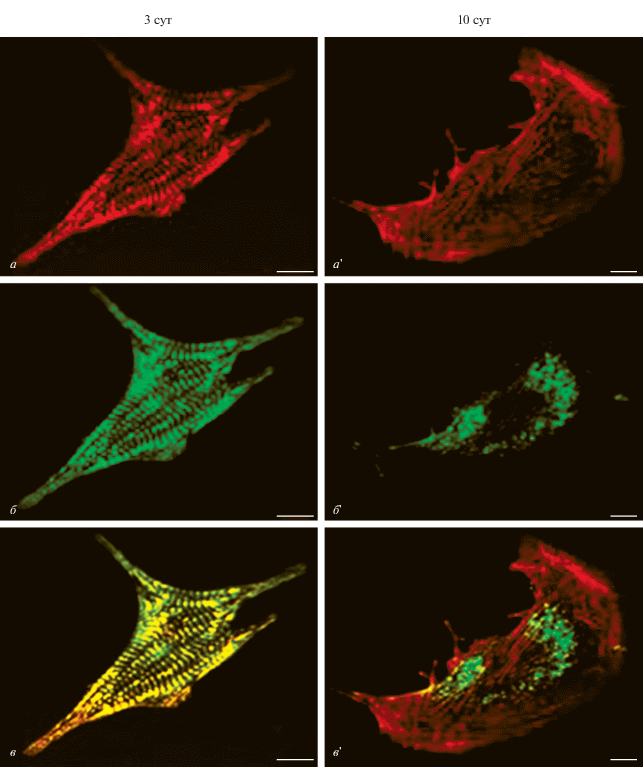
Рис. 2.
Распределение саркомерного α-актинина в кардиомиоцитах (КМЦ) на разных стадиях перестройки их сократительного аппарата – на 3 (а–в) и 10 (а'–в') сут культивирования. а – Полимерные актиновые структуры (окраска родамин-фаллоидином), видна миофибриллярная организация сократительного аппарата КМЦ; б – периодичное распределение сердечного α-актинина (FITC-меченные антитела) в миофибриллах КМЦ; а' – неисчерченные актиновые структуры (окраска родамин-фаллоидином) в КМЦ; б' – распределение сердечного α-актинина (FITC-меченные антитела) в виде не связанных с актином включений в цитоплазме КМЦ. в, в' – Наложение изображений от двух красителей. Масштабные отрезки: 10 мкм.
Распределение саркомерных белков оценивали с использованием моноклональных антител против сердечных изоформ миозина и α-актинина.
Через 3 сут культивирования КМЦ была показана регулярная организация сердечного миозина, что соответствует его нормальному распределению в миофибриллах (рис. 1б, 1в). Через 10 сут культивирования КМЦ сердечный миозин выявлялся в цитоплазме в виде включений, не связанных с полимерными актиновыми структурами (рис. 1б', 1в').
Для саркомерного α-актинина наблюдали сходное распределение на указанных стадиях. На 3 сут культивирования α-актинин выявлялся в миофибриллах с четкой периодичностью, что соответствует его локализации в Z-дисках саркомеров (рис. 2б, 2в). На 10 сут культивирования α-актинин выявлялся в цитоплазме в виде включений, не связанных с полимерными актиновыми структурами (рис. 2б', 2в').
Таким образом, при перестройке сократительного аппарата КМЦ саркомерные белки миозин и α-актинин выходят из актин-содержащих структур и запасаются в виде не связанных с актином включений в цитоплазме, при этом выход этих белков из актин-содержащих структур соответствует стадии замещения сердечного актина в сократительном аппарате КМЦ на гладкомышечную изоформу.
ОБСУЖДЕНИЕ
К настоящему времени накоплено достаточно много данных, указывающих на то, что разные изоформы актина, несмотря на высокую степень гомологии их первичных структур, не могут замещать друг друга без изменения своей функции (Antin, Ordahl, 1991; von Arx et al., 1995; Kaech et al., 1997; Kumar et al. 1997; Mounier et al., 1997; Fyrberg et al., 1998; Khaitlina, 2001; Martin et al., 2002). В частности, гладкомышечная и скелетная изоформы актина не могут обеспечить нормальное формирование миофибриллярного аппарата в моделях c нокаутом сердечной изоформы (Kumar et al., 1997). Одним из возможных объяснений является различное взаимодействие изоформ актина с актинсвязывающими белками (Perrin, 2010; De La Cruz, 2005).
Данные нашей предыдущей работы указывают на то, что включение гладкомышечного α-актина в миофибриллярные структуры на раннем сроке культивирования приводит к прекращению сократительной активности КМЦ и преобразованию миофибрилл в структуры, напоминающие стресс-фибриллы немышечных клеток (Bildyug et al., 2016). Обнаруженный в настоящей работе выход саркомерных изоформ белков α-актинина и миозина из актин-содержащих структур при перестройке сократительного аппарата КМЦ указывает на несовместимость гладкомышечного актина с саркомерными изоформами этих белков и миофибриллярной организацией в целом.
Известно, что стресс-фибриллы немышечных клеток также содержат α-актинин и миозин. Однако в этих структурах указанные белки представлены немышечными изоформами (Otey, Carpen, 2004; Kovacs et al., 2003; Wang et al., 2003; Golomb et al., 2004). В связи с этим мы предполагаем, что выход миофибриллярных белков в цитоплазму сопровождается их замещением в стресс-фибриллоподобных структурах клеток на немышечные изоформы.
Согласно нашим предыдущим данным при дальнейшем культивировании КМЦ после полной перестройки их сократительного аппарата происходит постепенное восстановление миофибрилл, которое сопровождается обратным замещением гладкомышечного актина на сердечную изоформу (Bildyug et al., 2016). В свете этих данных полученные нами результаты о том, что при перестройке сократительного аппарата саркомерные изоформы белков α-актинина и миозина сохраняются в виде включений в цитоплазме клеток, дают основание полагать, что восстановление исходной организации сократительного аппарата КМЦ может регулироваться не только на уровне экспрессии сердечных изоформ белков миофибрилл, но также путем включения в формирующиеся миофибриллы некоторых саркомерных белков из запасаемого в цитоплазме пула. Это предположение планируется проверить в ходе дальнейшей работы.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена при финансовой поддержке Российского научного фонда (проект 18-74-00129).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Авторы заявляют, что все эксперименты на крысах были проведены с соблюдением прав животных в соответствии с общепринятыми этическими международными нормами, гарантированными удостоверением Института цитологии РАН, идентификационный номер F18-00380 (Animal Welfare Assurance).
Список литературы
Бильдюг Н.Б., Пинаев Г.П. 2013. Зависимость организации сократительного аппарата кардиомиоцитов от внеклеточного матрикса. Цитология. 55(10): 713–724. (Bildjug N.B., Pinaev G.P. 2014. Extracellular matrix dependence of organization of the cardiomyocyte contractile apparatus. Cell Tiss. Biol. 8: 38–49.)
Борисов А.Б., Гончарова Е.И, Пинаев Г.П., Румянцев П.П. 1989. Изменения локализации α–актинина и миофибриллогенез в кардиомиоцитах крыс при культивировании. Цитология. 31(6): 642–646. (Borisov A.B., Goncharova E.I., Pinaev G.P., and Rumiantsev P.P. 1989. Changes in alpha-actinin localization and myofibrillogenesis in rat cardiomyocytes under cultivation. Tsitologiya. 31(6): 642–646.)
Antin P.B., Ordahl C.P. 1991. Isolation and characterization of an avian myogenic cell line. Dev. Biol. 143: 111–121.
Bildyug N., Bozhokina E., Khaitlina S. 2016 Contribution of α-smooth muscle actin and extracellular matrix to the in vitro reorganization of cardiomyocyte contractile system. Cell Biol. Int. 40: 472–477.
Clément S., Chaponnier C., Gabbiani G. 1999. A subpopulation of cardiomyocytes expressing α-skeletal actin is identified by a specific polyclonal antibody. Circ. Res. 85: e51–e58.
De La Cruz E.M. 2005. Cofilin binding to muscle and non-muscle actin filaments: Isoform-dependent cooperative interactions. J. Mol. Biol. 346: 557–564.
Fyrberg E.A., Fyrberg C.C., Biggs J.R., Saville D., Beall C.J., Ketchum A. 1998. Functional nonequivalence of Drosophila actin isoforms. Biochem. Genet. 36: 271–287.
Golomb E., Ma X., Jana S.S., Preston Y.A., Kawamoto S., Shoham N.G., Goldin E., Conti M.A., Sellers J.R., Adelstein R.S. 2004. Identification and characterization of nonmuscle myosin II-C, a new member of the myosin II family. J. Biol. Chem. 279: 2800–2808.
Handel S.E., Greaser M.L., Schultz E., Wang S.M., Bulinski J.C., Lin J.J., Lessard J.L. 1991. Chicken cardiac myofibrillogenesis studied with antibodies specific for titin and the muscle and nonmuscle isoforms of actin and tropomyosin. Cell Tiss. Res. 263: 419–30.
Kaech S., Fischer M., Doll T., Matus A. 1997. Isoform specificity in the relationship of actin to dendritic spines. J. Neurosci. 17: 9565–9572.
Khaitlina S.Y. 2001. Functional specificity of actin isoforms. Int. Rev. Cytol. 202: 35–98.
Kovacs M., Wang F., Hu A., Zhang Y., Sellers J.R. 2003. Functional divergence of humancytoplasmic myosin II: Kinetic characterization of the non-muscle IIA isoform. J. Biol. Chem. 278: 38132–38140.
Kumar A., Crafword K., Close L., Madison M., Lorenz J., Doetcshman T., Pawlowski S., Duffy J., Neumann J., Robbins J., Boivin G.P., O’Toole B.A., Lessard J.L. 1997. Rescue of cardiac α-actin-deficient mice by enteric smooth muscle-actin. Proc. Nat. Acad. Sci. USA. 94: 4406–4411.
Martin A.F., Phillips R.M., Kumar A., Crawford K., Abbas Z., Lessard J.L., de Tombe P., Solaro R.J. 2002. Ca(2+) activation and tension cost in myofilaments from mouse hearts ectopically expressing enteric gamma-actin. Am. J. Physiol. Heart Circ. Physiol. 283: H642–H649.
Mounier N., Perriard J.–C., Gabbiani G., Chaponnier C. 1997. Transfected muscle and nonmuscle actins are differentially sorted by cultured smooth muscle and nonmuscle cells. J. Cell Sci. 110: 839–846.
Nag A.C., Cheng M. 1981. Adult mammalian cardiac muscle cells in culture. Tissue Cell. 13: 515–523.
Otey C.A., Carpen O. 2004. Alpha-actinin revised: A fresh look at an old player. Cell Motil. Cytoskeleton. 58: 104–111.
Perrin B.J., Ervasti J.M. 2010. The actin gene family: function follows isoform. Cytoskeleton Hoboken. 6 : 630–634.
Ruzicka D.L., Schwartz R.J. 1988. Sequential activation of alpha-actin genes during avian cardiogenesis: vascular smooth muscle alpha-actin gene transcripts mark the onset of cardiomyocyte differentiation. J. Cell Biol. 107: 2575–2586.
Schaub M.C., Hefti M.A., Harder B.A., Eppenberger H.M. 1997. Various hypertrophic stimuli induce distinct phenotypes in cardiomyocytes. J. Mol. Med. 75: 901–920.
Van Bilsen M., Chien K.R. 1993. Growth and hypertrophy of the heart: Toward an understanding of cardiac specific and inducible gene expression. Cardiovasc. Res. 27: 1140–1149.
Vandekerckhove J., Bugaisky G., Buckingham M. 1986. Simultaneous expression of skeletal muscle and heart actin proteins in various striated muscle tissues and cells. J. Biol. Chem. 261: 1838–1843.
Von Arx P., Bantle S., Soldati T., Perriard J.C. 1995. Dominant negative effect of cytoplasmic actin isoproteins on cardiomyocytes cytoarchitecture and function. J. Cell Biol. 131: 1759–1773.
Wang F., Kovacs M., Hu A., Limouze J., Harvey E.V., Sellers J.R. 2003. Kinetic mechanism of non-muscle myosin-IIB: Functional adaptations for tension generation and maintenance. J. Biol. Chem. 278: 27439–27448.
Winegrad S., Wisnewsky C., Schwartz K. 1990. Effect of thyroid hormone on the accumulation of mRNA for skeletal and cardiac alpha–actin in hearts from normal and hypophysectomized rats. Proc. Nat. Acad. Sci. USA. 87: 2456–2460.
Дополнительные материалы отсутствуют.


