Цитология, 2019, T. 61, № 5, стр. 393-403
Чувствительность клеток с различным уровнем экспрессии гена Ppm1d к действию классической комбинации химиопрепаратов для лечения рака толстой кишки
Е. Ю. Кочеткова 1, *, Б. Б. Григораш 1, 2, О. Н. Демидов 1, 2
1 Институт Цитологии РАН
194064 Санкт-Петербург, Россия
2 INSERM UMR 1231, Университет Бургундии
Дижон, Франция
* E-mail: lena.linnaea@gmail.com
Поступила в редакцию 10.01.2019
После доработки 25.01.2019
Принята к публикации 25.01.2019
Аннотация
Мутации и амплификации гена Ppm1d, кодирующего фосфатазу Wip1, были обнаружены в различных опухолях. Новейшие исследования показали, что наличие устойчивой мутантной формы Wip1 после химиотерапии позволяет предполагать участие Wip1 в устойчивости злокачественных клеток к действию химиотерапевтических препаратов. В настоящей работе исследовали роль Wip1 в ответе клеток рака толстой кишки на действие противоопухолевых препаратов 5-фторурацила и оксалиплатины. Методом лентивирусной трансфекции были получены линии с увеличенным уровнем экспрессии гена Ppm1d. Показано, что оверэкпрессия Wip1 способствует поддержанию жизнеспособности клеток при действии оксалиплатины, тогда как делеция гена Ppm1d снижает жизнеспособность и клоногенную выживаемость клеток как при совместном действии двух препаратов, так и по раздельности. Полученные данные свидетельствуют о том, что увеличение уровня Wip1 в раковых клетках в ходе химиотерапии может способствовать развитию резистентности раковых клеток к противоопухолевой терапии. Методы, направленные на снижение уровня или активности Wip1, позволят увеличить эффективность терапии рака толстой кишки.
Злокачественные новообразования желудочно-кишечного тракта занимают лидирующие позиции среди онкологических заболеваний в России и мире. На сегодняшний день одним из основных методов лечения рака кишечника остается комбинированная химиотерапия. Чаще других используется комбинация химиопрепаратов, получившая название FOLFOX (фолиевая кислота, 5-фторурацил и оксалиплатина (Giuliani, Bonetti, 2018). Чувствительность раковых клеток к этим препаратам является одним из определяющих факторов успешности противоопухолевой терапии.
Индуцируемая диким типом белка р53 фосфатаза Wip1 является одной из его мишеней – ключевого регулятора ответа клетки на повреждения ДНК (Fiscella et al., 1997). Будучи активированной, Wip1 дефосфорилирует ряд белков, вовлеченных в ответ на повреждения ДНК – гистон H2AX, киназу ATM, Chk1,2, а также сам фактор p53 (Shreeram et al., 2006; Goloudina et al., 2016). Таким образом, фосфатаза Wip1 является регулятором ответа на повреждение ДНК (DDR, DNA damage response), инактивируя ключевые молекулы-участники этого процесса. Согласно многочисленным исследованиям, Wip1 может проявлять свойства онкогена. Она способна модулировать чувствительность раковых клеток к ДНК-повреждающим агентам (Goloudina et al., 2016). Было показано, что мутации и амплификации гена Ppm1d, кодирующего Wip1, обнаружены в опухолях рака легкого (Natrajan et al., 2009), яичников (Tan et al., 2009), а также ряде других видов опухолей (Saito-Ohara et al., 2003; Castellino et al., 2008; Liang et al., 2012; Peng et al., 2014; Richter et al., 2015).
В последнее время появились многочисленные работы, показывающие, что ген Ppm1d чаще других подвергается мутациям при химиотерапии (Coombs et al., 2017; Gibson et al., 2017). Индуцируемые химиопрепаратами мутации гена Ppm1d располагаются в последних двух экзонах гена и приводят к экспрессии более стабильной укороченной, но сохраняющей каталитический домен, версии белка. Оверэкспрессия Wip1 может усиливать способность клеток рака молочной железы формировать опухоли (Demidov et al., 2007). На некоторых линиях, например, MCF7, было показано, что оверэкспрессия Wip1 ведет к повышенной устойчивости к апоптозу (Yu et al., 2007). Недавние исследования острой миелоидной лейкемии показали, что подобные мутации повышают устойчивость злокачественных клеток к противоопухолевым препаратам цисплатине и доксорубицину и дают селективные преимущества при клональном гематопоэзе (Hsu et al., 2018). Таким образом, определение статуса Wip1 в опухоли может дать значимую информацию для разработки стратегии терапии опухоли.
Цель настоящей работы заключалась в изучении влияния повышенной экспрессии гена Ppm1d, кодирующего Wip1, или его делеции на ответ раковых клеток кишечника DLD1 на применение химиопрепаратов, входящих в противоопухолевый протокол FOLFOX – 5-фторурацила (ФУ) и оксалиплатины (ОП). Исследовали выживаемость клеток и их способность формировать клоны в низкой плотности посева после действия ФУ и ОП, а также их комбинированного действия. Согласно полученным нами данным, оверэкспрессия Wip1 повышает жизнеспособность и клоногенную выживаемость клеток DLD1 и при раздельном, и при совместном действии ФУ и ОП. В то же время отсутствие Wip1 снижает выживаемость клеток DLD1 при действии не только ОП, но и ФУ, к которому клетки дикого типа демонстрируют большую устойчивость. Полученные данные свидетельствуют о том, что повышение активности Wip1 может способствовать устойчивости раковых клеток к терапии, что важно для разработки стратегий терапии рака кишечника.
МАТЕРИАЛ И МЕТОДИКА
Создание клеточных линий рака кишечника DLD1 с модифицированным уровнем экспрессии фосфатазы Wip1. Трансфер гена Ppm1d для получения клеточной линии с увеличенной экпрессией Wip1 был осуществлен в составе лентивирусного вектора pLVX-EF1a-mCherry-N1 (#631 986; Clontech, США), куда по сайтам BamHI-NotI вместо рамки считывания mCherry была клонирована кДНК Wip1 человека. Корректность положения вставки была подтверждена секвенированием. Полученный вектор pLVX-EF1a-Wip1 в дальнейшем использовали для получения лентивирусных частиц, которыми трансфицировали клетки рака кишечника DLD1 для получения стабильной клеточной линии с увеличенной экспрессией Wip1. Клетки получены из Американской коллекции клеточных культур (American Type Culture Collection, США). Для упаковки лентивирусных частиц использовали клеточную линию 293T. Клетки котрансфицировали целевым вектором (pLVX-EF1a-Wip1 или pLVX-EF1a-mCherry-N1, #12 260 и #12 259 соответственно; Addgene, США) и вспомогательными, несущими белки gag и pol (psPax2) и белок оболочки vsv-g (pMD2.G). В качестве контроля трансдукции использовали исходный вектор pLVX-EF1a-mCherry-N1, несущий флуоресцентный белок mCherry. На третий день после трансдукции DLD1 лентивирусными частицами начинали селекцию клеток в присутствии 1 мкг/мл пуромицина. В полученной популяции клонов анализировали уровень экспрессии Wip1 методом Вестерн-блот-анализа.
ПЦР-генотипирование полученных линий. Клетки лизировали в буфере (5 мМ EDTA, pH 8.0; 200 мМ NaCl; 100 мМ Tris, pH 8.0; 0.2% SDS), содержащем 0.1 мг/мл протеиназы К в течение 1 ч. Затем проводили осаждение ДНК с помощью 100%-ного этанола, центрифугировали пробы и промывали осадок ДНК 70%-ным этанолом. ДНК растворяли в TE-буфере (10 мМ Tris-HCl, 0.2 мМ Na2EDTA, pH 7.5). Затем проводили ПЦР, бэнды выявляли с помощью электрофореза в 1.5%-ном агарозном геле и окрашивания бромистым этидием. Использовали следующие праймеры: к HDR обратный TCTCTAGGCACCCGTTCAAT; к Ppm1d человека к экзону 3 обратный AACAAGTCTGGGGTGAATCG и прямой CTGCCAGAAAAGGAATCTGG; к экзону 2 обратный CAACTGCCAGTGTGGTCATC и прямой CACCTCCACAGCTCTGACAA; к экзону 5 обратный TCTTGTGCCAAAATGCTTGT и прямой AAGGGCTGTCAGTCAGGTTC.
Культивирование клеток. Клетки культивировали в среде DMEM (стандартная среда Игла в модификации Дальбекко) в присутствии 10% сыворотки крупного рогатого скота (HyClone, США), пенициллина и стрептомицина при 5% CO2 и 37°С. В качестве противоопухолевых препаратов использовли ФУ и ОП в концентрации 10, 20 и 50 мкМ.
Вестерн-блот-анализ. Клетки лизировали в буфере (1% IGEPAL, 0.5% деоксихолата натрия; 0.1% SDS; 50 мМ TRIS-HCl pH 8.0; 150 мМ NaCl; 5 мМ EDTA pH 8.0; 60 мМ NaF) в течение 30 мин, центрифугировали и отбирали супернатант. Концентрацию белка в пробе определяли по методу Брэдфорда. Для электрофореза в 12%-ном SDS-полиакриламидном геле отбирали 50 мкг белка. После электрофоретического разделения белки переносили на PVDF-мембрану, проводили забивку в 5%-ном растворе молока в Tris-солевом буфере, содержащем 0.001% Tween-20 и инкубировали с первичными антителами к Wip1 (sc-376 257; Santa-Cruz, США) в течение 10 ч при 4°С. После отмывки мембрану инкубировали со вторичными антителами, коньюгированными с HRP (goat-anti-mouse; A9044; Sigma-Aldrich, США). Визуализацию бэндов осуществляли с помощью системы гель-документации GeneSys (SynGene, Великобритания).
Оценка жизнеспособности. Использовали два теста. Клетки высевали на 12-луночные платы и культивировали с ФУ и ОП раздельно и совместно в течение 96 ч. Через 48 и 96 ч культивирования среду заменяли на раствор 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолиум бромида (МТТ, 0.5 мг/мл) и инкубировали в течение 1 ч при 37°С. Затем поглощенный формазан растворяли в DMSO в течение 30 мин, отбирали по 80 мкл и проводили измерение оптической плотности на спектрофотометре Multiscan (США) при длине волны 572 нм.
Для оценки жизнеспособности по интенсивности поглощения 7-аминоактиномицина D (7-AAD) использовали цитометр Muse (Merck, Германия) и набор реактивов Count&Viability (MCH100102; Merck, Германия) согласно инструкции производителя. Клетки культивировали с ФУ и ОП в течение указанного времени, затем трипсинизировали, ресуспензировали в фосфатно-солевом буфере, смешивали 50 мкл суспензии клеток с 450 мкл раствора, содержащего 7-AAD и инкубировали 5 мин при комнатной температуре, затем проводили измерение интенсивности флуоресценции.
Анализ способности клеток формировать клоны в низкой плотности посева. Клетки культивировали с ФУ и ОП в течение 96 ч. Затем клетки трипсинизировали и высевали в свежую среду на культуральные чашки 35 мм в плотности 100 кл./мл. Клоны наблюдали в течение времени, необходимого для формирования клонов контрольными клетками, не подвергавшимися обработке 5ФУ и ОП (9 сут), среду заменяли на свежую каждые 2 сут. Через 9 сут чашки с клонами аккуратно промывали теплым (37°С) фосфатно-солевым буфером и окрашивали кристалл-виолетом в течение 30 мин.
Анализ распределения клеток по фазам клеточного цикла. Использовали цитометр Muse и набор реагентов Cell Cycle Assay kit (MCH100106; Merck, Германия) согласно инструкции производителя. Клетки фиксировали охлажденным 70%-ным этанолом в течение 3 ч, затем промывали в фосфатно-солевом буфере, ресуспензировали в растворе, содержащем йодид пропидия, и инкубировали в течение 30 мин в темноте, затем проводили цитометрироние.
Анализ β-галактозидазной активности, ассоциированной со старением (SA-β-Gal). Использовали ранее описанный метод (Dimri et al., 1995). Клетки на покровных стеклах фиксировали в 3.7%-ном формальдегиде, промывали в фосфатно-солевом буфере и инкубировали в буфере (pH 6.0), содержащем субстрат SA-β-Gal в течение 12–14 ч при 37°С. Конфокальные изображения клеток получали с помощью микроскопа Pascal (Carl Zeiss Microscopy, Германия). В качестве позитивного контроля для активности SA-β-Gal использовали эмбриональные фибробласты крысы, которые обрабатывали ингибитором гистоновых деацетилаз бутиратом натрия в течение 72 ч, что, согласно нашим предыдущим исследованиям, приводит к развитию старения этих клеток (Зубова и др., 2005).
Статистический анализ. Эксперименты производили в трех повторах, данные предоставлены как среднее и его ошибка. Обработку полученных результатов проводили в программе Microsoft Excel 2016. Достоверность оценивали с помощью t-критерия Стьюдента при P ≤ 0.05.
РЕЗУЛЬТАТЫ
Для выполнения поставленной задачи были модифицированы клетки рака толстого кишечника DLD1 с целью создания клонов с различным уровнем экспрессии белка Wip1. С помощью лентивирусной трансфекции были созданы клетки рака кишечника с оверэкспрессией Wip1. Транскрипция Wip1 в данном векторе осуществляется под контролем конститутивно активного промотора EF1a, не подвергающегося метилированию во многих клеточных линиях человека и мыши, включая опухолевые и стволовые клетки. Согласно результатам Вестерн-блотинга, полученные клоны характеризуются повышенным уровнем Wip1 (рис. 1а).
Рис. 1.
Клетки, оверэкспрессирующие фосфатазу Wip1 (Wip1On), демонстрируют лучшую выживаемость, чем клетки дикого типа (WT) при действии 5-фторурацила (ФУ) и оксалиплатины (ОП). а – Оверэкспрессия Wip1 в линии Wip1On, Вестерн-блот-анализ с антителами к Wip1 и GAPDH. б – Жизнеспособность клеток дикого типа при действии разных концентраций ФУ (серые столбцы) и ОП (белые столбцы), К – контроль. в – Жизнеспособность клеток WT и Wip1On в контроле (К) и при действии 50 мкМ ФУ и 20 мкМ ОП. Звездочками (б, в) отмечены точки, демонстрирующие достоверное отличие от контроля (P ≤ 0.05). г – Клоногенная выживаемость клеток WT и Wip1On при раздельном и совместном действии 50 мкМ ФУ и 20 мкМ ОП.
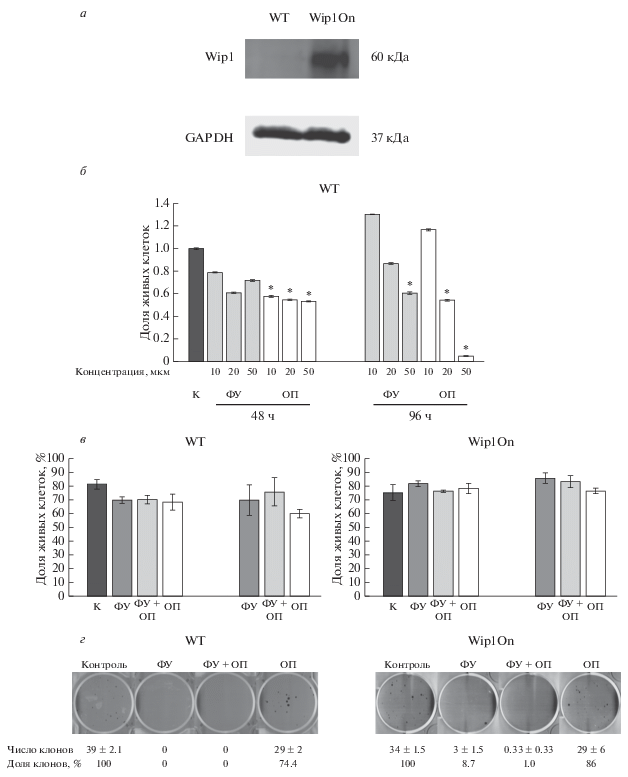
Далее мы оценили, как повышение уровня Wip1, которое может возникать как при спонтанной хромосомной амплификации гена, так и индуцироваться возникновением мутаций в ходе химиотерапии, сказывается на чувствительности раковых клеток к препаратам, используемым в клинике для лечения опухолей кишечника. Клетки дикого типа подвергали действию 10–50 мкМ ФУ и ОП по отдельности в течение 96 ч для выбора концентрации LD50 (для 50%-ной гибели клеток). По результатам, полученным с помощью МТТ-теста, были выбраны концентрации ФУ и ОП соответственно 50 и 20 мкМ (рис. 1б). Далее для выявления роли Wip1 в поддержании жизнеспособности клеток DLD1 при действии противоопухолевых препаратов клетки дикого типа (WT) и клетки, оверэкспрессирующие Wip1 (Wip1On), подвергали действию ФУ и ОП в выбранных концентрациях. Согласно полученным данным по интенсивности свечения 7-AAD (рис. 1в), клетки Wip1On оказались более устойчивы как к раздельным воздействиям ФУ и ОП, так и к их совместному действию, чем клетки дикого типа. Полученные данные подтверждаются анализом способности клеток формировать клоны в редком посеве после 96-часового культивирования в присутствии ФУ, ОП как порознь, так и совместно. Только 76% клеток WT способны сформировать клоны после действия ОП, в то время как у Wip1On клоны формируют 86% клеток. При этом культивирование в присутствии ФУ (в том числе и совместно с ОП) в течение 96 ч полностью подавляет способность клеток формировать клоны в низкой плотности посева (рис. 1г).
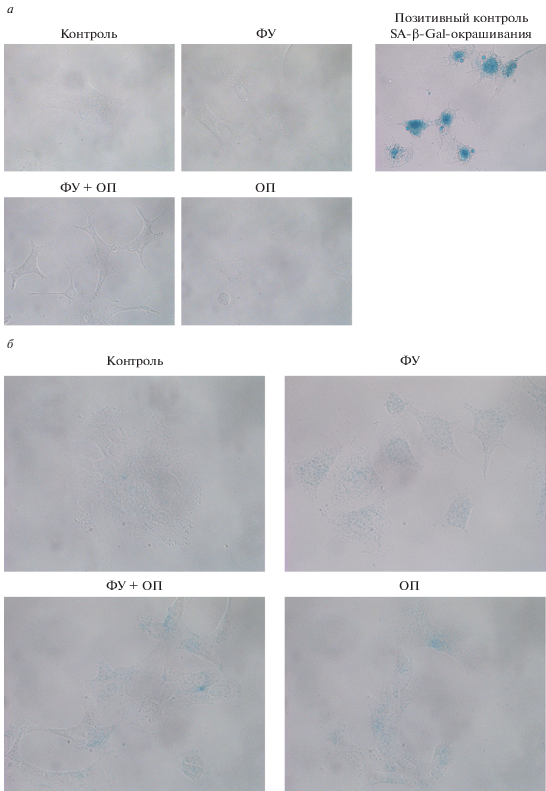
Известно, что клетки могут отвечать на противоопухолевую терапию индукцией старения (Ewald et al., 2010). Поэтому исследовали, индуцируются ли в клетках WT и Wip1On старение в ответ на действие ФУ и ОП. Было проанализировано распределение клеток по фазам клеточного цикла (рис. 2). Для клеток WT небольшое снижение доли клеток в S-фазе было отмечено только в случае совместного действия ФУ и ОП через 96 ч. Однако распределение клеток Wip1On по фазам клеточного цикла при раздельном и совместном действии ФУ и ОП никак не изменилось. Анализ ассоциированной со старением β-галактозидазной активности показал, что ни одна из линий не развивает эту активность в ответ ФУ, ОП и их комбинацию в использованных концентрациях (рис. 3а, 3б). Таким образом, устойчивость этих клеток к ФУ и ОП не связана с развитием старения.
Рис. 2.
Распределение клеток WT и Wip1On по фазам клеточного цикла в контроле (К) и при раздельном и совместном действии 50 мкМ ФУ и 20 мкМ ОП в течение 96 ч.
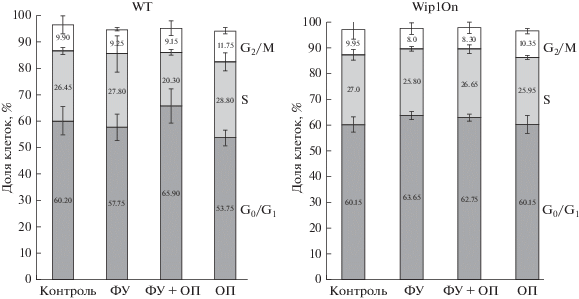
Рис. 3.
Ассоциированная со старением β-галактозидазная активность в клетках дикого типа WT (а) и в клетках с оверэкспрессией фосфатазы Wip1On (б) при раздельном и совместном действии 50 мкМ ФУ и 20 мкМ ОП в течение 96 ч. В качестве позитивного контроля использовали эмбриональные фибробласты крысы, в которых старение вызывали действием бутирата натрия (ингибитора гистоновых деацетилаз) в течение 72. Об.: 40×.
Чтобы подтвердить, что клетки со пониженным уровнем Wip1 имеют фенотип, противоположный не модифицированным клеткам или клеткам, оверэкспрессирующим Wip1, использовали клеточную линию DLD1 с нокаутом гена Ppm1d, кодирующего Wip1 (линия Wip1KO). Нокаут гена Ppm1d осуществлялся при помощи системы CRISPR/Cas9 (Santa Cruz, США). Данная система представляет собой пул из 3-х плазмид, несущих нуклеазу Cas9 и гидРНК на 2, 3 и 5 экзоны гена Wip1, а также 3 донорные плазмиды, содержащие кассету для селекции (loxP-EF1a-Puro-RFP-loxP), окруженную плечами гомологии к сайтам внесения двунитевых разрывов, соответствующих данным направляющей РНК (рис. 4а, 4б). После котрансфекции DLD1 пулом из 6 плазмид начинали селекцию клеток в присутствии 1 мкг/мл пуромицина, далее в популяции, устойчивой к пуромицину, анализировали экспрессию красного флуоресцентного белка RFP методом проточной цитометрии, выделяя RFP-положительные клетки. Как следует из рис. 4а, ПЦР-генотипирование RFP-положительных и устойчивых к пуромицину клеток показало, что нами получена успешная вставка кассеты во 2-й и 3-й экзон, но не в 5-й обоих аллелей (рис. 4а, клоны 5 и 6).
Рис. 4.
Делеция Wip1 усиливает чувствительность клеток DLD1 к действию ФУ и ОП. а: верхняя панель – ПЦР-генотипирование клонов DLD1 (дорожки 1–6) на наличие вставки селективной кассеты во 2-й, 3-й и 5-й экзон гена Ppm1d; стрелками обозначены клоны 5 и 6, успешно интегрировавшие вставку во все таргетируемые сайты; нижняя панель – ПЦР-генотипирование клонов DLD1 (дорожки 1–6) на присутствие аллели дикого типа, стрелками обозначены клоны 5 и 6, имеющие делецию гена Ppm1d. Дорожки 7 и 8 приведены в качестве контролей (экстракт геномной ДНК клеточных линий DLD1 дикого типа и MCF7 соответственно). б – Принципиальная схема осуществления вставки селективной кассеты в кодирующую часть гена Ppm1d методом CRISPR/Cas9; гидРНК – направляющая РНК. в – Жизнеспособность клеток с делецией Wip1 (Wip1KO) после 96-часового культивирования при раздельном или совместном (ФУ + ОП) присутствии 50 мкМ ФУ и 20 мкМ ОП; К – контроль; звездочками отмечены точки, демонстрирующие достоверное отличие от контроля (P ≤ 0.05). г – Клоногенная выживаемость клеток Wip1KO через 96 ч культивирования в присутствии ФУ и ОП порознь или совместно.
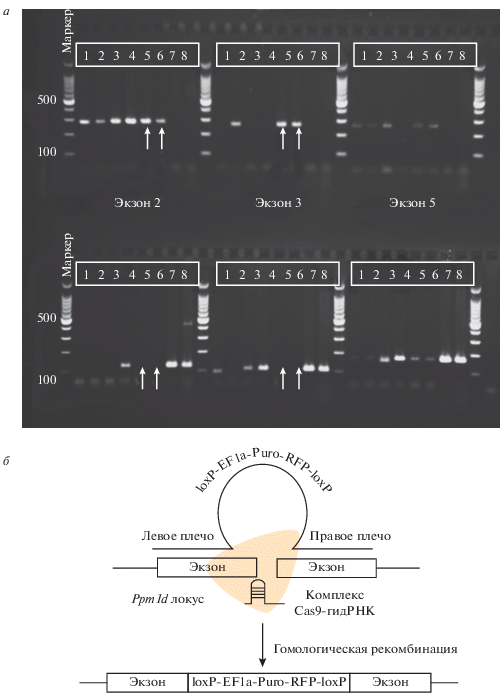
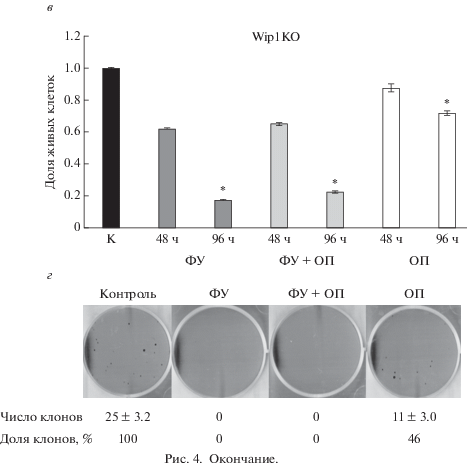
Согласно данным МТТ-теста и клоногенной выживаемости, делеция Wip1 усиливает чувствительность нокаутированных клеток к действию не только ОП, но и ФУ, а также к их совместному действию (рис. 4в, 4г). Кроме того, интересно отметить, что контрольные клетки с отсутствием Wip1 формируют меньше клонов, чем контрольные клетки WT и Wip1On, что говорит о том, что Wip1 поддерживает жизнеспособность клеток рака кишечника не только при действии противоопухолевых препаратов, но и в норме.
ОБСУЖДЕНИЕ
Несмотря на достижения последних лет в создании новых препаратов, направленных на таргетную терапию рака толстой кишки, применение комбинации химиопрепаратов ФУ и ОП остается одним из наиболее эффективных методов лечения пациентов с данным типом опухолей.
На клеточной модели рака молочной железы было обнаружено, что амплификация гена Ppm1d, локализованного на 17 хромосоме, локус 22–23, приводила к оверэкспрессии Wip1 и усиливала способность клеток рака молочной железы формировать опухоли (Bulavin et al., 2002). На некоторых клеточных линиях рака молочной железы с амплификацией гена Ppm1d, например, MCF7, было показано, что оверэкспрессия Wip1 ведет к повышенной устойчивости к апоптозу (Yu et al., 2007). В последние годы было обнаружено, что оверэкспрессия Wip1 может быть достигнута не только за счет амплификации гена, но и за счет появления мутаций в пятом и шестом экзонах гена, которые приводили к экспрессии более стабильной укороченной, но сохранившей каталитический домен, версии белка (Steensma et al., 2015; Hsu et al., 2018).
В настоящей работе оверэкспрессия Wip1 в клетках рака толстой кишки увеличивала их выживаемость при применении ФУ, ОП или их комбинации. Интересно, что комбинация данных препаратов имела менее выраженную токсичность, чем действие ОП, и походила на токсичность при применении только 5ФУ. Подобный паттерн распределения ответа на химиотерапию наблюдался и при анализе способности опухолевых клеток формировать клоны в редком посеве, но при этом наблюдали полное отсутствие клонов в случае комбинаторной терапии или действия одного ФУ. Оверэкспрессия Wip1 не способствовала росту колоний в этих двух случаях, но увеличивала количество колоний в случае применения ОП. Полученные результаты свидетельствуют, что оверэкспрессия Wip1, возникающая в ответ на применение химиопрепаратов, может являться одним из механизмов возникновения опухолевой устойчивости к химиотерапии. Ранее было показано, что мутации Ppm1d, в частности, мутация, приводящая к появлению стабильной укороченной формы Wip1, были обнаружены у пациентов, ранее подвергавшихся химиотерапии (Coombs et al., 2017; Pharoah et al., 2016). Повышенная устойчивость Wip1-оверэкспрессирующих опухолевых клеток может быть связана с тем, что Wip1 может обуславливать устойчивость к апоптозу. Было показано, что Wip1 дефосфорилирует проапоптотический белок Bax1, подавляя таким образом апоптоз клеток рака простаты в ответ на γ-облучение (Song et al., 2013). На модели нейробластомы показано, что ингибирование Wip1 с помощью специфического ингибитора GSK2830371 приводит к подавлению опухолевого роста и Chk2/p53-индуцированному апоптозу (Chen et al., 2016). Определение статуса Wip1 в опухолях, демонстрирующих повышенную устойчивость к общеприменимым противоопухолевым препаратам, важно для разработки стратегии терапии таких опухолей.
Для оценки потенциала возможного применения препаратов, снижающих уровень экспрессии Wip1 или ингибирующих активность Wip1 в клетках рака кишечника, мы создали клеточную линию, нокаутированную по гену фосфатазы Wip1 Ppm1d. В противоположность увеличенному уровню фосфатазы Wip1 в клетках рака толстой кишки, ее отсутствие усиливало действие обоих химиопрепаратов и их комбинации, что приводило к значительному снижению и жизнеспособности клеток, и их способности формировать клоны при низкой плотности посева по сравнению с не модифицированными клетками или клетками с оверэкспрессией Wip1. Ранее было показано, что делеция Wip1 способствует снижению жизнеспособности и апоптозу эмбриональных фибробластов мыши в ответ на повреждения ДНК (Xia et al., 2009). У мышей с нокаутом гена Ppm1d задерживалось восстановление волосяного покрова после облучения, что свидетельствовало о нарушении репаративных процессов при отсутствии функциональной Wip1 (Кочеткова и др., 2016). Будучи регулятором ключевых участников ответа на повреждения ДНК, Wip1 необходима для поддержания гомеостаза клеток и тканей в норме. Многочисленные данные исследований говорят о том, что и в опухолевых клетках для поддержания жизнеспособности также необходима активность Wip1.
Таким образом, мы показали, что увеличение уровня экспрессии фосфатазы Wip1 повышают устойчивость клеток рака кишечника к противоопухолевой терапии. Этот результат подтверждается данными, полученными на клетках с делецией гена Ppm1d, демонстрирующих понижение жизнеспособности и способности формировать клоны в диком посеве при действии ФУ и ОП, по сравнению с клетками дикого типа и Wip1-оверэкспрессирующими клетками. Поиск терапевтических подходов, направленных на снижение уровня и (или) активности Wip1 в раковых клетках важен для повышения эффективности препаратов, используемых в настоящем в клинике для лечения рака толстой кишки.
Список литературы
Зубова Ю.Г., Быкова Т.В., Зубова С.Г., Абрамова М.В., Аксенов Н.Д., Поспелов В.А., Поспелова Т.В. 2005. Индукция программы ускоренного старения ингибитором гистоновых деацетилах бутиратом натрия в нормальных и трансформированных фибробластах крысы. Цитология. 47(12) : 1055–1062. (Zubova Yu. G., Bykova T.V., Zubova S.G., Abramova M.V., Aksenov N.D., Pospelov V.A., Pospelova T.V. 2005. Induction of premature senescence program by an inhibitor of histone deacetylase sodium butyrate in normal and transformed rat fibroblasts. Tsitologiya. 47(12) : 1055–1062.)
Кочеткова Е.Ю., Поспелова Т.В., Демидов О.Н. 2016. Изменение чувствительности клеток кожи мышей к облучению ултрафиолетом типа В после удаления гена фосфатазы Wip1. Цитология. 58(3) : 213–218. (Kochetkova E.Yu., Pospelova T.V., Demidov O.N. 2016. Wip1 phosphatase affects sensitivity of murine skin cells to UV-B irradiation. Tsitologiia. 58(3) : 213–218).
Bulavin D.V., Demidov O.N., Saito S., Kauraniemi P., Phillips C., Amundson S.A., Ambrosino C., Sauter G., Nebreda A.R., Anderson C.W., Kallioniemi A., Fornace A.J.Jr., Appella E. 2002. Amplification of PPM1D in human tumors abrogates p53 tumor-suppressor activity. Nat Genet. 31 : 210–215.
Castellino R.C., De Bortoli M., Lu X., Moon S.H., Nguyen T.A., Shepard M.A., Rao P.H., Donehower L.A., Kim J.Y. 2008. Medulloblastomas overexpress the p53-inactivating oncogene WIP1/PPM1D. J. Neuro-Oncol. 86 : 245–256.
Chen Z., Wang L., Yao D., Yang T., Cao W.M., Dou J., Pang J.C., Guan S., Zhang H., Yu Y., Zhao Y., Wang Y., Xu X., Shi Y., Patel R., Zhang H., Vasudevan S.A., Liu S., Yang J., Nuchtern J.G. 2016. Wip1 inhibitor GSK2830371 inhibits neuroblastoma growth by inducing Chk2/p53-mediated apoptosis. Sci Rep. 6 : 38011.
Coombs C.C., Zehir A., Devlin S.M., Kishtagari A., Syed A., Jonsson P., Hyman D.M., Solit D.B., Robson M.E., Baselga J., Arcila M.E., Ladanyi M., Tallman M.S., Levine R.L., Berger M.F. 2017. Therapy-related clonal hematopoiesis in patients with non-hematologic cancers is common and associated with adverse clinical outcomes. Cell Stem Cell. 21 : 374–382.
Demidov O.N., Kek C., Shreeram S., Timofeev O., Fornace A.J.Jr., Appella E., Bulavin D.V. 2007. The role of the MKK6/p38 MAPK pathway in Wip1-dependent regulation of ErbB2driven mammary gland tumorigenesis. Oncogene. 26 : 2502–2506.
Dimri G.P., Lee X., Basile G., Acosta M., Scott G., Roskelley C., Medrano E.E., Linskens M., Rubelj I., Pereira-Smith O., Peacocke M., Campisi J. 1995. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proc. Natl. Acad. Sci. USA. 92 : 9363–9367.
Ewald J.A., Desotelle J.A., Wilding G., Jarrard D.F. 2010. Therapy-induced senescence in cancer. J. Natl. Cancer Inst. 102 : 1536–1546.
Fiscella M., Zhang H., Fan H.L., Sakaguchi K., Shen S., Mercer W.E., Vande Woude G.F., O’Connor P.M., Apella E. 1997. Wip1, a novel human protein phosphatase that is induced in response to ionizing radiation in a p53-dependent manner. Proc. Natl. Acad. Sci. USA. 94 : 6048–6053.
Gibson C.J., Lindsley R.C., Tchekmedyian V., Mar B.G., Shi J., Jaiswal S., Bosworth A., Francisco L., He, J., Bansal A., Morgan E.A., Lacasce A.S., Freedman A.S., Fisher D.C., Jacobsen E., Armand P., Alyea E.P., Koreth J., Ho V., Soiffer R.J., Antin J.H., Ritz J., Nikiforow S., Forman S.J., Michor F., Neuberg D., Bhatia R., Bhatia S., Ebert B.L. 2017. Clonal hematopoiesis associated with adverse outcomes after autologous stem-cell transplantation for lymphoma. J. Clin. Oncol. 35 : 1598–1605.
Giuliani J., Bonetti A. 2018. First-line therapies in metastatic colorectal cancer: Integrating clinical benefit with the costs of drugs. Int. J. Colorectal Dis. 33 : 1505–1516.
Goloudina A.R., Kochetkova E.Y., Pospelova T.V., Demidov O.N. 2016. Wip1 phosphatase: Between p53 and MAPK kinases pathways. Oncotarget 7 : 31563–31571.
Hsu J.I., Dayaram T., Tovy A., De Braekeleer E., Jeong M., Wang F., Zhang J., Heffeman T.P., Gera S., Kovacs J.J., Marszalek J.R., Bristow C., Yan Y., Garcia-Manero G., Kantarjian H., Vassiliou G., Futreal P.A., Donehower L.A., Takahashi K., Goodell M.A. 2018. PPM1D Mutations drive clonal hematopoiesis in response to cytotoxic chemotherapy. Cell Stem Cell. 23 : 700–713.
Liang C., Guo E., Lu S., Wang S., Kang C., Chang L., Liu L., Zhang G., Wu Z., Zhao Z., Ma S., Wang L., Jiao B.H. 2012. Over-expression of wild-type p53-induced phosphatase 1 confers poor prognosis of patients with gliomas. Brain Res. 1444 : 65–75.
Natrajan R., Lambros M.B., Rodríguez-Pinilla S.M., Moreno-Bueno G., Tan D.S.P., Marchió C., Vatcheva R., Rayter S., Mahler-Araujo B., Fulford L.G., Hungermann D., Mackay A., Grigoriadis A., Fenwick K., Tamber N., Hardisson D., Tutt A., Palacios J., Lord C.J., Buerger H., Ashworth A., Reis-Filho J.S. 2009. Tiling path genomic profiling of grade 3 invasive ductal breast cancers. Clin. Cancer Res. 15 : 2711–2722.
Peng T.S., He Y.H., Nie T., Hu X.D., Lu H.Y., Yi J., Shuai Y.F., Luo M. 2014. PPM1D is a prognostic marker and therapeutic target in colorectal cancer. Exp Ther Med. 8(2) : 430–434.
Pharoah P.D.P., Song H., Dicks E., Intermaggio M.P., Harrington P., Baynes C., Alsop K., Bogdanova N., Cicek M.S., Cunningham J.M., Fridley B.L., Gentry-Maharaj A., Hillemanns P., Lele S., Lester J., McGuire V., Moysich K.B., Poblete S., Sieh W., Sucheston-Campbell L., Widschwendter M., Whittemore A.S., Dörk T., Menon U., Odunsi K., Goode E.L., Karlan B.Y., Bowtell D.D., Gayther S.A., Ramus S.J., Australian Ovarian Cancer Study Group; Ovarian Cancer Association Consortium. 2016. PPM1D mosaic truncating variants in ovarian cancer cases may be treatment-related somatic mutations. J. Natl. Cancer Inst. 108(3) : Published online. https://doi.org/10.1093/jnci/djv347
Richter M., Dayaram T., Gilmartin A.G., Ganji G., Pemmasani S.K., Van Der Key H., Shohet J.M., Donehower L.A., Kumar R. 2015. WIP1 phosphatase as a potential therapeutic target in neuroblastoma. PLoS One. 10 : e0115635. https://doi.org/10.1371/journal.pone.0115635
Saito-Ohara F., Imoto I., Inoue J., Hosoi H., Nakagawara A., Sugimoto T., Inazawa J. 2003. PPM1D is a potential target for 17q gain in neuroblastoma. Cancer Res. 63 : 1876–1883.
Shreeram S., Demidov O.N., Hee W.K., Yamaguchi H., Onishi N., Kek C., Timofeev O.N., Dudgeon C., Fornace A.J., Anderson C.W., Minami Y., Appella E., Bulavin D.V. 2006. Wip1 phosphatase modulates ATM-dependent signaling pathways. Mol. Cell. 23 : 757–764.
Song J.Y., Ryu S.H., Cho Y.M., Kim Y.S., Lee B.M., Lee S.W., Choi J. 2013. Wip1 suppresses apoptotic cell death through direct dephosphorylation of BAX in response to γ-radiation. Cell Death Dis. 4 : e744. https://doi.org/10.1038/cddis.2013.252
Steensma D.P., Bejar R., Jaiswal S., Lindsley R.C., Sekeres M.A., Hasserjian R.P., Ebert B.L. 2015. Clonal hematopoiesis of indeterminate potential and its distinction from myelodysplastic syndromes. Blood. 126(1) : 9–16.
Tan D.S., Lambros M.B., Rayter S., Natrajan R., Vatcheva R., Gao Q., Marchio C., Geyer F.C., Savage K., Parry S., Fenwick K., Tamber N., Mackay A., Dexter T., Jameson C., McCluggage W.G., Williams A., Graham A., Faratian D., El-Bahrawy M., Paige A.J., Gabra H., Gore M.E., Zvelebil M., Lord C.J., Kaye S.B., Ashworth A., Reis-Filho J.S. 2009. PPM1D is a potential therapeutic target in ovarian clear cell carcinomas. Clin. Cancer Res. 15 : 2269–2280.
Yu E., Anh Y.S., Jang S.J., Kim M.J., Yoon H.S., Gong G., Choi J. 2007. Overexpression of the Wip1 gene abrogates the p38 MAPK/p53/Wip1 pathway and silences p16 expression in human breast cancers. Breast Cancer Res. Treat. 101 : 269–278.
Xia Y., Ongusaha P., Lee S.W., Liou Y.C. 2009. Loss of Wip1 sensitizes cells to stress- and DNA damage-induced apoptosis. J. Biol. Chem. 284 : 1742–17437.
Дополнительные материалы отсутствуют.


