Цитология, 2019, T. 61, № 5, стр. 404-411
Аутофагия в клетках гепатоцеллюлярной карциномы-29 при раздельном и совместном применении карбоната лития и рапамицина
Ю. С. Таскаева 1, 2, *, Н. П. Бгатова 1, А. О. Соловьева 1
1 Научно-исследовательский институт клинической и экспериментальной лимфологии – филиал Федерального исследовательского центра Института цитологии и генетики СО РАН
630060 Новосибирск, Россия
2 Лаборатория бор-нейтронозахватной терапии физического факультета Новосибирского национального исследовательского государственного университета
630090 Новосибирск, Россия
* E-mail: inabrite@yandex.ru
Поступила в редакцию 02.02.2019
После доработки 25.02.2019
Принята к публикации 26.02.2019
Аннотация
Роль аутофагии в развитии и прогрессировании гепатоцеллюлярной карциномы (ГЦК) неоднозначна и недостаточно изучена. Стимуляция аутофагии может представлять особый интерес в противоопухолевой фармакотерапии ГЦК. Рапамицин и литий являются признанными индукторами аутофагии. Цель настоящего исследования заключалась в сравнительной оценке уровня аутофагии в клетках ГЦК 29 (клетки Г-29) при раздельном и совместном применении карбоната лития и рапамицина. С помощью трансмиссионной электронной микроскопии и иммунофлюоресцентного анализа было выявлено более значительное образование аутолизосом и повышение экспрессии маркеров аутофагии LC3-beta и LAMP1 в популяции клеток Г-29 в условиях совместного введения карбоната лития и рапамицина. Эта комбинация препаратов может являться перспективной стратегией для химиотерапии ГЦК, поскольку позволит интегрировать различные клеточные сигнальные пути, регулирующие аутофагию и апоптоз в опухолевых клетках.
Аутофагия – это внутриклеточный механизм изоляции и деградации субклеточных компонентов в лизосомах для снабжения клетки энергией и пластическим материалом (Parzych, Klionsky, 2014; Bento et al., 2016). Выделяют три типа аутофагии: макроаутофагия, микроаутофагия и шаперон-опосредованная аутофагия (Parzych, Klionsky, 2014).
При микроаутофагии деградируемый груз попадает непосредственно в лизосому путем инвагинации лизосомальной мембраны. Шаперон-опосредованная аутофагия характеризуется высокой специфичностью: при этом типе аутофагии субстрат, предназначенный для деградации, содержит специфическую аминокислотную последовательность, которая распознается белком-шапероном HspA8 (heat shock protein 8), и с его помощью субстрат доставляется в лизосому (Cuervo, Wong, 2014; Parzych, Klionsky, 2014). При макроаутофагии предназначенный для деградации материал (груз) сначала ограничивается изолирующей мембраной (фагофором), которая, расширяясь и удлиняясь, секвестрирует груз с образованием двумембранной структуры – аутофагосомы, последняя затем сливается с лизосомой с образованием аутолизосомы, где полученный груз деградирует под действием лизосомных ферментов (Yang, Klionsky, 2009; Bento et al., 2016).
Роль макроаутофагии (далее: аутофагии) в канцерогенезе неоднозначна (Ávalos et al., 2014; Li et al., 2017). С одной стороны, известно, что аутофагия может способствовать выживаемости раковых клеток в условиях стресса или недостатка питательных веществ; с другой стороны, аутофагия может выступать в роли опухолевого супрессора, стимулируя аутофагическую гибель раковых клеток (Zhi, Zhong, 2015).
Наиболее известными индукторами аутофагии являются рапамицин, карбамазепин, вальпроат натрия, верапамил, амиодарон, лоперамид и литий (Sarkar et al., 2009). Рапамицин ингибирует серинтреонинкиназу mTOR (mammalian target of rapamycin), что вызывает активацию аутофагии (Sarkar et al., 2009). Литий является селективным ингибитором гликогенсинтазакиназы 3β (GSK-3β) – фермента, который участвует в регуляции клеточной пролиферации, дифференцировки и апоптоза опухолевых клеток (Quiroz et al., 2004). Кроме того, выявлена способность лития индуцировать аутофагию путем ингибирования фермента инозитолмонофосфатазы (IMPase) (Sarkar et al., 2005; Sade et al., 2016).
Одной из наиболее агрессивных и устойчивых к лекарственной терапии опухолей человека является гепатоцеллюлярная карцинома (ГЦК) (Germano, Daniele, 2014; Song, Bae, 2014). Роль аутофагии в развитии ГЦК также неоднозначна. Имеются данные, что ГЦК характеризуется дефицитной аутофагией (Dash et al., 2016). Несмотря на относительную изученность аутофагии, ее функции в развитии и прогрессировании ГЦК до сих пор неизвестны (Liu et al., 2017). Таким образом, стимуляция аутофагии может представлять особый интерес в противоопухолевой фармакотерапии ГЦК.
Цель настоящего исследования заключается в сравнительной оценке способности карбоната лития и рапамицина влиять на развитие аутофагии в популяции клеток ГЦК 29.
МАТЕРИАЛ И МЕТОДИКА
Клетки. Для моделирования опухолевого процесса использовали клеточную линию гепатоцеллюлярной карциномы-29 (клетки Г-29), полученную и верифицированную сотрудниками Института цитологии и генетики СО РАН и любезно предоставленную для наших исследований (Каледин и др., 2009). Клетки Г-29 культивировали в течение 48 ч в ростовой питательной среде RPMI, содержащей 10% сыворотки крови плодов коровы в CO2-инкубаторе при 37°С. Посевная концентрация составляла 2.0 × 106 кл./мл. Были сформированы 4 экспериментальные группы: контрольная (клетки, культивированные в питательной среде без добавления препаратов); группа, получавшая 5 мМ карбоната лития; группа, получавшая 10 нМ рапамицина и группа, получавшая одновременно 5 мМ карбоната лития и 10 нМ рапамицина. Клетки культивировали в питательной среде в присутствии карбоната лития и (или) рапамицина в течение 48 ч.
Световая и трансмиссионная электронная микроскопия. Для проведения микроскопии клетки фиксировали в 4%-ном растворе параформальдегида, приготовленном на среде Хенкса, дофиксировали в течение 1 ч в 1%-ном растворе тетраоксида осмия (ОsO4) на фосфатном буфере pH 7.4, дегидратировали в этиловом спирте возрастающей концентрации и заключали в эпон. Полутонкие срезы толщиной 1 мкм получали на ультрамикротоме Leica EM UC7 (Leica Microsystems, Германия), окрашивали толуидиновым синим, с помощью светового микроскопа LEICA DME (Leica Microsystems, Германия) выбирали образцы для исследования в электронном микроскопе. Из отобранного материала изготавливали ультратонкие срезы толщиной 70–100 нм на ультратоме Leica EM UC7 (Leica Microsystems, Германия), контрастировали насыщенным водным раствором уранилацетата и цитратом свинца. Фотографии получали с помощью электронного микроскопа JEM 1400 (JEOL, Япония).
Иммунофлюоресцентное исследование клеточной культуры Г-29. Клетки Г-29 наносили на полилизиновые стекла и фиксировали 10%-ным раствором формалина в течение 15 мин. После фиксации клетки трижды отмывали раствором PBS, затем покрывали раствором для блокирования неспецифического связывания антител (PBS, содержащем 2.5% бычьего сывороточного альбумина (BSA) и 0.25% тритона X-100), и инкубировали при комнатной температуре в течение 60 мин. Затем клетки гибридизовали с первичными поликлональными антителами к LC3β (microtubule-associated proteins 1A/1B light chain 3B) и LAMP1 (lysosomal-associated membrane protein 1) в течение ночи при 4°С и далее с соответствующими вторичными антителами, конъюгированными с флюорохромом, в течение 30 мин при 37°С. После гибридизации клетки отмывали и заключали в монтирующую среду, содержащую DAPI. Изображения получали на флюоресцентном микроскопе Axio Observer Z1 (Zeiss, Германия).
Морфометрия и статистический анализ. Морфометрию цифровых изображений, полученных в результате иммунофлюоресцентного окрашивания, проводили с помощью программного обеспечения Image J (Wayne Rasband, США), используя закрытую тестовую систему. Для оценки результатов иммунофлюоресцентного окрашивания клеток Г-29 были выбраны по 10 полей зрения для каждой исследуемой группы (общая тестовая площадь составила 0.005 мм2 для каждой группы). Считали клетки, содержащие везикулы, позитивные на маркеры LC3β или LAMP1, а также общее число клеток в каждом поле зрения. Данные представлены в виде средней доли (%) клеток на группу, имеющих LCβ3- или LAMP1-позитивные везикулы.
Среднее значение и стандартное отклонение вычисляли с помощью программного обеспечения Microsoft Excel (Microsoft, США). Достоверность различий между исследуемыми параметрами определяли с помощью программного обеспечения Statistica 6.0 (StatSoft, США) с использованием U-критерия Манна−Уитни (непараметрическая статистика) при уровне достоверности 95% (P < 0.05).
Использованные реактивы: карбонат лития (Завод редких металлов, Новосибирск, Россия); рапамицин (Invivogen, США); осмий тетроксид (Sigma, США); эпон (Serva, Германия); Triton X-100 (Sigma-Aldrich, США); BSA (бычий сывороточный альбумин) (Биолот, Россия); гематоксилин Майера (Биовитрум, Россия); монтирующая среда с красителем DAPI (4',6-diamidino-2-phenylindole) (Abcam, Великобритания); антитела (Abcam, Великобритания): поликлональные кролика к LC3β человека, мыши и крысы (ab48394), моноклональные крысы к LAMP1 человека и мыши (ab25245), а также вторичные поликлональные антитела козла к IgG кролика, конъюгированные с Alexa Fluor®488 (ab150077) и вторичные поликлональные антитела козла к IgG крысы, конъюгированные с Alexa Fluor®568 (ab175476).
РЕЗУЛЬТАТЫ
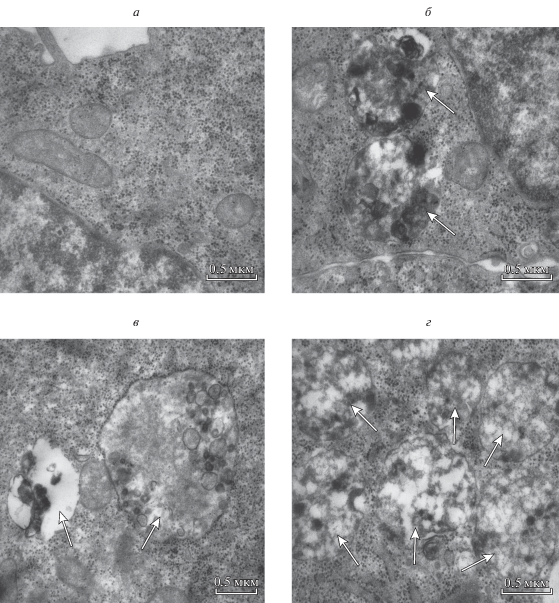
С помощью трансмиссионной электронной микроскопии в клетках Г-29 после введения карбоната лития и рапамицина были выявлены ультраструктурные признаки аутофагии: накопление аутолизосом, деградация цитоплазматического содержимого и субклеточных компонентов (рис. 1).
Рис. 1.
Ультраструктурные признаки аутофагии: накопление аутолизосом и деградация цитоплазматического содержимого (стрелки) в клетках гепатоцеллюлярной карциномы (ГЦК) 29 через 48 ч после культивирования в присутствии карбоната лития и (или) рапамицина. а – Контрольные клетки; б – в среде с 5 мМ карбоната лития; в – в среде с 10 нМ рапамицина; г – в среде с одновременным присутствием 5 мМ карбоната лития и 10 нМ рапамицина. Трансмиссионная электронная микроскопия, увел.: 50 000×.
С помощью иммунофлюоресцентного исследования оценивали способность карбоната лития и рапамицина влиять на экспрессию маркеров аутофагии LC3β (рис. 2) и LAMP1 (рис. 3) в клетках Г-29. Считали долю клеток (%), имеющих LC3β-позитивные аутофагические структуры и LAMP1-позитивные структуры (рис. 4). В среднем доля клеток в группе контроля с LCβ3 -позитивными везикулами составляла 6.08 ± 5.6%. При введении карбоната лития значимо повышалось число таких клеток в 3.9 раз (P < 0.005) по сравнению с контрольной группой; при введении рапамицина – в 2.7 раз (P < 0.005), а при совместном введении карбоната лития и рапамицина – в 8 раз (P < 0.005).
Рис. 2.
Иммунофлюоресцентное окрашивание клеток ГЦК 29 на маркер аутофагии LC3β после 48-часового культивирования их в присутствии карбоната лития и (или) рапамицина. а – Контрольные клетки; б – в присутствии 5 мМ карбоната лития; в – в присутствии 10 нМ рапамицина; г – одновременное присутствие 5 мМ карбоната лития и 10 нМ рапамицина. LC3β – зеленый цвет, окраска ядер DAPI – синий. Об.: 40×.
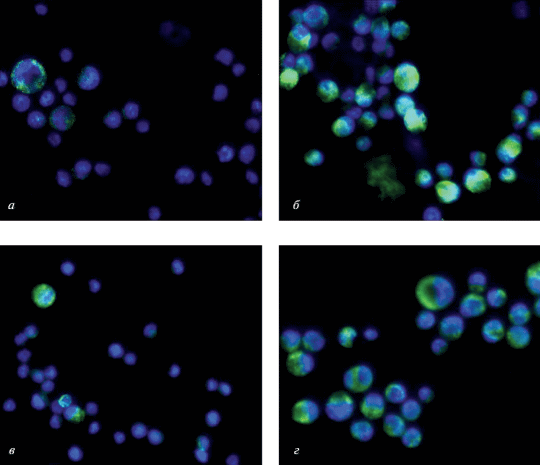
Рис. 3.
Иммунофлюоресцентное окрашивание клеточной культуры ГЦК на маркер аутофагии LAMP1 после 48-часового культивирования их в присутствии карбоната лития и (или) рапамицина. а – Контрольные клетки; б – в присутствии 5 мМ карбоната лития; в – в присутствии 10 нМ рапамицина; г – одновременное присутствие 5 мМ карбоната лития и 10 нМ рапамицина. LAMP1 – красный цвет, окраска ядер DAPI – синий. Об.: 40×.
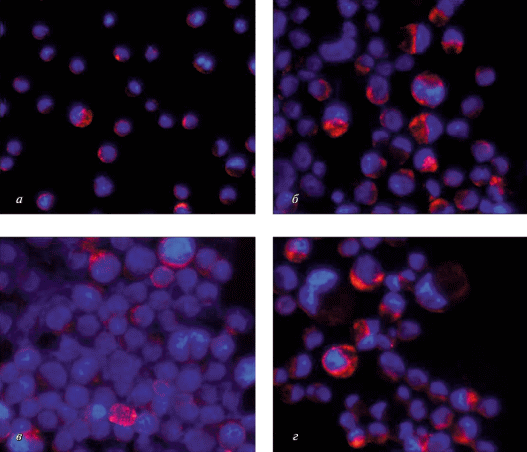
Рис. 4.
Распределение клеток по маркерам аутофагии LC3β и LAMP1 в контрольной группе (К) и через 48 ч после культивирования с карбонатом лития (КЛ) и рапамицином (Рап) раздельно и совместно. Различия достоверны по отношению к группе контроля (К) при *P < 0.005; по отношению к группе КЛ при #P < 0.05; по отношению к группе КЛ и Рап при 1P < 0.005; 2P < 0.05. Достоверных различий при сравнении с другими группами выявлено не было.
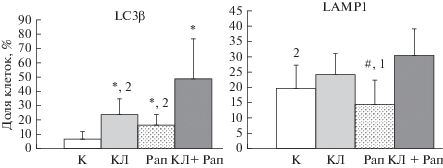
Кроме того, отмечено, что совместное введение карбоната лития и рапамицина способствовало увеличению числа клеток с LC3β-позитивными аутофагическими структурами в 2.1 раза по сравнению с группой, получавшей только карбонат лития (P < 0.05) и в 3 раза по сравнению с группой, получавшей только рапамицин (P < 0.05). Достоверных различий при сравнении с другими группами выявлено не было.
При подсчете числа клеток, имеющих LAMP1-позитивные структуры, было выявлено, что доля таких клеток в группе контроля составляла 19.9 ± 7.2% от общего числа. Совместное введение карбоната лития и рапамицина способствовало достоверному повышению количества клеток с LAMP1-позитивными структурами в 1.5 раз по сравнению с контрольной группой (P < 0.05) и в 2 раза по сравнению с группой, получавшей только рапамицин (P < 0.005). Кроме того, при введении карбоната лития увеличивалось число таких клеток в 1.7 раз (P < 0.005) по сравнению с группой, получавшей только рапамицин. Достоверных различий при сравнении с другими группами выявлено не было.
ОБСУЖДЕНИЕ
Основной регулятор аутофагии – метаболическое состояние клетки. Снижение факторов роста, уменьшение количества питательных веществ и кислорода могут индуцировать развитие аутофагии в клетке. Комплекс mTORC1 (mammalian target of rapamycin complex 1) является одним из первичных сенсорных сигнальных путей, реагирующих на изменения в поступлении питательных веществ: при снижении поступления нутриентов происходит торможение его негативной регуляции аутофагии (Yin et al., 2016).
Аутофагия может запускаться множеством клеточных сигнальных путей, среди которых можно выделить основные: mTOR-зависимые и mTOR-независимые. К mTOR-зависимым путям относятся сигнальный путь PI3K/АКТ/mTOR и сигнальный путь АМPK (5'AMP-activated protein kinase); при этом предполагается, что именно эти пути в основном регулируют аутофагию, индуцированную голоданием, снижением факторов роста, гипоксией и другими внешними факторами.
При достаточном поступлении питательных веществ ферменты класса I (фосфатидилинозитол-3-киназа (PI3K)) активируют протеинкиназу В (Akt), что приводит к ингибированию комплекса туберозного склероза TSC1/2 и негативной регуляции белка RHEB (белок из семейства Ras, которым богата кора головного мозга); последнее активирует mTOR и ингибирует сборку комплекса инициации аутофагии (Manning et al., 2002; Inoki et al., 2003; Huang, Manning, 2008).
Снижение поступления нутриентов и факторов роста через сигнальный каскад PI3K/АКТ/mTOR тормозит активность mTOR и запускает аутофагию. Энергетический дефицит стимулирует АМPK к фосфорилированию комплекса TSC1/2 (Inoki, et al., 2003), что в конечном итоге также приводит к инициации аутофагии через ингибирование mTOR. Увеличение уровня фактора, индуцируемого гипоксией HIF1 способствует накоплению белка DDIT4 (транскрипта-4, индуцируемого повреждением ДНК) и, следовательно, активации комплекса TSC1/2, что приводит к ингибированию mTOR через RHEB и запуску аутофагии (Shoshani et al., 2002; Inoki et al., 2003; DeYoung et al., 2008; Sato et al., 2010). Согласно данным из литературы, сигнальный путь PI3K/АКТ/mTOR считается потенциальной мишенью для химиотерапии, так как его активация происходит при различных типах рака (Russo, Russo, 2018). Рапамицин является признанным индуктором аутофагии, и реализует свои эффекты за счет ингибирования mTOR (Noda, Ohsumi, 1998).
mTOR-независимые сигнальные пути весьма многочисленны и включают Са2+-кальпаиновый сигнальный путь, сигнальный путь фосфоинозитола, а также многие другие. Литий индуцирует аутофагию за счет модуляции сигнального пути фосфатидилинозитола, независимо от сигнализации PI3K/AKT/mTOR. Было выявлено, что ингибирование литием IMPase, приводящее к истощению свободного инозитола и снижению уровней инозитол-1,4,5-трифосфата (IP3), индуцирует аутофагию (Sarkar et al., 2005). Однако позже было показано (Sade et al., 2016), что накопление IP3 может вызывать десенситизацию и снижение количества рецепторов к IP3 (IP3R). IP3R способны связывать белки Beclin 1 и Bcl-2, формируя специфический комплекс, состоящий из IP3R, Beclin 1 и Bcl-2. Высвобождение Beclin 1 из этого комплекса стимулирует развитие аутофагии (Vicencio et al., 2009). Таким образом, опосредуемое литием снижение количества IP3R может способствовать аутофагии, однако точную молекулярную основу этого взаимодействия еще предстоит выяснить.
С помощью трансмиссионной электронной микроскопии и иммунофлюоресцентного исследования в клетках Г-29 было выявлено, что после культивирования в присутствии карбоната лития или рапамицина в течение 48 ч образуются аутолизосомы и повышается экспрессия маркеров аутофагии LC3β и LAMP1. В то же время было выявлено, что при совместном введении карбоната лития и рапамицина увеличение количества клеток с LC3β-позитивными аутофагическими структурами более значительно по сравнению с группами, получавшими только карбонат лития или рапамицин.
Согласно данным из литературы, рапамицин и литий индуцируют аутофагию в клетках Г-29 предположительно за счет модуляции mTOR-зависимых (рапамицин) и mTOR-независимых (литий) сигнальных путей. Однако другая внутриклеточная мишень лития – GSK-3β также принимает участие в сигнальной оси PI3K/AKT/mTOR: ингибирование GSK-3β литием активирует mTOR за счет опосредуемого GSK-3β-фосфорилирования (и ингибирования) белка TSC 2 (Inoki et al., 2006). Тем не менее, было показано, что при моделировании болезни Хантингтона in vivo комбинированное применение рапамицина и лития имело взаимноусиливающее действие на аутофагию за счет активации mTOR-зависимых и mTOR-независимых сигнальных путей (Sarkar et al., 2008).
Ранее нами были получены данные, свидетельствующие об активации аутофагии (Taskaeva, Bgatova, 2018; Таскаева, Бгатова, 2019), а также снижении жизнеспособности (Гаврилова и др., 2016) и повышении апоптоза клеток ГЦК после введения солей лития (Бгатова и др., 2017). Результаты представленных экспериментов свидетельствуют, что совместное введение карбоната лития и рапамицина способствует значительному повышению образования аутолизосом и увеличению экспрессии маркеров аутофагии LC3β и LAMP1 в клетках Г-29. Необходимо проведение дальнейших исследований с использованием дополнительных высокотехнологичных методов визуализации аутофагического потока (иммуно-электронной микроскопии, проточной цитометрии, вестерн-блот-анализ и др.) для комплексного мониторинга аутофагии и оценки вклада всех аутофагических структур в процесс деградации в клетках Г-29 in vitro и in vivo при введении лития. Комбинированное применение лития и рапамицина может являться перспективной стратегией для химиотерапии ГЦК, поскольку позволит интегрировать различные клеточные сигнальные пути, регулирующие аутофагию и апоптоз в опухолевых клетках.
Список литературы
Бгатова Н.П., Гаврилова Ю.С., Лыков А.П., Соловьева А.О., Макарова В.В., Бородин Ю.И., Коненков В.И. 2017. Апоптоз и аутофагия в клетках гепатокарциномы, индуцированные различными формами солей лития. Цитология. 59(3) : 178–184. (Bgatova N.P., Gavrilova Yu.S., Lykov A.P., Solovieva A.O., Makarova V.V., Borodin Yu.I., Konenkov V.I. 2017. Apoptosis and autophagy in hepatocarcinoma cells induced by different forms of lithium salts. Cell Tiss. Biol. 11(4) : 261–267.)
Гаврилова Ю.С., Бгатова Н.П., Соловьева А.О., Трифонова К.Э., Лыков А.П., Бородин Ю.И., Коненков В.И. 2016. Клетки-мишени различных форм лития в гетерогенной популяции гепатокарциномы-29. Цитология. 58(3) : 186–191. (Gavrilova Y.S., Bgatova N.P., Solov’eva A.O., Trifonova K.E., Lykov A.P., Borodin Y.I., Konenkov V.I. 2016. Target cells for lithium in different forms within a heterogeneous hepatocarcinoma-29 population. Cell Tiss. Biol. 10(4) : 284–289.)
Каледин В.И., Жукова Н.А., Николин В.П. Попова Н.А., Беляев М.Д., Багинская Н.В., Литвинова Е.А., Толстикова Т.Г., Лушникова Е.Л., Семенов Д.Е. 2009. Гепатокарцинома-29 – метастазирующая перевиваемая опухоль мышей, вызывающая кахексию. Бюл. экспер. биол. 148(12) : 664–669. (Kaledin V.I., Zhukova N.A., Nikolin V.P., Popova N.A., Belyaev M.D., Baginskaya N.V., Litvinova E.A., Tolstikova T.G., Lushnikova E.L., Semenov D.E. 2009. Hepatocellular carcinoma-29 – metastatic transplantable tumor of mice, causing cachexia. Bull. Exper. Biol. Med. 148(12) : 664–669.)
Таскаева Ю.С., Бгатова Н.П. 2019. Ультраструктурные изменения в клетках гепатоцеллюлярной карциномы-29 при введении карбоната лития в эксперименте. Бюл. экспер. биол. 167(1) : 94–98. (Taskaeva Iu., Bgatova N. 2019. Ultrastructural changes in hepatocellular carcinoma-29 cells with lithium carbonate introduction in vivo. Bull. Exper. Biol. Med. 167(1) : 94–98.)
Ávalos Y., Canales J., Bravo-Sagua R., Criollo A., Lavandero S., Quest A.F. 2014. Tumor suppression and promotion by autophagy. Biomed. Res. Int. 2014 : 603980. https://doi.org/10.1155/2014/603980
Bento C.F., Renna M., Ghislat G., Puri C., Ashkenazi A., Vicinanza M., Menzies F.M., Rubinsztein D.C. 2016. Mammalian autophagy: How does it work? Annu. Rev. Biochem. 85 : 685–713.
Cuervo A.M., Wong E. 2014. Chaperone-mediated autophagy: Roles in disease and aging. Cell Res. 1 : 92–104.
Dash S., Chava S., Chandra P.K., Aydin Y., Balart L.A., Wu T. 2016. Autophagy in hepatocellular carcinomas: From pathophysiology to therapeutic response. Hepat. Med. 8 : 9–20.
DeYoung M.P., Horak P., Sofer A., Sgroi D., Ellisen L.W. 2008. Hypoxia regulates TSC1/2-mTOR signaling and tumor suppression through REDD1-mediated 14-3-3 shuttling. Genes. Dev. 2 : 239–251.
Germano D., Daniele B. 2014. Systemic therapy of hepatocellular carcinoma: Current status and future perspectives. World J. Gastroenterol. 12 : 3087–3099.
Huang J., Manning B.D. 2008. The TSC1-TSC2 complex: A molecular switchboard controlling cell growth. Biochem. J. 2 : 179–190.
Inoki K., Li Y., Xu T., Guan K.L. 2003. Rheb GTPase is a direct target of TSC2 GAP activity and regulates mTOR signaling. Genes. Dev. 15 : 1829–1834.
Inoki K., Ouyang H., Zhu T., Lindvall C., Wang Y., Zhang X., Yang Q., Bennett C., Harada Y., Stankunas K., Wang C.Y., He X., MacDougald O.A., You M., Williams B.O., Guan K.L. 2006. TSC2 integrates Wnt and energy signals via a coordinated phosphorylation by AMPK and GSK3 to regulate cell growth. Cell. 126 : 955–968.
Inoki K., Zhu T., Guan K.L. 2003. TSC2 mediates cellular energy response to control cell growth and survival. Cell. 5 : 577–590.
Li Y.Y., Feun L.G., Thongkum A., Tu C.H., Chen S.M., Wangpaichitr M., Wu C., Kuo M.T., Savaraj N. 2017. Autophagic mechanism in anti-cancer immunity: Its pros and cons for cancer therapy. Int. J. Mol. Sci. 18. https://doi.org/10.3390/ijms18061297
Liu L., Liao J.Z., He X.X., Li P.Y. 2017. The role of autophagy in hepatocellular carcinoma: Friend or foe. Oncotarget. 34 : 57 707–57 722.
Manning B.D., Tee A.R., Logsdon M.N., Blenis J., Cantley L.C. 2002. Identification of the tuberous sclerosis complex-2 tumor suppressor gene product tuberin as a target of the phosphoinositide 3-kinase/akt pathway. Mol. Cell. 1 : 151–62.
Noda T., Ohsumi Y. 1998. TOR, a phosphatidylinositol kinase homologue, controls autophagy in yeast. J. Biol. Chem. 273 : 3963–3966.
Parzych K.R., Klionsky D.J. 2014. An overview of autophagy: Morphology, mechanism, and regulation. Antioxid. Redox. Signal. 3 : 460–473.
Quiroz, J.A., Gould, T.D., Manji, H.K. 2004. Molecular effects of lithium. J. Mol. Interv. 5 : 259–272.
Russo M., Russo G.L. 2018. Autophagy inducers in cancer. Biochem. Pharmacol. 153 : 51–61.
Sade Y., Toker L., Kara N.Z., Einat H., Rapoport S., Moechars D., Berry G.T., Bersudsky Y., Agam G. 2016. IP3 accumulation and/or inositol depletion: Two downstream lithium’s effects that may mediate its behavioral and cellular changes. Transl. Psychiatry. 6 : e968. https://doi.org/10.1038/tp.2016.217
Sarkar S., Floto R.A., Berger Z., Imarisio S., Cordenier A., Pasco M., Cook L.J., Rubinsztein D.C. 2005. Lithium induces autophagy by inhibiting inositol monophosphatase. J. Cell Biol. 170 : 1101–1111.
Sarkar S., Krishna G., Imarisio S., Saiki S., O’Kane C.J., Rubinsztein D.C. 2008. A rational mechanism for combination treatment of Huntington’s disease using lithium and rapamycin. Hum. Mol. Genet. 2 : 170–178.
Sarkar S., Ravikumar B., Floto R.A., Rubinsztein D.C. 2009. Rapamycin and mTOR-independent autophagy inducers ameliorate toxicity of polyglutamine-expanded huntingtin and related proteinopathies. Cell Death Differ. 1 : 46–56.
Sato T., Nakashima A., Guo L., Coffman K., Tamanoi F. 2010. Single amino-acid changes that confer constitutive activation of mTOR are discovered in human cancer. Oncogene. 18 : 2746–2752.
Shoshani T. Faerman A., Mett I., Zelin E., Tenne T., Gorodin S., Moshel Y., Elbaz S., Budanov A., Chajut A., Kalinski H., Kamer I., Rozen A., Mor O., Keshet E., Leshkowitz D., Einat P., Skaliter R., Feinstein E. 2002. Identification of a novel hypoxia-inducible factor 1-responsive gene, RTP801, involved in apoptosis. Mol. Cell Biol. 7 : 2283–2293.
Song M.J., Bae S.H. 2014. Newer treatments for advanced hepatocellular carcinoma. Korean J. Intern. Med. 2 : 149–55.
Taskaeva Iu., Bgatova N. 2018. Ultrastructural and immunofluorescent analysis of lithium effects on autophagy in hepatocellular carcinoma cells. Asian Pac. J. Cancer. Biol. 3 : 83–87.
Vicencio J.M., Ortiz C., Criollo A., Jones A.W., Kepp O., Galluzzi L., Joza N., Vitale I., Morselli E., Tailler M., Castedo M., Maiuri M.C., Molgó J., Szabadkai G., Lavandero S., Kroemer G. 2009. The inositol 1,4,5-trisphosphate receptor regulates autophagy through its interaction with Beclin 1. Cell Death Differ. 16 : 1006–17.
Yang Z., Klionsky D.J. 2009. An overview of the molecular mechanism of autophagy. Curr. Top. Microbiol. Immunol. 335 : 1–32.
Yin Z., Pascual C., Klionsky D.J. 2016. Autophagy: Machinery and regulation. Microb. Cell. 12 : 588–596.
Zhi X., Zhong Q. 2015. Autophagy in cancer. F1000Prime Rep. 7 : 18. https://doi.org/10.12703/P7-18
Дополнительные материалы отсутствуют.


