Цитология, 2019, T. 61, № 5, стр. 370-384
ЭТАПЫ ГИСТОГЕНЕЗА ОСТЕОГЕННОГО ТРАНСПЛАНТАТА В КУЛЬТУРАЛЬНОЙ СРЕДЕ И РЕЦИПИЕНТНОМ ЛОЖЕ
А. М. Зайдман 1, *, И. А. Шевченко 2, Е. Л. Строкова 1, А. Ф. Гусев 1, 3, Н. Ю. Пахомова 1, И. А. Кирилова 1, В. В. Рерих 1, 3, В. М. Субботин 4
1 Новосибирский научно-исследовательский институт травматологии и ортопедии
им. Я.Л. Цивьяна
630091 Новосибирск, Россия
2 Федеральный исследовательский центр Институт цитологии и генетики СО РАН
630090 Новосибирск, Россия
3 Новосибирский государственный медицинский университет
630091 Новосибирск, Россия
4 Arrowhead Pharmaceuticals, Madison WI, and University of Pittsburgh
Pittsburgh, PA, USA
* E-mail: AZaydman@niito.ru
Поступила в редакцию 05.12.2018
После доработки 15.02.2019
Принята к публикации 26.02.2019
Аннотация
В статье представлены стадии остеогенной дифференцировки хондрогенного трансплантата в культуральной среде и в реципиентном ложе (дефекте костной ткани). В культуральной среде в хондротрансплантате происходят преобразования клеток и матрикса, формирование сосудистых полостей с эндотелиальной выстилкой, образование матричных везикул в остеобластах (первая стадия минерализации). Экспрессия генов и детекция белков хондрогенного типа сменяется экспрессией генов и белков остеогенной стадии дифференцировки. Дальнейшие этапы гистогенеза костной ткани происходят в реципиентном ложе. Через сформированные анастомозы сосудов остеотрансплантата и реципиента поступают гуморальные факторы регуляции и пластические вещества, на основе которых завершается процесс формирования органоспецифического регенерата с полной интеграцией в организм реципиента. Результаты исследования являются основанием для дальнейшего применения остеогенного трансплантата в клинической практике.
Костная система в процессе эволюции развилась в качестве опорной структуры в составе внутреннего скелета. С усложнением организмов функции костной системы значительно расширились. Прежде всего, это необходимый компонент нормального развития клеток костного мозга, который является источником обновления всей системы внутренней среды млекопитающих (Заварзин, 1976; Deckers et al., 2002). Размножение и дифференцировка стволовых клеток в направлении образования кроветворных клеток и форменных элементов крови требуют тесного контакта с костью, находящейся в состоянии активного остеогенеза (Фриденштейн, Лурия, 1980; Street et al., 2002). Это подтверждается и при образовании эктопической костной ткани, в которой неизменно формируется миелоидный костный мозг и возникает новый костномозговой орган. Участие в гистогенезе кроветворной ткани – важная функция костной ткани (Dai, Rabie, 2007; Claes et al., 2012).
Костная ткань представляет собой депо минерального обмена. Костные кристаллы (кристаллы гидроксиапатита) у человека с массой тела 70 кг содержат 1200 г кальция, суммарная поверхность костных кристаллов составляет 400 000 м2 и создает обширный плацдарм для обмена ионов. Для нормального уровня ионов кальция (Ca2+) в крови этого бывает недостаточно, тогда мобилизуются запасы Ca2+, заключенные во внутренних участках костных кристаллов (Фриденштейн, Чертков, 1969).
Скелет (кость) – не только депо минеральных солей, но и буферная система, участвующая в поддержании концентрации ионов Ca2+. Одна из функций костной ткани – непрерывное поддержание костеобразовательного процесса. Это значит, что кость в течение всего онтогенеза является постоянно обновляющейся системой, которая обеспечивает образование костной (опорной) и гемопоэтической тканей в нужном количестве (Фриденштейн, Чертков, 1969).
Естественно, что повреждение костной ткани, дефекты, оперативные вмешательства не могут не отражаться как на опорной функции, так и на обменных процессах организма, поэтому восстановление дефектов или заместительная терапия при утрате костной ткани являются важнейшей проблемой восстановительной медицины.
Каким должен быть процесс восстановления костной ткани? Можно ли сконструировать межпозвонковый диск, тело позвонка, пяточную, большеберцовую кости и создать банк запасных частей опорно-двигательного аппарата? Можно ли создать из аутологических клеток подобные трансплантаты – органы? Возможно, что разум человека в сочетании с техническим прогрессом создаст подобные трансплантаты, но в настоящее время это невозможно. Почему? Слишком сложным является строение и взаимоотношение тканей, входящих в состав, например, межпозвонкового диска с его тончайшими канальцами, через которые совершаются обменные процессы со сложным метаболизмом и регуляцией на общеорганизменном уровне (Зайдман, Бородин, 2015).
XX в. – это век перехода от “металломании” к клеточным технологиям, перспективы которых сулят создание совершенных биологических пластических материалов на основе передовых технологий (Kaneshiro et al., 2007; Gong et al., 2011; Bose et al., 2012; Samavedi et al., 2013; Takahashi, Yamanaka, 2013; Дергилев и др., 2016; Kairiyama, 2016). Именно биологические конструкции способны восстановить не только структурно-функциональную, но и гомеостатическую целостность костной ткани. В Новосибирском НИИТО разработка биологических клеточных технологий проводится в течение многих лет. Успешно апробированы в эксперименте культивированные хондробласты для регенерации дефектов костной ткани (Зайдман и др., 2013), пластинки роста (Зайдман и др., 2010) и пульпозного ядра межпозвонкового диска (Зайдман и др., 2012). На основе культивированных хондробластов разработан хондротрансплантат, который идентифицирован на молекулярно-генетическом уровне и успешно применен в эксперименте в качестве пластического материала. Полученные результаты явились основой для создания в культуральной среде остеотрансплантата, способного путем первичного остеогенеза в короткие сроки формировать регенерат на основе полной интеграции с ложем реципиента и встраиваться в гомеостатическую систему организма реципиента.
Цель настоящей работы – исследование закономерностей остеогенеза в процессе создания остеогенного трансплантата для пластического замещения дефектов костной ткани.
МАТЕРИАЛ И МЕТОДИКА
Объекты. Исследование выполнено на мини-свиньях с соблюдением положений Хельсинской декларации Всемирной медицинской ассоциации и Правилами проведения работ с использованием экспериментальных животных (утв. Приказом Министерства Здравоохранения Российской Федерации от 19.03.2003 г. № 226). Разрешение на проведение работ было получено на заседании Локального Этического Комитета ФГБУ “ННИИТО им. Я.Л. Цивьяна” Минздрава России (протокол заседания № 019/15 от 28 декабря 2015 г.). Основой для создания остеотрансплантатов служили хондротрансплантаты, изготовленные из культивированных хондробластов, полученных из позвоночника новорожденного мини-поросенка. Выделение клеток из ткани, культивирование хондробластов, формирование хондротрансплатата осуществляли согласно методикам, указанным в соответствующих патентах (Корель и др., 2006; Зайдман и др. 2010).
Направленную остеогенную дифференцировку производили на основе хондротрансплантата при помощи остеоиндуктивной среды на основе среды RPMI-1640, содержащей 15% фетальной бычьей сыворотки, смесь стрептомицина с пенициллиномом и амфотерицин В. В качестве индукторов остеогенной дифференцировки клеток применяли 10 мМ/л ß-глицерофосфата, 100 нМ/л дексометазона и 0.2 мМ/л аскорбиновой кислоты. Трехмерный остеотрансплантат получали по протоколу, описанному в патенте (Зайдман и др. 2016).
Пересадку остеотрансплантатов осуществляли на 15 мини-свиньях (возраст 6 мес.). В качестве контроля (10 животных того же возраста) использовали аутотрансплантат. В качестве аутотрансплантата была использована костная ткань при формировании дефекта тела позвонка экспериментального животного. Под общим наркозом выполняли передний забрюшинный доступ к телам поясничных позвонков. При помощи бора формировали в вентральном отделе тела позвонка костный дефект с размером в глубину и ширину, соответствующем размеру трансплантата (около 5 мм). Сформированный дефект полностью заполняли остеотрансплантатом. В сформированный дефект укладывали трехмерный остеотрансплантат и аутотрансплантат с плотным прилеганием к реципиентному ложу. Животных выводили из эксперимента через 7 и 14 сут и 1, 2, 3 мес. Фиксацию, проводку материалов и изготовление морфологических препаратов проводили по традиционной методике. Препараты окрашивали гематоксилин-эозином. Для ультраструктурного анализа клеток и матрикса хондротрансплантаты и остеотрансплантаты фиксировали в 4%-ном растворе параформа с дефиксацией раствором осмия, обезвоживали в спиртах возрастающей концентрации и заключали в эпон-аралдит. На ультратоме Leica (Германия) готовили ультратонкие срезы, контрастировали уранил ацетатом и изучали под электронным микроскопом Hitachi-600 (Япония).
Выделение РНК и полуколичественная Полимеразная цепная реакция (ПЦР) в режиме реального времени. РНК из клеток и трансплантатов выделяли с помощью TRIzol Reagent (Sigma, США). Синтез кДНК проводили обратной транскриптазой MMLV (Promega, США). Относительный уровень экспрессии генов определяли с помощью полуколичественной ПЦР в режиме реального времени, используя реакционную смесь с интеркалирующим красителем SYBR Green I (M-427; Синтол, Россия) на приборе LightCycler 480 II (Roche, Швейцария). Уровень экспрессии целевых генов относительно гена домашнего хозяйства Gapdh рассчитывался методом 2–ddCt, затем полученные значения нормировали на значение уровня экспрессии гена Col2 (коллагена I типа) в хондробластах. Последовательности олигонуклеотидов, размер ПЦР-продуктов и температура отжига приведены в табл. 1.
Таблица 1.
Список олигонуклетотидов для полуколичественного ПЦР в режиме реального времени
| Гены | Олигонуклеотиды | Размер продукта | Температура отжига, °С |
|---|---|---|---|
| Glyceraldehyde-3-Phosphate dehydrogenase Gapdh |
F1: acactcactcttctacctttg R1: caaattcattgtcgtaccag |
90 | 58.0 |
| Alkaline phosphatase Alp |
ALP-F ATGAGCTCAACCGGAACAA ALP-R GTGCCCATGGTCAATCCT |
131 | 56.0 |
| Osteonectin On |
ON-F TCCGGATCTTTCCITTGCTTTCTA ON-R CCTTCACATCGTGGCAAGAGTTTG |
187 | 57.0 |
| Bone sialoprotein Bsp |
BSP-F GCACGCCTACTTCTATCCTC BSP-R CGGCCTCGGAGTCTT |
185 | 59.0 |
| Osteopontin Opn |
OPN-F actccgatgaatccgatgag OPN-R tccgtctcctcactttccac |
220 | 58.0 |
| Runt-related transcription factor 2 Runx2 |
RUNX2_F CTCATTCCCTGG CTCAC RUNX2_R TGGGCAGACAGTCAGAAGAG |
80 | 63.0 |
| Transforming growth factor betta Tgfb |
F ACCTGACTGGGGTCTTCCTT R AGTTCCCAGGCTAGGGGTTA |
458 | 56.0 |
| Collagen type 2 Col2 |
COL2-F CTGGAGCTCCTGGCCTCGTG COL2-R CAGATGCGCCTTTGGGACCAT |
138 | 65.0 |
| Sex determining region Y-box 9 Sox9 |
SOX9-F CCGGTGCGCGTCAAC SOX9-R TGCAGGTGCGGGTACTGAT |
119 | 57.0 |
| Aggrecan Acan |
ACAN-F2 TTCCCTGAGGCCGAGAAC ACAN-R2 GGGCGGTAATGGAACACAAC |
194 | 65.0 |
| Decorin Dcn |
DEC-F CCATGAGAATGAGATCACCAAA DEC-R CTTGAGGGATGGTGGTAATGTT |
182 | 60.0 |
| Biglycan Bgn |
BG-FCTACCTGCACACCAACAACATC BG-RFCGGCTGCCTCTACTTTTTGTA |
202 | 60.0 |
| Lumican Lum |
LUM-F ATCCCCACAATGACATAACTCC LUM-RTGCACTATGGACAAGAATCCAC |
153 | 60.0 |
| Collagen type 1 Col1 |
COL1F CCAAGAGGAGGGCCAAGAAGAAGG COL1R GGGGCAGACGGGGCAGCACTC |
232 | 60.0 |
Иммунофлуоресцентное окрашивание. Использовали антитела к коллагену 1 в разведении 1 : 200 (ab34710), коллагену 2 в разведении 1 : 100 (ab3092), аггрекану в разведении 1 : 100 (ab3778-1), фибронектину в разведении 1 : 200 (ab6328), фактору фон Виллебранда в разведении 1 : 100 (ab6994) (Abcam, Великобритания), поверхностному антигену CD44 в разведении 1 : 100 (14-0441-82; eBioscience, США) и остеонектину в разведении 1 : 50 (NCL-O-NECTIN, Leica Biosystems, Германия). Детекцию антител осуществляли с помощью флуоресцентномеченных коньюгатов Alexa Fluor®568 и AlexaFluor®488 с антителами к иммуноглобулинам кролика или мыши. Кроме того, для выявления эндотелиальных клеток использовали флуоресцентномеченый Alexa Fluor®594 изолектин B4, (I21413, Termo Fisher Scientific, США) в разведении 1 : 75. Препараты анализировали на флуоресцентном микроскопе Nikon Ti-E (Япония).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
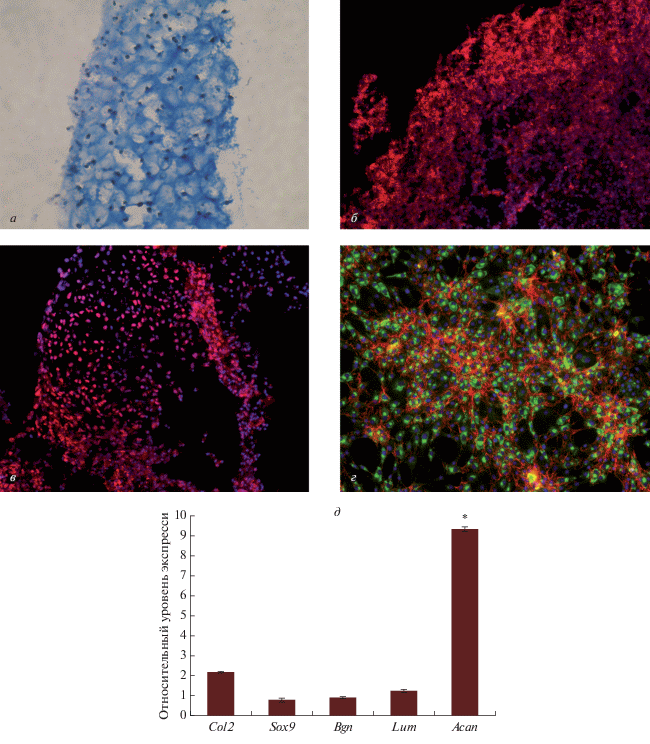
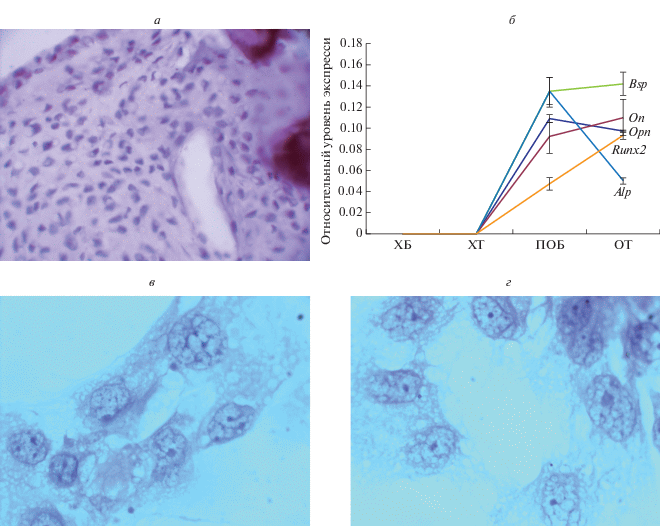
Структурная характеристика хондротрансплантата. Хондротрансплантат представлен клетками хондрогенного ряда, расположенными в гомогенном альциан- и Хейл-позитивном матриксе (рис. 1а). В центральных отделах хондротрансплантата встречаются гипертрофические хондроциты с крупным ядром и вакуолизированной цитоплазмой. На периферии – это дифференцированные хондробласты с центрально расположенным ядром, 1–2-мя ядрышками и гетерохроматином. В цитоплазме этих клеток – широкая эндоплазматическая сеть с прикрепленными и свободными рибосомами, а также диффузно расположенным комплексом Гольджи. Митохондрии круглые с хорошо контурирующими кристами. В хондробластах экспрессируются гены коллагена II типа (Col2), агрекана (Acan), бигликана (Bgn), люмикана (Lum) и SOX9 (рис. 1д). В цитоплазме детектируются белки, соответствующие хондрогенной дифференцировке (рис. 1б–1г).
Рис. 1.
Структурная характеристика хондротрансплантата (а–г) и относительный уровень экспрессии генов в хондротрансплантате (д). а – Окраска альциановым синим, б, в, г – иммуногистохимическая реакция на белки к агрекану, коллагену II типа и SOX9 соответственно. Об.: 20×. д – Уровень экспрессии генов в хондротрансплантате, ПЦР в режиме реального времени. Данные представлены средними значениями (±SD, вертикальные отрезки). Звездочка показывает достоверные различия уровня экспрессии гена агрекана (Acan) и генами коллагена II типа (Col2), бигликана (Bgn), люмикана (Lum) и SOX9 (Р < 0.05).
Трансформация хондротрансплантата в остеогенной среде проходила ряд последовательных стадий, каждая из которых имеет функциональные, морфологические и молекулярно-генетические особенности.
Стадия синтеза остеоида. Через 7–10 сут поверхность хондротрансплантата, помещенного в остеогенную среду, окружена клетками вытянутой формы с ацентрично расположенным ядром и узкой цитоплазмой. Клетки тесно прилежат друг к другу, формируя структуру, напоминающую оболочку (рис. 2а). Возможно, этот слой выполняет барьерную функцию подобно тому, как это происходит в эмбриогенезе на этапе хондро-остеогенеза. Вокруг хрящевого “макета” путем уплотнения мезенхимных клеток формируется “оболочка”, которая трансформируется в надкостницу – источник остео-васкулогенеза в процессе остеогенной дифференцировки хряща (Хэм, Кормак, 1983). Под этим слоем располагаются клетки преимущественно полигональной формы, в цитоплазме и в матриксе которых определяются эозинофильные включения, иммуногистохимически идентифицированные как сиалопротеины (рис. 2б).
Рис. 2.
Стадия синтеза остеоида. а – На поверхности остеотрансплантата расположены клетки, формирующие оболочку. Окраска гематоксилин-эозином, об.: 20×. б – В цитоплазме клеток и матриксе выявляются белковые включения (остеонектин). Иммуногистохимическая реакция на белки к остеонектину, об.: 100×. в – Гранулы щелочной фосфатазы в остеобластах, об.: 100×. г – Иммуногистохимическая реакция на белки к коллагену I типа, об.: 20×. д – Кальцификаты и остеоидные трабекулы в центре остеотрансплантата. Окраска гематоксилин-эозином, об.: 40×.
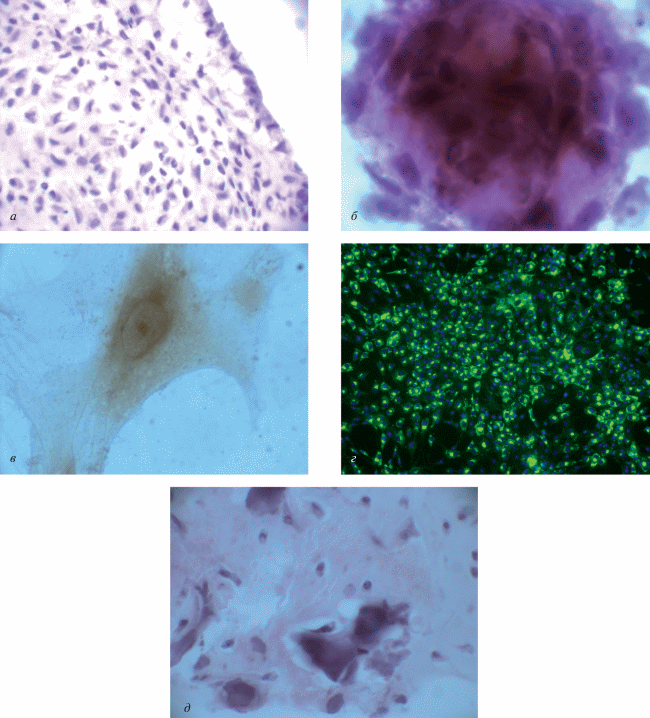
В центре трансплантата эозинофильные включения исчезают; матрикс становится гомогенным, приобретает бледно базофильную окраску. В клетках этих зон выявляются гранулы щелочной фосфатазы (рис. 2в); детектируется коллаген I типа (рис. 2г) и остеонектин, что является основанием для определения этих клеток как преостеобласты и остеобласты I–II степени (Омельяненко, Слуцкий, 2010). Часть клеток находится в апоптозе, в результате чего в матриксе образуются полости, ограниченные лишь тонким слоем базофильного матрикса (рис. 2а). Надо полагать, что подобные полости – это отражение гистогенеза в эмбриогенезе – предшествующий этап формирования сосудов. При формировании костной ткани из хряща также образуются полости путем апоптоза хондробластов, а затем на стадии остеогенеза эти полости выстилаются эндотелиальными клетками (Хэм, Кормак, 1983; Фриденштейн, Лурия, 1980).
Канальцевая система в эмбриогенезе формируется в матриксе хряща. В результате апоптоза хондробластов образуются бесклеточные участки, которые резорбируются металлопротеиназами, синтезируемыми гипертрофическими хондроцитами (Komori, 2008).
На стадии хондрогенной дифференцировки в эмбриогенезе (Хэм, Кормак, 1983; Фриденштейн, Чертков, 1969) и в дефинитивном хряще преобразованные полости выполняют функции обмена метаболитов. Это так называемая канальцевая система метаболизма (Зайдман, Бородин, 2015). В центральных зонах трансплантата наблюдаются остеоидные трабекулы и кальцификаты.
Известно, что преостеобласты и остеобласты интенсивно аккумулируют фосфор и кальций (Родионова, 1989) в данном варианте из культуральной среды. В этот период происходит соединение белков остеонектина с коллагеном I типа и формированием остеоидных трабекул как этап остеогенеза остеотрансплантата (Омельяненко, Слуцкий, 2010). Есть основания полагать, что стадия гистогенеза остеотрансплантата повторяет ранние этапы формирования костной ткани в эмбриогенезе (Фриденштейн, Лурия, 1980).
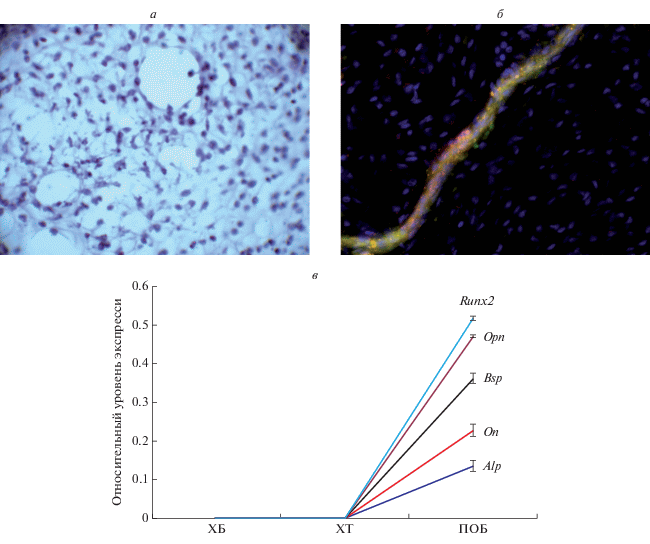
Стадия формирования сосудов. Через 10–14 сут в хондротрансплантате, помещенном в остеогенную среду, происходят значительные изменения клеточного состава и матрикса. Основной фенотип клеток – это преостеобласты, остеобласты I и II типов, расположенные в матриксе, в котором выявляются сосудистые полости (рис. 3а), выстланные клетками эндотелия, экспрессирующие фактор Виллебранда и изолектин В4 (рис. 3б). Матрикс базофильный, гомогенный, равномерно заселён клетками, в которых детектируется поверхностный антиген СД44, коллаген I типа, фибронектин, остеонектин и остеопонтин. В клетках экспрессируются гены щелочной фосфатазы (Alp), остеонектина (On), остеопонтина (Opn), сиалопротеина (Bsp), транскрипционного фактора Runx2 (рис. 3в). Все это свидетельствует о том, что клетки хондротрансплантата вступили в стадию остеогенной дифференцировки (Родан, Родан, 2000). Критерием остеогенной дифференцировки трансплантата является переход от канальцевой системы метаболизма (микроциркуляции) к оксигенетической – сосудистой. Об этом свидетельствует формирование сосудистых полостей с эндотелиальной выстилкой.
Рис. 3.
Стадия формирования сосудов. а – Сосудистые полости, выстланные эндотелием; окраска гемотоксилин-эозином, об.: 20×. б – Сосуд в остеотрансплантате; иммуногистохимическая реакция на белки к фактору Виллебрандта и изолектину В4, об.: 20×. в – Относительный уровень экспрессии генов в преостеобластах; ПЦР в режиме реального времени: ХБ – хондробласты, ХТ – хондротрансплантат, ПОБ – преостеобласты. Данные представлены средними значениями (±SD, вертикальные отрезки).
Вместе с тем, вопрос о природе эндотелиальных клеток в остеотрансплантате остается открытым. Известно, что клеточные популяции механоцитов не содержат детерминированных сосудистых клеток-предшественников (Заварзин, 1976). По данным Фриденштейна и Лурии (1980) клеточные линии механоцитов образуют строму, на которой развиваются потомки стволовых кроветворных клеток. Костная ткань служит необходимым индуктором для дифференцировки кроветворной ткани. Интенсивность кроветворения зависит от стромального “плацдарма”, который определяется объемом костного вещества (Javassoli, Fridenstein, 1983). Костная ткань как регулятор гомеостаза на организменном уровне появляется на самых ранних стадиях онтогенеза (Заварзин, 1976). На основе первичной костной ткани формируется гемопоэтическая ткань. Можно предполагать, что этапы остеогенеза в культуре повторяют закрепившуюся детерминированность формирования костной и сосудистой систем в эмбриогенезе. Наличие гипертрофических хондроцитов в центральных отделах остеотрансплантата является основанием для следующей трактовки природы эндотелиальных клеток. Известно (Maes et al., 2002), что гипертрофические хондроциты нарабатывают фактор роста сосудов. Есть данные, что гипертрофический хондроцит при делении уходит в апоптоз, а вторая клетка приобретает фенотип остеогенной (Roach et al., 1955; Kiyoto et al., 1966; Rodan et al., 1988; Maes et al., 2002; Nasharu et al., 2010). Далее под влиянием асимметричного деления происходит дифференцировка остеогенной клетки в остеобласт – эндотелиобласт. Подобной теории придерживается Гололобов с сотрудниками, называя эту клетку выстилающей, предположительно эндотелиальной (Гололобов, Деев, 2003; Деев и др., 2004).
Возможно ли принять гипотезу о дифференцировке остеобласта в эндотелиальную клетку? Существует и другое объяснение: дифференцировка эндотелиальных клеток является результатом синтеза остеобластами ангиопоэтина и кадгерина – сигнальных молекул, индуцирующих дифференцировку или трансдифференцировку остеобласта в эндотелиоцит (Wang et al., 2007; Franceschi et al., 2009). Возможен и третий вариант: в процессе выделения хрящевых клеток в культуральную среду могли попасть и предшественники гемопоэтических клеток, которые в остеогенной среде активизировались. Этот вопрос является предметом дальнейших исследований. Наличие сосудов в остеотрансплантате является метаболической основой продолжения остеогенной дифференцировки клеток – вступления в стадию минерализации.
Стадия минерализации. Это следующая стадия формирования остеотрансплантата (14–30 сут культивирования). В этот период происходит процесс трансформации клеток и матрикса – становление остеотрансплантата как “примитивной” тканевой структуры. Клетки трансплантата находятся на разной стадии дифференцировки: от преостеобластов до остеобластов IV типа. Последние представляют собой клетки с крупным ядром и инвагинантами (рис. 4а). Ядро и органеллы оттеснены к мембране вакуолями, окруженными двухслойной мембраной со светлым ободком. Вакуоли в зависимости от степени зрелости заполнены гомогенным содержимым от светлой до темной окраски (ультраструктурные данные). Эти образования идентифицированы как матричные пузырьки (рис. 4б).
Рис. 4.
Стадия минерализации. Матричные везикулы (а, б) в цитоплазме остеобластов IV степени. Электронная микроскопия, увел.: 1000× (а) и 5000× (б).
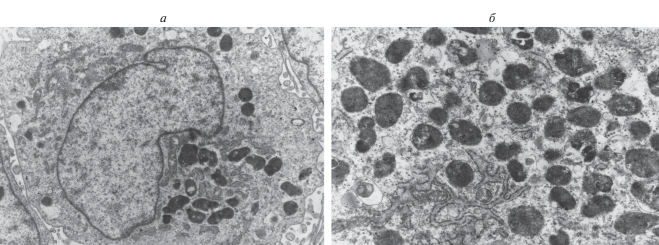
Что такое матричные пузырьки? Это структуры, формирующиеся на эндоплазматическом ретикулуме и комплексе Гольджи, содержащие пирофосфатазу, щелочную фосфатазу, неорганический пирофосфат (кальций и фосфор) (Фриденштейн, Лурия, 1980; Родионова, 1989; Омельяненко, Слуцкий, 2010). В матричных пузырьках происходит ферментное превращение аморфного пирофосфата в органический гидроксиапатит, растворение, гидратация кристаллов и формирование центров минерализации. Матричные пузырьки образуются из белков цитоскелета в остеобластах III–IV степени и являются универсальным этапом минерализации (Anderson et al., 2005; Nasharu et аl., 2010). Нанокристаллы минерализации в остеоиде при участии щелочной фосфатазы связываются с коллагеном I типа и располагаются в виде цепочек вдоль коллагенового волокна, и далее происходит процесс оссификации (Weismann et al, 2005). В культуральной среде стадия минерализации ограничивается формированием матричных пузырьков, отпочковыванием и выпадением их в матрикс.
Вторичный этап кристаллизации в культуральной среде в остеотрансплантате не происходит, так как для оппозиционного роста кристаллов требуется дополнительное количество кальция (Ca2+) и фосфора (Р) (Franz-Odendaal et al., 2006; Franceschi et al., 2009). Этот процесс совершается в реципиентном ложе при замещении дефекта костной ткани остеотрансплантатом.
Структурная характеристика остеогенного трансплантата. Остеогенный трансплантат на стадии 30 сут дифференцировки состоит из клеток остеогенного ряда – от преостеобластов до остеобластов I–IV типов. Цитоплазма последних заполнена матричными везикулами. Отпочкованные везикулы локализуются и в матриксе. Матрикс состоит из коллагена I типа, ПГ (фибронектин, бигликан, версикан, люмикан) и кальцификатов, расположенных вокруг сосудов с эндотелиальной выстилкой (рис. 5а). В клетках экспрессируются гены (рис. 5б): Alp, On, Bsp, Opn, RUNK2 и соответствующие белки: антиген СД44, фибронектин, коллаген I типа и остеонектин. В эндотелиоцитах выявляются фактор Виллебрандта и изолектин B4. Характерные для хрящевой ткани (хондротрансплантата) гены и белки (Sox9, Col2, Acan) экспрессируются в остеотрансплантате в минимальных количествах. Следовательно, есть основание заключить, что процесс начальных стадий гистогенеза костной ткани практически завершен (Данилов и др., 2000).
Рис. 5.
Остеотрансплантат (ОТ). а – Общая структура ОТ; сосуд с эндотелиальной выстилкой; гематоксилин-эозин, об.: 20×. б – Относительный уровень экспрессии генов в ОТ; ПЦР в режиме реального времени: ХБ – хондробласты, ХТ – хондротрансплантат, ПОБ – преостеобласты, ОТ – остеотрансплантат; данные представлены средними значениями (±SD, вертикальные отрезки). в, г – Расположение остеобластов в виде двух структурных композиций в ОТ; гематоксилин-эозин, иммерсия, об.: 100×.
Представляет значительный интерес архитектоника клеток в остеотрансплантате: остеобласты располагаются в виде двух структурных композиций (рис. 5в, 5г). Свободное бесклеточное пространство матрикса окружено остеобластами в виде многослойного кольца. Во втором варианте остеобласты формируют два параллельных ряда. Возникает вопрос о причинах подобного расположения клеток. Как объяснить двоякую архитектонику выстраивания остеобластов? Исходя из динамики построения структурных композиций можно предполагать, что процесс отражает формирование двух типов костной ткани в онтогенезе – остеонную и трабекулярную. Утверждать подобную возможность, было бы слишком смело, а высказать предположение, вероятно, допустимо. Процесс развития начальных типов костной ткани до сих пор не освещен. Надо полагать, что дальнейшее развитие клеточных технологий поможет заполнить это пробел в начальном гистогенезе костной ткани.
Возникает вопрос: что такое остеогенный трансплантат? Структурно-метаболические преобразования, которые проходит хондротрансплантат в остеогенной среде являются отражением эмбрионального развития и процесса регенерации костной ткани. Экспрессия генов и детекция белков хондрогенной стадии гистогенеза сменяется экспрессией генов и белков остеогенной стадии дифференцировки. Преобразование метаболического профиля, смена канальцевого типа обмена метаболитов на сосудистый (как непреложный атрибут формирования костной ткани), синтез коллагена I типа и щелочной фосфатазы, матричные везикулы в цитоплазме остеобластов и в матриксе, остеогенный тип клеток являются основанием для того, чтобы определить остеотрансплантат как стадию остеогенной дифференцировки эмбрионального хряща (Drukker et al., 2006). Следующий этап дифференцировки в дефинитивную костную ткань остеотрансплантат проходит в дефекте костной ткани реципиента.
Структурные преобразования остеотрансплантата в реципиентном ложе (дефекте костной ткани). В дефекте костной ткани остеотрансплантат проходит следующие стадии гистогенеза: пролиферации, сосудистой интеграции, остеогенеза и стадию полной интеграции.
Стадия пролиферации. Через семь сут область дефекта костной ткани в теле позвонка заполнена остеотрансплантатом. В центральных отделах остеотрансплантата наблюдается интенсивная пролиферация активных остеобластов (рис. 6а). Здесь сформированы слабоминерализированные трабекулярные структуры, окруженные активными остеобластами. Пролиферирующие остеобласты мигрируют в костное ложе реципиента и откладываются на опилах костных балок таким образом, что формируются анастомозы между регенератом и костными трабекулами реципиента (рис. 6б). Полученные факты свидетельствуют о регенерации в зоне дефекта за счет структурных компонентов остеотрансплантата. Большинство авторов считают, что регенерация дефекта костной ткани осуществляется за счет реципиентного ложа (Деев и др., 2004). Подобные результаты зависят от природы пластического материала. Исследуемый нами остеотрансплантат был получен путем дифференцировки в пределах одного гистогенетического ряда (дифферона): мезенхима, хрящ, кость.
Рис. 6.
Структурные преобразования остеотрансплантата (ОТ) в реципиентном ложе. а – Стадия пролиферации активных остеобластов через 7 сут после трансплантации. б – Эритроциты в сосудах ОТ; формирование анастомозов между регенератом и костными трабекулами реципиента. в – Стадия сосудистой и тканевой интеграции; в межтрабекулярных пространствах сосуды, заполненные кровью реципиента; формирование костных анастомозов между ОТ и реципиентным ложем. г – Стадия оссификации; в зоне бывшего дефекта сформирован костный регенерат в состоянии перестройки. д – Стадия полной интеграции; между образованными костными трабекулами расположен миелоидный костный мозг. Окраска гематоксилин-эозином, об.: 20× или 40× (г).
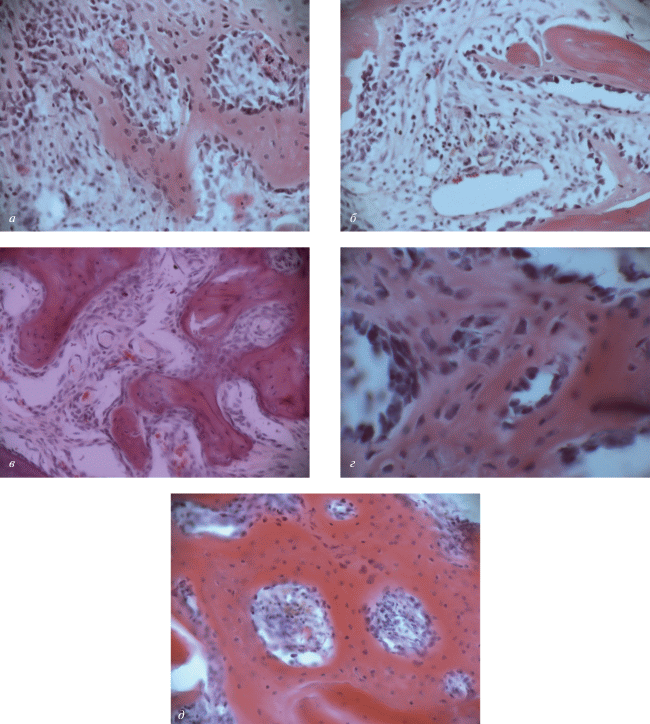
Стадия сосудистой интеграции. Через 14 сут в остеотранплантате сформирована примитивная костная ткань трабекулярного строения (рис. 6в). Между новообразованными костными структурами располагается остеогенная ткань и сосуды, содержащие элементы крови. Этот факт свидетельствует об интеграции регенерата с системой кровообращения реципиента (экспериментального животного), что является фактором формирования общей сосудистой сети. И дальнейшая регуляция остеогенеза в костной ткани происходит под влиянием гуморальных и локальных факторов, которые поступают с кровью реципиента на общеорганизменном уровне (паратгормон, факторы роста, сигнальные системы и т.д.) (Day et al., 2005; Day, Yang, 2008; Campbell et al., 2015). Активация остеогенеза наблюдается и по периферии остеотрансплантата, прилежащего к краям дефекта. Процесс формирования костной ткани в зоне дефекта и в остеотрансплантате происходит путем прямого остеогенеза.
Стадия остеогенеза. Через 30 сут полость бывшего дефекта замещена вновь сформированной костной тканью. Между трабекулами реципиентного ложа и остеотрансплантатом образованы костные анастомозы. В центральных отделах остеотрансплантата располагается трабекулярная костная ткань с признаками перестройки. Миелоидный костный мозг в межбалочных промежутках отсутствует (рис. 6г).
Стадия полной интеграции. Через 60 сут зона дефекта представлена органоспецифической костной тканью. Границы между костным ложем и остеотрансплантатом удается установить только по степени зрелости костной ткани. В межтрабекулярных пространствах располагается миелоидный костный мозг. Морфологические данные позволяют констатировать, что произошла полная интеграция остеотрансплантата с реципиентным ложем (рис. 6д).
Полная интеграция остеотрансплантата с реципиентным ложем является результатом формирования единой сосудистой системы кровообращения – остеотрансплантат–реципиент. Это значит, что процесс регуляции метаболизма остеотрансплантата осуществляется на общеорганизменном уровне реципиента и тем самым реализует генетическую программу окончательной дифференцировки остеотрансплантата в дефинитивную органоспецифическую костную ткань. Этот процесс можно назвать полной интеграцией: формирование морфологически и генетически однородной костной структуры.
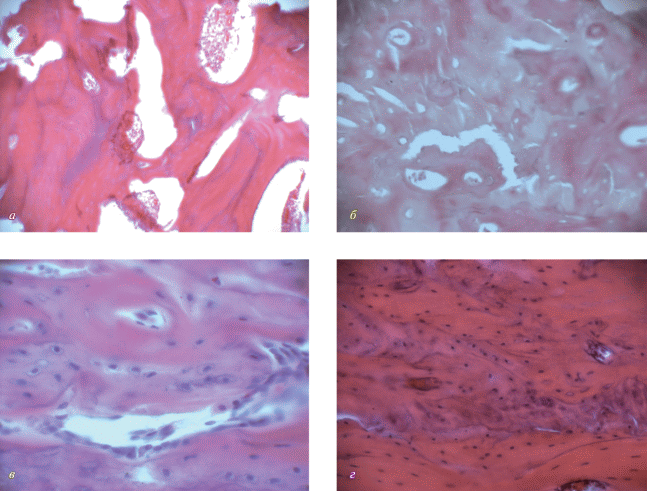
Структурные преобразования аутотрансплантата в реципиентном ложе (дефекте костной ткани). Через 7 сут зона дефекта костной ткани заполнена аутотрансплантатом, поверхность которого, прилежащего к реципиентому ложу, узурирована. Процесс остеогенеза не прослеживается (рис. 7а). Через 14 сут продолжается процесс резорбции аутотрансплантата, вплоть до фрагментации. Из реципиентого ложа между фрагментами аутотрансплантата проникают сосуды (рис. 7б). Через 30 сут наряду с продолжающейся резорбцией аутотрансплантата, наблюдается формирование регенерата в виде примитивной костной ткани между фрагментами аутотрансплантата (рис. 7в). Через 60 сут зона дефекта заполнена грубоволокнистой костной тканью в состоянии ремоделирования (рис. 7г).
Рис. 7.
Резорбция аутотрансплантата через 7 сут (а) и его фрагментация через 14 сут (б) после пластики. На поверхности безостеоцитных балок наблюдается регенерация костной ткани (в). Через 60 сут дефекта заполнена грубоволокнистой костной тканью в состоянии ремоделирования (г). Окраска гематоксилин-эозином, об.: 10× (а, б), 40× (в) и 20× (г).
Регенерация и интеграция дефекта костной ткани реципиента при пластическом замещении аутотрансплантатом происходит за счет структурных компонентов реципиента.
ЗАКЛЮЧЕНИЕ
Хондротрансплантат в остеогенной среде проходит ряд структурно-метаболических и генетических преобразований. В результате формируется остеогенный трансплантат подобный эмбриональной предкостной ткани. Исходом пластического замещения дефекта костной ткани остеотрансплантатом является формирование органоспецифического регенерата, встраивающегося в общую систему гомеостаза организма реципиента.
БЛАГОДАРНОСТИ
Авторы выражают искреннюю благодарность сотрудникам Института цитологии и генетики П.М. Бородину и О.Л. Серову за ценные советы и консультации в процессе выполнения этой работы.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работы выполнена в рамках государственного задания Министерства здравоохранения РФ на выполнение научно-исследовательских работ и разработок (номер гос. регистрации 115 071 510 020).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Эксперименты с участием животных выполнены с соблюдением положений Хельсинской декларации Всемирной медицинской ассоциации и Правилами проведения работ с использованием экспериментальных животных (согласно Приказу Министерства Здравоохранения Российской Федерации от 19.03.2003 г. № 226). Разрешение на проведение работ было получено на заседании локального Этического Комитета Новосибирского научно-исследовательского института травматологии и ортопедии им. Я.Л. Цивьяна Минздрава России (протокол заседания № 019/15 от 28 декабря 2015 г.).
Список литературы
Гололобов В.Г., Деев Р.В. 2003. Стволовые стромальные клетки и остеобластический клеточный дифферон. Морфология. 5 : 9–19. (Gololobov V.G., Deev R.V. 2003. Stvolovye stromal’nye kletki i osteoblasticheskij kletochnyj differon. Morfologiya. 5 : 9–19. (In Russ.))
Данилов Р.К., Боровая Н.Д., Клочков Т.Г. 2000. Экспериментально-гистологический анализ гистогенеза и регенерации тканей. Некоторые итоги XX века и перспективы дальнейших исследований. Морфология. 118(4) : 7–16. (Danilov R.K., Borovaya N.D., Klochkov T.G. 2000. Eksperimental’no-gistologicheskij analiz gistogeneza i regeneracii tkanej. Nekotorye itogi XX veka i perspektivy dal’nejshih issledovanij. Morfologiya. 118(4) : 7–16. (In Russ.))
Деев Р.В., Николаенко Н.С., Цупкина Н.В., Гололобов В.Г., Патокин И.Л., Пинаев Г.П. 2004. Формирование и морфофункциональная характеристика остеобластического фенотипа в клеточных культурах in vitro. Цитология. 46(3) : 185–190. (Deev R.V., Nikolaenko N.S., Tsupkina N.V., Gololobov V.G., Patokin I.L., Pinaev G.P. 2004. Development and morphofunctional characterization of the osteoblastic phenotype in cell culture in vitro. Tsitologiya. 46(3) : 185–190. (In Russ.))
Дергилев К.В., Макаревич П.И., Меньшиков М.Ю., Парфёнова Е.В. 2016. Применение тканеинженерных конструкций на основе пластов клеток для восстановления тканей и органов. Гены и Клетки. XI(3) : 23–32. (Dergilev K.V., Makarevich P.I., Menshikov M.Yu., Parfyonova E.V. 2016. Application of tissue engineered constructs on the basis of cell sheets for restoration of tissues and organs. Genes & Cells. XI(3) : 23–32. (In Russ.)) https://elibrary.ru/download/elibrary_29321516_85895974.pdf
Заварзин А.А. 1976. Основы частной цитологии и сравнительной гистологии многоклеточных животных. Л. : Наука. 441 с. (Zavarzin A.A. 1976. Osnovy chastnoj citologii i sravnitel’noj gistologii mnogokletochnyh zhivotnyh. Leningrad: Nauka. 441 pp. (In Russ.))
Зайдман А.М., Бородин Ю.И. 2015. Морфогенез межпозвонкового остеохондроза. Международный журнал прикладных и фундаментальных исследований. 11(4) : 523–526. (Zaydman A.M., Borodin U.I. 2015. Morphogenesis of intervertebral osteochondrosis. Int. J. Applied Fund. Res. 11(4) : 523–526. (In Russ.))
Зайдман А.М., Ким И.И., Садовой М.А. 2010. Способ получения трехмерного хондротрансплантата. Патент 2 392 973 РФ: МПК А61L27/38. Заявитель и патентообладатель Федеральное государственное учреждение Новосибирский научно-исследовательский институт травматологии и ортопедии Федерального агентства по высокотехнологичной медицинской помощи. № 2008103109/15; заявл. 28.01.2008; опубл. 27.06.2010, Бюл. № 18. 11 с. (Zaydman A.M., Kim I.I., Sadovoy M.A. 2010. Sposob polucheniya trekhmernogo khondrotransplantata. Patent. 2392973 RF: MPK A61L27/38 Zayavitel i patentoobladatel Federalnoye gosudarstvennoye uchrezhdeniye Novosibirskiy nauchno-issledovatelskiy institut travmatologii i ortopedii Federalnogo agentstva po vysokotekhnologichnoy meditsinskoy pomoshchi. № 2008103109/15; zayavl. 28.01.2008; opubl. 27.06.2010. Byul. № 18. 11 p. (In Russ.))
Зайдман А.М., Корель А.В., Щелкунова Е.И., Иванова Н.А. 2016. Способ получения трехмерного остеотрансплантата. Патент 2574942 РФ: МПК A61L27/24, A61L27/38, А61К35/28, А61Р19/00. Заявитель и патетообладатель Федеральное государственное бюджетное учреждение “Новосибирский научно-исследовательский институт травматологии и ортопедии им. Я.Л. Цивьяна” Министерства здравоохранения Российской Федерации. № 2014145384/15; заявл. 11.11.2014; опубл. 10.02.2016, Бюл. № 4. 8 с. (Zaydman A.M., Korel A.V., Shchelkunova E.I., Ivanova N.A. 2016. Sposob polucheniya trekhmernogo osteotransplantata. Patent: 2574942 RF: MPK A61L27/24. A61L27/38. A61K35/28. A61R19/00. Zayavitel i patentoobladatel Federalnoye gosudarstvennoye byudzhetnoye uchrezhdeniye “Novosibirskiy nauchno-issledovatelskiy institut travmatologii i ortopedii im. Ya.L. Tsiviana” Ministerstva zdravookhraneniya Rossiyskoy Federatsii. № 2014145384/15; zayavl. 11.11.2014; opubl. 10.02.2016. Byul. № 4. 8 p. (In Russ.))
Зайдман А.М., Михайловский М.В., Завьялова Е.Л., Суздалов В.А., Садовой М.А. 2010. Структурно-функциональные особенности деформации позвоночника при нейрофиброматозе NF-1. Бюллетень сибирской медицины. 9(6) : 34–40. (Zaidman A.M., Mikhailovsky M.V., Zaviyalova Y.L., Suzdalov V.A., Sadovoy M.A. 2010. Structural and functional peculiarities of spine deformity development in neurofibromatosis NF-1. Bull. Siberian Med. 9(6) : 34–40. (In Russ.) https://doi.org/10.20538/1682-0363-2010-6-34-40)
Зайдман А.М., Щелкунова Е.И., Строкова Е.Л., Корель А.В., Рахматиллаев Ш.Н., Шевченко А.И. 2012. Трехмерный хондротрансплантат – пластический материал для замещения дефектов костной ткани. Хирургия позвоночника. 4 : 65–72. (Zaidman A.M., Schelkunova E.I., Strokova E.L., Korel A.V., Rakhmatillaev Sh.N., Shevchenko A.I. 2012. 3D chondrograft: bone defect replacement material. Hirurgiâ pozvonočnika. 4 : 65–72. (In Russ.) https://doi.org/10.14531/ss2012.4.65-72)
Зайдман А.М., Щелкунова Е.И., Строкова Е.Л., Шевченко А.И., Ластевский А.Д., Рерих В.В. 2013. Коррекция патологических изменений межпозвонкового диска методами тканевой инженерии в эксперименте. Хирургия позвоночника. 1 : 80–88. (Zaidman A.M., Shchelkunova E.I., Strokova E.L., Shevchenko A.I., Lastevsky A.D., Rerikh V.V. 2013. Experimental correction of pathological changes in the intervertebral disc using tissue engineering. Hirurgiâ pozvonočnika. 1 : 080–088. (In Russ.) )
Корель А.В., Зайдман А.М., Колокольцева Т.Д. 2006. Способ получения донорских хондробластов. Патент 2285039 РФ: МПК C12N 5/06. Заявитель и патентообладатель Федеральное государственное бюджетное учреждение “Новосибирский научно-исследовательский институт травматологии и ортопедии” МЗ РФ. № 2004120645; заявл. 06.07.2004; опубл. 10.10.2006, Бюл. № 28. 7 с. (Korel A.V., Zaydman A.M., Kolokoltseva T.D. 2006. Sposob polucheniya donorskikh khondroblastov. Patent 2285039 RF: MPK C12N 5/06. Zayavitel i patentoobladatel “Novosibirskiy nauchno-issledovatelskiy institut travmatologii i ortopedii” MZ RF. № 2004120645; zayavl. 06.07.2004; opubl. 10.10.2006, byull. № 28. 7 p. (In Russ.))
Омельяненко Н.П., Слуцкий Л.И. 2010. Соединительная ткань (гистофизиология и биохимия). М.: Известия. 1. 395 с. (Omel’yanenko N.P., Sluckij L.I. 2010. Soedinitel’naya tkan' (gistofiziologiya i biohimiya). M.: Izvestiya. 1. 395 p. (In Russ.))
Родан Г.А., Родан С.Б. 2000. Костные клетки. Остеопороз. М.-СПб. : Бином-Невский диалект. 15–84. (Rodan G.A., Rodan S.B. 2000. Kostnye kletki. Osteoporoz. Moscow–St.Petersburg: Binom-Nevskij dialekt. 15–84. (In Russ.))
Родионова Н.В. 1989. Функциональная морфология клеток в остеогенезе. М.: Новукова думка. 192 с. (Rodionova N.V. 1989. Funkcional’naya morfologiya kletok v osteogeneze. M.: Novukova dumka. 192 pp. (In Russ.))
Фриденштейн А.Я., Лурия Е.А. 1980. Клеточные основы кроветворного микроокружения. М.: Медицина. 216 с. (Fridenshtejn A.Ya., Luriya E.A. 1980. Kletochnye osnovy krovetvornogo mikrookruzheniya. M.: Medicina. 216 p. (In Russ.))
Фриденштейн А.Я., Чертков И.А. 1969. Клеточные основы иммунитета. М.: Медицина. 256 с. (Fridenshtejn A.Ya., Chertkov I.A. 1969. Kletochnye osnovy immuniteta. M.: Medicina. 256 p. (In Russ.))
Хэм А., Кормак Д. 1983. Гистология. М.: Мир. 5. 296 с. (Hehm A., Kormak D. 1983. Gistologiya. M.: Mir. 5. 296 pp. (In Russ.))
Anderson H.C., Garimella R., Tague S.E. 2005. The role of matrix vesicles in growth plate development and biomineralization. Front Biosci. 10 : 822–837.
Bose S., Roy M., Bandyopadhyay A. 2012. Recent advances in bone tissue engineering scaffolds. Trends Biotechnol. 30(10) : 546–554. https://doi.org/10.1016/j.tibtech.2012.07.005
Campbell E.J., Campbell G.M, Hanley D.A. 2015. The effect of parathyroid hormone and teriparatide on fracture healing. Expert Opinion Biol. Ther. 1 : 119–129.
Claes L., Recknagel S., Ignatius A. 2012. Fracture healing under healthy and inflammatory conditions. Nat. Rev. Rheumatol. 8 : 133–143.
Dai J., Rabie A.B. 2007. VEGF: An essential mediator of both angiogenesis and endochondral ossification. J. Dent Res. 86 : 937–950.
Day T.F., Guo X., Garrett-Beal L., Yang Y. 2005. Wnt/beta-catenin signaling in mesenchymal progenitors controls osteoblast and chondrocyte differentiation during vertebrate skeletogenesis. Dev. Cell 8 : 739–750.
Day T.F., Yang Y. 2008. Wnt and hedgehog signaling pathways in bone development. J. Bone Joint Surgery – Series A. 90. Issue SUPPL. 1 : 19–24.
Deckers M.M., van Bezooijen R.L., van der Horst G., Hoogendam J., van Der Bent C., Papapoulos S.E., Clemens W.G.M. 2002. Bone morphogenetic proteins stimulate angiogenesis through osteoblast-derived vascular endothelial growth factor A. Endocrinol. 143 : 1545–1553.
Drukker M., Katchman H., Katz G., Eventov-Friedman S., Shezen E., Hornstein E., Mandelboim O., Reisner Y., Benvenisty N. 2006. Human embryonic stem cells and their differentiated derivatives are less susceptible to immune rejection than adult cells. Stem Cells. 24 : 221–229.
Franceschi R.T., Ge C., Xiao G., Roca H., Jiang D. 2009. Transcriptional regulation of osteoblasts. Cells Tiss. Organs. 189 : 144–152.
Franz-Odendaal T.A., Hall B.K., Witten P.E. 2006. Buried alive – how osteoblasts become osteocytes. Dev. Biol. 235 : 176–190.
Gong Y.Y., Xue J.X., Zhang W.J., Zhou G.D., Liu W., Cao Y. 2011. A sandwich model for engineering cartilage with acellular cartilage sheets and chondrocytes. Biomaterials. 32 : 2265–2273.
Javassoli M., Fridenstein A. 1983. Homopoetic stromal microenriromently. American Hematol. 15 : 151–203.
Kairiyama E. 2016. Legal system for tissue banking in Latin America. In: Legal basis of global tissue banking. A proactive clinical perspectives. Singapore: World Scientific. 149–196.
Kaneshiro N., Sato M., Ishihara M., Mitani G., Sakai H., Kikuchi T., Mochida J. 2007. Cultured articular chondrocytes sheets for partial thickness cartilage defects utilizing temperature – responsive culture dishes. Eur. Cells Materials. 13 : 87–92. https://doi.org/10.22203/eCM.v013a09
Kiyoto I., Masaharu T., Fujio S. 1966. Merckell’s cartilage chondrocytes eroke bone-linke matrix and further transform into osteocyte-like cells in culture. Anat. Rec. 245. 1: 25–35.
Komori T. 2008. Regulation of bone development and maintenance by Runx2. Front Biosci. 13 : 898–903.
Maes C., Carmeliet P., Moermans K., Stockmans I., Smets N., Collen D., Bouillon R., Carmeliet G. 2002. Impaired angiogenesis and endochondral bone formation in mice lacking the vascular endothelial growth factor isoforms VEGF 164 and VEGF 188. Mech Dev. 111 : 61–73.
Nasharu T.N., Martinez-Fernandez A., fur zic A. 2010. Induced pluripotent stem cells: Developmental biology to regulature medicine. Nat. Rev. Cardiol. 7 : 700–710.
Roach H.I., Erenpreisa J., Aigner T. 1955. Osteogenic differentiation of hypertrophic chondrocytes involves asymmetric cell division and apoptosis. J. Cell Biol. 131 : 483–494.
Rodan G.A., Heath J.K., Yoon K., Noda M., Rodan S.B. 1988. Diversity of the osteoblastic phenotype. In: Cell and molecular biology of vertebrate hard tissues. N.Y.: John Wiley & Sons. 78–85.
Samavedi S., Whittington A. R., Goldstein A.S. 2013. Calcium phosphate ceramics in bone tissue engineering: A review of properties and their influence on cell behavior. Review. Acta Biomaterialia. 9 : 8037–8045.
Street J., Bao M., de Guzman L., Bunting S., Peale F.V., Ferrara N., Steinmetz H., Hoeffel J., Cleland J.L., Daugherty A., van Bruggen N., Redmond H.P., Carano R.A., Filvaroff E.H. 2002. Vascular endothelial growth factor stimulates bone repair by promoting angiogenesis and bone turnover. Proc. Natl. Acad. Sci. USA. 99 : 9656–9661.
Takahashi K., Yamanaka S. 2013. Induced pluripotent stem cells in medicine and biology. Development. 140 : 2457–2461. https://doi.org/10.1242/dev.092551
Wang Y., Wan C., Deng L., Liu X., Cao X., Gilbert S.R., Mary L. Bouxsein M.L., Faugere M.C., Guldberg R.E., Gerstenfeld L.C., Haase V.H., Johnson R.S., Schipani E., Clemens T. 2007. The hypoxia-inducible factor a pathway couples angiogenesis to osteogenesis during skeletal development. J. Clin. Invest. 117 : 1616–1626.
Weismann P., Meyer U., Plate U., Honling H.Y. 2005. Aspects of collagen mineralisation in hard tissue formation. Int. Rev. Cytol. 1 : 121–156.
Дополнительные материалы отсутствуют.


