Цитология, 2019, T. 61, № 7, стр. 548-555
Реакция нейронов и микроглии коры мозжечка на анестезию севофлураном
Г. Ю. Юкина 1, *, Е. Г. Сухорукова 1, И. В. Белозерцева 1, Ю. С. Полушин 1, В. В. Томсон 1, А. Ю. Полушин 1
1 Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова
197376 Санкт-Петербург, Россия
* E-mail: pipson@inbox.ru
Поступила в редакцию 01.03.2019
После доработки 04.04.2019
Принята к публикации 05.04.2019
Аннотация
Мозжечок – один из отделов головного мозга, наиболее чувствительных к токсическому воздействию общих анестетиков. Целью настоящей работы была морфометрическая оценка реакции нейронов и микроглиоцитов всех слоев коры мозжечка при длительной (6 ч) экспозиции севофлурана (общего анестетика). На половозрелых крысах-самцах стока Вистар (n = 15) показано, что после длительной экспозиции севофлурана во всех слоях коры мозжечка наблюдается структурно-функциональная перестройка. В молекулярном и ганглионарном слоях общая плотность нейронов снижается, число морфологически измененных клеток молекулярного слоя и клеток Пуркинье увеличивается до 250 и 300% соответственно, что объясняется как прямым токсическим воздействием анестетика, так и нарушением межнейронных связей. В зернистом слое общая плотность популяции нейронов не изменяется, а число морфологически измененных нейронов увеличивается не значимо. Иммуногистохимическим методом выявлены микроглиоциты, число которых существенно не увеличивается, а активация в ответ на гибель нейронов выражена слабо. Отсутствие чрезмерной активации микроглиоцитов при длительной экспозиции севофлурана является положительным фактом, так как медиаторы нейровоспаления вырабатываются в меньшей степени и нейроны не испытывают дополнительных повреждающих воздействий со стороны микроглии.
Мозжечок – это центральная структура головного мозга, ответственная за двигательную активность и осуществление когнитивных навыков (Schmahmann, Sherman, 1998; Peng et al., 2005; DelRosso, Hoque, 2014). Известно, что мозжечок является высокочувствительным к повреждающим воздействиям отделом головного мозга. При всем многообразии повреждающих факторов, токсическое воздействие общих анестетиков занимает особое место, поскольку частота нарушений функций именно мозжечка при общей анестезии чрезвычайно высока (Monk et al., 2008; Steinmetz et.al., 2009). По мнению большинства авторов клинические проявления когнитивной дисфункции после действия общей анестезии сохраняются в течение некоторого периода времени, при этом увеличение продолжительности общей анестезии повышает сроки и выраженность когнитивной дисфункции в послеоперационном периоде (Frei 1992; Moller, 1997; Norsidah, Puvaneswari, 1997). В связи с этим данные о структурных изменениях, происходящих в мозжечке при воздействии общих анестетиков, представляют исключительный интерес.
В настоящее время в коре мозжечка выделяют корзинчатые и звездчатые клетки молекулярного слоя, грушевидные нейроны Пуркинье, образующие ганглионарный слой, а также несколько типов интернейронов зернистого слоя: мелкие клетки-зерна, клетки Гольджи, клетки Лугаро, клетки-канделябры, униполярные кисточковые клетки и клетки Ландау (Laine, Axelrad, 2002; Калиниченко, Мотавкин, 2005; Ambrosi, 2007). Вместе с тем наиболее изученной клеточной популяцией коры мозжечка являются грушевидные клетки Пуркинье. Это вполне оправдано, поскольку для этих клеток характерны самая высокая функциональная нагрузка и предельный уровень энергетического обмена (Bertoni-Freddari et al., 2004), что обуславливает их чрезвычайную восприимчивость к действию различных повреждающих факторов (Mavroudis et al., 2013). При этом морфофункциональная оценка состояния нейронов молекулярного и зернистого слоев коры мозжечка, имеющих с нейронами Пуркинье тесные анатомофизиологические связи, как правило, не проводится, что существенно снижает уровень достоверности суждения о степени повреждения коры мозжечка в целом, а значит и грамотность проводимой терапевтической коррекции протекающих в нем патологических процессов.
Исследуя морфофункциональное состояние нейронов коры мозжечка при токсическом воздействии, невозможно оставить в стороне и реакцию микроглиоцитов – клеток, являющихся ключевыми элементами воспалительного процесса, развивающегося в нервной ткани (нейровоспаления) в ответ на влияния повреждающих факторов (Block et al., 2007; Graeber, Stteit, 2010). Согласно классическим представлениям микроглия подразделяется на три основных типа: ветвящуюся (рамнифицированную), амебоидную (активированную) и переходную (промежуточную) (Хожай, Отеллин, 2013). При этом многочисленные исследования этих клеток свидетельствуют о наличии значимых различий их структурной организации в разных отделах головного мозга (Кирик и др., 2014; Коржевский и др., 2014; Алексеева и др., 2016). Однако несмотря на имеющиеся факты о разнообразных свойствах и особенностях строения микроглии в норме, относительно немного известно о трансформации микроглиоцитов под воздействием такого неблагоприятного фактора как общий анестетик.
В связи со сказанным выше, цель настоящей работы – морфометрическая оценка реакции нейронов и микроглиоцитов всех слоев коры мозжечка при длительной (6 ч) экспозиции анестетика севофлурана.
МАТЕРИАЛ И МЕТОДИКА
Работу проводили на крысах стока Wistar. Все эксперименты in vivo выполнены в соответствии с правилами проведения работ с использованием экспериментальных животных (принципами Европейской конвенции, Страсбург, 1986 г., и Хельсинской декларации Всемирной медицинской ассоциации о гуманном обращении с животными, 1996 г.).
Животных контрольной группы (КГ, n = 8) на 5 мин (максимальная длительность ограничения движений до вхождения крыс в состояние наркоза) помещали в индивидуальные боксы, аналогичные тем, в которых далее проводили индукцию анестезии. Крыс экспериментальной группы (ЭГ, n = 7) подвергали длительной экспозиции севофлурана (6 ч).
Для индукции анестезии крыс ЭГ помещали в индивидуальные боксы, размещенные в общей камере, подключенной к аппарату для ингаляционной анестезии, оборудованного испарителем “Sevoran” (Abbott Laboratories Ltd., Великобритания), и подавали 8 об. % севофлурана (Севоран®; Abbott Laboratories Ltd., Великобритания, № серии: 6042404) в потоке воздуха (2 л/мин). После принятия животными бокового положения для поддержания анестезии использовали 2 об. % севофлурана и поток воздуха 1 л/мин.
В течение 21 сут после длительной экспозиции севофлурана крыс групп КГ и ЭГ тестировали по ряду поведенческих тестов (Белозерцева и др., 2017). Через 12 ч после проведения последнего поведенческого теста (на 22-е сут эксперимента) крыс декапитировали и извлекали головной мозг. Материал фиксировали в 10%-ном нейтральном формалине на фосфатном буфере (рН 7.4) не менее 24 ч. Для получения сопоставимых результатов от всех животных образцы обрабатывали параллельно и в одинаковых условиях.
После формалиновой фиксации из мозга вырезали мозжечок, для морфологического анализа забирали заднюю долю мозжечка. Материал обезвоживали в серии этанола возрастающей концентрации и заливали в парафиновые блоки по стандартной гистологической методике. Срезы, перпендикулярные извилинам, толщиной 5 мкм готовили с помощью микротома Accu-Cut SRT 200 (Sakura, Япония); для выявления субстанции Ниссля применяли крезиловый фиолетовый (Bio-Optica, Италия); для обзорного исследования препаратов и в качестве вспомогательной методики для выявления нейронов использовали окраску гематоксилином Майера и эозином (Bio-Optica, Италия).
Микроглиоциты выявляли иммуноцитохимически, используя первичные поликлональные козьи антитела к антигену Iba-1, маркеру микроглии (ab107159; AbCam, Великобритания), в разведении 1 : 2000 с экспозицией 45 мин при комнатной температуре. Для связывания антител использовали набор реагентов R.T.U. VECTASTAIN Universal Quick Kit Catalog № РК-7800 (США). Визуализацию продукта реакции проводили при помощи хромогена DAB+ (Diagnostic BioSystems, Нидерландыs). Препараты докрашивали гематоксилином Майера (Bio-Optica, Италия).
На препаратах под световым микроскопом DM-750 (Leica, Германия) с помощью компьютерной программы анализа изображений ImageScope M изучали оба полушария мозжечка. На каждом срезе, используя окуляр 10× и объектив 40× в 20 полях зрения (размер каждого поля 0.33 × 0.25 мм) для молекулярного и ганглионарного слоев и в 10 полях зрения для зернистого слоя считали число неизмененных нейронов. Число ядросодержащих микроглиоцитов считали в молекулярном и ганглионарном слоях и отдельно в зернистом в 20 полях зрения при том же увеличении. У микроглиоцитов определяли диаметр тела, длину и толщину отростков. Нейроны оценивали в соответствии с существующими критериями: четко очерченное светлое ядро эллипсоидной или круглой формы, хорошо различимые ядрышки, четкие границы перикариона нейронов. Кроме того, считали патологически измененные нейроны: сморщенные нейроны без ядра, нейроны с деформированным гиперхромным ядром и клетки-тени.
Статистическую обработку полученных количественных данных проводили с использованием стандартного пакета программ (Statistica 7.0, Stat.Soft for Windows). Вычисляли среднее арифметическое значение и его стандартную ошибку. Оценку значимости различий показателей проводили с применением критерия Вилкоксона и U-критерия Манна–Уитни. Значимость различий определяли при P < 0.05.
РЕЗУЛЬТАТЫ
Изучение полученных препаратов у животных КГ показало, что цитоархитектоника слоев коры мозжечка не нарушена (рис. 1а). Перицеллюлярного и периваскулярного отека не выявлено. Молекулярный слой представлен мелкими корзинчатыми и звездчатыми нейронами с перикарионами округлой или полигональной формы, округлыми ядрами с расположенным по центру ядрышком. Они лежат свободно и относительно далеко друг от друга. Общая плотность популяции нейронов в поле зрения в молекулярном слое составляет 85 ± 1 клеток, из них лишь 2 ± 0.2 нейрона морфологически изменены.
Рис. 1.
Кора мозжечка крысы интактной (а) и после длительного воздействия (6 ч) анестетика севофлурана (б). МС – молекулярный слой, ГС – ганглионарный слой, ЗС – зернистый слой. Стрелки указывают на морфологически измененные клетки. Окраска крезиловым фиолетовым, Об.: 40 ×.
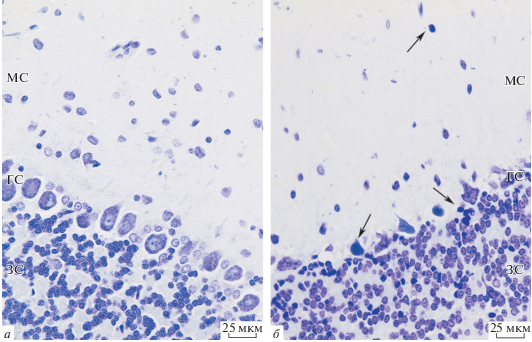
Ганглионарный слой состоит из одного ряда крупных клеток Пуркинье грушевидной формы с большими округлыми ядрами с центрально расположенными ядрышками. Число клеток Пуркинье в поле зрения составляет 9 ± 0.1, из них 1 ± 0.1 нейрон не соответствует морфологическим признакам функционирующей клетки.
При морфометрическом анализе общей популяции нейронов зернистого слоя выявили, что общее число интернейронов составляет 740 ± 56, из них 15 ± 3 нейрона морфологически изменены (табл. 1). В пределах слоя нейроны располагаются в виде плотных тяжей толщиной в 1–2 клетки и гнезд по 3–28 клеток.
Таблица 1.
Численность морфологически неизмененных и измененных нейронов в коре мозжечка после длительной экспозиции севофлурана (6 ч)
| Слой коры | Показатель | Число клеток | |
|---|---|---|---|
| контроль | после севофлурана | ||
| Молекулярный | Общая плотность нейронов | 85 ± 1 | 79 ± 2а (0.005905) |
| Неизмененные нейроны | 83 ± 1 | 74 ± 1а (0.0003) |
|
| Измененные нейроны | 2.0 ± 0.2 | 5 ± 0.4а (0.001255) |
|
| Ганглионарный | Общая плотность клеток Пуркинье | 9.0 ± 0.1 | 8.0 ± 0.2 |
| Неизмененные нейроны | 8.0 ± 0.1 | 5.0 ± 0.1а (0.00139) |
|
| Измененные нейроны | 1.0 ± 0.1 | 3 ± 0.2а (0.0008042) |
|
| Зернистый | Общая плотность нейронов | 740 ± 56 | 740 ± 57 |
| Неизмененные нейроны | 725 ± 57 | 709 ± 57 | |
| Измененные нейроны | 15 ± 3 | 31 ± 9б (0.05556) |
|
После проведения иммуноцитохимической реакции во всех исследованных препаратах были обнаружены Iba-1-позитивные клетки, имеющие характерную для микроглиоцитов структурную организацию (рис. 2а). В молекулярном и ганглионарном слоях преобладают мультиполярные микроглиоциты, имеющие разветвленные отростки. В области разветвления крупных отростков нередко наблюдали характерные для микроглиоцитов “натеки” цитоплазмы. Иногда наблюдали отростчатые клетки, лежащие периваскулярно или перинейронально. В зернистом слое встречаются микроглиоциты преимущественно круглой или овальной формы с 3–4 отходящими от тела длинными тонкими практически неветвящимися отростками. Диаметр тел микроглиоцитов составляет 8.3 ± 0.3 мкм, толщина отростков – 1.3 ± ± 0.03 мкм и длина – 35 ± 2 мкм. В молекулярном и ганглионарном слоях коры мозжечка число микроглиоцитов равно 5 ± 0.1 в поле зрения, в зернистом слое – 4 ± 0.1 (табл. 2). Помимо ядросодержащих микроглиоцитов все слои коры мозжечка содержат тонкие отростки, перинуклеарные участки которых не попали в плоскость среза.
Рис. 2.
Микроглия в коре мозжечка крысы. а – Микроглиоциты контрольного животного; б – микроглиоциты после длительного воздействия (6 ч) севофлурана. Иммуногистохимическая реакция на маркер микроглии белок Iba1 с подкраской срезов гематоксилином. Об.: 40 ×.
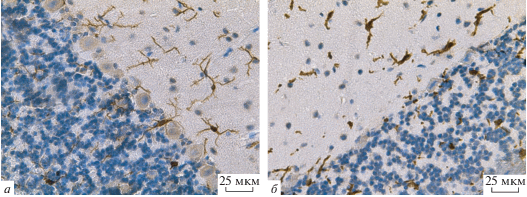
Таблица 2.
Морфометрические показатели микроглии в коре мозжечка после длительной экспозиции севофлурана (6 ч)
| Показатель | Контроль | После севофлурана |
|---|---|---|
| Число клеток (молекулярный и ганглионарный слои) | 5.0 ± 0.1 | 6.0 ± 0.4 |
| Число клеток (зернистый слой) |
4.0 ± 0.1 | 4.0 ± 0.4 |
| Диаметр микроглиоцита, мкм | 8.3 ± 0.3 | 12.1 ± 0.3а (0.000122) |
| Длина отростков микроглиоцита, мкм | 35 ± 2 | 18.0 ± 0.7а (0.000079) |
| Толщина отростков микроглиоцита, мкм | 1.30 ± 0.03 | 2.0 ± 0.05а (0.00077) |
У животных ЭГ цитоархитектоника слоев коры мозжечка сохранена (рис. 1б). Определяется периваскулярный отек. Общая плотность популяции нейронов молекулярного слоя в поле зрения составляет 79 ± 2 клеток, из них 5 ± 0.4 нейронов морфологически изменены, что составляет 92 и 250% от уровня контрольных значений соответственно и значимо отличается от данных в КГ (табл. 1).
Общая плотность популяции клеток Пуркинье в ганглионарном слое уменьшается до 8 ± 0.2, из них 3 ± 0.2 нейрона морфологически изменены, число морфологически измененных нейронов составляет 300% и значимо отличается от значений в КГ (табл. 1). Визуально отмечается уменьшение размеров клеток Пуркинье. Перикарион таких нейронов сморщивается, изменяются тинкториальные свойства: контур становится нечеткий, ядра и цитоплазма имеют трудноразличимые границы (рис. 1б). В единичных случаях наблюдается эктопия клеток Пуркинье в зернистый слой, в пределах гранулярного слоя видны пустоты и просветления вокруг перикарионов.
В зернистом слое коры мозжечка общая плотность популяции интернейронов после анестезии севофлураном не изменяется. Однако доля морфологически измененных нейронов увеличивается до 206% по сравнению с контрольными показателями и имеет тенденцию к отличию от контроля (КГ) (табл. 1). В таких нейронах отмечается искажение формы ядер и пикноз (рис. 1б).
После экспериментального воздействия морфологические признаки микроглиоцитов претерпевают некоторые преобразования. Единичные микроглиоциты сохраняют свою форму, однако большая часть клеток приобретает округлую или овальную форму с увеличенной перинуклеарной областью (рис. 2б). Диаметр тела таких клеток составляет 12.1 ± 0.3 мкм. Отростки измененных микроглиоцитов укорачиваются до 18 ± 0.7 мкм и утолщаются до 2 ± 0.05 мкм и лучше выявляются на срезе. Эти морфометрические показатели значимо отличаются от контрольных значений. Число микроглиоцитов в молекулярном и ганглионарном слоях коры мозжечка возрастает (табл. 2).
ОБСУЖДЕНИЕ
Полученные данные свидетельствуют о том, что нейроны разных слоев коры мозжечка по-разному реагируют на длительную экспозицию общего анестетика. Больше всего после анестезии севофлураном страдают клетки Пуркинье, из которых доля морфологически сохранных значимо уменьшается, в то время как число морфологически измененных нейронов значимо возрастает до 300% по сравнению с контрольными показателями (КГ). Эти результаты согласуются с данными из литературы, свидетельствующими о высокой чувствительности клеток Пуркинье к повреждающим факторам в связи с их высоким уровнем энергетического обмена, нарушение которого приводит к их гибели (Baloyannis, 2013; Kozaiol et al., 2014). В ходе исследования было замечено изменение тинкториальных свойств клеток Пуркинье. Оно проявляется в слабом окрашивании вещества Ниссля, нечетком контуре клетки, трудноразличимых границах ядра и цитоплазмы и сморщивании перикарионов. Все это указывает на снижение метаболических процессов в клетках. В пределах ганглионарного слоя плотность расположения нейронов уменьшается, наблюдаются пустоты, просветления вокруг перикарионов, встречаются участки с неравномерным многорядным распределением клеток Пуркинье. Визуальное уменьшение размеров клеток Пуркинье, изменение их формы свидетельствует о глубоких гипотрофических процессах в них.
Оценка состояния популяции клеток молекулярного слоя после анестезии севофлураном также показала значимое уменьшение количества нейронов, причем не только морфологически неизмененных до 89%, но и общей популяция нейронов (до 92%) от значений в контроле. При этом число морфологически измененных нейронов увеличилось до 250% контрольных значений. Массовую гибель нейронов молекулярного слоя можно объяснить не только прямым токсическим воздействием анестетика, проникающего через гематоэнцефалический барьер. В молекулярном слое мозжечка находятся ГАМКергические интернейроны – корзинчатые и звездчатые. Функция этих нейронов – регуляция активности клеток Пуркинье при воздействии на них афферентных лазящих волокон (Pouzat, Hestrin, 1997), то есть аксоны нейронов молекулярного слоя образуют тормозные синапсы на клетках Пуркинье. Очевидно, гибель клеток Пуркинье при воздействии севофлурана приводит к нарушению тормозных синапсов на их телах, что в свою очередь вызывает гибель нейронов молекулярного слоя.
В зернистом слое коры мозжечка общая плотность популяции интернейронов, а также число нейронов с прежней морфологией не изменяется. Число морфологически измененных нейронов значимо не отличается от контроля. Столь незначительные повреждения нейронов зернистого слоя можно объяснить, во-первых, меньшей чувствительностью к токсическим веществам (в нашем случае – к севофлурану) в результате низкого, по сравнению с клетками Пуркинье, энергетического обмена в этих клетках и, во-вторых, межнейронными связями в коре мозжечка (Калиниченко, Мотавкин, 2005). Как известно, аксоны малых клеток-зерен направляются в молекулярный слой, формируя там параллельные волокна, на которых находятся возбуждающие синапсы дендритов клеток Пуркинье, нейронов и клеток Гольджи. Аксоны клеток Гольджи участвуют в формировании клубочков мозжечка (синаптические контактные зоны между моховидными волокнами) в пределах зернистого слоя (Schmahmann, Caplan, 2006). Аксоны униполярных кисточковых клеток формируют внутрикорковую систему моховидных волокон, усиливающих возбуждающее влияние на клетки-зерна коры мозжечка (Dino, 2001). В свою очередь отростки клеток Ландау покидают кору и направляются к глубоким ядрам мозжечка (Ambrosi, Flace, 2007). Таким образом, аксоны клеток-зерен, клеток Гольджи, униполярных кисточковых клеток и клеток Ландау не связаны с клетками Пуркинье, гибель которых по этой причине не затрагивает данные нейроны.
Мишенями аксонов клеток Лугаро являются тела корзинчатых, звездчатых нейронов и дендриты клеток Пуркинье. Основной мишенью для аксона клетки-канделябра являются дендриты клеток Пуркинье (Laine, Axelrad, 1996). В связи с этим, вероятнее всего, именно эти типы интернейронов зернистого слоя, аксоны которых связаны с дендритами клеток Пуркинье и телами нейронов молекулярного слоя, погибают при длительном воздействии севофлурана.
Что же касается микроглиоцитов, то полученные данные свидетельствуют о том, что токсическое воздействие ведет к их активации, прежде всего, в молекулярном и ганглионарном слоях коры мозжечка, поскольку именно там происходит наиболее значительная гибель нейронов. При этом несмотря на то, что морфометрические показатели, характеризующие диаметр тела микроглиоцитов, длину и толщину их отростков после воздействия севофлурана значимо отличаются от контрольных показателей, их число значимо не увеличивается. Известно, что микроглиоциты являются основными иммунными клетками головного мозга, ответственными за развитие нейровоспаления, проявляющегося увеличением количества Iba-1 положительных микроглиоцитов с изменением их формы до амебоидной и выработкой ими провоспалительных цитокинов (Marshall et al., 2013; Gonzales et al., 2014). Установлено, что чрезмерная активация микроглиоцитов может приводить к патологическим процессам, в частности, к гибели нейронов, являясь одним из патологических механизмов нейродегенеративных заболеваний (Serhan et al., 2008; Wake et al., 2009). В ходе настоящего исследования не было выявлено увеличения числа микроглиоцитов и изменения их формы до амебоидной, что свидетельствует о невысокой степени активации микроглиоцитов, что в свою очередь снижает вероятность выработки ими провоспалительных цитокинов (Lyman et al., 2014). Очевидно, что отсутствие чрезмерной активации микроглиоцитов при длительной экспозиции севофлурана является положительным фактором, так как вероятность развития нейродеструктивных процессов, связанных с медиаторами нейровоспаления мала, а значит нейроны не испытывают дополнительных повреждающих воздействий со стороны микроглии.
Таким образом, полученные экспериментальные данные подтверждают токсическое влияние севофлурана, при этом изменение плотности популяции нейронов в слоях коры мозжечка зависит не только от токсического влияния анестетика, но и, по-видимому, от межнейронных связей в коре мозжечка. В большей степени страдают клетки Пуркинье, вовлекая в процесс гибели нейроны молекулярного слоя. Нейроны зернистого слоя с низким уровнем энергетического обмена более устойчивы по отношению к действию севофлурана и в процесс гибели вовлекаются, прежде всего, нейроны, связанные с клетками Пуркинье и нейронами молекулярного слоя (клетки Лугаро и клетки-канделябры). Вместе с тем микроглиоциты реагируют на длительную экспозицию севофлурана и гибель нейронов в молекулярном и ганглионарном слоях не активно, доля их значимо не увеличивается и они, по всей видимости, не оказывают дополнительного влияния на развитие нейродегенеративных процессов в коре мозжечка. Учитывая хорошо известные в настоящее время межнейронные связи мозжечка его удобно рассматривать как модель для определения степени токсичности анестетиков и дальнейшей разработки мер по профилактике их воздействия на деятельность мозга.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена в рамках темы госзадания № госрегистрации АААА-А18-118102590054-0.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Все эксперименты с животными выполнены в соответствии с правилами проведения работ с использованием экспериментальных животных (согласно принципами Европейской конвенции, Страсбург, 1986 г., и Хельсинской декларации Всемирной медицинской ассоциации о гуманном обращении с животными, 1996 г.).
Список литературы
Алексеева О.С., Гилерович Е.Г., Кирик О.В., Коржевский Д.Э. 2016. Структурная и пространственная организация микроглиоцитов молекулярного слоя коры мозжечка кролика. Морфология. 150(4) : 40–43. (Alekseeva O.S., Gilerovich E.G., Kirik O.V., Korzhevskii D.E. 2017. Structure and spatial organization of microgliocytes in the molecular layer of the cerebellar cortex in rabbits. Neurosci. Behavioral Physiol. 47(6) : 637–640.)
Белозерцева И.В., Драволина О.А., Кривов В.О., Тур М.А., Мус Л.В., Полушин Ю.С. 2017. Послеоперационные изменения поведения крыс, получавших анестезию севофлураном. Вестник анестезиологии и реаниматологии. 14(2) : 55–62. (Belozertseva I.V., Dravolina O.А., Krivov V.O., Tur M.А., Mus L.V., Polushin Yu.S. 2017. Postoperative changes in the behavior of rats after anesthesia with sevoflurane. Messenger of Anesthesiology and Resuscitation. 14(2) : 55–63.)
Калиниченко С.Г., Мотавкин П.А. 2005. Кора мозжечка. М.: Наука. 319 с. (Kalinichenko S.G., Motavkin P.A. 2005. The cerebellar cortex. Moscow: Nauka. 319 p.)
Кирик О.В., Сухорукова Е.Г., Алексеева О.С., Коржевский Д.Э. 2014. Субэпендимные микроглиоциты III желудочка головного мозга. Морфология. 145(2) : 67–69. (Kirik O.V., Sukhorukova E.G., Alekseeva O.S., Korzhevskii D.E. 2014. Subependymal microgliocytes of the third ventricle of the brain. Morfologiia. 145(2) : 67–69).
Коржевский Д.Э., Кирик О.В., Сухорукова Е.Г., Сырцова М.А. 2014. Микроглия черного вещества головного мозга человека. Медицинский академический журнал. 14(4) : 68–72. (Korzhevskii D.E., Kirik O.V., Sukhorukova E.G., Syrszova M.A. 2014. Microglia of the human substantia nigra. Medical Academic J. 14(4) : 68–72).
Хожай Л.И., Отеллин В.А. 2013. Реактивные изменения микроглии в неокортексе и гиппокампе у крыс после воздействия острой перинатальной гипоксии. Морфология. 143(1) : 23–27. (Khozhai L.I., Otellin V.A. 2013. Reactive microglial changes in rat neocortex and hippocampus after exposure to acute perinatal hypoxia. 2013. Morphology. 143(1) : 23–27).
Ambrosi G., Flace P., Lorusso L., Girolamo F., Rizzi A., Bosco L., Errede M., Virgintino D., Roncali L., Benagiano V. 2007. Non-traditional large neurons in the granular layer of the cerebellar cortex. Eur J. Histochem. 51 : 59–64.
Ancelin M.L., De Roquefeuil G., Ritchie K. 2000. Anesthesia and postoperative cognitive dysfunction in the elderly: a review of clinical and epidemiological observations. Rev. Epidemiol. Sante Publique. 48 : 459–472.
Baloyannis S.J. 2013. Dendritic and spinal pathology of the Purkinje cells from the human cerebellar vermis in Alzheimer’s disease. Psychiatr. Danub. 25 : 221–226.
Bertoni-Freddari C., Fattoretti P., Giorgetti B., Solazzi M., Balietti M., Casoli T., Di Stefano G. 2004. Decay of mitochondrial metabolic competence in the aging cerebellum. Ann. N. Y. Acad. Sci. USA. 1019 : 29–32.
Block M.L., Zecca L., Hong J.S. 2007. Microglia-mediated neurotoxicity: uncovering the molecular mechanisms. Nature Rev. Neurosci. 8 : 57–69.
DelRosso L.M., Hoque R. 2014. The cerebellum and sleep. Neurol. Clin. 32 : 893–900.
Frei J. 1992. Cerebral complications and general anesthesia. Schweiz. Rundsch. Med. Prax. 81 : 1098–1101.
Dino M.R., Perachio A.A., Mugnaini E. 2001. Cerebellar unipolar brush cells are targets of primary vestibular afferents: an experimental study in the gerbil. Exp. Brain Res. 140 : 162–170.
Gonzalez H., Elgueta D., Montoya A., Pacheco R. 2014. Neuroimmune regulation of microglial activity involved in neuroinflammation and neurodegenerative diseases. J. Neuroimmunol. 274 : 1–13.
Graeber M.B., Streit W.J. 2010. Microglia: biology and pathology. Acta Neuropathol. 119 : 89–105.
Koziol L.F., Budding D., Andreasen N., D’Arrigo S., Bulgheroni S., Imamizu H., Ito M., Manto M., Marvel C., Parker K., Pezzulo G., Ramnani N., Riva D., Schmahmann J., Vandervert L., Yamazaki T. 2014. Consensus paper: the cerebellum’s role in movement and cognition. Cerebellum. 13 : 151–177.
Laine J., Axelrad H. 1996. Morphology of the Golgi-impregnated Lugaro cell in the rat cerebellar cortex: a reappraisal with a description of its axon. J. Comp. Neurol. 375 : 618–640.
Laine J., Axelrad H. 2002. Extending the cerebellar Lugaro cell class. Neurosci. 115 : 363–374.
Lyman M., Lloyd D.G., Ji X., Vizcaychipi M.P., Ma D. 2014. Neuroinflammation: the role and consequences. Neurosci. Res. 79 : 1–12.
Marshall S.A., McClain J.A., Kelso M.L., Hopkins D.M., Pauly J.R., Nixon K. 2013. Microglial activation is not equivalent to neuroinflammation in alcohol-induced neurodegeneration: The importance of microglia phenotype. Neurobiol. Dis. 54 : 239–251.
Mavroudis I.A., Manani M.G., Petrides F., Petsoglou K., Njau S.D., Costa V.G., Baloyannis S.J. 2013. Dendritic and spinal pathology of the Purkinje cells from the human cerebellar vermis in Alzheimer’s disease. Psychiatr. Danub. 25 : 221–226.
Moller J.T. 1997. Cerebral dysfunction after anaesthesia. Acta. Anaesthesiol. Scand. 110 : 13–16.
Monk T.G., Weldon B.C., Garvan C.W., Dede D.E., van der Aa M.T., Heilman K.M., Gravenstein J.S. 2008. Predictors of cognitive dysfunction after major noncardiac surgery. Anesthesiology. 108 : 18–30.
Norsidah A.M., Puvaneswari A. 1997. Anaesthetic complications in the recovery room. Singapore Med. J. 38 : 200–204.
Peng Y.P., Qiu Y.H., Chao B.B., Wang J.J. 2005. Effect of lesion of cerebellar fastigial nuclei on lymphocyte functions of rat. Neurosci. Res. 51 : 275–284.
Pouzat C., Hestrin S. 1997. Developmental regulation of basket/stellate cells – Purkinje cell synapses in the cerebellum. Neurosci. 17 : 9104–9112.
Schmahmann J.D., Caplan D. 2006. Cognition, emotion and the cerebellum. Brain. 129 : 341–347.
Schmahmann J.D., Sherman J.C. 1998. The cerebellar cognitive affective syndrome. Brain. 121 : 561–579.
Serhan C.N., Chiang N., Van Dyke T.E. 2008. Resolving inflammation: dual anti-inflammatory and pro-resolution lipid mediators. Nature Rev. Immunol. 8 : 349–361.
Steinmetz J., Funder K.S., Dahl B.T., Rasmussen L.S. 2010. Depth of anaesthesia and post-operative cognitive dysfunction. Acta Anaesthesiol. Scand. 54 : 162–168.
Wake H., Moorhouse A.J., Jinno S., Kohsaka S., Nabekura J. 2009. Resting microglia directly monitor the functional state of synapses in vivo and determine the fate of ischemic terminals. J. Neurosci. 29 : 3974–3980.
Дополнительные материалы отсутствуют.


