Цитология, 2020, T. 62, № 1, стр. 47-55
Влияние ионов меди на клеточные элементы целомической жидкости морских звезд Asterias rubens L.
В. А. Федюнин 1, *, А. А. Поромов 1, А. В. Смуров 1
1 Биологический факультет Московского государственного университета им. М.В. Ломоносова
119234 Москва, Россия
* E-mail: v-fedyunin@mail.ru
Поступила в редакцию 19.08.2019
После доработки 17.10.2019
Принята к публикации 18.10.2019
Аннотация
Работа посвящена изучению действия ионов меди на количество и соотношение различных субпопуляций и функциональные показатели клеток целомической жидкости морских звезд Asterias rubens. Эксперименты проводили на базе Беломорской Биологической станции им. Н.А. Перцова Биологического факультета МГУ им. М.В. Ломоносова. Воздействие на морских звезд хлоридом меди(II) (концентрация ионов Cu2+ составляла 0.78, 1.95 или 3.91 мкМ) проводили в аквариумах в течение 96 ч после добавления соли. У морских звезд, содержащихся в аквариумах с максимальной концентрацией ионов меди, наблюдали значительное увеличение числа целомоцитов. Изменялось также и распределение субпопуляций клеток: доля мелких клеток увеличивалась с 9 до 15.5%, агранулоцитов – с 61 до 75%, доля гранулоцитов соответственно уменьшалась с 30 до 8.5%. Уровень экспрессии стресс-индуцируемых белков 70 (Hsc70/Hsp70), определяемого методом Вестерн-блот-анализа, увеличивался у морских звезд во всех экспериментальных аквариумах. Жизнеспособность выделенных целомоцитов, оцениваемая по поглощению красителя нейтрального красного (НК), возрастала у морских звезд в экспериментальных аквариумах с концентрациями ионов меди 0.78 и 1.95 мкМ по сравнению с контролем, однако при концентрации 3.91 мкМ поглощение НК резко снижалось. Таким образом, показано, что ответ A. rubens на воздействие ионами меди(II) выражается в увеличении количества циркулирующих целомоцитов и увеличении доли субпопуляции фагоцитов, что, предположительно, может служить компенсаторным механизмом в ответ на токсическое действие меди(II).
Загрязнение морской среды токсическими веществами антропогенного происхождения приводит к существенным нарушениям физико-химического состава природных вод, оказывающим отрицательное воздействие, как на отдельные организмы, так и на морские экосистемы в целом. Вопросы, связанные с изучением особенностей развития токсических эффектов загрязняющих веществ на живые организмы в условиях морской среды, адаптация к их воздействию, в том числе и на клеточном уровне, остаются актуальными. Белое море (внутреннее море на севере европейской части России) имеет важное экономическое значение за счет интенсивного промышленного рыболовства и хозяйственной деятельности в прибрежной зоне. Горнодобывающая промышленность оказывает значительное влияние на экосистему Белого моря, что связано с загрязнением различными металлами (Коршенко, 2015; Черногаева, 2017), среди которых медь является одним из наиболее токсичных. Медь представляет особый интерес с точки зрения токсикологии не только в связи с еe высокой токсичностью, но также и с ее высокой биологической активностью и многообразием присущих ей функций в организме животных: от участия в регуляции функциональной активности некоторых ферментов до влияния на обменные процессы, рост и развитие целого организма.
Перспективным объектом токсикологических исследований являются представители типа Иглокожие (Echinodermata). Иглокожие, древнейшие представители группы Deuterostomia, представляют интерес в связи с их высокой экологической значимостью и широким ареалом распространения. Взрослые животные – бентосные организмы, распространённые по всей акватории мирового океана, они заселяют морское дно от литорали до почти максимальных глубин. Ввиду того, что представители типа Иглокожие ведут в основном малоподвижный образ жизни и являются одним из конечных звеньев многих пищевых цепей, они в большей мере подвергаются воздействию факторов природного (Barbaglio et al., 2012) и антропогенного (Falugi et al., 2012) происхождения. Иглокожие филогенетически близки к позвоночным животным и имеют сложную иммунную систему, включающую Toll-подобные рецепторы (Smith et al., 2010) и стресс-индуцируемые белки, участвующие в реализации врожденного иммунного ответа (Tsan, 2009). На биологическом материале иглокожих разного уровня организации (от субклеточного до организменного) можно изучать токсические эффекты загрязняющих веществ (Coteur et al., 2003; Ronning, 2005; Поромов, Смуров, 2014).
В качестве объекта исследования нами выбран широко распространённый эвригалинный вид морских звезд Asterias rubens L. При исследовании адаптации этой группы к абиотическим факторам внешней среды, повышенный интерес вызывают клеточные элементы целомической жидкости. Целомоциты играют важную роль в регенерации и защитных реакциях иглокожих от различного рода повреждений и инфекций. Эти клетки циркулируют в составе целомической жидкости и способны к фагоцитозу инородных частиц и образованию агрегатов в зонах существенных повреждений тела, затрагивающих целомические каналы (Козлова и др., 2006). Восстановление пула целомоцитов при повреждении животного происходит достаточно быстро. Целомоциты иглокожих могут быть выделены в переживающую первичную клеточную культуру (Шарлаимова и др., 2010), на которой можно проводить анализ токсичности водорастворимых загрязняющих веществ, в частности, ионов металлов.
Количественные, качественные и функциональные изменения клеточных элементов целомической жидкости наблюдают при действии различных природных и антропогенных факторов. Количество целомоцитов увеличивается в ответ на травмы, инфекции, неблагоприятные условия (Козлова и др., 2006). Отмечено увеличение концентрации амебоцитов (одной из субпопуляций целомоцитов) в ответ на паразитарные инвазии, что послужило основанием рассматривать это явление как часть воспалительного процесса. Инъекция грамположительных бактерий в целомическую полость приводит к увеличению концентрации только двух субпопуляций амебоцитов, которые являются наиболее активными фагоцитами (Coteur et al., 2004).
Исследования в Норвежском фьорде Sorfjord (Coteur et al., 2003, 2004) показали, что концентрации амебоцитов и выделение клетками активных форм кислорода (АФК) в условно чистом районе и в загрязнённом различались. Также показана прямая зависимость образования микроядер в клетках целомической жидкости и выделения АФК от содержания в окружающей среде ионов кадмия (Cd2+) и свинца (Pb2+) (Coteur et al., 2004). При этом повышение АФК является маркером апоптоза и представляет собой угрозу для целостности амебоцитов, поскольку может привести к изменению активности некоторых макромолекул (Guzik et al., 2003).
Известно также, что ионы металлов способны стимулировать экспрессию белков теплового шока (Hsp) в морских организмах (Franzellitti, Fabbri, 2005; Deane, Woo, 2005). Стресс-индуцируемые белки теплового шока играют исключительно важную роль в поддержании нормального клеточного гомеостаза, а также в комплексном механизме, обеспечивающем выживание клеток в неблагоприятных условиях (Becker, Craig, 1994; Browne et al., 2007).
В нашей предыдущей работе (Федюнин, 2018) показано, что наиболее токсичным металлом для морских звезд A. rubens L. среди ряда изученных является медь. Ее полулетальная концентрация ЛК50 (при которой гибнет половина популяции) составляет 0.98 ± 0.16 мкM при 96-часовом действии, поэтому в настоящей работе выбраны концентрации меди сублетальные (0.78, 1.95 и 3.91 мкM), не приводящие к гибели всей экспериментальной группы животных в течение 4 сут воздействия.
Цель настоящей работы заключалась в изучении действия ионов меди в сублетальных концентрациях на количество разных типов клеток и их соотношение в различных субпопуляциях целомической жидкости (ЦЖ) морских звезд Asterias rubens. Кроме того, изучали такие функциональные показатели, как лизосомальная активность и содержание стресс-индуцируемых белков с мол. массой 70 кДа (Hsc70/Hsp70).
МАТЕРИАЛ И МЕТОДИКА
Сбор и содержание экспериментальных животных. Морские звезды A. rubens были собраны вблизи Беломорской биологической станции им. Н.А. Перцова биологического факультета МГУ им. М.В. Ломоносова (Кандалакшский залив Белого моря). Сбору подлежали только неповрежденные пятилучевые морские звезды диаметром 10−12 см. Морских звезд содержали в стеклянных аквариумах объемом 20 л при температуре воды 15 ± 2°C, солености 26‰ и естественном световом цикле.
Действие хлорида меди в аквариумах. В аквариумы добавляли раствор хлорида меди (CuCl2 ∙ 2H2O) (Реахим, Россия) до концентрации ионов меди, равной 0.78, 1.95 или 3.91 мкМ. Для расчета экспериментальных концентраций металлов использовали значения, кратные экологическим нормативам (предельно допустимым концентрациям) (Приказ от 18 января 2010 года № 20, Москва). Воду в аквариумах меняли ежедневно наполовину, добавляя в нее раствор хлорида меди до соответствующей концентрации ионов меди в растворе. Забор ЦЖ морских звезд A. rubens проводили через 4 сут (96 ч) эксперимента. Контролем служили морские звезды A. rubens, которых содержали в морской воде без добавления меди. Воду в контрольных аквариумах тоже же меняли ежедневно наполовину.
Забор ЦЖ. ЦЖ извлекали из кончика луча морских звезд A. rubens при помощи шприца объемом 1 мл не менее чем у 5 животных из каждого экспериментального и контрольного аквариумов через 4 сут после начала эксперимента. Далее ЦЖ каждой морской звезды сливали в отдельные пробирки, содержащие равный объем солевого раствора CMFSS (0.5 M NaCl (ЛенРеактив, Россия), 0.0026 M KCl (Хеликон, Россия), 0.1 M Трис (Хеликон, Россия), pH 8.0) (Козлова и др., 2006), добавляя 15 мМ ЭДТА (Хеликон, Россия) (антикоагулянт) и помещали на лед.
Определение числа клеток в ЦЖ. 100 мкл ЦЖ отбирали в отдельные пробирки, добавляли к ним 10 мкл 0.6%-ного раствора красителя толуидинового синего (Диаэм, Россия), перемешивали, выдерживали 30 мин, после чего считали клетки под микроскопом в камере Горяева (Диаэм, Россия). Число целомоцитов оценивали в двух повторах у 5 морских звезд A. rubens из каждого экспериментального и контрольного аквариумов.
Анализ клеточного состава ЦЖ. Отобранную ЦЖ объемом 200 мкл помещали в 8%-ный формалина равного объема (Нева-Реактив, Россия). Клетки фиксировали в течение 30 мин в пластиковых пробирках объемом 0.5 мл (Эппендорф, Германия). Фиксатор смывали дистиллированной водой путем центрифугирования. Осадок клеток ресуспендировали в дистиллированной воде, наносили на предметное стекло, предварительно обработанное полилизином (20 мкг/мл), высушивали в течение 30 мин, затем вымачивали в дистиллированной воде в течение 20 мин. Далее клетки фиксировали в метаноле в течение 15 мин с последующим окрашиванием 5%-ным раствором Романовского−Гимзы (ЛенРеактив, Россия) в течение 20 мин. Избыток красителя смывали дистиллированной водой с последующим обезвоживанием в спиртах в следующей последовательности: 70 и 96% этанол, изобутанол, ксилол (по методу Козловой с коллегами (2006) с модификациями).
Процентное соотношение клеток различных типов оценивали, как минимум, у 5 морских звезд из каждого экспериментального и контрольного аквариумов через 4 сут от начала эксперимента. В каждой пробе ЦЖ подсчитывали 500 клеток.
Анализ экспрессии белков Hsc70/Hsp70 в целомоцитах при воздействии медью. Вестерн-блот-анализ. Суспензию клеток, полученную от 3-х морских звезд, немедленно центрифугировали при 1500 g в течение 10 мин при комнатной температуре. Осадок клеток ресуспендировали в лизирующем буфере (1% PMSF-1% (Диаэм, Россия), Triton X-100 и 58 мМ ЭДТА (Хеликон, Россия)) и добавляли смесь ингибиторов протеаз (по 2 мкг/мкл антипаина и леупептина, по 1 мкг/мкл апротинина и пепстатина, 1 мМ бензамидина) и гомогенизировали в течение 10 мин на льду. Клеточные лизаты центрифугировали при 5600 g в течение 10 мин при 4°С; супернатанты собирали, общий белок в клеточных лизатах определяли по методу Бредфорда (Bradford, 1976) c помощью набора реактивов Bradford protein assay kit (Bio-Rad, США) по протоколу производителя, используя бычий сывороточный альбумин в качестве стандарта. Далее клеточные лизаты подвергали электрофорезу в пластинах полиакриламидного геля в присутствии додецилсульфата натрия (ДСН) и β-меркаптоэтанола (Хеликон, Россия). Использовали 7.5%-ные гели со стандартной сшивкой (2.7%).
После проведения электрофореза гелевые пластины использовали для последующего иммуноблоттинга. Электроперенос после электрофореза в ПААГ в присутствии ДСН проводили на фильтры PVDF при 80 V/350 мА в буфере, содержащем 25 мМ Триса (Хеликон, Россия), 180 мМ глицина (Реахим, Россия), pH 8.3, 20% этанола, 0.1% ДСН. Электроперенос белков с геля на нитроцеллюлозную мембрану осуществляли в течение 2.5 ч. Затем фильтр 30 мин обрабатывали 0.25%-ным водным раствором глутарового альдегида для ковалентной сшивки белков с фильтром. Фильтр ополаскивали 7%-ной уксусной кислотой и окрашивали 0.1%-ным Ponceau S в 1%-ной уксусной кислоте. После этого фильтры блокировали 1 ч при комнатной температуре в 5%-ном растворе обезжиренного молока в буфере ТСБ-Т (20 мМ Трис-HCl, pH 7.6, 165 мМ NaCl и 0.05% Твин-20 (Хеликон, Россия)).
В качестве первичных антител использовали коммерчески доступные бычьи моноклональные антитела к белкам теплового шока с мол. массой 70 кДа (Hsp70 McAb) (Sigma Chemical Company, H-5147, USA) в разведении 1 : 5000. Эти антитела распознают как индуцибельные (Hsp70), так и конститутивные (Hsc70) изоформы белка теплового шока. В качестве вторичных антител использовали коммерческие противомышиные антитела (IgG), коньюгированные с пероксидазой хрена (Amersham, Великобритания), в разведении 1/10 000. Инкубацию как с первичными, так и с вторичными антителами проводили 1 ч при комнатной температуре в растворе 1%-ного обезжиренного молока в буфере ТСБ-Т. Для выявления белковых полос использовали хемилюминесцентную детекцию с помощью набора реактивов (Amersham, Великобритания) и 3.3-диаминобензидина (ДАБ). После проявления пленки сканировали, интенсивность полос измеряли с помощью системы ChemiDoc (Bio-Rad, США), оснащенной программным обеспечением Quantity One, версия 4.2.1. Значения интенсивностей хемилюминесценции представлены в усл. ед. полученных на основе объемного анализа полос.
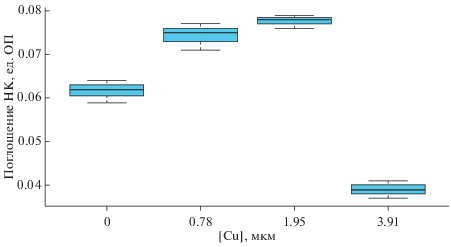
Оценка жизнеспособности целомоцитов. Жизнеспособность выделенных целомоцитов морской звезды A. rubens исследовали с помощью цитотоксического теста с использованием красителя нейтрального красного (НК) (Hauton, Smith, 2004; Kudryavtsev et al., 2016). Тест с НК применяется для оценки функциональной активности лизосом клеток in vitro. НК – катионный краситель, используемый для прижизненного окрашивания клеток за счет избирательного накопления в лизосомах путем пассивного транспорта через клеточную мембрану. Ввиду того, что погибшие клетки утрачивают способность к аккумуляции нейтрального красного в лизосомах, степень окраски клеток характеризует их жизнеспособность.
Для проведения эксперимента готовили полную культуральную среду на основе питательной среды RPMI-1640 (ПанЭко, Россия), содержащей NaCl до 24‰, 10% сыворотки A. rubens, 10 мМ HEPES (Диаэм, Россия), 2 мМ L-глютамина (ПанЭко, Россия) и 80 мкг/мл гентамицина (ПанЭко, Россия). Рабочий раствор НК (Sigma Aldrich, USA) в концентрации 40 мкг/мл готовили непосредственно перед началом эксперимента, добавляя к 5 мл полной культуральной среды 10 мкл маточного раствора (5 мг НК в 1 мл ДМСО (Хеликон, Россия), который хранили до использования при −20°С). В лунки 96-луночного плоскодонного планшета (Sarstedt, USA) вносили по 100 мкл клеточной суспензии (3 × 106 кл./мл). К клеткам добавляли 50 мкл рабочего раствора НК, 50 мкл фильтрованной морской воды или равный объем раствора хлорида меди с концентрацией ионов меди равной 0.78 мкМ, 1.95 мкМ или 3.91 мкМ. Время культивирования целомоцитов с раствором НК составляло 6 ч при 10°С в атмосфере 3% СО2.
По завершении культивирования лунки планшета дважды промывали от свободного красителя 200 мкл фильтрованной морской водой, и в каждую лунку вносили 100 мкл фиксатора (1% КСl (Нева-Реактив, Россия) в 0.5%-ном формалине (Нева-Реактив, Россия) на дистиллированной воде). Включившийся в лизосомальную и цитоплазматическую фракции НК экстрагировали при помощи 1%-ной уксусной кислоты на 50%-ом этаноле. Спектроскопию проводили на многоканальном спектрофотометре BioRad X-mark (BioRad, США) при длине волны 570 нм. Результат выражали в единицах оптической плотности (ОП). Жизнеспособность оценивали отношением значения ОП в эксперименте к значению ОП в контроле и выражали в %.
Статистический анализ. Статистическую обработку данных проводили с помощью пакета RStudio (версия 1.0.143). Для количественных показателей результат представлен в виде среднего значения и стандартного отклонения. Для оценки влияния на исследуемые показатели ионов меди в различных концентрациях использовали однофакторный дисперсионный анализ (ANOVA). Для межгрупповых сравнений количественных показателей использовали непараметрический U-критерий Манна−Уитни. При использовании статистических процедур различия считали статистически значимыми при P ≤ 0.05.
РЕЗУЛЬТАТЫ
Параметры качества воды и выживаемость животных. Температура воды в экспериментальных аквариумах колебалась от 13.4 до 15.2°C, соленость – от 25 до 26 ед. фактической солености, значение рН воды составляло от 8.0 до 8.2. Через 96 ч воздействия ионами меди в концентрации 1.95 мкМ наблюдали гибель 10% морских звезд A. rubens, а в концентрации 3.91 мкМ – 30% (табл. 1).
Таблица 1.
Изменение числа целомоцитов и выживаемость морских звезд A. rubens в ответ на воздействие металлов
| Концентрация ионов меди, мкМ | Выживаемость, % (число живых животных) |
Число клеток в ЦЖ, ×103/мкл а | Доли субпопуляций клеток, %б |
|---|---|---|---|
| 0 (Контроль) | 100 (20) | 16.2 ± 30.8 | А: 61 ± 6 Г: 30 ± 6 М: 9 ± 1 |
| 0.78 | 100 (20) | 38.3 ± 79.3 | А: 45 ± 6 Г: 48 ± 3 (P = 0.001)г М: 7 ± 4 |
| 1.95 | 90 (18) | 33.9 ± 42.1 | А: 74 ± 5 Г: 14 ± 3 (P = 0.01)г М: 11 ± 6 |
| 3.91 | 70 (14) | 111.9 ± 108.8 (P = 0.039)в |
А: 76 ± 6 Г: 9 ± 3 (P = 0.005)г М: 15 ± 5 |
Общее число целомоцитов. Количество клеток в ЦЖ в начале эксперимента составило (52.7 ± 43.7) × × 103 кл./мкл (медиана 37.7 × 103). Через 4 сут наблюдали снижение числа целомоцитов у морских звезд в контрольном аквариуме до (16.2 ± 30.8) × 103 кл./мкл. Через 4 сут эксперимента среднее количество целомоцитов у морских звезд в экспериментальных аквариумах было выше, чем у контрольных животных (Р < 0.05) при воздействии меди в максимальной концентрации (3.91 мкМ); результаты приведены в табл. 1.
Клеточный состава ЦЖ. Микроскопическое исследование клеточного состава ЦЖ позволило выделить три различных морфотипа клеток, а именно: (1) агранулоциты (также называемые фагоцитарными амебоцитами) – клетки различной формы без гранул с хорошо идентифицируемым ядром, до 7 мкм в диаметре, окрашивались базофильно); (2) гранулоциты (называемые также красными сферическими клетками или красными амебоцитами) до 7 мкм в диаметре, округлой или овальной формы, окрашивались эозинофильно, гранулы окрашивались в более темный цвет, ядро не идентифицировалось) и (3) мелкие клетки до 4 мкм в диаметре, окрашивались в синий цвет. Для морских звeзд, содержащихся в контрольном аквариуме, через 96 ч воздействия доля агранулоцитов составляла 61%, гранулоцитов – 30% и мелких клеток – 9%. При этом наблюдали значительные различия в распределении клеток между отдельными звездами. Воздействие медью увеличило долю мелких клеток до 15.5% и долю агранулоцитов – до 76%; результаты приведены в табл. 1.
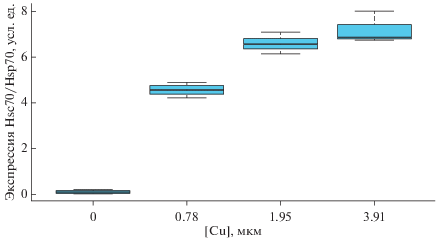
Экспрессия белка Hsc70/Hsp70. Анализ интенсивности полос на геле, полученном в результате проведения иммуноблоттинна, проведенного для трех морских звезд из каждого экспериментального аквариума (рис. 1), показал значимое увеличение уровня экспрессии белка стресса с мол. массой 70 кДа (Hsc70/Hsp70) при увеличении концентрации меди (ANOVA, P < 0.05).
Рис. 1.
Уровни экспрессии белков Hsc70/Hsp70 в целомоцитах морских звезд A. rubens при воздействии ионов меди в различной концентрации в экспериментальных аквариумах. Уровень экспрессии Hsc70/Hsp70, представленный в произвольных единицах, был измерен методом иммуноблоттинга в трех повторах (3 животных из каждого аквариума). Диаграмма размаха здесь и на рис. 2 включает медиану, стандартную ошибку и стандартное отклонение (линия, граница прямоугольника и граница погрешности соответственно).
Жизнеспособность целомоцитов морской звезды. Этот показатель оценивали по поглощению красителя НК. Время окрашивания клеток составляло 6 ч и было подобрано в ходе предварительных экспериментов по адаптации данной методики для работы на морских звездах. В результате эксперимента, представленного на рис. 2, показано, что через 6 ч после его начала накопление НК в лизосомах и в цитоплазме интактных целомоцитов возрастало по сравнению с контролем при добавлении меди в концентрации 0.78 и 1.95 мкМ и резко снижалось при увеличении концентрации меди до 3.91 мкМ.
ОБСУЖДЕНИЕ
В качестве модельного объекта в настоящей работе для оценки риска загрязнения окружающей среды на субклеточном уровне использовали широко распространeнный в морях северных широт вид беспозвоночных, входящий в состав макробентоса морей, – морскую звезду A. rubens. Металлы являются основным компонентом среди комплекса загрязняющих веществ, поступающих в воды северо-восточной части Атлантического океана. Популяция морских звезд A. rubens обитает в условиях повышенной антропогенной нагрузки, в связи с чем актуальным становится следующий вопрос: какие субклеточные и клеточные ответные механизмы связаны с адаптацией этих животных?
В сравнении с действием других металлов, изученным ранее, действие меди даже при незначительном превышении экологических нормативов при долгосрочном нахождении в морской среде оказывается токсичным и вызывает гибель A. rubens (Федюнин, 2018). Несмотря на быстрое проникновение и аккумуляцию в теле морских звезд (Coteur et al., 2003) и потенциальную цитотоксичность ионов меди при высоких концентрациях ее в воде, количество циркулирующих целомоцитов не уменьшалось в ходе настоящих экспериментов. Наоборот, уже через 96 ч действия число клеток увеличивалось у всех экспериментальных животных не менее чем в 2 раза, а при воздействии меди в максимальной концентрации – в 7 раз. Вероятно, ионы меди активируют клеточную пролиферацию, что дополнительно подтверждается увеличением числа мелких клеток, являющихся, предположительно, клетками-предшественниками (Козлова и др., 2006).
Увеличение числа агранулоцитов может быть связано как с повышением уровня фагоцитоза, так и с участием клеток этого типа в транспортировке металлов между тканями и к органам выведения. Массовая миграция целомоцитов в жабры, пищеварительный тракт и другие органы детоксикации в условиях воздействия металлами (Cd2+, Cu2+, Pb2+) была ранее показана в экспериментах с моллюсками (Soto et al., 2003). Эти эксперименты продемонстрировали возможность выведения кадмия и меди у моллюсков путем их связывания со специфическими белками, называемыми металлотионеинами, а также путем выведения металлов путем включения в лизосомы фагоцитов.
Анализ изменения интенсивности экспрессии белков в целомоцитах морских звезд A. rubens и поглощения клетками красителя НК в ответ на воздействие ионов меди, позволяет сделать предположение о реализации адаптационных механизмов, основанных на деятельности белков теплового шока и увеличении лизосомальной активности. Увеличение экспрессии белков семейства теплового шока Hsp70, выявляемое на 4 сут эксперимента, при воздействии ионов меди в концентрации до 1.95 мкМ, фактически отражает реакцию организма и его шаперонной системы на стресс.
Однако нами обнаружено, что значительное увеличение общего числа клеток ЦЖ в ответ на воздействие ионов меди в максимальной исследуемой концентрацией (3.91 мкМ) сопровождается увеличением доли мелких клеток и значительным уменьшением жизнеспособности всех клеток ЦЖ. При этом аналогичного значительного увеличения количества белка Hsc70/Hsp70, участвующего в реализации адаптационных механизмов, не наблюдали. Учитывая, что при концентрации ионов меди выше 1.95 мкМ выживаемость морских звезд A. rubens снижается, можно предположить, что данная концентрация Hsc70/Hsp70 является максимальной, по достижении которой индукция синтеза белков останавливается.
Значимое увеличение уровня экспрессии стресс-индуцируемых белков наблюдается уже при появлении низких концентраций меди в среде. Аналогичные результаты были получены в другой работе по анализу уровней экспрессии белков стресса в морских звездах A. rubens, собранных в районах с различными уровнями загрязнения (Coteur et al., 2004).
При высоких концентрациях меди жизнеспособность клеток значительно снижается, а увеличение числа целомоцитов может являться компенсаторным механизмом, реализуемым в ответ на острый стресс. Будучи токсичной для клеток целомической жидкости, медь, вероятно, оказывает негативное влияние и на другие системы органов и иммунные механизмы животного.
Проведенная работа показалa выраженное цитотоксическое действие ионов меди на морских звезд при воздействии в различных концентрациях, при этом токсическое действие наблюдали уже при концентрациях, реально встречающихся в морской среде. Полученные результаты дают возможность предположить, что материал морских звезд A. rubens на клеточном и субклеточном уровнях может быть использован как биоиндикатор качества морской среды. Так, гибель животных и токсические эффекты на клеточном уровне наблюдали при концентрации меди 1.95 мкМ и выше, однако значительные изменения метаболизма клеток наблюдали при меньших ее концентрациях.
На основе полученных данных можно заключить, что изменения, происходящие в целомической жидкости морских звезд A. rubens в ответ на присутствие ионов меди, направлены на снижение негативного воздействия химического загрязнения и способствуют адаптации животного к антропогенному воздействию.
Список литературы
Козлова А.Б., Петухова О.А., Пинаев Г.П. 2006. Анализ клеточных элементов целомической жидкости на ранних сроках регенерации морской звезды Asterias rubens L. Цитология. Т. 48. № 3. С. 175. (Kozlova A.B., Petukhova O.A., Pinaev G.P. 2006. The analysis of cellular elements in coelomic fluid during early regeneration of the starfish Asterias rubens L. Tsitologiya. V. 48. No 3. P. 175.)
Коршенко А.Н. 2015. Качество морских вод по гидрохимическим показателям. Ежегодник. М.: Наука. 200 с.
Поромов А.А., Смуров А.В. 2014. Характеристика заселенности морских звезд Asterias rubens L. копеподами Scottomyzon gibberum Scott в условиях различной антропогенной нагрузки. Вестник Московского университета. Т. 69. № 2. С. 74. (Poromov A.A., Smurov A.V. 2014. Characterization of copepod Scottomyzon gibberum scott population on Asterias rubens L. starfishes under different anthropogenic load conditions. Moscow Univ. Biol. Sci. Bull. V. 69. № 2. P. 74.)
Приказ Федерального агентства по рыболовству от 18 января 2010 г. № 20. Об утверждении нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения. 2010.
Федюнин В.А., Поромов А.А., Смуров А.В. 2018. Влияние металлов на выживаемость и жизнедеятельность морских звезд Asterias rubens. Токсикологический вестник. Т. 151. № 4. С. 29. (Fedyunin V.A., Poromov A.A., Smurov A.V. 2018. The effect of metals on the survival and vitality of starfish Asterias rubens. Toxicol. Rev. (Toksikologicheskiy Vestnik). V. 151. № 4. P. 29.).
Черногаева Г.М. 2017. Обзор состояния и загрязнения окружающей среды в Российской Федерации за 2016 г. М.: Росгидромет. 206 с.
Шарлаимова Н.С., Пинаев Г.П., Петухова О.А. 2010. Сравнительный анализ поведения и пролиферативной активности в культуре клеток целомической жидкости и клеток различных тканей морской звезды Asterias rubens L., полученных из нормальных и травмированных животных. Цитология. Т. 52. № 4. С. 317. (Sharlaimova N.S., Pinaev G.P., Petukhova O.A. 2010. Cells of coelomic liquid and cells of different tissues of sea star Asterias rubens L. isolated from intact and post-traumatic animals: behaviour and proliferation under cultivation in vitro. Tsitologiya. V. 52. № 4. P. 317.)
Barbaglio A., Tricarico S., Ribeiro A., Ribeiro C., Sugni M., Di Benedetto C., Candia D. 2012. The mechanically adaptive connective tissue of echinoderms: Its potential for bio-innovation in applied technology and ecology. Mar. Environ. Res. V. 76. P. 108.
Becker J., Craig E.A. 1994. Heat-shock proteins as molecular chaperones. Eur. J. Biochem. V. 219. P. 11.
Bradford M.M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. V. 72. P. 248.
Browne C.L., Swan J.B., Rankin E.E., Calvert H., Griffiths S., Tytell M. 2007. Extracellular heat shock protein 70 has novel functional effects on sea urchin eggs and coelomocytes. J. Exper. Biol. V. 210. P. 1275.
Coteur G., Corriere N., Dubois P. 2004. Environmental factors influencing the immune responses of the common European starfish (Asterias rubens). Fish Shellfish Immunol. V. 16. P. 51.
Coteur G., Gillan D., Joly G., Pernet P., Dubois P. 2003. Field contamination of the starfish Asterias rubens by metals. Part 2: Effects on cellular immunity. Environ. Toxicol. and Chem. V. 22. P. 2145.
Deane E.E., Woo N.Y.S. 2005. Cloning and characterization of the hsp70 multigene family from silver sea bream: modulated gene expression between warm and cold temperature acclimation. Biochem. Biophys. Res. Commun. V. 330. P. 776.
Falugi C., Aluigi M.G., Chiantore M.C., Privitera D., Ramoino P., Gatti M.A., Fabrizi A., Pinsino A., Matranga V. 2012. Toxicity of metal oxide nanoparticles in immune cells of the sea urchin. Mar. Environ. Res. V. 76. P. 114.
Franzellitti S., Fabbri E. 2005. Differential HSP70 gene expression in the Mediterranean mussel exposed to various stressors. Biochem. Biophys. Res. Commun. V. 336. P. 1157.
Guzik T.J., Korbut R., Adamek-Guzik T. 2003. Nitric oxide and superoxide in inflammation and immune regulation. J. Physio. Pharmacol. V. 54. P. 469.
Hauton C., Smith V.J. 2004. In vitro cytotoxicity of crustacean immunostimulants for lobster (Homarus gammarus) granulocytes demonstrated using the neutral red uptake assay. Fish Shellfish Immunol. V. 17. P. 65.
Kudryavtsev I., D’yachkov I., Mogilenko D., Sukhachev A., Polevshchikov A. 2016. The functional activity of fractions of coelomocytes of the starfish Asterias rubens Linnaeus, 1758. Russ. J. Mar. Biol. V. 42. P. 158.
Ronning B.I. 2005. Echinoderm coelomocytes as a cellular model in toxicity testing and biomonitoring. https://www.duo.uio.no/bitstream/handle/10852/11837/ronning.pdf?sequence=3&isAllowed=y
Smith L.C., Ghosh J., Buckley K.M., Clow L.A., Dheilly N.M., Haug T., Henson J.H., Li C., Lun C.M., Majeske A.J., Matranga V., Nair S.V., Rast J.P., Raftos D.A., Roth M., Sacchi S., Schrankel C.S., Stensvag K. 2010. Echinoderm immunity. In: Invertebrate Immunity. N.-Y.: Landes Biosci. and Spring Sci. + Business Media. P. 260.
Soto M., Marigomez I., Cancio I. 2013. Biological aspects of metal accumulation and storage. Accessed on 25/01/2018. www.ehu.es/europeanclass2003/biological_aspects_of_metal_accu.htm
Tsan M.F., Gao B. 2009. Heat shock proteins and immune system. J. Leukocyte Biol. V. 85. P. 905.
Дополнительные материалы отсутствуют.