Цитология, 2020, T. 62, № 1, стр. 32-37
Метилирование гистона Н3 по лизину 4 в нейронах грибовидных тел мозга медоносной пчелы при формировании памяти
Т. Г. Зачепило 1, *, Н. Г. Лопатина 1
1 Институт физиологии им. И.П. Павлова РАН
199034 Санкт-Петербург, Россия
* E-mail: polosataya2@mail.ru
Поступила в редакцию 14.06.2019
После доработки 18.10.2019
Принята к публикации 18.10.2019
Аннотация
У медоносной пчелы исследованы моно-, ди- и триметилирование гистона H3K4 в нейронах грибовидных тел – структур, ответственных за обучение и память насекомых. Показано, что через 1 ч после обучения увеличивается число нейронов, содержащих модификации гистона Н3: H3K4me1, H3K4me2 и H3K4me3, что, вероятно, связано с активацией транскрипции в этот период. Через 24 ч после обучения отличий от контроля не наблюдали. Данное исследование вносит вклад в понимание эпигенетических механизмов формирования памяти.
Бурное развитие нейронаук в последние десятилетия способствовало значительному прогрессу в понимании тонких механизмов работы мозга. У позвоночных и беспозвоночных (аплизия, виноградная улитка, дрозофила, пчела, грызуны, человек) продемонстрирована общность нейромедиаторных, сигналинговых, биоэлектрических и молекулярных (в том числе эпигенетических) механизмов, лежащих в основе процессов обучения и памяти (Guan et al., 2002).
Формирование памяти сопровождается двумя волнами транскрипции. Сначала наблюдается транскрипция генов раннего ответа, продукты которых в дальнейшем активируют экспрессию генов позднего ответа (кодирующие различные нейрональные белки) (Guan et al., 2002). Для дифференциальной регуляции этих процессов необходимо участие белковых комплексов, ремоделирующих хроматин путем химических модификаций ДНК и гистонов (метилирование ДНК, фосфорилирование, ацетилирование, метилирование и др. гистонов) (Kim, Kaang, 2017).
Метилирование гистонов возможно по лизинам и аргининам. Метилирование различных остатков лизина (K) в гистоне H3 (H3K4, H3K9, H3K27, H3K36, H3K79 и H4K20) может быть связано с инициацией и элонгацией транскрипции генов или ее репрессией. Гистон H3 может иметь три разных степени метилирования по лизину 4: моно, ди- и триметилирование. Монометилирование (H3K4me1) показано для промоторов транскрипционно активных генов, а также энхансеров. Диметилирование (H3K4me2) и триметилирование (H3K4me3) связаны с промоторами транскрипционно активных генов, при этом область H3K4me3 уже, чем H3K4me2, и расположена вокруг сайта начала транскрипции (Collins et al., 2019). Таким образом, метилирование гистона H3 по лизину 4 (H3K4) ассоциировано с транскрипционной активностью хроматина.
Метилирование H3K4, вероятно, важно для поддержания открытых состояний хроматина, а неметилированный H3K4 эффективно служит сигналом метилирования ДНК, который у промоторов и энхансеров в основном связан с репрессией и ингибированием транскрипционной активности (Collins et al., 2019).
Нарушения в метилировании гистона Н3 по лизину 4 характерны для ряда нейропсихических патологий, таких как синдром Видеманна-Штайнера, синдром Клеефстры, синдром Кабуки, аутизм, при некоторых типах умственной отсталости, афазиях, шизофрении, тревожности и депрессии (Shen et al., 2014).
Участие H3K4me3 в обучении и формировании ассоциативной памяти было показано у мышей (условно-рефлекторное замирание, Gupta et al., 2010), виноградной улитки (пищевая аверзия, Гринкевич, 2012) и медоносной пчелы (условный рефлекс вытягивания хоботка, Швецов и др., 2013). Участие H3K4me1 H3K4me2 в обучении и памяти ранее не исследовали.
Целью данной работы было сравнительное исследование моно-, ди- и триметилирования гистона Н3 по лизину 4 в нейронах мозга при формировании памяти у медоносной пчелы.
МАТЕРИАЛ И МЕТОДИКА
Материал. Объектом исследований служили 10–20 суточные рабочие медоносные пчелы краинской расы Apis mellifera (ЦКП “Биоколлекция ИФ РАН”). Пчел содержали в небольших ульях в комнатном помещении в сетчатой камере при температуре 20–25°C. Пчелы были обеспечены белковым, углеводным кормом, водой. Очистительные облеты пчелы могли совершать ежедневно.
Метод выработки пищевого условного рефлекса вытягивания хоботка на обонятельный раздражитель (Proboscis Extension Reflex, PER). Условный пищевой рефлекс вытягивания хоботка на обонятельный раздражитель вырабатывали путем трехкратного сочетания запахa гвоздики (условный стимул) с пищевым подкреплением (50%-ный раствор сахара): каплю ароматизированного гвоздикой раствора сахарозы приводили в соприкосновение с антеннами, в ответ на вкусовую стимуляцию пчела вытягивает хоботок и слизывает раствор сахарозы (Лопатина, Чеснокова, 1992; Menzel, 2012). Интервал между сочетаниями составлял 6 мин. Проверяли сохранение условного рефлекса в памяти, дистантно предъявляя запах гвоздики. Регистрировали число пчел, ответивших на запах гвоздики вытягиванием хоботка, через 1 и 24 ч после обучения.
За 3 ч до эксперимента пчел лишали пищи, изолируя их от семьи для достижения стабильного безусловно рефлекторного фона. Для выработки условного рефлекса пчел, обездвиженных с помощью холодового наркоза, иммобилизовали в металлическом патроне. Обучение начинали через 30 мин после холодового наркоза. Далее проверяли спонтанную и пищевую возбудимость пчел. Пчелы, демонстрирующие спонтанную реакцию и, напротив, не ответившие безусловно рефлекторной пищевой реакцией, в дальнейших экспериментах не участвовали.
В эксперименте исследовали следующие группы пчел: контрольная группа – необученные пчелы (получали 50%-ный раствор сахарозы без сочетания с запахом), экспериментальная группа – обученные пчелы (трехкратное сочетание запаха гвоздики с раствором сахарозы). В каждой группе в каждой серии экспериментов число пчел было не менее 10.
После завершения поведенческого эксперимента образцы мозга пчел обеих групп использовали для иммуногистохимического окрашивания. Из экспериментальной группы (с обучением) для дальнейших исследований брали только пчел, ответивших условной реакцией.
Иммуногистохимическое окрашивание. У охлажденных на льду пчел извлекали мозг, фиксировали в забуференном параформальдегиде (4% в PBS) 3 ч. Обезвоживали в этаноле (в 40, 70, 96, 100%-ном по 30 мин). Переносили препарат в метилбензоат на ночь при комнатной температуре. Инкубировали в смеси метилбензоата и парафина (50 : 50) 1 ч при 6°С. Парафинизировали препарат (2 раза по 1 ч) при 65°С. Заливали в парафин (Биовитрум, Россия). Готовили серийные парафиновые срезы толщиной 7 мкм.
Депарафинизацию срезов проводили в ксилоле (2 раза по 15 мин) и в спиртах с убывающей концентрацией (100, 96, 70, 40% по 10 мин). Производили демаскировку антигенов в течение 10 мин в 0.03 М цитратном буфере (рН 6.0) в микроволновой печи (450 Вт). Инкубировали препараты с 0.3%-ным раствором перекиси водорода 30 мин. Промывали дистиллированной водой. Производили блокировку срезов в нормальной блокировочной сыворотке (Vectastain ABC Quick kit, Vector, Великобритания) в течение 1 ч при 25°С во влажной камере. Инкубировали срезы с тремя разными первичными антителами (к H3K4me1, H3K4me2, H3K4me3, Abcam, Великобритания), разведение 1 : 300, во влажной камере в течение ночи при 4°С. Промывали буфером РВТ (PBS + 0.1%-ный Triton). Инкубировали срезы с вторичными биотинилированными антителами (Vectastain ABC Quick kit, Vector, Великобритания) 1 ч при 37°С во влажной камере. Инкубировали срезы со стрептавидин-биотиновым комплексом (набор Vectastain ABC Quick kit, Vector, Великобритания) 1 ч при 37°С во влажной камере. Окрашивали диаминобензидином (DAB, Vector, Великобритания). Обезвоживали в спиртах (40, 70, 96% по 10 мин). Заключали препараты в монтировочную среду Витрогель (Биовитрум, Россия).
Микроскопический анализ. Полученные постоянные препараты анализировали с помощью установки, содержащей световой микроскоп Микромед 2 (Россия), цифровую CCD-камеру и компьютер. Оценивали процент окрашенных нейронов в каликсах грибовидных тел.
Статистическая обработка. Для оценки достоверности различий между исследуемыми характеристиками экспериментальных групп использовали непараметрический критерий Манна−Уитни для независимых выборок. Статистические расчеты проводили в программе Past3.
РЕЗУЛЬТАТЫ
Грибовидные тела – парные образования в надглоточном ганглии головного мозга насекомых, состоящие из 2 чашечек (каликсов) и ножки (педункулюса). Внутри каждой чашечки расположены интернейроны (клетки Кеньона), чьи отростки и образуют чашечки и ножки. Грибовидные тела отвечают за высшие интегративные функции у насекомых – способность к ассоциативному обучению и памяти. Основные синаптические контакты дендритов клеток Кеньона с терминалями аксонов, приходящих в грибовидные тела из других областей ЦНС и участвующих в образовании нейропиля, осуществляются именно в области каликсов. Подробно морфофункциональные корреляты обучения и памяти у насекомых описаны в работах (Швецов, Зачепило, 2012; Журавлев и др., 2015).
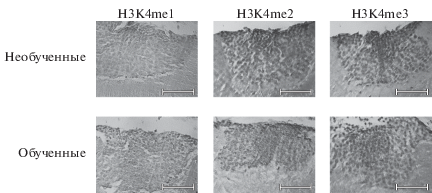
Для выявления моно-, ди и триметилированного гистона Н3 в ядрах нейронов латеральных и медиальных каликсов грибовидных тел мозга медоносной пчелы проводили 3 варианта иммуногистохимического окрашивания: с антителами к Н3К4me1, Н3К4me2 и Н3К4me3 (рис. 1).
Рис. 1.
Каликсы мозга медоносной пчелы. Иммуногистохимическое выявление Н3К4me1, Н3К4me2 и Н3К4me3 на парафиновых срезax мозга обученных (1 ч после обучения) и необученных животных. Увел. об.: 5×. Масштабный отрезок – 20 мкм.
Монометилирование гистона Н3 по лизину 4. Проанализировав полученные данные, мы обнаружили, что доля иммунопозитивных к Н3К4me1 нейронов в чашечках грибовидных тел после выработки условного обонятельного пищевого рефлекса (“обученные”) через 1 ч была достоверно больше чем в контрольной группе (“необученные”) (рис. 2). Через 24 ч после обучения доля иммунопозитивных нейронов не отличалась от таковой у необученных пчел.
Рис. 2.
Доля (%) иммунопозитивных (к Н3К4me1, Н3К4me2 и Н3К4me3) нейронов в мозге обученных и необученных пчел через 1 и 24 ч после обучения. * – различия достоверны, Р < 0.05.
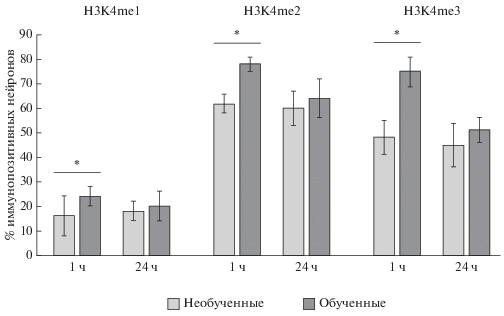
Диметилирование гистона Н3 по лизину 4. Доля иммунопозитивных к Н3К4me2 нейронов в каликсах грибовидных тел после выработки у обученных пчел через 1 ч достоверно превышала таковую у необученных пчел (рис. 2). Через 24 ч после обучения достоверных различий не наблюдали.
Триметилирование гистона Н3 по лизину 4. Проанализировав полученные данные по Н3К4me3 через 1 ч после процедуры обучения, мы выявили достоверное повышение доли иммунопозитивных нейронов у обученных пчел, по сравнению с необученными (рис. 2). Через 24 ч после обучения доля иммунопозитивных нейронов достоверно не отличалась от таковой у необученных пчел.
ОБСУЖДЕНИЕ
Формирование долговременной памяти требует дифференциальной активации генома и синтеза белка. У медоносной пчелы первая волна транскрипции начинается через 10–15 мин после обучения и длится около 1 ч. Вторая волна транскрипции возникает через 3 ч и длится около 5 ч (Lefer et al., 2012). В период первой волны транскрипции происходит активация многочисленных биохимических каскадов, связанных с формированием долговременной памяти (Menzel, 2012 и др.). Регуляция этого этапа требует работы транскрипционных факторов и ремоделирования хроматина. Показано, что у медо-нoсной пчелы в этот период идут процессы ацетилирования гистонов и метилирования/деметилирования ДНК (Merschbaecher et al., 2012; Biergans et al., 2017).
Первые факты, указывающие на участие метилирования H3 (H3K4me3 и H3K9me2) в формировании памяти, были получены в работе Гупта с соавторами в 2010 году (Gupta et al., 2010) на модели условного рефлекса страха у мышей. Методом иммунопреципитации хроматина было показано увеличение уровня триметилирования H3K4 и диметилирования H3K9 на промоторах генов Zif268 и Bdnf через 1 ч после обучения с использованием модели условного рефлекса страха. Через 24 ч этот эффект исчезал. Согласно недавним исследованиям, проведенным на крысах, повышение уровня H3K4me3 в поле CA1 гиппокампа происходит и при извлечении памяти. При этом H3K4me3 располагается в виде широкого домена в кодирующих областях генов раннего ответа Fos и Npas4, а не у их промоторов (Webb et al., 2017).
Данные о процессах метилирования гистонов в ЦНС беспозвоночных при обучении были получены в 2012 г с помощью вестерн-блоттинга: наблюдали глобальное повышение уровня H3K4me3 и H3K9me2 в модели пищевой аверзии у виноградной улитки He-lix в нейронах подглоточного комплекса ганглиев (Гринкевич, 2012).
Результаты, полученные в нашей работе, свидетельствуют, что в мозге пчелы в этот же период времени (1 ч после обучения, начальные этапы формирования долговременной памяти) активно протекают процессы моно-, ди- и триметилирования гистона Н3 по лизину 4.
Изучение процессов метилирования гистона Н3 на медоносной пчеле были начаты нами с изучения суммарного ди- и триметилирования H3K4 в мозге (Зачепило и др., 2012). Далее было показано значительное увеличение числа иммунопозитивных (суммарное H3K4me2 + H3K4me3) нейронов грибовидных тел через 1 и 24 ч после обучения (Швецов и др., 2013).
В настоящей работе моно-, ди- и триметилирование H3K4 исследованы раздельно, для изучения вклада каждого варианта метилирования.
Результаты, полученные в данной работе, свидетельствуют, что в мозге пчелы через 1 ч после обучения (начальные этапы формирования долговременной памяти) активно протекают процессы моно-, ди- и триметилирования гистона Н3 по лизину 4.
Монометилирование H3K4 – это ключевой признак хроматина энхансерных элементов. Энхансеры часто регулируют тканеспецифическую экспрессию генов и могут вступать в физический контакт с промоторами, которые они регулируют, укладывая ДНК в петли. Важно отметить, что уровни H3K4me1 энхансеров коррелируют с паттернами экспрессии генов, специфичными для определенного клеточного типа (Collins et al., 2019). Возможно, увеличение числа иммунопозитивных к Н3К4me1 нейронов грибовидных тел пчелы связано с увеличением числа потенциально активных энхансеров вследствие обучения.
Диметилировние H3K4 изучено в меньшей степени, чем H3K4me1 или H3K4me3. Эта модификация важна для быстрой реактивации транскрипции (D’Urso et al., 2017). В работах с дрожжевыми и человеческими иммунными клетками показано, что H3K4me2 сохраняется в промоторных областях генов после быстрой индукции транскрипции, даже после того, как уровни H3K4me3 вернулись к исходному уровню (Collins et al., 2019). Таким образом, увеличение числа иммунопозитивных к Н3К4me2 нейронов грибовидных тел пчелы может говорить о наличии пула генов, способных быстро повысить (или восстановить) уровень транскрипционной активности.
Триметилировние H3K4 участвует в ряде ядерных процессов: транскрипции, сплайсинге, рекомбинации и репарации ДНК (Collins et al., 2019). Присутствие H3K4me3 показано в промоторах транскрипционно активных генов и в целом совпадают с локализацией РНК-полимеразы II. Уровни H3K4me3 положительно коррелируют с уровнями экспрессии генов (Santos-Rosa et al., 2002). Однако, есть данные, согласно которым H3K4me3, возможно, не является жизненно важным для основных транскрипционных программ (Hödl, Basler, 2012). У обученных пчел, по сравнению с необученными контрольными животными, более высокое число иммунопозитивных H3K4me3 нейронов в чашечках грибовидных тел, по-видимому, отражает глобальное повышение транскрипционной активности в отдельных нейронах.
Наши результаты, таким образом, позволяют заключить, что формирование долговременной памяти у пчел сопровождается процессами моно-, ди- и триметилирования гистона Н3 по лизину 4 и активацией транскрипционной активности хроматина нейронов грибовидных тел. Усиление метилирования H3K4 в нейронах на начальных этапах формировании долговременной памяти является, по-видимому, общим феноменом для животных с разным типом организации центральной нервной системы. Полученные нами ранее данные о повышении суммарного ди- и триметилирования H3K4 через 24 ч после обучения в последующих исследованиях не подтвердились. В совокупности с данными литературы, проведенные нами исследования, свидетельствуют о сходстве эпигенетических механизмов обучения и памяти у позвоночных и беспозвоночных животных.
Список литературы
Гринкевич Л.Н. 2012. Исследование метилирования гистона H3 при формировании долговременной памяти. Рос. физиол. журн. им. И.М. Сеченова. Т. 98. № 9. С. 1111. (Grinkevich L.N. 2012. Investigation of histone H3 methylation during long-term memory formation. Ross. Fiziol. Zh. Im. I.M. Sechenova. V. 98. № 9. P. 1111.)
Журавлев А.В., Никитина Е.А., Савватеева-Попова Е.В. 2015. Обучение и память у дрозофилы: физиолого-генетические основы. Успехи физиол. наук. Т. 46. № 1. С. 76. (Zhuravlev A.V., Nikitina E.A., Savvateeva-Popova E.V. 2015. Learning and memory in Drosophila: physiologic and genetic bases. Usp. Fiziol. Nauk. V. 46. № 1. P. 76.)
Зачепило Т.Г., Вайдо А.И., Камышев Н.Г., Лопатина Н.Г. 2012. Метилирование гистона H3 в головном ганглии медоносной пчелы в условиях дефицита эндогенных кинурениновых метаболитов триптофана. Биол. мембраны. Т. 29. № 6. С. 454. (Zachepilo T.G., Vido A.I., Kamyshev N.G., Lopatina N.G. 2012. Methylation of histone H3 in the honeybee head ganglion at deficiency of endogenous kynurenine metabolites of tryptophan. Biol. Membr. V. 29. № 6. P. 454.)
Лопатина Н.Г., Чеснокова Е.Г. 1992. Условные рефлексы и память у медоносной пчелы. Журн. ВНД им. И.П. Павлова. Т. 42. № 5. С. 890. (Lopatina N.G., Chesnokova E.G. 1992. Conditional reflexes and memory of the honeybee. Zh. Vyssh. Nerv. Deiat. Im. I.P. Pavlova. V. 42. № 5. P. 890.)
Швецов А.В., Зачепило Т.Г. 2012. Морфологическая основа условного рефлекса у медоносной пчелы Apis mellifera L. Журн. ВНД им. И.П. Павлова. Т. 62. № 6. С. 654. (Shvetsov A.V., Zachepilo T.G. 2012. The morphological basis of conditioned reflex in the honeybee Apis mellifera L. Zh. Vyssh. Nerv. Deiat. Im. I.P. Pavlova. V. 62. № 6. P. 654.)
Швецов А.В., Зачепило Т.Г., Вайдо А.И., Швецов А.В., Камышев Н.Г., Лопатина Н.Г. 2013. Об эпигенетической регуляции процесса формирования долговременной памяти. Журн. эвол. биохим. и физиол. Т. 49. № 2. С. 97. (Shvetsov A.V., Zachepilo T.G., Vaydo A.I., Kamyshev N.G., Lopatina N.G. 2013. On epigenetic regulation of process of formation of long-term memory. Zh. Evol. Biokhim. Fiziol. V.49. № 2. P. 97.)
Biergans S.D., Claudianos C., Reinhard J., Galizia C.G. 2017. DNA methylation mediates neural processing after odor learning in the honeybee. Sci. Rep. V. 7: 43635.
Collins B.E., Greer C.B., Coleman B.C., Sweatt J.D. 2019. Histone H3 lysine K4 methylation and its role in learning and memory. Epigenetics Chromatin. V. 12 : 7.
D’Urso A., Brickner J.H. 2017. Epigenetic transcriptional memory. Curr. Genet. V. 63. P. 435.
Guan Z., Giustetto M., Lomvardas S., Kim J.H., Miniaci M.C., Schwartz J.H., Thanos D., Kandel E.R. 2002. Integration of long-term-memory-related synapticplasticity involves bidirectional regulation of gene expression and chromatin structure. Cell. V. 111. P. 483.
Gupta S., Kim S.Y., Artis S., Molfese D.L., Schumacher A., Sweatt J.D. 2010. Histone methylation regulates memory formation. J. Neurosci. V. 30. P. 3589.
Hödl M., Basler K. 2012. Transcription in the absence of histone H3.2 and H3K4 methylation. Curr. Biol. V. 22. P. 2253.
Kim S., Kaang B.K. 2017. Epigenetic regulation and chromatin remodeling in learning and memory. Exp. Mol. Med. V. 49. P. e281.
Lefer D., Perisse E., Hourcade B., Sandoz J., Devaud J.M. 2012. Two waves of transcription are required for long-term memory in the honeybee. Learn. Mem. V. 20. P. 29.
Merschbaecher K., Jakob H., Mueller U. 2012. Acetylation-mediated suppression of transcription-independent memory: bidirectional modulation of memory by acetylation. PLoS One. V. 7. P. 123.
Menzel R. 2012. The honeybee as a model for understanding the basis of cognition. Nat. Rev. Neurosci. V. 13. P. 758.
Santos-Rosa H., Schneider R., Bannister A.J., Sherriff J., Bernstein B.E., Emre N.C., Schreiber S.L., Mellor J., Kouzarides T. 2002. Active genes are tri-methylated at K4 of histone H3. Nature. V. 419. P. 407.
Shen E., Shulha H.,Weng Z., Akbarian S. 2014. Regulation of histone H3K4 methylation in brain development and disease. Philos. Trans. R. Soc. Lond. B Biol. Sci. V. 369. P. 213.
Webb W.M., Sanchez R.G., Perez G., Butler A.A., Hauser R.M., Rich M.C., O’Bierne A.L., Jarome T.J., Lubin F.D. 2017. Dynamic association of epigenetic H3K4me3 and DNA 5hmC marks in the dorsal hippocampus and anterior cingulate cortex following reactivation of a fear memory. Neurobiol. Learn Mem. V. 142. Pt A. P. 66.
Дополнительные материалы отсутствуют.


