Цитология, 2020, T. 62, № 6, стр. 396-402
Получение и характеристика эмбриональных стволовых клеток мыши с нокаутом по гену Pcbp1
Е. И. Бахмет 1, *, С. В. Пономарцев 1, П. А. Дыбан 2, И. Б. Назаров 1, А. А. Кузьмин 1, Н. Д. Аксёнов 1, Е. В. Потапенко 1, М. Н. Гордеев 1, А. Н. Томилин 1, 3, **
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Институт экспериментальной медицины
197376 Санкт-Петербург, Россия
3 Институт трансляционной биомедицины, Санкт-Петербургский Университет
199034 Санкт-Петербург, Россия
* E-mail: e.bakhmet@incras.ru
** E-mail: a.tomilin@incras.ru
Поступила в редакцию 19.02.2020
После доработки 27.02.2020
Принята к публикации 27.02.2020
Аннотация
KH-доменные PolyC-связывающие белки выполняют множество функций: от регуляции транскрипции до альтернативного сплайсинга. Существуют свидетельства важной роли этих белков в эмбриогенезе и в эмбриональных стволовых клетках (ЭСК). ЭСК являются культивируемыми аналогами клеток эпибласта до имплантации и находятся в состоянии так называемой наивной плюрипотентности. Ранее нами было показано, что представители этого семейства белков – hnRNP-K, Pcbp1 и Pcbp2 – способны связываться с PolyC-сайтами регуляторных элементов гена Pou5f1, кодирующего ключевой для плюрипотентности фактор Oct4. Кроме того, в литературе представлены данные о раннем летальном фенотипе Pcbp1–/– эмбрионов мыши. Для исследования роли Pcbp1 в ЭСК нами были получены ЭСК с нокаутом по гену Pcbp1. В отличие от показанного нами ранее летального фенотипа hnRNP-K-дефицитных ЭСК, Pcbp1–/– ЭСК оказались жизнеспособны, продолжали экспрессировать фактор Oct4 и, в целом, сохраняли плюрипотентные свойства. Полученные результаты говорят о том, что Pcbp1 не нужен ни для регуляции экспрессии Oct4, ни для поддержания состояния наивной плюрипотентности. В последующих исследованиях будет проанализирована роль Pcbp1 в процессах перехода клеток в состояние праймированной плюрипотентности, а также дальнейшего выхода из него путем дифференцировки в клетки трех зародышевых листков.
Эмбриональные стволовые клетки (ЭСК) впервые были успешно выделены в 1981 г двумя независимыми группами ученых (Evans, Kaufman, 1981; Martin, 1981). С тех пор ЭСК активно изучаются, накоплено множество новых фактов о фундаментальных принципах, которые лежат в основе их функционирования. Существует довольно много работ, посвященных их прикладному значению для регенеративной медицины. Этот уникальный по своим свойствам тип клеток характеризуется способностью к самообновлению и к дифференцировке во все типы соматических клеток. Огромный прорыв в теме ЭСК и в биологии в целом произошёл в 2006 г в связи открытием индуцированной плюрипотентности (Takahashi, Yamanaka, 2006). Эта работа наглядно продемонстрировала возможность с помощью определенных факторов вернуть дифференцированную клетку обратно в плюрипотентное состояние. Oct4 является ключевым транскрипционным фактором ЭСК. Как повышение, так и понижение его экспрессии ведет к дифференцировке (Niwa et al., 2000). Кодирующий Oct4 ген Pou5f1 имеет три регуляторных участка – промотор, проксимальный энхансер и дистальный энхансер. В нашей лаборатории было показано, что белки, способные связываться in vitro с PolyC-последовательностью сайта 2А дистального энхансера присутствуют в различных тканях мыши (Назаров и др., 2013), и они являются представителями семейства KH-доменных PolyC-связывающих белков – hn-RNP-K, Pcbp1 и Pcbp2. Эти белки принимают участие во множестве различных процессов, включая транскрипцию, процессинг мРНК, сплайсинг, регуляцию трансляции и т.д. (Wang et al., 1995; Michelotti et al., 1996; Ritchie et al., 2003; Lynch et al., 2005; Mikula et al., 2006; Choi et al., 2008; Hwang et al., 2017). Среди биологических функций показана их роль в эмбриогенезе, дифференцировке; также показаны их онкосупрессорные и онкогенные свойства, зависящие от типа опухоли (Chia et al., 2010; Ghanem et al., 2015; Thompson et al., 2015; Zhang et al., 2016). Ранее нами было показано, что белок hnRNP-K оккупирует дистальный и проксимальный энхансеры Pou5f1 in vivo. Нокаут hnRNP-K не приводил к значимым изменениям в экспрессии Oct4, однако оказался критичным для самообновления и жизнеспособности ЭСК (Bakhmet et al., 2019). Поставив в настоящем исследовании целью выяснить роль Pcbp1 в ЭСК, мы получили ЭСК, нокаутные по этому гену, оценили экспрессию Oct4 и сохранение этими клетками плюрипотентых свойств.
МАТЕРИАЛ И МЕТОДИКА
Культивирование клеток. Эмбриональные стволовые клетки (ЭСК) мыши линии E14 Tg2a (Bay Genomics) культивировали на адгезивном пластике, обработанном 0.1%-ным раствором желатина (Sigma) в стандартной mES-среде, состоящей из Knockout DMEM (ThermoFisher) с добавлением пенициллина/стрептомицина (ThermoFisher), 15% фетальной бычьей сыворотки (PAA), L-глутамина (ThermoFisher), дополнительных аминокислот (NEAA, ThermoFisher), 50 мкМ β-меркаптоэтанола (Sigma) и лейкемия-ингибирующего фактора (LIF, производится в лаборатории) в специализированных инкубаторах при 37°С и 5% СО2. Клетки пассировали с использованием раствора Трипсин/ЭДТА (ThermoFisher).
CRISPR/Cas9-опосредованный нокаут гена Pcbp1. Для выполнения этих работ была использована плазмида pX330-U6-Chimeric_BB-CBh-hSpCas9 (Addgene). Гид-РНК (guide RNA) для нокаута подбирали с использованием сервиса Zhang Lab MIT (http://crispr.mit.edu/; CRISPR-PCBP1-4_F 5'-CACCGCCGCCGCTCGCCATGGACGC-3'; CRISPR-PCBP1-4_R 5'-AAACGCGTCCATGGCGAGCGGCGGC-3'). В качестве контрольных гид-РНК были выбраны последовательности, не имеющие комплементарных участков в геноме мыши (CRISPR-Scr_F 5'-CACCGCACTACCAGAGCTAACTCA-3'; CRISPR-Scr_R 5'-AAACTGAGTTAGCTCTGGTAGTGC-3'). Отобранные олигонуклеотиды синтезировали в компании Евроген и лигировали в плазмиду по сайтам BbsI. Для генного нокаута, опосредованного системой CRISPR/Cas9, был выбран принцип сдвига рамки считывания гена по обоим аллелям (Ran et al., 2013). Для этого гид-РНК подбирали таким образом, чтобы PAM-сайт был в самом начале кодирующей части гена. Таким образом, после двунитевого разрыва, который образуется в результате работы нуклеазы Cas9, и последующей репарации этого места путем гомологичной рекомбинации, как правило, образуются короткие инсерции или делеции. Если число нуклеотидов инсерции или делеции в белок-кодирующей части гена не кратно трем, то возникает сдвиг рамки считывания гена. Такой сдвиг ведет к остановке трансляции РНК практически в самом начале и, как следствие, к отсутствию целевого белка в клетке.
Трансфекция и отбор клонов. Доставку плазмиды, несущей Cas9 с гид-РНК, осуществляли методом временной трансфекции с липофектамином (Lipofectamine Stem, Invitrogen). За день до трансфекции клетки высевали в концентрации 20 000/см2 и культивировали ночь в стандартной среде. На следующий день клетки промывали раствором PBS и переводили на среду OptiMEM (ThermoFisher) с добавлением пенициллина/стрептомицина и LIF. Через 2 ч добавляли трансфекционную смесь, содержащую OptiMEM, плазмиду и Lipofectamine Stem (Invitrogen) из расчёта 0.25 мкг плазмиды и 1 мкл Lipofectamine на 1 см2. Через 5 ч среду с трансфекционной смесью заменяли на стандартную среду. Успешность трансфекции оценивали на следующий день по наличию маркера EGFP. Сортировку клеток после предварительной очистки от клеточных агрегатов с помощью клеточного фильтра (SPL Life Science), проводили на приборе S3e Cell Sorter (Bio-Rad), используя фильтр EGFP. Далее клетки рассевали в низкой плотности для получения отдельных клонов. Отбор клонов проводили через 10–14 сут после сортировки и анализировали (1) секвенированием локуса Pcpb1 по Сэнгеру в компании Евроген (Москва) и (2) проверкой на наличие белка Pcbp1 с помощью иммунноблоттинга.
Анализ ДНК нокаутных клонов. Для проверки наличия инсерций или делеций в начале гена Pcbp1, из клонов ЭСК выделяли тотальную ДНК, затем секвенировали этот участок гена. Для выделения ДНК к осадку 100–200 тыс клеток добавляли 50 мкл буфера для выделения ДНК (Ear buffer) с протеиназой К (ThermoFisher) (45 мкл Ear Buffer – 100мМ Tris-HCl (pH 8.5), 5мМ ЭДТА, 200мМ NaCl, 0.2% SDS, 5 мкл протеиназы К). Полученную смесь инкубировали 2 ч при 55°С, затем протеиназу инактивировали нагреванием при 95°С в течение 5 мин. К полученному раствору добавляли 325 мкл TE/RNAse буфера: 10 мМ Tris-HCl (pH 8.0), 1мМ ЭДТА, 20 мкг/мл RNAse A (ThermoFisher). Полученные ДНК-пробы использовали для стандартного ПЦР с праймерами, фланкирующими старт белок-кодирующей части гена Pcbp1 (Pcbp1-4 check4_F ACTTGACCACGTAACGAGCC; Pcbp1-4 check_R CCCCTCCGAGATGTTGATCC). Для проверки различных аллелей секвенированием ПЦР-продукт предварительно клонировали с помощью Quick-TA набора (Евроген) в pAL2-T вектор. Далее полученные продукты секвенировали в компании Евроген с помощью M13-праймеров.
Иммунноблоттинг. В работе анализировали пробы, приготовленные посредством инкубации (из расчета 50 тыс клеток на 10 мкл 1× буфера) в течение 5 мин при 100°С в буфере Лэммли (2% SDS, 10% глицерина, 60 мМ Tris-HCl pH 6.8). Пробы затем разделяли в денатурирующих (SDS) условиях с помощью электрофореза в ПААГ. Перенос на нитроцеллюлозную мембрану (Ammersham) осуществляли методом полусухого блоттинга с параметрами 25V, 1 mA/1см2, 120 мин. Мембрану блокировали в растворе 3%-ного обезжиренного молока в PBST 30 мин. Далее мембрану инкубировали с первичными антителами к Oct4 (SantaCruz; sc5279; 1 : 500), Pcbp1 (Abcam; ab74793; 1 : 1000), GAPDH (Cell signaling; 2118s; 1 : 2000) в течение ночи при 4°С, промывали 2 раза по 5 мин раствором молока на PBST, инкубировали 2 ч при комнатной температуре с вторичными антителами, промывали 2 раза по 5 мин раствором молока на PBST, 1 раз PBST, 1 раз PBS. Сигнал регистрировали на приборе Chemidoc Touch (BIO-RAD) с использованием реагентов для люминесцентной детекции HRP-меток (ThermoFisher).
Иммуноцитохимическое окрашивание клеток. Клетки фиксировали на пластике раствором 4%-ного параформальдегида на PBS (Sigma) при комнатной температуре в течение 10 мин. Далее клетки промывали PBS и пермеабилизировали 15 мин 0.1%-ным раствором Triton X-100 (AppliChem). Блокировку проводили 3%-ным раствором бычьего сывороточного альбумина (Life Science) 1 ч при комнатной температуре. Клетки затем инкубировали с первичными антителами к Oct4 (Santa-Cruz; sc5279; 1 : 500), Sox2 (NCB, Казахстан; 1 : 2000), Nanog (Bethyl; a300-397) в течение ночи при 4°С, промывали 6 раз PBS c 0.1% Tween20 (PBST), добавляли вторичные флуоресцентные антитела (Alexa Fluor 488, Cy3, Alexa Fluor 647; Jackson Laboratories) и инкубировали ещё 2–3 ч при комнатной температуре. Клетки промывали 3 раза раствором PBST, добавляли PBS и визуализировали на флуоресцентном микроскопе EVOS FL AUTO (Thermo Fisher Scientific).
Тератомный тест. Клетки ресуспензировали в PBS и вводили подкожно бестимусным мышам линии BALB/c Nude в количестве 2 × 106 клеток в 100 мкл PBS (1×) на мышь. Через 21 сут после подкожной инъекции клеток мышей умерщвляли с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях. Выделенные тератомы фиксировали в жидкости Буэна и после проводки и заливки в парафин изготавливали серийные срезы толщиной 7 мкм, которые окрашивали гематоксилин-эозином и азаном по Гейденгайну.
РЕЗУЛЬТАТЫ
В отличие от предыдущих экспериментов, где ЭСК с нокаутом по гену hnRNP-K были нежизнеспособны и погибали (Bakhmet et al., 2019), в настоящей работе мы успешно получили пролиферирующие клоны с нокаутом по близкородственному члену KH-семейства – гену Pcbp1. Анализ ДНК нескольких отобранных клонов, полученных в ходе CRI-SPR/Cas9-опосредованного нокаута, показал наличие коротких (1–23 п. о.) инсерций и делеций в начале белок-кодирующей части гена Pcbp1 (рис. 1). У клона “KO1” в первом аллеле обнаружилась делеция в 9 п. о., во втором – инсерция из 13 нуклеотидов. Аллели клона “KO3” содержали делеции 9 и 11 нуклеотидов. В случае с клоном “KO22”, выявили делеции 1 нуклеотида в первом аллеле и несколько делеций по 23, 3 и 2 нуклеотидa. Как описано в разделе “Материал и методика”, такие нарушения в начале белок-кодирующей части гена ведут к сдвигу рамки считывания, и, как следствие, к возникновению стоп-кодонов в самом начале кодирующей части мРНК. Далее методом иммунноблоттинга мы подтвердили отсутствие белка Pcbp1 в отобранных клонах (рис. 2). Несмотря на то, что ранее нами было показано сродство Pcbp1 к PolyC‑сайту 2А дистального энхансера гена Pou5f1 (Oct4), отсутствие Pcbp1 не отразилось на экспрессии Oct4. Такой результат может говорить либо об отсутствии связи Pcbp1 с энхансером Pou5f1 in vivo, либо о наличии резервных механизмов, благодаря которым транскрипция Pou5f1 остается на прежнем уровне в отсутствии Pcbp1. В ходе культивирования полученных клонов при визуальных наблюдениях отмечалось наличие нехарактерных для контроля спонтанных дифференцировок (рис. 3). Так как наличие недифференцированного статуса ЭСК напрямую зависит от определенного уровня экспрессии Oct4 (Niwa et al., 2000), вероятно, отсутствие Pcbp1 может приводить к дестабилизации экспрессии этого ключевого для ЭСК фактора в некоторых клетках.
Рис. 1.
Данные секвенирования ДНК клонов, отобранных в ходе CRISPR/Cas9-опосредованного нокаута гена Pcbp1. Отмечены инсерции и делеции, выявленные в ходе секвенирования. WT – ДНК дикого типа.
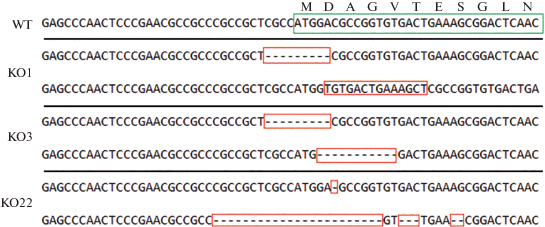
Рис. 2.
Анализ экспрессии белков Pcbp1, Oct4 и GAPDH из контрольных (Scr 1–3) и нокаутных по Pcbp1 клонов ЭСК (клоны KO1, 3, 22) с помощью иммуноблотинга.
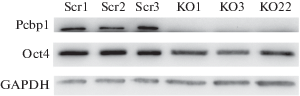
Рис. 3.
Микрофотографии контрольных (Scr1) и нокаутных (KO3) клеток. Фазовый контраст. Черными стрелками отмечены характерные колонии ЭСК. Белыми стрелками отмечены спонтанно дифференцировавшиеся клетки.
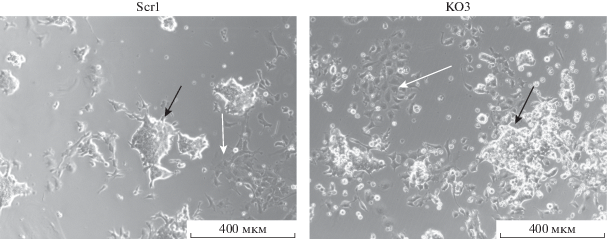
Далее полученные Pcbp1–/– клоны были охарактеризованы с помощью нескольких методов, включая иммуноцитохимическую окраску на основные факторы плюрипотентности, а также тератомный тест. Иммуноцитохимический анализ показал наличие в нокаутных клетках всех трех основных факторов плюрипотентности – Oct4, Sox2 и Nanog (рис. 4).
Рис. 4.
Иммуноцитохимическая окраска Pcbp1–/– ЭСК на основные маркеры плюрипотентных клеток – Oct4, Sox2 и Nanog. Представлены результаты одновременного выявления Oct4 и Nanog, выявление маркера Sox2 проводили отдельно, ввиду отсутствия возможности использования четвертого оптического канала.
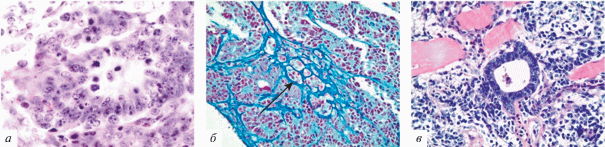
C целью проверки наличия плюрипотентных свойств у исследуемых клонов c помощью тератомного теста, Pcbp1–/– и контрольные ЭСК дикого типа инъецировали подкожно иммунодефицитным мышам линии Nude. Через 3 нед после инъекции образовавшиеся тератомы выделяли и анализировали с помощью стандартных гистологических методов с окраской препаратов гематоксилином и эозином, а также азаном по Гейденгайну. Данный анализ подтвердил наличие плюрипотентных свойств у клонов ЭСК, нокаутных по Pcbp1, – полученные тератомы содержали производные всех трёх зародышевых листков (энтодерму, мезодерму, эктодерму). Производные эктодермы были представлены нейроэпителиальными “розетками”; мезодермы – скоплениями в мезенхиме групп хондробластов и хондроцитов (ранние стадии хондрогенеза); энтодермы – дифференцирующимся энтеродермальным эпителием (рис. 5).
Рис. 5.
Гистологический анализ тератом, сформированных ЭСК с нокаутом по гену Pcbp1. (а) – Производные эктодермы (нейроэпителиальная розетка); (б) – производные мезодермы – скопления в мезенхиме хондробластов и хондроцитов (ранние стадии хондрогенеза, стрелка указывает на такое скопление); (в) – производные энтодермы – дифференцирующийся энтеродермальный эпителий. Окраска: (а) и (в) – гематоксилин-эозин, (б) – азан по Гейденгайну. Ув. об.: (а) – 100×, (б), (в) – 40×.
ОБСУЖДЕНИЕ
В настоящем исследовании нами было показано, что ЭСК с нокаутом по гену Pcpb1 жизнеспособны, что отличает их от ЭСК, нокаутных по гену hnRNP-K. Важно отметить, что Pcpb1–/– ЭСК сохраняют экспрессию Oct4, а также других факторов плюрипотентности, дифференцируются в составе тератом в клеточные типы всех трех зародышевых листков, иными словами, сохраняют все самые важные признаки плюрипотентных клеток. Этот факт оказался неожиданным в свете опубликованных данных о раннем летальном фенотипе эмбрионов мышей с нокаутом по гену Pcbp1 (Ghanem et al., 2015). В этом исследовании Ганема с соавторами было показано, что нокаутные эмбрионы присутствуют на 3.5 сут развития (стадия бластоцисты), но погибают к 8.5 сут. Известно, что плюрипотентные клетки в эмбриогенезе мыши существуют с 3.5 по 7.5 день, а культивируемые ЭСК по паттернам экспрессии генов соответствуют плюрипотентным клеткам бластоцисты на 4.5 сут развития мыши (Boroviak et al., 2014). Клетки эпибласта на данной стадии развития и ЭСК принято считать наивными плюрипотентными клетками, тогда как клетки эпибласта в период имплантации или после нее (5.5–6.5 сут развития) и соответствующие им культивируемые аналоги (эпибластные стволовые клетки) относят к праймированным плюрипотентным стволовым клеткам (Morgani et al., 2017). Возможно, критические нарушения в эмбриогенезе мышей с нокаутом по Pcbp1 происходят во время или после имплантации эмбриона. Также нарушения могут быть связаны с самой имплантацией в случае, если белок Pcbp1 каким-то образом участвует в этом процессе. Если же проблемы связаны именно с ЭСК, то, вероятно, Pcbp1 играет определенную роль в переходе плюрипотентных клеток из наивного в праймированное состояние (Morgani et al., 2017). Кроме того, тератомный тест не выявил каких-либо нарушений в потенциале дифференцировки Pcbp1–/– ЭСК в производные энто-, мезо- и эктодермы. Этот факт с учетом данных о раннем летальном фенотипе эмбрионов с нокаутом по Pcbp1, указывает на роль белка Pcbp1 не в запуске определенной дифференцировки, но на определенные нарушения в динамике эмбриогенеза. Наши дальнейшие исследования будут посвящены детальному изучению описанных предположений.
Список литературы
Назаров И.Б., Красноборова В.А., Миттенберг А.Г., Чихиржина Е.В., Давыдов-Синицын А.П., Лисковых М.А., Томилин А.Н. 2013. Исследование транскрипционной регуляции гена Oct4 (Pou5F1) через его дистальный энхансер. Т. 55. № 10. С. 697. (Nazarov I.B., Krasnoborova V.A., Mitenberg A.G., Chikhirzhina E.V., Davidov-Sinitzin A.P., Liskovykh M.A., Tomilin A.N. 2014. Transcription regulation of Oct4 (Pou5F1) gene by its distal enhancer. Cell Tiss. Biol. V. 8. P. 27.)
Bakhmet E.I., Nazarov I.B., Gazizova A.R., Vorobyeva N.E., Kuzmin A.A., Gordeev M.N., Sinenko S.A., Aksenov N.D., Artamonova T.O., Khodorkovskii M.A., Alenina N., Onichtchouk D., Wu G., Schöler H.R., Tomilin A.N. 2019. hnRNP-K targets open chromatin in mouse embryonic stem cells in concert with multiple regulators. Stem Cells. V. 37. P. 1018.
Boroviak T., Loo, R., Bertone P., Smith A., Nichols J. 2014. The ability of inner-cell-mass cells to self-renew as embryonic stem cells is acquired following epiblast specification. Nat. Cell Biol. V. 16. P. 516.
Chia N.Y., Chan Y.S., Feng B., Lu X., Orlov Y.L., Moreau D., Kumar P., Yang L., Jiang, J., Lau M.S., Huss M., Soh B.S., Kraus P., Li P., Lufkin T. et al. 2010. A genome-wide RNAi screen reveals determinants of human embryonic stem cell identity. Nature. V. 468. P. 316.
Choi H.S., Song K.Y., Hwang C.K., Kim C.S., Law P.Y., Wei L.N., Loh H.H. 2008. A proteomics approach for identification of single strand DNA-binding proteins involved in transcriptional regulation of mouse mu opioid receptor gene. Mol. Cell. Proteom. V. 7. P. 1517.
Evans M.J., Kaufman M.H. 1981. Establishment in culture of pluripotential cells from mouse embryos. Nature. V. 292. P. 154.
Ghanem L.R., Kromer A., Silverman I.M., Chatterji P., Traxler E., Penzo-Mendez A., Weiss M.J., Stanger B.Z., Liebhaber S.A. 2015. The Poly(C) binding protein Pcbp2 and its retrotransposed derivative Pcbp1 are independently essential to mouse development. Mol. Cell. Biol. V. 36. P. 304.
Hwang C.K., Wagley Y., Law P.Y., Wei L.N., Loh H.H. 2017. Phosphorylation of poly(rC) binding protein 1 (PCBP1) contributes to stabilization of mu opioid receptor (MOR) mRNA via interaction with AU-rich element RNA-binding protein 1 (AUF1) and poly A binding protein (PABP). Gene. V. 598. P. 113.
Lynch M., Chen L., Ravitz M.J., Mehtani S., Korenblat K., Pazin M.J., Schmidt E.V. 2005. hnRNP K binds a core polypyrimidine element in the eukaryotic translation initiation factor 4E (eIF4E) promoter, and its regulation of eIF4E contributes to neoplastic transformation. Mol. Cell. Biol. V. 25. P. 6436.
Martin G.R. 1981. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proc. Nat. Acad. Sci. USA. V. 78. P. 7634.
Michelotti E.F., Michelotti G.A., Aronsohn A.I., Levens D. 1996. Heterogeneous nuclear ribonucleoprotein K is a transcription factor. Mol. Cell. Biol. V. 16. P. 2350.
Mikula M., Dzwonek A., Karczmarski J., Rubel T., Dadlez M., Wyrwicz L.S., Bomsztyk K., Ostrowski J. 2006. Landscape of the hnRNP K protein-protein interactome. Proteomics. V. 6. P. 2395.
Morgani S., Nichols J., Hadjantonakis A.K. 2017. The many faces of pluripotency: In vitro adaptations of a continuum of in vivo states. BMC Dev. Biol. V. 17 : 7.
Niwa H., Miyazaki J.-I., Smith A.G. 2000. Quantitative expression of Oct-3/4 defines differentiation, dedifferentiation or self-renewal of ES cells. Nat. Genet. V. 24. P. 372.
Ran F.A., Hsu P.D., Wright J., Agarwala V., Scott D.A., Zhang F. 2013. Genome engineering using the CRISPR-Cas9 system. Nat. Protoc. V. 8. P. 2281.
Ritchie S.A., Pasha M.K., Batten D.J.P., Sharma R.K., Olson D.J.H., Ross A.R.S., Bonham K. 2003. Identification of the SRC pyrimidine-binding protein (SPy) as hnRNP K: implications in the regulation of SRC1A transcription. Nucl. Acid. Res. V. 31. P. 1502.
Takahashi K., Yamanaka S. 2006. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. V. 126. P. 663.
Thompson P.J., Dulberg V., Moon K.M., Foster L.J., Chen C., Karimi M.M., Lorincz M.C. 2015. hnRNP K coordinates transcriptional silencing by SETDB1 in embryonic stem cells. PLoS Genet. V. 11 : e1004933.
Wang X., Kiledjian M., Weiss I.M., Liebhaber S.A. 1995. Detection and characterization of a 3' untranslated region ribonucleoprotein complex associated with human alpha-globin mRNA stability. Mol. Cell. Biol. V. 15. P. 1769.
Zhang P., Wang N., Lin X., Jin L., Xu H., Li R., Huang H. 2016. Expression and localization of heterogeneous nuclear ribonucleoprotein K in mouse ovaries and preimplantation embryos. Biochem. Biophys. Res. Comm. V. 471. P. 260.
Дополнительные материалы отсутствуют.


