Цитология, 2020, T. 62, № 6, стр. 437-445
Изменение характеристик флуоресценции квантовых точек на основе InP/ZnS при взаимодействии с клетками
И. К. Литвинов 1, *, Т. Н. Беляева 1, Е. А. Леонтьева 1, А. О. Орлова 2, Е. С. Корнилова 1, 3
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Санкт-Петербургский национальный исследовательский университет информационных технологий, механики и оптики
197101 Санкт-Петербург, Россия
3 Санкт-Петербургский политехнический университет Петра Великого
195251 Санкт-Петербург, Россия
* E-mail: lik314@mail.ru
Поступила в редакцию 20.02.2020
После доработки 05.03.2020
Принята к публикации 10.03.2020
Аннотация
Полупроводниковые квантовые точки (КТ), благодаря своим уникальным спектрально-люминесцентным свойствам, привлекательны для визуализации биологических объектов в биологических и медицинских исследованиях. Основными способами регистрации люминесцентных КТ в клетках являются различные виды сканирующей микроскопии. Важно заметить, что в процессе использования КТ попадают в различное внеклеточное и внутриклеточное окружение, которое может повлиять на целостность поверхности КТ и, как следствие, на его фотофизические характеристики. В связи с этим нами были исследованы изменения характеристик сигналов люминесценции нетаргетных КТ на основе InP/ZnS, покрытых ПЭГ, имеющим СООН-группы, при применении которых возможно снижение рисков токсических эффектов в процессе биологических и медицинских исследований. В ходе работы было показано, что исследуемые КТ накапливаются в культивируемых клетках линии A549. Анализ фотофизических свойств КТ показал их различия внутри и вне клеток. Так, средняя интенсивность КТ в эндосомах была ниже, чем интенсивность кластеров вне клеток, что может объясняться более низкой концентрацией КТ во внутриклеточных кластерах. Однако и время жизни люминесценции КТ в кластерах, не зависящее от концентрации, также было ниже на 5–10 нс. Анализ раствора КТ показал, что снижение квантового выхода и времени жизни люминесценции КТ наблюдается в растворе со значением pH 4.0, но не наблюдается в диапазоне рН 7.4–8.0. В таких растворах не выявлено также и процесса существенного формирования агрегатов КТ. В связи с этим, изменения фотофизических свойств КТ при взаимодействиях с клетками можно связать с попаданием в эндосомы с пониженным значением pH. Таким образом, анализ времени жизни люминесценции КТ позволяет получить более полную информацию о состоянии КТ, нежели интенсивность люминесценции, как в случае использования флуоресцентной микроскопии. Наши результаты важны для адекватной интерпретации данных, касающихся как вопросов эффективности поглощения КТ, так и анализа свойств внутриклеточных компартментов, в которых накапливаются КТ.
Использование полупроводниковых квантовых точек (КТ) для визуализациии биологических объектов является относительно новой областью исследований. Уникальность КТ определяется такими их свойствами как широкий спектр поглощения, узкие спектры люминесценции, зависимые от размера полупроводникового ядра КТ, большой Стоксов сдвиг. Привлекательна также высокая фотостабильность КТ, дающая возможность проводить относительно длительные прижизненные наблюдения.
КТ могут быть получены из соединений элементов II–VI, III–V или IV–VI групп периодической системы химических элементов. Для биологических исследований чаще всего используются КТ типа ядро–оболочка. Ядра КТ обычно состоят из CdSe, CdTe, InP и т.п. Обычно в качестве оболочки используется ZnS. Размеры таких наночастиц, определяющие длину волны флуоресценции, находятся в пределах 2–9 нм. Поскольку синтез КТ в основном проводится в гидрофобной среде, для обеспечения биосовместимости КТ покрывают слоем амфифильного соединения, в качестве которого наиболее часто используется полиэтиленгликоль (ПЭГ). Он эффективно снижает неспецифическое связывание с клетками и инертен по отношению к иммунной системе. Кроме того, за счет использования различных функциональных групп модифицированного ПЭГ можно конъюгировать КТ c представляющими интерес биомолекулами, такими как антитела или лиганды к поверхностным рецепторам. Это превращает нетаргетные КТ в адресные и делает возможным визуализацию различных биологических процессов в определенных клетках, что важно для фундаментальных исследований (Wegner et al., 2015). Кроме того, поскольку функционализация КТ с помощью ПЭГ, несущего множественные активные группы, существенно увеличивает размер частицы (до 15–30 нм), и, соответственно, площадь ее поверхности, можно использовать такие КТ в качестве многофункциональных платформ для медицинской диагностики, т.е. КТ, имеющие молекулярный адрес, и КТ, нагруженные, в зависимости от задачи, лекарственным средством или, например, фотосенсибилизатором.
Наиболее часто используемыми являются КТ на основе CdSe/ZnS. Это объясняется тем, что, во-первых, метод химического коллоидного металлоорганического синтеза таких КТ хорошо отработан и дает стабильный результат, а, во-вторых, спектр их люминесценции покрывает практически весь видимый спектр. Однако кадмий за счет связывания карбоксильных, аминных и сульфгидрильных групп белковых молекул способен угнетать активность многих ферментных систем. Поэтому несмотря на то, что CdSe-КТ покрываются слоем ZnS, их опасаются использовать в медицинских целях.
Действительно, теоретически существует риск утечки ионов кадмия при длительном пребывании КТ в активной биологической среде в результате повреждения оболочки под действием высокого уровня активных форм кислорода (Kirchner et al., 2005; Smith et al., 2008). Тем не менее, следует учитывать, что размер функционализированных нетаргетных КТ-ПЭГ делает возможным их поступление в клетки только посредством разных видов эндоцитоза, в результате чего КТ оказывается изолированным от цитоплазмы в мембранных пузырьках – эндосомах. Основным фактором внешнего воздействия в данном случае является снижение уровня рН в эндосомах по мере прохождения последовательных этапов эндоцитозного пути – от 7.4–7.0 на ранних стадиях эндоцитоза до 4.0–4.5 в лизосомах, куда нетаргетные КТ попадают через несколько часов и где могут сохраняться в течение нескольких суток. Действительно, в ряде работ такие эффекты были продемонстрированы (Aldana et al., 2001, 2005; Derfus et al., 2004; Bentzen at al., 2005; Uyeda et al., 2005). Тем не менее, решение проблемы учета этих эффектов при поглощении КТ клетками находится пока на стадии разработки (Martynenko et al., 2016).
Очевидно, что любые риски должны быть минимизированы. Одним из путей решения этой проблемы является использование “безкадмиевых” КТ, например, на основе фосфида индия (InP) (Young et al., 2012), однако различные аспекты взаимодействия их с клетками до сих пор изучены недостаточно.
Следует учитывать, что КТ является нанокристаллом, состоящим из неорганического ядра и органической оболочки, т.е. ансамблем частиц, способным демонстрировать достаточно сложное поведение при нарушении целостности или при взаимодействии с окружающими молекулами (ионами). В полупроводниковых КТ поглощение света приводит к возбуждению электронов и переходу их из валентной зоны в зону проводимости, оставляя позади дырки – квазичастицы, являющиеся носителями положительного заряда. Носители зарядов в полупроводниковых КТ – электрон и дырка функционируют как единая квантово-механическая система: электронно-дырочная пара (e-h-пара). В литературе такую пару называют экситоном.
Во время перехода электрона обратно в свое основное состояние – валентную зону, происходит излучение в виде кванта света (экситон рекомбинирует). Возбужденная КТ может расходовать энергию фотовозбуждения в результате излучательной или безызлучательной дезактивации возбужденного состояния (Lakowicz et al., 2007). Соотношение скоростей излучательных и безызлучательных переходов определяют такие параметры, как квантовый выход и время жизни люминесценции. Чем больше доля излучательных рекомбинаций по отношению к безызлучательным, тем выше интенсивность флуоресценции, квантовый выход (φ) и время жизни (〈τ〉) люминесценции ансамбля (называемое также временем затухания).
Интенсивность флуоресценции (I), таким образом, положительно связана с этими параметрами, однако практически оценка интенсивности не дает исследователю информации о состоянии КТ в эндосомах по следующим причинам. Во-первых, в отличие от квантового выхода и времени жизни люминесценции КТ, интенсивность люминесценции зависит от концентрации источников флуоресценции в анализируемых объектах (т.е. от концентрации самих КТ). Во-вторых, регистрация люминесцентных сигналов клеток, поглотивших флюорофоры, методом флуоресцентной конфокальной микроскопии идет при длительном облучении всего поля, и различия фотофизических параметров отдельных элементов ансамблей КТ существенно нивелируются. Таким образом, при анализе люминесцентного сигнала, полученного с помощью конфокального микроскопа, различия интенсивности люминесценции КТ вне и в клетках не позволяют однозначно сделать вывод о причинах этих различий – связаны ли они с различной концентрацией КТ, или с квантовым выходом люминесценции КТ, или и с тем, и с другим одновременно. Поэтому необходимо корректно исследовать состояние КТ в клетках, анализируя кинетику затухания их люминесценции.
При экспериментальном определении значения усредненного 〈τ〉 на лазерном сканирующем микроскопе возбуждение проводят фемтосекундным лазерным импульсом с последующей регистрацией одиночных фотонов в выбранном канале длин волн в течение определенного времени. Далее при обработке данных с помощью приборного программного обеспечения можно определить 〈τ〉 интересующей нас области. Как отмечалось выше, повреждение поверхности КТ или их агрегация влияют на определяемую величину, что дает возможность получить информацию о состоянии КТ в исследуемых объектах.
В настоящей работе мы изучили возможность поглощения клетками линии А549 КТ на основе InP/ZnS, покрытых ПЭГ, имеющим СООН-группы (КТ-InP), сравнивали среднее время жизни люминесценции КТ (〈τ〉) скоплений КТ вне и внутри клеток и моделировали влияние разных величин рН раствора на фотофизические характеристики КТ.
МАТЕРИАЛ И МЕТОДИКА
Материалы. Использовали КТ на основе InP/ZnS с оболочкой из ПЭГ с СООН-группами (КТ-InP) с максимумом люминесценции при 640 нм (Mesolight, Китай).
Культивирование клеток. Клетки аденокарциномы легкого человека A549 из Российской коллекции клеточных культур Института цитологии РАН (Санкт-Петербург) культивировали во флаконах 25 см2 или 96-луночных планшетах (Nunc, США) в среде DMEM (Биолот, Россия), содержащей 20 мМ глютамина, 10% сыворотки крови плодов коровы, 0.1% гентамицина в атмосфере 5% CO2 при 37°С. Клетки для экспериментов сеяли на покровные стекла в чашках Петри (Nunc, США) и проводили эксперименты через 48 ч при достижении клетками 60–70%-ного монослоя. КТ в необходимой концентрации добавляли в среду культивирования клеток на 24 ч. Затем клетки фиксировали 4%-ным параформальдегидом в течение 15 мин.
Конфокальная микроскопия. Исследования проводили на лазерном сканирующем конфокальном микроскопе Olympus FV3000 (Япония). Использовали иммерсионный объектив 40/1.42×. Флуоресценцию КТ возбуждали лазером с длиной волны 405 нм и регистрировали в области 600–680 нм. Изображения снимали в спектральном канале, соответствующем области регистрации флуоресценции конкретных КТ, и с помощью метода дифференциально-интерференционного контраста в проходящем свете. Регистрировали одиночные срезы или серийные Z-серии с шагом 0.5 мкм (10–20 последовательных оптических срезов).
Спектрально-люминесцентные свойства КТ-InP. Использовали метод стационарной оптической спектроскопии. Расчет квантового выхода люминесценции КТ (φ) проводили на основе данных, полученных на спектрофотометре UV-3600 (Shimadzu, Япония) и спектрофлуориметре Cary Eclipse (Aligent, США).
Регистрация кинетики затухания люминесценции КТ-InP. Применяли лазерный сканирующий люминесцентный микроскоп MicroTime 100 (PicoQuant, Германия), работающий в режиме одиночного счета фотонов. В настоящей работе распады люминесценции наноструктур (времена жизни люминесценции КТ, τ) были зарегистрированы с использованием интерференционных оптических фильтров, характеризующихся полосами пропускания с шириной 10 нм на уровне 50% от максимума пропускания при 600, 640 и 680 нм.
Изменение значения τ для КТ-InP изучали в фосфатно-солевом буферном растворе (PBS) при значении pH 4.0, 7.4 или 8.0, а также на клетках линии A549. Нужное значение pH раствора PBS устанавливали добавлением HCl или NaOH.
Статистическая обработка данных. Все результаты были получены как минимум из трех независимых экспериментов. При исследовании на конфокальном микроскопе для каждого случая просматривали не менее 4-х полей зрения (около 15–20 клеток). Изображения для презентации обрабатывали в программе Adobe Photoshop 5.0. Полученные изображения анализировали с помощью программы ImageJ (National Institute of Health, США). Статистическую обработку данных проводили с использованием Microsoft Office Excel 2007 (Microsoft Corporation, США). Аппроксимацию кривых затухания люминесценции КТ проводили с помощью программы Origin Pro 8.5; диаграммы строили с помощью Microsoft Office Excel 2007.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Взаимодействие клеток A549 с КТ-InP. Основными способами регистрации люминесцирующих КТ в клетках являются различные виды сканирующей микроскопии. Мы использовали конфокальный микроскоп. На рис. 1а представлено типичное конфокальное изображение клеток A549, фиксированных после инкубации с КТ-InP в течение 24 ч, совмещенное с изображением в дифференциально-интерференционном контрасте, что позволяет видеть как контуры клеток, так и локализацию флуоресцентного сигнала во внутриклеточных везикулярных структурах (эндосомах) разного размера (примеры обозначены тонкими стрелками). Картина внутриклеточного распределения КТ-InP в принципе совпадает с той, что мы наблюдали ранее для нетагертных КТ на основе CdSe/ZnS с такой же органической оболочкой (Litvinov et al., 2018) и говорит о возможности использования КТ-InP в качестве биологической метки.
Рис. 1.
Визуализация квантовых точек на основе InP/ZnS, покрытых ПЭГ, имеющим СООН-группы (КТ-InP, 20 нМ) в клетках А549, фиксированных через 24 ч культивирования в присутствии КТ. (а) – Изображение клеток и КТ, полученное с помощью лазерного сканирующего микроскопа Olympus FV3000 (Япония); представлено наложение канала люминесценции КТ (красный) и дифференциально-контрастного изображения клеток (серый); тонкими стрелками показаны частные примеры кластеров КТ внутри клеток, толстыми стрелками – кластеры КТ вне клеток, головкой стрелки отмечено скопление КТ на поверхности клетки. (б, в) – Распределение средней интенсивности люминесценции пикселя в кластере (ИП, б) и средней интенсивности кластеров (ИК, б) на изображении (а). Средние интенсивности рассчитывали для 76 кластеров внутри клеток и 12 кластеров вне клеток.
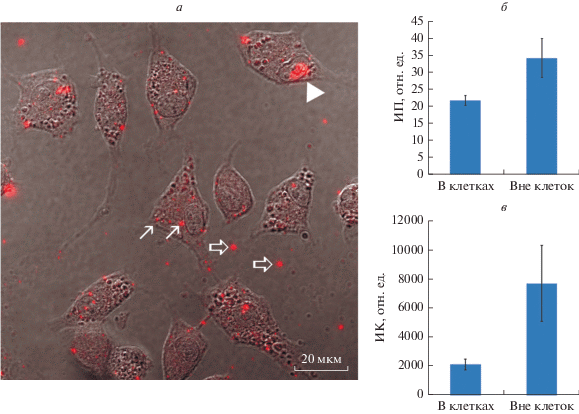
Анализ Z-серий изображений этих клеток (рис. 1а) позволил также выделить скопления КТ, локализованные на поверхности клеток (пример обозначен головкой стрелки). Таким образом, небольшая часть исследуемых КТ неспецифически связывается с поверхностью клеток за время длительной инкубации (подобные скопления в настоящей работе не анализировали). В то же время, часть КТ остается на подложке, и, судя по размерам, они представлены не единичными КТ (толстые стрелки). Для упрощения дальнейшего изложения мы будем называть такие скопления люминесцирующих объектов как внутри клеток (т.е. в эндолизосомах), так и вне клеток на подложке, кластерами. Визуально кластеры и вне, и внутри клеток существенно различаются по размеру, но разница в интенсивности люминесценции КТ не столь очевидна. Однако оценка на представленном имидже (рис. 1б) величины средней интенсивности одного пикселя кластера вне клеток (12 выделенных объектов) и внутри них (76 выделенных объектов) показывает, что эта величина примерно на треть ниже у внутриклеточных кластеров чем у внеклеточных, тогда как средняя интенсивность самих кластеров меньше примерно в 4 раза.
Интерпретация этих данных крайне затруднительна. На результат, очевидно, может повлиять неодинаковое число проанализированных кластеров вне и внутри клетки, а также более существенный вклад мелких объектов в среднюю интенсивность внутриклеточных кластеров. Однако более вероятно, причина заключается в том, что происходит гашение КТ в процессе попадания в эндосомы. С другой стороны, не исключено, что часть КТ внутри клеток или не подвергается процессу концентрирования в лизосомах, или уже покинула клетку в результате процесса экзоцитоза эндолизосом. Более определенных выводов на основе такого анализа сделать невозможно.
Если проанализировать кинетику затухания люминесцирующих объектов на микроскопе PicoQuant, предназначенном для регистрации времени жизни люминесценции методом FLIM (fluorescence lifetime imaging), то можно получить данные, которые не зависят от концентрации КТ в кластерах, и которые говорят о том, различаются ли свойства КТ внутри и вне клеток.
Как упоминалось выше, возбужденная импульсом лазера КТ может расходовать энергию фотовозбуждения как в результате излучательной, так и безызлучательной дезактивации возбужденного состояния (Lakowicz et al., 2007). Если обозначить константу скорости излучательного перехода kr, а суммарную константу всех остальных процессов, приводящих к безыизлучательной дезактивации возбужденного состояния – knr, то квантовый выход люминесценции (φ) можно рассчитать по формуле:
а время жизни люминесценции τ по формуле:Очевидно, что появление новых каналов безызлучательной дезактивации возбужденного состояния КТ, константа скорости которых сравнима или превышает kr, будет приводить к сокращению величин φ и τ, вследствие механизмов тушения люминесценции по следующим причинам: безызлучательный перенос энергии фотовозбуждения (FRET) от КТ к внешним молекулам или соседними КТ; перенос носителей заряда (электрон КТ в возбужденном состоянии может перейти к молекуле-акцептору электронов, либо молекула-донор электронов может отдать электрон КТ). Такая ситуация тушения люминесценции КТ может складываться при повреждении поверхности КТ, при включении в ансамбль дополнительных молекул, и при формировании агрегатов.
Величина τ определяется из кинетики мультиэкспоненционного затухания (Schlegel et al., 2002). В рамках теоретических моделей отклонение от моноэкспоненциального затухания люминесценции КТ связывается с разупорядоченностью кристаллической решетки ядра КТ и увеличением числа поверхностных дефектных состояний, приводящих к мультиэкспоненциальной зависимости затухания люминесценции, описываемой функцией Колрауша−Уильямса−Ватта:
(3)
$I\left( t \right) = \sum\limits_n {\left( {{{A}_{n}}{{e}^{{\frac{t}{{{{\tau }_{n}}}}}}}} \right),} $(4)
$\left\langle \tau \right\rangle = \frac{{\sum\limits_n {{{A}_{n}}\tau _{n}^{2}} }}{{\sum\limits_n {{{A}_{n}}{{\tau }_{n}}} }}.$В ходе анализа с помощью микроскопа PicoQuant происходит сканирование области интереса обычно с разрешением 512 × 512 пикселей. По сканируемому участку программным обеспечением прибора выстраивается кривая затухания люминесценции, по аппроксимации которой определяется распределение значений времени затухания люминесценции по всему образцу с формированием гистограммы τ. Согласно этой гистограмме, каждому пикселю участка сканирования соответствует свое значение τ, определяемое по цветной шкале значений на гистограмме τ. Таким образом, в соответствии с данными гистограммы τ выстраивается цветное FLIM-изображении участка сканирования.
На рис. 2 в виде FLIM-визуализации представлены данные сканирования участка стекла с клетками А549, зафиксированными через 24 ч после инкубации с КТ-InP в концентрации 20 нМ.
Рис. 2.
FLIM (fluorescence lifetime imaging)-визуализация КТ-InP (20 нМ) в клетках А549, фиксированных через 24 ч культивирования в присутствии КТ, полученная с помощью лазерного сканирующего микроскопа (MicroTime, 100; PicoQuant, Германия). Клетки выделены контуром. Справа вверху – цветовая шкала времен жизни люминесценции на изображении. (а, б) – Увеличенные в 3 раза участки с КТ, выделенные на основном изображении. Стрелкой обозначен пример крупного кластера внутри клетки с очень коротким временем жизни.
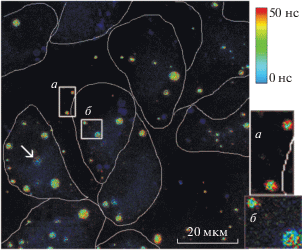
Данные сканирования, представленные на рис. 2, позволили, отдельно выделяя с FLIM-визуализации интересующие нас кластеры КТ (внутри и вне клеток), вычислить их 〈τ〉. Для выбранных кластеров КТ выводили отдельные кривые затухания люминесценции (рис. 3а, б), при аппроксимации которых были вычислены значения 〈τ〉. Из данных табл. 1 следует, что для КТ значения 〈τ〉 между этими типами кластеров различаются примерно на 5–10 нс. Таким образом, можно сделать вывод, что при попадании КТ в клетки, происходит изменение их фотофизических характеристик.
Рис. 3.
Кривые затухания люминесценции КТ-InP (20 нМ) в клетках A549, фиксированных через 24 ч культивирования в присутствии КТ, полученные на основе анализа изображения на рис. 2. Для кластеров КТ внутри и вне клеток получали отдельные кривые затухания люминесценции. (а, б) – Усредненные кривые затухания интенсивности люминесценции (ИЛ) кластеров КТ внутри (а) и вне (б) клеток. ИЛ нормирована на максимальное значение сигнала люминесценции.
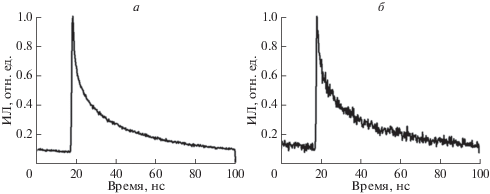
Таблица 1.
Аппроксимация кривых затухания люминесценции в соответствии с трехэкспоненциальной моделью
| Кластеры | A1, отн. ед. | A2, отн. ед. | A3, отн. ед. | τ1, нс | τ2, нс | τ3, нс | ❬τ❭, нс |
|---|---|---|---|---|---|---|---|
| Внутри клеток | 0.59 ± 0.03 | 0.33 ± 0.01 | 0.08 ± 0.03 | 35.0 ± 1.6 | 6.0 ± 0.4 | 0.6 ± 0.4 | 32.0 ± 1.2 |
| Вне клеток | 0.42 ± 0.08 | 0.31 ± 0.04 | 0.27 ± 0.09 | 46.0 ± 3.3 | 8.3 ± 1.5 | 0.2 ± 0.1 | 42.0 ±7.6 |
Примечание. Аппроксимацию проводили по формуле (3). Даны значения компонент амплитуды (А) и соответствующие им времена жизни люминесценции (τ).
Визуальный анализ 〈τ〉 кластеров (рис. 2) позволяет сделать еще несколько интересных наблюдений. Так, общий характер окраски кластеров говорит о том, что, во-первых, разброс по временам жизни как в группе внеклеточных, так и в группе внутриклеточных кластеров гораздо больше, чем разброс интенсивностей, и, во-вторых, в пределах одного кластера могут находиться участки с разным временем жизни. Интересно, что для внеклеточных кластеров характерно наличие долгоживущих (красных) участков в основном по внешнему краю кластера и более коротких времен жизни люминесценции в центре кластера (см. рис. 2а). Для внутриклеточных кластеров распределение сложнее: так, мелкие периферические кластеры имеют больше участков с долгоживущим сигналом, аналогичным внеклеточному, тогда как более крупные в основном демонстрируют более короткие времена затухания люминесценции, оставаясь при этом неоднородными (рис. 2б).
Кроме того, внутри клеток имеются довольно крупные кластеры с очень короткими временами жизни (рис. 2, показаны стрелкой). Резонно предположить, что внеклеточные кластеры представляют собой более агрегированные в центре и менее агрегированные на периферии кластеры, возможно, сформировавшиеся в процессе хранения стокового раствора КТ или налипания на подложку. Кластеры КТ, локализованные в клетках, могли возникнуть путем интернализации КТ в ранние эндосомы и далее подвергаться гашению по мере прохождения по эндоцитозному пути, основной характеристикой которого является снижение внутриэндосомного рН от значения 7.4 до 4.0–4.5 в лизосомах. Также не исключена возможность их агрегации при изменении pH. Для проверки этих предположений на модельных системах in vitro мы определяли φ и 〈τ〉 КТ, позволяющие оценить влияние закисления на свойства КТ и степень их агрегированности.
Для исследования влияние величины pH раствора на фотофизические характеристики КТ использовали раствор КТ-InP в PBS в концентрации 80 нМ с различными значениями pH. Анализ значений φ проводили с помощью спектрофотометра и спектрофлуориметра. Квантовый выход люминесценции наноструктур определяли с помощью метода сравнения, в котором использовали образец (в качестве эталона) с известным значением квантового выхода люминесценции (родамин 6G, φ = 95%). На рис. 4 представлены значения φ для КТ в зависимости от величины pH раствора PBS и в зависимости от времени инкубации в нем.
Рис. 4.
Квантовый выход люминесценции КТ-InP в растворах PBS. Измерения проводили при значениях pH 4.0, 7.4 и 8.0 сразу после введения КТ в раствор (0 ч) и через 2, 3 и 24 ч инкубации в растворе.
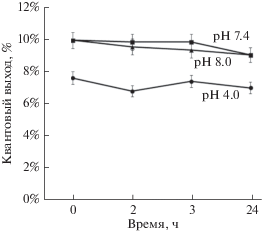
Результаты измерения на рис. 4 показывают, что воздействие среды щелочной (рН 8.0) и нормальной (рН 7.4) незначительно: значения φ остаются в пределах 9–10% в течение всего времени эксперимента, тогда как в кислом растворе PBS (pH 4.0) сразу же происходит резкое снижение квантового выхода люминесценции КТ от 10 до 7%, однако дальнейшая инкубация в кислой среде практически не влияет на эту величину, остающуюся в границах погрешности.
Влияние рН может объясняться как гашением флуоресценции, так и стимулированием агрегации, при которой 〈τ〉 тоже уменьшается. Для оценки степени агрегации был использован следующий подход. Считается, что этот процесс сопровождается сдвигом спектра люминесценции со смещением максимума вправо в область более длинных волн. Это происходит потому, что реальное распределение КТ по размерам имеет некоторый разброс и при их агрегации в ансамбль включаются КТ разного размера, тем самым увеличивая вероятность FRET от КТ меньшего размера к КТ большего размера, так как в агрегатах резко повышается вероятность безызлучательной рекомбинации экситона. При этом люминесценция малых КТ-доноров в агрегатах гасится, а крупные КТ-акцепторы остаются непотушенными.
Мы определили времена жизни люминесценции КТ в трех точках, соответствующих положению максимума люминесценции (640 нм), слева и справа от него на половине высоты полосы люминесценции (600 и 680 нм). Для получения данных использовали импульсный лазерный сканирующий микроскоп с интерференционными фильтрами, прозрачными на этих длинах волн. В результате анализа кинетики затухания люминесценции КТ на этих длинах волн, были получены соответствующие времена жизни люминесценции КТ. Данные представлены на рис. 5.
Рис. 5.
Средние времена жизни люминесценции КТ-InP (〈τ〉) в растворах PBS. Измерения проводили при значениях pH 8.0, 7.4 и 4.0 сразу после введения КТ в раствор (0 ч) и через 2, 3 и 24 ч инкубации в растворе. Использованы интерференционные оптические фильтры, характеризующиеся полосами пропускания с шириной 10 нм на уровне 50% от максимума пропускания при длине волны 600, 640 и 680 нм.
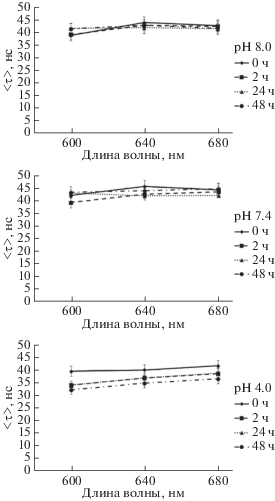
Из кинетики затухания люминесценции КТ на длине волны, соответствующей ее максимуму люминесценции (640 нм), следует, что при инкубации КТ в течение 0–48 ч в нормальном (pH 7.0) и щелочном (рН 8.0) растворе PBS время жизни снижалось от 45 до 42 нс, а в кислом растворе PBS (pH 4.0) – от 40 до 35 нс. Однако эти различия были в пределах погрешности измерений. Измерение этого же параметра КТ (τ) при 600 и 680 нм не показало существенных изменений во времени по сравнению с нулевой точкой. Однако при рН 4.0 наблюдался незначительный рост τ от меньшей длины волны к большей через 2 ч инкубации, но в дальнейшем он уже не увеличивался. Это может свидетельствовать о том, что доля агрегатов не изменяется при инкубации КТ при высоких значениях рН, однако при pH 4.0, характерном для лизосом, наблюдается небольшая тенденция к увеличению доли агрегатов КТ, что следует из наибольшего значения τ в случае измерения на длине волны 680 нм.
Поскольку изменения фотофизических характеристик КТ напрямую зависят от целостности структуры КТ и влияния молекул внешнего окружения, можно предположить, что для КТ-InP воздействие ионов H+ приводит к возникновению дефектных состояний на поверхности оболочки КТ и формированию ловушечных состояний, приводящих к нарушению процессов рекомбинации носителей зарядов, и, как следствие, происходит снижение как квантового выхода люминесценции, так и времени жизни люминесценции КТ.
В настоящей работе показано, что КТ-InP обнаруживаются в клетках внутри компартментов в виде кластеров, доступных для анализа накопления и определения фотофизических характеристик, в частности оценки времен затухания люминесценции КТ. Анализ времени затухания люминесценции на фиксированном препарате клеток и подходы in vitro позволили показать, что в эндосомах клеток происходит гашение люминесценции КТ, поэтому оценка их внутриклеточного накопления по интенсивности флуоресценции занижена. Существенно подчеркнуть, что мы анализировали времена жизни на фиксированных клетках, поскольку сканирование области, содержащей достаточное для статистического анализа число клеток, занимает слишком много времени (десятки минут). За это время состояние и распределение КТ может существенно изменяться в ходе эндоцитозных процессов и, кроме того, прижизненные препараты существуют в нефизиологических условиях.
Ранее мы показали, что фиксация существенно нивелирует разброс значений времен жизни между отдельными эндосомами (Литвинов и др., 2018), так что отработка методики прижизненной регистрации распада люминесценции в живых клетках, позволяющая оценить 〈τ〉, может дать более существенную разницу и, соответственно, более значительную поправку. При этом роль закисления эндосом в гашении люминесценции КТ в эндолизосомах кажется более существенной, чем их агрегация.
В последнее время методы обработки и анализа флуоресцентных изображений клеток получают все более широкое распространение, в частности, для оценки количественных параметров динамики таких процессов, как эндоцитоз (Collinet et al., 2010; Tonti et al., 2015). Поэтому понимание возможных искажений данных, основанных только на интенсивности меченого флуорофором белка без учета природы флуорофора и его реакции на микроокружение, становится чрезвычайно актуальной задачей.
Подводя итог этой работе, мы можем утверждать, что нетаргетные КТ на основе InP ведут себя аналогично таким же КТ на основе кадмия, демонстрируя накопление в клетках и чувствительность к кислому рН. Несмотря на то, что фотофизические характеристики КТ-InP могут варьировать в зависимости от состава ядра и производителя, основные тенденции в изменении поведения сохраняются. Следует подчеркнуть важность продемонстрированных эффектов по изменениям свойств КТ для адекватной интерпретации данных, касающихся, как вопросов эффективности поглощения КТ, так и внутриклеточной локализации КТ. Показано, что КТ-InP можно применять в небольших концентрациях для мечения клеток в целом или интересующих внутриклеточных мишеней, что снижает риски возможных токсических эффектов.
Список литературы
Литвинов И.К., Беляева Т.Н., Салова А.В., Аксенов Н.Д., Леонтьева Е.А., Орлова А.О., Корнилова Е.С. 2017. Квантовые точки на основе фосфида индия (InP): влияние химических модификаций органической оболочки на взаимодействие с культивируемыми клетками различного происхождения. Цитология. Т. 59. № 10. С. 685. (Litvinov I.K., Belyaeva T.N., Salova A.V., Aksenov N.D., Leontieva E.A., Orlova A.O., Kornilova E.S. 2018. Quantum dots based on indium phosphide (InP): the effect of chemical modification of the organic shell on interaction with cultured cells of various origins. Cell Tiss. Biol. (Tsitologiya). V. 12. P. 135.)
Aldana J., Lavelle N., Wang Y.J., Peng X.G. 2005. Size-dependent dissociation pH of thiolate ligands from cadmium chalcogenide nanocrystals. J. Am. Chem. Soc. V. 127. P. 2496.
Aldana J., Wang Y.A., Peng X. 2001. Photochemical instability of CdSe nanocrystals coated by hydrophilic thiols. J. Am. Chem. Soc. V. 123. P. 8844.
Bentzen E.L., Tomlinson I.D., Mason J., Gresch P., Warnement M.R., Wright D., Sanders-Bush E., Blakely R., Rosenthal S.J. 2005. Surface modification to reduce nonspecific binding of quantum dots in live cell assays. Bioconjug. Chem. V. 16. P. 1488.
Collinet C., Stoter M., Bradshaw C.R., Samusik N., Rink J.C., Kenski D., Habermann B., Buchholz F., Henschel R., Mueller M.S., Nagel W.E., Fava E., Kalaidzidis Y., Zerial M. 2010. Systems survey of endocytosis by multiparametric image analysis. Nature. V. 464. P. 243.
Derfus A.M., Chan W.C.W., Bhatia S.N. 2004. Probing the cytotoxicity of semiconductor quantum dots. Nano Lett. V. 4. P. 11.
Kirchner C., Liedl T., Kudera S., Pellegrino T., Muñoz Javier A., Gaub H.E., Stölzle S., Fertig N., Parak W.J. 2005. Cytotoxicity of colloidal CdSe and CdSe/ZnS nanoparticles. Nano Lett. V. 5. P. 331.
Lakowicz J.R. 2007. Principles of fluorescence spectroscopy. N.Y.: Springer Science & Business Media.
Litvinov I.K., Belyaeva T.N., Bazhenova A.S., Leontieva E.A., Orlova A.O., Kornilova E.S. 2018. QDs-cysteine luminescence kinetics: comparative analysis on live and fixed cells. In: Int. Conf. Laser Optics (ICLO). IEEE Proceedings. P. 574.
Martynenko I.V., Kuznetsova V.A., Litvinov I.K., Orlova A.O., Maslov V.G., Fedorov A.V., Dubavik A., Purcell-Milton F., Gun’ko Y.K., Baranov A.V. 2016. Enantioselective cellular uptake of chiral semiconductor nanocrystals. Nanotechnol. V. 27. № 7. P. 075102.
Schlegel G., Bohnenberger J., Potapova I., Mews A. 2002. Fluorescence decay time of single semiconductor nanocrystals. Phys. Rev. Letters. V. 88. https://doi.org/10.1103/PhysRevLett.88.137401
Smith A.M., Duan H., Mohs A.M., Nie S. 2008. Bioconjugated quantum dots for in vivo molecular and cellular imaging. Adv. Drug Deliver. Rev. V. 60. P. 1226.
Tonti S., Di Cataldo S., Bottino A., Ficarra E. 2015. An automated approach to the segmentation of hep-2 cells for the indirect immunofluorescence ANA test. Comput. Med. Imaging Graph. V. 40. P. 62.
Uyeda H.T., Medintz I.L., Jaiswal J.K., Simon S.M., Mattoussi H. 2005. Synthesis of compact multidentate ligands to prepare stable hydrophilic quantum dot fluorophores. Am. Chem. Soc. V. 127. P. 3870.
Wegner K.D., Hildebrandt N. 2015. Quantum dots: bright and versatile in vitro and in vivo fluorescence imaging biosensors. Chem. Soc. Rev. V. 44. № 14. P. 4792.
Young K. T., Wang Y., Roy I., Rui H., Swihart M.T., Law W.C., Kwak S.K., Ye L., Liu J., Mahajan S.D., Reynolds J.L. 2012. Preparation of quantum dot/drug nanoparticles formulations for traceable targeted delivery and therapy. Theranostics. V. 2. P. 681.
Дополнительные материалы отсутствуют.


