Цитология, 2020, T. 62, № 9, стр. 638-653
Ответ клеток ретинального пигментного эпителия человека на воздействие кондиционированных сред регенератов сетчаток тритона
Е. В. Шафеи 1, *, Л. А. Ржанова 1, Ю. П. Новикова 1, А. М. Куринов 1, Э. Н. Григорян 1, М. А. Александрова 1, А. В. Кузнецова 1, **
1 Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, Россия
* E-mail: elenashafei@gmail.com
** E-mail: avkuzn@list.ru
Поступила в редакцию 13.05.2020
После доработки 30.05.2020
Принята к публикации 31.05.2020
Аннотация
Основываясь на консервативности развития сетчатки в ряду позвоночных и сигнальных путей, участвующих в этом процессе, была выдвинута гипотеза, что активные факторы, стимулирующие регенерацию сетчатки тритонов, способны вызывать трансдифференцировку клеток РПЭ человека. Для этого изучали действие кондиционированных сред (КС), полученных от регенерирующих in vitro сетчаток тритонов, на фенотип, экспрессию ряда генов и локализацию белков клеток ретинального пигментного эпителия человека (РПЭ) линии ARPE-19. В течение 120 ч культивирования наблюдали изменение морфологии клеток РПЭ человека, проявляющееся в изменении формы и увеличении размера клеток, которые сопровождались снижением пролиферативной активности. Через 24 ч после воздействия КС в клетках ARPE-19 наблюдали краткосрочное повышение экспрессии гена TUBB3 (паннейронального маркера) и снижение экспрессии генов белков-ингибиторов нейральной дифференцировки BMP2 и ВМР4. Иммуноцитохимическим (ИЦХ) методом на сроке 24–72 ч выявлено увеличение интенсивности окрашивания клеток антителами против белка βIII-тубулина при снижении окрашивания на белок щелевых контактов Сх43 по сравнению с контролем. Одновременно снижались уровни экспрессии мРНК генов РПЭ-маркеров OTX2 и KRT18, а также гена KLF4, отвечающего за пролиферацию и дифференцировку. В то же время с помощью ИЦХ отмечено перераспределение локализации β-катенина из цитоплазматической мембраны в цитозоль. Для исключения мезенхимной, в частности остеогенной дифференцировки под влиянием КС, исследовали экспрессию генов SPP1, RUNX2 (с помощью кПЦР) и показали отсутствие транскрипции SPP1 в клетках ARPE-19 в контроле и под воздействием КС, а также снижение уровня экспрессии мРНК RUNX2 под воздействием КС. Таким образом, через 24–72 ч после воздействия КС регенератов сетчаток тритона в клетках ARPE-19 наблюдается попытка выхода в нейрональную дифференцировку, о чем говорит увеличение транскрипции и трансляции βIII-тубулина, ослабление межклеточной адгезии и снижение экспрессии генов ингибиторов нейральной дифференцировки BMP2 и ВМР4, а также генов РПЭ-маркеров OTX2 и KRT18. Однако затем, ввиду краткосрочного воздействия КС, во временном промежутке 72–120 ч наблюдается возврат клеток к исходной дифференцировке, о чем свидетельствует снижение экспрессии генов маркеров нейрональной дифференцировки (NES, TUBB3, PAX6) и увеличение экспрессии генов маркеров РПЭ (OTX2, MITF).
Клетки ретинального пигментного эпителия (РПЭ) обладают способностью к репрограммированию, которая в ряду позвоночных проявляется в разной степени (Григорян, 2015, 2019). Хвостатые амфибии (Urodelа) отличаются полной и совершенной формой регенерации – эпиморфной регенерацией ряда структур. Индуцированная удалением исходной сетчатки или перерезкой зрительного нерва регенерация сетчатки включает следующие этапы: дедифференцировку клеток РПЭ вплоть до приобретения ими черт “стволовости”, образование популяции нейробластов за счет деления малодифференцированных клеток, их дифференцировку в нейроны, фоторецепторы и глиальные клетки и редифференцировку в пигментный эпителий. Этот процесс является примером естественного репрограммирования РПЭ in vivo (Chiba et al., 2006; Chiba, Mitashov, 2007; Григорян 2019).
В противоположность этому, у взрослых млекопитающих и человека при патологии клетки РПЭ in vivo генерируют фибробластоподобные клетки, провоцирующие отслойку сетчатки и ее дегенерацию (Sparrow et al., 2010). В то же время исследования, проведенные in vitro на РПЭ взрослого человека, показали способность клеток к экспрессии генов маркерных белков стволовых и нейральных клеток (Милюшина и др., 2012; Кузнецова и др., 2018; Chen et al., 2020). Выявленные молекулярные изменения в клетках человека in vitro в общих чертах сходны с таковыми у амфибий in vivo (Милюшина и др., 2012; Григорян, 2015), что указывает на консервативность механизмов репрограммирования РПЭ. Однако репрограммирование клеток РПЭ взрослого человека in vitro в нейральном направлении поддерживается кратковременно. Этот факт ставит вопрос о поиске факторов стимуляции и поддержания этого пути развития и свидетельствует о необходимости исследований молекулярных механизмов, лежащих в основе де- и трансдифференцировки этих специализированных клеток – потенциального источника восстановления сетчатки после повреждения (Григорян, 2019).
Развитию методов прямого репрограммирования соматических клеток, в том числе РПЭ, в нейроны сетчатки с помощью низкомолекулярных соединений способствовало изменение парадигмы в регенеративной медицине относительно роли клеток-предшественников в восстановлении тканей при трансплантации, а именно понимание значимости в этом процессе паракринного эффекта стволовых клеток (Bollini et al., 2013; Xia et al., 2019). В настоящее время внимание сосредоточено не столько на анализе генома этих клеток, сколько на составе их секретома (Oudina et al., 2018; Moon et al., 2019). Последний, как правило, представлен факторами роста, микроРНК, цитокинами и хемокинами, обнаруживающимися в составе кондиционированных сред (КС) и клеточных экстрактов от нейральных и эмбриональных стволовых клеток (ЭСК).
Такие КС способны паракринно активировать репрограммирование соматических клеток (Bollini et al., 2013: Mukherjee, Mani, 2013). Уделяется внимание и экстрактам регенерирующих тканей низших позвоночных. Показано, что экстракты из регенератов передних конечностей тритонов вызывают дедифференцировку, повторный вход в клеточный цикл и фрагментацию миотуб мышиной линии C2C12 (Kawesa et al., 2015), тогда как КС таких регенератов оказывает цитопротекторное действие на кардиомиоциты крыс при окислительном стрессе (Middleton et al., 2018).
Процесс дедифференцировки является одним из основных для осуществления регенерации у низших позвоночных. Благодаря ему дифференцированные клетки входят в клеточный цикл и возвращаются к малодифференцированному фенотипу. Дедифференцированные клетки способны пролиферировать и дифференцироваться вновь в различные клеточные типы регенерирующей структуры (Chiba, Mitashov, 2007). Этот процесс сопровождает регенерацию сетчатки у тритона из РПЭ в случае ее удаления.
Кроме того, известно, что сетчатка глаза тритона является индуктором регенерации хрусталика (Gulati, Reyer, 1980; Eguchi, 1988) и продуцентом факторов, в частности семейства FGF, способных индуцировать и стимулировать регенерацию хрусталика из пигментированных клеток радужки глаза этих животных (Del Rio-Tsonis et al., 1997). Наряду с другими тканями задней стенки глаза сетчатка тритонов является источником bFGF – ключевого фактора в репрограммировании пигментированных клеток (Walsh et al., 2001; Yafai et al., 2013). В доступной нам литературе мы не встретили сообщений по влиянию секретомов (кондиционированных сред, экстрактов) сетчатки низших позвоночных на клетки РПЭ взрослого человека.
Настоящая работа посвящена изучению морфологических и молекулярных изменений в клетках РПЭ человека in vitro под влиянием сред, кондиционированных регенерирующими в условиях органотипического культивирования сетчатками взрослых тритонов.
МАТЕРИАЛ И МЕТОДИКА
Культивирование клеток. В работе использовали линию клеток пигментного эпителия сетчатки взрослого человека ARPE-19, депонированную в УНУ “Коллекция клеточных культур для биотехнологических и биомедицинских исследований (общебиологического и биомедицинского направления)" (ККК УНУ Института биологии развития РАН, Москва). Для стабилизации культуры клетки после размораживания субкультивировали в течение трех пассажей при 37°С и 5% СО2 в ростовой среде, состоящей из культуральной среды DMEM/F12 (Sigma-Aldrich, США), L-глутамина (2 мM; Sigma-Aldrich, США), 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина (PanBiotech, Германия) и 10% ЭТС (Gibco, США). Снятие клеток с подложки при пассировании проводили смесью растворов трипсина (0.25%) и версена (0.48 мМ; Gibco, Invitrogen, США) при объемном соотношении 1 : 3.
Для экспериментов клетки в концентрации 104/см2 высаживали на поверхность культуральных флаконов для адгезивных культур Т-25 Greiner CELLSTAR® (Greiner Bio-One GmbH, Германия) или в 6-луночные планшеты (Greiner Bio-One Gm-bH, Германия) в ростовой среде, состоящей из DMEM/F12, L-глутамина (2 мM), антибиотиков в стандартной концентрации, ЭТС (Gibco, США) и КС регенератов сетчаток тритонов. КС добавляли к ростовой среде в соотношении 1 : 1 с конечной концентрацией ЭТС 1%. В качестве контроля использовали клетки, культивированные в ростовой среде того же состава с 1% ЭТС, но без добавления КС. Изменения морфологии клеток изучали с помощью инвертированного микроскопа Olympus CKX31 (Япония) через 24, 48, 72 и 120 ч после посадки клеток. В течение всего срока культивирования среду не меняли. Фотографии получали с помощью микроскопа Olympus c цифровой камерой DP70.
Получение КС от регенерирующих сетчаток тритонов. Работа выполнена с соблюдением международных принципов Хельсинкской декларации о гуманном отношении к животным. Использовали взрослых половозрелых тритонов Pleurodeles waltl в возрасте от 6 мес до 1 года, разводимых в аквариальной ИБР РАН. Тритонов наркотизировали в растворе MS-222 (1 : 1000; Sigma-Aldrich, США) в течение 10–15 мин до полной иммобилизации животного. Выделение глаз проводили в стерильных условиях с помощью микрохирургических инструментов. С помощью бинокулярной лупы выделяли сетчатку, полностью свободную от других тканей задней стенки глаза (пигментного эпителия, хороидальной и склеральной оболочек).
Образцы 2-х сетчаток помещали в стеклянные флаконы с 5 мл ростовой среды, состоящей из культуральной среды 199 (Биолот, Россия) и стерильной бидистиллированной воды в соотношении 70% среды 199 и 30% воды, 1 М буфера HEPES, 80 мг/л сульфата гентамицина и 10% ЭТС. Сетчатки культивировали в темноте при температуре 22–24°С в мини-роллере RM-1 (Elmi, Латвия) при скорости вращения 60 об./мин. Через 120 ч культивирования меняли среду на ростовую среду того же состава, но без ЭТС и культивировали еще 48 ч. Далее полученную КС стерилизовали через фильтры с диаметром пор 0.22 мкм (Millipore, США), аликвотировали и хранили при −70°С. В работе использовали КС только от целых, не разрушенных регенерирующих сетчаток тритона.
Морфометрический анализ. Для оценки морфологических изменений клетки ARPE-19 высаживали в культуральные флаконы для адгезивных культур Т-25 Greiner CELLSTAR® (Greiner Bio-OneGmbH, Германия). После культивирования в течение 24, 48, 72 и 120 ч в присутствии КС или без нее (контроль) клетки фотографировали с помощью микроскопа Olympus (Япония) с цифровой камерой DP70 (Olympus, Япония). Затем из клеток выделяли тотальную РНК (см. ниже). Поскольку через 120 ч клетки достигали конфлюэнтного монослоя, что затрудняло проведение адекватного морфометрического исследования, оценку морфологии клеток ARPE-19 проводили на сроках 24, 48 и 72 ч по изображениям случайных полей зрения (формат JPEG, размер изображения 1360 × 1024 пикселей).
С помощью графического планшета и стилуса в программе ImageJ1.51j8 (Wayne Rasband, National Institute of Health, США) на изображениях вручную обводили каждую клетку, исключая двуядерные клетки и те, края которых соприкасались с границами изображения. Для каждого срока анализировали от 150 до 300 клеток, используя 4–16 микрофотографий независимых полей зрения с масштабным увеличением 200×. Программа автоматически рассчитывала площади проекций клетoк на подложке (далее площадь клетки). Площади клеток были рассчитаны в пикселях без перевода в метрические единицы измерения, поскольку для анализа были важны не абсолютные значения, а относительные. Дополнительно в программе CellsCount11f (Россия) проводили подсчет клеток. Для каждого срока анализировали от 1000 до 2000 клеток, используя 10–20 микрофотографий независимых полей зрения с масштабным увеличением 100×.
Оценка пролиферативной активности клеток РПЭ (МТТ-тест). Клетки высаживали на поверхность 96-луночных планшетов в концентрации 104/см2 и культивировали в течение 24 ч в отсутствие (контроль) и присутствии КС. Для оценки пролиферативной активности клеток за 3 ч до окончания срока культивирования в каждую лунку добавляли маточный раствор МТТ (5 мг/мл; Sigma Aldrich, США) в соотношении 1 : 10 по отношению к объему ростовой среды. По окончании инкубации удаляли ростовую среду, затем для извлечения из клеток образовавшегося темноокрашенного формазана добавляли 100 мкл ДМСО (Applichem, Германия) и ресуспендировали осадок. Анализ оптической плотности окрашенного раствора проводили на планшетном анализаторе StatFax 2100 (Awareness Technology Inc, США) при длине волны 545 нм и корректирующем фильтре 630 нм. Исследования проведены дважды по 16 повторностей на одно разведение вещества и (или) контрольную группу. Для вычисления средних значений оптической плотности окрашенных растворов и стандартных отклонений применяли программное обеспечение Excel 2013 (Microsoft Corporation, США). Пролиферативную активность клеток (%) оценивали по изменению средних значений оптической плотности растворов по отношению к контролю, принятому за 100%.
Иммуноцитохимическое исследование (ИЦХ). Клетки высаживали на круглые покровные стекла (CellStar, Германия) в 24-луночные планшеты (Greiner Bio-One GmbH, Германия) и после культивирования в отсутствие (контроль) или присутствии КС через 24, 48 и 72 ч фиксировали в течение 6 мин 4%-ным раствором параформальдегида (Sigma-Aldrich, США). Препараты хранили в смеси глицерина и этиленгликоля при −20°C до проведения ИЦХ-окрашивания.
Дифференцировку клеток оценивали по иммунофлуоресценции, используя первичные антитела к следующим белкам: коннексину 43 (Сх43; C6219, кроличьи, разведение 1 : 200; Sigma-Aldrich, США); цитокератину 8 (СК8; Mob 054-05, мышиные, 1 : 40, Diagnostic BioSystems, США); белку OTX2 (AV32439, кроличьи, 1 : 100; Sigma-Aldrich, США); βIII-тубулину (ab7751, мышиные, 1 : 200; Abcam, Великобритания); нейрофиламентам средней и тяжелой фракции (N2912, мышиные, 1 : 400, Sigma-Aldrich, США); β-катенину (ab32572, кроличьи, 1 : 200; Abcam, Великобритания); фибронектину (ab23750, кроличьи, 1 : 100; Abcam, Великобритания); виментину (ab8978, мышиные, 1:100; Abcam, Великобритания); коллагену типа I (ab34710, кроличьи, 1 : 100; Abcam, Великобритания), разведенные в 0.1%-ном растворе бычьего сывороточного альбумина (БСА; Sigma-Aldrich, США).
Препараты экспериментальной и контрольной групп клеток ARPE-19 обрабатывали параллельно для последующего проведения сравнительного анализа. ИЦХ-окрашивание включало в себя обработку 1%-ным БСА для блокировки неспецифического связывания, инкубацию с первичными антителами при 4°С в течение ночи, связывание первичных антител с соответствующими вторичными антителами, меченными флуорохромами AlexaFluor 488 или 594 (1 : 300; Molecular Probes, США) в течение 2 ч при комнатной температуре, заключение в среду c ядерным красителем DAPI (Vectashield; Vector Laboratories, США).
Оценку результатов ИЦХ-анализа и фотографирование клеток проводили с помощью флуоресцентного микроскопа Keyence BZ-9000E (Япония). Интенсивность флуоресцентного сигнала и число клеток (ядер) оценивали с помощью программы ImageJ на цифровых изображениях препаратов (RGB, формат TIFF) с разрешением 1360 × 1024 пикселей по методике, описанной нами ранее (Кузнецова и др., 2019). Для маркерных белков Сх43, OTX2, фибронектина, коллагена I типа и βIII-тубулина вычисляли количественный индекс (QI) интенсивности флуоресценции по отношению средних значений интенсивности флуоресцентного сигнала (IntDen, в пикселях) к количеству клеток (ядер) ARPE-19 (Takeuchi et al., 2012). Для СК8 подсчитывали долю положительно окрашенных клеток, используя программу CellsCount11f (Россия). Для каждого срока анализировали от 400 до 900 клеток, используя 8–12 микрофотографий независимых полей зрения с масштабным увеличением 200×. В случае β-катенина, локализующегося по цитоплазматической мембране и в цитоплазме, подсчитывали клетки, имеющие цитоплазматическое распределение гранул β-катенина, используя ту же программу. Для каждого срока анализировали от 300 до 700 клеток, используя 4–7 микрофотографий независимых полей зрения с масштабным увеличением 200×. Определяли число клеток, не содержащих гранул β-катенина и содержащих единичные или множество гранул этого белка.
Количественная ПЦР в реальном времени (кПЦР). Подготовку проб, а также выделение тотальной РНК из культур клеток и кПЦР проводили по методике, описанной нами ранее (Шафеи и др., 2017; Кузнецова и др., 2018, 2019). Методом кПЦР оценивали изменения уровня экспрессии мРНК следующих генов транскрипционных факторов, сигнальных белков и маркеров дифференцировки: OCT4, NANOG, PAX6, OTX2, MITF, KRT18, βIII-тубулин (TUBB3), COL1A1, CTNNB1, GSK3B, KLF4, SPP1, RUNX2, FGF2, FGFR1, SMAD4, SMAD5, IGFR1 (праймеры и зонды от компании ДНК-Синтез, Россия), NES, BMP2, BMP4, CCND1 (циклин D1) (Applied Biosystems, США). В качестве эндогенного контроля использовали ген домашнего хозяйства GAPDH (праймеры и зонд от компании ДНК-Синтез, Россия). Праймеры и зонды представлены в табл. 1.
Таблица 1.
Праймеры, использованные для кПЦР
| Ген (Ref_Seq) | Последовательность прямого (F) и обратного (R) праймера, зонд или каталожный номер | Размер ампликона, п.н. |
|---|---|---|
| OCT4 (NM_002701) | F: 5'-GAACCGAGTGAGAGGCAACC-3' R: 5'-ATAGTCGCTGCTTGATCGCTT-3' Зонд: 5'-FAM-CAGTGCCCGAAACCCACACTGC-BHQ1-3' |
163 |
| NANOG (NM_024865) |
F: 5'-GAAATACCTCAGCCTCCAGCA-3' R: 5'-TGCCACCTCTTAGATTTCATTCTC-3' Зонд: 5'-FAM-CTCTCCAACATCCTGAACCTCAGCTACA-BHQ1-3' |
111 |
| NESTIN (NM_006617.1) | Hs04187831_g1 | 58 |
TUBB3 (NM_006086) |
F: 5'-GGGCCAAGTTCTGGGAAGTC-3' R: 5'-CGAGTCGCCCACGTAGTTG-3' Зонд: 5'-FAM-ATGAGCATGGCATCGACCCCAGC-BHQ1-3' |
71 |
| PAX6 (NM_001604) |
F: 5'-CAATTCCACAACCCACCACAC-3' R: 5'-CTGTAGGTGTTTGTGAGGGCTGT-3' Зонд: 5'-FAM-TCCTCCTTCACATCTGGCTCCATGT-BHQ1-3' |
88 |
| OTX2 (NM_001270525, NM_021728) |
F: 5'-ATGGACTTGCTGCACCCCT-3' R: 5'-CAAACAGTGCTTCCAGCACATC-3' Зонд: 5'-VIC-GGGCTACCCGGCCACCCC-BHQ1-3' |
109 |
| MITF (NM_198159) |
F: 5'-CACCAGCCATAAACGTCAGTGT-3' R: 5'-CGAGGTGGGTCTGCACCTT-3' Зонд: FAM-CCACCACCCTTCCCTCTGCCAC-BHQ1-3' |
87 |
| KRT18 (NM_199187.1; NM_000224.2) | F: 5'-GAGGACCTGAGGGCTCAGA-3' R: 5'-GACTCTAAAGTCATCAGCAGCAA-3' Зонд: 5'-FAM-ACTGTGGACAATGCCCGCATC-BHQ1-3' |
98 |
| KLF4 (NM_001314052.1) |
F: 5'-ACCAGGCACTACCGTAAACACA-3' R: 5'-GGTCCGACCTGGAAAATGCT-3' |
79 |
| CCND1 (NM_053056.2) | Hs00765553_m1 | 57 |
| CTNNB1 (NM_001330729.1) | F: 5'-CCTCTGATAAAGGCTACTGTTGG-3' R: 5'-GCACGAACAAGCAACTGAACT-3' Зонд: 5'-FAM-CGAAATCTTGCCCTTTGTCCCGC-BHQ1-3' |
115 |
| GSK3B (NM_001146156.1) | F: 5'-CAAATTAAGGCACATCCTTGGA-3' R: 5'-GCAGACGGCTACACAGTGCA-3' Зонд: 5'-FAM-CTTCCGACCCCGAACTCCACC-BHQ1-3' |
78 |
| BMP2 (NM_001200.2) | Hs00154192_m1 | 60 |
| BMP4 (NM_001202.3, NM_130850.2, NM_130851.2) | Hs00370078_ml | 58 |
| SMAD4 (NM_005359.6) |
F: 5'-AAAACGGCCATCTTCAGCA-3' R: 5'-TGTGAACAGGCCAGTAATGTC-3' Зонд: 5'-FAM-ACCCGCCTATGCCGCCC-BHQ1-3' |
65 |
| SMAD5 (NM_001001419.3) |
F: 5'-TGATTCCTCAGATTATGCCCA-3' R: 5'-CTTCTCCAACACGATTGTTTAAT-3' Зонд: 5'-FAM-CCAGCAGGGATGTTCAGCCTGT-BHQ1-3' |
116 |
| FGF2 (NM_001361665.2) |
F: 5'-GACGGGGTCCGGGAGA-3' R: 5'-CGGTTAGCACACACTCCTTTG-3' Зонд: 5'-FAM-CGACCCTCACATCAAGCTACAACTT-BHQ1-3' |
94 |
| FGFR1 (NM_023110.3) |
F: 5'-CTATCGGACTCTCCCATCACT-3' R: 5'-CCTGTGCAATAGATGATGATCTC-3' Зонд: 5'-FAM-CCGTTCTGGAAGCCCTGGAAGA-BHQ1-3' |
111 |
| IGFR1 (NM_001291858.2) |
F: 5'-CGGCAGCCAGAGCATGT-3' R: 5'-GAGCAGAAGTAACAGAATCAATG-3' Зонд: 5'-FAM-CCTTGCCCGAAGGTCTGTGAG-BHQ1-3' |
100 |
| RUNX2 (NM_001278478) |
F: 5'-GCCTTCAAGGTGGTAGCC-3' R: 5'-CGTTACCCGCCATGACAGT-3' Зонд: 5'-FAM-CACAGTCCCATCTGGTACCTCTCCG-BHQ1-3' |
66 |
| GAPDH (NM_002046) |
F-5’-GAAGGT GAAGGTCGGAGTC-3’ R-5’-GAAGATGGTGATGGGATTTC-3’ Зонд 5’-FAM-CCATCAATGACCCCTTCATTGACC-BHQ1-3’ |
220 |
| COL1A1 (NM_000088.3) | F: 5'-GTCGAGGGCCAAGACGA-3' R: 5'-CAGGTCTCGGTCATGGTAC-3' Зонд: 5'-FAM-CATCCCACCAATCACCTGCGTAC-BHQ1-3' |
71 |
Смесь реагентов для кПЦР (25 мкл) включала 2 мМ MgCl2, 200 мкМ dNTPs, 1 Ед Maxima HS Taq-полимеразы (Fermentas, Латвия), 5 мкл разведенной кДНК (эквивалентной 4 нг исходной тотальной РНК), 250 нM праймеров и 250 нM зонда. Реакцию проводили на приборе LightCycler®96System (Roche, Швейцария). Программа для ПЦР включала: 1 цикл денатурации при 95°C 3 мин, 40 циклов денатурации при 95°C 15 с и совмещенный этап отжига–синтеза при 60°C 1 мин. Пороговый цикл определяли, применяя программное обеспечение LightCycler® 96 Application Software Version 1.1 (Roche, Швейцария). Количество мРНК каждого исследованного гена в образцах оценивали в 3-х повторностях. Обработка данных кПЦР включала усреднение значений Ct для повторных точек в эксперименте, расчет значений относительной экспрессии исследуемых генов методом ΔΔCt для каждого образца с использованием значения Ct по гену GAPDH в качестве нормирующего.
Статистический анализ. Статистическую обработку полученных показателей, вычисление средних значений и ошибки среднего проводили с помощью программы Excel 2013 (Microsoft Corporation, США). Достоверность различий средних величин устанавливали с помощью t-критерия Стьюдента при уровне значимости P < 0.01 или P < 0.05.
РЕЗУЛЬТАТЫ
Морфология клеток. После воздействия КС в клетках ARPE-19 наблюдали морфологические отличия от контрольных клеток, имеющие место на протяжении всего срока эксперимента (рис. 1а). Так, через 24 ч после трипсинизации клеток ARPE-19 и посадки их на твердый субстрат доля распластанных клеток была выше в группе клеток, культивированных в ростовой среде с КС. Тогда как значительная доля контрольных клеток к этому моменту наблюдения оставалась округлой формы. На более поздних сроках культивирования (48–120 ч) клетки в экспериментальной группе также оставались более вытянутыми.
Рис. 1.
Изменение морфологии (а) и морфологических параметров (б, в) клеток ARPE-19 в различные временные промежутки после добавления в среду культивирования кондиционированной среды (КС) регенератов сетчаток тритонов. а – Фазовый контраст, прижизненная микроскопия; б – средние значения площади клеток (в пикселях) в отсутствие (контроль, черные столбики) и в присутствии КС (серые столбики) и их ошибки (вертикальные отрезки), *P < 0.01; в – распределение клеток по размеру площади, выраженное в %. Разными цветами обозначены значения площади клеток в пикселях ×1000.
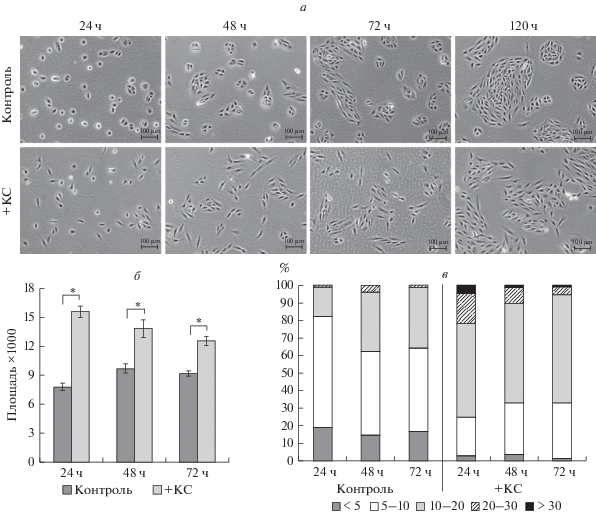
Под действием КС наблюдали изменения и в формировании колоний. Клетки контрольной группы формировали эпителиоидные колонии, в центральной части которых преобладали клетки кубовидной или полигональной формы, в маргинальной зоне – вытянутые, при этом клетки в колониях плотно прилежали друг к другу (рис. 1а). Клетки в среде с КС формировали рыхлые, неупорядоченные колонии. Следует сказать, что, несмотря на возможные различия составов разных партий КС из-за отличий животных по возрасту (от 6 мес. до 1 г.), полу и размеру, изменения морфологии в клетках ARPE-19 были сходны.
Результаты количественного анализа представлены на рис. 1б, в. Они показывают изменения морфологических параметров клеток ARPE-19 после воздействия КС с течением времени по сравнению с контролем. На всех сроках наблюдения средние значения площади клеток в эксперименте выше, чем в контроле (рис. 1б), однако их различия с течением времени постепенно уменьшаются: в 1.99 (24 ч), 1.43 (48 ч) и 1.36 (72 ч) раза. Увеличение площади клеток свидетельствует об изменении их размера и (или) появлении субпопуляций (пула) клеток большего размера под влиянием КС, что подтверждается при анализе распределения клеток ARPE-19 по площади (рис. 1в). Так, через 24 ч после воздействия КС отмечается увеличение доли клеток среднего (рис. 1в) и крупного размера (рис. 1в), тогда как доля клеток мелкого размера (рис. 1в) уменьшается. Известно, что малые размеры клеток коррелируют со стволовостью и, наоборот, увеличение размера клеток коррелирует с фенотипом дифференцированных клеток (Li et al., 2015).
Пролиферативная активность. Пролиферация является естественным процессом для клеток in vitro, однако темпы пролиферации могут зависеть от условий культивирования. Наблюдение за клетками ARPE-19 на светооптическом уровне показало увеличение их числа с течением времени культивирования от момента посадки (рис. 1а), что подтверждает количественный анализ на микрофотографиях в программе CellsCount11f (рис. 2а). Это свидетельствует о том, что клетки продолжают делиться как в контроле, так и в экспериментальной группе. Кроме того, как в контроле, так и в эксперименте наблюдали митотические фигуры при окраске красителем DAPI. Однако темпы пролиферации различались в контроле и под действием КС. Число клеток ARPE-19 после воздействия КС было статистически ниже, чем в контроле во временном промежутке 24–72 ч, и это различие постепенно увеличивалось с течением времени: на 17.7 (24 ч), 20.8 (48 ч) и 22.2% (72 ч).
Рис. 2.
Среднее число клеток ARPE-19 (а) на микрофотографиях независимых полей зрения в разные промежутки времени после добавления в среду КС (серые столбики), а также их пролиферативная активность (б) через 24 ч после добавления КС (серый столбик). Черные столбики – контроль. Клетки считали в программе CellsCount11f (Россия), пролиферативную активность определяли по МТТ-тесту. Вертикальные отрезки – ошибки среднего, *P < 0.01. по сравнению с контролем.
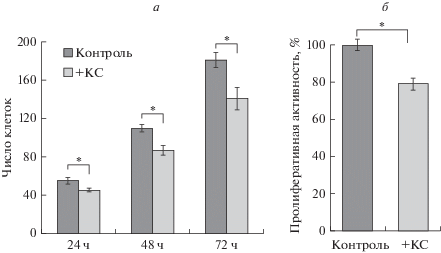
Данные количественного анализа числа клеток ARPE-19 в присутствии КС указывают на снижение темпов пролиферации и совпадают с результатами МТТ-теста, проведенного на сроке 24 ч (рис. 2б). Таким образом, КС при добавлении в среду культивирования понижала пролиферативную активность клеток ARPE-19 человека в период культивирования от 24 до 72 ч, что сходно с поведением клеток тритона во время их трансдифференцировки (Chiba et al., 2006; Yasumuro et al., 2017). Чтобы понять основные механизмы морфологических изменений в клетках ARPE-19, наблюдаемых после культивирования с КС, были проведены ИЦХ-анализ и кПЦР.
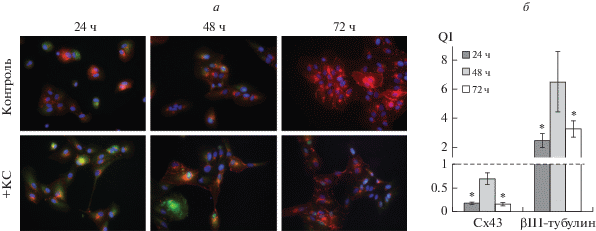
ИЦХ-анализ. Мы оценили маркеры РПЭ и других возможных дифференцировок – нейральной и мезенхимной, поскольку это наиболее частые пути трансдифференцировки клеток РПЭ (Salero et al., 2012). В качестве маркеров РПЭ мы использовали белок щелевых контактов Cх43 и белок цитоскелета СК8. В клетках ARPE-19 отмечали снижение интенсивности иммунофлуоресцентного сигнала от Cx43 через 24, 48 и 72 ч после воздействия КС по сравнению с контрольными клетками тех же сроков (рис. 3а). Определение количественного индекса (QI) интенсивности флуоресцентного сигнала в целом подтвердило нашу визуальную оценку и показало, что интенсивность сигнала была более чем в 5 раз ниже на сроках 24 и 72 ч (рис. 3б). Снижение интенсивности окрашивания белка межклеточных контактов Cx43 свидетельствует о потере большинством клеток РПЭ эпителиальной морфологии под действием КС.
Рис. 3.
Изменения интенсивности свечения белков Cx43 и βIII-тубулина в клетках ARPE-19 через 24, 48 и 72 ч после воздействия КС: а – двойное иммунофлуоресцентное окрашивание с помощью специфических антител на Cx43 (красное свечение) и βIII-тубулин (зеленое свечение); ядра окрашены DAPI (синее свечение); об.: 40×. б – Количественный индекс (QI) интенсивности флуоресцентных сигналов после воздействия КС по отношению к контролю, принятому за 1 (штриховая линия). Вертикальные отрезки – ошибки среднего, *P < 0.05.
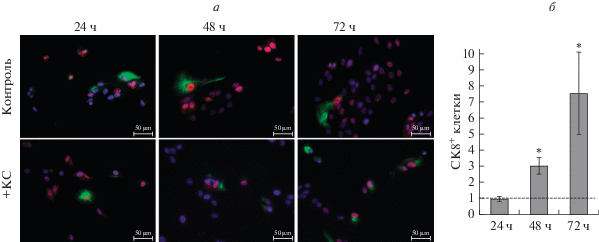
С течением времени культивирования в контрольных клетках ARPE-19 происходило снижение доли клеток, окрашенных на СК8, которая составляла 8.9% (24 ч), 1.7% (48 ч) и 0.8% (72 ч), что говорит о дедифференцировке клеток in vitro по мере культивирования. Изменения же количества СК8-позитивных клеток ARPE-19 после воздействия КС не выявлено (рис. 4а). Однако по сравнению с контролем отмечено увеличение доли таких клеток относительно общего количества с течением времени культивирования (рис. 4б), что свидетельствует о том, что часть клеток под действием КС сохраняет свои эпителиальные характеристики.
Рис. 4.
Изменения интенсивности свечения белков OTX2 и СК8 в клетках ARPE-19 через 24, 48 и 72 ч после воздействия КС: а – двойное иммунофлуоресцентное окрашивание на OTX2 (красное свечение) и CК8 (зеленое свечение), ядра окрашены DAPI (синее свечение), об.: 40×. б – Изменение количества СК8+-положительных клеток по отношению к контролю, принятому за 1 (штриховая линия). Вертикальные отрезки – ошибки среднего, *P < 0.05.
Анализ ИЦХ-окрашивания антителами против βIII-тубулина, маркера ранней стадии дифференцировки нейронов сетчатки, выявил увеличение числа маркированных клеток через 24 и 72 ч после воздействия КС по сравнению с контролем (рис. 3а, б). Различий в иммуноокрашивании антителами против средних и тяжелых цепей нейрофиламентов на сроках 24 и 48 ч не обнаружено. Достоверных различий в окрашивании на маркер РПЭ и нейроэпителия OTX2 в клетках ARPE-19 под действием КС по сравнению с контролем не выявлено (рис. 4а).
Оценка маркеров мезенхимной дифференцировки выявила усиление окрашивания на белок внеклеточного матрикса фибронектин через 24 и 48 ч после воздействия КС (рис. 5). Другой белок внеклеточного матрикса, коллаген I типа, характерный для развития эпителиально-мезенхимного перехода (ЭМП), окрашивался слабоположительно как в контрольной, так и в экспериментальной группе. Значимых различий при этом не выявлено.
Рис. 5.
Иммунофлуоресцентное окрашивание на фибронектин (красное свечение) в клетках ARPE-19 через 24 и 48 ч после воздействия КС. Ядра окрашены DAPI (синее свечение). Об.: 40×.
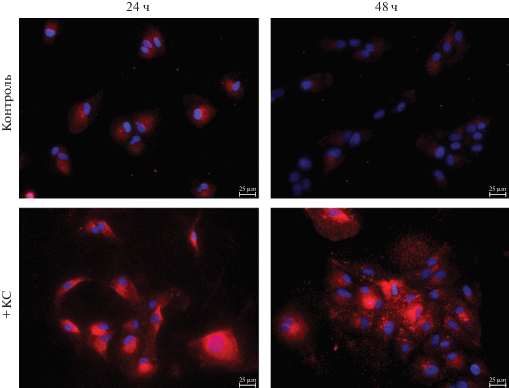
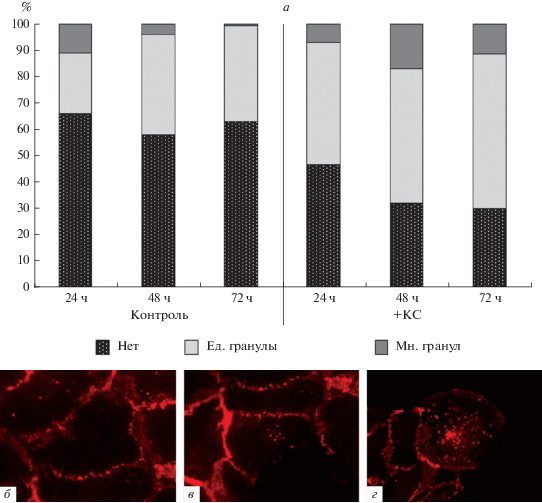
При визуальной оценке окрашивания на β-катенин (белок адгезионных контактов и центральный медиатор канонического Wnt-сигнального пути) через 24 ч после воздействия КС отмечали увеличение числа клеток с гранулярным цитоплазматическим окрашиванием, которое увеличивалось к 48 ч и сохранялось до 72 ч наблюдения, что подтверждено количественным анализом (рис. 6а). Перераспределение β-катенина в клетке и изменение его локализации с цитоплазматической мембраны на внутриклеточное говорит об ослаблении межклеточной адгезии и объясняет появление рыхлых колоний.
Рис. 6.
Количественная оценка распределения гранул β-катенина в цитоплазме клеток ARPE-19 (а) и примеры иммунофлуорисцентного окрашивания на β-катенин (красное свечение), демонстрирующие его отсутствие (б), единичные (в) и множественные (г) гранулы в цитоплазме. а – Число клеток, не содержащих гранул (Нет) и содержащих единичные гранулы (Ед.) или множество их (Мн.) через 24, 48 и 72 ч после добавления в среду КС по сравнению с контролем, в %.
Результаты кПЦР. Через 24 ч после воздействия КС на клетки ARPE-19 отмечено увеличение уровней мРНК гена-маркера пронейральной дифференцировки TUBB3 более чем в 1.6 раза (рис. 7) и специфического регулятора перехода G1/S-фазы в клеточном цикле циклина D1 (CCND1) в 1.7 раза по сравнению с контролем (рис. 7). На этом же сроке по сравнению с контролем наблюдается снижение уровней мРНК OTX2 в 3.6 раза, маркера РПЭ гена BMP4 – в 3.5 раза и BMP2 – в 1.7 раза (рис. 7б). При этом по сравнению с контролем, принятым за единицу, отмечается увеличение уровня экспрессии мРНК SMAD5, участвующего в передаче сигналов белков семейства BMP, в 1.5 раза (рис. 7), тогда как изменения уровня экспрессии мРНК транскрипционного фактора SMAD4, медиатора трансдукции сигналов BMP и TGF-β, не выявлено (рис. 7). Кроме того, на этом же сроке наблюдается увеличение уровня экспрессии мРНК трансмембранного рецептора IGFR1 в 1.5 раза (рис. 7) и незначительное снижение уровня экспрессии мРНК FGFR1 при увеличении уровня экспрессии мРНК bFGF более чем в 1.4 раза по сравнению с контролем (рис. 7). Следует отметить, что на этом же сроке отмечается экспрессия мРНК гена-маркера белка внеклеточного матрикса COL1A1 по сравнению с контролем, где его экспрессия не детектируется. Уровень экспрессии мРНК RUNX2, ключевого фактора транскрипции, связанного с дифференцировкой остеобластов, в клетках ARPE-19 после воздействия КС был ниже в 1.4 раза, чем в контроле (рис. 7). В то же время, экспрессия SPP1, кодирующего секретируемый фосфопротеин 1/остеопонтин (белок, участвующий в формировании костной ткани), не детектировалась ни в контрольных, ни в экспериментальных группах клеток ARPE-19. Таким образом, мы установили отсутствие остеогенной дифференцировки ARPE-19 под действием КС.
Рис. 7.
Изменение профиля экспрессии генов клеток ARPE-19 под действием КС регенератов сетчаток тритонов относительно соответствующего контроля (в отсутствии КС), принятого за единицу (штриховая линия).
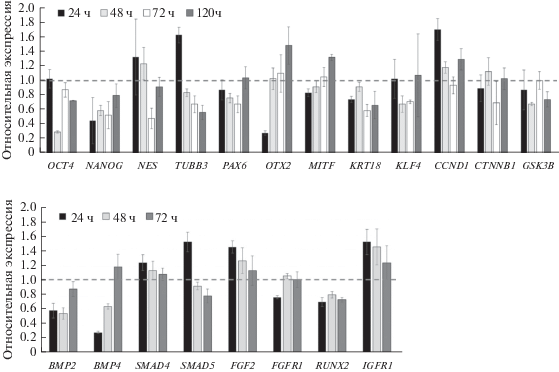
кПЦР подтвердил экспрессию в клетках ARPE-19 взрослого человека генов OCT4 и NANOG. Экспрессия этих генов-маркеров плюрипотентности в контрольных клетках постоянной линии РПЭ человека невысока (рис. 7). OCT4 в кПЦР определяется после 35-го цикла амплификации кДНК, а NANOG – после 38-го цикла, что свидетельствует об их неактивности (Lengner et al., 2007). Через 48 ч после воздействия КС отмечено снижение уровней мРНК OCT4 в 3.4 раза и NANOG – в 1.7 раза, что косвенно свидетельствует о дифференцировочных процессах, происходящих в клетках ARPE-19 под действием КС тритонов. Кроме того, на этом же сроке кПЦР-анализ показал снижение в 1.5 раза уровней мРНК KLF4 и GSK3B (гена киназы гликогенсинтазы-3β, GSK3β) с сохранением на низком уровне мРНК генов ВМР2 и ВМР4 по сравнению с контролем (рис. 7).
Через 72 ч по сравнению с контролем выявляется снижение уровня мРНК NES в 2 раза, PAX6 и TUBB3 – в 1.5 раза, KRT18 – в 1.7 раза с сохранением на низком уровне мРНК генов NANOG и KLF4 (рис. 7). Через 120 ч наблюдения на низком уровне сохраняются мРНК генов TUBB3, KRT18, ВМР2 и ВМР4 и отмечается подъем уровней мРНК генов OTX2 в 1.5 раза и MITF в 1.3 раза (рис. 7).
ОБСУЖДЕНИЕ
Результаты морфологического и морфометрического исследований показали изменения морфологии клеток линии РПЭ человека ARPE-19, проявляющиеся в изменении их формы и увеличении их размеров в течении 120 ч культивирования после воздействия КС регенератов сетчаток тритонов. По данным литературы известно, что по мере увеличения размера клеток увеличивается содержание рибосом и скорость синтеза белка (Mueller, 2015). В то же время результаты проведенного нами впервые количественного исследования наглядно продемонстрировали неоднородность клеточной популяции линии ARPE-19 человека по морфологическим параметрам, что дополняет наблюдения, представленные в ранее опубликованных работах, выполненных на первичном материале (Burke, Hjelmeland, 2005; Al-Hussaini et al., 2008).
Результаты ИЦХ-исследования показали снижение интенсивности окрашивания клеток на белок щелевых контактов Сх43 и перераспределение β-катенина по сравнению с контролем. Так, во временном отрезке культивирования 24–48 ч отмечалось увеличение доли клеток, имеющих внутриклеточную локализацию β-катенина. Поскольку β-катенин является не только центральным медиатором канонического Wnt-сигнального пути (Katoh, Katoh, 2006), но и белком адгезионных контактов (Nelson, Nusse, 2004), это наблюдение совместно с результатами окраски на белок Сх43 говорит об ослаблении межклеточной адгезии и объясняет появление рыхлых колоний под действием КС. Снижение через 24 ч после воздействия КС экспрессии OTX2, маркера предшественников РПЭ, и BMP4, участвующего в определении ранней специализации клеток РПЭ из нейроэпителия (Wordinger, Clark, 2007), свидетельствует наряду с ослаблением межклеточных контактов о частичной потере эпителиальной дифференцировки.
Снижение интенсивности окрашивания на β-катенин по цитоплазматической мембране в клетках ARPE-19 сопровождалось сохранением уровня экспрессии его гена (CTNNB1) одновременно со снижением уровня экспрессии GSK3B. В отсутствие Wnt-сигнализации GSK3β препятствует стабилизации и накоплению β-катенина в цитоплазме. При активации Wnt-сигнального пути накопленный β-катенин мигрирует в ядро, где взаимодействует с мишенями Wnt, регулирующими экспрессию многих генов (Cadigan, 2012). Кроме того, в ARPE-19 под действием КС наблюдали увеличение экспрессии гена коллагена I типа COL1A1, но усиления синтеза белка при ИЦХ-окрашивании не выявлено. Однако отмечено усиление иммуноокрашивания на белок внеклеточного матрикса фибронектин.
Рассматриваемые вместе эти изменения указывают на возможный ЭМП клеток РПЭ и активацию канонического Wnt-сигнального пути. Связь между ЭМП и активацией Wnt/β-катенинового пути показана при эмбриональном развитии и регенерации (Han et al., 2015; Bosada et al., 2016). Нарушение межклеточных контактов и реорганизация цитоскелета, о которых свидетельствуют изменения морфологии клеток и появление рыхлых колоний, являются одними из ранних событий ЭМП (Miyazono, 2009). Клетки, подвергшиеся ЭМП, приобретают мезенхимоподобный фенотип, характеризующийся экспрессией соответствующих белков цитоскелета (в частности виментина) и повышенным отложением белков внеклеточного матрикса, включая коллаген I типа и фибронектин (Lee et al., 2001; Feist et al., 2014; Che et al., 2016).
ИЦХ-окрашивание на виментин не выявило значимых различий между контрольной и экспериментальной группой. Однако виментин не является надежным показателем для выявления ЭМП в культуре РПЭ, поскольку различные виды эпителия экспрессируют его в культуре (Pieper et al., 1992). Кроме того, виментин экспрессируется в тканях, регенерирующих после повреждения (Witzgall et al., 1994). Часто процесс регенерации связан с возвращением клеток к менее дифференцированному фенотипу (Witzgall et al., 1994).
Как и РПЭ низших позвоночных, РПЭ человека может быть репрограммирован в нейральном направлении (Salero et al., 2012; Li et al., 2019), однако для этого требуются дополнительные манипуляции, в то время, как у низших позвоночных трансдифференцировка РПЭ является естественным процессом (Григорян и др., 2013). У низших позвоночных трансдифференцировка происходит через стадию специфических мультипотентных клеток, сохраняющих некоторые свойства РПЭ. В процессе трансдифференцировки клетки РПЭ низших позвоночных демонстрируют признаки ЭМП: они теряют пигментацию, в них снижается экспрессия маркеров РПЭ, увеличивается подвижность и пролиферация (Grigoryan, Markitantova, 2016; Yasumuro et al., 2017). У млекопитающих признаки ЭМП проявляются в клетках РПЭ как при различных патологиях глаз, так и при восстановлении РПЭ после воздействия лазера (Han et al., 2015; Che et al., 2016). Таким образом, наблюдаемые нами эффекты КС на клетки ARPE-19 могут свидетельствовать о начале ЭМП, который, однако, не имеет завершенного характера из-за однократного воздействия КС. По мере снижения концентрации КС клетки возвращаются к исходному состоянию.
Одновременно с событиями ЭМП в культуре наблюдали признаки, характерные для нейральной и эпителиальной дифференцировок, что, вероятно, связано с выделением двух субпопуляций. Увеличение доли СК8-положительных клеток после воздействия КС на фоне общего снижения эпителиальных маркеров говорит о поддержании небольшого пула клеток ARPE-19 в дифференцированном состоянии. В пользу попытки клеток выйти в нейральную дифференцировку свидетельствуют повышение уровня экспрессии гена TUBB3, усиление иммуноокрашивания на белок βIII-тубулин на фоне понижения экспрессии BMP2 и BMP4.
Ингибирование передачи сигналов BMP играет центральную роль во время нейральной индукции у млекопитающих (Di-Gregorio et al., 2007). Однако затем, ввиду краткосрочного воздействия КС в нашем эксперименте, во временном промежутке 72–120 ч наблюдали снижение транскрипции маркеров нейрональной дифференцировки (TUBB3, NES, PAX6) и увеличение транскрипции маркеров предшественников РПЭ (OTX2, MITF), что, вероятно, связано с возвратом клеток к исходной дифференцировке. Изменений в иммуноокрашивании против нейрофиламентов не наблюдали, вероятно из-за короткого времени воздействия дифференцировочного фактора. О попытке изменения дифференцировки на раннем сроке после воздействия КС и возврате к исходной говорит и характер изменения размера клеток по сравнению с контролем. Максимальные различия в площади клеток наблюдались на сроке 24 ч, которые постепенно уменьшались с течением времени культивирования.
Тот факт, что клетки ARPE-19 под действием КС совершают попытку выйти в нейральную дифференцировку, предполагает, что фактор(ы), присутствующий(ие) в КС регенератов сетчаток тритонов, способны обеспечить триггер для инициирования этого процесса. Подобные факторы, по существующему мнению (Mcgann et al., 2001), могут принадлежать ряду различных типов биомолекул, включая белки, липиды, нуклеиновые кислоты и полисахариды.
Проведя ряд экспериментов по выявлению природы дедифференцировочного сигнала по отношению к кардиомиоцитам мыши в экстракте регенерирующих конечностей тритона, исследователи (Mcgann et al., 2001) показали его белковую природу. Данные о составе секретома регенерирующей in vitro сетчатке глаза тритона пока отсутствуют. Однако нам известно, что на первой неделе органотипического культивирования in vitro изолированных тотальных сетчаток тритона по данным ПЦР в них происходит значительное возрастание экспрессии мРНК гена bFgf (Markitantova et al., 2019). Ростовой фактор bFGF, член FGF-сигнального пути, функционирует на самых ранних стадиях эмбрионального развития (Dorey, Amaya, 2010), в том числе развития глаза, способствуя специализации нейроэпителия в сетчатку (Bharti et al., 2006). Основными молекулами, стимулирующими трансдифференцировку РПЭ в клетки сетчатки при регенерации у тритона являются bFGF и IGF-1 (Mitsuda et al., 2005). Самостоятельно IGF-1 не способен вызвать изменения в РПЭ, скорее всего он участвует в повышении эффективности передачи сигнала bFGF (Mitsuda et al., 2005). В нашей работе мы наблюдали увеличение уровней экспрессии мРНК IGFR1 и FGF2 в клетках ARPE-19 под действием КС, что свидетельствует о консервативности механизмов трансдифференцировки РПЭ у позвоночных и возможном присутствии IGF-1 и bFGF в КС.
Важным участником контроля пролиферации и дифференцировки клеток является KLF4. Значение KLF4 показано при спецификации эпителиальных клеток и созревании нейронов (Li et al., 2012; Qin, Zhang, 2012). В нашем исследовании ингибирование экспрессии KLF4 положительно коррелировало со снижением экспрессии генов-маркеров дифференцировки РПЭ (OTX2, BMP4, KRT18) через 24–72 ч после воздействия КС. Кроме того, на этом же сроке мы наблюдали снижение пролиферативной активности клеток ARPE-19 по сравнению с контролем. Снижение пролиферации совпадало со снижением уровня экспрессии KLF4.
В наших предыдущих исследованиях показана связь между повышением экспрессии KLF4 и усилением пролиферации после воздействия bFGF как в иммортализованной (Шафеи и др., 2017), так и в неиммортализованных культурах клеток РПЭ (Кузнецова и др., 2018). Усиление пролиферации клеток ARPE-19 и повышение уровня экспрессии KLF4 наблюдали через 24 ч после воздействия bFGF, в то время как в первичных клетках РПЭ в первые 48 ч пролиферативная активность была снижена при неизменном уровне KLF4, а повышение уровня пролиферации и экспрессии KLF4 происходили только через 72 ч после воздействия bFGF. Такое различие, вероятно, связано с разной чувствительностью линейных и первичных клеток на одинаковую концентрацию фактора (Alge et al., 2006). По всей видимости, в зависимости от контекста KLF4 может регулировать клеточный цикл либо негативно (Chen et al., 2003; Li et al., 2012), либо позитивно (Tien et al., 2015). Еще один белок, контекст-зависимо влияющий на пролиферативный ответ и дифференцировку – BMP2 (Shu et al., 2011; Wang et al., 2017). Если сопоставлять результаты падения пролиферативной активности клеток ARPE-19 человека и данные кПЦР, показавшие снижение уровня экспрессии мРНК BMP2 в интервале 24–72 ч, то можно отметить их прямую корреляцию.
Отсутствие пролиферативного эффекта при использовании КС и экстрактов из регенерирующих конечностей тритона, показанное ранее в других работах (Kawesa et al., 2015; Middleton et al., 2018) и подтвержденное в нашем исследовании, может быть связано с тем, что для активации пролиферации требуется больше времени. Так, в экспериментах японских авторов (Yasumuro et al., 2017) клетки РПЭ тритона входили в клеточный цикл между 5 и 10 сут после ретиноэктомии, а полная регенерация сетчатки занимала более 65 сут.
В качестве основного фактора, влияющего на клетки РПЭ человека, мы предполагаем bFGF. Однако в КС могут присутствовать и другие активные молекулы, кроме того, концентрация bFGF может быть недостаточна для того, чтобы стимулировать пролиферативный ответ.
ЗАКЛЮЧЕНИЕ
Данная работа является первой в попытке тестировать действие КС, полученных из регенерирующих сетчаток тритона, на клетки ARPE-19 человека с целью обнаружить изменения дифференцировки этих клеток, в частности в сторону нейронального пути развития. Полученные первые свидетельства о возможности с помощью КС уже в первые сутки культивирования индуцировать экспрессию пронейральных маркерных молекул по сравнению с контролем требуют дальнейшего изучения, как и определение активных, действующих в этом направлении молекул “секретома” амфибий.
Список литературы
Григорян Э.Н. 2019. Эндогенные клеточные источники регенерации сетчатки глаза позвоночных животных и человека. Онтогенез. Т. 50. № 1. С. 13. (Grigoryan E.N. Endogenous cell sources for eye retina regenerationin vertebrate retina and human. Russ. J. Dev. Biol. 2018. V. 49. P. 314.)https://doi.org/10.1134/s0475145019010038
Григорян Э.Н. 2015. Факторы компетенции клеток ретинального пигментного эпителия для репрограммирования в нейрональном направлении при регенерации сетчатки у тритонов. Известия РАН. Серия биологическая. Т. 1. С. 5. (Grigoryan E.N. Competence factors of retinal pigment epithelium cells for reprogramming in the neuronal direction during retinal regeneration in newts. Dev. Biol. 2015. V. 42. P. 1.)
Григорян Э.Н., Маркитантова Ю.В., Авдонин П.П., Радугина Е.А. 2013. Исследование регенерации у амфибий в эпоху молекулярно-генетических подходов и методов. Генетика. Т. 49. № 1. С. 55. (Grigoryan E.N., Markitantova Y.V., Avdonin P.P., Radugina E.A. 2013. Study of regeneration in amphibians in age of molecular-genetic approaches and methods. Russ. J. Genet. V. 49. P. 46.)https://doi.org/10.7868/S0016675813010049
Кузнецова А.В., Куринов А.М., Ржанова Л.А., Александрова М.А. 2018. Механизмы дедифференцировки клеток ретинального пигментного эпителия глаза взрослого человека in vitro. Морфологический и молекулярно-генетический анализ. Цитология. Т. 60. № 12. С. 996. (Kuznetsova А.V., Kurinov A.M., Rzhanova L.A., Aleksandrova М.A. 2019. Mechanisms of dedifferentiation of adult human retinal pigment epithelial cells in vitro. Morphological and molecular genetic analysis. Cell Tiss. Biol. (Tsitologiya). V. 13. № 2. P. 107. )https://doi.org/10.1134/S1990519X19020068
Кузнецова А.В., Ржанова Л.А., Куринов А.М., Александрова М.А. 2019. Влияние основного фактора роста фибробластов на сигнальные пути в клетках ретинального пигментного эпителия человека. Цитология. Т. 61. № 4. С. 286. (Kuznetsova А.V., Rzhanova L.A., Kurinov A.M., Aleksandrova М.A. 2019. Effect of basic fibroblast growth factor on signaling pathways in adult human retinal pigment epithelial cells. Cell Tissue Biol. (Tsitologiya). V. 13. P. 292. https://doi.org/10.1134/S1990519X19040059)https://doi.org/10.1134/S0041377119040023
Милюшина Л.А., Вердиев Б.И., Кузнецова А.В., Александрова М.А. 2012. Экспрессия мультипотентных и ретинальных маркеров в пигментном эпителии сетчатки глаза взрослого человека in vitro. Клеточные технологии в биологии и медицине. Т. 1. С. 44. (Milyushina L.A., Verdiev B.I., Kuznetsova A. V., Aleksandrova M.A. 2012. Expression of multipotent and retinal markers in pigment epithelium of adult human in vitro. Bull. Exp. Biol. Med. V. 153. P. 157.)
Шафеи Е.В., Куринов А.М., Кузнецова А.В., Александрова М.А. 2017. Репрограммирование клеток ретинального пигментного эпителия человека под влиянием bFGF in vitro. Клеточные технологии в биологии и медицине. Т. 2. С. 128. (Shafei E.V., Kurinov A.M., Kuznetsova A.V., Aleksandrova M.A. 2017. Reprogramming of human retinal pigment epithelial cells under the effect of bFGF in vitro. Bull. Exp. Biol. Med. V. 163. P.574.) https://doi.org/10.1007/s10517-017-3852-5
Al-Hussaini H., Kam J.H., Vugler A., Semo M., Jeffery G. 2008. Mature retinal pigment epithelium cells are retained in the cell cycle and proliferate in vivo. Mol. Vis. V. 14. P.1784.
Bharti K., Nguyen M.-T.T., Skuntz S., Bertuzzi S., Arnheiter H. 2006. The other pigment cell: specification and development of the pigmented epithelium of the vertebrate eye. Pigment Cell Res. V. 19. P. 380. https://doi.org/10.1111/j.1600-0749.2006.00318.x
Bollini S., Gentili C., Tasso R., Cancedda R. 2013. The regenerative role of the fetal and adult stem cell secretome. J. Clin. Med. V. 2. P. 302. https://doi.org/10.3390/jcm2040302
Bosada F.M., Devasthali V., Jones K.A., Stankunas K. 2016. Wnt/β-catenin signaling enables developmental transitions during valvulogenesis. Dev. V.143. P. 1041. https://doi.org/10.1242/dev.130575
Burke J.M., Hjelmeland L.M. 2005. Mosaicism of the retinal pigment epithelium: seeing the small picture. Mol. Interv. V. 5. P. 241. https://doi.org/10.1124/mi.5.4.7
Cadigan K.M. 2012. TCFs and Wnt/β-catenin Signaling. More than One Way to Throw the Switch, Current Topics in Developmental Biology. V. 98: P. 1. https://doi.org/10.1016/B978-0-12-386499-4.00001-X
Che D., Zhou T., Lan Y., Xie J., Gong H., Li C., Feng J., Hong H., Qi W., Ma C., Wu Q., Yang X., Gao G. 2016. High glucose-induced epithelial-mesenchymal transition contributes to the upregulation of fibrogenic factors in retinal pigment epithelial cells. Int. J. Mol. Med. V. 38. P. 1815. https://doi.org/10.3892/ijmm.2016.2768
Chen F., Liu X., Chen Y., Liu J.Y., Lu H., Wang W., Lu X., Dean K.C., Gao L., Kaplan H.J., Dean D.C., Peng X., Liu Y. 2020. Sphere-induced reprogramming of RPE cells into dual-potential RPE stem-like cells. EBioMedicine. V. 52. P. 1. https://doi.org/10.1016/j.ebiom.2019.102618
Chiba C., Hoshino A., Nakamura K., Susaki K., Yamano Y., Kaneko Y., Kuwata O., Maruo F., Saito T. 2006. Visual cycle protein RPE65 persists in new retinal cells during retinal regeneration of adult newt. J. Comp. Neurol. V. 495. P. 391. https://doi.org/10.1002/cne.20880
Chiba C., Mitashov V. 2007. Cellular and molecular events in the adult newt retinal regeneration. In: “Strategies for Retinal Tissue Repair and Regeneration in Vertebrates: From Fish to Human” (ed. by Chiba C). Research Signpost, Trivandrum, India. P. 15.
Del Rio-Tsonis K., Jung J.C., Chiu I.-M., Tsonis P.A. 1997. Conservation of fibroblast growth factor function in lens regeneration. Proc. Natl. Acad. Sci.V. 94. P. 13701. https://doi.org/10.1073/pnas.94.25.13701
Di-Gregorio A., Sancho M., Stuckey D.W., Crompton L.A., Godwin J., Mishina Y., Rodriguez T.A. 2007. BMP signalling inhibits premature neural differentiation in the mouse embryo. Development. V. 134. P. 3359. https://doi.org/10.1242/dev.005967
Dorey K., Amaya E. 2010. FGF signalling: diverse roles during early vertebrate embryogenesis. Development. V. 137. P. 3731. https://doi.org/10.1242/dev.037689.FGF
Eguchi G. 1988. Cellular and molecular background of wolffian lens regeneration. Cell Differ. Dev. V. 25. P. 147. https://doi.org/10.1016/0922-3371(88)90111-6
Feist R.M., King J.L., Morris R., Witherspoon C.D., Guidry C. 2014. Myofibroblast and extracellular matrix origins in proliferative vitreoretinopathy. Graefe’s Arch. Clin. Exp. Ophthalmol. V. 252. P. 347. https://doi.org/10.1007/s00417-013-2531-0
Grigoryan E.N., Markitantova Y. V. 2016. Cellular and molecular preconditions for retinal pigment epithelium (RPE) natural reprogramming during retinal regeneration in Urodela. Biomedicines. V. 4. P. 1. https://doi.org/10.3390/biomedicines4040028
Gulati A.K., Reyer R.W. 1980. Role of neural retina and vitreous body during lens regeneration: Transplantation and autoradiography. J. Exp. Zool. V. 214. P. 109. https://doi.org/10.1002/jez.1402140114
Han J.W., Lyu J., Park Y.J., Jang S.Y., Park T.K. 2015. Wnt/β-catenin signaling mediates regeneration of retinal pigment epithelium after laser photocoagulation in mouse eye. Investig. Ophthalmol. Vis. Sci.V. 56. P. 8314. https://doi.org/10.1167/iovs.15-18359
Kawesa S., Vanstone J., Tsilfidis C. 2015. A differential response to newt regeneration extract by C2C12 and primary mammalian muscle cells. Skelet. Muscle. V. 5. P. 1. https://doi.org/10.1186/s13395-015-0044-8
Lee S.C., Kwon O.W., Seong G.J., Kim S.H., Ahn J.E., Kay E.D.P. 2001. Epitheliomesenchymal transdifferentiation of cultured RPE cells. Ophthalmic Res. V. 33. P. 80. https://doi.org/10.1159/000055648
Lengner C.J., Camargo F.D., Hochedlinger K., Welstead G.G., Zaidi S., Gokhale S., Scholer H.R., Tomilin A., Jaenisch R. 2007. Oct4 expression is not required for mouse somatic stem cell self-renewal. Cell Stem Cell. V.1. P. 403. https://doi.org/10.1016/j.stem.2007.07.020
Li Q., Rycaj K., Chen X., Tang D.G. 2015. Cancer stem cells and cell size: a causal link? Semin. Cancer Biol. V. 35. P. 191. https://doi.org/10.1016/j.semcancer.2015.07.002
Li S., Zhang H., Wang A., Liu Y., Liu H., Yue F., Abulaiti X., Zhang C., Li L. 2019. Differentiation of adult human retinal pigment epithelial cells into dopaminergic-like cells in vitro and in the recipient monkey brain. Mol. Med. V. 25. P. 1. https://doi.org/10.1186/s10020-019-0076-3
Markitantova Y. V., Novikova Y.P., Poplinskaya V.A., Grigoryan E.N. 2019. Expression of FGF2 and Nucleostemin in models of retinal regeneration in the newt under conditions of 3D organotypic culture. EC Ophtalmol. V. 12. P. 1. https://doi.org/10.31080/ecop.2020.11.00580
McGann C.J., Odelberg S.J., Keating M.T. 2001. Mammalian myotube dedifferentiation induced by newt regeneration extract. Proc. Natl. Acad. Sci. U.S.A. V. 98. P. 13699. https://doi.org/10.1073/pnas.221297398
Middleton R.C., Rogers R.G., De Couto G., Tseliou E., Luther K., Holewinski R., Soetkamp D., Van Eyk J.E., Antes T.J., Marbán E. 2018. Newt cells secrete extracellular vesicles with therapeutic bioactivity in mammalian cardiomyocytes. J. Extracell. Vesicles. V. 7. P. 1456888. https://doi.org/10.1080/20013078.2018.1456888
Mitsuda S., Yoshii C., Ikegami Y., Araki M. 2005. Tissue interaction between the retinal pigment epithelium and the choroid triggers retinal regeneration of the newt. Cynops pyrrhogaster. Dev. Biol. V. 280. P. 122. https://doi.org/10.1016/j.ydbio.2005.01.009
Miyazono K. 2009. Transforming growth factor-β signaling in epithelial-mesenchymal transition and progression of cancer. Proc. Japan Acad. Ser. B Phys. Biol. Sci. V. 85. P. 314. https://doi.org/10.2183/pjab.85.314
Moon H.Y., Javadi S., Stremlau M., Yoon K.J., Becker B., Kang S.-U., Zhao X., van Praag H. 2019. Conditioned media from AICAR-treated skeletal muscle cells increases neuronal differentiation of adult neural progenitor cells. Neuropharmacology. V. 145. P. 123. https://doi.org/10.1016/j.neuropharm.2018.10.041
Mueller R.L. 2015. Genome biology and the evolution of cell-size diversity. Cold Spring Harb. Perspect. Biol. V. 7. https://doi.org/10.1101/cshperspect.a019125
Mukherjee P., Mani S. 2013. Methodologies to decipher the cell secretome. Biochim. Biophys. Acta - Proteins Proteomics. V.1834. P. 2226. https://doi.org/10.1016/j.bbapap.2013.01.022
Oudina K., Paquet J., Moya A., Massourides E., Bensidhoum M., Larochette N., Deschepper M., Pinset C., Petite H. 2018. The paracrine effects of human induced pluripotent stem cells promote bone-like structures via the upregulation of BMP expression in a mouse ectopic model. Sci. Rep. V 8. P. 1. https://doi.org/10.1038/s41598-018-35546-6
Pieper F.R., Van de Klundert F.A., Raats J.M., Henderik J.B., Schaart G., Ra, aekers F.C., Bloemendal H. 1992. Regulation of vimentin expression in cultured epithelial cells. Eur. J. Biochem.V. 210. P. 509. https://doi.org/10.1111/j.1432-1033.1992.tb17449.x
Salero E., Blenkinsop T.A., Corneo B., Harris A., Rabin D., Stern J.H., Temple S. 2012. Adult human RPE can be activated into a multipotent stem cell that produces mesenchymal derivatives. Stem Cell. V. 10. P. 88. https://doi.org/10.1016/j.stem.2011.11.018
Sparrow J.R., Hicks D., Hamel C.P. 2010. The retinal pigment epithelium in health and disease. Curr. Mol. Med. V. 10. P. 802. https://doi.org/10.2174/156652410793937813
Takeuchi A., Fukazawa S., Chida K., Taguchi M., Shirataka M., Ikeda N. 2012. Semi-automatic counting of connexin 32s immunolocalized in cultured fetal rat hepatocytes using image processing. Acta Histochem. V. 114. P. 318. https://doi.org/10.1016/j.acthis.2011.06.008
Walsh N., Valter K., Stone J. 2001. Cellular and subcellular patterns of expression of bFGF and CNTF in the normal and light stressed adult rat retina. Exp. Eye Res. V. 72. P. 495. https://doi.org/10: https://doi.org/10.1006/exer.2000.0984
Witzgall R., Brown D., Schwarz C., Bonventre J. V. 1994. Localization of proliferating cell nuclear antigen, vimentin, c-Fos, and clusterin in the postischemic kidney. Evidence for a heterogenous genetic response among nephron segments, and a large pool of mitotically active and dedifferentiated cells. J. Clin. Invest. V. 93. P. 2175. https://doi.org/10.1172/JCI117214
Wordinger R.J., Clark A.F. 2007. Bone morphogenetic proteins and their receptors in the eye. Exp. Biol. Med. (Maywood). V. 232. P. 979. https://doi.org/10.3181/0510-MR-345
Xia J., Minamino S., Kuwabara K., Arai S. 2019. Stem cell secretome as a new booster for regenerative medicine. Biosci. Trends. V. 13. P. 299. https://doi.org/10.5582/bst.2019.01226
Yafai Y., Iandiev I., Lange J., Yang X.M., Wiedemann P., Bringmann A., Eichler W. 2013. Basic fibroblast growth factor contributes to a shift in the angioregulatory activity of retinal glial (müller) cells. PLoS One. V.8. P. e68773. https://doi.org/10.1371/journal.pone.0068773
Yasumuro H., Sakurai K., Toyama F., Maruo F., Chiba C. 2017. Implications of a multi-step trigger of retinal regeneration in the adult newt. Biomedicines. V. 5. P.1. https://doi.org/10.3390/biomedicines5020025
Дополнительные материалы отсутствуют.


