Цитология, 2021, T. 63, № 1, стр. 80-87
Использование конфокальной микроскопии и программных методов 2D и 3D анализа для изучения стуктурной организации астроцитов
О. И. Носова 1, *, Д. А. Суфиева 1, Д. Э. Коржевский 1
1 Институт экспериментальной медицины
197376 Санкт-Петербург, Россия
* E-mail: nosova@neuro.nnov.ru
Поступила в редакцию 10.09.2020
После доработки 24.09.2020
Принята к публикации 25.09.2020
Аннотация
Цель работы состояла в изучении возможностей двухмерного и трехмерного количественного анализа структурно-функционального состояния астроцитов на примере изображений, полученных при двойной иммуноцитохимической реакции на астроцитарные маркеры GFAP и GLT-1, с применением свободно распространяемого программного обеспечения. Материалом для исследования служил мозг половозрелых самцов крыс линии Вистар (n = 5). В работе продемонстрировано, что современные методы двухмерного и трехмерного анализа с помощью общедоступного программного обеспечения расширяют возможности получения качественной и количественной информации о структурно-функциональном состоянии таких сложноорганизованных объектов, как астроциты центральной нервной системы, а также обеспечивает уровень стандартизации данных, необходимый для сопоставления результатов исследований, полученных разными научными группами.
Функционирование головного мозга зависит от взаимодействия двух основных типов клеток: нейронов и клеток глии (Verkhratsky et al., 2014). Нарушение этого взаимодействия происходит при нейродегенеративных заболеваниях, таких как эпилепсия, болезнь Альцгеймера и другиx, следствием которых является снижение когнитивных функций, потеря памяти, психические расстройства (Hancock et al., 2014; Rodríguez-Arellano et al., 2016; Verkhratsky et al., 2016). В настоящее время в мировой литературной базе накапливается все больше данных о ключевой роли астроцитов в патогенезе этих заболеваний (Baber, Haghighat, 2010; Bernardinelli et al., 2014; Pekny, Pekna, 2014; Sukhorukova et al., 2015). Понимание механизмов вовлечения астроцитов в формирование и развитие массовой гибели нейронов может стать ключом к эффективной терапии нейродегенеративных заболеваний. В контексте этого становится актуальным применение современных подходов, позволяющих получать дополнительную информацию о структурно-функциональном состоянии астроцитов – важнейших клеток нейроглии.
В последние десятилетия наблюдается стремительное развитие методов флуоресцентной и конфокальной микроскопии (Ведяйкин и др., 2019; Jonkman et al., 2020). Методы, созданные на основе флуоресцентной микроскопии, стали незаменимыми в клеточных и молекулярно-биологических исследованиях. Эти подходы позволяют получать изображения с более высоким разрешением, чем традиционная световая микроскопия, что также открывает новые возможности для применения современных методов количественного анализа изображений. Кроме того, появляется все больше инструментов, позволяющих осуществлять объективную оценку изображений, основанную на количественных подходах не только в двухмерном пространстве (Costes et al., 2004; Bolte, Cordelieres, 2006; Lagache et al., 2015), но и в трехмерном (Zinchuk, Grossenbacher-Zinchuk, 2009; Adler, Parmryd, 2010; Zinchuk et al., 2013; Rizk et al., 2014; Heck et al., 2015; Kraus et al., 2017). Чтобы визуализировать, обрабатывать и анализировать эти типы данных, необходимо использовать соответствующее программное обеспечение. Существуют коммерческие пакеты, такие как Amira (Thermo Fisher Scientific, USA), Imaris (Bitplane, Switzerland), Volo-city (PerkinElmer, UK) и др. Эти программы представляют собой дорогостоящее програмное обеспечение, что является ограничивающим фактором для использования во многих цитологических лабораториях. Свободно распространяемым аналогом этих программ является пакет для анализа изображений ImageJ (https://imagej.net/Fiji). Хотя первоначально ImageJ был разработан для целей двухмерного анализа морфологических данных, благодаря дополнительным плагинам он может использоваться в качестве мощного программного обеспечения и для трехмерного анализа изображений. Большая популярность ImageJ у исследователей и открытость используемых в этом программном обеспечении алгоритмов создает благоприятную возможность для широкого использования этой программы в качестве основного средства анализа изображений, получаемых с помощью конфокальной микроскопии в процессе исследования сложноорганизованных цитологических объектов, к которым можно отнести и астроциты головного мозга.
Целью данной работы стало изучение возможностей двухмерного и трехмерного количественного анализа структурно-функционального состояния астроцитов на примере изображений, полученных при двойной иммуноцитохимической реакции на астроцитарные маркеры GFAP и GLT-1 с применением свободно распространяемого программного обеспечения.
Выбор маркеров, анализируемых в рамках представленной работы, был обусловлен следующими причинами. Белок цитоскелета GFAP широко используется в качестве маркера для оценки морфологического состояния астроцитов как в норме, так и при патологических состояниях (Emsley, Macklis, 2006; Takahashi et al., 2010; Kulijewicz-Nawrot et al., 2013). GLT-1 – это глутаматный транспортер астроцитов, обеспечивающий захват глутамата из синаптической щели. Многочисленные исследования свидетельствуют о роли этих транспортеров в развитии и формировании нейродегенеративных заболеваний (Baber, Haghighat, 2010; Gibbons et al., 2013; Kulijewicz-Nawrot et al., 2013; Hubbard et al., 2016; Murphy-Royal et al., 2017). Мембранные транспортеры глутамата формируют кластеры, размеры и расположение которых могут варьировать в зависимости от функционального состояния астроцитов (Benediktsson et al., 2012; Murphy-Royal et al., 2015). Таким образом, были использованы маркеры, позволяющие произвести количественную оценку морфологических особенностей как мембранного, так и цитоплазматического белков.
МАТЕРИАЛ И МЕТОДИКА
Животные. В качестве объекта исследования использовали интактных половозрелых самцов крыс линии Вистар в возрасте 4–6 мес. (n = 5). При содержании и умерщвлении животных соблюдали международные правила Хельсинской декларации о гуманном обращении с животными и “Правила проведения работ с использованием экспериментальных животных” (приказ № 755 от 12.08.1977 г. МЗ СССР). Исследование одобрено Локальным этическим комитетом ФГБНУ “ИЭМ” (протокол № 3/18 от 22.11.2018).
Гистологическое исследование. Головной мозг был фиксирован в цинк-этанол-формальдегиде (Korzhevskii et al., 2015), обезвожен и залит в парафин обычным способом. Изготавливали фронтальные срезы толщиной 10 мкм. После стандартной процедуры депарафинирования срезы подвергали тепловому демаскированию в модифицированном цитратном буфере S1700 (Dako, Дания). Далее срезы инкубировали в смеси первичных антител к GFAP (моноклональные мышиные антитела, клон SPM507; Spring Bioscience, США) и глутаматным транспортерам GLT-1 (поликлональные кроличьи антитела, ab106289; Abcam, Великобритания). Для визуализации данных маркеров использовали следующие вторичные антитела: моновалетный Fab-фрагмент антикроличьего иммуноглобулина осла, конъюгированного с флуорохромом Rhodamine Red™-X (RRX) (Jackson ImmunoReaserch, США) и моновалетный Fab-фрагмент антимышиного иммуноглобулина осла, конъюгированного с флуорохромом Cy-2 (Jackson ImmunoReaserch, США). Полученные препараты заключали в водорастворимую среду Fluorescence Mounting Medium (Dako, Дания). Анализировали астроциты зоны stratum radiatum поля CA1. Препараты фотографировали с помощью конфокального лазерного микроскопа LSM 710 (Zeiss, Германия) с объективом alpha Plan-Apochromat 100×/1.46 Oil DIC M27, в режиме сканирования по оси z, параметры которого определялись согласно общепринятым методикам (Штейн, 2007). Для этого была использована управляющая программа Zen2011 Black (Zeiss, Германия). С каждого образца мозга животных было получено по 3 z-стека толщиной от 4 до 7 мкм, которые использовали для дальнейшего анализа.
Анализ изображений. Нормализацию изображений проводили в свободно распространяемой программе Intensify 3D (https://github.com/nadavyayon/Intensify3D) (Yayon et al., 2018). Для унификации полученных данных z-стеки обрезали до размеров 40×40×4 мкм по 13 оптических срезов. Далее осуществляли двухмерный анализ в ImageJ в плагине GDSC (http://sites.imagej.net/GDSC/) (Herbert et al., 2014), где использовали каждый 4-й срез в z-стеке. Для трехмерного анализа применяли плагины DiAna (https://github.com/JeffGilles/DistanceAnalysis-DiAna) и 3D Suite в ImageJ (Gilles et al., 2017). Трехмерную визуализацию изображений выполняли с помощью бесплатно распространяемого программного обеспечения Blender (https://www.blender.org/) (Calì et al., 2016).
Статистический анализ. Для расчета значений коэффициента Пирсона и Мандерса использовали корреляционный поиск порога интенсивности флюоресценции с уровнем значимости p < 0.05. Для трехмерного анализа рассчитывали объем колокализованных вокселей, объем и площади поверхности исследованных маркеров, объем и количество кластеров глутаматных транспортеров. Статистический анализ данных параметров осуществляли в программе Origin 2016 (https://www.originlab.com/). Результаты расчетов представлены в виде медианы и интерквартильного интервала.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Предварительная обработка изображений. Полученные цифровые изображения подвергались предварительной обработке перед анализом. Для корректировки неоднородности распределения сигнала (аберрация оптических систем, различное проникновение и рассеивание света по z-оси в образце) применяли алгоритм нормализации интенсивности флюоресценции (Yayon et al., 2018). Каждый канал оригинального стека проходил нормализацию в программе Intensify 3D со следующими параметрами: размер пространственного фильтра 205 пикселей, автоматическая детекция ткани с помощью EM-алгоритма с параметром чувствительности равным 9 пикселям. Данные параметры выбирали с учетом имеющегося опыта использования данного алгоритма. Следует учитывать, что при использовании слишком высоких или слишком низких значений параметров фильтра, возможно появление артефактных зон с повышенным уровнем флюоресценции, что является критичным для дальнейшего анализа (Yayon et al., 2018). Затем для удаления шума применяли медианный фильтр (Median3D Filter; параметры фильтра: х радиус “2” пикселя, y радиус “2” пикселя, z радиус “2” пикселя), являющийся стандартным плагином в ImageJ. Таким образом были получены нормализованные изображения, с более четким контуром как тел, так и отростков исследуемых клеток.
Двухмерный анализ. Изображения анализировали в плагине GDSC (Herbert et al., 2014), который позволяет осуществлять анализ колокализации белков в разных каналах. Применение такого подхода позволяет производить более объективную оценку колокализованных областей интереса, в сравнении с описательным методом. Кроме того, этот анализ используется для определения точного местоположения интересующих структур и их общих характеристик. Анализ выполнялся в два этапа: поиск корреляционного порога, где отделяется сигнал от шума, и анализ колокализации пикселей, где пиксели считаются колокализованными, если присутствуют в двух каналах одновременно. Поиск корреляционного порога выполняется автоматически плагином G-DSC (Costes et al. 2004). Далее вычисляли значения коэффициента Мандерса, коэффициента корреляции Пирсона, и процент колокализованных пикселей – показатели, которые широко используются для колокализационного анализа (Manders et al., 1993; Zinchuk, Grossenbacher-Zinchuk, 2009; Adler, Parmryd, 2010; Ramírez et al., 2010; Zinchuk et al., 2013; Wang et al., 2016; Papageorgiou et al., 2018). Коэффициент Пирсона отражает корреляцию интенсивности флюоресценции между двумя каналами и может варьировать от –1 (отрицательная корреляция) до 1 (положительная корреляция). Коэффициент Мандерса представляет собой долю пикселей от каждого канала, которые вносят вклад в колокализованную область, т.е. представляет степень перекрытия сигнала и может принимать значения в пределах от 0 до 1 (Manders et al., 1993; Adler, Parmryd, 2010; Ramírez et al., 2010). Эти критерии позволяют получить информацию о степени взаимного перекрытия маркированных белков, а также оценить степень колокализации между ними (Zinchuk et al., 2013). Поскольку значения коэффициентов Мандерса и Пирсона часто принимают промежуточные значения, необходимо ввести оценочные критерии для различных уровней показателя. На практике удобно использовать классификатор, предложенный Зинчук с соавторами (Zinchuk et al., 2013). Данный метод подразумевает использование следующих оценок для характеристики степени колоколизации с учетом значений коэффициента корреляции Пирсона и коэффициента Мандерса: 0.1 – очень слабая, 0.2 – слабая, 0.3 – менее слабая, 0.4 – меньше умеренной, 0.5 – умеренная, 0.6 – более умеренная, 0.7 – меньше сильной, 0.8 – сильная, 0.9 – очень сильная). Тем не менее, применение данного подхода не избавляет от трудностей интерпретирования близких значений. Например, при очень слабой степени колокализации сложно объяснить в чем состоит биологический смысл ее отличия от слабой степени колокализации.
С использованием плагина GDSC были получены изображения с колокализованными пикселями (рис. 1г), где пурпурным цветом отображен GFAP (рис. 1а), желтым – GLT-1 (рис. 1б), синим – колокализованные пиксели (рис. 1в). Рассчитанные основные характеристики представлены в табл. 1. Согласно коэффициенту Пирсона (0.15 ± 0.07 при p < 0.05, n = 5), изучаемые белки демонстрируют очень слабую степень колокализации. Анализ показал, что коэффициент Мандерса имеет значения 0.63 ± 0.18 при p < 0.05 для GFAP и 0.22 ± 0.29 при p < 0.05 для GLT-1 (табл. 1). Значение параметра доли колокализованных пикселей для обоих каналов оказалось малым и составило 0.09 ± 0.17 при p < 0.05. Объяснить это можно тем, что исследуемые маркеры располагаются не слишком близко друг к другу, что обусловлено размещением в разных клеточных компартментах (GFAP – белок цитоскелета, GLT-1 – мембранный белок). В целом, такого рода данные могут быть использованы для исследования структурно-функциональных особенностей распределения двух белков в разных физиологических и патологических состояниях.
Рис. 1.
Визуализация GFAP и GLT-1 в одном из астроцитов гиппокампа крысы с помощью плагина GDSC в пределах одного оптического среза толщиной 0.3 мкм. а – GFAP (пурпурный), б – GLT-1 (желтый), в – области колокализации астроцитарных GFAP и GLT-1 (синий), г – объединенное изображение GFAP, GLT-1 и колокализованных пикселей.
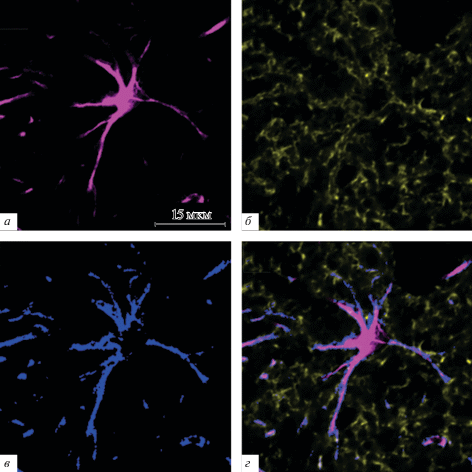
Таблица 1.
Значения коэффициентов колокализации, рассчитанные в плагине GDSC для изображений с двойным иммуномечением GFAP и GLT-1
| Коэффициент колокализации | Значения коэффициентов |
|---|---|
| Коэффициент Пирсона | 0.15 ± 0.07 |
| Коэффициент Мандерса для GFAP | 0.63 ± 0.18 |
| Коэффициент Мандерса для GLT-1 | 0.22 ± 0.29 |
| Общий объем колокализованных пикселей | 0.09 ± 0.17 |
Описанный подход к анализу изображений позволяет получить количественную информацию о колокализации исследуемых белков, что представляет возможность для оценки структурно-функционального состояния отдельных астроцитов. Тем не менее, этот метод имеет значительный недостаток, связанный со сложностью интерпретации промежуточных значений используемых коэффициентов Пирсона и Мандерса. В целом, количественные параметры описанного подхода позволяют получить информацию о перекрывающихся пикселях исследуемых маркеров, но не о пространственных характеристиках, таких как объем, площадь поверхности и т.д. Подобные недостатки ограничивают применение двухмерного подхода к анализу изображений сложно организованных биологических объектов, что требует использования трехмерного подхода, который их устраняет.
3D анализ. Изображения, подвергавшиеся пре-процессингу, далее проходили процедуру сегментации в дополнительном плагине ImageJ 3D Suite. К настоящему времени разработаны различные алгоритмы сегментации, что позволяет при выборе алгоритма учитывать особенности распределения маркеров (Bolte, Cordelieres, 2006; Heck et al., 2015; Sigal et al., 2015). В данной работе, принимая во внимание особенности распределения белков GLT-1 (мембранный белок) и GFAP (белок цитоскелета), применяли разные алгоритмы сегментации. Так, изображения с реакцией на GLT-1 сегментировали с использованием точечной сегментации (“spot segmentation”), что позволяет более правильно определять кластеры транспортеров глутамата. В то время как для цитоплазматического белка GFAP применяли алгоритм простой сегментации (“simple segmentation”), в результате чего отростки лучше выявлялись. Сегментированные изображения анализировали в плагине DiAna в ImageJ (Gilles et al., 2017). Плагин позволяет получить значения объема колокализованных вокселей (объем, занимаемый вокселями, которые располагаются в одном и том же объеме пространства в обоих каналах, нормализованных к общему объему вокселей одного канала): общий объем колокализованных вокселей в обоих каналах (составил 0.053 ± 0.05%), объем колокализованных вокселей для каждого из каналов (для GFAP 0.05 ± 0.05%, для GLT-1 31.86 ± 41.42%). Использование этих параметров позволяет косвенно судить об объеме, который занимает изучаемый белок, а также об изменениях соотношения маркеров в ткани. Также изменения в объеме колокализованных вокселей могут свидетельствовать о перераспределении наблюдаемых белков. Кроме того, рассчитываются значения объема и площади поверхности для маркеров обоих каналов (объем GFAP в ткани 925.62 ± 1035.6 мкм3, площадь поверхности GFAP 8074.31 ± 6929.66 мкм2, объем GLT-1 1543.96 ± 1499.9 мкм3, площадь поверхности GLT-1 19723.64 ± 40917.76 мкм2). Более того, для белков с преимущественно кластерным распределением актуально использование параметра объема и количества кластеров (объем кластера GTL-1 0.16 ± 0.15 мкм3, количество кластеров GLT-1 86.38 ± ± 76.49 на 125 мкм3) (рис. 2б), что также может являться важным физиологическим показателем. Исследованные параметры, в отличие от двухмерного подхода, позволяют оценить пространственные характеристики исследуемых маркеров в норме (объем, площадь поверхности исследуемых маркеров ткани, объем и количество кластеров), что может быть использовано в дальнейшем для сравнительного исследования при патологических состояниях. При использовании различных алгоритмов сегментации важно учитывать характер распределения маркера, так, при использовании точечной сегментации для цитоплазматических белков можно получить артефактные изменения в толщине и форме отростков. Поэтому необходимо подбирать метод сегментации в соответствии с характером цитологического объекта. Для графического представления полученных в результате трехмерного анализа изображений возможно применение программы Blender, имеющей более широкие возможности для трехмерного реконструирования, чем базовая программа ImageJ (рис. 2). Таким образом, использование трехмерного подхода к анализу изображений позволяет получить свидетельства функционального состояния рассматриваемых маркеров, что может быть использовано как при исследовании нормального морфофункционального состояния мозга, так и его патологический изменений.
Рис. 2.
Трехмерная реконструкция астроцита гиппокампа из оптических срезов в программе Blender. Для создания изображения был использован z-стек размером 40 × 40 × 4 мкм. а – Трехмерная реконструкция на основе реакции на GFAP, б – реконструкция на основе распределения глутаматных транспортеров, в – трехмерная визуализация колокализованных вокселей, г – совмещенное изображение для обоих маркеров (GFAP и GLT-1).
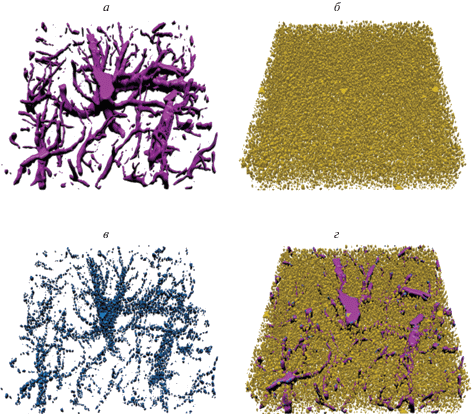
Описанный трехмерный подход, в отличие от двухмерного, позволяет получить информацию не только о колокализации исследуемых маркеров, но и о пространственных характеристиках изучаемых объектов. В частности, используемый алгоритм анализа позволяет рассчитать площадь поверхности изучаемого объекта и объем, занимаемый анализируемым маркером. Более того, для белков с кластерным распределением возможно получение информации о количестве и размерах кластеров. Учитывая то, что трехмерный подход показал информативность при анализе распределения как цитоплазматического, так и мембранного астроцитарных маркеров, можно заключить, что использование подобных маркеров и при исследованиях других клеток нервной системы окажется перспективным.
Полученные результаты свидетельствуют о том, что использование многомаркерной конфокальной микроскопии в сочетании с современными методами 2D и 3D анализа позволяет увеличить объем информации о структурно-функциональной организации астроцитов центральной нервной системы в дополнение к традиционным методам морфометрического анализа. На основании проведенного исследования можно заключить, что для исследования сложноорганизованных цитологических структур, к которым относятся и астроциты, предпочтительнее выбирать трехмерные алгоритмы анализа. Несомненным преимуществом представленного подхода является использование общедоступного программного обеспечения, которое широко используется исследователями, что обеспечивает определенный уровень стандартизации морфологических подходов, необходимый для сопоставления данных, получаемых различными научными группами.
Список литературы
Ведяйкин А.Д., Ходорковский М.А., Вишняков И.Е. 2019. Методы флуоресцентной микроскопии сверхвысокого разрешения и их использование для визуализации различных клеточных структур. Цитология. Т. 61. № 5 С. 343. (Vedyaykin A.D., Khodorkovskii M.A., Vishnyakov I.E. 2019. Super-resolution microscopy methods and their use for visualization of various cell structures. Tsitologiya. V. 61. № 5. P. 343.)
Штейн Г.И. 2007. Руководство по конфокальной микроскопии. СПб: Институт цитологии РАН. (Stein G.I. 2007. Guide to confocal microscopy. SPb: Institute of Cytology RAS.)
Adler J., Parmryd I. 2010. Quantifying colocalization by correlation: The pearson correlation coefficient is superior to the Mander’s overlap coefficient. Cytom. Part A. V. 77. P. 733.
Baber Z., Haghighat N. 2010. Glutamine synthetase gene expression and glutamate transporters in C6-glioma cells. Metab. Brain Dis. V. 25. P. 413.
Benediktsson A.M., Marrs G.S., Tu J.C., Worley P.F., Rothstein J.D., Bergles D.E., Dailey M.E. 2012. Neuronal activity regulates glutamate transporter dynamics in developing astrocytes. Glia. V. 60. P. 175.
Bernardinelli Y., Muller D., Nikonenko I. 2014. Astrocyte-synapse structural plasticity. Neural. Plast. V. 2014. https://doi.org/10.1155/2014/232105
Bolte S., Cordelieres F.P. 2006. A guided tour into subcellular colocalisation analysis in light microscopy. J. Microsc. V. 224. P. 213.
Calì C., Baghabra J., Boges D.J., Holst G.R., Kreshuk A., Hamprecht F.A., Srinivasan M., Lehväslaiho H., Magistretti P.J. 2016. Three-dimensional immersive virtual reality for studying cellular compartments in 3D models from EM preparations of neural tissues. J. Comp. Neurol. V. 524. P. 23.
Costes S. V., Daelemans D., Cho E.H., Dobbin Z., Pavlakis G., Lockett S. 2004. Automatic and quantitative measurement of protein-protein colocalization in live cells. Biophys. J. V. 86. P. 3993.
Emsley J.G., Macklis J.D. 2006. Astroglial heterogeneity closely reflects the neuronal-defined anatomy of the adult murine CNS. Neuron Glia Biol. V. 2. P. 175.
Gibbons M.B., Smeal R.M., Takahashi D.K., Vargas J.R., Wilcox K.S. 2013. Contributions of astrocytes to epileptogenesis following status epilepticus: Opportunities for preventive therapy. Neurochem. Int. V. 3. P. 660.
Gilles J.-F., Dos Santos M., Boudier T., Bolte S., Heck N. 2017. DiAna, an ImageJ tool for object-based 3D co-localization and distance analysis. Methods. V. 115. P. 55.
Hancock S.M., Finkelstein D.I., Adlard P.A. 2014. Glia and zinc in ageing and alzheimer’s disease: A mechanism for cognitive decline. Front. Aging Neurosci. V. 6. https://doi.org/10.3389/fnagi.2014.00137
Heck N., Dos Santos M., Amairi B., Salery M., Besnard A., Herzog E., Boudier T., Vanhoutte P., Caboche J. 2015. A new automated 3D detection of synaptic contacts reveals the formation of cortico-striatal synapses upon cocaine treatment in vivo. Brain Struct. Funct. V. 220. P. 2953.
Herbert A.D., Carr A.M., Hoffmann E. 2014. FindFoci: A focus detection algorithm with automated parameter training that closely matches human assignments, reduces human inconsistencies and increases speed of analysis. PLoS One. V. 9. P. 344
Hubbard J.A., Szu J.I., Yonan J.M., Binder D.K. 2016. Regulation of astrocyte glutamate transporter-1 (GLT1) and aquaporin-4 (AQP4) expression in a model of epilepsy. Exp. Neurol. V. 283. P. 85.
Jonkman J., Brown C.M., Wright G.D., Anderson K.I., North A.J. 2020. Tutorial: guidance for quantitative confocal microscopy. Nat. Protoc. V. 15. P. 1585.
Korzhevskii D.E., Sukhorukova E.G., Kirik O.V., Grigorev I.P. 2015. Immunohistochemical demonstration of specific antigens in the human brain fixed in zinc-ethanol-formaldehyde. Eur. J. Histochem. V. 59. P. 5.
Kraus F., Miron E., Demmerle J., Chitiashvili T., Budco A., Alle Q., Matsuda A., Leonhardt H., Schermelleh L., Markaki Y. 2017. Quantitative 3D structured illumination microscopy of nuclear structures. Nat. Protoc. V. 12. P. 1011.
Kulijewicz-Nawrot M., Syková E., Chvátal A., Verkhratsky A., Rodríguez J.J. 2013. Astrocytes and glutamate homoeostasis in Alzheimer’s disease: A decrease in glutamine synthetase, but not in glutamate transporter-1, in the prefrontal cortex. ASN Neuro. V. 5. P. 273.
Lagache T., Sauvonnet N., Danglot L., Olivo-Marin J.-C. 2015. Statistical analysis of molecule colocalization in bioimaging. Cytom. Part A. V. 87. P. 568.
Manders E.M., Verbeek F.J., Aten J.A. 1993. Measurement of co-localization of objects in dual-colour confocal images. J. Microsc. V. 169. P. 375.
Murphy-Royal C., Dupuis J., Groc L., Oliet S.H.R. 2017. Astroglial glutamate transporters in the brain: Regulating neurotransmitter homeostasis and synaptic transmission. J. Neurosci. Res. V. 95. P. 2140.
Murphy-Royal C., Dupuis J.P., Varela J.A., Panatier A., Pinson B., Baufreton J., Groc L., Oliet S.H.R. 2015. Surface diffusion of astrocytic glutamate transporters shapes synaptic transmission. Nat. Neurosci. V. 18. P. 219.
Papageorgiou I.E., Valous N.A., Lahrmann B., Janova H., Klaft Z., Koch A., Schneider U.C., Vajkoczy P., Heppner F.L., Grabe N., Halama N., Heinemann U., Kann O. 2018. Astrocytic glutamine synthetase is expressed in the neuronal somatic layers and down-regulated proportionally to neuronal loss in the human epileptic hippocampus. Glia. V. 66. P. 920.
Pekny M., Pekna M. 2014. Astrocyte reactivity and reactive astrogliosis: Costs and benefits. Physiol. Rev. V. 94. P. 1077.
Ramírez O., García A., Rojas R., Couve A., Härtel S. 2010. Confined displacement algorithm determines true and random colocalization in fluorescence microscopy. J. Microsc. V. 239. P. 173.
Rizk A., Paul G., Incardona P., Bugarski M., Mansouri M., Niemann A., Ziegler U., Berger P., Sbalzarini I.F. 2014. Segmentation and quantification of subcellular structures in fluorescence microscopy images using Squassh. Nat. Protoc. V. 9. P. 586.
Rodríguez-Arellano J.J., Parpura V., Zorec R., Verkhratsky A. 2016. Astrocytes in physiological aging and Alzheimer’s disease. Neuroscience. V. 323. P. 170.
Sigal Y.M., Speer C.M., Babcock H.P., Zhuang X. 2015. Mapping synaptic input fields of neurons with super-resolution imaging. Cell. V. 163. P. 493.
Sukhorukova E.G., Korzhevskii D.E., Alekseeva O.S. 2015. Glial fibrillary acidic protein: The component of intermediate filaments in the vertebrate brain astrocytes. J. Evol. Biochem. Phys. V. 51. P. 1.
Takahashi D.K., Vargas J.R., Wilcox K.S. 2010. Increased coupling and altered glutamate transport currents in astrocytes following kainic-acid-induced status epilepticus. Neurobiol. Dis. V. 40. P. 573.
Verkhratsky A., Rodríguez J.J., Parpura V. 2014. Neuroglia in ageing and disease. Cell Tissue Res. V. 357. P. 493.
Verkhratsky A., Zorec R., Rodriguez J.J., Parpura V. 2016. Pathobiology of neurodegeneration: The role for astroglia. Opera Med. Physiol. V. 2. P. 1.
Wang W., Kiyoshi C.M., Du Y., Ma B., Alford C.C., Chen H., Zhou M. 2016. mGluR3 activation recruits cytoplasmic TWIK-1 channels to membrane that enhances ammonium uptake in hippocampal astrocytes. Mol. Neurobiol. V. 53. P. 6169.
Yayon N., Dudai A., Vrieler N., Amsalem O., London M., Soreq H. 2018. Intensify3D: Normalizing signal intensity in large heterogenic image stacks. Sci. Rep. V. 8. https://doi.org/10.1038/s41598-018-22489-1
Zinchuk V., Grossenbacher-Zinchuk O. 2009. Recent advances in quantitative colocalization analysis: Focus on neuroscience. Prog. Histochem. Cytochem. V. 44. P. 125.
Zinchuk V., Wu Y., Grossenbacher-Zinchuk O. 2013. Bridging the gap between qualitative and quantitative colocalization results in fluorescence microscopy studies. Sci. Rep. V. 3. https://doi.org/10.1038/srep01365
Дополнительные материалы отсутствуют.


