Цитология, 2021, T. 63, № 4, стр. 363-372
Дифференциальная регуляция BBC3/PUMA и PMAIP1/Noxa при ионизирующем излучении: роль p53
О. А. Кучур 1, *, П. Д. Кучур 1, Д. О. Кузьмина 1, А. В. Завирский 2, А. А. Штиль 1, 3
1 Химико-биологический кластер Санкт-Петербургского национального исследовательского университета информационных технологий, механики и оптики
197101 Санкт-Петербург, Россия
2 Военно-медицинская академия им. С.М. Кирова
194044 Санкт-Петербург, Россия
3 Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина
115478 Москва, Россия
* E-mail: kuchur@scamt-itmo.ru
Поступила в редакцию 02.04.2021
После доработки 14.04.2021
Принята к публикации 15.04.2021
Аннотация
Транскрипционный фактор р53 – важнейший сенсор ионизирующего излучения. Среди многочисленных эффекторов p53 – гены ВВС3 и PMAIP1, кодирующие проапоптотические белки PUMA и Noxa соответственно, а также ингибитор клеточного цикла CDKN1A/р21. Эффективность лучевого воздействия – гибель клеток или выживание – определяется балансом механизмов, регулируемых этими белками. В настоящей работе на изогенных линиях опухолевых клеток человека (карцинома кишки НСТ116 и сублиния НСТ116р53КО с нефункционирующим р53) установлена преимущественная роль ВВС3/PUMA и CD-KN1A/р21 по сравнению с PMAIP1/Noxa в р53-опосредованных ответах на действие терапевтических доз γ-излучения. Биоинформатический анализ полногеномных нуклеотидных последовательностей выявил существенные различия предположительных мотивов связывания р53 в структуре генов ВВС3 и PMAIP1. Полученные результаты важны для разработки таргетных воздействий, позволяющих сохранить р53-зависимую активацию проапоптотических генов при ограничении блокирования клеточного цикла в облученных опухолевых клетках.
Более полувека лучевая терапия сохраняет важнейшее место в лечении больных злокачественными новообразованиями. Проблемой, ограничивающей эффективность ионизирующего излучения, остается радиоустойчивость опухолей – долговременное выживание клеток, переживших однократное воздействие. Требуется идентификация молекулярных механизмов, определяющих выживание и гибель облученных клеток.
Многочисленными исследованиями доказана ключевая роль повреждений ДНК и активации транскрипционного фактора p53 (кодируется геном Тр53) – одного из ранних событий, определяющих жизнеспособность облученных клеток (Gajjar et al, 2012; Maréchal, Zou, 2013; Speidel, 2015). Каскады молекулярных событий, опосредованные р53, могут индуцировать апоптоз. Среди эффекторов p53-зависимого апоптоза существенное значение имеют белки PUMA (p53 up-regulated modulator of apoptosis) и Noxa (от лат. “повреждение”). PUMA образует комплекс с анти-апоптотическими белками семейства Bcl-2: Bcl-xL, Bcl-2, Mcl-1, Bcl-w и Bfl-1/A1. В результате комплексообразования остаются свободными проапоптотические белки Bax и Bak, опосредующие гибель клеток в ответ на повреждающие воздействия (Nakano, Vousden, 2001). Noxa также образует комплексы с белками семейства Bcl-2, но партнеров у Noxa меньше: Mcl-1, Bfl-1/A1; к последнему белку аффинность Noxa мала (Chen et al., 2005; Ploner et al., 2008). Гены BBC3 (PUMA) и PMAIP1 (Noxa) – транскрипционные мишени р53 (Hemann, Lowe, 2006). Нокаут Тр53, BBC3 или PMAIP1 приводил к ограничению апоптоза и становлению радиоустойчивости в клетках различного видового и тканевого происхождения (Vavrova, Rezacova, 2014), а также в моделях in vivo (Leibowitz, 2011).
Наряду с индукцией гибели, активация p53 в облученных клетках может индуцировать белок р21 (кодируется геном CDKN1A) – ингибитор нескольких циклин-зависимых киназ. Это приводит к блокированию прохождения фазы G1 клеточного цикла, после чего клетки получают возможность репарировать повреждения в контрольной точке (Kreis, 2014). Зависимая от р53 регуляция баланса выживание−гибель в ответ на облучение оказывается двоякой: клетки с функционирующим р53 задерживаются в фазе G1 и могут избежать гибели, а р53-негативные клетки такой возможности не имеют, проходят контрольную границу фаз клеточного цикла G1/S с невосстановленными повреждениями, продолжают продвигаться по циклу и погибают (“митотическая катастрофа”) (Broude, 2008).
В настоящей работе исследована роль р53 в регуляции генов BBC3, PMAIP1 и CDKN1A. Для решения поставленной задачи использованы изогенные линии клеток человека, отличающиеся статусом р53: исходным или генетически инактивированным.
По результатам экспериментов и биоинформатического анализа нуклеотидных последовательностей установлены существенные различия молекулярных механизмов ответа клеток на облучение и неодинаковую роль р53 в регуляции отдельных генов. В облученных р53-положительных клетках преобладают р53-зависимая активация генов BCC3 и CDKN1A, что сопровождается увеличением количества белков PUMA и р21. Напротив, активация гена PMAIP1 и прирост белка Noxa не выявлены. Для усиления гибели клеток с интактным р53 требуется дополнительная активация PMAIP1 и (или) ограничение индукции CDKN1A. В клетках с нефункционирующим р53 гены BCC3, PMAIP1 и CDKN1A лучевыми воздействиями не регулируются.
МАТЕРИАЛ И МЕТОДИКА
Реагенты и клетки. Использовали реактивы фирмы Sigma-Aldrich, кроме особо оговоренных случаев. Линию клеток карциномы толстой кишки человека HCT116 с исходным р53 (American Type Culture Collection, США) и изогенную сублинию HCT116p53KO (получена в лаборатории B. Vogelstein, университет Джонса Хопкинса, Балтимор, США (Bunz et al., 1998); предоставлена авторам др-ом Б. П. Копниным), в которой рамка считывания гена р53 удалена в результате гомологической рекомбинации, культивировали в модифицированной Дульбекко среде Игла, содержащей 2 мМ L-глутамина (Биолот, Россия), 5% сыворотки эмбриона теленка (HyClone, США) и 50 мкг/мл гентамицина (Биолот, Россия) при 37°С, 5% CO2. В экспериментах использовали клетки в логарифмической фазе роста, культивируемые не более 15 пассажей.
Воздействие ионизирующим излучением. Клетки рассевали во флаконы с площадью поверхности 25 см2 (Eppendorf, Германия) за 24–48 ч до экспериментов и облучали γ-фотонами на аппарате РУМ-17 (Мосрентген, Россия). Разовые дозы 4 Гр и 10 Гр сопоставимы с используемыми в клинике. Параметры облучения: напряжение на трубке 180 кВ, ток 10 мА, фокусное расстояние 50 см, фильтр 1 мм Al; 0.5 мм Cu, мощность дозы 0.32 Гр/мин. Для валидации значений использовали дозиметрический контроль (дозиметр ИД-11, Россия).
Анализ экспрессии генов p53, p21, BBC3 (PUMA) и PMAIP1 (Noxa). После облучения клетки культивировали 3–24 ч при 37°С, 5% CO2 и лизировали реагентом Extract RNA (Евроген, Россия). Экстракцию тотальной РНК и обратную транскрипцию (ревертаза MMLV) проводили согласно инструкции производителя. Полимеразную цепную реакцию (ПЦР) проводили в реальном времени (qPCRmix-HS SYBR; Евроген). Нуклеотидные последовательности праймеров: для Tp53 прямой 5'-GAGCTGAATGAGGCCTTGGA-3' и обратный 5'-CTGAGTCAGGCCCTTCTGTCTT-3'; для р21 прямой 5'-AGTCAGTTCCTTGTGGAGCC-3' и обратный 5'-CATTAGCGCATCACAGTCGC-3'; для PUMA прямой 5'-ACAGTATCTTACAGGCTGGG-3' и обратный 5'-CAGACTGTGAATCCTGTGCT-3'; для Noxa прямой 5'-CCAGCCGCCCAGTCTAATCA-3' и обратный 5'-GTGCCCTTGGAAACGGAAGA-3'. Для соотнесения сигналов (нормализации) использовали кДНК GAPDH; праймеры для GAPDH: прямой 5'-CCATCACCATCTTCCAGGAGCG-3' и обратный 5'-AGAGATGATGACCCTTTTGGC-3'.
Иммуноблотинг. Необлученные (контроль) и облученные клетки лизировали в буфере, содержащем 150 мM NaCl, 1% NP-40, 0.1% SDS, 50 мM Tris pH 8.0 с добавлением фенилметилсульфонилфторида и смеси ингибиторов протеиназ. Концентрацию общего белка в лизатах определяли методом Брэдфорда (Bradford, 1976). Электрофоретическое разделение белков проводили в 12%-ном полиакриламидном геле с додецилсульфатом натрия при напряжении 120–140 мВ. Белки переносили на нитроцеллюлозную мембрану (GE Healthcare Amersham, США; 250 мА, 1.5 ч). Использовали первичные антитела (Cell Signaling, США) к p53, p21, PUMA и Noxa (разведения 1 : 1000). В качестве контроля использовались антитела к β-актину в разведении 1 : 2000. Для хемилюминесцентной визуализации белков использовали вторичные антитела к IgG мыши или кролика (Amersham, США), конъюгированные с пероксидазой хрена (1 : 5000–1 : 10 000). Визуализацию проводили в растворе ECL и документировали с помощью системы ChemiDoc Touch (BioRad, США). Денситометрию проводили в программе ImageJ, инструментом Grey Mean Value Calculation.
Биоинформатический анализ. Исследовали предполагаемые нуклеотидные последовательности, содержащие мотивы связывания транскрипционного фактора р53 с промоторными областями генов BBC3/PUMA и PMAIP1/Noxa. В качестве входных данных программы принимали нуклеотидные последовательности генов: BBC3 (ENSG00000105327) и PMAIP1 (уникальный идентификатор ENSG00000141682) из раздела Sequence сайта ensembl. Размер промоторов (600 нуклеотидов) соответствовал стандарту. Достоверность нуклеотидных последовательностей промоторных областей подтверждали проверкой соответствующих областей в базе GenomeBrowser (https://www.ensembl.org/index.html).
Поиск мотивов осуществляли с помощью программы FIMO (find individual motif occurrences) из набора инструментов MEME (Grant et al., 2011) с опорой на базу данных HOCOMOCOv11_full_HUMAN_mono_meme_format. На начальном этапе в качестве исходных были заданы последовательности только промоторных областей генов BBC3 и PMAIP1. Затем поиск мотивов осуществляли по всему гену, включая экзоны и интроны. Полученные мотивы дополнительно проанализированы инструментами MATCH (Kel et al., 2003) и PROMO (Farré et al., 2003). У мотивов, предсказанных PROMO, вероятность несовпадения 5%. Мотивы, идентифицированные программой MATCH, обнаружены при следующих параметрах анализа: поиск по базам данных мотивов, обладающих специфичностью для клеточного цикла позвоночных. Из предсказанных последовательностей отобраны мотивы, имеющие сходство не менее 0.95 с мотивами из баз. Далее использовали программы FIMO MEME для идентификации мотивов потенциальных транскрипционных факторов, связывающихся с промоторными областями генов. Дополнительно предсказаны мотивы связывания р53 с полноразмерными генами BBC3 и PMAIP1.
Статистическая обработка. Данные ПЦР (3 повтора экспериментов) обрабатывали с помощью программы Microsoft Excel 2016. Результаты представлены в виде средних значений и стандартных отклонений. Достоверность различий определялась однофакторным тестом ANOVA при p ≤ 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Экспрессия генов Tp53, CDK1NA, BBC3 и PMAIP1 в зависимости от дозы облучения и статуса p53. Анализ мРНК с помощью ПЦР в реальном времени показал, что активация Tp53 в клетках НСТ116 происходит в первые часы после облучения и достигает максимума через 12 ч (усиление приблизительно в 9 раз при облучении 4 Гр и в 13 раз в ответ на 10 Гр по сравнению с необлученными клетками). Через 24 ч после облучения экспрессия Tp53 несколько снижалась: приблизительно в 7 (4 Гр) и 9 раз (10 Гр) (рис. 1а). В сублинии НСТ116р53КО (с нокаутированным р53) незначительный специфический сигнал определялся на 32−34 циклах (данные не представлены).
Рис. 1.
Изменения во времени экспрессии генов Tp53, CDKN1A, BBC3 и PMAIP1 в ответ на облучение в дозе 4 Гр (белые столбцы) и 10 Гр (черные столбцы) в клетках исходной линии HCT116 (а) и сублинии HCT116p53KO с инактивированным p53 (б). По горизонтали – время, ч. Контроль – необлученные клетки (экспрессия принята за 1). Представлены средние значения из 3-х экспериментов и доверительные интервалы (вертикальные отрезки). Для нормализации использовали транскрипты гена GAPDH. Во всех группах отличия от контроля достоверны при p ≤ 0.05 (однофакторный ANOVA).
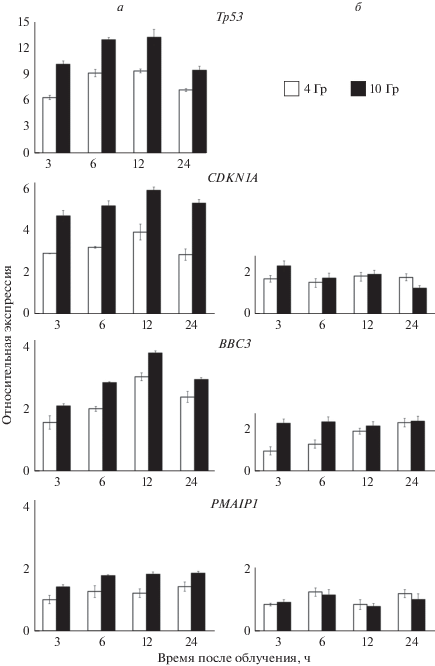
Ген CDK1NA, кодирующий белок p21, играет важнейшую роль в ответе клеток на повреждения ДНК, в том числе при ионизирующем излучении (Huerta et al., 2013). Этот ген – транскрипционная мишень p53. Характер активации CDK1NA в облученных клетках схож с таковым для Tp53: максимум достигается к 12 ч (рис. 1а). В это время увеличение мРНК CDK1NA достигает 4–6 раз. К 24 ч мРНК CDK1NA снижалась на ~20% от контрольных значений. Напротив, в сублиниии с нефункционирующим p53 CDKN1A слабо отвечал на облучение (рис. 1б).
Регуляция экспрессии генов семейства Bcl-2 – BBC3 (PUMA) и PMAIP1 (Noxa) – опосредована фактором р53 (Kim et al., 2019). В ответ на облучение клеток НСТ116 относительное количество мРНК BBC3 увеличивалось одновременно с повышением мРНК Tp53, достигая 3–4-кратного подъeма к 12 ч. К 24 ч мРНК BBC3 снижалась, однако превышала контрольные значения в ~2–3 раза (рис. 1а). Ген BBC3 практически не экспрессируется в сублинии НСТ116р53КО; в облученных клетках уровень мРНК BBC3 превышал контрольный не более, чем в 1.5 раза (рис. 1б). Низкий базальный уровень экспрессии BBC3 в сублинии НСТ116р53КО можно объяснить р53-независимыми механизмами (Fernandez-Zapico et al., 2011; Valentino, 2013).
Индукция гена PMAIP1 в клетках выражена слабее, чем индукция BBC3. В линии НСТ116 PMAIP1 практически не отвечает на облучение в дозе 4 Гр; даже при действии дозы 10 Гр активация этого гена не превышает 2-кратный уровень. В сублинии HCT116p53KO зависимости относительного содержания мРНК PMAIP1 от времени и дозы не наблюдается (рис. 1а, б). Таким образом, гены Tp53, CDK1NA и BBC3 следует считать р53-зависимыми сенсорами ответа клеток на ионизирующее излучение, тогда как ген PMAIP1 рефрактерен даже для “сверхсильного” (10 Гр) стимула.
Влияние облучения и статуса гена Tp53 на индукцию белков p53, p21, PUMA и Noxa. Как соотносятся уровни мРНК исследуемых генов с количествами соответствующих белков в ответ на облучение клеток с различным статусом р53? Результаты иммуноблотинга через 3–24 ч после облучения клеток НСТ116 и НСТ116р53КО (4 Гр и 10 Гр) показаны на рис. 2. Белок p53 активируется дозозависимым образом в первые 3–6 ч, достигает максимума, превышающего контроль в ~3 и ~6 раз для дозы 4 и 10 Гр соответственно, после чего снижается до 3-часовых значений (по результатам денситометрии полос иммуноблота). Изменения p21 схожи с таковыми для p53; выраженность прироста р21 значительно ниже (в ~2–3 раза даже для дозы 10 Гр), однако и через 24 ч количество р21 остается повышенным. В сублинии HCT116p53KO p53 не определяется; уровень p21 в ответ на облучение практически не изменяется.
Рис. 2.
Количество белков p53, p21, PUMA и Noxa в клетках НСТ116 и НСТ116р53КО после облучения в дозе 4 и 10 Гр. Иммуноблотинг. Вверху указано время после облучения, ч. В качестве контроля нанесения белков на гель использовали β-актин.
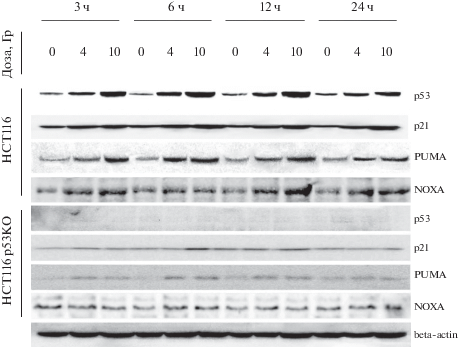
Количество белка PUMA в облученных клетках HCT116 изменяется в соответствии с нарастанием p53; важно, что PUMA нарастает уже в первые часы после облучения. В сублинии HCT116р53КО выявлены лишь следовые количества PUMA. Наконец, количество Noxa не зависело от доз облучения и статуса р53 (рис. 2).
Биоинформатический анализ регуляции BBC3 и PMAIP1. В начале поиска нуклеотидных последовательностей, несущих мотивы узнавания р53, мы предположили, что этот транскрипционный фактор связывается с промоторными областями генов PUMA и Noxa. Поэтому на первом этапе анализа рассмотрены только последовательности этих промоторов.
Оценка вхождений мотивов связывания р53. Поиск вхождений мотивов связывания р53 с PMAIP1 и BBC3 (с помощью FIMO) предсказал пять последовательностей P53_HUMAN.H11MO.1.A в промоторной области PMAIP1 (табл. 1) и отсутствие таковых в промоторе BBC3. Согласно принятым стандартам, достоверными можно считать мотивы с p-value ≤ 0.05 и q-value ≤ 0.05, т.е. вероятность ложноположительного вхождение мотива справедлива для 5% случаев. Чем меньше величины p-value и q-value, тем выше достоверность предсказанного мотива. Обнаружено 3 мотива, удовлетворяющих статистическим оценкам вероятности (обозначены символами А, Б, В; табл. 1). Анализ MATCH выявил один мотив узнавания р53 в промоторе PMAIP1 и отсутствие мотивов в промоторе BBC3. Обнаруженный мотив ggGCAGGtcg гена PMAIP1 совпадает с мотивом CGACCTGCCCGGACACGCTC, предсказанным программой FIMO, с учетом направления цепи ДНК.
Поскольку мотивы связывания р53 с промотором BBC3 не выявлены, на следующем этапе нами учтены полноразмерные последовательности генов: промоторные области, все интроны и экзоны. В табл. 2 приведены мотивы, статистические показатели вхождения которых удовлетворяют диапазонам q-value ≤ 0.05 и p-value ≤ 0.05. Из табл. 1 и 2 видно, что некоторые мотивы, предсказанные для промоторной области PMAIP1, оказались ложноположительными и повысили значение q-value на более длинном протяжении гена. Таким образом, достоверно предсказано наличие только одного мотива (А) связывания р53 в гене PMAIP1, и этот мотив А локализуется в промоторе (табл. 2).
Таблица 1.
Статистические показатели мотивов р53 (А–Д), предсказанных программой FIMO для промоторной области гена PMAIP1
| Мотив (символ) |
Последовательность предсказанного мотива | Направление цепи | p-Value | q-Value |
|---|---|---|---|---|
| А | CGACCTGCCCGGACACGCTC | 3′–5′ | 2.4e-06 | 0.0026 |
| Б | GAGCGTGTCCGGGCAGGTCG | 5′–3′ | 2.7e-05 | 0.0147 |
| В | AGACTTGGGTAAACAAGCCC | 3′–5′ | 6.19e-05 | 0.0225 |
| Г | AAACAAGCCCAGA | 3′–5′ | 6.51e-05 | 0.0504 |
| Д | GAGCGTGTCCGGG | 5′–3′ | 9.17e-05 | 0.0504 |
Таблица 2.
Статистические показатели мотивов р53 (А–Д), предсказанных FIMO для полноразмерных генов PMAIP1 и BBC3
| Ген PMAIP1 | ||||
|---|---|---|---|---|
| Мотив (символ) |
Последовательность предсказанного мотива | Направление цепи | p-Value | q-Value |
| А | CGACCTGCCCGGACACGCTC | 3′–5′ | 2.4e-06 | 0.0264 |
| Ген BBC3 | ||||
| Б | GGACATGCCTGGG | 3′–5′ | 8.55e-09 | 0.000214 |
| В | GGGTCTGCCCAGGCATGTCC | 5′–3′ | 3.09e-08 | 0.000772 |
| Г | CTGCAAGTCCTGACTTGTCC | 5′–3′ | 6.42e-07 | 0.00801 |
| Д | GGGCATGTTTGGG | 5′–3′ | 2.91e-06 | 0.0364 |
Для гена BBC3 связывание р53 с промотором не предсказано, но найдены два мотива в экзоне 1 (табл. 2, мотивы Б и В) и по одному в интронах 1 (табл. 2, мотив Г) и 2 (табл. 2, мотив Д). Результаты анализа MATCH выявили мотив узнавания р53 aggCATGTcc в области экзона 1 гена BBC3 и совпадение этого мотива с последовательностью GGGTCTGCCCAGGCATGTCC, указанной FIMO. Также MATCH выявил мотив tgaCTTGTcc, совпадающий с CTGCAAGTCCTGACTTGTCC в интроне 1 и мотив gggCGTGTct в интроне 2, не совпадающий с результатами FIMO.
Таким образом, программы FIMO и MATCH подтвердили вхождение двух мотивов р53 в экзоне 1 и одного мотива в интроне 1 гена BBC3. Поскольку эти мотивы найдены в противоположных цепях ДНК, при конвертировании GGACATGCCTGGG в (+)-направление обнаруживается полное совпадение со 2-м найденным мотивом GGGTCTGCCCAGGCATGTCC в экзоне 1. Следовательно, интрон 1 – место предпочтительного связывания р53 с геном BBC3.
Итак, в гене BBC3 (PUMA) сайт связывания р53 находится в экзоне 1. Напротив, р53 предположительно связывается с промотором PMAIP1 (Noxa). Различия в предсказанных сайтах связывания р53 не объясняют различий ответа каждого гена: при облучении в дозе 4 Гр активируется только ген BBC3 и накапливается белок PUMA (рис. 1, 2), а ген PMAIP1 индуцируется слабо и лишь при интенсивном воздействии (10 Гр). Требуется расширить анализ структуры обоих генов для выявления мотивов связывания других транскрипционных факторов.
Для предсказания мотивов связывания транскрипционных факторов с исследуемыми генами взяты последовательности их промоторов и экзона 1. Причина выбора таких районов – предсказанные мотивы связывания р53 в промоторе гена PMAIP1 и в экзоне 1 гена BBC3 (см. выше). Учитывались мотивы всех факторов с достоверностью предсказания (p‑value и q-value) выше, чем для р53. При обнаружении нескольких мотивов одного фактора в таблицу вносили мотив с наименьшими значениями p-value и q-value. (табл. 3).
Таблица 3.
Статистические показатели мотивов узнавания транскрипционных факторов, предсказанных FIMO
| Ген PMAIP1 | ||||
|---|---|---|---|---|
| Факторы/семейства | Паттерн | Мотив 5'–3' | p-Value | q-Value |
| Sp/KLF | SP1 SP4 KLF15 SP2 SP3 KLF16 KLF3 KLF6 KLF12 KLF1 |
GCGGGGCGGGGACAGGGGCGGG GGGACAGGGGCGGGGACAGG GGGGCGGGGACAGGGGCGG GGGACAGGGGCGGGGACAGGGG GGACAGGGGCGGGCCGGGCG CTGGGAGTGGCGGGAGGGG GGACAGGGGCGGGGACAGG ACAGGGGCGGGGACAGGGG CGGGGCGGGGA GGGGCGGGGACAGG |
8.3e-10 4.39e-09 5.11e-09 6.18e-09 3.32e-08 1.08e-07 2.85e-07 3.18e-07 1.15e-06 1.77e-06 |
3.82e-07 5.73e-06 3.17e-06 4.26e-06 1.7e-05 0.000123 0.000352 0.000237 0.000857 0.00125 |
| PATZ1 | PATZ1 | GGGGCGGGGACAGGGGCGGGGA | 4.81e-09 | 5.2e-06 |
| Белки “цинковых пальцев” | ZN467 ZN143 ZN341 ZF64A ZN770 ZN263 |
GGGGCGGGGACAGGGGCGGGGA GGGATGCTGGGATCGGGTGTCC CGGGGACAGGGGCGGGGACAGG AGAGCCCGGGAACCTC TGGAGGCTGAG GGGAGGAGAAGGGGGTCGGC |
8.23e-08 6.52e-07 7.21e-07 7.62e-07 7.94e-07 8.95e-07 |
9.87e-05 0.000923 0.000767 0.00067 0.00105 0.00113 |
| TBX | TBX1 TBX15 |
GCGGGGACAGGGGCGGGCCG TGGGAGTGGCGGGAGGGGA |
1.47e-07 6.77e-07 |
0.000164 0.000692 |
| MAZ | MAZ | GGAGCTGGGAGTGGCGGGAGGG | 1.66e-07 | 0.000116 |
| Z324A | Z324A | GATCCCAGCATCCCTGCCTGCAG | 3.3e-07 | 0.000398 |
| EGR | EGR2 EGR1 |
GCTGAGTGGGCGGCGG AGCTGAGTGGGCGGCGG |
4.19e-07 8.81e-07 |
0.000542 0.00124 |
| E2F | E2F7 E2F6 E2F1 |
GGGGCGGGGACAG GTGGCGGGAGGGG GAGTGGCGGGAGGG |
5.08e-07 6.47e-07 1.34e-06 |
0.000349 0.000784 0.00148 |
| SRBP2 | SRBP2 | GGGTGGGGAGAGA | 1.24e-06 | 0.00145 |
| p53 | P53 | CGACCTGCCCGGACACGCTC | 2.4e-06 | 0.00362 |
| Ген BBC3 | ||||
| ZN770 | ZN770 | GGGAGGCTGAGGCAGAAGACTT | 1.3e-09 | 1.86e-06 |
| p53 | P53 | GGACATGCCTGGG | 8.55e-09 | 1.39e-05 |
Предыдущие исследования (Ploner et al., 2008; Kuribayashi et al., 2011) и наши результаты указывают на второстепенную (в отличие от PUMA) роль Noxa в ответе клеток на ионизирующее излучение. Действительно, ген PMAIP1 активируется только при сильном (10 Гр) р53-активирующем воздействии; уровень активации невелик по сравнению с таковым у гена BBC3. Биоинформатический анализ указал на особенности, важные для интерпретации экспериментальных данных о дифференциальной роли р53 в регуляции BBC3 и PMAIP1. Требуется иммунопреципитация хроматина для суждения о функциональной значимости того или иного предсказанного мотива для транскрипционных ответов при облучении. Отметим, что возможных сайтов связывания р53 в гене BBC3 в 4 раза больше, чем в гене PMAIP1 (табл.2); можно предположить более высокую значимость р53-опосредованной регуляции BBC3. Выявлены различия в локализации сайтов связывания р53: у BBC3 экзоны, у PMAIP1 – промотор.
Исходя из предсказанных мотивов (табл. 3), количество транскрипционных факторов, связывающихся с промотором гена PMAIP1, намного превышает число таковых для промотора и экзона 1 гена BBC3. Это может означать, что регуляция экспрессии PMAIP1 и, следовательно, содержание белка Noxa осуществляются многочисленными механизмами, зависимыми и независимыми от р53. На рис. 3 представлены предсказанные мотивы связывания транскрипционных факторов в области промотора и экзона 1 гена PMAIP1.
Рис. 3.
Сайты связывания транскрипционных регуляторов с промоторной областью и экзоном 1 гена PMAIP1 (Noxa). Указаны индивидуальные белки или семейства, а также положения предсказанных мотивов их связывания с ДНК. Стрелка – сайт инициации транскрипции. Размеры последовательностей взяты из раздела Sequence базы данных Ensembl.
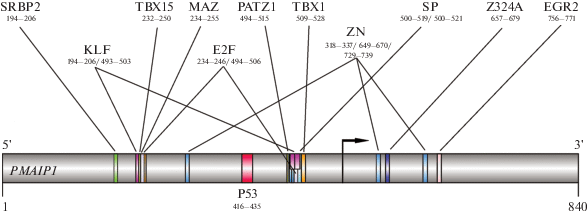
На клетках линии эмбриональных фибробластов мыши MEF и в модели in vivo показано, что белок PATZ1, имеющий сайт связывания с PMAIP1, способен конкурировать с р53 за связывание с ДНК и ингибировать функции р53 при повреждении ДНК (Fedele et al., 2005). Представители семейства транскрипционных белков SP/KLF, в частности KLF4, ингибируют р53-зависимую регуляцию гена р53 (Rowland et al., 2014). KLF5 связывается с р53, отменяя р53-зависимое подавление гена сурвивина; это способствует выживанию клеток острого лимфобластного лейкоза (Zhu et al., 2006). Таким образом, неэффективность р53-активирующего стимула может быть обусловлена взаимодействием p53 с белком (белками) семейства KLF. Рефрактерность гена PMAIP1 к р53-активирующим стимулам (например, ионизирующему излучению) может быть обусловлена тем, что среди белков семейства KLF немало репрессоров транскрипции, а промотор PMAIP1 богат сайтами связывания KLF/SP (табл. 3). Предположение о механизме трансрепрессии в регуляции р53-зависимых ответов согласуется со следующими данными: в линии эпителия молочной железы MCF10A Мyc-ассоциированный белок MAZ (из семейства “цинковых пальцев”) связывался с регуляторной областью р53 и ингибировал этот ген (Lee et al., 2016). Протеинкиназа Akt отменяла ингибирующий эффект MAZ, что указывает на возможности эпигенетической реактивации p53.
Можно ли активировать экспрессию PMAIP1 для усиления гибели р53-положительных клеток в ответ на стресс, в частности при комбинации с терапевтическими дозами ионизирующего излучения? В экспериментах с тепловым шоком в клетках меланомы (Davis et al., 2015) производное хинона – аурин – ингибировало белок теплового шока Hsp90α. Это сопровождалось падением мембранного потенциала митохондрий, индукцией массивного окислительного стресса, истощением глутатиона и активацией Noxa с последующей апоптотической гибелью. Такой подход не представляется перспективным для практического использования из-за отсутствия специфичности к PMAIP1/Noxa как внутриклеточной мишени.
Эярестатин I (Eeyarestatin I; EerI) блокирует деградацию белков при стрессе эндоплазматического ретикулума. В ответ на действие EerI в клетках накапливаются транскрипционные факторы семейства CREB/ATF, связывающиеся с промотором PMAIP1. Наряду с этим блокируется убиквитинирование гистона H2A – репрессора PMAIP1. В результате дерепрессия PMAIP1 и накопление Noxa обусловливают апоптоз (Wang et al., 2009). Однако для гибели клеток при стрессе эндоплазматического ретикулума р53 не обязателен (Nikiforov et al., 2007). Комбинирование такого вида стресса с облучением предусматривает вовлечение р53-независимых механизмов, что терапевтически оправдано. Вместе с тем, для гибели р53-позитивных клеток целесообразно использовать активацию этого важнейшего проапоптотического механизма (а при лучевом воздействии такая активация – одно из главных событий) и уменьшение р53-зависимых ответов, позволяющих клеткам пережить воздействие. К таким ограничивающим механизмам относится р53/р21-зависимая задержка клеточного цикла. Правомерно предположить, что селективная инактивация р21 (препятствие транскрипции гена CDKN1A или прицельная деградация белка с применением технологии PROTAC (Paiva, Crews, 2019)) позволят сохранять проапоптотические эффекты р53 и предотвращать блокирование клеточного цикла, что повысит чувствительность р53-положительных клеток к лучевым воздействиям.
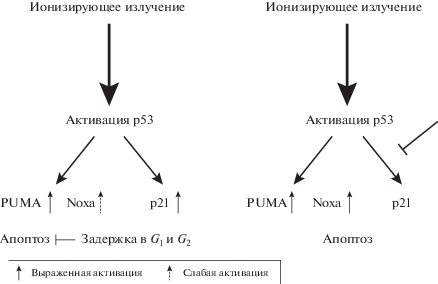
На рис. 4 представлены возможности использования р53-зависимой регуляции для повышения эффективности облучения опухолевых клеток.
Рис. 4.
Р53-зависимые ответы на лучевое воздействие: возможности усиления гибели клеток. Слева: активация р53 в ответ на облучение индуцирует разнонаправленные р53-зависимые механизмы (примеры: PUMA и р21). Гибель клеток лимитирована невысокой активацией других проапоптотических механизмов (пример: Noxa) и задержкой клеточного цикла. Справа: стратегия интенсификации апоптоза облученных клеток: реактивация проапоптотических генов (Noxa) и (или) предотвращение активации ингибитора клеточного цикла р21.
Список литературы
Bradford M.M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. V. 72. P. 248.
Broude E.V., Loncarek J., Wada I., Cole K., Hanko C., Roninson I.B., Swift M. 2008. Mitotic catastrophe in cancer therapy. Beyond Apoptosis: Cellular outcomes of cancer therapy. N.Y.: Informa Healthcare. P. 307.
Bunz F., Dutriaux A., Lengauer C., Waldman T., Zhou S., Brown J.P., Vogelstein B. 1998. Requirement for p53 and p21 to sustain G2 arrest after DNA damage. Science. V. 282. P. 1497.
Chen L., Willis S.N., Wei A., Smith B.J., Fletcher J.I., Hinds M.G., Huang D.C. 2005. Differential targeting of prosurvival Bcl-2 proteins by their BH3-only ligands allows complementary apoptotic function. Mol. Cell. V. 17. P. 393.
Davis A.L., Qiao S., Lesson J.L., De La Vega M.R., Park S.L., Seanez C.M., Wondrak G.T. 2015. The quinone methide aurin is a heat shock response inducer that causes proteotoxic stress and Noxa-dependent apoptosis in malignant melanoma cells. J. Biol. Chem. V. 290. P. 1623.
Farré D., Roset R., Huerta M., Adsuara J.E., Roselló L., Albà M.M., Messeguer X. 2003. Identification of patterns in biological sequences at the ALGGEN server: PROMO and MALGEN. Nucleic Acids Res. V. 31. P. 3651.
Fedele M., Crescenzi E., Cerchia L. 2017. The POZ/BTB and AT-hook containing zinc finger 1 (PATZ1) transcription regulator: physiological functions and disease involvement. Int. J. Mol. Sci. V. 18. P. 2524.
Fernandez-Zapico M.E., Lomberk G.A., Tsuji S., DeMars C.J., Bardsley M.R., Lin Y.H., Urrutia R. 2011. A functional family-wide screening of SP/KLF proteins identifies a subset of suppressors of KRAS-mediated cell growth. Biochem. J. V. 435. P. 529.
Gajjar M., Candeias M.M., Malbert-Colas L., Mazars A., Fujita J., Olivares-Illana V., Fahraeus R. 2012. The p53 mRNA-Mdm2 interaction controls Mdm2 nuclear trafficking and is required for p53 activation following DNA damage. Cancer Cell. V. 21. P. 25.
Grant C.E., Bailey T.L., Noble W.S. 2011. FIMO: Scanning for occurrences of a given motif. Bioinformatics. V. 27. P. 1017.
Hemann M.T., Lowe S.W. 2006. The p53-BCL-2 connection. Cell Death Differ. V. 13. P. 1256.
Huerta S., Gao X., Dineen S., Kapur P., Saha D., Meyer J. 2013. Role of p53, Bax, p21, and DNA-PKcs in radiation sensitivity of HCT-116 cells and xenografts. Surgery. V. 154. P. 143.
Kel A.E., Gossling E., Reuter I., Cheremushkin E., Kel-Margoulis O.V., Wingender E. 2003. MATCHTM: a tool for searching transcription factor binding sites in DNA sequences. Nucleic Acids Res. V. 31. P. 3576.
Kim W., Lee S., Seo D., Kim D., Kim K., Kim E., Youn B. 2019. Cellular stress responses in radiotherapy. Cells. V. 8. P. 1105.
Kreis N.N., Sanhaji M., Rieger M.A., Louwen F., Yuan J. 2014. p21Waf1/Cip1 deficiency causes multiple mitotic defects in tumor cells. Oncogene. V. 33. P. 5716.
Kuribayashi K., Finnberg N.K., Jeffers J.R., Zambetti G.P., El-Deiry W.S. 2011. The relative contribution of pro-apoptotic p53-target genes in the triggering of apoptosis following DNA damage in vitro and in vivo. Cell Cycle. V. 10. P. 2380.
Lee W.P., Lan K.H., Li C.P., Chao Y., Lin H.C., Lee S.D. 2016. Akt phosphorylates myc-associated zinc finger protein (MAZ), releases P-MAZ from the p53 promoter, and activates p53 transcription. Cancer Lett. V. 375. P. 9.
Leibowitz B.J., Qiu W., Liu H., Cheng T., Zhang L., Yu J. 2011. Uncoupling p53 functions in radiation-induced intestinal damage via PUMA and p21. Mol. Cancer Res. V. 9. P. 616.
Maréchal A., Zou L. 2013. DNA damage sensing by the ATM and ATR kinases. Cold Spring Harb. Perspect. Biol. V. 5. https://doi.org/10.1101/cshperspect.a012716
Nakano K., Vousden K.H. 2001. PUMA, a novel proapoptotic gene, is induced by p53. Mol. Cell. V. 7. P. 683.
Nikiforov M.A., Riblett M., Tang W.H., Gratchouck V., Zhuang D., Fernandez Y., Soengas M.S. 2007. Tumor cell-selective regulation of NOXA by c-MYC in response to proteasome inhibition. PNAS. V. 104. P. 19488.
Paiva S.L., Crews C.M. 2019. Targeted protein degradation: Elements of PROTAC design. Curr. Opin. Chem. Biol. V. 50. P. 111.
Ploner C., Kofler R., Villunger A. 2008. Noxa: At the tip of the balance between life and death. Oncogene. V. 27. P. 84.
Rowland B.D., Bernards R., Peeper D.S. 2005. The KLF4 tumour suppressor is a transcriptional repressor of p53 that acts as a context-dependent oncogene. Nat. Cell. Biol. V. 7. P. 1074.
Speidel D. 2015. The role of DNA damage responses in p53 biology. Arch. Toxicol. V. 89. P. 501.
Valentino T., Palmieri D., Vitiello M., Pierantoni G.M., Fusco A., Fedele M. 2013. PATZ1 interacts with p53 and regulates expression of p53-target genes enhancing apoptosis or cell survival based on the cellular context. Cell Death Dis. V. 4. https://doi.org/10.1038/cddis.2013.500
Vavrova J., Rezacova M. 2014. Importance of proapoptotic protein PUMA in cell radioresistance. Folia Biol. V. 60. P. 53.
Wang Q., Mora-Jensen H., Weniger M.A., Perez-Galan P., Wolford C., Hai T., Ye Y. 2009. ERAD inhibitors integrate ER stress with an epigenetic mechanism to activate BH3-only protein NOXA in cancer cells. PNAS. V. 106. P. 2200.
Zhu N., Gu L., Findley H. W., Chen C., Dong J.T., Yang L., Zhou M. 2006. KLF5 Interacts with p53 in regulating survivin expression in acute lymphoblastic leukemia. J. Biol. Chem. V. 281. P. 14711.
Дополнительные материалы отсутствуют.


