Цитология, 2021, T. 63, № 4, стр. 373-378
Вальпроевая кислота повышает уровень экспрессии генов, кодирующих BDNF, GDNF и их рецепторы, в эмбриональном мозге мышей и индуцирует стереотипное поведение
А. А. Семёнова 1, *, Е. В. Харитонова 1, Е. Д. Хилажева 1, А. Б. Салмина 1, 2
1 НИИ молекулярной медицины и патобиохимии, КрасГМУ им. проф. В.Ф. Войно-Ясенецкого
660022 Красноярск, Россия
2 Отдел исследований мозга, Научный центр неврологии
125367 Москва, Россия
* E-mail: alina_shamsutdin@mail.ru
Поступила в редакцию 08.03.2021
После доработки 17.03.2021
Принята к публикации 18.03.2021
Аннотация
Модель с пренатальным введением вальпроевой кислоты является наиболее распространенной для изучения механизмов развития аутизма на экспериментальных животных. Мы показали, что введение беременным самкам мышей вальпроевой кислоты повышает уровень экспрессии генов, кодирующих нейротрофические факторы BDNF, GDNF и их рецепторы, в эмбриональном мозге. В то же время, взрослые мыши с пренатальным введением вальпроевой кислоты характеризуются усилением выраженности стереотипного поведения, что является одним из признаков аутистически-подобного поведения. Мы предполагаем, что гиперэкспрессия нейротрофических факторов во время эмбрионального периода может стимулировать развитие аномального мозга, приводящее к изменениям в поведенческих характеристиках.
В последнее время все большее распространение в мире приобретают расстройства аутистического спектра (РАС). Аутизм представляет собой совокупность разнородных состояний развития центральной нервной системы, характеризующихся ранними трудностями в социальном общении и наличием стереотипных ограниченных форм поведения. Причины развития аутизма остаются неизученными, однако известно, что данное заболевание связано с нарушением развития мозга, в том числе процессов нормального нейрогенеза, дифференциации, миграции нервных клеток и удаления избыточных связей и нейронов (Chomiak, Hu, 2012; Chen et al., 2020).
Развитие мозга невозможно без влияния нейротрофических факторов – белковых молекул, выделяющихся в эмбриональном и постнатальном мозге в больших количествах и регулирующих рост и развитие нейронов, синаптогенез и направленную миграцию. Было показано, что уровень мРНК и белка нейротрофического фактора мозга BDNF в эмбриональном мозге увеличивался через 1, 2, 3 и 6 ч после введения вальпроевой кислоты беременным самкам мышей и возвращался к норме через 12 ч (Almeida et al., 2014; Hara et al., 2017). В то же время другой белок – глиальный нейротрофический фактор GDNF – не был исследован в этом отношении, однако было показано увеличение его уровня в гиппокампе крыс, получавших вальпроат (Varela et al., 2015). Модель с пренатальным введением вальпроевой кислоты грызунам и приматам является общепринятой для изучения патогенеза аутизма и методов его коррекции (Семёнова и др., 2020; Yamaguchi et al., 2017; Zhao et al., 2019). Логично предполагать, что в модели вальпроат-индуцированного аутизма у грызунов введение вальпроевой кислоты беременным самкам приводит к значительному повышению уровня нейротрофических факторов в эмбриональном мозге, что вызывает нарушения развития мозга и индуцирует аутистически-подобное поведение у мышей. Вместе с тем, нельзя не рассматривать другие молекулярные механизмы действия вальпроата, например, ингибирование гистоновых деацетилаз, дисбаланс возбуждения и торможения, нейровоспаление и окислительный стресс (Fujiki et al., 2013; Hamed et al., 2018).
Гиперактивность сигнальной трансдукции, опосредованной влиянием нейротрофических факторов, во время эмбрионального развития может стать причиной аномального увеличения массы мозга, появления очагов судорожной активности и развития аберрантного поведения, характерного для РАС (Tsai, 2005). В то же время, вальпроевая кислота по-прежнему широко применяется для лечения эпилепсии у людей (Tomson et al., 2015; Шнайдер, Дмитренко, 2016; Yang et al., 2020), причем использование данного препарата во время беременности связано с повышенным риском врожденных пороков развития, включая дефекты нервной трубки, когнитивный дефицит, проявления РАС (Moore et al., 2000). Мы предполагаем, что патологически измененная экспрессия нейротрофических факторов может вносить вклад в терапевтические эффекты вальпроевой кислоты во взрослом мозге, однако приводит к нарушениям развития эмбрионального мозга.
Известно, что кроме дефицита социального поведения пациенты с аутизмом часто характеризуются проявлением стереотипного поведения – склонностью к осуществлению однообразных повторяющихся действий и ритуалов (Лущекина, Стрелец, 2014). Исходя из вышесказанного, целью нашей работы являлось исследование влияния вальпроевой кислоты на уровень мРНК нейротрофических факторов BDNF, GDNF и экспрессию их рецепторов в эмбриональном мозге мышей, а также оценка стереотипного поведения взрослых мышей, подвергшихся пренатальному воздействию вальпроата.
МАТЕРИАЛ И МЕТОДИКА
Воспроизведение вальпроатной модели аутизма. Эксперименты были проведены на мышах инбредной линии C57BL/6. Внутрибрюшинное введение вальпроевой кислоты (Sigma-Aldrich, США) в дозе 500 мг/кг проводили беременным самкам на 13 день гестации (время закрытия нервной трубки и формирования ствола мозга). Беременным самкам контрольной группы вводили соответствующий объем PBS.
ПЦР в реальном времени. Образцы эмбрионального мозга были взяты через 3 и 6 ч после введения вальпроевой кислоты. Выделение тотальной РНК из образцов осуществляли с помощью набора реагентов “РНК-Экстран” (Синтол, Россия) по стандартному протоколу фирмы-изготовителя. Обратную транскрипцию проводили с помощью набора реагентов “MMLV RT kit” (Евроген, Россия) при 40°С в течение 1 ч. Полученную кДНК использовали для проведения ОТ-ПЦР в режиме реального времени с помощью набора qPCRmix-HS (Евроген, Россия). Также использовали наборы праймеров и флуоресцентно-меченных ДНК-зондов для определения количества фрагментов кДНК генов, кодирующих нейротрофические факторы BDNF, GDNF и их рецепторы TrkB, p75, GFR-α1, а также референсных генов GAPDH и ACTB (ДНК-Синтез, Россия). Для проведения ПЦР использовали амплификатор LightCycler 96 (Roche, США), относительный количественный анализ экспрессии генов проводили с помощью программного обеспечения LightCycler 96 Software.
Поведенческое тестирование. У другой части потомства с пренатальным введением вальпроевой кислоты исследовали поведение в возрасте 3 месяцев в тесте “аутогрумминг”. Мыши естественно поглаживают, почесывают и облизывают свою голову и тело с помощью передних лап (аутогрумминг), однако гипертрофированный аутогрумминг можно рассматривать как стереотипное поведение (Maraz et al., 2017). Мышь помещали в пустую чистую клетку без подстила, после 10 мин привыкания фиксировали общее время аутогрумминга в течение 10 мин.
Статистическую обработку результатов проводили с использованием непарного t-критерия Стьюдента для нормально распределенных выборок и методов непараметрической статистики (критерий Манна–Уитни) для выборок с ненормальным распределением. Результаты представлены в виде M ± SD (σ), где М – среднее значение, σ – стандартное отклонение. Статистически значимыми считали различия при p < 0.05.
РЕЗУЛЬТАТЫ
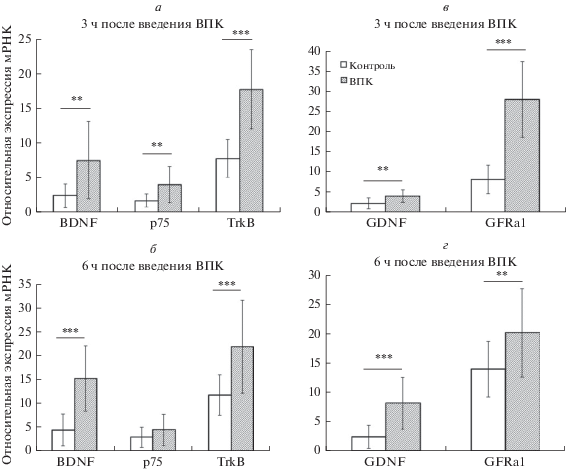
Введение вальпроевой кислоты беременным самкам (13 день гестации) стимулировало повышение экспрессии мРНК, кодирующих нейротрофический фактор BDNF и его рецепторы p75 и TrkB, в мозге эмбрионов как через 3 ч (рис. 1а), так и через 6 ч (рис. 1б). Повышение экспрессии мРНК глиального нейротрофического фактора GDNF и его рецептора GFR-α1 также повышалось через 3 (рис. 1в) и 6 ч (рис. 1г) в экспериментальной группе по сравнению с контрольной группой.
Рис. 1.
Экспрессия мРНК генов, кодирующих BDNF и его рецепторы p75 и TrkB (а, б), а так же GDNF и его рецепторы GFR-α1 (в, г), в эмбриональном мозге мышей спустя 3 ч (а, в) и 6 ч (б, г) после введения беременной самке вальпроевой кислоты (ВПК) или PBS (контроль). Данные представлены как среднее ± стандартное отклонение (n = 11–17), ** – различия между группами достоверны для p < 0.01, *** – для p < 0.001.
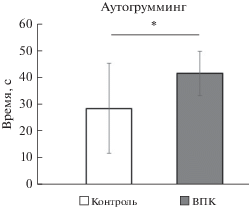
Мыши, родившиеся после пренатального воздействия вальпроевой кислоты, демонстрировали более продолжительный аутогрумминг, чем мыши контрольной группы. В экспериментальной группе среднее значение времени аутогрумминга составило 28.6 ± 8.2 с, тогда как в контрольной группе – 41.7 ± ± 16.8 с (p < 0.05) (рис. 2). Таким образом, полученные данные позволяют говорить об увеличении выраженности стереотипного поведения у мышей с фетальным вальпроатным синдромом.
ОБСУЖДЕНИЕ
В наших экспериментах мы показали, что введение вальпроевой кислоты беременной самки мыши вызывает значительное (в 2–3 раза) повышение экспрессии генов, кодирующих нейротрофические факторы BDNF, GDNF и их рецепторы, в мозге эмбрионов через 3 и 6 ч. В то же время, у взрослых мышей, подвергшихся пренатальному воздействию вальпроевой кислоты, наблюдается усиление выраженности стереотипного поведения, что является одним из признаков РАС.
С одной стороны, повышение уровня нейротрофических факторов в пренатальный период может стимулировать эктопический нейрогенез и нейритогенез, приводя к увеличению размеров мозга и развитию аберрантного поведения у потомства, с другой стороны, повреждающее действие вальпроевой кислоты может опосредоваться другими механизмами, а возрастание уровня нейротрофических факторов можно рассматривать как маркер нарушений развития эмбрионального мозга мышей. Другими словами, уровень нейротрофических факторов компенсаторно повышается в ответ на какие-либо повреждающие влияния вальпроевой кислоты. Точный механизм действия вальпроатов на мозг эмбрионов, приводящий к развитию аутизма, не определен, однако, к таким эффектам можно отнести эпигенетические изменения (Fujiki et al., 2013), окислительный стресс и нейровоспаление (Defoort et al., 2006; Tung, Winn, 2011), дисбаланс нейромедиаторов и эксайтотоксичность глутамата (Hamed et al., 2018).
Один из наиболее вероятных эпигенетических механизмов, посредством которого вальпроевая кислота может проявлять свою тератогенную активность – это неселективное ингибирование гистоновых деацетилаз (Menegola et al., 2005; Fujiki et al., 2013). В регуляции экспрессии генов играют роль модификации гистонов, такие как метилирование, фосфорилирование и ацетилирование. Последний процесс регулируется двумя классами ферментов: гистонацилтрансферазами, которые катализируют реакции присоединения ацетильных групп к остаткам лизина у гистонов, и гистоновыми деацетилазами, которые впоследствии удаляют эти группы. Так как в результате ацетилирования положительный заряд гистонов снижается, а ДНК заряжена отрицательно, то хроматин становится менее компактным. Это приводит к повышению уровня транскрипции генов. Гистоновые деацетилазы удаляют ацетильную группу с молекул гистонов, что приводит к более компактному накручиванию ДНК на гистоны, в результате чего активность транскрипции подавляется. Вальпроевая кислота, являясь ингибитором гистоновых деацетилаз, повышает степень ацетилирования гистонов и, следовательно, может одновременно усиливать экспрессию различных генов. Ранее было показано, что пренатальное введение вальпроевой кислоты беременным самкам мышей приводило к временному (до 24 ч) гиперацетилированию гистонов в эмбриональном мозге, что сопровождалось усилением апоптоза в коре мозга эмбрионов (Kataoka et al., 2013). В культуре астроцитов вальпроевая кислота стимулировала повышение экспрессии генов, кодирующих нейротрофические факторы BDNF и GDNF (Wu et al., 2009). Обработка вальпроевой кислотой культур нейронов коры крыс приводила к увеличению экспрессии мРНК и белка BDNF, что сопровождалось ростом нейритов (Yasuda et al., 2009; Hasan et al., 2013). Подобным образом обработка вальпроевой кислотой культур клеток глиомы приводила к повышению уровня мРНК BDNF и GDNF (Castro et al., 2005), а также мРНК и белка BDNF в развивающихся кортикальных нейронах (Ko et al., 2019). Примечательно, что обработка клеток эпидермального нервного гребня вальпроевой кислотой усиливала транскрипцию генов, кодирующих BDNF, GDNF и VEGF, не влияя на транскрипты нейротрофинов NGF и NT3 (Pandamooz et al., 2019); стоит обратить внимание, что повышенная экспрессия генов наблюдалась даже на 7 сут после однократной обработки вальпроатом.
Таким образом, гиперэкспрессия нейротрофических факторов, вызванная вальпроевой кислотой, в критический период развития мозга может активировать процессы, приводящие к формированию аномального мозга. Одно из таких нарушений – это стимуляция чрезмерной пролиферации нейронов и увеличения числа нейритов. Так, было продемонстрировано, что однократное воздействие вальпроевой кислоты на 12 день эмбрионального развития (Е12) приводило к снижению массы эмбрионального мозга до Е18, однако на 2 и 7 день постнатального развития масса мозга крыс значительно возрастала (Go et al., 2012). Эта мегацефалия сопровождалась повышением количества нейритов и усиленной пролиферацией нейронов. В культурах кортикальных нейронов крысы вальпроевая кислота стимулировала увеличение плотности нейритов, что также сопровождалось повышением уровня ацетилирования гистонов Н3 и белка BDNF (Hasan et al., 2013). По-видимому, стимулируемые вальпроевой кислотой нейрогенез и нейритогенез вносят вклад в чрезмерный рост мозга, наблюдаемый при РАС (Courchesne et al., 2011; Ecker et al., 2012). Конкретные молекулярные механизмы нарушения нейрогенеза и нейритогенеза при вальпроат-индуцированном аутизме нуждаются в дальнейшем изучении, что позволит идентифицировать молекулы-мишени для патогенетически обоснованной коррекции РАС.
Список литературы
Лущекина Е.А., Стрелец В.Б. 2014. Расстройста аутистического спектра. Обзор современных экспериментальных исследований. Журн. высш. нерв. деят. Т. 64. № 6. С. 585. (Luschekina E. A., Strelets V. B. 2014. Autism spectrum disorder. Contemporary experimental researches review. Zh. Vyssh. Nerv. Deiat. Im. I.P. Pavlova V. 64. № 6. P. 585.)
Семёнова А.А., Лопатина О.Л., Салмина А.Б. 2020. Модели аутизма и методики оценки аутистически-подобного поведения у животных. Журн. высш. нерв. деят. Т. 70. № 2. С. 147. (Semenova A.A., Lopatina O.L., Salmina A.B. 2020. Autism models and assesement techniques for autistic-like behavior in animals. Neuroscience and behavioral physology (Zh. Vyssh. Nerv. Deiat. Im. I.P. Pavlova) V. 50. P. 1024.)
Шнайдер Н.А., Дмитренко Д.В. 2016. Хроническая интоксикация вальпроевой кислотой в эпилептологии: диагностика и лечение. Неврология, нейропсихиатрия, психосоматика. Т. 8. № 2. С. 94. (Shnaider N.A., Dmitrenko D.V. 2016. Nevrologia, Neiropsikhiatriya, Psikhosomatika. V. 8. № 2. P. 94.)
Almeida L.E., Roby C.D., Krueger B.K. 2014. Increased BDNF expression in fetal brain in the valproic acid model of autism. Mol. Cell Neurosci. V. 59. P. 57.
Castro L.M., Gallant M., Niles L.P. 2005. Novel targets for valproic acid: up-regulation of melatonin receptors and neurotrophic factors in C6 glioma cells. J. Neurochem. V. 95. P. 1227.
Chen O., Tahmazian I., Ferrara H.J., Hu B., Chomiak T. 2020. The early overgrowth theory of autism spectrum disorder: Insight into convergent mechanisms from valproic acid exposure and translational models. Prog. Mol. Biol. Transl. Sci. V. 173. P. 275.
Chomiak T., Hu B. 2013. Alterations of neocortical development and maturation in autism: insight from valproic acid exposure and animal models of autism. Neurotoxicol. Teratol. V. 36. P. 57.
Courchesne E., Mouton P.R., Calhoun M.E., Semendeferi K., Ahrens-Barbeau C., Hallet M.J., Barnes C.C., Pierce K. 2011. Neuron number and size in prefrontal cortex of children with autism. JAMA. V. 306. P. 2001.
Defoort E.N., Kim P.M., Winn L.M. 2006. Valproic acid increases conservative homologous recombination frequency and reactive oxygen species formation: a potential mechanism for valproic acid-induced neural tube defects. Mol. Pharmacol. V. 69. P. 1304.
Ecker C., Suckling J., Deoni S.C., Lombardo M.V., Bullmore E.T., Baron-Cohen S., Catani M., Jezzard P., Barnes A., Bailey A.J., Williams S.C., Murphy D.G. MRC AIMS Consortium. 2012. Brain anatomy and its relationship to behavior in adults with autism spectrum disorder: a multicenter magnetic resonance imaging study. Arch. Gen. Psychiatry. V. 69. P. 195.
Fujiki R., Sato A., Fujitani M., Yamashita T. 2013. A proapoptotic effect of valproic acid on progenitors of embryonic stem cell-derived glutamatergic neurons. Cell Death Dis. V. 4. e677.
Go H.S., Kim K.C., Choi C.S., Jeon S.J., Kwon K.J., Han S.H., Lee J., Cheong J.H., Ryu J.H., Kim C.H., Ko K.H., Shin C.Y. 2012. Prenatal exposure to valproic acid increases the neural progenitor cell pool and induces macrocephaly in rat brain via a mechanism involving the GSK-3β/β-catenin pathway. Neuropharmacology. V. 63. P. 1028.
Hamed N.O., Al-Ayadhi L., Osman M.A., Elkhawad A.O., Qasem H., Al-Marshoud M., Merghani N.M., El-Ansary A. 2018. Understanding the roles of glutamine synthetase, glutaminase, and glutamate decarboxylase autoantibodies in imbalanced excitatory/inhibitory neurotransmission as etiological mechanisms of autism. Psychiatry Clin. Neurosci. V. 72. P. 362.
Hara Y., Ago Y., Takano E., Hasebe S., Nakazawa T., Hashimoto H., Matsuda T., Takuma K. 2017. Prenatal exposure to valproic acid increases miR-132 levels in the mouse embryonic brain. Mol. Autism. V. 8. P. 33.
Hasan M.R., Kim J.H., Kim Y.J., Kwon K.J., Shin C.Y., Kim H.Y., Han S.H., Choi D.H., Lee J. 2013. Effect of HDAC inhibitors on neuroprotection and neurite outgrowth in primary rat cortical neurons following ischemic insult. Neurochem. Res. V. 38. P. 1921.
Kataoka S., Takuma K., Hara Y., Maeda Y., Ago Y., Matsuda T. 2013. Autism-like behaviours with transient histone hyperacetylation in mice treated prenatally with valproic acid. Int. J. Neuropsychopharmacol. V. 16. P. 91.
Ko H.M., Jin Y., Park H.H., Lee J.H., Jung S.H., Choi S.Y., Lee S.H., Shin C.Y. 2018. Dual mechanisms for the regulation of brain-derived neurotrophic factor by valproic acid in neural progenitor cells. Korean J. Physiol. Pharmacol. V. 22. P. 679.
Maraz A., Hende B., Urbán R., Demetrovics Z. 2017. Pathological grooming: Evidence for a single factor behind trichotillomania, skin picking and nail biting. PLoS One. V. 12. e0183806.
Menegola E., Di Renzo F., Broccia M.L., Prudenziati M., Minucci S., Massa V., Giavini E. 2005. Inhibition of histone deacetylase activity on specific embryonic tissues as a new mechanism for teratogenicity. Birth Defects Res. B. Dev. Reprod. Toxicol. V. 74. P. 392.
Moore S.J., Turnpenny P., Quinn A., Glover S., Lloyd D.J., Montgomery T., Dean J.C. 2000. A clinical study of 57 children with fetal anticonvulsant syndromes. J. Med. Genet. V. 37. P. 489.
Pandamooz S., Salehi M.S., Safari A., Azarpira N., Heravi M., Ahmadiani A., Dargahi L. 2019. Enhancing the expression of neurotrophic factors in epidermal neural crest stem cells by valproic acid: A potential candidate for combinatorial treatment. Neurosci. Lett. V. 704. P. 8.
Tomson T., Battino D., Perucca E. 2016. Valproic acid after five decades of use in epilepsy: time to reconsider the indications of a time-honoured drug. Lancet Neurol. V. 15. P. 210.
Tsai S.J. 2005. Is autism caused by early hyperactivity of brain-derived neurotrophic factor? Med. Hypotheses. V. 65. P. 79.
Tung E.W., Winn L.M. 2011. 2011. Valproic acid increases formation of reactive oxygen species and induces apoptosis in postimplantation embryos: a role for oxidative stress in valproic acid-induced neural tube defects. Mol. Pharmacol. V. 80. P. 979.
Varela R.B., Valvassori S.S., Lopes-Borges J., Mariot E., Dal-Pont G.C., Amboni R.T., Bianchini G., Quevedo J. 2015. Sodium butyrate and mood stabilizers block ouabain-induced hyperlocomotion and increase BDNF, NGF and GDNF levels in brain of Wistar rats. J. Psychiatr. Res. Vol. 61. P.114.
Wu X., Chen P.S., Dallas S., Wilson B., Block M.L., Wang C.C., Kinyamu H., Lu N., Gao X., Leng Y., Chuang D.M., Zhang W., Lu R.B., Hong J.S. 2008. Histone deacetylase inhibitors up-regulate astrocyte GDNF and BDNF gene transcription and protect dopaminergic neurons. Int. J. Neuropsychopharmacol. Vol. 11. P. 1123.
Yamaguchi H., Hara Y., Ago Y., Takano E., Hasebe S., Nakazawa T., Hashimoto H., Matsuda T., Takuma K. 2017. Environmental enrichment attenuates behavioral abnormalities in valproic acid-exposed autism model mice. Behav. Brain Res. V. 333. P. 67.
Yang X., Wang P., Pan J., Wang C., Luo J., Ma H. 2020. Valproic acid concentration and biochemical indexes in epilepsy outpatients during monotherapy or combination therapy. Zhong Nan Da Xue Xue Bao Yi Xue Ban. V. 45. P. 782.
Yasuda S., Liang M.H., Marinova Z., Yahyavi A., Chuang D.M. 2009. The mood stabilizers lithium and valproate selectively activate the promoter IV of brain-derived neurotrophic factor in neurons. Mol. Psychiatry. V. 14. P. 51.
Zhao H., Wang Q., Yan T., Zhang Y., Xu H.J., Yu H.P., Tu Z., Guo X., Jiang Y.H., Li X.J., Zhou H., Zhang Y.Q. 2019. Maternal valproic acid exposure leads to neurogenesis defects and autism-like behaviors in non-human primates. Transl. Psychiatry. V. 9. P. 267.
Дополнительные материалы отсутствуют.