Цитология, 2021, T. 63, № 4, стр. 352-362
Органоидные и первичные эпителиальные культуры предстательной железы человека показывают ключевую роль эпителиально-мезенхимного перехода в формировании тканеспецифических стромальных клеток
В. М. Рябов 1, А. О. Георгиева 2, М. А. Воскресенский 3, Б. К. Комяков 3, О. В. Рогоза 4, Р. В. Грозов 4, Я. Г. Муразов 5, Д. Г. Прохоров 6, Б. В. Попов 1, *
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Университет ИТМО
197101 Санкт-Петербург, Россия
3 Городская многопрофильная больница № 2 МЗ РФ
194354 Санкт-Петербург, Россия
4 Национальный медицинский исследовательский центр им. В.А. Алмазова МЗ РФ
197341 Санкт-Петербург, Россия
5 Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова МЗ РФ
197758 Санкт-Петербург, Россия
6 Российский научный центр радиологии и хирургических технологий им. А.М. Гранова МЗ РФ
197758 Санкт-Петербург, России
* E-mail: borisvp478@gmail.com
Поступила в редакцию 14.04.2021
После доработки 26.04.2021
Принята к публикации 28.04.2021
Аннотация
Предстательная железа (ПЖ) представляет собой небольшой орган в мужской репродуктивной системе, который в настоящее время находится в фокусе биомедицинских исследований благодаря лидирующему положению в заболеваемости и смертности от тканеспецифического рака (РПЖ). Эпителий ПЖ, который подвергается раковой трансформации, формируется и функционирует с помощью андрогенов. Вначале заболевания клетки эпителия продуцируют андрогенный рецептор (AR) и проявляют чувствительность к андроген-депривационной терапии. Однако такая терапия неизбежно приводит к переходу болезни в кастрационно-резистентную форму (КР-РПЖ), проявляющуюся в метастазировании и быстрой смертности. При КР-РПЖ клетки эпителия ПЖ изменяют свой фенотип, что может быть связано с мутацией AR и потерей чувствительности к специфической терапии. Механизм фенотипической трансформации эпителия ПЖ может быть скрыт в особенностях взаимодействия и формирования стромальных и эпителиальных клеток, которые проявляются в ходе образования первичных культур. Задача настоящей работы заключалась в изучении формирования стромальных клеток ПЖ человека в первичных стромальных и органоидных культурах. В результате работы мы нашли, что в отличие от быстрого появления и формирования гомогенной популяции мезенхимных клеток в первичных стромальных культурах большинства тканей, стромальные клеточные культуры ПЖ человека формируются вначале из эпителиальных клеток, которые появляются на второй неделе культивирования и продуцируют цитокератины (ЦК). Только к концу 4-й нед. культивирования происходит формирование гомогенной популяции мезенхимных клеток, продуцирующих виментин, чему сопутствует исчезновение эпителиальных клеток. При этом некоторые эпителиальные клетки продуцируют одновременно ЦК и виментин. В органоидных культурах ПЖ часто происходит сопутствующий рост на культуральном пластике эпителиальных, но не мезенхимных клеток. При культивировании эпителиальных клеток, возникших из органоидных культур, они, как и клетки первичного эпителия, обнаруживают способность к спонтанной трансформации в мезенхимные клетки и продуцируют одновременно ЦК и виментин. Полученные нами данные дают возможность предположить, что в первичных и органоидных культурах ПЖ стромальные клетки могут формироваться благодаря эпителиально-мезенхимному переходу (ЭМП). Склонность эпителия ПЖ к спонтанному ЭМП может вносить вклад в механизм высокой чувствительности ткани ПЖ к злокачественной трансформации и метастазированию, а понимание этого механизма может способствовать выработке эффективной противоопухолевой терапии РПЖ.
Предстательная железа (ПЖ) представляет собой небольшой вспомогательный орган в мужской репродуктивной системе, который в последнее десятилетие переместился в центр внимания биологов и врачей из-за ведущей роли в заболеваемости и смертности от рака предстательной железы (РПЖ) (Siegel et al., 2018). Оказалось, что ПЖ значительно более чувствительна к онкогенной трансформации, чем другие половые органы, РПЖ диагностируется в течение жизни у каждого седьмого лица мужского пола (Siegel et al., 2016). ПЖ является железистым органом, развитие и функции которого регулируются действием андрогенов на тканеспецифические стромальные и эпителиальные клетки (Prins, Putz, 2008). Cтромальные клетки в ПЖ, в основном, представляют собой гладкомышечные клетки, их число дважды превышает число эпителиальных клеток, что связано с насосной функцией органа, периодически выбрасывающего секретируемую жидкость (Bartsch, Rohr, 1980).
Выделяют два основных типа эпителиальных клеток ПЖ: базальные и люминальные, различающиеся между собой по маркерам. Базальные клетки расположены на базальной мембране и формируют базальный слой эпителиальных структур ПЖ. Эти клетки продуцируют цитокератины (ЦК) 5, 14 (Brawer et al., 1985) и транскрипционный фактор р63 из семейства р53 (Signerotti et al., 2000). Основным типом эпителиальных клеток ПЖ являются люминальные клетки, которые экспрессируют андрогенный рецептор (AR), низкомолекулярные ЦК8 и ЦК18 (Abate-Shen, Shen, 2000). В процессе дифференцировки базальные клетки превращаются в люминальные. Маленькая популяция базальных клеток ПЖ была идентифицирована в качестве стволовых (СК) у человека и мышей. Эти клетки экспрессируют TROP2 (tumor associated calcium signal transducer 2), p63, CD133 (Goldstein et al., 2008; Trerotola et al., 2010).
РПЖ, как и рак в других органах, возникает из опухолевых СК (ОСК), формирующих небольшую популяцию клеток опухолевой ткани, которая, тем не менее, генерирует ее основные свойства: прогрессию, инвазию, метастазирование и устойчивость к противоопухолевой терапии (Bao et al., 2006; Li et al., 2008). Клетки-предшественники РПЖ (cells of origin) – это клетки в пределах опухолевой ткани, которые служат мишенями раковой трансформации (Visvader, 2011). Такие клетки отличаются от ОСК, ключевая черта которых – регенерация опухоли (Clevers, 2011).
Клетками-мишенями при РПЖ могут быть как базальные, так и люминальные клетки, но фенотипически клетки РПЖ являются люминальными и несут AR (Xin, 2013). Лечение первичного РПЖ основано на андроген-депривационной терапии, направленной против раковых клеток, несущих AR. Такая терапия является успешной в течение первых 16–20 мес., но затем РПЖ неизбежно переходит в прогрессирующую метастатическую форму, так называемый кастрационно-резистентный РПЖ (КР-РПЖ), устойчивый к антиандрогенной терапии (Fizazi et al., 2019; Elbadawy et al., 2020). Механизм возникновения КР-РПЖ и поиск его эффективной терапии являются актуальными биомедицинскими задачами, которые могут быть решены с помощью современных преклинических моделей.
В настоящее время существует две эффективные преклинические модели РПЖ: КT-РПЖ – ксенотрансплантаты опухоли человека иммунодефицитным мышам (patient derived xenografts, PDX) и ОК-РПЖ – органоидные культуры РПЖ человека (patient derived organoids, PDO) (Bleijs et al., 2019). В обеих моделях клетки опухоли человека сохраняют в течение длительного времени свои молекулярно-генетические свойства, но технология ОК-РПЖ не ограничена необходимостью использования иммунодефицитных линий мышей. ОК-РПЖ, в отличие от КT-РПЖ, могут быть использованы для быстрого скрининга лекарств с целью выработки персонифицированной терапии. Tехнология ОК-РПЖ была разработана в последнее десятилетие, ее применение основано на получении 3D-культуры клеток, которые возникают из СК и поддерживают все свойства материнской ткани (Sato et al., 2009). ОК могут формироваться как из нормальной, так и из опухолевой ткани (Sato et al., 2011). Первые публикации об этих культурах (ОК-ПЖ) появились в 2014 г. (Karthaus et al., 2014; Gao et al., 2014). ОК-ПЖ могут быть получены из нормальных или опухолевых эпителиальных клеток, они поддерживают, по крайней мере в течение года, все свойства исходной ткани при оценке ее молекулярного, гистологического, тканевого, и генетического профилей. Используя ОК-РПЖ, уже удалось моделировать редкие фенотипы РПЖ (Puca et al., 2018).
Механизм высокой чувствительности к злокачественной трансформации и формирование клеток-предшественников РПЖ может быть скрыт в особенностях взаимодействия и формирования стромальных и эпителиальных клеток ПЖ, которые проявляются в ходе образования первичных культур, включая ОК-ПЖ.
Цель настоящей работы заключалась в получении первичных стромальных, эпителиальных и органоидных культур (ОК) из тканей ПЖ человека и маркерный анализ ОК-ПЖ, полученных из опухолевой и нормальной ткани ПЖ.
МАТЕРИАЛ И МЕТОДИКА
Пробы ткани предстательной железы. Образцы ткани предстательной железы получали от пациентов, подвергнутых радикальной простатэктомии по поводу РПЖ в урологическом отделении 2-й городской клинической больницы г. Санкт-Петербурга в соответствии с протоколом этического комитета этой больницы. Пробы ткани ПЖ весом около 100 мг, содержащие опухолевый узел и нормальную ткань того же слоя, помещали в пробирки с 5 мл стерильного физиологического раствора, содержащего 50 мкг/мл гентамицина (Биолот, Россия). Каждую из двух проб разделяли острыми ножницами на три части, одну из которых фиксировали в 10 мл 4%-ного параформальдегида (Sigma, США) в фосфатном буфере (pH 7.4) для последующей гистологической обработки. Вторая проба предназначалась для экстрагирования тотальной РНК и общеклеточного белка. Третью часть обрабатывали коллагеназой для приготовления клеточной суспензии, которую использовали в дальнейшем для получения органоидных, стромальных и эпителиальных культур.
Получение первичных стромальных и эпителиальных клеточных культур из образцов тканей ПЖ. Пробы ткани ПЖ, предназначенные для получения клеточных культур, помещали в чашки Петри (10 см) в 10 мл стерильного фосфатного буфера (PBS), разрезали стерильными ножницами на кусочки размером 1 мм, переносили в конические пластиковые пробирки (15 мл; TTP, Новосибирск, Россия), и подвергали ферментативной обработке в 1 мл раствора, содержащего 5 мг коллагеназы II типа (Life Technologies, США) в 1 мл среды adDMEM/F12 (advanced), содержащей 50 мкг/мл пенициллина и стрептомицина, 10 мМ HEPES и 1-кратный GlutaMAX (adDMEM/F12+++; Life Technologies, CША), добавляли ингибитор Rho-киназы Y-27632 (Abmole Bioscience, США) до конечной концентрации 10 мкМ и дегидротестостерон (Sigma, США) до конечной концентрации 1 нМ (Drost et al., 2016). Пробирки инкубировали на ротационном шейкере (PST-60 HL-4; Биосан, Латвия) в течение 18 ч при 37°С и 230 rpm. Затем суспензии центрифугировали при 250 g 5 мин, клеточные осадки отмывали в 5 мл среды adD-MEM/F12, фильтровали через нейлоновые сито с порами 70 мкм (Corning, CША), осаждали при 250 g 5 мин, осадок ресуспендировали в 1 мл раствора TrypLE Express (Life Technologies, США) в течение 1 ч на ротационном шейкере (PST-60 HL-4; Биосан, Латвия) при 37°С и 230 rpm. Затем к суспензии добавляли 5 мл среды adDMEM/F12, клетки осаждали центрифугированием при 250 g 5 мин, осадок ресуспендировали в 500 мкл среды adDMEM/F12+++. Для подсчета числа клеток 5 мкл клеточной суспензии смешивали с 45 мкл 1%-ной уксусной кислоты и 50 мкл 2%-ного трипанового синего (Биолот, Россия). Клетки считали в камере Горяева.
Для получения первичных стромальных культур, 2 × 104 клеток из клеточной суспензии добавляли в 4 мл специальной среды SCBM (Lonza, Швейцария) для стромальных клеток ПЖ человека и наносили в культуральные 60 мм чашки (TPP, Новосибирск, Россия). Для получения эпителиальных клеточных культур, 2 × 104 клеток ПЖ, полученных после обработки проб коллагеназой, ресуспендировали в 4 мл специальной среды PrEBM для эпителиальных клеток ПЖ человека (Lonza, Швейцария) и наносили на 60 мм культуральные чашки, предварительно покрытые коллагеном (Биолот, Россия). Имиджи стромальных, эпителиальных и органоидных культур получали без пересева клеток на 1–4-ой нед. культивирования с помощью микроскопа Axiovert 200M (Германия) и камеры DFC420 (Leica, Германия) в режиме проходящего света или фазового контраста. Использовали объектив 20×/0.5, размер снимка составлял 1728 × 1296 пикселей.
Получение, культивирование и пассирование ОК из опухолевой и нормальной ткани ПЖ. Клетки (1 × 105) суспензии ПЖ, полученные после обработки проб коллагеназой, ресуспендировали на льду в 20 мкл среды adDMEM/F12+++, смешивали со 140 мкл предварительно расплавленного на льду матригеля (BD, CША) и при комнатной температуре (КТ) наносили по 40 мкл в 4 лунки 24-луночной культуральной пластины (Corning, США), предварительно подогретой в течение ночи в СО2-инкубаторе при 37°С. После нанесения матригеля пластину переворачивали и помещали на 15 мин в СО2-инкубатор.
Затем в каждую лунку добавляли по 500 мкл специальной среды для культивирования органоидов ПЖ следующего состава: 1.0 мл B27 (Life Technologies, США), 500 мкл 1 М никотинамида в PBS (Sigma, США), 125.0 мкл 500 мМ N-ацетилцистеина (Sigma, США), 0.5 мкл раствора EGF (0.5 мг/мл в PBS + 0.1% БСА) (PeproTech, США), 5 мкл 5 мМ A83-01 в DMSO (Tocris Bioscience, США), 50 мкл Noggin (100 мкг/мл в PBS + 0.1% БСА) (PeproTech, США), 50 мкл раствора R-spondin 1 (500 мкг/мл в PBS + 0.1% БСА) (R&D Systems, США), 50 мкл 1 мкМ дегидротестостерона в этаноле (Sigma, США), 5 мкл раствора FGF2 (50 мкг/мл в PBS + 0.1% БСА) (PeproTech, США), 5 мкл раствора FGF10 (0.1 мг/мл в PBS + 0.1% БСА) (PeproTech, США), 5 мкл 10 мМ простагландина E2 в DMSO (Tocris Bioscience, США), 16.7 мкл 30 мМ SB202190 в DMSO (Sigma, США) и до 50 мл adDMEM/F12+++ (Life Technologies, США).
Пассирование органоидов. К культуральной среде в начале культивирования органоидов добавляли 5 мкл 100 мМ реактива Y-27632 (Abmole Bioscience, США) (Drost et al., 2016). Через 14 сут ресуспендировали органоиды из 1 лунки 24-луночной пластины в собственной культуральной среде и переносили в 15 мл-пластиковые пробирку, осаждали 5 мин центрифугированием при 250 g, осадок ресуспендировали в 1 мл TrypLE с 10 мкМ Y-27632, пробирку помещали на 5 мин на орбитальный шейкер при температуре 37°C. Инактивировали TrypLE путем добавления среды adDMEM/F12+/+/+, содержащей 5% ФБС, центрифугировали при 200 g 5 мин, удаляли супернатант, ресуспендировали клеточный осадок в 80 мкл матригеля, и помещали 40 мкл матригеля с клетками в центр лунки 24-луночной пластины. Переносили пластину на 15 мин в перевернутом состоянии в СО2 инкубатор, добавляли в лунки 500 мкл среды для органоидов, содержащей 10 мкМ ингибитора Rho-киназы Y-27632, среду меняли на свежую каждые 2–3 сут (Drost et al., 2016).
Окраска срезов ткани ПЖ гематоксилин/эозином. Пробы тканей фиксировали в 4%-ном забуференном параформальдегиде (pH 7.4) в течение 40–48 ч, промывали проточной водой, дегидратировали изопропанолом и заливали парафином. Парафиновые срезы ткани толщиной 2.5 мкм депарафинировали ксилолом, регидратировали изопропанолом и окрашивали общепринятым способом гематоксилином/эозином. После дегидратации и осветления в ксилоле окрашенные срезы заключали в среду для микроскопии.
Извлечение тотальной РНК из проб ткани ПЖ пациентов и производных ОК, а также синтез кДНК. Пробы ткани ПЖ размером 2 × 2 мм помещали в стальную ступку, охлаждали жидким азотом и растирали пестиком. Полученный порошок переносили в отдельную пробирку и добавляли 1 мл Тризола (Invitrogen, США), оставляли на льду на 5 мин. Затем в каждую пробирку добавляли по 200 мкл охлажденного хлороформа и суспензию перемешивали на вортексе. После этого пробирки ставили в лед на 3 мин, центрифугировали 15 мин при 4°С и 13 000 g, верхнюю фазу супернатанта переносили в новые пробирки и добавляли 500 мкл изопропанола (Sigma, США). Инкубировали на льду 10 мин, затем центрифугировали 10 мин при 4°С и 13000 g, удаляли супернатант, добавляли по 1 мл 70%-ного этанола, центрифугировали 5 мин при 4°С и 7600 g. Полностью удаляли супернатант, осадок сушили при КТ 10 мин, растворяли в 32 мкл безнуклеазной воды (Thermo Fisher Scientific, США) и инкубировали 15 мин при 57.5°С. Концентрацию РНК измеряли на спектрофотометре NanoDrop ND-1000 (Thermo Fisher Scientific, США).
Тотальную РНК выделяди из OК-ПЖ на 3-м пассаже. Для получения РНК удаляли культуральную среду из 4 лунок 24-луночных пластин, в которых росли ОК. Матригель ресуспендировали в каждой лунке пипетированием в 1 мл PBS, собирали суспензии в пробирку 15 мл, центрифугировали 5 мин при 300 g. К осадку добавляли 750 мкл Тризола (Invitrogen, США) и пипетировали 10 раз до полного растворения осадка. Пробирки оставляли на льду на 5 мин, затем в каждую пробирку добавляли 150 мкл охлажденного хлороформа, перемешивали на вортексе и оставляли на льду на 5 мин, центрифугировали 15 мин при 4°С и 13000 g. После центрифугирования верхнюю фазу супернатанта переносили в новые пробирки и добавляли 500 мкл изопропанола (Sigma, США), инкубировали на льду 10 мин, центрифугировали 10 мин при 4°С и 13 000 g, удаляли супернатант, к осадку добавляли 1 мл 70%-ного этилового спирта, снова центрифугировали 5 мин при 4°С и 7600 g. Полностью удаляли супернатант, осадок сушили при КТ 10 мин, растворяли в 32 мкл безнуклеазной воды (Thermo Fisher Scientific, США) и инкубировали 15 мин при 57.5°С. Концентрацию РНК измеряли на спектрофотометре NanoDrop ND-1000 (Thermo Fisher Scientific, США).
Для синтеза кДНК 2 мкг РНК смешивали с 1 мкл праймера олиго-дТ18 (Алкор Био, Россия), объем смеси доводили до 11 мкл и инкубировали при 70°С 10 мин, охлаждали, добавляли 2 мкл буфера для обратной транскриптазы (SibEnzyme, Россия), 2 мкл 10 мМ смеси дНТФ (Beagle, Россия), 0.5 мкл ингибитора рибонуклеаз RiboLock (Thermo Scientific, США) и инкубировали 1 ч при 37°С. Реакцию останавливали нагреванием до 70°С 10 мин.
Полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР). Смесь реагентов для проведения ПЦР включала: 1 мкл 10 мМ смеси дНТФ (Beagle, Россия), 2.5 мкл 10-кратного буфера для Taq-полимеразы (Алкор Био, Россия), 2.5 мкл 10 мМ MgCl2, 1 мкМ прямого и обратного праймеров (Алкор Био, Россия), 2 мкл ДНК, 0.25 мкл Taq-полимеразы (Алкор Био, Россия) и воду до 25 мкл общего объeма реакционной смеси. Смесь готовили при температуре тающего льда. Амплификацию проводили на термоциклере Bio-Rad T100 (США) при следующем температурном режиме: инициирующее плавление – 1 мин, 94°С; плавление – 15 с, 94°С; отжиг – 30 с, 58°С; элонгация – 30 с, 72°С (40 циклов); плато – 10 мин, 72°С. Для праймеров к гену ЦК5 температура отжига была 60°С. Продукты ПЦР-амплификации подвергали электрофорезу в 2%-ном агарозном геле с бромистым этидием, размер отдельных ампликонов в агарозном геле определяли при сравнении их подвижности с маркерами 100 пар оснований (п. о.) (Invitrogen, США) на имиджах, полученных с помощью Bio-Rad ChemiDoc XRS+ (США) (табл. 1).
Таблица 1.
Праймеры, использованные для амплификации ряда маркеров в ткани ПЖ и производных органоидных культурах
| Ген | Праймер прямой (5′–3′) | Праймер обратный (5′–3′) | Размер ампликона, п. о. |
|---|---|---|---|
| ЦК5 | AAGCTGCTGGAGGGCGAGGAATG | CGGGAGGAGGAGGTGGTGGAGAC | 341 |
| TP63 | TCCTCAGGGAGCTGTTATCC | ATTCACGGCTCAGCTCATGG | 101 |
| ЦК18 | TGGTCACCACACAGTCTGCT | CCAAGGCATCACCAAGATTA | 348 |
| AR 1 | AAGACGCTTCTACCAGCTCACCAA | TCCCAGAAAGGATCTTCGCACTT | 170 |
| AMACR | TGGCCACGATATCAACTATTTGG | ACTCAATTTCTGAGTTTTCCACAGAA | 247 |
| GAPDH | CCATCTTCCAGGAGCGAGA | GGCAGTGATGGCATGGACTGT | 326 |
Иммунофлюоресцентное окрашивание. Покровные стекла с клетками, распластанными при росте в культуре, переносили в чашки 35 мм, однократно отмывали PBS 5 мин, фиксировали 4%-ным параформальдегидом 15 мин, затем 70%-ным этиловым спиртом в течение ночи при 4°С, обрабатывали 0.2%-ным Тритоном X-100 10 мин, промывали PBS 2 раза по 5 мин. Сайты неспецифического связывания антител блокировали 1 ч раствором, содержащим 3% БСА и 0.1% Твина 20. Затем на клетки наносили специфические антитела (разведение в 50–200 раз) в блокирующем растворе на 1 ч при КТ. В случае окраски препарата с помощью двух разных первых антител (например, против ЦК и виментина) сначала наносили кроличьи антитела к цитокератинам на 2 ч при КТ, промывали 3 раза по 5 мин PBS, и наносили мышиные антитела против виментина на 2 ч при КТ. Затем стекла промывали 3 раза по 5 мин PBS и наносили смесь вторых антител против IgG кролика, конъюгированных с Cy5, и против IgG мыши, конъюгированных с Су3 на 1 ч при КТ. Затем стекла с клетками отмывали 3 раза по 5 мин PBS и заключали в среду Аnti-Fade (BioRad, США), уменьшающую неспецифическую флюоресценцию и содержащую краситель DAPI для окраски ДНК. Иммунофлюоресцентные изображения получали на сканирующем микроскопе Leica (Carl Zeiss, Германия), используя лазеры с длиной волны 405, 543 и 633 нм и объектив 63×.
Антитела. Для иммунофлюоресценции были использованы следующие антитела: кроличьи анти-ПанЦК (Thermo Fisher Scientific, США), мышиные анти-виментин (Sigma, США), мышиные моноклональные антитела против AMACR были получены самостоятельно (Popov et al., 2018). Антитела козы против IgG (H+L) мыши, конъюгированные с цианиновым красителем Cy3 и антитела козы против IgG кролика, конъюгированные с Cy5 (Molecular Probes, Thermo Fisher Scientific, США) служили в качестве вторых антител для иммунофлюоресценции. Для иммуноблота использовали анти-кроличьи антитела, конъюгированные с пероксидазой хрена (HRP; Cell Signaling, США) и анти-мышиные антитела, конъюгированные с HRP (BioRad, США).
РЕЗУЛЬТАТЫ
Морфологические изменения ткани ПЖ у пациентов с РПЖ. Образцы ткани ПЖ, взятые из опухоли и окружающей ее нормальной ткани в ходе оперативного вмешательства, были подвергнуты гистологическому анализу после фиксации и окраски гематоксилин/эозином с последующей микроскопией в проходящем свете. В нормальной ткани ПЖ при микроскопии выявляли альвеолярно-трубчатые эпителиальные железы в продольном и поперечном сечении, разделeнные прослойками соединительной ткани (рис. 1I, a). В опухолевых образцах обращала на себя внимание гиперплазия железистой ткани ПЖ, проявляющаяся в значительном увеличении числа мелких и средних желез с небольшими внутренними просветами и узкими прослойками разделяющей их соединительной ткани (рис. 1I, b). В опухолевой ткани структура желез была нарушена, базальный слой клеток практически отсутствовал, клетки люминального слоя теряли столбчатую форму (рис. 1I, b).
Рис. 1.
Функционально различные маркеры в опухолевой и нормальной ткани предстательной железы (ПЖ) у пациентов с раком ПЖ. I – Гистологические препараты участков нормальной (а) и опухолевой (б) ткани ПЖ; окраска гематоксилин-эозином; стрелками показаны эпителиальные структуры ПЖ; имиджи получены на микроскопе Axiovert 200M (Германия), камера DFC420 (Leica, Германия) в режиме проходящего света, размер снимка 1728 × 1296 пикселей, об. 20×. II – Эпителиальные (а) и стромальные (б) клетки в первичных стромальных культурах ПЖ; стрелками показаны эпителиальные (а) и стромальные (б) клетки, имиджи получены на том же микроскопе в режиме фазового контраста, размер снимка 1728 × 1296 пикселей, об. 20×. III – Маркеры в первичных стромальных культурах ПЖ; показаны совмещенные изображения, полученные при окраске специфическими антителами к цитокератинам (ПанЦК, а), виментину (б), к цитокератинам и виментину (в), к AMACR в стромальной культуре из нормальной (г) и опухолевой (д) ткани; ядра окрашены DAPI (синий цвет); иммунофлюоресцентные изображения получали на сканирующем конфокальном микроскопе Leica (Carl Zeiss, Германия), лазеры с длиной волны 405, 543 и 633 нм, размер снимка 1024 × 1024 пикселей, объектив 63×.
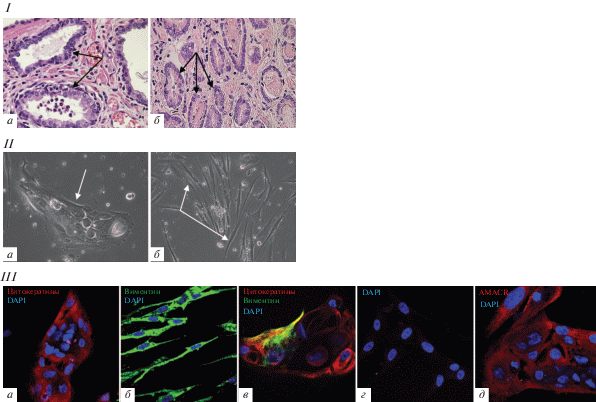
Характеристика первичных клеточных культур, полученных из ткани ПЖ. Первичные культуры из нормальной или опухолевой ткани ПЖ человека, растущие в специальной среде SCBM (Lonza, Швейцария) для стромальных клеток ПЖ, начинали формироваться на второй неделе культивирования и были представлены эпителиальными клетками. Такие клетки имели полигональную форму, тесно контактировали друг с другом и формировали кластеры, увеличивающие в размерах по мере роста (рис. 1II, a). На третьей неделе культивирования мы наблюдали появление в первичных культурах веретенообразных фибробласто-подобных клеток, растущих раздельно (рис. 1II, б), и постепенно формирующих клоны, размер которых увеличивался в процессе культивирования, пока популяция стромальных клеток не становилась гомогенной, что совпадало с уменьшением количества и постепенным полным исчезновением эпителиальных клеток.
Маркерная характеристика клеток в первичных стромальных культурах ткани ПЖ человека. Клетки первичных культур ПЖ были окрашены с помощью антител к эпителиальным, стромальным маркерам, и маркеру РПЖ AMACR. В качестве эпителиальных маркеров мы использовали ЦК, которые выявляются антителами, распознающими один и тот же эпитоп в нескольких ЦК (ПанЦК), а в качестве стромального маркера – виментин. Полигональные плотно прилегающие друг к другу клетки, формирующие кластеры в начале культивирования клеточной суспензии из ткани ПЖ, окрашивались антителами к ПанЦК (рис. 1III, a). Фибробласто-подобные клетки, растущие отдельно и постепенно становящиеся доминантной популяцией в стромальных культурах ПЖ, окрашивались на виментин (рис. 1III, б). Вместе с тем, при одновременной окраске антителам к ПанЦК и виментину в первичных культурах через 2–3 нед. культивирования выявлялись клетки, которые продуцировали как ЦК, так и виментин (рис. 1III, в). С целью идентификации клеток, происходящих из опухолевой ткани ПЖ, мы красили первичные культуры антителами к AMACR. Этот маркер отсутствовал в эпителиальных клетках первичных культур ПЖ, происходящих из нормальной ткани ПЖ (рис. 1III, г), но ясно определялся в эпителиальных клетках первичных культур, происходящих из опухолевой ткани (рис. 1III, д).
ОК нормальной и опухолевой ткани ПЖ. Органоиды в 3D-культурах ПЖ появлялись уже на 3-и сут культивирования, их количество в матригеле значительно возрастало к 7-м сут культивирования (рис. 2I, а), а к 14-м сут размер и число органоидов возрастало в еще большей степени (рис. 2I, b) и они подвергались пассированию 1 : 4 в том же формате.
Рис. 2.
Маркерная характеристика органоидных культур (ОК), производных нормальной ткани ПЖ (I), нормальной и опухолевой тканей ПЖ (II). I: Культивирование в течение 7 сут (а) и 14 сут (б–в); черными стрелками отмечены органоиды, красными стрелками – эпителиальные клетки; имиджи получены на том же микроскопе, что и на рис. 1а–в в режиме проходящего света, об. 20×; г – иммунофлюоресценция цитокератинов (красный цвет) и виментина (зеленый цвет) в эпителиальных клетках, происходящих из ОК-ПЖ при окраске специфическими антителами; ядра окрашены DAPI (синий цвет); имиджи получали на сканирующем микроскопе Leica (Carl Zeiss, Германия), лазеры с длиной волны 405, 543 и 633 нм, об. 63×. II – Электрофоретические имиджи продуктов ОТ-ПЦР-амплификации – маркеров базального (ЦК5, р63) и люминального (ЦК18, AR) эпителия, а также AMACR в нормальной и опухолевой тканях ПЖ и в производных ОК. Маркерный белок сравнения (М) – 100 пар оснований (100 п. о.).
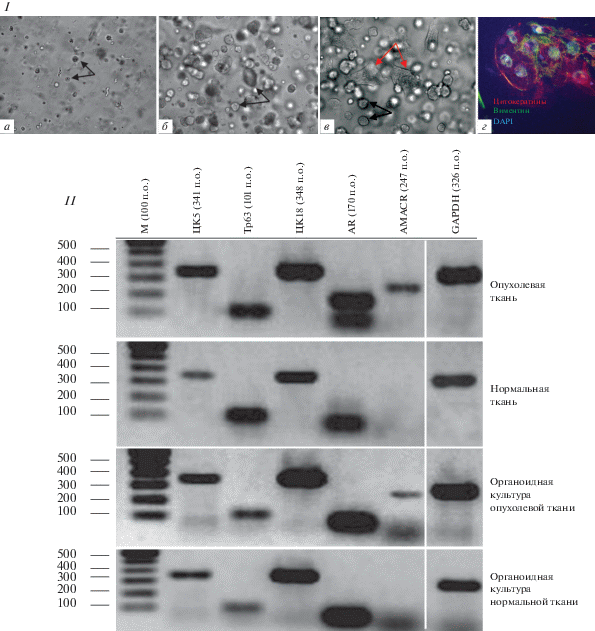
В некоторых ОК выявлялся рост эпителиальных клеток (рис. 2I, в). Такие клетки, как и первичный эпителий в стромальных культурах, были позитивны при окраске антителами к ПанЦК в случае переноса в чашки Петри 60 мм и пассирования. При пассировании с последующей окраской таких клеточных культур антителами к ПанЦК и виментину в иммунофлюоресценции выявлялась продукция ЦК и виментина в одних и тех же клетках (рис. 2I, г).
Маркерная характеристика тканей и ОК-ПЖ с помощью ОТ-ПЦР. С целью подтверждения идентичности нормальной, опухолевой ткани ПЖ и производных ОК, мы оценивали экспрессию генов маркеров базального (ЦК5, р63) и люминального (ЦК18, AR) эпителия ПЖ, а также маркера РПЖ гена AMACR, а в качестве контроля – гена GAPDH путем ОТ-ПЦР. В пробах тканей ПЖ, полученных от 10 пациентов, и производных органоидах всегда выявляли в одних и тех же культурах маркеры базальных и люминальных эпителиальных клеток ПЖ. Это в равной степени касалось органоидов, происходящих из нормальной и опухолевой тканей. В опухолевой ткани и производных органоидах присутствовал AMACR, который отсутствовал в нормальной ткани ПЖ и производных органоидах (рис. 2II).
ОБСУЖДЕНИЕ
В настоящей работе мы нашли, что в отличие от быстрого появления и формирования гомогенной популяции мезенхимных клеток в первичных стромальных культурах большинства тканей, например, костного мозга, жировой ткани, эндометрия, тканей сердца, мочевого пузыря и других (Popov et al., 2007; Musina et al., 2008; Meirelles, Nardi, 2009; Zhidkova et al., 2013; Mikheeva et al., 2018), стромальные клеточные культуры ПЖ человека имеют другие свойства. В стромальных культурах ПЖ клетки появляются на 2-ой нед. культивирования и представляют собой эпителиальные клетки, продуцирующие ЦК. Только к концу 4-ой нед. культивирования происходит формирование гомогенной популяции мезенхимных клеток, продуцирующих виментин, чему сопутствует исчезновение эпителиальных клеток.
Наши наблюдения подтверждаются публикациям исследователей из других лабораторий, в которых было отмечено, что эксплантаты ПЖ человека вначале формируют клетки с эпителиальной морфологией, тогда как стромальные клетки в культуре появляются после 21-суточного культивирования (Janssen et al., 2000). В публикации из другой лаборатории, в которой авторы использовали суспензию клеток ПЖ, клетки первичной культуры вначале показывали наличие эпителиальных маркеров и только на 5-ом пассаже становились гомогенно-подобными фибробластными клетками, продуцирующими виментин (Gravina et al., 2013). Быстрое формирование гомогенной популяции мезенхимных клеток в первичных стромальных культурах большинства тканей, вероятно, связано с их происхождением из первичной мезенхимы, а не из тканеспецифических СК (Sági et al., 2012). И наоборот, отставание формирования мезенхимных клеток в первичных культурах ПЖ от мезенхимных клеток из большинства органов, возможно, свидетельствует об их происхождении из другого источника, например, из эпителиальных клеток ПЖ, которые формируются в начале культивирования в первичных культурах ПЖ. Результаты нашей работы предполагают, что смена эпителиального профиля клеток на мезенхимный в первичных культурах ПЖ человека может происходить вследствие эпителиально-мезенхимного перехода (ЭМП).
Такое предположение подтверждается наблюдением, что в первичных стромальных культурах ПЖ человека формируются клетки, которые одновременно продуцируют как эпителиальные маркеры (ЦК), так и стромальный маркер – виментин. Такое наблюдение подтверждается и результатами культивирования органоидов ПЖ, происходящих из тканеспецифических СК. Органоиды ПЖ в ходе культивирования часто показывают сопутствующий рост эпителиальных клеток, но никогда не формируют стромальные клетки. Однако последующее культивирование эпителия, полученного из органоидных культур ПЖ, выявляет (с помощью иммунофлюоресценции) в отдельных клетках продукцию цитокератинов и виментина (рис. 2I, г), как это наблюдается в первичных культурах ПЖ (рис. 1III, в).
Известно, что ЭМП и обратный мезенхимно-эпителиальный переход (МЭП) относятся к физиологическим процессам, которые организм использует в ходе развития, регенерации, регуляции свойств СК. ЭМП также вовлечен в формирование фиброза, воспаления, инвазии и метастазировании (Zhang, Weinberg, 2018). С другой стороны, известно, что способность к инвазии и метастазированию существенно различается в различных тканях, что может быть связано с особенностями сигнальных путей и мезенхимно-эпителиальными взаимодействиями, регулирующими рост эпителия (Grant, Kyprianou, 2013). Склонность эпителия ПЖ к злокачественной трансформации и развитию КР-РПЖ могут быть основаны на особенностях сигнальной регуляции, которая осуществляется андрогенами. Андроген-депривационная терапия РПЖ неизбежно завершается мутациями рецептора AR и восстановлением андрогенного сигналинга по коллатеральным путям или репрограммированием клеток первичного РПЖ и возникновением КР-РПЖ, который устойчив к андроген-депривационной терапии. Последующее изучение механизма ЭМП в клетках ПЖ позволит понять механизм их чувствительности к раковой трансформации и выработать эффективные способы его терапии.
Список литературы
Abate-Shen C., Shen M.M. 2000. Molecular genetics of prostate cancer. Genes Dev. V. 14. P. 2410.
Bao S., Wu Q., McLendon R.E., Hao Y., Shi Q., Hjelmeland A.B., Dewhirst M.W., Bigner D.D., Rich J.N. 2006. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. V. 444. P. 756.
Bartsch G., Rohr H.P. 1980. Comparative light and electron microscopic study of the human, dog and rat prostate. An approach to an experimental model for human benign prostatic hyperplasia (light and electron microscopic analysis) – a review. Urol. Int. V. 35. P. 91.
Bleijs M. van de Wetering M. Clevers H. Drost J. 2019. Xenograft and organoid model systems in cancer research. EMBO J. V. 38. P. e101654. https://doi.org/10.15252/embj.2019101654
Brawer M.K., Peehl D.M., Stamey T.A., Bostwick D.G. 1985. Keratin immunoreactivity in the benign and neoplastic human prostate. Cancer Res. V. 45. P. 3663.
Clevers H. 2011. The cancer stem cell: premises, promises and challenges. Nat. Med. V. 17. P. 313.
Drost J., Karthaus W.R., Gao D., Driehuis E., Sawyers C.L., Chen Y., Clevers H. 2016. Organoid culture systems for prostate epithelial and cancer tissue. Nat. Protoc. V. 11. P. 347.
Elbadawy M., Abugomaa A., Yamawaki H., Usui T., Sasaki K. 2020. Development of Prostate Cancer Organoid Culture Models in Basic Medicine and Translational Research. Cancers (Basel). V. 12. P. 777.
Fizazi K., Tran N., Fein L., Matsubara N., Rodriguez-Antolin A., Alekseev B.Y., Özgüroğlu M., Ye D., Feyerabend S., Protheroe A., Sulur G., Luna Y., Li S., Mundle S., Chi K.N. 2019. Abiraterone acetate plus prednisone in patients with newly diagnosed high-risk metastatic castration-sensitive prostate cancer (LATITUDE): final overall survival analysis of a randomised, double-blind, phase 3 trial. Lancet Oncol. V. 20. P. 686.
Gao D., Vela I., Sboner A., Iaquinta P.J., Karthaus W.R., Gopalan A., Dowling C., Wanjala J.N., Undvall E.A., Arora V.K., Wongvipat J., Kossai M., Ramazanoglu S., Barboza L.P., Di W., Cao Z., Zhang Q.F., Sirota I., Ran L., MacDonald T.Y., Beltran H., Mosquera J.M., Touijer K.A., Scardino P.T., Laudone V.P., Curtis K.R., Rathkopf D.E., Morris M.J., Danila D.C., Slovin S.F., Solomon S.B., Eastham J.A., Chi P., Carver B., Rubin M.A., Scher H.I., Clevers H., Sawyers C.L., Chen Y. 2014. Organoid cultures derived from patients with advanced prostate cancer. Cell. V. 159. P. 176.
Goldstein A.S., Lawson D.A., Cheng D., Sun W., Garraway I.P., Witte O.N. 2008. Trop2 identifies a subpopulation of murine and human prostate basal cells with stem cell characteristics. Proc. Natl. Acad. Sci. USA, V. 105. P. 20882.
Grant C.M., Kyprianou N. 2013. Epithelial mesenchymal transition (EMT) in prostate growth and tumor progression. Transl. Androl. Urol. V. 2. P. 202.
Gravina G.L., Mancini A., Ranieri G., Di Pasquale B., Marampon F., Di Clemente L., Ricevuto E., Festuccia C. 2013. Phenotypic characterization of human prostatic stromal cells in primary cultures derived from human tissue samples. Int. J. Oncol. V. 42. P. 2116.
Janssen M., Albrecht M., Möschler O., Renneberg H., Fritz B., Aumüller G., Konrad L. 2000. Cell lineage characteristics of human prostatic stromal cells cultured in vitro. Prostate. V. 43. P. 20.
Karthaus W.R., Iaquinta P.J., Drost J., Gracanin A., van Boxtel R., Wongvipat J., Dowling C.M., Gao D., Begthel H., Sachs N., Vries R.G.J., Cuppen E., Chen Y., Sawyers C.L., Clevers H.C. 2014. Identification of multipotent luminal progenitor cells in human prostate organoid cultures. Cell. V. 159. P. 163.
Li X., Lewis M.T., Huang J., Gutierrez C., Osborne C.K., Wu M.F., Hilsenbeck S.G., Pavlick A., Zhang X., Chamness G.C., Wong H., Rosen J., Chang J.C. 2008. Intrinsic resistance of tumorigenic breast cancer cells to chemotherapy. J. Natl. Cancer. Inst. V. 100. P. 672.
Meirelles L. da S., Nardi N.B. 2009. Methodology, biology and clinical applications of mesenchymal stem cells. Front Biosci-Landmrk. V. 14. P. 4281.
Mikheeva N.F., Butylin P.A., Zaritskii A.Yu., Popov B.V. 2018. A Decrease in the Proliferative Activity of Human Mesenchymal Stem Cells during Long-Term Cultivation is Not Connected with Change in Their Migration Properties. Cell and Tissue Biology. V. 12. P. 197.
Musina R.A., Belyavski A.V., Tarusova O.V., Solovyova E.V., Sukhikh G.T. 2008. Endometrial mesenchymal stem cells isolated from the menstrual blood. Bull. Exp. Biol. Med. V. 145. P. 539.
Popov B.V., Serikov V.B., Petrov N.S., Izusova T.V, Gupta N., Matthay M.A. 2007. Lung epithelial cells induce endodermal differentiation in mouse mesenchymal bone marrow stem cells by paracrine mechanism. Tissue Eng. V. 13. P. 2441.
Popov B.V., Sutula G.I., Petrov N.S., Yang X.J. 2018. Preparation and characterization of the antibody recognizing AMACR inside its catalytic center. Int. J. Oncol. V. 52. P. 547.
Prins G.S., Putz O. 2008. Molecular signaling pathways that regulate prostate gland development. Differentiation. V. 76. P. 641.
Puca L., Bareja R., Prandi D., Shaw R., Benelli M., Karthaus W.R., Hess J., Sigouros M., Donoghue A., Kossai M., Gao D., Cyrta J., Sailer V., Vosoughi A., Pauli C., Churakova Y., Cheung C., Deonarine L.D., McNary T.J., Rosati R., Tagawa S.T., Nanus D.M., Mosquera J.M., Sawyers C.L., Chen Y., Inghirami G., Rao R.A., Grandori C., Elemento O., Sboner A., Demichelis F., Rubin M.A., Beltran H. 2018. Patient derived organoids to model rare prostate cancer phenotypes. Nat. Commun. V. 9. P. 2404.
Sági B., Maraghechi P., Urbán V.S, Hegyi B., Szigeti A., Fajka-Boja R., Kudlik G., Német K., Monostori E., Gócza E., Uher F. 2012. Positional identity of murine mesenchymal stem cells resident in different organs is determined in the postsegmentation mesoderm. Stem Cells Dev. V. 21. P. 814.
Sato T., Stange D.E., Ferrante M., Vries R.G., Van Es J.H., Van den Brink S., Van Houdt W.J., Pronk A., Van Gorp J., Siersema P.D., Clevers H. 2011. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett’s epithelium. Gastroenterology. V. 141. P. 1762.
Sato T., Vries R.G., Snippert H.J., van de Wetering M., Barker N., Stange D.E., van Es J.H., Abo A., Kujala P., Peters P.J., Clevers H. 2009. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. V. 459. P. 262.
Siegel R.L., Miller K.D., Jemal A. 2016. Cancer statistics, 2016. CA Cancer J. Clin. V. 66. P. 7.
Siegel R.L., Miller K.D., Jemal A. 2018. Cancer statistics, 2018. CA Cancer J. Clin. V. 68. P. 7.
Signoretti S., Waltregny D., Dilks J., Isaac B., Lin D., Garraway L., Yang A., Montironi R., McKeon F., Loda M. 2000. p63 is a prostate basal cell marker and is required for prostate development. Am. J. Pathol. V. 157. P. 1769.
Trerotola M., Rathore S., Goel H.L., Li J., Alberti S., Piantelli M., Adams D., Jiang Z., Languino L.R. 2010. CD133, Trop-2 and alpha2beta1 integrin surface receptors as markers of putative human prostate cancer stem cells. Am. J. Transl. Res. V. 2. P. 135.
Visvader J. E. 2011. Cells of origin in cancer. Nature. V. 469. P. 314.
Xin L. 2013. Cells of origin for cancer: An updated view from prostate cancer. Oncogene. V. 32. P. 3655.
Zhang Y., Weinberg R.A. 2018. Epithelial-to-mesenchymal transition in cancer: complexity and opportunities. Front Med. V. 12. P. 361.
Zhidkova O.V., Petrov N.S., Popov B.V. 2013. Production and characteristics of the growth and marker properties of mesenchymal stem cells of urinary bladder. Zh. Evol. Biokhim. Fiziol. V. 49. P. 67.
Дополнительные материалы отсутствуют.


