Цитология, 2021, T. 63, № 4, стр. 379-389
Роль СК19-позитивных клеток портальных зон при тиоацетамид-индуцированном циррозе печени крыс
Е. И. Лебедева *
Кафедра гистологии, цитологии и эмбриологии Витебского государственного медицинского университета
210009 Витебск, Республика Беларусь
* E-mail: lebedeva.ya-elenale2013@yandex.ru
Поступила в редакцию 14.04.2021
После доработки 27.04.2021
Принята к публикации 28.04.2021
Аннотация
При заболеваниях печени инициируется сложный механизм регенерации, проявляющийся в пролиферации, дифференцировке, миграции клеток, реструктуризации стромы и ангиогенезе. К настоящему времени клеточные и молекулярно-генетические механизмы нарушения регенерации и резервные возможности восстановления печени до конца не изучены. Целью исследования явилось изучение роли СК19-позитивных клеток портальных зон при тиоацетамид-индуцированном циррозе печени крыс. Установлено, что при фиброгенезе печени СК19-позитивные клетки портальных зон мигрируют по соединительнотканным септам и дифференцируются в клетки двух линий: холангиоциты, формирующие междольковые желчные протоки и проточки, и гепатоциты, формирующие зачатки новых печеночных микродолек. Выявлена морфологическая и функциональная гетерогенность популяции пролиферирующих СК19-позитивных клеток.
Регенерация печени – это весьма сложный, динамичный и до конца не изученный процесс, в котором задействованы различные популяции клеток (гепатоциты, холангиоциты, клетки Ито/звездчатые клетки, эндотелиоциты, тканевые макрофаги/клетки Купфера, инфильтрирующие моноциты/макрофаги), молекулярные каскады сигнальных путей и эпигенетические механизмы (Gilgenkrantz et al., 2018; Abu Rmilah et al., 2019; Van Haele et al., 2019; Li et al., 2020). В зависимости от природы повреждающего агента, степени тяжести и места локализации повреждения печень интегрирует данные компоненты по-разному. На протяжении многих лет определение источника клеток, способствующего регенерации печени, остается фундаментальной проблемой в гепатологии (Fabris et al., 2017; Abu Rmilah et al., 2019; Lee et al., 2020).
При многих острых и хронических заболеваниях печени в области портальных зон исследователи наблюдают усиленную пролиферацию клеток. У человека этот процесс называют протокой или дуктулярной реакцией. В отношении лабораторных животных преимущественно говорят об овально-клеточной пролиферации (Gouw et al., 2011; Overi et al., 2020; Ge et al., 2020; Szucs et al., 2020).
Большинство ученых предполагают (Li et al., 2020; Overi et al., 2020; Ge et al., 2020), что протоковая реакция представляет собой пролиферацию печеночных стволовых клеток (бипотентных стволовых клеток/клеток-предшественниц печени, HPCs), способных дифференцироваться в гепатоциты и холангиоциты. В настоящее время убедительных доказательств в поддержку этой гипотезы нет. Окончательные места локализации HPCs до сих пор не установлены. Другие исследователи связывают появление протоковой реакции с активацией холангиоцитов, протоковой метаплазией зрелых гепатоцитов, дифференцировкой клеток, мигрирующих из костного мозга (Lee et al., 2014; Yanger et al., 2014; Chien et al., 2018; Tsuchiya et al., 2019).
Отсутствие специфических фенотипических маркеров для HPCs, дифференцирующихся и зрелых клеток внутрипеченочных желчевыводящих путей осложняет поиск источника происхождения протоковых клеток портальных зон. Часто в качестве маркеров HPCs исследователи используют EpCAM и SOX9, а для идентификации холангиоцитов – CK7 или CK19. Однако холангиоциты также экспрессируют маркеры EpCAM и SOX9, а HPCs – СК19. Вместе с тем для идентификации HPCs применяют и другие маркеры, такие как TROP2, Lgr5, OV6, A6, CD24, CD133, NGA2 и CXCR4. Согласно литературным данным, маркер CK19 относится к цитокератинам кислого типа с низкой молекулярной массой и является ключевым фенотипическим маркером билиарных и стволовых клеток печени (Sato et al., 2019; Overi, 2020).
В последнее время возникают разногласия по поводу функции протоковых клеток портальных зон. Одни специалисты считают, что эти клетки принимают участие в регенерации печени путем дифференцировки в гепатоциты. Неизвестно, способны ли прогениторные клетки печени и холангиоциты полностью дифференцироваться в гепатоциты во время регенерации печени (Kamimoto et al., 2020; Xu et al., 2020). Выявленная корреляционная связь между фиброзом печени и протоковой реакцией дает основание предполагать, что она усиливает фиброгенез. Очевидно решение данного вопроса будет иметь важное значение при разработке антифибротических препаратов (Williams et al., 2014; Rоkusz et al., 2017; Zhao et al., 2018; Sato et al., 2019).
Также назрела необходимость консенсуса в отношении терминологии не только в связи с протоковой реакциeй портальных зон, но и внутрипеченочных желчных путей. Согласованность в этом вопросе до настоящего времени не достигнута. Использование общепринятых терминов ускорит процесс сопоставления полученных данных, систематизирует их и облегчит интерпретацию функций данных клеток при патологиях печени (Roskams et al., 2004; Gouw et al., 2011).
Таким образом, в отношении протоковой реакции существует ряд неразрешенных проблем, требующих проведения фундаментальных исследований. В рамках настоящей работы использовали международные термины по цитологии и гистологии (Банин, Быков, 2009), а протоковую реакцию описывали как пролиферацию клеток портальных зон. Целью исследования явилось изучение роли СК19-позитивных клеток портальных зон при тиоацетамид-индуцированном циррозе печени крыс.
МАТЕРИАЛ И МЕТОДИКА
Экспериментальное исследование выполнено на 117 половозрелых крысах-самцах Wistar весом от 190 до 210 г. Животных содержали в пластико-металлических клетках по 6 особей при естественном освещении со свободным доступом к корму и воде. Температура в помещении вивария поддерживалась на уровне 21–23°С, а влажность воздуха составляла около 50%. Цирроз печени у животных индуцировали свежеприготовленным раствором тиоацетамида (ТАА), который вводили в желудок с помощью зонда в дозе 200 мг/кг массы тела животного 2 раза в неделю за 3 ч до кормления в течение 17 нед. Согласно литературным данным, у лабораторных животных ТАА вызывает поражение печени с морфологическими характеристиками, аналогичными таковым у людей с фиброзом и циррозом печени (Muthiah et al., 2019). Животных рандомизировали на 9 групп по 12 особей в каждой (m0 – контрольная, m1 – длительность воздействия ТАА 3 нед., m2 – длительность воздействия ТАА 5 нед., m3 – длительность воздействия ТАА 7 нед., m4 – длительность воздействия ТАА 9 нед., m5 – длительность воздействия ТАА 11 нед., m6 – длительность воздействия ТАА 13 нед., m7 – длительность воздействия ТАА 15 нед., m8 – длительность воздействия ТАА 17 нед.). В ходе эксперимента погибло 9 животных.
Гистологическое и иммуногистохимическое исследования. После гуманного умерщвления животных декапитацией с применением гильотины в состоянии кратковременного эфирного наркоза из большой левой доли печени крыс забирали образцы материала диаметром 5–10 мм. Время препарирования одного животного не превышало 2 мин. Для проведения гистологического и иммуногистохимического исследований образцы печени помещали в 10%-ный раствор нейтрального формалина на фосфатном буфере и фиксировали в течение 24 ч. Затем проводили обработку фиксированного материала с последующей заливкой в парафин с использованием автомата для гистологической обработки ткани (STP-120, тип карусель, Thermo Fisher Scientific, Германия) и станции для заливки ткани парафином (EC350, Thermo Fisher Scientific, Германия). От каждого животного получали по одному блоку для каждого метода окраски и с помощью ротационного микротома (НМ340Е, MICROM, Laborgerate GmbH, Германия) изготавливали в среднем по 3–4 среза толщиной 4 мкм и помещали их на предметные стекла. Для получения обзорных гистологических препаратов срезы печени окрашивали гематоксилином и эозином, а для выявления соединительной ткани – по методу Маллори в автоматическом программируемом приборе для цитологических и гистологических исследований (HMS70, Thermo Fisher Scientific, Германия). Степень фиброза определяли согласно полуколичественной шкале Ishak K.G. (Everhart et al., 2010).
Иммуногистохимическое исследование проводили на парафиновых срезах (Коржевский, 2014) с использованием моноклональных мышиных антител CК19 (разведение 1 : 1000) в соответствии с инструкцией производителя. Для лучшей ориентации в препарате и правильной идентификации клеток, содержащих искомый антиген, срезы подкрашивали гематоксилином Майера в течение 1 мин. Для объективной интерпретации результатов для каждой исследуемой серии (группы животных) использовали положительный и отрицательный контроли. Иммуногистохимическую окраску расценивали как положительную только при отсутствии окрашивания в отрицательном контроле и, наоборот, как отрицательную при окрашивании в положительном контроле.
Морфометрический анализ гистологических препаратов проводили с использованием компьютерных программ анализа изображений ImageScope Color и cellSens Standard. Определяли площадь, занимаемую СК19-позитивными клетками в процентах к площади изображения без учета интенсивности окраски экспрессии маркера (Guerrier et al., 2014). Измерения проводили на цифровых изображениях, полученных с помощью цифровой камеры OLYMPUS XC30 (Япония) на базе микроскопа OLYMPUS BX51 (Япония) при увеличении объектива 20×. Анализировали не менее 3 полей зрения на каждом гистологическом срезе.
Статистический анализ. Статистический анализ выполняли с использованием программ Statistica 10.0 фирмы StatSoft, IBM SPSS Statistics 23.0, Microsoft Office Excel. Для каждой выборки определяли нормальность частотного распределения каждого признака. Выборки не являлись малыми (n = 60 > 50), поэтому проверку осуществляли по критерию Лиллиефорса. Анализ показал, что во всех группах (кроме группы m7) частотные распределения признака не соответствуют нормальному распределению. На основании полученных результатов анализ влияния продолжительности эксперимента (стадии фиброза) на исследуемый признак проводили с помощью непараметрического критерия Краскела–Уоллиса.
Использованные реактивы. Тиоацетамид (Acros Organics, Бельгия); формалин, этиловый спирт, ксилол, гематоксилин Майера, эозин (Биовитрум, Россия); набор 2-step plus Poly-HRP Anti Rabbit/Mouse IgG Detection System/with DAB Solution, моноклональные мышиные антитела CК19 (номер в каталоге Е-АВ-70231) (Wuman Elabscience Biotechnology Incorporated Company, Китай); Retrieve-All Antigen (Unmasking System Basic, США); буфер для разведения антител (BioLegend Inc, США); Tween 20 (Glentham Life Sciences, Великобритания); PBS (Melford, Великобритания).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При микроскопическом изучении гистологических препаратов печени крыс контрольной группы морфология паренхимы органа соответствовала критериям нормы. В центре классической дольки четко визуализировались центральная вена, а по периферии – печеночные триады с междольковой артерией, междольковой веной и двумя−тремя междольковыми желчными протоками (рис. 1).
Рис. 1.
Гистологический препарат печени крысы из контрольной группы. Междольковые желчные протоки отмечены стрелками. Иммуногистохимическое выявление СК19 и окрашивание гематоксилином Майера. Увел. об. 40×.
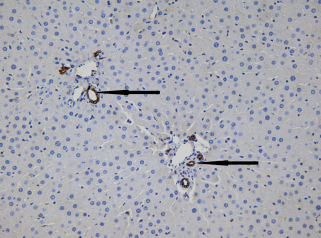
В холангиоцитах протоков и проточков интенсивно экспрессировался билиарный маркер цитокератин СК19. В светлых и крупных ядрах клеток протоков выявлялись гипербазофильные ядрышки. Клетки эпителия междольковых протоков имели кубическую форму, а эпителиальные клетки желчных проточков были ближе к плоской форме. Цитоплазма этих клеток была окрашена в коричневый цвет. Полученные результаты подтверждают описанную другими исследователями гетерогенность билиарного эпителия внутрипеченочных желчных путей, в том числе секреторную и пролиферативную (Glaser et al., 2009; Lee et al., 2014). Следует отметить, что вблизи протоков и проточков локализовались клетки с признаки недифференцированных. Они имели базофильные ядра, небольшой объем цитоплазмы, небольшие размеры, округлую форму и не экспрессировали маркер СК19.
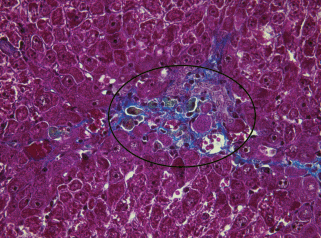
При моделировании цирроза печени у всех экспериментальных крыс наблюдали постепенное нарастание деструктивных и дистрофических явлений. На начальном этапе эксперимента (через 3 нед.) выявляли: очаговые поражения гепатоцитов в виде вакуольной дистрофии с плазмолизисом и кариолизисом, перинуклеарный отек, фиброзные расширения большинства портальных зон (портальный фиброз) (рис. 2). Степень фиброза по шкале Ishak K.G. соответствовала F1.
Рис. 2.
Гистологический препарат печени крысы с индуцированным циррозом через 3 нед. после начала эксперимента. Портальная зона отмечена рамкой овальной формы. Окраска по методу Маллори. Увел. об. 60×.
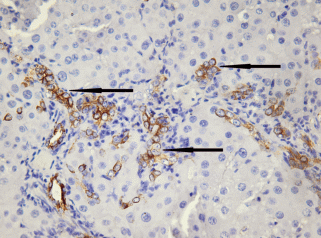
В портальных зонах вблизи междольковых желчных протоков и проточков концентрировались пролиферирующие крупные СК19-позитивные клетки преимущественно округлой формы (рис. 3). Они имели светлое овально-округлое ядро с узким ободком примембранного гетерохроматина, преобладанием эухроматина и одним−двумя ядрышками. Местами 2–5 таких клеток были собраны в группы, местами формировали отходящие от желчных протоков и проточков тяжи в два ряда клеток без просвета. Так как клетки протоков и проточков экспрессируют маркер CK19 (Glaser et al., 2009; Ge et al., 2020), с помощью гистологических подходов невозможно определить, какая именно клеточная популяция является источником пролиферирующих СК19-позитивных клеток. Нельзя исключать тот факт, что и протоки, и проточки являются родоначальниками данных клеток. По морфологическим признакам пролиферирующие СК19-позитивные клетки портальных зон соответствуют клеткам, описываемыми другими авторами как печеночные стволовые клетки/овальные клетки. (Roskams et al., 2004; Fabris et al., 2017; Ge et al., 2020).
Рис. 3.
Гистологический препарат печени крысы с индуцированным циррозом через 3 нед. после начала эксперимента. Пролиферирующие крупные СК19-позитивные клетки отмечены стрелками. Иммуногистохимическое выявление СК19 и окрашивание гематоксилином Майера. Увел. об. 60×.
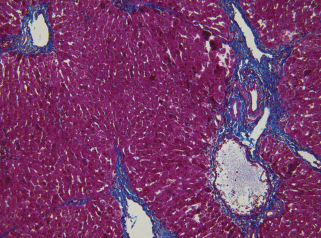
Через 5–7 нед. эксперимента на гистологических препаратах печени крыс из экспериментальной группы выявили прогрессирование токсического поражения: очаги некроза гепатоцитов, нарастание отека паренхимы, портальный и мостовидный фиброз. Его степень соответствовала F2/F3 (через 5 нед., рис. 4) и F3/F4 (через 7 нед.).
Рис. 4.
Гистологический препарат печени крысы с индуцированным циррозом через 5 нед. после начала эксперимента. Окраска по методу Маллори. Увел. об. 40×.
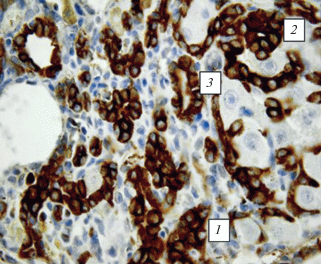
В портальных зонах и в соединительнотканных септах отмечалось увеличение числа междольковых желчных протоков, проточков и пролиферирующих СК19-позитивных клеток, формирующих два типа структур: тяжи и розетки с просветом и без просвета. На гистологических срезах можно было наблюдать стадии формирования междольковых желчных протоков: от округлых розеткообразных скоплений клеток без просвета и структур с намечающимся просветом до полностью сформированных протоков (рис. 5). Это свидетельствует о дифференцировке пролиферирующих СК19-позитивных клеток в холангиоциты. Формирующиеся протоки практически всегда сопровождали гипербазофильные веретеновидные клетки. Местами были отчетливо видны тяжи из СК19-позитивных клеток, образующиеся, по-видимому, в результате миграции этих клеток от желчных протоков и проточков портальных зон в соединительную ткань. Часто эти тяжи окружали границы намечающихся ложных печеночных долек.
Рис. 5.
Образование новых междольковых желчных протоков в печени крысы с индуцированным циррозом через 5 нед. после начала эксперимента. 1 – скопление клеток без просвета, 2 – скопление клеток с намечающимся просветом, 3 – скопление клеток со сформированным просветом. Иммуногистохимическое выявление СК19 и окрашивание гематоксилином Майера. Увел. об. 100×.
На фоне дальнейшей интоксикации животных (9–11 нед. эксперимента) в большинстве полей зрения гистологических препаратов выявляли признаки портального и мостовидного фиброза (F4/F5), очаги некроза гепатоцитов, увеличение количества желчных протоков (более двадцати поперечных сечений в одном участке гистологического препарата).
Вблизи портальных зон одновременно наблюдали два процесса: узелковой трансформации паренхимы органа с формированием единичных ложных печеночных долек (рис. 6) и образование в соединительнотканных септах небольших структур из скопления СК19-позитивных клеток морфологически сходных с гепатоцитами (микродолек). Можно было наблюдать, как на периферии микроделек выстраивался слой клеток вытянутой формы с базофильным ядром, затем снаружи от него локализовался слой пролиферирующих СК19-позитивных клеток, затем ситуация повторялась. Это свидетельствует о дифференцировке пролиферирующих СК19-позитивных клеток в гепатоциты и формировании новых печеночных долек/регенерирующих долек. Тяжи и розетки из СК19-позитивных клеток наблюдали во всех препаратах и по всему срезу (рис. 7).
Рис. 6.
Гистологический препарат печени крысы с индуцированным циррозом через 9 нед. после начала эксперимента. Сформированная ложная печеночная долька выделена рамкой овальной формы. Окраска по методу Маллори. Увел. об. 40×.
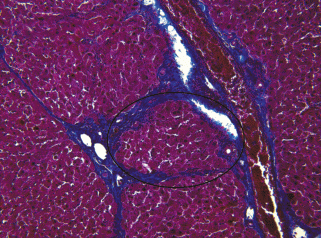
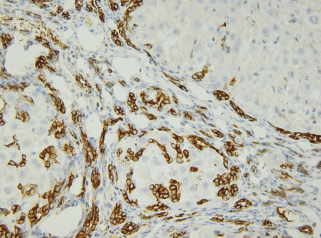
Рис. 7.
Гистологический препарат печени крысы с индуцированным циррозом через 11 нед. после начала эксперимента. Четко визуализируются тяжи и розетки из СК19-позитивных клеток. Иммуногистохимическое выявление СК19 и окрашивание гематоксилином Майера. Увел. об. 40×.
На следующем этапе эксперимента (13–15 нед.) гистологическое исследование печени крыс позволило установить тотальное поражение паренхимы в виде замещения соединительной тканью участков вакуольной дистрофии. На данном этапе отмечали выраженный цирроз с формированием многочисленных ложных печеночных долек (рис. 8). В соединительнотканых септах и портальных зонах в значительном количестве выявляли СК19-позитивные клетки, формирующие тяжи, желчные протоки и микродольки. Часто тяжи окружали ложные печеночные дольки по периферии, местами они направлялись в центр дольки (рис. 9). В крупных очагах некроза, среди погибающих и погибших гепатоцитов отмечали большое скопление пролиферирующих СК19-позитивных клеток. Вероятно, на месте некроза данные клетки формировали новую печеночную микродольку.
Рис. 8.
Гистологический препарат печени крысы с индуцированным циррозом через 15 нед. после начала эксперимента. Тотальное разрастание соединительной ткани в паренхиме. Новая печеночная микродолька выделена рамкой овальной формы. Окраска по методу Маллори. Увел. об. 40×.
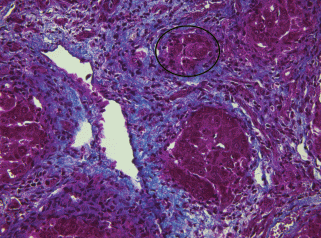
Рис. 9.
Гистологический препарат печени крысы с индуцированным циррозом через 15 нед. после начала эксперимента. СК19-позитивные клетки в соединительной ткани и по периферии ложной печеночной дольки. Иммуногистохимическое выявление СК19 и окрашивание гематоксилином Майера. Увел. об. 40×.
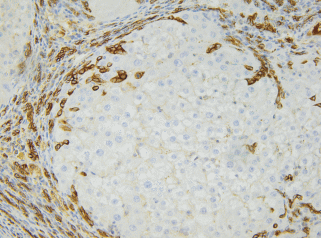
К концу эксперимента (17 нед.) в печени всех экспериментальных животных наблюдали тотальный цирроз с обширными полями соединительной ткани, ограничивающей ложные печеночные дольки широкими поясами (рис. 10). В отношении пролиферирующих СК19-позитивных клеток наблюдали картину, сходную с картиной на предыдущем сроке (рис. 11). В соединительнотканных септах и портальных зонах увеличилось количество микродолек, происходила выраженная пролиферация междольковых желчных протоков (рис. 12). В портальной зоне можно было обнаружить более 30 поперечных сечений протоков. При сопоставлении гистологических препаратов, окрашенных двумя способами (иммуногистохимический, гематоксилином и эозином) было отмечено, что практически всегда на всех сроках эксперимента в соединительнотканных септах тяжи из СК19-позитивных клеток сопровождали базофильно окрашенные клетки треугольной, крыловидной и палочковидной формы с нечетким разделением на цитоплазму и ядро (рис. 13).
Рис. 10.
Гистологический препарат печени крысы с индуцированным циррозом через 15 нед. после начала эксперимента. Выраженный цирроз печени. Окраска по методу Маллори. Увел. об. 40×.
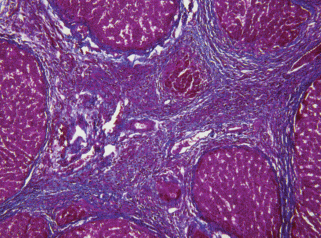
Рис. 11.
Гистологический препарат печени крысы с индуцированным циррозом через 17 нед. после начала эксперимента. Иммуногистохимическое выявление СК19 и окрашивание гематоксилином Майера. Увел. об. 20×.
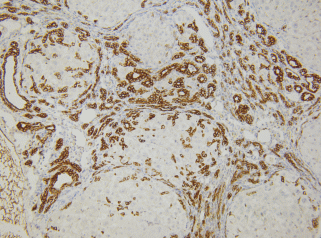
Рис. 12.
Гистологический препарат печени крысы с индуцированным циррозом через 17 нед. после начала эксперимента. Пролиферация междольковых желчных протоков. Окраска по методу Маллори. Увел. об. 60×.
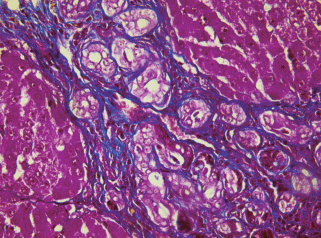
Рис. 13.
Гистологический препарат печени крысы с индуцированным циррозом через 17 нед. после начала эксперимента. Тяжи, образованные пролиферирующими крупными клетками, отмечены стрелкой. Окраска гематоксилином и эозином. Увел. об. 60×.
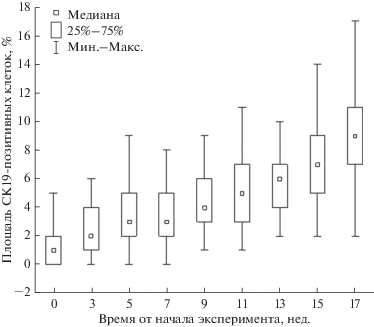
На рис. 14 представлена диаграмма размаха медиан, отражающая динамику изменений площади CК19-позитивных клеток на протяжении всего эксперимента. Как видно из графиков, с процессом прогрессирования фиброгенеза печени (увеличением количества нед. эксперимента) наблюдается тенденция роста процента площади данных клеток, причем на последних двух неделях эксперимента этот показатель значимо отличается от контрольной группы.
На всех этапах эксперимента в печеночных дольках среди гипертрофированных гепатоцитов выявляли единичные диффузно локализованные клетки, экспрессирующие маркер СК19. По морфологическим признакам они напоминали гепатоциты. В последнее время специалисты высказывают гипотезу о эпителиально-мезенхимальном переходе гепатоцитов в клетки желчных протоков. Показано, что при культивировании в геле коллагена I типа и в присутствии эпидермального фактора роста и фактора роста гепатоцитов зрелые гепатоциты способны дифференцироваться в клетки желчных протоков. Предполагается, что фенотипы гепатоцитов и клеток желчных протоков могут быть взаимно обратимыми (Nishikawa et al., 2005; Glaser et al., 2009; Lee et al., 2014).
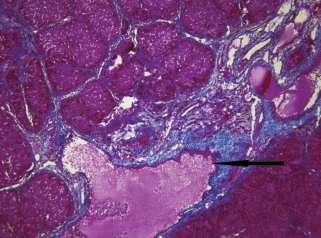
Необходимо отметить, что в портальных трактах и соединительнотканных септах фиброгенез печени сопровождался выраженным неоангиогенезом, который проявлялся формированием множества мелких кровеносных сосудов венозного типа. Наряду с вновь образованными сосудами, в соединительнотканных септах имелись гигантские междольковые вены (рис. 15), что очевидно указывает на перестройку венозной системы портальной вены и, вероятно, формирование коллатералей и шунтов, перенаправляющих венозную кровь в обход печеночных долек.
Рис. 15.
Гистологический препарат печени крысы с индуцированным циррозом через 15 нед. после начала эксперимента. Гигантская междольковая вена отмечена стрелкой. Окраска по методу Маллори. Увел. об. 10×.
По периферии соединительнотканных септ и в синусоидных капиллярах вблизи портальных зон выявляли СК19-позитивные клетки, отличающиеся по своей морфологии от описанных выше. Эти клетки имели вытянутую форму и нитевидное, гипербазофильное ядро. Предположительно, данные клетки являются предшественниками эндотелиоцитов и принимают участие в неоангиогенезе венозной системы воротной вены и формировании синусоидных капилляров. Задачей настоящего исследования не являлось установление связи между неоангиогенезом и пролиферирующими клетками портальных зон. Очевидно, что два процесса развиваются параллельно, нельзя исключать, что совместно и регулируются общими молекулярными механизмами.
Таким образом, выявленные пролиферирующие СК19-позитивные клетки, при тиоацемид-индуцированном фиброгенезе печени крыс являются источником междольковых желчных протоков и проточков, а также гепатоцитов, формирующих зачатки новых печеночных микродолек. При выраженном циррозе они локализовались в портальных зонах, желчных протоках, соединительнотканных септах, паренхиме микродолек и в синусоидных капиллярах. Выявлена морфологическая и функциональная гетерогенность СК19-позитивных клеток: клетки округлой формы со светлым овально-округлым ядром с узким ободком примембранного гетерохроматина, преобладанием в нем эухроматина и одним-двумя ядрышками и клетки вытянутой формы с нитевидным, гипербазофильным ядром.
Список литературы
Банин В.В., Быков В.Л. (ред.). 2009. Международные термины по цитологии и гистологии человека с официальным списком русских эквивалентов. М.: ГЭОТАР-Медиа. 272 с. (Banin V.V., Bykov V.L. (Eds.). 2009. International terms in human cytology and histology with an official list of Russian equivalents. M.: GEOTAR-Media. 272 р.)
Коржевский Д.Э. (ред.). 2014. Теоретические основы и практическое применение методов иммуногистохимии. СПб.: СпецЛит. 119 с. (Korzhevsky D.E. (ed.). 2014. Theoretical foundations and practical application of immunohistochemistry methods. SPb.: SpechLit. 119 р.)
Abu Rmilah A., Zhou W., Nelson E., Lin L., Amiot B., Nyberg S.L. 2019. Understanding the marvels behind liver regeneration. Wiley Interdiscip. Rev. Dev. Biol. V. 8. P. 340. https://doi.org/10.1002/wdev.340
Chien C.S., Chen Y.H., Chen H.L., Wang C.P., Wu S.H., Ho S.L., Huang W.C., Yu C.H., Chang M.H. 2018. Cells responsible for liver mass regeneration in rats with 2-acetylaminofluorene/partial hepatectomy injury. J. Biomed. Sci. V. 25. P. 39. https://doi.org/10.1186/s12929-018-0441-5
Everhart J.E., Wright E.C., Goodman Z.D., Dienstag J.L., Hoefs J.C., Kleiner D.E., Ghany M.G., Mills A.S., Nash S.R., Govindarajan S., Rogers T.E., Greenson J.K., Brunt E.M., Bonkovsky H. L., Morishima C. et al. 2010. Prognostic value of Ishak fibrosis stage: findings from the hepatitis C antiviral long-term treatment against cirrhosis trial. Hepatology. V. 51. P. 585. https://doi.org/10.1002/hep.23315
Fabris L., Spirli C., Cadamuro M., Fiorotto R., Strazzabosco M. 2017. Emerging concepts in biliary repair and fibrosis. Am. J. Physiol. Gastrointest. Liver Physiol. V. 313. P. 102. https://doi.org/10.1152/ajpgi.00452.2016
Ge J.Y., Zheng Y.W., Tsuchida T., Furuya K., Isoda H., Taniguchi H., Ohkohchi N., Oda T. 2020. Hepatic stellate cells contribute to liver regeneration through galectins in hepatic stem cell niche. Stem Cell Res. Ther. V. 11. P. 425. https://doi.org/10.1186/s13287-020-01942-x
Gilgenkrantz H., Collin de l’Hortet A. 2018. Understanding liver regeneration: From mechanisms to regenerative medicine. Am J. Pathol. V. 188. P. 1316. https://doi.org/10.1016/j.ajpath.2018.03.008
Glaser S.S., Gaudio E., Rao A., Pierce L.M., Onori P., Franchitto A., Francis H.L., Dostal D.E., Venter J.K., DeMorrow S., Mancinelli R., Carpino G., Alvaro D., Kopriva S.E., Savage J.M., Alpini G.D. 2009. Morphological and functional heterogeneity of the mouse intrahepatic biliary epithelium. Lab. Invest. V. 89. P. 456. https://doi.org/10.1038/labinvest.2009.6
Gouw A.S.H., Clouston A.D., Theise N.D. 2011. Ductular reactions in human liver: diversity at the interface. Hepatology. V. 54. P. 1853. https://doi.org/10.1002/hep.24613
Guerrier M., Attili F., Alpini G., Glaser S. 2014. Prolonged administration of secretin to normal rats increases biliary proliferation and secretin-induced ductal secretory activity. Hepatobiliary Surg. Nutr. V. 3. P. 118. https://doi.org/10.3978/j.issn.2304-3881.2014.04.04
Kamimoto K., Nakano Y., Kaneko K., Miyajima A., Itoh T. 2020. Multidimensional imaging of liver injury repair in mice reveals fundamental role of the ductular reaction. Commun. Biol. V. 3. P. 289. https://doi.org/10.1038/s42003-020-1006-1
Lee J.Y., Hong S.H. 2020. Hematopoietic stem cells and their roles in tissue regeneration. Int. J. Stem Cells. V. 13. P. 1. https://doi.org/10.15283/ijsc19127
Lee S.J., Park J.B., Kim K.H., Lee W.R., Kim J.Y., An H.J., Park K.K. 2014. Immunohistochemical study for the origin of ductular reaction in chronic liver disease. Int. J. Clin. Exp. Pathol. V. 7. P. 4076.
Li W., Li L., Hui L. 2020. Cell plasticity in liver regeneration. Trends Cell Biol. V. 30. P. 329. https://doi.org/10.1016/j.tcb.2020.01.007
Muthiah M.D., Huang D.Q., Zhou L., Jumat N.H, Choolani M., Chan J.K.Y., Wee A., Lim S.G., Dan Y.Y. 2019. A murine model demonstrating reversal of structural and functional correlates of cirrhosis with progenitor cell transplantation. Sci. Rep. V. 9. P. 15446.
Nishikawa Y., Doi Y., Watanabe H., Tokairin T., Omori Y., Su M., Yoshioka T., Enomoto K. 2005. Transdifferentiation of mature rat hepatocytes into bile duct-like cells in vitro. Am. J. Pathol. V. 166. P. 1077. https://doi.org/10.1016/S0002-9440(10)62328-0
Overi D., Carpino G., Franchitto A., Onori P., Gaudio E. 2020. Hepatocyte injury and hepatic stem cell niche in the progression of non-alcoholic steatohepatitis. Cells. V. 9. P. 590. https://doi.org/10.3390/cells9030590
Roskams T.A., Theise N.D., Balabaud C., Bhagat G., Bhathal P.S., Bioulac-Sage P., Brunt E.M., Crawford J.M., Crosby H.A., Desmet V., Finegold M.J., Geller S.A., Gouw A.S.H., Hytiroglou P., Knisely A.S. et al. 2004. Nomenclature of the finer branches of the biliary tree: canals, ductules, and ductular reactions in human livers. Hepatology. V. 39. P. 1739. https://doi.org/10.1002/hep.20130
Rokusz A., Veres D., Szücs A., Bugyik E., Mozes M., Paku S., Nagy P., Dezso K. 2017. Ductular reaction correlates with fibrogenesis but does not contribute to liver regeneration in experimental fibrosis models. PLoS One. V. 12 : e0176518. https://doi.org/10.1371/journal.pone.0176518
Sato K., Marzioni M., Meng F., Francis H., Glaser S., Alpini G. 2019. Ductular reaction in liver diseases: pathological mechanisms and translational significances. Hepatology. V. 69. P. 420. https://doi.org/10.1002/hep.30150
Szucs A., Paku S., Sebestyen E., Nagy P., Dezso K. 2020. Postnatal, ontogenic liver growth accomplished by biliary/oval cell proliferation and differentiation. PLoS One. V. 15 : e0233736. https://doi.org/10.1371/journal.pone.0233736
Tsuchiya A., Lu W.Y. 2019. Liver stem cells: Plasticity of the liver epithelium. World J. Gastroenterol. V. 25. P. 1037. https://doi.org/10.3748/wjg.v25.i9.1037
Van Haele M., Snoeck J., Roskams T. 2019. Human liver regeneration: An etiology dependent process. Int. J. Mol. Sci. V. 20. P. 2332. https://doi.org/10.3390/ijms20092332
Williams M.J., Clouston A.D., Forbes S.J. 2014. Links between hepatic fibrosis, ductular reaction, and progenitor cell expansion. Gastroenterology. V. 146. P. 349. https://doi.org/10.1053/j.gastro.2013.11.034
Xu T., Lu Z., Xiao Z., Liu F., Chen Y., Wang Z., Zhu S. 2020. Myofibroblast induces hepatocyte-to-ductal metaplasia via laminin-αvβ6 integrin in liver fibrosis. Cell Death Dis. V. 11. P. 199. https://doi.org/10.1038/s41419-020-2372-9
Yanger K., Knigin D., Zong Y., Maggs L., Gu G., Akiyama H., Pikarsky E., Stanger B.Z. 2014. Adult hepatocytes are generated by self-duplication rather than stem cell differentiation. Cell Stem Cell. V. 15. P. 340. https://doi.org/10.1016/j.stem.2014.06.003
Zhao L., Westerhoff M., Pai R.K., Choi W.T, Gao Z.H., Hart J. 2018. Centrilobular ductular reaction correlates with fibrosis stage and fibrosis progression in non-alcoholic steatohepatitis. Mod. Pathol. V. 31. P. 150. https://doi.org/10.1038/modpathol.2017.115
Дополнительные материалы отсутствуют.