Цитология, 2021, T. 63, № 4, стр. 335-351
Сравнительный анализ влияния антител к эндоглину на функциональные характеристики клеток эндотелия HUVEC и EA.hy926
А. Ю. Столбовая 1, 2, *, И. В. Смирнов 1, А. А. Пиневич 1, 3, Н. Л. Вартанян 1, И. Ю. Крутецкая 1, Л. А. Терехина 1, К. Л. Маркова 4, А. Б. Малашичева 2, М. П. Самойлович 1, 3
1 Российский научный центр радиологии и хирургических технологий им. акад. А.М. Гранова
197758 Санкт-Петербург, Россия
2 Национальный медицинский исследовательский центр им. В.А. Алмазова
197341 Санкт-Петербург, Россия
3 Санкт-Петербургский государственный университет, кафедра цитологии и гистологии
199034 Санкт-Петербург, Россия
4 Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта
199034 Санкт-Петербург, Россия
* E-mail: anastasia.stolbovaya@gmail.com
Поступила в редакцию 22.03.2021
После доработки 01.04.2021
Принята к публикации 05.04.2021
Аннотация
Эндоглин, корецептор ростовых факторов семейства TGF-β, является маркером эндотелиальных клеток. В предыдущей работе нами было показано, что моноклональные антитела (МКАТ) к эндоглину могут изменять функциональные свойства клеток эндотелия линии EA.hy926. Целями настоящей работы стали изучение влияния тех же антител против эндоглина на клетки эндотелия HUVEC, а также сравнительный анализ данных, полученных на клетках линий HUVEC и EA.hy926. Сопоставление in vitro моделей, основанных на постоянной клеточной линии эндотелия EA.hy926 и первичных клеточных линиях HUVEC, выявило, наряду с общими морфофункциональными свойствами этих линий, различия в уровне экспрессии ими адгезионных молекул и активности некоторых генов эндотелиальной дифференцировки. На линиях HUVEC было показано, что антитела против эндоглина (2C8 и 4E4) вызывают торможение миграции клеток, снижают их адгезию к твердому субстрату, изменяют расположение актиновых микрофиламентов и затрудняют формирование капилляроподобных структур. Эти эффекты проявлялись только в присутствии в культуральной среде ростового фактора TGF-β1 или при культивировании клеток в условиях гипоксии. Добавление в ростовую среду МКАТ 2C8 стимулировало сбрасывание (шеддинг) эндоглина с мембраны клеток HUVEC как в гипоксических условиях, так и при культивировании в нормоксии. Ряд эффектов МКАТ против эндоглина, выявленных на клетках HUVEC, совпадал с результатами, полученными в экспериментах на линии EA.hy926. Однако МКАТ 2С8 оказывали противоположное влияние на шеддинг эндоглина в клетках линий HUVEC и EA.hy926.
Эндоглин – трансмембранный гликопротеин, который экспрессируется на поверхности клеток эндотелия, мезенхимных стволовых клеток и гемопоэтических клеток-предшественников (Rokhlin et al., 1995; Banerjee et al., 2012; Пиневич и др, 2020). Эндоглин входит в состав рецепторного комплекса, связывающего белки семейства TGF-β1, регулирует баланс сигнальных путей, опосредованных белками Smad 2/3 или Smad 1/5/8 (Barbara et al., 1999; Goumans et al., 2002), переход клеток эндотелия от состояния покоя к пролиферации (Kopczyńska, Makarewicz, 2012), участвует в адгезии (Rossi et al., 2014, 2018; Tian et al., 2012) и миграции клеток (Conley et al., 2004; Sanz-Rodriguez et al., 2004). Эндоглин опосредует межклеточные взаимодействия эндотелия с гладкомышечными клетками сосудов, стабилизируя их стенку (Tian et al., 2017). Он также регулирует форму эндотелиальных клеток и диаметр сосудов в ответ на гемодинамические изменения тока крови (Sugden et al., 2017). Во взрослом организме плотность молекул эндоглина значительно возрастает на мембране клеток эндотелия в тканях, находящихся в ишемии (López-Novoa, Bernabeu, 2010), или при васкуляризации злокачественных новообразований (Kopczyńska, Makarewicz, 2012). Последнее позволяет рассматривать эндоглин, как мишень для антиангиогенной терапии (Rosen et al., 2014).
В настоящее время моноклональные антитела (МКАТ) используют в качестве инструмента для направленного подавления опухолевого ангиогенеза (Rosen et al., 2014). На основе МКАТ SN6j, обладающих антиангиогенными свойствами, созданы химерные антитела против эндоглина TRC105 (TRACON, Pharmaceuticals Inc., США). На I фазе клинических испытаний была показана эффективность этих антител в лечении пациентов, страдающих солидными опухолями (Gordon et al., 2014).
В лаборатории нами была создана панель МКАТ против молекул эндоглина (Смирнов и др., 2015). Исследование этих МКАТ, проведенное на эндотелиальной клеточной линии EA.hy926 (Столбовая и др., 2019), позволило отобрать два антитела (2C8 и 4E4), которые оказывали воздействие на миграцию, пролиферацию и адгезию культивируемых клеток эндотелия. Эти антитела замедляли миграцию клеток эндотелия EA.hy926, стимулированных ростовым фактором TGF-β1, и снижали образование растворимой формы эндоглина. Одно из них (2C8) снижало пролиферацию эндотелиальных клеток EA.hy926, а другое (4E4) увеличивало адгезию моноцитоподобных клеток U937 к эндотелию EA.hy926 (Столбовая и др., 2019). Таким образом, было показано, что под влиянием МКАТ клетки EA.hy926 способны изменять функциональные характеристики.
Клетки линии EA.hy926 получены в результате слияния клеток эндотелия HUVEC c клетками карциномы легкого A549 (Edgell et al., 1983). Вследствие их гибридомной природы, клетки EA.hy926 могут быть менее чувствительными к воздействиям, по сравнению с первичными культурами. В исследованиях in vitro эталоном модели эндотелиальных клеток считается первичная культура эндотелия пупочной вены HUVEC (Jaffe et al., 1973). Клетки HUVEC были использованы для изучения свойств антител TRC105 против эндоглина, и было показано, что под их воздействием происходит замедление миграции и формирования капилляроподобных структур на матригеле (Liu et al., 2014). Для подтверждения ранее описанных нами изменений функциональных характеристик клеток эндотелия культивируемой линии EA.hy926 (Столбовая и др., 2019) было необходимо оценить влияние МКАТ 2C8 и 4E4 против эндоглина на первичную культуру клеток эндотелия HUVEC.
Целью настоящей работы было изучение влияния МКАТ против эндоглина 2C8 и 4E4 на клетки эндотелия HUVEC и сравнительный анализ результатов, полученных на клетках HUVEC, с данными, полученными на линии EA.hy926.
МАТЕРИАЛ И МЕТОДИКА
Культивирование клеток. Клетки эндотелия пупочной вены HUVEC были получены от четырех доноров в НМИЦ им. В.А. Алмазова. Клетки культивировали в среде для первичных культур эндотелия (Endothelial cell medium) на поверхности, покрытой фибронектином, в атмосфере с 6% CO2 и 20% О2 или в условиях гипоксии (6% CO2, 2% О2). В экспериментах использовали клетки HUVEC до 10 пассажа культивирования. Клетки EA.hy926 были предоставлены И.С. Фрейдлин с любезного разрешения автора (Edgell et al., 1983). Клетки EA.hy926 культивировали в среде DMEM/F12, содержащей 5% эмбриональной телячьей сыворотки, 0.5 мкМ аминоптерина, 16 мкМ тимидина и 100 мкМ гипоксантина. Эксперименты по влиянию МКАТ против эндоглина на клетки были выполнены на культурах EA.hy926, прошедших после поступления в лабораторию более 30 пассажей. Для характеристики линии EA.hy926 в качестве модели эндотелия in vitro исследовали культуры с 3 по 15 пассаж и после 30 пассажей культивирования. Мезенхимные стволовые клетки (МСК), полученные из жировой ткани, были охарактеризованы ранее (Пиневич и др., 2014). МСК культивировали в среде для мезенхимальных стволовых клеток (КэмБио, Россия) до 10 пассажа.
Антитела. При оценке функциональных характеристик клеток HUVEC использовали МКАТ против эндоглина 2С8 и 4E4, ранее полученные в лаборатории (Столбовая и др., 2019). Во всех нижеописанных экспериментах использовали антитела изотипического контроля, не распознающие эндоглин. Меченные изотиоционатом флуоресцеина вторичные поликлональные козьи антитела против иммуноглобулинов мыши (Invitrogen, США) готовили в лаборатории по стандартной методике (Catty et al., 1989).
Проточная цитометрия. Для оценки насыщения связывания эндоглина на мембране клеток с антителами клетки эндотелия снимали с поверхности культуральных флаконов, проводя инкубацию в растворе версена, содержащего 0.12% трипсина. Клетки инкубировали с МКАТ к эндоглину 2C8 или 4E4 в фосфатно-солевом растворе, содержащем 3% эмбриональной телячьей сыворотки и 0.1% азида натрия, в течение 1 ч при 4°С. Комплексы антител, связанных с эндоглином на мембране клеток, выявляли меченными изотиоцианатом флуоресцеина козьими антителами против мышиных иммуноглобулинов, инкубацию проводили в течение 1 ч при 4°С.
Для выявления адгезионных молекул на плазматической мембране клетки эндотелия инкубировали с меченными фикоэритрином моноклональными антителами против CD29, CD31, CD34, CD44, CD49e, CD54, CD62E, CD105, CD106, CD144, CD146, CD166 (BD Biosciences, США) в течение 1 ч при 4°С.
Образцы анализировали на проточном цитометре BD FACSAriaTM III в растворе CellWASH (BD Biosciences, США).
ПЦР в режиме реального времени. РНК из клеток эндотелия выделяли с помощью Trizol Reagent согласно рекомендациям производителя. В реакции обратной транскрипции использовали 500 нг РНК. Реакцию проводили согласно протоколу производителя обратной транскриптазы.
ПЦР в режиме реального времени проводили в термоцикле CFX96 Touch (Bio-Rad, Россия) в 96-ти луночных планшетах. В состав реакционной смеси объемом 25 мкл входили: 0.5 мкл кДНК (полученной в ходе обратной транскрипции), 2.5 мкл буфера для Hot-start Taq-ДНК полимеразы, 0.8 ммоль смеси dNTP, 2.5 ммоль MgCl2, 0.04 ед./мкл Hot-start Taq ДНК полимеразы, 1 мкл SYBR Green. Последовательности праймеров (табл. 1) были взяты из банка праймеров Гарвардской Медицинской школы (США). Концентрация праймеров в реакционной смеси составляла 200–300 нмоль. Реакционную смесь предварительно инкубировали при температуре 95°С в течение 10 мин, затем проводили 40 циклов амплификации, состоящих из трех стадий: 1) плавление ДНК при 95°С, 30 с, 2) отжиг праймеров при 56°С, 30 с, 3) синтез молекул ДНК при 72°С, 30 с.
Таблица 1.
Последовательности праймеров, используемых для амплификации генов
| Название гена | Прямой праймер | Обратный праймер |
|---|---|---|
| GAPDH | GTGAACCATGAGAAGTATGACAAC | CATGAGTCCTTCCACGATACC |
| ММР-14 | GGCTACAGCAATATGGCTACC | GATGGCCGCTGAGAGTGAC |
| VWF | ACCACTCCTTCTCCATTGTC | CCCCATGCTTCAGTTTCA |
| ENG | CGGGTCTCAAGACCAGGAAG | GAGGAAGGCACCAAAGGTGA |
| TGF-β1 | GGCCAGATCCTGTCCAAGC | GTGGGTTTCCAACCATTAGCAC |
| FGF2(b) | AGAAGAGCGACCCTCACATCA | CGGTTAGCACACACTCCTTTG |
| VEGF | AGGGCAGAATCATCACGAAGT | AGGGTCTCGATTGGATGGCA |
| VEGFR1 | TGCCGGGTTACGTCACCTA | GTCCCAGATTATGCGTTTTCCAT |
| VEGFR2 | GTGATCGGAAATGACACTGGAG | CATGTTGGTCACTAACAGAAGCA |
Таблица 2.
Изменение экспрессии генов клетками EA.hy926 при культивировании*
| Гены | Длительность культивирования EA.hy926, количество пассажей | |
|---|---|---|
| <15 | >30 | |
| VWF | 7.8 ± 0.41 | 12.2 ± 0.24 |
| VEGFR1 | 11.6 ± 1.28 | 14.2 ± 0.63 |
| VEGFR2 | 7.2 ± 0.46 | 10.3 ± 0.51 |
| VEGF | 8.6 ± 0.17 | 8.8 ± 0.25 |
| ENG | 5.2 ± 0.23 | 5.9 ± 0.24 |
| TGF-β1 | 6.9 ± 0.28 | 8.0 ± 0.2 |
| FGF2(b) | 6.2 ± 0.33 | 5.2 ± 0.26 |
| MMP-14 | 6.4 ± 0.33 | 6.8 ± 0.42 |
Таблица 3.
Экспрессия генов клетками HUVEC, полученными от разных доноров*
| Гены | Доноры клеток HUVEC | |||
|---|---|---|---|---|
| № 1 | № 2 | № 3 | № 4 | |
| VWF | Нет данных | 0.3 | 1.3 | 0.7 ± 0.51 |
| VEGFR1 | 8.6 | 8.8 | 8.9 ± 0.4 | 10.2 ± 1.7 |
| VEGFR2 | 7.1 ± 0.37 | 6.4 ± 1.98 | 6.5 ± 0.8 | 5.5 ± 0.28 |
| VEGF | 8.7 ± 0.6 | 7.6 | 7.2 | 8.3 ± 0.16 |
| ENG | 4.2 ± 0.24 | 3.1 | 4.0 ± 0.24 | 4.6 ± 0.52 |
| TGF-β1 | 7.2 ± 0.43 | 7.2 ± 0.23 | 8.1 ± 2.4 | 5.7 ± 0.16 |
| FGF2(b) | 6.3 ± 0.21 | 4.6 | 4.5 | 5.7 |
| MMP-14 | Нет данных | 3.7 | Нет данных | 3.9 ± 0.5 |
В качестве гена сравнения использовали уровень экспрессии гена GAPDH. Уровень активности исследуемых генов определяли в виде разницы (ΔCT) между пороговым циклом исследуемого гена и гена сравнения GAPDH. Пороговый цикл соответствует числу циклов амплификации, необходимых для достижения порогового уровня флуоресценции.
Пролиферация клеток. Клетки HUVEC расcевали в 96-ти луночные планшеты в концентрации 10 тыс. клеток/см2. Через сутки ростовую среду полностью заменяли и вносили среду, содержащую либо антитела против эндоглина (5 мкг/мл), либо антитела и ростовые факторы TGF-β1 (1 нг/мл) или BMP-9 (1 нг/мл). В последующих тестах использовали антитела и ростовые факторы в указанных концентрациях. Клетки культивировали в течение 72 ч и проводили MTT-тест. Оптическую плотность измеряли при длине волны 540 нм с помощью планшетного мультисканера (Bio-Rad, Россия).
Адгезия клеток к фибронектину. Для изучения адгезионных свойств клетки эндотелия снимали с поверхности флакона с помощью скребка. Затем клетки помещали в среду, содержащую либо антитела против эндоглина, либо антитела и ростовые факторы, рассевали в 96-ти луночный планшет, покрытый фибронектином, в концентрации 25 тыс. клеток/см2 и культивировали в инкубаторе в течение 40 мин. Неприкрепившиеся клетки отмывали фосфатно-солевым раствором, прикрепившиеся клетки фиксировали 4% забуференным формальдегидом и окрашивали 0.2% кристаллическим фиолетовым. Клетки исследовали под инвертированным микроскопом Axio Zeiss (Германия) и фотографировали с помощью камеры AxioCam MRm.
Для визуализации морфологических изменений суспензию клеток с антителами рассевали на покровные стекла, покрытые фибронектином. Клетки культивировали в течение суток, фиксировали и окрашивали актиновый цитоскелет TRITC-фаллоидином. Ядра докрашивали красителем DAPI. Клетки исследовали под флуоресцентным микроскопом A-xio Zeiss (Германия) и фотографировали с помощью камеры AxioCam MRm.
Адгезия клеток эндотелия к МСК. МСК сокультивировали с клетками эндотелия, окрашенными красителем CFSE в 96-ти луночных планшетах, в условиях гипоксии. Эксперимент выполняли в трех вариантах. В первом варианте суспензию окрашенных CFSE клеток эндотелия инкубировали в среде с антителами при постоянном перемешивании на ротационном шейкере Intelli-Mixer RM-2 (ELMI, Россия) в течение 30 мин, отмывали от несвязавшихся антител и вносили в монослойную интактную культуру МСК. Во втором варианте окрашенные CFSE клетки эндотелия после инкубации с антителами добавляли к монослою МСК, который также предварительно культивировали в среде с антителами в течение 30 мин. В третьем варианте культуру МСК в монослое инкубировали с антителами, а затем к ним добавляли окрашенные CFSE клетки эндотелия.
Во всех трех вариантах сокультивирование проводили в течение 45 мин, после чего для удаления неприкрепившихся эндотелиальных клеток монослой МСК трижды отмывали ростовой средой с 1% эмбриональной телячьей сыворотки. Клетки в каждой лунке фотографировали в трех полях зрения с помощью камеры люминесцентного инвертированного микроскопа Axio Zeiss (Германия). Подсчитывали количество окрашенных CFSE клеток эндотелия, прикрепленных к монослою МСК.
Подсчет клеток на цифровых изображениях. Число окрашенных клеток на фотографиях определяли с помощью созданного в лаборатории приложения для автоматического подсчета клеток (Столбовая и др., 2019).
Миграция клеток. Исследование миграции проводили в 24-луночных планшетах, лунки которых содержали вставки (IBIDI, Германия). Клетки по 30 тыс. рассевали в лунки, образованные вставкой, и помещали в инкубатор. Через сутки вставки удаляли, в результате чего в монослое клеток образовывались “раны”. Клетки культивировали в среде, содержащей либо антитела, либо антитела и ростовые факторы в течение 24 ч, затем фиксировали. “Рану” в монослое в каждой лунке фотографировали до начала миграции и через 24 ч в трех полях зрения с помощью камеры AxioCam MRm инвертированного микроскопа Axio Zeiss (Германия).
Размер раны на цифровом изображении определяли с помощью приложения, разработанного в лаборатории (Столбовая и др., 2019). Были определены границы раны, и ее площадь оценивали в % от общего размера изображения. Степень закрытия раны определяли по формуле: C = (S1 – S2)/S1 ×100%, где C – степень закрытия раны; S1 – средняя площадь раны в начале эксперимента (в %); S2 – средняя площадь раны спустя 1 сут (в %).
Формирование трубок в матригеле. В 24-луночные планшеты, поверхность которых предварительно покрывали матригелем, рассевали клетки в концентрации 180 тыс./мл в ростовой среде, содержащей антитела. Клетки культивировали в течение 24 ч, фотографировали несколько полей зрения каждой лунки. Подсчитывали количество и длину капилляроподобных структур – трубок в программе Image G.
Влияние антител на образование растворимого эндоглина. Клетки эндотелия рассевали в 96-луночные планшеты. Через сутки заменяли среду и продолжали культивирование в среде, содержащей антитела, в течение 24, 48, 72 или 96 ч. В собранных образцах культуральной жидкости измеряли концентрацию растворимого эндоглина с помощью систем двухцентрового иммуноферментного анализа, разработанных в лаборатории (Столбовая и др. 2019).
Статистическая обработка данных. Статистическую обработку данных выполняли с помощью функций языка R (R Core Teams, 2020). Сравнение уровней экспрессии генов в культурах HUVEC и EA.hy926 проводили с помощью дисперсионного анализа.
При анализе пролиферации клеток было построено четыре линейных модели, описывающих зависимость оптической плотности от присутствия антител при культивировании в условиях нормоксии или гипоксии, а также при добавлении ростовых факторов TGF-β1 и BMP-9. В этой серии анализов проводилась коррекция уровней значимости с помощью поправки Бонферрони (Qiunn, Keough, 2002).
Для оценки влияния антител на адгезию, миграцию и формирование капилляроподобных структур строили регрессионные линейные модели со смешанными эффектами (Zuur et al., 2009). Анализ выполняли с помощью пакета lme4. После расчетов параметров моделей проводили множественные сравнения средних значений с контролем. Оценку статистической значимости различий осуществляли с помощью теста Даннета (Bretz et al., 2011). Различия считали статистически значимыми при p < 0.05. Для расчетов применяли функции пакета multcomp (Hothorn et al., 2008). Для визуализации данных использовали функции пакета ggplot2 (Wickham, 2016).
Использованные реактивы и среды. Среда DMEM/F12, версен, фибронектин (Биолот, Россия); среда для первичных культур эндотелия Endothelial cell medium (ScienCell Research Laboratories, США); среда для мезенхимальных стволовых клеток (Кембио, Россия); эмбриональная телячья сыворотка (Biowest Premium, Франция); аминоптерин, гипоксантин, тимидин, изотиоцианат флуоресцеина, TRITC-фаллоидин, CFSE, DAPI (Sigma, США); трипсин (HyClone, США); рекомбинантные молекулы TGF-β1, BMP-9, эндоглина (R&D Systems, США); матригель (Corning, США); TMB для иммуноферментного анализа (Хема, Россия); Trizol Reagent (Life Technologies, США); обратная транскриптаза M-MuLV, смесь dNTP, random-праймера, Hot-start Taq-ДНК полимераза, буфер для Hot-start Taq-ДНК полимеразы, раствор MgCl2 (Сибэнзим, Россия); Sybr Green (BioDye, Россия); RiboLock RNAse inhibitor (Thermo Scientific, США); CellWash (BD Bioscience, США).
РЕЗУЛЬТАТЫ
Сравнительная характеристика культур клеток эндотелия HUVEC и EA.hy926. Две культуры клеток эндотелия, первичная HUVEC и постоянная EA.hy926, формируют монослой по типу “булыжной мостовой” (cobblestone) (рис. 1а, б). Они способны формировать капилляроподобные трубки при культивировании на матригеле, что характерно для эндотелиальных клеток (рис. 1в, г).
Рис. 1.
Общий вид культур клеток эндотелия HUVEC (а) и EA.hy926 (б). Капилляроподобные структуры (трубки) на поверхности матригеля, образованные клетками HUVEC (в) и EA.hy926 (г). Объектив 10×. Фазовый контраст.

При сравнении экспрессии генов в двух эндотелиальных клеточных линиях были выявлены заметные различия. Высокий уровень экспрессии гена фактора фон Виллебранда (VWF), характерный для дифференцированных клеток, обнаружен в клетках HUVEC (рис. 2). В клетках EA.hy926 уровень активности гена VWF был значительно ниже уже на протяжении первых 15 пассажей культивирования в лаборатории, несмотря на то, что клетки постоянно культивировали в среде, содержащей HAT-компоненты. В процессе более длительного непрерывного пассирования этих клеток отмечалось дальнейшее снижение активности гена VWF. Первичная культура HUVEC, в отличие от линии EA.hy926, обладала более высоким уровнем экспрессии генов VEGFR1 и VEGFR2, продукты которых принимают участие в процессах ангиогенеза. Экспрессия этих генов в линии EA.hy926 снижалась по мере культивирования. Активность генов ростовых факторов (VEGF, TGF‑β1, FGF2(b)), генов ENG и MMP-14 в клетках HUVEC и EA.hy926 была одинаковой и не изменялась в процессе культивирования последних (рис. 2).
Рис. 2.
Экспрессия генов в клетках эндотелия HUVEC и EA.hy926, измеренная методом ПЦР в режиме реального времени. Приведены значения ΔCT, разницы между пороговыми циклами исследуемых генов и гена сравнения GAPDH. *** – статистически значимые отличия между двумя клеточными культурами, p < 0.001.
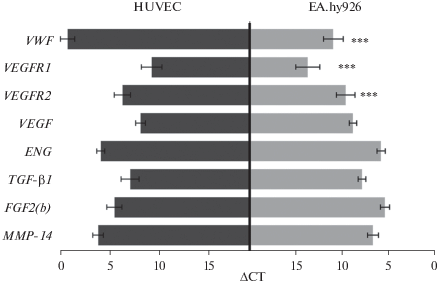
В клетках HUVEC, выделенных от разных доноров, уровни активности исследованных генов, в том числе гена эндоглина, не были одинаковыми, но различались незначительно. Наибольшие различия были отмечены для гена TGF–β1.
Цитофлуориметрический анализ выявил фенотипические различия между культурами HUVEC и EA.hy296 по экспрессии адгезионных молекул (рис. 3). Более 90% клеток обеих клеточных культур несли на мембране CD29, CD44, CD49e, CD105, CD144, CD166. Однако плотность вышеуказанных маркеров на поверхности клеток была разной, что отражалось в различиях медиан интенсивности флуоресценции. Популяция клеток HUVEC, в отличие от линии EA.hy296, была гетерогенна по маркерам CD44, CD49e и CD166. Плотность молекул CD105 и CD144 была выше на мембране клеток HUVEC по сравнению с EA.hy296. Плотность маркера CD166, напротив, оказалась выше на клетках EA.hy296.
Рис. 3.
Экспрессия адгезионных молекул на мембране клеток эндотелия HUVEC (черный цвет) и EA.hy926 (серый цвет) по результатам проточной цитометрии. Пунктирными линиями обозначены изотипические контроли. Приведены результаты анализа клеток HUVEC, выделенных от одного донора, и клеток линии EA.hy926 на 41 пассаже культивирования. Указан процент клеток, несущих на поверхности соответствующий антиген, в сравнении с изотипическим контролем.
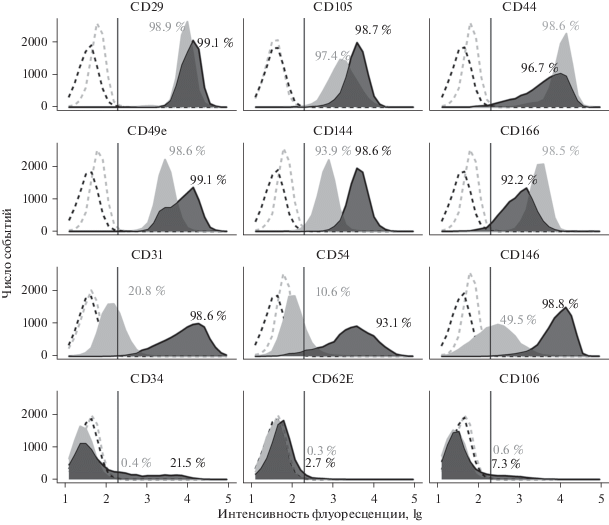
Популяции клеток, имеющих антигены CD31, CD54 и CD146, в культурах HUVEC составляли более 90%, тогда как в линии EA.hy296 доля таких клеток была значительно меньше. Около 21% клеток HUVEC экспрессировали CD34; на мембране клеток EA.hy296 этот маркер не был обнаружен. Клетки, имеющие антигены CD62E и CD106, отсутствовали в обеих клеточных культурах.
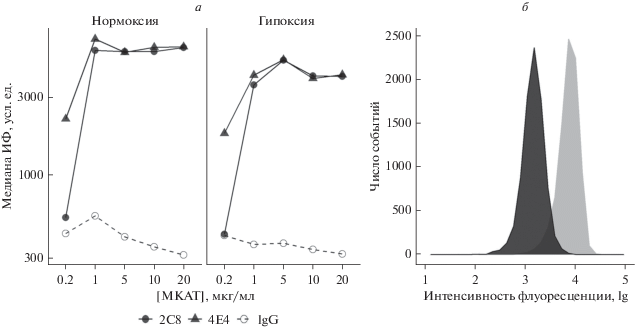
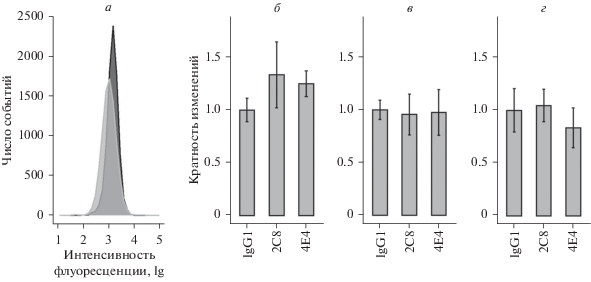
Влияние МКАТ к эндоглину на функциональные характеристики клеток HUVEC. Для оценки изменений функциональных характеристик первичной культуры эндотелия HUVEC в ростовую среду вносили МКАТ к эндоглину 2C8 или 4E4 в конечной концентрации 5 мкг/мл. Методом проточной цитометрии было показано, что при такой концентрации происходило насыщение связывания антител с антигеном на клетках эндотелия (рис. 4а). При увеличении концентрации антител интенсивность флуоресценции не изменялась. Несмотря на то, что плотность молекул эндоглина на мембране клеток HUVEC, культивируемых в условиях гипоксии, увеличивалась по сравнению с клетками, находящимися в условиях нормоксии (рис. 4в), насыщение связывания эндоглина наступало также при концентрации антител 5 мкг/мл (рис. 4б). Все функциональные тесты выполняли не менее трех раз на клетках HU-VEC, полученных от четырех разных доноров.
Рис. 4.
Концентрационная зависимость связывания МКАТ 2C8 и 4E4 с эндоглином на мембране клеток эндотелия HUVEC в условиях нормоксии (a) и гипоксии (б). Экспрессия эндоглина на поверхности клеток эндотелия HUVEC, культивируемых в условиях нормоксии (черная заливка) и гипоксии (серая заливка) (в).
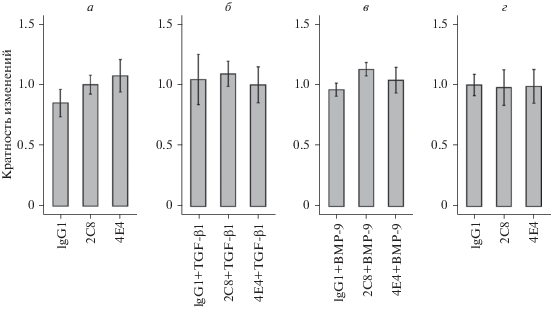
Уровень пролиферации клеток эндотелия HU-VEC (рис. 5а), культивируемых на фибронектине, статистически значимо не изменялся в присутствии антител 2С8 или 4Е4 как при нормоксии, так и при гипоксии. Также не было выявлено различий в уровне пролиферации клеток при одновременном добавлении в ростовую среду антител и ростовых факторов TGF-β1 или BMP-9 (рис. 5б, в).
Рис. 5.
Влияние МКАТ к эндоглину на пролиферацию клеток эндотелия HUVEC, культивируемых в условиях нормоксии (а–в) и гипоксии (г) в присутствии ростовых факторов TGF-β1 (б), BMP-9 (в) или без них (а, г). Количество клеток оценивали через 72 ч после начала эксперимента с помощью МТТ-теста. Данные нормализованы относительно среднего значения изотипического контроля. Вертикальными отрезками обозначены 95%-ные доверительные интервалы.
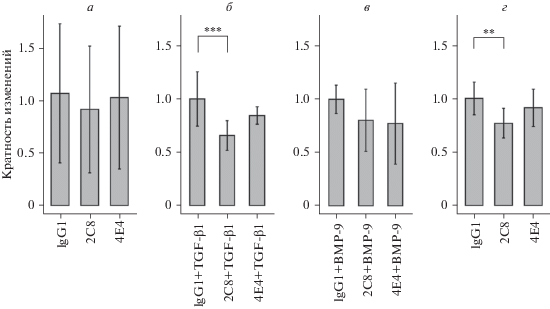
В экспериментах по изучению влияния МКАТ 2C8 и 4E4 на адгезию эндотелиальных клеток HU-VEC к фибронектину не было выявлено различий по сравнению с изотипическим контролем (рис. 6а). Однако в присутствии МКАТ 2C8 и при одновременной стимуляции TGF-β1 наблюдали уменьшение адгезивной способности клеток (рис. 6б). Аналогичный эффект снижения адгезии клеток эндотелия к фибронектину в присутствии МКАТ 2C8 был выявлен при культивировании клеток в условиях гипоксии (рис. 6г). Одновременное добавление в среду МКАТ и BMP-9 не влияло на адгезию клеток, культивируемых в условиях нормоксии (рис. 6в).
Рис. 6.
Влияние МКАТ к эндоглину на адгезию HUVEC к твердой фазе, покрытой фибронектином, при культивировании клеток в условиях нормоксии (а–в), в том числе в присутствии ростовых факторов TGF-β1 (б) или BMP-9 (в), и в условиях гипоксии (г). Число клеток, прикрепившихся к твердой фазе, нормализовано относительно средних значений изотипического контроля. Вертикальными отрезками обозначены 95%-ные доверительные интервалы. ** – различия между группами достоверны для р < 0.01, *** – р < 0.001.
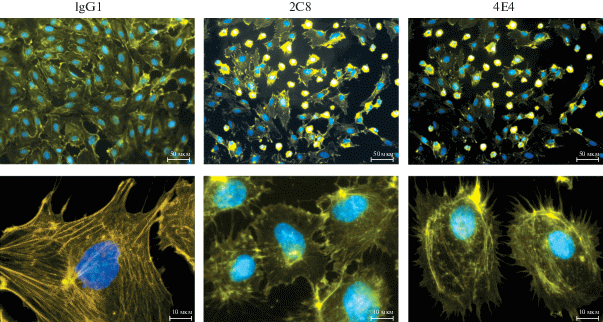
Внесение МКАТ 2C8 или 4E4 в суспензию предварительно снятых с подложки эндотелиальных клеток влияло на последующее распластывание клеток на субстрате. Окрашенные TRITC-фаллоидином клетки, прикрепившиеся к фибронектину в присутствии антител, были сжатыми и обладали большим количеством фокальных контактов по сравнению с контролем (рис. 7). Обращает на себя внимание тот факт, что при окрашивании TRITC-фаллоидином клетки, обработанные МКАТ 2C8 или 4E4, выглядели одинаково, тогда как в предыдущих экспериментах МКАТ 4E4 не влияли на количество прикрепленных к фибронектину клеток (рис. 6 и 7).
Рис. 7.
Изменения в организации актинового цитоскелета клеток HUVEC, вызванные добавлением МКАТ 2С8 или 4Е4. Актиновые филаменты окрашены TRITC-фаллоидином, ядра окрашены DAPI. Верхний ряд – об. 20×, нижний ряд – об. 100×.
Для изучения влияния антител на межклеточные взаимодействия провели сокультивирование клеток эндотелия HUVEC с МСК в условиях гипоксии. МСК, так же, как и клетки эндотелия несут на своей поверхности эндоглин (рис. 8а), поэтому перед сокультивированием клетки инкубировали в среде с антителами в одном из трех вариантов: 1) только МСК, 2) МСК и клетки эндотелия, 3) только клетки эндотелия. Ни в одном случае антитела не влияли на взаимодействие клеток HUVEC и МСК (рис. 8б–г).
Рис. 8.
Влияние МКАТ к эндоглину на адгезию клеток эндотелия HUVEC к монослою МСК в условиях гипоксии. а – Экспрессия эндоглина клетками HUVEC (черная гистограмма) и МСК (серая гистограмма). Эксперименты проводили в трех вариантах: перед сокультивированиванием клеток МКАТ добавляли только к МСК (б), к МСК и HUVEC (в), только к клеткам эндотелия HUVEC (г). Количество прикрепившихся к монослою МСК клеток эндотелия нормализовано относительно изотипического контроля. Вертикальными отрезками обозначены 95%-ные доверительные интервалы.
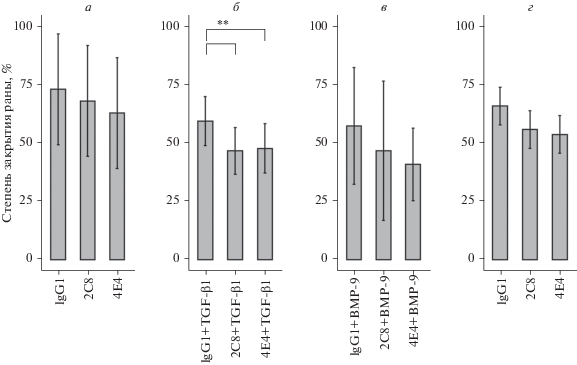
Антитела против эндоглина 2C8 и 4E4 не оказывали влияния на миграционную активность клеток эндотелия HUVEC, оцененную в тесте закрытия “раны”. Однако одновременное присутствие в ростовой среде МКАТ и ростового фактора TGF-β1 замедляло процесс миграции. К концу наблюдения степень закрытия раны в контроле составляла 55%, тогда как в культурах клеток с добавлением антител и TGF-β1 – 47% (рис. 9б). Добавление BMP-9 одновременно с антителами приводило к значительной вариабельности результатов экспериментов (рис. 9в). Проведение экспериментов в условиях нормоксии или гипоксии не влияло на миграцию клеток, культивируемых в среде с антителами (рис. 9а, г).
Рис. 9.
Влияние антител против эндоглина на миграцию клеток эндотелия HUVEC в присутствии ростовых факторов TGF-β1 (б) или BMP-9 (в) при нормоксии (а, б, в) и при гипоксии (г). Вертикальными отрезками обозначены 95%-ные доверительные интервалы. ** – достоверные различия между группами, р < 0.01.
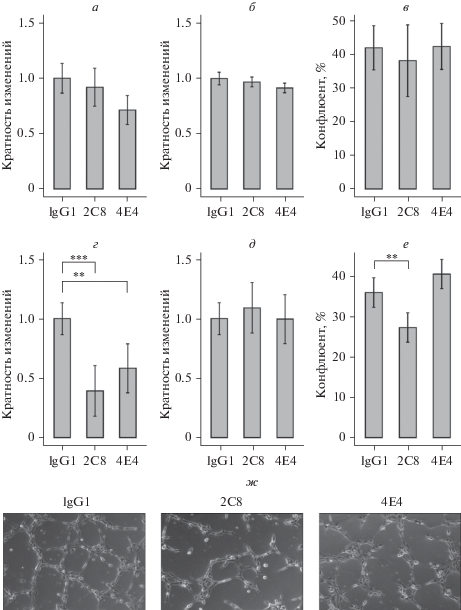
В качестве модели ангиогенеза в условиях клеточной культуры использовали тест формирования капилляроподобных структур (трубок) на матригеле. В присутствии МКАТ 2C8 или 4E4 клетки HUVEC формировали трубки на поверхности матригеля, при этом число, длина трубок и степень покрытия трубками субстрата не отличались от контроля (рис. 10а–в). Снижение числа сформированных трубок в присутствии антител наблюдали только при помещении клеток в условия гипоксии (рис. 10г), тогда как длина капилляроподобных структур не изменялась (рис. 10д). Для обоих антител был получен одинаковый результат.
Рис. 10.
Формирование капилляроподобных структур клетками эндотелия HUVEC, культивируемыми на матригеле в присутствии МКАТ к эндоглину в условиях нормоксии (а–в) или гипоксии (г–ж). Определяли число капилляроподобных структур (а, г), длину трубок (б, д) и конфлюент в поле зрения (в, е). Капилляроподобные структуры фотографировали при фазово-контрастной настройке микроскопа (ж). Об. 10×. Вертикальными отрезками обозначены 95%-ные доверительные интервалы. ** – достоверные различия между группами, р < 0.01, *** – р < 0.001.
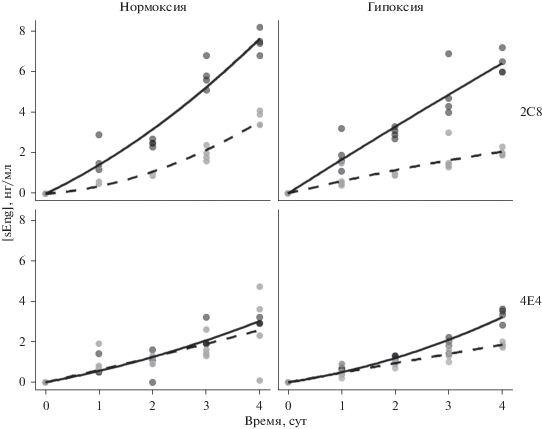
Процесс фермент-зависимого сбрасывания эндоглина с мембраны клеток эндотелия с образованием растворимого эндоглина был исследован в условиях нормоксии и при снижении содержания кислорода в газовой фазе. Присутствие МКАТ 2C8 приводило к увеличению концентрации эндоглина в ростовой среде клеток HUVEC с 2 нг/мл до 8 нг/мл (рис. 11а). Этот эффект наблюдали как при пониженном, так и при нормальном содержании кислорода в газовой фазе (рис. 11а, б). МКАТ 4E4 не оказывало влияния на образование растворимого эндоглина (рис. 11а, б).
ОБСУЖДЕНИЕ
В работе проведено сравнение свойств и функциональных характеристик клеток двух эндотелиальных линий, HUVEC и EA.hy926, в ответ на присутствие антител против эндоглина 2С8 и 4Е4.
Культивирование клеток HUVEC с анти-эндоглиновыми антителами приводило к уменьшению адгезии клеток к внеклеточному матриксу и замедлению их миграции при условии одновременного присутствия в среде ростового фактора TGF-β1. Влияние антител на формирование каппиляроподобных трубок клетками HUVEC проявлялось только в условиях гипоксии. Таким образом, эффекты действия антиэндоглиновых МКАТ на свойства клеток эндотелия HUVEC проявлялись либо в условиях нормоксии, но при стимуляции клеток ростовым фактором TGF-β1, либо в условиях пониженного содержания кислорода.
Функции TGF-β1 в отношении эндотелия многообразны. В условиях нормоксии этот ростовой фактор связывается с рецепторным комплексом ALK5/TGF-βRII и активирует сигнальный путь Smad 2/3, который поддерживает состояние покоя эндотелия (Goumans et al., 2009). На последних этапах ангиогенеза TGF-β1 тормозит пролиферацию и миграцию клеток эндотелия и вносит вклад в стабилизацию стенки вновь образованного сосуда (Goumans et al., 2009). Эндоглин является корецептором рецепторного комплекса, распознающего и связывающего TGF-β1 на клетках эндотелия. Связывание МКАТ 2C8 с эндоглином в присутствии TGF-β1 приводило к ослаблению адгезии к внеклеточному матриксу (фибронектину) и замедлению миграции клеток HUVEC. Аналогичный феномен торможения миграционной активности эндотелия анти-эндоглиновыми антителами в присутствии TGF-β1 был показан нами ранее на клетках постоянной линии EA.hy296 (Столбовая и др., 2019). Ранее было показано, что добавление TGF-β1 к клеткам EA.hy926, у которых с помощью антисмысловой последовательности (сайленсинг) снижена экспрессия гена эндоглина, приводило к значительному снижению миграционной активности клеток (Warrington et al., 2005).
В условиях пониженной концентрации кислорода в тканях усиливается ангиогенез (López-Novoa, Bernabeu, 2010). В условиях гипоксии происходит одновременное повышение экспрессии эндоглина за счет активации транскрипционного фактора HIF1 (Sánchez-Elsner et al., 2002) и киназы ALK1 (Tian et al., 2010). ALK1 встраивается в рецепторный комплекс TGF-β вместо ALK5 и активирует сигнальный путь Smad 1/5/8, который приводит к активации эндотелиальной клетки: усилению пролиферации, ослаблению адгезии и увеличению миграции (Tian et al., 2010). Формирование капилляроподобных структур на матригеле моделирует одновременно несколько процессов, происходящих во время ангиогенеза. Это адгезия клеток к матригелю, который по составу напоминает базальную мембрану (в состав матригеля входит ламинин), межклеточная адгезия и направленная миграция. Наблюдавшееся нами снижение числа трубок, сформированных на матригеле в присутствии МКАТ 2C8, может свидетельствовать о том, что связывание антител с эндоглином препятствует активации клеток эндотелия, ослабляя их адгезию и миграцию.
Сходные результаты были описаны при использовании химерных антител к эндоглину TRC105 (Liu et al., 2014). Так, антитела TRC105 в концентрации 100 мкг/мл в тесте заживления раны снижали миграционную активность клеток HUVEC. Однако в другом исследовании те же антитела TRC105 в концентрации 2 мкг/мл демонстрировали увеличение миграционной активности в 1.4–1.5 раза (Kumar et al., 2014). Возможная причина расхождения результатов связана с использованной концентрацией антител или разным дизайном экспериментов. Антитела TRC105 также способны ингибировать образование капилляроподобных структур клетками HUVEC на матригеле. Как полагают авторы, этот эффект проявляется за счет ингибирования взаимодействия эндоглина с BMP-9 (Nolan-Stevaux et al., 2012).
Финальной стадией ангиогенеза является формирование контактов с другими типами клеток, стабилизирующих стенки сосудов. МСК способны взаимодействовать с эндотелиальными клетками и усиливать или ингибировать ангиогенез (Nassiri, Rahbarghazi, 2014). Имеются данные о том, что МСК способны дифференцироваться в гладкомышечные клетки сосудов и перициты (Nassiri, Rahbarghazi, 2014). Однако в нашем исследовании сокультивирование МСК с клетками HUVEC, которое моделировало взаимодействие эндотелиоцитов с мезенхимными клетками, не выявило значимого влияния антиэндоглиновых МКАТ 2C8 и 4E4 на межклеточную адгезию.
Эндоглин выполняет адгезионные функции независимо от TGF-β-сигналинга. Помимо непосредственного связывания с интегринами через присутствующий в его составе RGD-триплет, эндоглин способен влиять на организацию актиновых филаментов в эндотелиальной клетке посредством взаимодействия с белками зиксином и ZRP-1 (Conley et al., 2004; Sanz-Rodriguez et al., 2004). Экспрессия зиксина связана с распластыванием клеток на субстрате. Показано, что присутствие эндоглина в клетках вызывает перераспределение белка ZRP-1, который уходит из фокальных контактов и локализуется вдоль актиновых стресс-фибрилл (Sanz-Rodriguez et al., 2004).
Связывание МКАТ 2C8 и 4E4 с эндоглином на поверхности клеток HUVEC приводило к их сжатию в процессе адгезии, что может косвенно свидетельствовать о реорганизации актинового цитоскелета.
В организме эндоглин присутствует не только в мембранной, но и в растворимой форме. Последняя обладает антиангиогенными свойствами и образуется под действием матриксной металлопротеазы ММР-14 (López-Novoa, Bernabeu, 2010). Ранее было показано, что антитела TRC105 в концентрации 0.1–0.2 мкг/мл вызывают повышение уровня растворимого эндоглина в среде культивирования клеток HUVEC в 2 раза (Kumar et al., 2014; Liu et al., 2014). Описанный эффект авторы связывали с индуцированным TRC105 сближением эндоглина и матриксной металлопротеазы MMP-14, которая осуществляет протеолитическое отщепление эндоглина (Kumar et al., 2014). Одни из исследованных нами антител, 2C8, также вызвали двукратное увеличение концентрации растворимого эндоглина в культуральной среде клеток HUVEC. Существенно отметить, что противоположный результат был получен при добавлении МКАТ 2C8 к клеткам EA.hy926: концентрация растворимого эндоглина при этом снижалась (Столбовая и др., 2019). Возможно, что наблюдаемое различие связано с разным уровнем экспрессии матриксных металлопротеаз в двух клеточных культурах эндотелия (рис. 2б, в).
Сопоставление эффектов антиэндоглиновых МКАТ, полученных нами на эндотелиальных клетках HUVEC и клеточной линии EA.hy926, представлены в табл. 4.
Таблица 4.
Влияние МКАТ 2C8 на функциональные характеристики клеток эндотелия HUVEC и EA.hy926
| Функциональная характеристика | Критерий или метод оценки | Условия культивирования |
Клетки | |
|---|---|---|---|---|
| HUVEC | EA.hy926а | |||
| Пролиферация | МТТ-тест или окраска кристаллическим фиолетовым | Нормоксия | Нет эффекта | Снижение |
| Нормоксия + TGF-β1 | Нет эффекта | Нет эффекта | ||
| Гипоксия | Нет эффекта | – б | ||
| Адгезия к внеклеточному маткриску | Прикрепление клеток к фибронектину | Нормоксия | Нет эффекта | – |
| Нормоксия + TGF-β1 | Снижение | – | ||
| Гипоксия | Снижение | – | ||
| Межклеточная адгезия | Сокультивирование с МСК | Гипоксия | Нет эффекта | – |
| Миграция | Заживление раны in vitro |
Нормоксия | Нет эффекта | Нет эффекта |
| Нормоксия + TGF-β1 | Замедление | Замедление | ||
| Гипоксия | Нет эффекта | – | ||
| Ангиогенез in vitro |
Формирование трубок на матригеле | Нормоксия | Нет эффекта | – |
| Гипоксия | Снижение | – | ||
| Шеддинг эндоглина с мембраны клеток | Определение методом ИФА растворимого эндоглина в культуральной среде | Нормоксия | Усиление | Снижение |
| Гипоксия | Усиление | – | ||
Как следует из данных, представленных в табл. 4, многие эффекты антиэндоглиновых антител на клетки эндотелия воспроизводились и на культурах HUVEC, и на постоянной клеточной линии EA.hy926. Основное отличие состояло в действии МКАТ 2C8 на шеддинг эндоглина. Связываясь с рецептором на клетках HUVEC, антитела усиливали отщепление эндоглина с мембраны, тогда как на клетках линии EA.hy926 происходило угнетение шеддинга.
В настоящей работе было проведено сравнение культур клеток HUVEC и постоянной линии EA.hy926 в качестве моделей для исследования воздействия различных препаратов на эндотелий in vi-tro. Сравнительные характеристики этих клеточных культур периодически появляются в научных публикациях (Mutin et al., 1997; Bouis et al., 2001), однако известно, что постоянные клеточные линии при длительном культивировании эволюционируют и меняют свойства. Обе клеточные модели эндотелия, культивируемые в нашей лаборатории, обладали морфологическими, фенотипическими и функциональными признаками, характерными для дифференцированных эндотелиальных клеток. Одним из главных маркеров эндотелиальных клеток является фактор фон Виллебранда (VWF). Этот фактор высоко экспрессирован в клетках HUVEC. При создании линии клеток эндотелия EA.hy926 авторы (Edgell et al., 1983) ставили одной из задач сохранение клетками экспрессии VWF. По данным ряда публикаций (Jaffe et al., 1973; Edgell et al., 1983; 1990; Unger et al., 2002; Heng et al., 2011) клетки EA.hy926, так же как и HUVEC, экспрессируют этот фактор. В клетках линии EA.hy926, использованных в нашем исследовании, уровень экспрессии гена VWF был значительно ниже, чем в клетках HUVEC, и снижался в процессе длительного культивирования, несмотря на то, что линию постоянно вели в селективной среде, содержащей аминоптерин, тимидин и гипоксантин. В то же время активность генов ряда ростовых факторов, индукторов ангиогенеза, а также эндоглина сохранялась в клетках EA.hy926 на протяжении длительного культивирования.
Сравнение фенотипических характеристик клеток HUVEC и EA.hy926 показало, что обе клеточные линии несут на поверхности одинаковый набор адгезионных маркеров, за исключением CD34. Тем не менее, плотность молекул, поддерживающих целостность клеточного монослоя (CD31, CD144, CD146) и взаимодействующих с экстраклеточным матриксом (CD49e), оказалась выше на мембране клеток HUVEC. Эндоглин имели более 95% клеток в обеих клеточных культурах, но плотность молекул CD105 была немного выше на клетках HUVEC. Индуцибельные маркеры активированного эндотелия CD62E и CD106 отсутствовали на клетках обеих линий, за исключением маркера CD54, который был представлен на поверхности всей популяции клеток HUVEC. Полученные нами результаты о фенотипических характеристиках эндотелиальных клеточных культур совпадали с ранее известными характеристиками этих клеточных культур (Mutin et al., 1997).
Таким образом, на клетках первичной культуры эндотелия HUVEC и постоянной клеточной линии эндотелия EA.hy926 моноклональные антитела 2C8 и 4E4, связывающие эндоглин на мембране, меняют функциональные свойства клеток эндотелия, культивируемых в присутствии TGF-β1 или в условиях гипоксии.
Список литературы
Пиневич А.А., Вартанян Н.Л., Терехина Л.А., Крутецкая И.Ю., Шашкова О.А., Смирнов И.В., Самойлович М.П. 2020. Экспрессия и обновление эндоглина на мембране мезенхимных стволовых клеток и клеток эндотелия. Цитология. Т. 62. № 8. С. 542. (Pinevich A.A., Vartanyan N.L., Terekhina L.A., Krutetskaya I.Y., Shashkova O.A., Smirnov I.V., Samoylovich M.P. 2021. Endoglin expression and surface renewal in mesenchymal stem cells and endothelial cells. Cell Tiss. Biol. V. 15. № 2. P. 107).
Пиневич А.А., Самойлович М.П., Шашкова О.А., Вартанян Н.Л., Полысалов В.Н., Киселева Л.Н., Карташев А.В., Айзенштадт А.А., Климович В.Б. 2014. Характеристика мезенхимальных стромальных клеток при раке молочной железы. Клеточные технологии в биологии и медицине. № 2. С. 84. (Pinevich A.A., Samoilovich M.P., Shashkova O.A., Vartanyan N.L., Polysalov V.N., Kiseleva L.N., Kartashev A.V., Aizenshtadt A.A., Klimovich V.B. 2014. Characteristics of mesenchymal stromal cells isolated from patients with breast cancer. Cell Technologies in Biology and Medicine. № 2. P. 666).
Смирнов И.В., Грязева И.В., Самойлович М.П., Терехина Л.А., Пиневич А.А., Крылова А.А., Крутецкая И.Ю, Никольский Н.Н., Климович В.Б. 2015. Панель моноклональных антител против эндоглина человека: получение и характеристика. Цитология. Т. 57. № 7. С. 499. (Smirnov I.V., Gryazeva I.V., Samoilovich M.P., Terekhina L.A., Pinevich A.A., Krylova A.A., Krutetskaia I.Yu., Nikolsky N.N., Klimo-vich V.B. 2015. Production and characterization of the panel of monoclonal antibodies against human endoglin. Cell Tiss. Biol. V. 9. № 6. P. 473).
Столбовая А.Ю., Смирнов И.В., Пиневич А.А., Берлина М.А., Козырева А.Р., Шашкова О.А., Соколов Д.И., Сельков С.А., Самойлович М.П. 2019. Влияние моноклональных антител к эндоглину человека на функциональные характеристики клеток эндотелия EA.hy926. Цитология. Т. 61. № 6. С. 439. (Stolbovaya A.Yu., Smirnov I.V., Pinevich A.A., Berlina M.A., Kozyreva A.R., Shashkova O.A., Sokolov D.I., Selkov S.A., Samoylovich M.P. 2020. Influence of monoclonal antibodies against human endoglin on the functional characteristics of EA.hy926 endothelial cells. Cell Tiss. Biol. V. 14. № 1. P. 1).
Banerjee S., Dhara S.K., Bacanamwo M. 2012. Endoglin is a novel endothelial cell specification gene. Stem Cell Res. V. 8. P. 85.
Barbara N.P., Wrana J. L., Letarte M. 1999. Endoglin is an accessory protein that interacts with the signaling receptor complex of multiple members of the transforming growth factor-beta superfamily. J. Biol. Chem. V. 274. P. 584.
Bouïs D., Hospers G.A., Meijer C., Molema G., Mulder N.H. 2001. Endothelium in vitro: a review of human vascular endothelial cell lines for blood vessel-related research. Angiogenesis. V. 4. P. 91.
Bretz F., Hothorn T., Westfall P. 2011. Multiple comparisons using R. Taylor and Francis Group. 193 pp.
Catty D. 1989. Antibodies: A practical approach. Volume 2. Oxford: Oxford University Press. 259 pp.
Conley B.A., Koleva R., Smith J.D., Kacer D., Zhang D., Ber-nabeu C., Vary C.P.H. 2004. Endoglin controls cell migration and composition of focal adhesions: function of the cytosolic domain. J. Biol. Chem. V. 279. P. 27440.
Edgell C.J, Haizlip J.E., Bagnell C.R., Packenham J.P., Harrison P., Wilbourn B., Madden V.J. 1990. Endothelium specific Weibel-Palade bodies in a continuous human cell line, EA.hy926. In Vitro Cell. Dev. Biol. V. 26. P. 1167.
Edgell C.J, McDonald C.C., Graham J.B. 1983. Permanent cell line expressing human factor VIII-related antigen established by hybridization. Proc. Natl. Acad. Sci. USA. V. 80. P. 3734.
Gordon M.S., Robert F., Matei D., Mendelson D.S., Goldman J.W., Chiorean E.G., Strother R.M., Seon B.K., Figg W.D., Peer C.D., Alvarez D., Adams B.J., Theuer C.P., Rosen L.S. 2014. An open-label phase Ib dose-escalation study of TRC105 (anti-endoglin antibody) with bevacizumab in patients with advanced cancer. Clin. Cancer Res. V. 20. P. 5918.
Goumans M.J, Liu Z., ten Dijke P. 2009. TGF-β signaling in vascular biology and dysfunction. Cell Res. V. 19. P. 116.
Goumans M.J., Valdimarsdottir G., Itoh S., Rosendahl A., Sid-eras P., ten Dijke P. 2002. Balancing the activation state of the endothelium via two distinct TGF-beta type I receptors. EMBO J. V. 21. P. 1743.
Heng B.C., Bezerra P.P., Preiser P.R., Alex Law S.K., Xia Y., B-oey F., Venkatraman S.S. 2011. Effect of cell-seeding density on the proliferation and gene expression profile of human umbilical vein endothelial cells within ex vivo culture. Cytotherapy. V. 13. P. 606.
Hothorn T., Bretz F., Westfall P., Heiberger R.M. 2008 multcomp: Simultaneous inference in general parametric mod-els. https://cran.r-project.org/web/packages/multcomp/index.html
Jaffe E.A., Nachman R.L., Becker C.G., Minick C.R. 1973. Culture of human endothelial cells derived from umbilical veins. Identification by morphologic and immunologic cri-teria. J. Clin. Invest. V. 52. P. 2745.
Kopczyńska E., Makarewicz R. 2012. Endoglin – a marker of vascular endothelial cell proliferation in cancer. Contemp. Oncol. (Pozn). V. 16. P. 68.
Kumar S., Pan C.C., Bloodworth J.C., Nixon A.B., Theuer C., Hoyt D.G., Lee N.Y. 2014. Antibody-directed coupling of endoglin and MMP-14 is a key mechanism for endoglin shedding and deregulation of TGF-β signaling. Oncogene. V. 33. P. 3970.
Liu Y., Tian H., Blobe G.C., Theuer C.P., Hurwitz H.I., Nixon A.B. 2014. Effects of the combination of TRC105 and bevacizumab on endothelial cell biology. Invest. New Drugs. V. 32. P. 851.
López-Novoa J.M., Bernabeu C. 2010. The physiological role of endoglin in the cardiovascular system. Am. J. Physiol. Heart Circ. Physiol. V. 299. P. H959.
Mutin M., Dignat-George F., Sampol J. 1997. Immunologic phenotype of cultured endothelial cells: quantitative analysis of cell surface molecules. Tissue Antigens. V. 50. P. 449.
Nassiri S.M., Rahbarghazi R. 2014. Interactions of mesen-chy-mal stem cells with endothelial cells. Stem Cells Dev. V. 23. P. 319.
Nolan-Stevaux O., Zhong W., Culp S., Shaffer K., Hoover J., Wickramasinghe D., Ruefli-Brasse A. 2012. Endoglin requirement for BMP9 signaling in endothelial cells reveals new mechanism of action for selective anti-endoglin antibodies. PLoS One. V. 7. P. e50920.
Quinn G., Keough M. 2002. Experimental design and data anal-ysis for biologists. Cambridge University Press. 557 pp.
Rokhlin O.W., Cohen M.B., Kubagawa H., Letarte M., Coope M.D. 1995. Differential expression of endoglin on fetal and adult hematopoietic cells in human bone marrow. J. Immunol. V. 154. P. 4456.
Rosen L.S., Gordon M.S., Robert F., Matei D.E. 2014. Endoglin for targeted cancer treatment. Curr. Oncol. Rep. V. 16. P. 365.
Rossi E., López-Novoa J.M., Bernabeu C. 2015. Endoglin involvement in integrin-mediated cell adhesion as a putative pathogenic mechanism in hereditary hemorrhagic telangectasia type 1 (HHT1). Front. Genet. V. 5. P. 1.
Rossi E., Pericacho M., Bachelot-Loza C., Pidard D., Gaussem P., Poirault-Chassac S., Blanco F.J., Langa C., González-Manchyn C., López-Novoa J.M., Smadja D.M., Bernabeu C. 2018. Human endoglin as a potential new partner involved in platelet–endothelium interactions. Cell. Mol. Life Sci. V. 75. P. 1269.
Sánchez-Elsner T., Botella L.M., Velasco B., Langa C., Ber-nabeu C. 2002. Endoglin expression is regulated by transcriptional cooperation between the hypoxia and transforming growth factor-β pathways. J. Biol. Chem. V. 277. P. 43 799.
Sanz-Rodriguez F., Guerrero-Esteo M., Botella L.M., Banville D., Vary C.P.H., Bernabeu C. 2004. Endoglin regulates cytoskeletal organization through binding to ZRP-1, a member of the Lim family of proteins. J. Biol. Chem. V. 279. P. 32 858.
Sugden W.W., Meissner R., Aegerter-Wilmsen T., Tsaryk R., Leonard E.V., Bussmann J., Hamm M.J., Herzog W., Jin Y., Jakobsson L., Denz C., Siekmann A.F. 2017. Endoglin controls blood vessel diameter through endothelial cell shape changes in response to haemodynamic cues. Nat. Cell Biol. V. 19. P. 653.
Tian H., Ketova T., Hardy D., Xu X., Gao X., Zijlstra A., Blobe G.C. 2017. Endoglin mediates vascular maturation by promoting vascular smooth muscle cell migration and spreading. Arterioscler. Thromb. Vasc. Biol. V. 37. P. 1115.
Tian H., Mythreye K., Golzio C., Katsanis N., Blobe G.C. 2012. Endoglin mediates fibronectin/α5β1 integrin and TGF-β pathway crosstalk in endothelial cells. EMBO J. V. 31. P. 3885.
Tian F., Zhou A.X., Smits A.M., Larsson E., Goumans M.J., Heldin C.H., Borén J., Akyürek L.M. 2010. Endothelial cells are activated during hypoxia via endoglin/ALK-1/SMAD1/5 signaling in vivo and in vitro. Biochem. Biophys. Res. Commun. V. 392. P. 283.
Unger R.E., Krump-Konvalinkova V., Peters K., Kirkpatrick J.C. 2002. In vitro expression of the endothelial phenotype: comparative study of primary isolated cells and cell lines, including the novel cell line HPMEC-ST1.6R. Microvasc. Res. V. 64. P. 384.
Warrington K., Hillarby M.C., Li C., Letarte M., Kumar S. 2005. Functional role of CD105 in TGFβ-1 signalling in murine and human endothelial cells. Anticancer Res. V. 25. P. 1851.
Wickham H. 2016. ggplot2: elegant graphics for data analysis. 253 pp.
Zuur A.F., Ieno E.N, Walker N., Saveliev A.A., Smith G.M. 2009. Mixed effects models and extensions in ecology with R. Springer. 574 pp.
Дополнительные материалы отсутствуют.