Цитология, 2021, T. 63, № 6, стр. 590-604
Условия культивирования, гистологический и биохимический анализ каллусной культуры солодки Glycyrrhiza glabra L.
А. Н. Акулов 1, *, Ю. А. Костюкова 1
1 Казанский институт биохимии и биофизики Федерального исследовательского центра Казанского научного центра Российской академии наук
420111 Казань, Россия
* E-mail: akulov_anton@mail.ru
Поступила в редакцию 01.08.2021
После доработки 15.08.2021
Принята к публикации 17.08.2021
Аннотация
Подобраны условия индукции и периодического культивирования каллусной культуры из корневых эксплантов солодки Glycyrrhiza glabra L. Основным отличием подобранной среды от уже описанных в литературе являлось применение смеси фитогормонов – кислот индолилуксусной (ИУК, 1.5 мг/л) и нафтилуксусной (НУК, 1.5 мг/л), а также кинетина (1 мг/л). Полученный каллус сложно организован и обладает способностью к синтезу вторичных соединений. Сферообразные клеточные комплексы, составляющие каллус, рассматриваются как ксилемные нодулы. Гистохимическое изучение локализации флавонолов и терпенов позволило выявить клетки каллуса и клеточные органеллы локализации вторичных метаболитов. Содержание в каллусе (на 1 г сухого веса) к завершению пассирования составляло: глицирризиновой кислоты – 74.65 мг/г, фенольных соединений – 19.65 ± 0.8 мг/, флавонолов – 3.46 ± 0.07 мг/г. Полученная каллусная культура Glycyrrhiza glabra L. может найти применение для получения ценных биологически активных веществ.
Солодка голая (Glycyrrhiza glabra L.) – ценное растение, находящее применение в медицине, пищевой промышленности, косметике. Экстракты растений обладают противовоспалительными, анальгезирующими, жаропонижающими, иммуностимулирующими, противовирусными свойствами (Толстиков и др., 2007; Бычкова и др., 2011). В качестве исходного сырья для производства как фармакологической, так и пищевой продукции используют корни 4–6-летних растений солодки (Шретер, 1972; Шретер и др, 2004). Основными ценными биологически активными вторичными метаболитами солодки голой являются фенольные соединения и глицирризиновая кислота.
Содержание глицирризиновой кислоты в растениях носит сезонный характер и зависит от почв и условий произрастания (Яницкая, 2015), что вносит определенные сложности в получение достаточного количества однородного качественного сырья. Наряду с традиционным источником сырья, альтернативным источником может быть культура клеток, позволяющая получать растительное сырье в достаточных количествах в короткие, по сравнению с выращиванием в естественных условиях, сроки, а также в экологически безопасных условиях.
В настоящее время разработаны методы микроклонального размножения Glycyrrhiza glabra L. верхушечными меристемами и почками боковых корней (Badkhane et al., 2014; Pandey, Ayangla, 2018). Описана методика получения эмбриогенного каллуса из гипокотильных эксплантов G. glabra L. (Fu et al., 2010). Подобраны условия для индукции и поддержания каллусных и суспензионных культур, обладающих синтезом фенольных соединений (Hayashi et al., 1988).
В 70-е гг. годы прошлого века были опубликованы противоречивые сведения о синтезе глицирризиновой кислоты в каллусных культурах G. glabra L. В более поздней работе Хаяши (Hayashi, 1988) в каллусной культуре и суспензионной культуре G. glabra L. была обнаружена лишь бетулиновая кислота, глицирризиновая кислота не синтезировалась. По мнению исследователей, синтез глицирризиновой кислоты в условиях in vitro может происходить в клеточных культурах G. glabra L., имеющих какую-либо дифференцировку. В условиях in vitro, дифференциация – формирование тканей и органов – регулируется экзогенными фитогормонами и условиями культивирования (Halder, Jha, 2020).
Несмотря на многочисленные опубликованные работы по клеточным культурам различных видов солодки (Pandey, Ayangla, 2018), детальные гистологические исследования каллусных культур этого растения не известны.
Цель нашей работы заключалась в получении длительно пассируемой и способной к синтезу вторичных соединений каллусной культуры солодки голой. Задачами исследования являлись подбор оптимального состава питательной среды для индукции и поддержания каллуса, морфологический и гистологический анализ полученной культуры, а также оценка содержания в ней вторичных соединений. Полученные результаты могут служить основой для дальнейших исследований по подбору условий культивирования каллусов солодки с целью получения продуцентов биологически активных соединений.
МАТЕРИАЛ МЕТОДИКА
Объект исследования. Для индукции каллусогенеза использовали корневые экспланты корней асептически выращиваемых растений солодки голой Glycyrrhiza glabra L. в возрасте 30 сут c хорошо развитой корневой системой. Растения выращивали из семян солодки голой, полученных из питомника редких и лекарственных растений Г.А. Анисимова (Томск, Россия). Семена стерилизовали в 10%-ном растворе гипохлорита натрия и переносили на агаризованную среду МS (Murashige, Skoog, 1962) без фитогормонов. Появившиеся проростки, а затем и растения выращивали на агаризованной среде МS (Murashige, Skoog, 1962) без фитогормонов (фотопериод: 16 ч день, 8 ч ночь; температура 24–25°С). Для получения и поддержания культуры клеток применяли разные питательные среды на основе среды MS (Murashige, Skoog, 1962). Описание использованных сред дано ниже в разделе “Результаты”. Величину рН всех питательных сред доводили до 5.5–5.6, используя 1 н соляную кислоту. Среды автоклавировали в течение 1 ч при давлении 0.8 атм. Полученная и используемая в работе каллусная культура поддерживается нами на подобранной питательной среде при регулярных пересадках уже в течение 2 лет.
Гистологическая характеристика каллусных культур. Материал фиксировали в 2.5%-ном глутаровом альдегиде (Fluca, Швейцария), приготовленном на 0.1 М фосфатном буферном растворе (рН 7.3). Образцы промывали 0.1 М фосфатным буфером в течение 1 ч. Постфиксацию образцов осуществляли в течение 3 ч в 1%-ном растворе OsO4 (Alfa Aesar, США), приготовленном на 0.1 М фосфатном буфере (рН 7.3), содержащем сахарозу (25 мг/мл). Объекты обезвоживали в спиртах с постепенным возрастанием их концентрации, ацетоне и пропилене (Acros, США). Далее объекты заключали в эпоксидную смолу Epon 812 (Sigma-Aldrich, Германия). Полутонкие срезы толщиной 3 мкм изготавливали на ультрамикротоме UltraсutE (Reichert-Jung, Австрия) и окрашивали 0.5%-ным раствором толуидинового синего (Serva, Германия) в 0.1%-ном растворе Na2CO3 (ОТК Экос-1, Россия) (pH 11.1) с нагреванием при 60°С на предметном столике Slides Warmer XH-2002 (CfA and Scientific Co., Inc, США) в течение 1–6 мин (Trump et al., 1961). Срезы изучали с помощью микроскопа Jenamed (Carl Zeiss, Германия), изображения получали с помощью цифровой камеры AxioCam MRc5 (Carl Zeiss, Германия).
Определение содержания глицирризиновой кислоты. Определение проводили согласно методике фармакопеи РФ для корней солодки (Государственная фармакопея РФ, 2018; ФС 2.5.0040.15: http://femb.ru/ femb/pharmacopea.php). Для этого 0.05 г предварительно растертой сухой каллусной ткани помещали в плотно закрывающуюся пластиковую пробирку и заливали 0.5 мл 3%-ного раствора азотной кислоты в ацетоне (ОТК Экос-1, Россия). Инкубировали 10 мин в ультразвуковой ванне при 20°С. Оставляли на 50 мин при интенсивном встряхивании. Центрифугировали 5 мин при 12 000 g. Супернатант отбирали, а осадок заливали 0.75 мл ацетона и помещали на водяную баню при 60°С на 5 мин. Охлаждали и центрифугировали 5 мин при 12 000 g. Супернатант отделяли, а осадок заливали 0.25 мл ацетона и встряхивали. Центрифугировали 5 мин при 12 000 g и отбирали супернатант. Все супернатанты объединяли и доводили ацетоном до 5 мл. К полученному экстракту по каплям добавляли 10%-ный водный раствор аммиака до образования желтого творожистого осадка. При этом контролировали уровень рН с помощью индикаторной бумаги. Титровали до рН 8.5. Осадок собирали центрифугированием в течение 10 мин при 3000 g. Супернатант сливали, а осадок заливали 1 мл дистиллированной воды (V1). Из этого раствора отбирали 0.5 мл (V2) и добавляли 4.5 мл дистиллированной воды (V3). Получали кривую поглощения в диапазоне длин волн от 200 до 500 нм, используя спектрофотометр Lambda 25 (Perkin Elmer, США). Измеряли оптическую плотность раствора при длине волны 258 нм и толщине слоя 1 см. Содержание глицирризиновой кислоты Q (мг на 1 г сухого веса) определяли по формуле: Q = (D ⋅ V1 ⋅ V3)/(V2 ⋅ M × 106) где, D – оптическая плотность, M – масса навески.
Определение суммы растворимых фенольных соединений. Клеточную массу отделяли от среды культивирования, лиофильно высушивали и растирали в порошок. К навеске 25 мг добавляли 500 мкл 80%-ного метанола и инкубировали на водяной бане при температуре 80°С в течение 30 мин. Полученный экстракт центрифугировали при 12 000 g в течение 10 мин. Определение содержания растворимых фенольных соединений проводили по методу Фолина−Чокальтеу в модификации Синглетона−Росси (Singleton, Rossi, 1965). К 0.1 мл спиртового экстракта фенольных соединений добавляли 0.5 мл реактива Фолина−Чокальтеу (Folin-Ciocalteu; PanReac AppliChem, Германия), через 3 мин приливали 0.4 мл водного раствора Na2CO3 (75 г/л) (ОТК Экос-1, Россия). В контрольные пробирки вместо экстракта вносили 0.1 мл 80%-ного метанола. Пробирки с реакционной смесью хорошо встряхивали и оставляли на 2 ч в темноте. Измерение оптической плотности проводили в микрокюветах на спектрофотометре при длине волны 765 нм. Содержание фенольных соединений в экстракте определяли с помощью калибровочной кривой, построенной по галловой кислоте. Содержание фенольных соединений выражали в мг-экв галловой кислоты (Acros Organics, США) на 1 г сухого веса. Для расчета общего содержания в образце внутриклеточных фенольных соединений (ФС, мг-экв галловой кислоты на 1 г сухого веса) использовали формулу: ФС = (СVэкстракта)/(M × 1000), где С – концентрация фенольных соединений, полученная по калибровочной кривой на основе оптической плотности образцов; Vэкстракта – общий объeм экстракта, мл; M – масса навески, г; 1000 – коэффициент перевода л в мл (объeма экстракта).
Определение содержания флавоноидов. Для определения суммарного содержания флавоноидов к 150 мкл спиртового экстракта фенольных соединений добавляли 450 мкл 80%-ного этанола и 30 мкл 5%-ного раствора AlCl3 (Компонент-Реактив, Россия) в 2%-ном спиртовом растворе уксусной кислоты (ОТК Экос-1, Россия). Перемешивали и оставляли на 30 мин. Затем измеряли оптическую плотность раствора при 425 нм, используя спектрофотометр Lambda 25 (Perkin Elmer, США). Калибровочную кривую строили по известным концентрациям кверцетина (Alfa Aesar, США).
Гистохимическое выявление терпенов. Для определения терпенов в каллусной культуре готовили свежие срезы каллусной ткани толщиной 25 мкм на микротоме с вибрирующим лезвием VT1000 S (Leica, Германия). Срезы окрашивали реактивом NADI, состоящим из 0.5 мл 1%-ного раствора нафтола (ОТК Экос-1, Россия), приготовленного в 40%-ом этиловом спирте, 0.5 мл 1%-ного водного раствора N,N-диметил-п-фенилендиамина солянокислого (ОТК Экос-1, Россия) и 49 мл 0.05 М фосфатного буфера (рН 7.2) (Pasqua et al., 2002). Срезы помещали в реактив на 1 ч при комнатной температуре. Окрашенные срезы отмывали 0.1 М фосфатным буфером (рН 7.2). Согласно данным литературы, реактивом NADI терпены окрашиваются в фиолетовый цвет (Pasqua et al., 2002), а эфирные масла – в голубой (Machado et al., 2006). Срезы изучали с помощью микроскопа Jenamed (Carl Zeiss, Германия), фотографировали цифровой камерой AxioCam MRc5 (Carl Zeiss, Германия).
Гистохимическое выявление крахмала. Присутствие крахмала в клетках каллуса определяли с помощью реактива Люголя (раствор йода в йодиде калия по методу Грама): навеску 2 г йодистого калия (Компонент-Реактив, Россия) растворяли при нагревании в 5 мл дистиллированной воды, добавляли 1 г кристаллического йода и доводили объем раствора до 300 мл (Барыкина и др., 2004). На давленые препараты каллусной ткани наносили раствор Люголя на 5 мин. Крахмал окрашивался в черный цвет. Препараты изучали с помощью микроскопа Jenamed (Carl Zeiss, Германия), фотографировали цифровой камерой AxioCam MRc5 (Carl Zeiss, Германия).
Гистохимическое выявление флавонолов. Локализацию флавонолов определяли прижизненно на срезах каллусной ткани приготовленных с помощью микротома с вибрирующем лезвием VT1000 S (Leica, Германия). Срезы окрашивали 0.25%-ным раствором красителя DPBA (Sigma-Aldrich, Германия) в 25%-ном растворе этанола (Peer et al., 2001). Окрашенные срезы просматривали на конфокальном лазерном сканирующем микроскопе LSM 510 META (Carl Zeiss, Германия) с помощью аргонового лазера в диапазонах длин волн возбуждения и эмиссии 530–615 и 503–600 нм соответственно.
Статистическая обработка данных. Каждый эксперимент проводили в трех биологических повторностях. Статистическую обработку данных осуществляли с использованием пакета статистического анализа программы Microsoft Office Excel 2007. Данные представлены в виде среднего значения и стандартной ошибки среднего при доверительной вероятности 95%.
Реактивы. Использовали: азотную кислоту (ОТК Экос-1, Россия), ацетон (ОТК Экос-1, Россия), AlCl3 (Компонент-Реактив, Россия), галловую кислоту (Acros Organics, США), глутаровый альдегид (Fluca, Швейцария), йодистый калий (Компонент-Реактив, Россия), кверцетин (Alfa Aesar, США), нафтол (ОТК Экос-1, Россия), Na2CO3 (ОТК Экос-1, Россия), OsO4 (Alfa Aesar, США), N,N-диметил-п-фенилендиамин солянокислый (ОТК Экос-1, Россия), пропилен (Acros, США), реактив Фолина-Чокальтеу (PanReac AppliChem, Германия), толуидиновый синий (Serva, Германия), уксусную кислоту (ОТК Экос-1, Россия), Epon 812 (Sigma–Aldrich, Германия).
РЕЗУЛЬТАТЫ
Для получения каллусной культуры G. glabra L. были выбраны корневые экспланты выращиваемых в асептических условиях растений солодки голой. Индукцию каллусогенеза проводили на средах, в основе которых лежала среда MS с известным минеральным составом, в которую добавляли различные фитогормоны (табл. 1).
Таблица 1.
Состав сред культивирования каллусов G. glabra L.
| Компоненты, добавленные к среде MS |
Содержание, мг/л в среде | |||
|---|---|---|---|---|
| Б/И(0.5/2) | Д/Н/И/К(0.5/0.5/0.5/0.1) | Н/И/К(0.75/0.75/0.5) | Н/И/К(1.5/1.5/1) | |
| Мезоинозитол | 100.0 | 100.0 | 100.0 | 100.0 |
| Тиамин (В1) | 2.0 | 2.0 | 2.0 | 2.0 |
| Пиридоксин (В6) | 1.0 | 1.0 | 1.0 | 1.0 |
| Никотиновая кислота (B3) | 1.0 | 1.0 | 1.0 | 1.0 |
| 2,4-дихлорфенокси-уксусная кислота (2,4-Д) | 0 | 0.5 | 0 | 0 |
| Индолилуксусная кислота (ИУК) | 0.5 | 0.5 | 0.75 | 1.5 |
| Нафтилуксусная кислота (НУК) | 0 | 0.5 | 0.75 | 1.5 |
| 6-бензиламинопурин (БАП) | 2 | 0 | 0 | 0 |
| Кинетин | 0 | 0.1 | 0.5 | 1 |
| Сахароза | 25 000.0 | 25 000.0 | 25 000.0 | 25 000.0 |
| Агар-агар | 7500.0 | 7500.0 | 7500.0 | 7500.0 |
Примечание к табл. 1 и 2. В названии питательных сред буквы обозначают добавленные фитогормоны: Б – 6-БАП; Д – 2,4-Д; И – ИУК; Н – НУК; К – кинетин; числа – содержание в мг/л, косая черта – coотношение.
Корневые экспланты размером 5–7 мм помещали на питательные среды и культивировали в темноте, фиксируя образование и морфологию появляющегося каллуса. Появление каллуса на эксплантах было отмечено уже на 7-е сут. Каллусогенез удалось индуцировать только на средах, содержащих НУК (Н), ИУК (И) и кинетин (К) в следующем их соотношении (мг/л): 0.75 : 0.75 : 0.5 (среда Н/И/К(0.75/0.75/0.5); табл. 2), а частота индукции была существенно выше на среде с соотношением гормонов НУК, ИУК и кинетина (мг/л) 1.5 : 1.5 : 1 (среда Н/И/К(1.5/1.5/1)) и составляла 86.5% (табл. 2).
Первичный каллус представлял собой округлые клеточные образования светло-желтого или серого цветов на поверхности эксплантов или на месте срезов. При дальнейшем культивировании были отобраны каллусы сферообразной морфологии, состоящие из белых или желтоватых популяций клеток. Последующее поддержание отобранной каллусной культуры проводили на среде Н/И/К(1.5/1.5/1) переносом части клеточной культуры на свежую питательную среду каждые 30 сут.
Морфология и особенности роста каллусной культуры солодки голой. Полученный каллус G. glabra L. в течение пассажа изменял свой цвет и был представлен тремя популяциями клеток белого, желтого и коричневого оттенков (рис. 1), в дальнейшем называемых белый, желтый и коричневый каллусы. Белый и желтый каллусы были более рыхлые по структуре, чем коричневый (рис. 1а, б). Для выяснения особенностей роста и строения каждого из трех каллусов были проведены эксперименты по их раздельному культивированию.
Рис. 1.
Морфология каллусной культуры солодки G. glabra L. а – Гетерогенный каллус (ГК) солодки состоит из популяций белых, желтых и коричневых клеток, которые в дальнейшем рассматривали как белый (БК), желтый (ЖК) и коричневый (КК) каллус. б – Формирование БК из эксплантов КК и ЖК солодки на 14-е сутки культивирования. в – Экспланты КК и БК на каллусогенной среде. г – Формирование ГК солодки из КК и БК на 37-е сут культивирования.
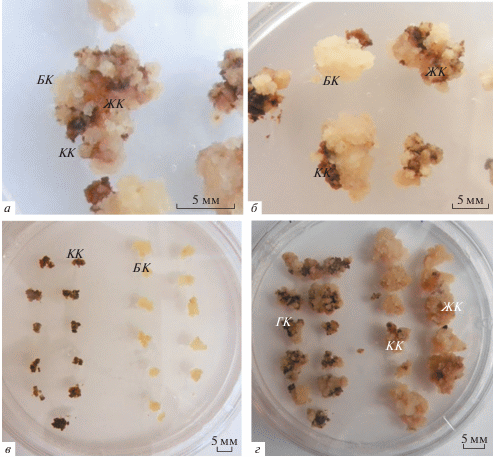
При высаживании на свежую питательную среду белого каллуса (рис. 1в) клетки интенсивно наращивали биомассу. Через 14 сут культивирования наблюдали изменение цвета каллуса на желтый, а через 30 сут на поверхности желтого каллуса формировались небольшие очаги коричневого каллуса (рис. 1г). Желтый каллус можно рассматривать как переходный вариант между белым и коричневым каллусами.
Отобранный в конце пассажа и высаженный на свежую питательную среду коричневый каллус медленно наращивал биомассу. На 7-е сут на части исходного коричневого каллуса формировались очаги белого каллуса (рис. 1б), которые активно пролиферировали и к 30-тым сут начинали желтеть с формированием коричневых очагов. Отмечено, что каллус, сформированный на отдельно высаженном коричневом каллусе, отличался от каллуса, появившегося из отдельно высаженного белого каллуса, большей гетерогенностью (рис. 1г).
Биохимический анализ каллусной культуры солодки голой. Для биохимического анализа были взяты каллусы белого, желтого и коричневого цветов, сформированные на определенные сутки культивирования: на 7-е сут – белый каллус, на 14-е сут – желтый каллус, на 35-е сут – коричневый каллус. Проведенный биохимический анализ каллуса солодки выявил наличие БАВ, характерных для корней этого растения. Среди них определены фенольные соединения, такие как флавоноиды, а также терпены, представленные глицирризиновой кислотой. При анализе отдельных каллусов было отмечено, что основная часть вторичных соединений находится в клетках коричневого каллуса. Содержание глицирризиновой кислоты на 1 г сухого веса составляло в белом каллусе 4.04, в желтом – 3.04 и в коричневом – 74.65 мг/г. Содержание фенольных соединений составляло в белом каллусе 11.71, в желтом – 5.72 и в коричневом – 19.65 мг/г (табл. 3).
Таблица 3.
Содержание вторичных соединений в каллусной культуре G. glabra L.
| Каллус | Содержание, мг на 1 г сухого веса | ||
|---|---|---|---|
| фенольные соединения | флавоноиды | глицирризиновая кислота | |
| Белый | 11.71 ± 0.93 | 0.39 ± 0.05 | 4.04 ± 0.05 |
| Желтый | 5.72 ± 0.13 | 0.21 ± 0.04 | 30.04 ± 0.35 |
| Коричневый | 19.65 ± 0.82 | 3.46 ± 0.07 | 74.65 ± 1.53 |
Гистологические особенности каллусной культуры. Для выяснения строения полученной каллусной культуры нами был проведен детальный гистологический анализ белого, желтого и коричневого каллусов. Белый каллус был представлен неплотно прилегающими друг к другу округлыми комплексами. Округлые комплексы были образованы клетками разных типов (рис. 2а, б). Центр комплекса состоял из меристематических клеток, ближе к поверхности небольшими очагами были расположены прокамбиальные клетки, поверхность комплекса была покрыта клетками паренхимного типа (рис. 2а). В течение пассажа комплексы увеличивались в размере, происходила дифференцировка сосудов (рис. 2б), возрастало количество паренхимных клеток в центральной части комплекса (рис. 2в), сосуды дифференцировались не только в центре комплекса, но и в верхних клеточных слоях (рис. 2в).
Рис. 2.
Гистологические особенности белого каллуса G. glabra L. а, б – На постоянных препаратах, окрашенных толуидиновым синим, белый каллус состоит из округлых структур – нодул (Н); центр Н образован меристематическими клетками (МК), в верхних слоях клеток визуализируются прокамбиальные клетки (ПрК), поверхность Н покрыта клетками паренхимного типа (ПК). б – В более зрелых Н происходит дифференцировка сосудов (С). в, г – Прижизненные неокрашенные срезы: в течение пассажа Н увеличиваются в размере, происходит дифференцировка многочисленных С. д, е – Постоянные препараты, окрашенные толуидиновым синим: д – формирование Н происходит из клеток инициалей (КИ), обнаруженных в коричневом каллусе, е – гистологический срез каллуса с формированными Н.
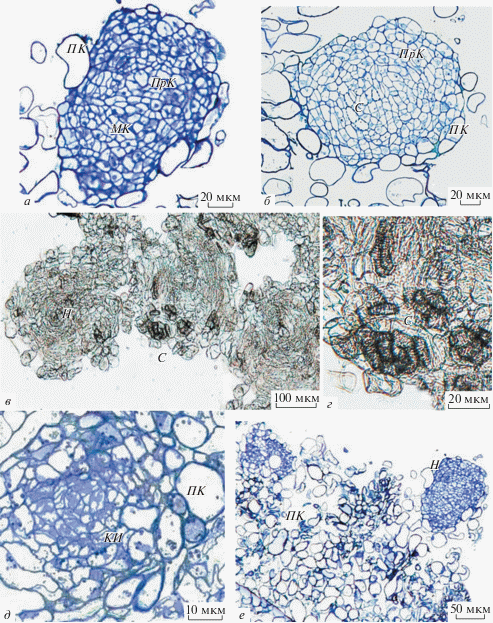
Клеточные комплексы, обнаруженные в белом каллусе, обладают клеточным строением, аналогичным ксилемным нодулам. Нодулы – это округлые клеточные структуры, имеющие какую-либо дифференцировку (Fortes et al., 2010). Нодулы, в которых происходит дифференцировка сосудов рассматриваются как ксилемные нодулы (Savona et al., 2011). Ксилемные нодулы описаны для растений родов Populus (McCown et al., 1988), Taxus (Ellis et al., 1996), Cyclamen (Savona et al., 2012), Gyoscyamus (Абделазиз и др., 2019). Формирование нодул белого каллуса солодки происходило из клеток инициалей, обнаруженных в коричневом каллусе (рис. 2г, д)
Желтый каллус имел глобулярную морфологию (рис. 3а). Так же, как и белый, желтый каллус состоял из нодул, но в отличие от белого, в желтом каллусе визуально отмечали увеличение количества паренхимных клеток между нодулами (рис. 3а). На прижизненных неокрашенных срезах было обнаружено, что отдельные нодулы покрыты слоем экстраклеточных выделений (ЭВ) желтого цвета (рис. 3б), поверхностные клетки паренхимного типа нодул имели утолщенные клеточные стенки, окрашенные в темно-желтый цвет (рис. 3б, в). В поверхностных клетках паренхимного типа многочисленны амилопласты (рис. 3г, д). Обработка поверхностных клеток реактивом Люголя формировала темно-коричневое окрашивание, характерное для крахмальных зерен (рис. 3д).
Рис. 3.
Гистологические особенности желтого каллуса G. glabra L. а, б, в, д – Прижизненные неокрашенные срезы: а, б – на гистологических срезах отдельные нодулы (Н) покрыты слоем экстраклеточных выделений (ЭВ) желтого цвета; в – поверхностные клетки паренхимного типа (ПК) имеют утолщенные клеточные стенки (КС); г – ЭВ на постоянных гистологических препаратах, окрашенных толуидиновым синим, представлены в виде тяжей, в вакуолях поверхностных клеток Н обнаруживались зернистые, зеленоватые, вакуолярные включения (ВВ); д – в поверхностных паренхимных клетках многочисленны амилопласты (А), обработка реактивом Люголя формировала темно-коричневое окрашивание, характерное для крахмальных зерен (прижизненный срез). е, ж, з – Постоянные препараты желтого каллуса, окрашенные толуидиновым синим: е – гистологический срез желтого каллуса; ж – на срезах отчетливо выделяются слои прокамбиальных клеток (ПрК), дифференцировка сосудов (С); з – в редких случаях на срезах Н наблюдали элементы флоэмы (ЭФ).
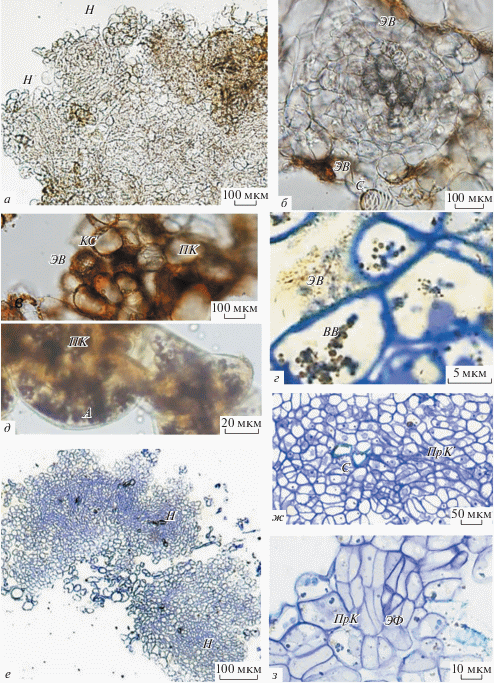
На гистологических срезах желтого каллуса ЭВ представлены в виде тяжей (рис. 3г). В вакуолях поверхностных клеток нодул желтого каллуса многочисленны включения желтого и зеленоватого цветов (рис. 3г).
Нодулы в желтом каллусе были образованы клетками меристематического типа (рис. 3е), среди них хорошо визуализировались слои прокамбиальных клеток (рис. 3е, ж). Дифференцировка сосудов была отмечена как в центре, так и в верхних слоях клеток нодулы (рис. 3б, ж). В редких случаях на срезах нодулы в верхних слоях клеток наблюдали дифференцировку элементов флоэмы (рис. 3з).
Коричневый каллус имел глобулярную морфологию и состоял из плотно прилегающих многочисленных нодул. Нодулы были покрыты густым слоем ЭВ (рис. 4б). На поверхности нодулы присутствовали многочисленные погибающие клетки паренхимного типа с крупными крахмальными зернами в амилопластах, покрытые ЭВ (рис. 4в, г). Формирование экстраклеточных выделений, вероятно, связано с разрывом тонопласта и выделением содержимого вакуолей во внеклеточное пространство (рис. 4г). Нодулы образованы клетками меристематического типа, прокамбиальными клетками и сосудами (рис. 4д).
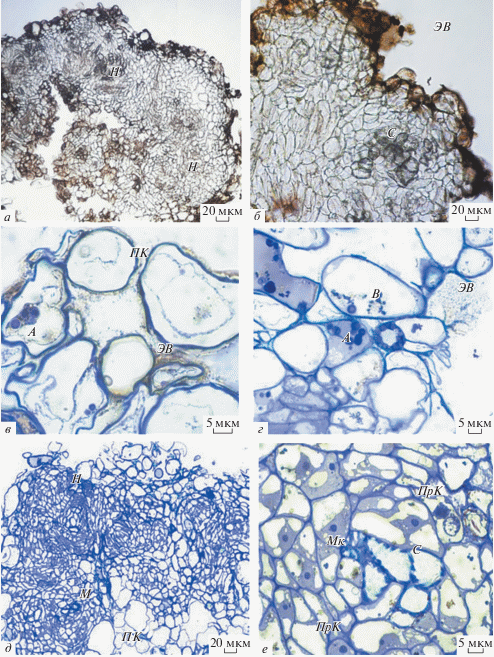
Рис. 4.
Гистологические особенности коричневого каллуса G. glabra L. а, б – На прижизненных неокрашенных срезах многочисленные нодулы (Н) плотно прилегают друг к другу; б – поверхность Н покрыта густыми экстраклеточными выделениями (ЭВ) желтого цвета, в центральной части Н визуализируются сосуды (С). в, г, д, е – Постоянные препараты, окрашенные толуидиновым синим: в – Н покрыты погибающими клетками паренхимного типа (ПК) с крупными крахмальными зернами в амилопластах (А), на поверхности клеток визуализируются ЭВ желтого цвета; г – формирование ЭВ происходит в результате выделения содержимого вакуолей (В) клеток после их гибели; д – на гистологических срезах в Н визуализируются тяжи меристематических (М) и ПК-клеток; е – Н состоит из меристематических клеток (Мк), прокамбиальных клеток (ПрК), наблюдается дифференцировка С.
Гистохимическое изучение локализации терпенов в каллусе солодки. Локализацию фенольных соединений изучали с помощью реактива NADI в белом, желтом и коричневом каллусах солодки. Гистохимическое окрашивание свежеприготовленных срезов каллусов показало, что в белом каллусе конъюгаты реактива и терпенов, формирующие фиолетовые капли в цитоплазме клеток редки (рис. 5а, б). Кроме фиолетовых капель в цитоплазме были обнаружены более мелкие капли голубого цвета, которые могут свидетельствовать о присутствии эфирных масел в каллусных клетках солодки (рис. 5б) (Machado et al., 2006).
Рис. 5.
Гистохимическая локализация терпенов в каллусной культуре солодки на прижизненных срезах G. glabra L. а, б – На срезах белого каллуса фиолетовые капли конъюгата реактива NADI и терпенов (Т) обнаружены в цитоплазме клеток, эфирные масла (ЭМ) представлены более мелкими каплями голубого цвета. в – Синтез и накопление Т в желтом каллусе визуально значительно превышает накопление в белом каллусе. г – В цитоплазме клеток желтого каллуса обнаружены многочисленные капли фиолетового цвета различного размера. д – В некоторых клетках желтого каллуса наблюдали окрашивание цитоплазмы, обусловленное разрушением целостности клеток при приготовлении срезов, в сосудах не обнаружено Т. е – В нодулах коричневого каллуса фиолетовое окрашивание (конъюгаты NADI и Т) наблюдали в клетках, находящихся по периметру нодул. ж – Наибольшая интенсивность окрашивания наблюдается в клеточных стенках клеток (КС), в субповерхностных клетках нодул обнаружены капли ЭМ, окрашенные в голубой цвет.
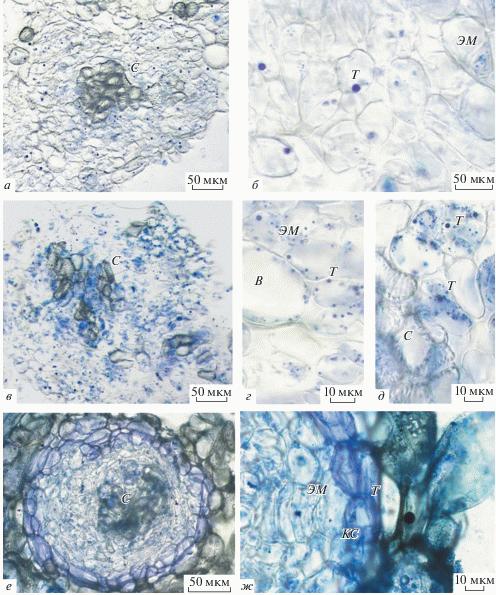
В желтом каллусе интенсивность окрашивания реактивом клеточных включений значительно увеличивалась (рис. 5в, г). Насыщенность окраски цитоплазматических включений возрастала в клетках, расположенных около сосудов (рис. 5в, с). В клетках желтого каллуса были обнаружены многочисленные капли фиолетового цвета различного размера (рис. 5д), тогда как в клетках сосудов терпены отсутствовали (рис. 5д). В некоторых клетках желтого каллуса наблюдали окрашивание цитоплазмы, обусловленное, возможно, разрушением целостности клеток при приготовлении срезов (рис. 5в, д).
В коричневом каллусе фиолетовое окрашивание наблюдали в клетках паренхимного типа, находящихся по периметру нодул (рис. 5е, ж). Наибольшая интенсивность окрашивания была отмечена в клеточных стенках (рис. 5ж). В клетках, составляющих центральную часть нодулы, накопление терпенов было выявлено в цитоплазме клеток в виде отдельных капель фиолетового и голубого цветов (рис. 5ж).
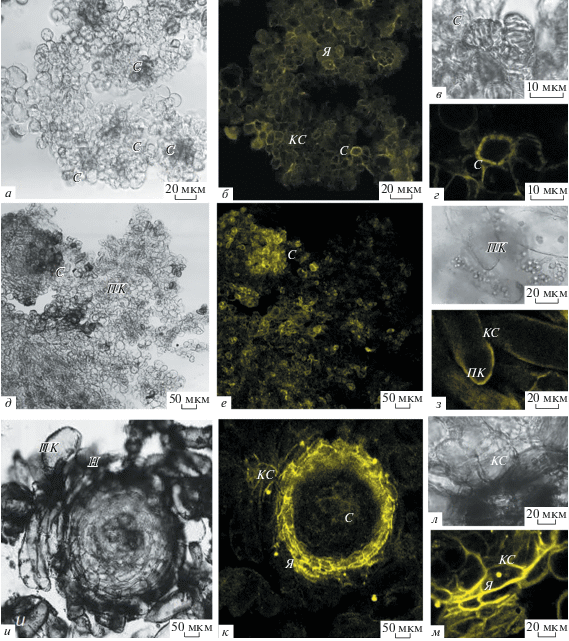
Гистохимическое изучение локализации фенольных соединений в каллусах солодки. Краситель DPBA находит применение для визуализации флавонолов в тканях растений (Ogo et al., 2015). Благодаря различным спектральным свойствам коньюгатов флавонолов с реактивом DPBA можно визуально определить место аккумуляции отдельных флавонолов. Конъюгаты кверцетина с DPBA обладают более длинноволновой эмиссией и имеют желтую флуоресценцию, тогда как коньюгаты кемпферола с DPBA обладают желтой-зеленой флуоресценцией (Saslowsky et al., 2001; Lewis et al., 2011).
В белом каллусе желтое свечение флавонолов было обнаружено в клеточных стенках клеток паренхимного типа, клеточных стенках сосудов и ядрах (рис. 6б, г). В желтом каллусе локализацию флавонолов наблюдали в цитоплазме и клеточных стенках отдельных клеток паренхимного типа, в ядрах, клеточных стенках сосудов (рис. 6з). В коричневом каллусе флавоноиды накапливались в клеточных стенках поверхностных клеток, расположенных в верхних слоях нодул, ядрах клеток, клеточных стенках сосудов (рис. 6к, м).
Рис. 6.
Гистохимическая локализация фенольных соединений на прижизненных срезах каллусах G. glabra L., выявленная с помощью реактива DPBA. а, в – гистологический срез белого каллуса. б – Окрашивание среза белого каллуса реактивом DP-BA обнаружило желтое свечение флавонолов в ультрафиолетовом диапазоне в клеточных стенках (КС) и ядрах (Я). г – Желтое свечение клеточных стенок сосудов (С). д, ж – Гистологический срез желтого каллуса с клетками паренхимного типа (ПК). е – Окрашивание среза желтого каллуса реактивом DPBA, желтое свечение флавонолов обнаружено в КС, С и Я. е – Желтое свечение флавонолов в цитоплазме ПК, КС. и, л – Гистологический срез нодулы коричневого каллуса. к – Окрашивание среза нодулы (Н) коричневого каллуса реактивом DPBA, желтое свечение флавонолов в КС поверхностных клеток Н, Я, С. м – Желтое свечение флавонолов в КС и Я клеток Н коричневого каллуса.
ОБСУЖДЕНИЕ
Характерная особенность растительной клетки – тотипотентность и высокая пластичность (Fehér, 2019). Одним из следствий пластичности является способность растений продуцировать каллус, массу недифференцированных клеток, способных проявить биосинтетическую тотипотентность и синтезировать вторичные метаболиты, идентичные исходному растению (Colin, 2001; Matsuura et al., 2018). Клетка растений потенциально способна продуцировать весь спектр соединений, синтезирующихся в родительском организме (Colin, 2001). Правильно подобранные компоненты среды культивирования позволяют создать оптимальные условия для поддержания роста, и способствовать дифференцировке специализированных структур необходимых для синтеза вторичных метаболитов.
Согласно данным литературы, микро и макроэлементы, входящие в среду Мурасиге−Скуга (Murashige, Skoog, 1962) наиболее оптимальны для индукции и поддержания каллусных культур солодки голой (Khan et al., 2016), а в качестве гормонов предпочтительны НУК в сочетании с 6-БАП (Pandey, Ayangla, 2018).
Необходимо отметить, что для клеточных культур солодки в большинстве случаев используют фитогормон 6-БАП в сочетании с ауксинами (Pandey, Ayangla, 2018). Основными отличиям подобранной нами среды, от уже описанных ранее, являлось использование кинетина (6-фурфруриламинопурина), и применение смеси фитогормонов ИУК (1.5 мг/л), НУК (1.5 мг/л) и кинетина (1 мг/л). Известно, что тип и концентрация ауксина и цитокинина, их соотношение в среде культивирования оказывают значительное влияние на рост клеточной культуры и синтез вторичных метаболитов. Например, цитокинины могут оказывать влияние на синтез вторичных метаболитов, в том числе на синтез фенольных соединений. Так, на среде культивирования, содержащей кинетин и 2,4-Д в среде MS, клеточная культура Ci-trullus colocynthi синтезировала больше фенолов и флавонолов, чем на среде MS, содержащей НУК и 6-БАП (El-Baz et al., 2010). Было показано, что кинетин может стимулировать синтез антоцианов в клеточной культуре Haplopappus gracilus, но ингибировать синтез антоцианов в культуре клеток тополя (Seitz, Hinderer, 1988).
Подобранная среда для индукции каллусной культуры из корневых эксплантов солодки голой и последующая селекция позволили получить каллус, способный к синтезу как флавоноидов, так и терпенов. В клетках белого каллуса содержание фенольных соединений и глицирризиновой кислоты меньше по сравнению с клетками желтого и коричневого каллусов (табл. 3). Гистохимический анализ выявил, что в белом каллусе терпены присутствуют лишь в единичных клетках паренхимного типа (рис. 5а, б), а флавоноиды в клеточных стенках клеток и сосудов (рис. 6б, г). Незначительное содержание глицирризиновой кислоты и фенольных соединений в клетках нодул белого каллуса, состоящих в основном из меристематических клеток согласуется с исследованиями, проведенными на корнях G. glabra L. в которых было показано, что флавоноиды и глицирризиновая кислота полностью отсутствовали в камбиальных слоях корней (Li et al., 2014).
Цитохимическое (рис. 5б–д, 6е, з) и биохимическое (табл. 3) изучение желтого каллуса демонстрирует увеличение синтеза и накопления вторичных метаболитов в этом каллусе. В клетках паренхимного типа желтого каллуса было отмечено значительное количество вакуолей, накапливающих терпены (рис. 5б–д). Окрашивание реактивом DPBA выявило интенсивное свечение клеточных стенок клеток паренхимного типа, составляющих каллус (рис. 6е, з). Увеличение синтеза фенольных соединений и глицирризиновой кислоты в желтом каллусе может быть обусловлено дифференцировкой части клеток белого каллуса в клетки, способные к синтезу вторичных метаболитов.
Дифференцировка включает этапы, связанные с изменениями скорости и типа делений клеток, субклеточной организации, метаболизма и приобретением компетенции к синтезу вторичных соединений (Lindse, Yeoman 1983). Одним из признаков цитодифференцировки может служить значительный синтез крахмала в поверхностных клетках.
Характерной особенностью желтого каллуса является формирование густых ЭВ на поверхности нодул. Формирование ЭВ, возможно, происходит в результате гибели поверхностных паренхимных клеток и выделения вакуолярного содержимого в межклеточное пространство и на поверхность каллуса. Из литературных источников известно, что желтый цвет корней лакричных определяют флавоноиды и халконы (Asl, Hosseinzadeh, 2008). Зеленоватое окрашивание вакуолярных включений также может свидетельствовать о накоплении фенольных соединений в вакуолях (Trump et al., 1961). Вероятно, накопление ЭВ на поверхности каллусной культуры и в клеточных стенках, приводит к изменению цвета каллусной культуры с белого на желтый. Биохимические исследования показали, что наибольшее количество вторичных метаболитов обнаружено в коричневом каллусе (табл. 3). Содержание глицирризиновой кислоты в коричневом каллусе составляет 74.65 мг/г (7.46%), что соответствует данным для культур клеток солодки других авторов (Pandey, Ayangla, 2018), а также удовлетворяет требования фармакопеи к качеству исходного сырья. Согласно требованиям Государственной фармакопеи РФ (http:// femb.ru/femb/pharmacopea.php), в корнях, используемых в качестве сырья, содержание глицирризиновой кислоты не должно быть ниже 6% (ФС 2.5.0040.15, 2018). В ряде работ показано, что содержание глицирризиновой кислоты в корнях может быть и выше, например, до 12.49% (Яницкая и др., 2014). По некоторым источникам, содержание глицирризиновой кислоты в корнях может достигать 23% от сухого веса (Путырский, Прохоров, 2000). Однако содержание глицирризиновой кислоты в экстрактах корней солодки существенно зависит от времени сбора сырья. Так, содержание глицирризина в корнях солодки, собранных в разные месяцы года, варьировало от 41 до 114 мг на 1 г сухого веса (Cheel et al., 2013).
Содержание растворимых фенольных соединений в полученном нами каллусе (на сухой вес) было наибольшим в коричневом каллусе (19.82 мг/г) и сопоставимо с их средним содержанием в корнях растений (29.2 мг/г, вес сухой) (Cai et al., 2004). Одна из групп фенольных соединений в полученном каллусе – флавоноиды, содержание которых в коричневом каллусе составляло 3.46 мг/г. Необходимо отметить, что как и для глицирризина, содержание фенольных соединений в корнях растений может зависеть от времени сбора сырья и варьировать от 72 до 108 мг/г, а флавоноидов – от 18 до 44 мг/г (на сухой вес) (Cheel et al., 2013). Вероятно, одной из причин меньшего, по сравнению с корнями, содержания фенольных соединений в полученном каллусе может быть их полимеризация и образование комплексов с белками и полисахаридами. Так, для ряда фенольных соединений, прежде всего танинов, показано окисление и (или) полимеризация фенольных соединений, накапливающихся на поверхности клеток (Hiltunen et al., 2008; Moya et al., 2012).
Танины являются группой фенольных соединений, характерной для клеток корней солодки (Sharma et a., 2013) и вероятно могут присутствовать и в полученном нами каллусе. Возможно, присутствие окисленных и (или) полимеризованных танинов в клетках коричневого каллуса способствует формированию коричневой окраски к завершению пассажа. Потемнение окраски каллуса может быть также связано с накоплением тритерпеновых гликозидов в клеточных стенках. На клеточной культуре Dioscorea deltoidea с помощью электронно-микроскопического анализа было обнаружено депонирование стероидных гликозидов в периплазматическом пространстве – клеточной стенке и межклетниках (Князьков и др., 1994). Возможно поэтому, на гистологических срезах коричневого каллуса солодки голой мы наблюдали окрашивание клеточных стенок реактивом NADI (рис. 5е, ж).
Независимо от цвета популяции клеток, окрашивание живых препаратов реактивом DPBA обнаружило локализацию флавоноидов в цитоплазме, в ядре удлиненных паренхимных клеток и в трахеидах. Аккумуляция флавоноидов в клеточной стенке и ядре описана для многих растений (Hutzler et al., 1998; Peer et al., 2001). Флавоноиды были обнаружены в клеточных стенках игл ели и сосны и были представлены, главным образом, кемферол-3-O-гликозидом (Hutzler et al., 1998).
Локализация флавоноидов в ядре клеток может быть обусловлена защитными и регуляторными функциями этих соединений. Флавоноиды в клетках растений защищают ДНК клеток от ультрафиолетового излучения, а также прямо или опосредованно контролируют экспрессию ряда генов (Grandmaisin, Ibrahim, 1996).
Также необходимо отметить возможное регуляторное влияние фенольных соединений на строение и рост каллусных культур. Предполагается, что фенольные соединения, особенно флавоноиды, принимают активное участие в формировании органогенных нодул через регулирование транспорта ауксина (Fortes et al., 2008). На каллусной культуре Humulus lupulus L. было показано, что в период, предшествующий формированию органногенных нодул в каллусе происходит активная транскрипция генов, кодирующих ферменты фенилпропаноидного пути синтеза фенольных соединений: цинамат-4-гидролазу, флавонолсинтазу, фенилаланинаммиаклиазу (Fortes et al., 2010).
Вероятно, преобладающим классом фенольных соединений в каллусе солодки является кверцетин или другие негликозилированные флавоноиды, так как лишь конъюгаты DPBA и флавоноидов солодки обладают желтой флуоресценцией (Saslowsky et al., 2001; Lewis et al., 2011), а флавоноиды могут быть представлены характерными для солодки соединениями: ликвиритином, ликвиритигенином, формонетином кверцетином, лютеолином (Vlaisavljevića et al., 2018). Возможно, возрастание количества нодул в коричневом каллусе связано с регуляторным влиянием фенольных соединений на процесс роста каллусной культуры.
Проведенные биохимические и гистохимические исследования позволяют предположить, что изменения цвета каллуса солодки может быть следствием накопления вторичных метаболитов, а возрастание синтеза вторичных метаболитов к завершению пассажа, возможно, как и в целом растении, определяется возрастом культуры и степенью дифференцировки клеток (Khan et al., 2016).
Исследования синтеза глицирризиновой кислоты в культуре столонов G. glabra L. обнаружили, что взрослые коричневые столоны (28 сут) синтезируют в 10 раз больше глицирризиновой кислоты (1.9 мг/г), чем молодые желто-зеленые (14 сут) (0.19 мг/г) (Khan et al., 2016). Аналогичную картину наблюдали в корнях. Молодые культивируемые корни солодки содержат в два раза меньше глицирризиновой кислоты, чем старые (0.15 мг/г и 0.37 мг/г соответственно). Исследователи предполагают, что существует тесная связь между клеточной дифференцировкой ткани и синтезом глицирризиновой кислоты в культурах G. glabra L. (Khan et al., 2016). По мнению Хаяши (Hayashi et al., 1988), отсутствие синтеза глицирризиновой кислоты в каллусной и суспензионной культурах G. glabra L., возможно, является следствием отсутствия синтеза ферментов, осуществляющих биохимические преобразования β-амирина в глицирризиновую кислоту. Необходимость клеточной дифференцировки для синтеза вторичных метаболитов была показана для клеточных культур многих видов растений (De Luca, St.Pieere, 2000; Кунах, Кацан, 2004; Smetanska, 2008; Halder et al., 2020).
Проведенные гистологические исследования показали, что каллус солодки сложно организован. Сферообразные клеточные комплексы, составляющие каллусы различного цвета, рассматриваются как ксилемные нодулы.
Формирование ксилемных нодул характерно для органогенных каллусов (Fortes et al., 2010; Savona et al., 2011) и каллусов, синтезирующих вторичные метаболиты (McCown et al., 1988; Ellis et al., 1996).
Дифференцировка сосудов ксилемы и сферообразная морфология, по-видимому, являются характерными особенностями ксилемных нодул независимо от вида растения. Тогда как степень дифференцированности клеток, составляющих нодулу, может варьировать у различных видов растений и может определяться уровнем зрелости нодулы. Например, ксилемные нодулы, формирующиеся в органогенном каллусе цикламена состояли из центрально расположенных сосудов ксилемы, окруженных прокамбиальными клетками (Savona et al., 2012). Тогда как нодулы тиса имеют более сложное строение (Ellis et al., 1996) и состоят из внутренне локализованных элементов ксилемы, покрытых клетками сосудистого камбия, и элементов флоэмы, расположенных снаружи. Созревание нодул тиса сопровождалось дифференцировкой элементов вторичной ксилемы, вторичной флоэмы и формированием слоя камбиальных клеток, обволакивающих флоэму.
В отличие от описанных выше ксилемных нодул, в каллусе солодки в течение культивирования мы наблюдали хаотичную дифференцировку сосудов. Дифференцировка сосудов обнаруживалась как в центре нодул, так и в поверхностных слоях клеточных комплексов. Подобное отличие, возможно, объясняется очаговым заложением элементов прокамбия и, возможно, является признаком инициирования дифференцировки полицентрических нодул, которые описаны для видов рода Populus (McCown et al., 1988).
Формирование нодул в каллусной культуре солодки и поддержание ее анатомической структуры может быть результатом подобранных нами концентраций НУК и кинетина в среде культивирования, являющихся синтетическими аналогами природных ауксинов и цитокининов (Miller et al., 1956; Agusti et al., 1996; Imin et al., 2005). При получении каллусной культуры люцерны было показано, что добавление кинетина в среду для инициации каллуса также позволяло получить каллусные культуры, имеющие нодулярный морфотип (Wan et al., 1988).
Таким образом, подобранная нами питательная среда позволила получить длительно поддерживаемую каллусную культуру солодки голой, которая является дифференцированной и способной синтезировать различные группы БАВ в количестве, сопоставимом с целыми растениями. Дальнейшая оптимизация условий культивирования каллусной культуры солодки с целью увеличения выхода интересующих БАВ может позволить применить ее для биотехнологического получения глицирризиновой кислоты и фенольных соединений.
Список литературы
Абделазиз В.М.А., Костюкова Ю.А., Хуснетдинова Л.З., Тимофеева О.А. 2019. Гистологический анализ каллусной культуры белены египетской (Hyosciamus muticus L.). Цитология. Т. 61. № 7. С. 571. (Abdelaziz V.M.A., Kostyukova Y.A., Khusnetdinova L.3., Timofeeva O.A. 2019. Histological analysis of the callus culture Belena Egyptian (Hyosciamus muticus L.). Tsitologiya. V. 61. № 7. P. 571.) https://doi.org/10.1134/S0041377119070022
Барыкина Р., Веселова Т., Девятов А., Джалилова Х., Ильина Г., Чубатова Н. 2004. Справочник по ботанической микротехнике. Основы и методы. М.: Московский университет. С. 99. (Barykina R., Veselova T., Ninth A., Jalilova H., Ilyina G., Chubatova N. 2004. Handbook on botanical microtechnics. Basics and methods. M.: Moscow University. P. 99.)
Бычкова О.С., Картелишев А.В., Коколина В.Ф., Кузетченко И.Н. 2011. Современные принципы диагностики и лечения папилломавирусной инфекции аногенитальной области у детей и подростков. Педиатрия. Т. 90. № 3. С. 55. (Bychkova O.S., Cartelishev A.V., Kokoolina V.F., Kusetchenko I.N. 2011. Modern principles of diagnosis and treatment of papillomaviral infection in the anogenital region in children and adolescents. Pediatriya. V. 90. № 3. P. 55.)
Князьков И., Лобокова Е., Носов А. 1994. Определение локализации стероидных гликозидов в культуре клеток Dioscorea deltoidea на основе изучения их ультраструктуры. Физиология растений. Т. 41. № 6. С. 896. (Knyazkov I., Lobokova E., Nosov A. 1994. Definition of localization of steroid glycosides in cell culture Dioscorea deltoidea based on study of their ultraperformance. Plant physiol. V. 41. № 6. P. 896.)
Кунах В.А., Кацан В.А. 2004. Биосинтез изохинолиновых алкалоидов мака в природе и культуре in vitro. Укр.bioxim. журн. Т. 76. № 5. С. 29. (Kunakh A.A., Katsan V.A. 2004. Biosynthesis of poppy isoquinoline alkaloids in nature and in vitro culture Ukr.Biochim. J. V. 75. № 5. P. 29.)
Путырский И.Н., Прохоров В.Н. 2000. Универсальная энциклопедия лекарственных растений. М.: Махаон. (Putyrsky I.N., Prokhorov V.N. 2000. Universal encyclopedia of medicinal plants. M.: Mahaon.)
Толстиков Г.А., Балтина Л.А., Гранкина В.П., Кондратенко Р.М., Толстикова Т.Г. 2007. Солодка: биоразнообразие, химия, применение в медицине. М.: Издательский дом Гео. (Tolstikov G.A., Baltina L.A., Grankin V.P., Kondratenko R.M., Tolstikova T.G. 2007. Liduorice: biodiversity, chemistry, medical applications. M.: Publishing House Geo.)
Шретер Г.К. 1972. Лекарственные растения и растительное сырье, включенные в отечественные фармакопеи. М.: Медицина. 122 с. (Shrether G.K. 1972. Medicinal plants and plant raw materials included in the national pharmacopoeia. Moscow: Medicine. 122 p.)
Шретер А.И., Валентинов Б.Г., Наумова Э.М. 2004. Природное сырье китайской медицины. Справочник. Т. 1. М.: Теревинф. (Shreter A.I., Valentinov B.G., Naumova E.M. Natural raw materials of сhinese medicine. Handbook. V. 1. M.: Tervinf.)
Яницкая А.В., Землянская И.В., Недилько О.В. 2015. Выявление основных анатомических диагностических признаков травы солодки голой. Вестник ВГУ. Химия. Биология. Фармация. № 3. С. 103. (Janitskaya A.V., Earthenskaya I.V., Nedilko O.V. 2015. Identification of the basic anatomical diagnostic features of the grass with bare straw. Vestnik VGU. Chimiya. Biologiya. Pharmaciya. № 3. P. 103.)
Agusti M., Almela V., Zaragoza S., Primo-Milo E., El-Otmani M. 1996. Recent findings on the mechanisms of action of the synthetic auxins used to improve fruit size of Citrus. Proceeding International Society of Citriculture, V. 2. P. 922. http://www.crec.ifas.ufl.edu/academics/classes/hos6546/materials/ ISC_2_1996_922-928.
Asl M., Hosseinzadeh H. 2008. Review of pharmacological effects of Glycyrrhiza sp. and its bioactive compounds. Phytoyherapy Res. Phytother. Res. V. 22. P. 709. https://doi.org/10.1002/ptr.2362
Badkhane Y., Yadav A.S., Bajaj A., Sharma A.K., Raghuwanshi D.K. 2014. Glycyrrhiza glabra L. a miracle medicinal herb. Indo-American J. Pharm. Res. V. 4. P. 5808.
Cai Y., Luo Q., Sun M., Corke H. 2004. Antioxidant activity and phenolic compounds of 112 traditional Chinese medicinal plants associated with anticancer. Life Sci. V. 74. P. 2157. https://doi.org/10.1016/j.lfs.2003.09.047
Cheel J., Tumova L., Areche C., Van Antwerpen P., Neve J., Zouaoui-Boudjeltia K., San Martin A., Vokral I., Wsol V., Neugebauerova J. 2013. Variations in the chemical profile and biological activities of licorice (Glycyrrhiza glabra L.), as influenced by harvest times. Acta Physiol Plant. V. 35. P. 1337. https://doi.org/10.1007/s11738-012-1174-9
Collin H.A. 2001. Secondary product formation in plant tissue cultures. Plant Growth Regulation. V. 34. P. 119.
Ellis D.D., Zeldin E.L., Brodhagen M., Russin W.A., McCown B.H. 1996. Taxol1 production in nodule cultures of taxus. J. Nat. Prod. V. 59. P. 246.
El-Baz F.K., Mohamed A.A., Ali S.A. 2010. Callus formation, phenolic content and related antioxidant activities in tissue culture of a medicinal plant Colocynth (Citrullus colocynthis). Nova Biotechnologica. V. 10-2. P. 79.
De Luca V., St. Pierre B. 2000. The cell and developmental biology of alkaloid biosynthesis. Trends Plant Sci. V. 5. P. 168.
Fehér A. 2019. Callus, dedifferentiation, totipotency, somatic embryogenesis: What these terms mean in the era of molecular plant biology? Front. Plant Sci. V. 10. Article 536. https://doi.org/10.3389/fpls.2019.00536
Fortes A.M., Santos F., Choi Y.H., Silva M.S., Figueiredo A., Sousa L., Pais M.S. 2008. Organogenic nodule development in hop (Humulus lupulus L.): Transcript and metabolic responses. BMC Genomics. V. 9. P. 445. https://doi.org/10.1186/1471-2164-9-445
Fortes A.M., Santos F., Pais M.S. 2010. Organogenic nodule formation in hop: A tool to study morphogenesis in plants with biotechnological and medicinal applications. J. Biomed. Biotechnol. V. 2. P. 1. https://doi.org/10.1155/2010/583691
Fu C., Lei C., Gan L., Li M., Yang Y., Yu L. 2010. Optimization of embryogenic-callus induction and embryogenesis of Glycyrrhiza glabra. African J. Biotechnol. V. 9. P. 5823
Grandmaison J., Ibrahim R.K. 1996. Evidence for nuclear protein binding of flavonol sulfate esters in Flaveria chloraefolia. J. Plant Physiol. V. 147. P. 653. https://doi.org/10.1016/S0176-1617(11)81474-4
Halder M., Jha S. 2020. Morphogenesis, genetic stability, and secondary metabolite production in untransformed and transformed cultures. P. 1. In: Plant cell and tissue differentiation and secondary metabolites. Cham: Springer. https://doi.org/10.1007/978-3-030-11253-0_15-2
Hayashi H., Fukui H., Tabata M. 1988. Examination of triterpenoids produced by callus and cell suspension cultures of Glycyrrhiza glabra. Plant Cell Reports. V. 7. P. 508.
Hiltunen E., Mononen K., Alvila L., Pakkanen T.T. 2008. Discolouration of birch wood: Analysis of extractives from discoloured surface of vacuum-dried European white birch (Betula pubescens) board. Wood Sci. Technol. V. 42. P. 103. https://doi.org/10.1007/s00226-007-0143-8
Hutzler P., Robert Fischbach R., Werner Heller W., Jungblut T., Reuber S., Schmitz R., Veit M., Weissenbock G., Schnitzler J. 1998. Tissue localization of phenolic compounds in plants by confocal laser microscopy. J. Exper. Botany. V. 49. P. 953. https://doi.org/10.1093/jexbot/49.323.953
Imin N., Nizamidin M., Daniher D., Nolan K.E., Rose R.J., Rolfe B.G. 2005. Proteomic analysis of somatic embryogenesis in Medicago truncatula explants culture grown under 6 benzylaminopurine and 1-naphthaleneacetic acid treatments. Plant Physiol. V. 137. P. 1250. https://doi.org/10.1104/pp.104.055277
Khan S., Pandotra P., Manzoor M., Kushwaha M., Sharma R., Jain S., Ahuja A., Amancha V., Bhushan6 S., Guru S., Gupta A., Vishwakarma R., Gupta S. 2016. Terpenoid and flavonoid spectrum of in vitro cultures of Glycyrrhiza glabra revealed high chemical heterogeneity: platform to understand biosynthesis. Plant Cell Tiss. Organ Cult. V. 124. P. 507. https://doi.org/10.1007/s11240-015-0910-4
Li B., Bhandari D., Janfelt C., Rompp A., Spengler B. 2014. Natural products in Glycyrrhiza glabra (licorice) rhizome imaged at the cellular level by atmospheric pressure matrix assisted laser desorption/ionization tandem mass spectrometry imaging. Plant J. V. 80. P. 161.
Lindsey K., Yeoman M. 1983. The relationship between growth rate, differentiation and alkaloid accumulation in cell cultures. J. Exper. Botany. V. 34. P. 1055.
Lewis D.R., Ramirez M.V., Miller N.D., Vallabhaneni P., Ray W.K., Helm R.F., Muday G.K. 2011. Auxin and ethylene induce flavonol accumulation through distinct transcriptional networks. Plant Physiol. V. 156. P. 144. https://doi.org/10.1104/pp.111.172502
Machado M., Santoro G., Sousa M.C., Salgueiro L., Cavaleiro C. 2010. Activity of essential oils on the growth of Leishmania infantum promastigotes. Flavour Frag. J. V. 25. P. 156.
Matsuura H., Sonia Malik S., Fernanda de Costa, Yousefzadi M., Mirjalili M., Arroo R., Bhambra A., Strnad M., Bonfll M., Fett‑Neto A. 2018. Specialized plant metabolism characteristics and impact on target molecule biotechnological production. Mol. Biotechnol. V. 60. P. 169. https://doi.org/10.1007/s12033-017-0056-1
McCown B.H., Zeldin E.L., Pinkalla H.A., Dedolph R.R. 1988. Nodule culture a developmental pathway with high potential for regeneration, automated micropropagation, and plant metabolite production from woody plants. In: Genetic manipulation of woody plants. Springer. V. 2. P. 149.
Miller C.O., Skoog F., Okumura F.S., Von Saltza M.H., Strong F.M. 1956. Isolation, structure and synthesis of kinetin, a substance promoting cell division. Journal of the American Chemical Society. 1956. V. 78. P. 1375. https://doi.org/10.1021/ja01588a032
Moya R., Fallas R.S., Bonilla P.J., Tenorio C. 2012. Relationship between wood color parameters measured by the CIELab system and extractive and phenol content in Acacia mangium and Vochysia guatemalensis from fast-growth plantations. Molecules. V. 17. P. 3639. https://doi.org/10.3390/molecules17043639
Murashige T., Skoog F. 1962. A revised medium for rapid growth and bio-assays with tobacco tissue cultures. Physiol. Plant. V. 15. P. 473. https://doi.org/10.1007/s11240-014-0467-7
Ogo Y., Mori T., Nakabayashi R., Saito K., Takaiwa F. 2016. Transgenic rice seed expressing flavonoid biosynthetic genes accumulate glycosylated and/or acylated flavonoids in protein bodies. J. Exper. Bot. V. 67. P. 95. https://doi.org/10.1093/jxb/erv429
Pandey D.K., Ayangla N.W. 2018. Biotechnological aspects of the production of natural sweetener glycyrrhizin from Glycyrrhiza sp. Phytochem Rev. V. 17. P. 397. https://doi.org/10.1007/s11101-017-9540-2
Pasqua G., Monacelli B., Manfredini C., Loreto F., Perez G. 2002. The role of isoprenoid accumulation and oxidation in sealing wounded needles of Mediterranean pines. Plant Sci. V. 163. P. 355. https://doi.org/10.1016/s0168-9452(02)00139-5
Peer W., Brown D., Tague B., Muday G., Taiz L., Murphy A. 2001. Flavonoid accumulation patterns of transparent testa mutants of Arabidopsis. Plant Physiol. V. 126. P. 536.
Savona M., Mattioli R., Nigro S., Falasca G., Rovere F., Costantino P., S. De Vries, Ruffoni B., Trovato M., Altamura M. 2012. Two SERK genes are markers of pluripotency in Cyclamen persicum Mill. J. Exper. Botany. V. 63. P. 471. https://doi.org/10.1093/jxb/err295
Saslowsky D., Winkel-Shirley B. 2001. Localization of avoid enzymes in arabidopsis roots. The Plant J. V. 27. P. 37.
Seitz H.U., Hinderer W. 1988. Anthocyanins. In: Cell culture and somatic cell genetics of plants. San Diego: Academic Press. P. 125.
Sharma V., Agrawal R.C., Pandey S. 2013. Phytochemical screening and determination of anti-bacterial and anti-oxidant potential of Glycyrrhiza glabra root extracts. J. Environ. Res. Develop. V. 7. P. 1552.
Singleton V.L., Rossi J.A. 1965. Colorimetry of total phenolics with phosphomolybdic-phoungstic acid reagent. Am. J. Enol. Vitic. V. 16. P. 144.
Smetanska I. Production of secondary metabolites using plant cell cultures. Adv. Biochem. Eng. Biotechnol. V. 3. P. 187. https://doi.org/10.1007/10_2008_103
Trump B.A., Smuckler E., Bendit E. 1961. Methods for staining epoxy sections for light microscopy. J. Ultrustruct. Res. V. 5. P. 343.
Vlaisavljevića S., Šibula F., Sinkab I., Istvan Z., Ocsovszkid I., Jovanović-Šantaa S. 2018. Chemical composition, antioxidant and anticancer activity of licorice from Fruska Gora locality. Industrial Crops & Products. V. 112. P. 217. https://doi.org/10.1016/j.indcrop.2017.11.050
Wan Y., Sorensen E.L., Liang G.H. 1988. The effects of kinetin on callus characters in alfalfa (Medicago sativa L.). Euphytica. V. 39. P. 249.
Дополнительные материалы отсутствуют.


