Цитология, 2021, T. 63, № 6, стр. 580-589
Влияние тиреоидного статуса на структуру и процесс восстановления области травматического повреждения нижней челюсти крыс в условиях стресса
И. В. Городецкая 1, Т. Н. Маркевич 1, *
1 Кафедра нормальной физиологии Витебского государственного ордена Дружбы народов медицинского университета
210009 Витебск, Белоруссия
* E-mail: tanya.markevich86@mail.ru
Поступила в редакцию 18.08.2021
После доработки 28.08.2021
Принята к публикации 30.08.2021
Аннотация
На 130 белых беспородных крысах-самцах изучена роль йодсодержащих тиреоидных гормонов в процессе постфрактурной репарации костной ткани в условиях стресса. Показано, что стресс (свободное плавание в клетке) ухудшает процесс восстановления области перелома нижней челюсти (отверстия диаметром 2.0 мм), в частности на 14-е сут уменьшается количество островков хрящевой и незрелой костной ткани на фоне увеличения количества плотной неоформленной соединительной ткани, коллагеновых волокон и площади гаверсовых каналов. Все это свидетельствует о торможении фаз репаративного ответа в области повреждения. Экспериментальный гипотиреоз (25 мг/кг мерказолила внутрижелудочно в течение 20 сут) негативно воздействует на трофику костной ткани сам по себе и замедляет заживление костного дефекта. L-тироксин, напротив, в близких к физиологическим дозах (1.5–3.0 мкг/кг внутрижелудочно в течение 28 дней), способствует интенсификации указанного процесса как после изолированного травматического повреждения мандибулярной кости, так и после сочетания его со стрессом. Полученные результаты открывают новый взгляд на антистрессорное действие йодсодержащих гормонов щитовидной железы – их участие в постфрактурной остеорегенерации на фоне стресса. Обсуждаются механизмы полученного эффекта, которые связаны с геномным и негеномным действием йодсодержащих тиреоидных гормонов.
Исследование механизмов постфрактурных репаративных процессов, связанных, в частности, с гормональной регуляцией, обеспечивающей реализацию пролонгированных ответных реакций является актуальной задачей медицинской науки. Это объясняется, с одной стороны, их недостаточной изученностью, а с другой – ростом бытового и дорожно-транспортного травматизма и многообразием клинических форм переломов (Кадыков, Морозов, 2020).
Около 3% всех повреждений скелета человека приходится на долю травм челюстно-лицевой области (Аверьянов и др., 2019), при этом чаще всего страдает нижняя челюсть (около 80% пациентов с травмами этой области) (Ефимов и др., 2019). В отличие от повреждения других отделов костной системы, травма челюстно-лицевой области затрагивает функционирование практически всех систем организма вследствие нарушения процесса питания.
Наблюдающаяся тенденция к увеличению числа переломов костей лицевого черепа (Храмова и др., 2020) диктует необходимость поиска новых способов стимуляции репаративных процессов, индуцированных травмами челюстно-лицевой области, с целью оптимизации их лечения и снижения экономических потерь, связанных с этим процессом.
На заживление костной раны влияет множество факторов. Одним из ключевых является стресс (Иванов, Александровская, 2018). Вместе с тем, доказано, что важное значение в антистрессовой защите организма имеют йодсодержащие тиреоидные гормоны (Городецкая, Гусакова, 2021). Однако их протекторная роль, заключающаяся в ограничении влияния стресса на процесс репарации костной раны в области травматического дефекта, до сих пор не обсуждалась. На возможность такой защиты указывает, во-первых, установленное под влиянием ЙТГ снижение интенсивности стрессовой реакции, сопровождающей повреждающее воздействие (Городецкая, Гусакова, 2021), а во-вторых, геномное действие ЙТГ (Bianco et al., 2019). Оно может привести к стимуляции синтеза факторов, которые, с одной стороны, способствуют новообразованию костной ткани, а именно остеопротегерина – природного антагониста рецептора-активатора ядерного транскрипционного фактора (Wright et al., 2009), а также щелочной фосфатазы (маркерного фермента остеобластов) (Желнин, 2015). С другой стороны, геномное действие ЙТГ ограничивает активность механизмов резорбции, снижающих ее интенсивность – маркерного фермента остеокластов кислой фосфатазы (Желнин, 2015), катепсинов Д и К (Fasanya, Siemann, 2021) и матриксных металлопротеиназ (Ярмолинская и др., 2012).
Наше предположение о возможности ЙТГ ограничивать негативное влияние стресса на формирование костной мозоли после травматического повреждения основывается на данных об изменении активности или содержания факторов, указанных выше, при изменении тиреоидного статуса у пациентов при лечении (Черных и др., 2016; Degertekin et al., 2016) и в экспериментах на крысах (Маянская и др., 2013; Здор и др., 2016) в отсутствии стрессовых воздействий.
Цель настоящего исследования – изучить воздействие ЙТГ на процесс остеорепарации области перелома нижней челюсти крыс в условиях стресса.
МАТЕРИАЛ И МЕТОДИКА
Объект исследования. Работа выполнена на 130 белых беспородных крысах-самцах массой 180–230 г в осенне-зимний период. Крыс содержали на диете вивария с соблюдением стандартных условий в соответствии с нормами содержания лабораторных животных (СанПиН 2.1.2.12.-18-2006 “Устройство, оборудование и содержание экспериментально-биологических клиник (вивариев)”). В эксперимент брали только здоровых крыс. При проведении экспериментов соблюдали требования гуманного обращения с животными, изложенные в методических указаниях “Положение о порядке использования лабораторных животных в научно-исследовательских работах и педагогическом процессе учреждения образования “Витебский государственный ордена Дружбы народов медицинский университет” и мерах по реализации требований биомедицинской этики” (2010).
Модель стресса. Стрессом служило свободное плавание в клетке (группа “Стресс”). Для этого крыс по 5 особей помещали в пластиковую клетку размером 50 × 30 × 20 см, заполненную водой на высоту 15 см. Процедуру проводили по 30 мин ежедневно в течение 14 сут (Бондаренко, Манухина, 1999).
Модель перелома. Животное фиксировали за 4 конечности на деревянном столике в положении на спине. Под эфирным наркозом минимально инвазивно скальпелем делали разрез кожи по краю нижней челюсти. Обеспечивали доступ к внешней поверхности тела мандибулярной кости путeм частичного отслоения передне-нижнего края жевательной мышцы. Шаровидным твердосплавным бором, используя портативную бормашину (УС-01 Селена-2000, Россия), производили дефект – отверстие диаметром 2.0 мм. Рану послойно ушивали (группа “Перелом). На следующие сутки после перелома нижней челюсти крыс подвергали процедуре свободного плавания в клетке, сочетая травматическое повреждение мандибулярной кости со стрессом (группа “Перелом + стресс”).
Контролем служили животные, получавшие внутрижелудочно 1%-ный крахмальный клейстер в течение такого же срока, что и опытные крысы, получавшие препараты, модулирующие тиреоидный статус.
Животных выводили из эксперимента на 14 день свободного плавания (через 1 ч после последней процедуры) (группа “Стресс”), на 15 день после травматического повреждения нижней челюсти – изолированного (группа “Перелом”) и комбинированного со стрессом (группа “Перелом + стресс”).
Моделирование тиреоидного статуса. Экспериментальный гипотиреоз у крыс вызывали внутрижелудочным введением животным мерказолила (ООО “Фармацевтическая компания “Здоровье”, Украина) в дозе 25 мг в 1%-ном крахмальном клейстере на 1 кг веса животного с помощью зонда с шаровидным наконечником в течение 20 сут (группа “Мерказолил). Введение L-тироксина (L-Т4) (Berlin-Chemie AG, “Менарини Групп”, Германия) осуществляли аналогичным способом в течение 28 сут в постепенно нарастающих дозах (от 1.5 до 3.0 мкг/кг; группа “Тироксин”), которые, как было установлено ранее, не оказывали влияния на прирост массы тела крыс, частоту сердечных сокращений и уровень ЙТГ в крови, что позволило классифицировать их как малые, близкие к физиологическим.
Для исключения влияния на изучаемые параметры самой процедуры введения мерказолила или L-тироксина (внутрижелудочно жестким зондом), животным всех групп за исключением интактных (“Контроль”, “Стресс”, “Перелом”, “Перелом + + стресс”) также вводили 1%-ный крахмальный клейстер таким же способом и в течение такого же времени. Все воздействия на крыс (стресс, перелом) осуществляли на следующий день после окончания введения препаратов и установления моделированного тиреоидного статуса.
Гистология. Для приготовления гистологических препаратов нижнюю челюсть фиксировали в забуференном 10%-ном нейтральном формалине. Затем материал подвергали декальцинации в 5%-ном растворе муравьиной кислоты, проводили через батарею спиртов для обезжиривания и заливали в парафин. Готовили срезы толщиной 5–7 мкм. Препараты окрашивали гематоксилином и эозином. Для получения сопоставимых данных строго выдерживали продолжительность фиксации, декальцинации, заливки, толщину срезов и технологию окрашивания. Обработку полученного от животных материала с момента фиксации и до заключения в парафин проводили параллельно. Фотодокументирование гистопрепаратов проводили с использованием фотооборудования Leiсa Microsystems (Германия).
В каждом препарате исследовали 5 полей зрения. Наличие плотной неоформленной соединительной ткани оценивали следующим образом: 0 (не наблюдается ни в одном поле зрения), 1 (визуализируется в 1–2-х полях), 2 (в 3–4-х) и 3 (во всех полях зрения). Наличие островков хрящевой и незрелой костной ткани оценивали как 0 (нет во всех полях), 1 (1–2 островка во всех 5 полях), 2 (3–4 во всех 5 полях) и 3(5 и более островков во всех 5 полях).
Количество коллагеновых волокон оценивали с помощью измерительной сетки для цитогистостереометрических исследований (Автандилов, 1990), представляющей собой вырезанный из плотной прозрачной плeнки прямоугольник, разделенный на два квадрата, один из которых разделен на 4 более мелких квадрата. В каждом из этих малых квадратов имеется по 25 точек. Подсчет производили во всех 4 квадратах (100 точках). Учитывали количество волокон, имеющих контакт с точками, и выражали его в %.
Все вышеприведенные исследования проводили в области костного дефекта (перелома). Площадь S Гаверсовых каналов изучали в ткани, прилежащей к ней, и рассчитывали по формуле: S = πab, где S – площадь эллипса, π – 3.1415, a – длина большой полуоси, b – длина малой полуоси. Длины полуосей измеряли в мм с помощью изготовленной самостоятельно сетки, представляющей собой квадрат из плотной прозрачной плeнки размером стороны 5 см, в центре которой типографским способом нанесены две перпендикулярные линии, имеющие миллиметровые деления. Точку их пересечения помещали на середину длинной полуоси канала. Для стандартизации расчетов производили перерасчет мм в мкм с помощью помещенной на каждом препарате линейки с масштабом 10 мкм. На каждом препарате измеряли самый крупный и самый мелкий каналы и рассчитывали среднюю площадь.
Статистическая обработка данных. Результаты анализировали с применением пакета прикладных программ “STATISTICA 10.0” (StatSoftinc., STA999K347156-W). Для выбора методов статистического анализа сначала определяли характер распределения признака, используя тест Шапиро–Уилка. Поскольку было выявлено, что характер распределения признака в наших экспериментах не соответствовал нормальному, для обработки данных использовали методы непараметрической статистики. При межгрупповом сравнении и проведении анализа различий по количественным параметрам использовали U-критерий Манна–Уитни. Критическим уровнем значимости был принят p < 0.05. Наличие (количество) КТ, ПНС-ткани и ХТ выражали в баллах, коллагеновых волокон и площадь ГК – в виде медиан и границ нижнего (25) и верхнего (75) квартилей.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
У контрольных животных нами определялась только площадь Гаверсовых каналов (в связи с отсутствием дефекта нижней челюсти), которая составила 0.31 (0.19; 0.49) мкм2. Введение крысам 1%-ного крахмального клейстера (группа “Контроль”) и свободное плавание крыс в клетке (группа “Стресс”) не оказали влияния на этот показатель (р > 0.05) (табл. 1).
Таблица 1.
Влияние тиреоидного статуса на гистоструктуру костной ткани нижней челюсти после ее экспериментального перелома без и в сочетании со стрессом (плавание)
| № | Группа животных | ПНС-ткань, баллы |
Островки ХТ, баллы |
Островки незрелой КТ, баллы |
Количество коллагеновых волокон, % |
Площадь ГК, мкм2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 1 | 2 | 3 | 0 | 1 | 2 | 3 | 0 | 1 | 2 | 3 | ||||
| 1 | Контроль | 10 | – | – | – | 10 | – | – | – | 10 | – | – | – | – | 0.38 (0.23; 0.51) |
| 2 | Стресс | 10 | – | – | – | 10 | – | – | – | 10 | – | – | – | – | 0.23 (0.19; 0.38) |
| р > 0.05 (1 и 2) | р > 0.05 (1 и 2) | р > 0.05 (1 и 2) | – | р > 0.05 (1 и 2) | |||||||||||
| 3 | Перелом | – | 6 | 4 | – | – | 2 | 6 | 2 | 4 | 4 | 2 | – | 16 (10; 20) | 0.69 (0.59; 0.75) |
| р < 0.01 (2 и 3) | р < 0.01 (2 и 3) | р < 0.05 (2 и 3) | – | р < 0.01 (2 и 3) | |||||||||||
| р < 0.01(1 и 3) | р < 0.01 (1 и 3) | р < 0.05 (1 и 3) | – | р < 0.05 (1 и 3) | |||||||||||
| 4 | Перелом + стресс | – | 2 | 4 | 4 | 1 | 8 | 1 | – | 6 | 4 | – | – | 24 (15; 31) | 0.95 (0.76; 1.23) |
| р < 0.01 (2 и 4) | р < 0.01(2 и 4) | р < 0.05 (2 и 4) | – | р < 0.01 (2 и 4) | |||||||||||
| р < 0.05 (3 и 4) | р < 0.05 (3 и 4) | р>0.05 (3 и 4) | р < 0.05 (3 и 4) | р < 0.025 (3 и 4) | |||||||||||
| р < 0.01 (1 и 4) | р < 0.01 (1 и 4) | р < 0.05 (1 и 4) | – | р < 0.01 (1 и 4) | |||||||||||
| 5 | Мерказолил | 10 | – | – | – | 10 | – | – | – | 10 | – | – | – | – | 0.21 (0.18; 0.32) |
| р > 0.05 (1 и 5) | р>0.05 (1 и 5) | р>0.05 (1 и 5) | – | р < 0.05 (1 и 5) | |||||||||||
| 6 | Мерказолил + + стресс | 10 | – | – | – | 10 | – | – | – | 10 | – | – | – | – | 0.14 (0.11; 0.19) |
| р > 0.05 (5 и 6) | р > 0.05 (5 и 6) | р > 0.05 (5 и 6) | – | р < 0.05 (5 и 6) | |||||||||||
| р > 0.05 (1 и 6) | р > 0.05 (1 и 6) | р > 0.05 (1 и 6) | – | р < 0.01 (1 и 6) | |||||||||||
| р > 0.05 (2 и 6) | р > 0.05 (2 и 6) | р > 0.05 (2 и 6) | – | р < 0.05 (2 и 6) | |||||||||||
| 7 | Мерказолил + + перелом | – | 1 | 3 | 6 | 3 | 7 | – | – | 10 | – | – | – | 31 (26; 38) | 0.97 (0.68; 1.31) |
| р < 0.01 (5 и 7) | р < 0.01 (5 и 7) | р > 0.05 (5 и 7) | – | р < 0.01 (5 и 7) | |||||||||||
| р < 0.01 (6 и 7) | р < 0.01 (6 и 7) | р > 0.05 (6 и 7) | – | р < 0.01 (6 и 7) | |||||||||||
| р < 0.01 (1 и 7) | р < 0.01 (1 и 7) | р > 0.05 (1 и 7) | – | р < 0.01 (1 и 7) | |||||||||||
| р < 0.01 (3 и 7) | р < 0.01 (3 и 7) | р < 0.05 (3 и 7) | р < 0.01 (3 и 7) | р < 0.05 (3 и 7) | |||||||||||
| 8 | Мерказолил + + перелом + + стресс | – | – | 1 | 9 | 6 | 4 | – | – | 10 | – | – | – | 35 (29; 39) | 1.28 (1.12; 1.53) |
| р < 0.01 (5 и 8) | р < 0.05(5 и 8) | р > 0.05(5 и 8) | – | р < 0.01 (5 и 8) | |||||||||||
| р < 0.01 (6 и 8) | р < 0.05 (6 и 8) | р > 0.05 (6 и 8) | – | р < 0.01 (6 и 8) | |||||||||||
| р > 0.05 (7 и 8) | р > 0.05 (7 и 8) | р > 0.05 (7 и 8) | р > 0.05 (7 и 8) | р < 0.025 (7 и 8) | |||||||||||
| р < 0.01 (1 и 8) | р < 0.05 (1 и 8) | р > 0.05 (1 и 8) | – | р < 0.01 (1 и 8) | |||||||||||
| р < 0.05 (4 и 8) | р < 0.05 (4 и 8) | р < 0.05 (4 и 8) | р < 0.05 (4 и 8) | р < 0.05 (4 и 8) | |||||||||||
| 9 | Тироксин | 10 | – | – | – | 10 | – | – | – | 10 | – | – | – | – | 0.44 (0.36; 0.58) |
| р > 0.05 (1и 9) | р > 0.05 (1и 9) | р > 0.05 (1и 9) | – | р > 0.05 (1и 9) | |||||||||||
| 10 | Тироксин + + стресс | 10 | – | – | – | 10 | – | – | – | 10 | – | – | – | – | 0.33 (0.19; 0.53) |
| р > 0.05 (9 и 10) | р > 0.05 (9 и 10) | р > 0.05 (9 и 10) | – | р > 0.05 (9 и 10) | |||||||||||
| р > 0.05 (1 и 10) | р > 0.05 (1 и 10) | р > 0.05 (1 и 10) | – | р > 0.05 (1 и 10) | |||||||||||
| р > 0.05 (2 и 10) | р > 0.05 (2 и 10) | р > 0.05 (2 и 10) | – | р > 0.05 (2 и 10) | |||||||||||
| 11 | Тироксин + + перелом |
3 | 6 | 1 | – | – | – | 4 | 6 | – | 5 | 4 | 1 | 6 (1; 11) | 0.57 (0.49; 0.67) |
| р < 0.01 (9 и 11) | р < 0.01 (9 и 11) | р < 0.01 (9 и 11) | – | р < 0.05 (9 и 11) | |||||||||||
| р < 0.01 (10 и 11) | р < 0.01 (10 и 11) | р < 0.01 (10 и 11) | – | р < 0.05 (10 и 11) | |||||||||||
| р < 0.01 (1 и 11) | р < 0.01 (1 и 11) | р < 0.01 (1 и 11) | – | р < 0.025 (1 и 11) | |||||||||||
| р < 0.05 (3 и 11) | р < 0.05 (3 и 11) | р < 0.05 (3 и 11) | р < 0.05 (3 и11) | р < 0.05 (3 и 11) | |||||||||||
| 12 | Тироксин + + перелом + + стресс |
– | 6 | 4 | – | – | 5 | 3 | 2 | 2 | 6 | 2 | – | 12 (7; 18) | 0.66 (0.48; 0.91) |
| р < 0.01 (9 и 12) | р < 0.01 (9 и 12) | р < 0.01 (9 и 12) | – | р < 0.05 (9 и 12) | |||||||||||
| р < 0.01 (10 и 12) | р < 0.01 (10 и 12) | р < 0.01 (10 и 12) | – | р < 0.025 (10и12) | |||||||||||
| р < 0.05 (11 и 12) | р < 0.025 (11 и 12) | р > 0.05 (11 и 12) | р > 0.05 (11и 12) | р < 0.05 (11 и 12) | |||||||||||
| р < 0.01 (1 и 12) | р < 0.01 (1 и 12) | р < 0.01 (1 и 12) | – | р < 0.025 (1 и 12) | |||||||||||
| р < 0.05 (4 и 12) | р < 0.05 (4 и 12) | р < 0.05 (4 и 12) | р < 0.01 (4 и 12) | р < 0.05 (4 и 12) | |||||||||||
Примечание. Наличие (количество) ткани выражено в баллах по визуальной оценке гистологических срезов. Для коллагеновых волокон и площади ГК указаны медианы и границы нижнего (25) и верхнего (75) квартилей; число животных в каждой группе n = 10; р – достоверность различий между группами сравнения (указаны в скобках рядом).
Новообразование костной ткани после перелома. После воспроизведения дефекта нижней челюсти (группа “Перелом”) в области травматического повреждения на 14-е сут визуализировался процесс репаративной регенерации, который характеризовался следующими параметрами: количество плотной неоформленной соединительной ткани (ПНС-ткань) – 1 балл у 60% и 2 балла у 40% крыс; количество островков хрящевой ткани (ХТ) – 1 балл у 20%, 2 балла у 60%, 3 балла у 20% крыс; количество островков незрелой костной ткани (КТ) оценивалось в 1 балл (20%) или в 2 балла (тоже 20% крыс); количество коллагеновых волокон – 16 (10; 20)%; площадь Гаверсовых каналов (ГК) – 0.69 (0.59; 0.75) мкм2. Показатель ГК по сравнению с группами “Контроль” и “Стресс” был больше в 3 (р < 0.01) и 1.8 раза (р < 0.05) соответственно. В целом, полученные данные отражают перестройку костной ткани для осуществления процесса постфрактурного ремоделирования и свидетельствуют об окончании образования тканевого регенерата в области перелома, что соответствует концу 2-ой стадии заживления костной ткани.
Влияние стресса на формирование костной мозоли. Стрессовое воздействие на животных, подвергнутых травматическому повреждению мандибулярной кости (группа “Перелом + стресс”), негативно повлияло на восстановление костного дефекта: количество ПНС-ткани, оцениваемое в 1 балл, наблюдали у 20% крыс, а в 2 и 3 балла – у 40%; количество островков ХТ – в 1 балл у 80%, в 2 – у 10%, а у 10% крыс их не выявили; количество островков незрелой КТ оценили в 1 балл у 40% животных, а у остальных не обнаружили (рис. 1).
Рис. 1.
Гистологическая картина области посттравматического восстановления мандибулярной костной ткани в группе крыс “Перелом + стресс” Здесь и на рис. 2 и 3: 1 – Гаверсов канал, 2 – хрящевая ткань, 3 – коллагеновые волокна, 4 – незрелая костная ткань. Увел. об.: 63×.
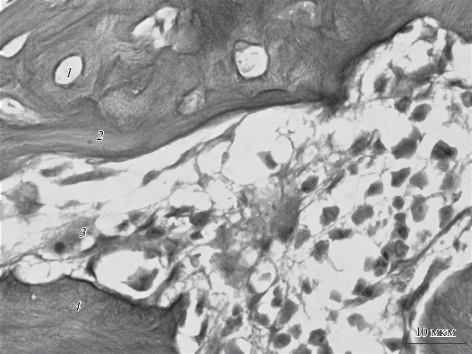
Количество коллагеновых волокон в группе “Перелом + стресс” составило 24 (15; 31)%, а площадь ГК 0.95 (0.76; 1.23) мкм2. По сравнению с величиной показателя ГК в группах “Контроль” и “Стресс” его значение в группе “Перелом + стресс” было больше в 2.5 и 4.1 раза (р < 0.01 в обоих случаях) соответственно.
По отношению к группе “Перелом” процесс заживления костной раны в группе “Перелом + стресс” был замедлен: доля животных, имеющих количество ПНС-ткани с оценкой в 1 балл, была на 40% меньше, а у 40% крыс появилась ПНС-ткань с оценкой 3 балла. У 10% животных группы этой группы островки ХТ вообще не визуализировались, островков с оценкой в 1 балл было больше на 60%, а в 2 балла – напротив, меньше на 50%, чем в группе “Перелом”. Отсутствовали крысы, имевшие количество островков ХТ с оценкой 3 балла. Количество островков незрелой КТ в 1 балл было больше на 20%, и не было животных с их количеством в 2 балла. Количество коллагеновых волокон было больше на 8% (р < 0.05), а площадь ГК была выше в 1.4 раза (р < 0.025).
Следовательно, стресс значительно ухудшает процесс остеорегенерации, индуцированный экспериментальным моделированием перелома нижнечелюстной кости, о чем свидетельствует снижение скорости образования тканевого регенерата в области дефекта. Это привело к тому, что в группе “Перелом + стресс” в отличие от группы “Перелом” за 14 сут не завершилась 2-ая стадия образования костной мозоли, т.е. образование и дифференцирование тканевых структур (Волотовский и др., 2010).
Влияние гипотиреоза на гистоструктуру костной ткани нижней челюсти. После введения мерказолила (группа “Мерказолил”) в микропрепаратах определяли только площадь ГК (в связи с отсутствием дефекта), которая составила 0.21 (0.18; 0.32) мкм2. По сравнению с аналогичным параметром у контрольных крыс она была меньше в 1.8 раза (р < 0.05). Следовательно, экспериментальный гипотиреоз per se приводит к сужению просвета ГК. Такая деформации остеонов может являться признаком развития остеопороза.
Влияние гипофункции щитовидной железы на вызванные стрессом морфологические изменения мандибулярной кости. После стресса у животных, которым вводили тиреостатик (группа “Мерказолил + стресс”), визуализировались ещe более значительные изменения микроструктуры костной ткани: площадь ГК составила 0.14 (0.11; 0.19) мкм2, т.е. была в 1.5 раза меньше по отношению к таковой в группе “Мерказолил” (р < < 0.05). По сравнению с аналогичными значениями в контроле и после стресса у эутиреоидных крыс (с нормальным уровнем ЙТГ) площадь ГК была меньше в 2.7 (р < 0.01) и 1.6 раза (р < 0.05) соответственно. Следовательно, стресс ускоряет вызванный гипофункцией щитовидной железы процесс развития остеопорозных изменений в мандибулярной костной ткани.
Влияние гипотиреоза на образование остеорегенерата в области травматического повреждения нижней челюсти. Моделирование перелома нижнечелюстной кости у животных, получивших мерказолил (группа “Мерказолил + перелом”), значительно снижало скорость заживления костной раны: количество ПНС-ткани в 1 балл визуализировали у 10% крыс, в 2 балла – у 30%, в 3 балла – у 60%; количество островков ХТ в 1 балл – у 70% а у остальных крыс они не выявлялись; островки незрелой КТ отсутствовали у всех животных; количество коллагеновых волокон составило 31 (26; 38)%; площадь ГК 0.97 (0.68; 1.31) мкм2. По отношению к величине ГК в группах “Мерказолил” и “Контроль” этот показатель был выше в 4.6 и 2.5 раза (р < 0.01 в обоих случаях) соответственно.
По сравнению с группой “Перелом” скорость постфрактурного восстановления кости нижней челюсти была снижена: доля животных, имевших количество ПНС-ткани в 1 балл, была меньше на 50%, а в 2 балла – на 10%. Появились крысы с количеством ПНС-ткани в 3 балла (60%) и без островков ХТ в области костного дефекта (30%). Число последних в 1 балл было на 50% больше, отсутствовали крысы, имевшие количество островков ХТ, соответствующее 2 и 3 баллам, а также имевшие островки незрелой КТ. Количество коллагеновых волокон было больше на 15% (р < 0.01), а площадь ГК больше в 1.4 раза (р < 0.05).
Следовательно, гипотиреоз существенно замедляет процесс регенерации в мандибулярной кости: гистологическая картина постфрактурной области соответствует лишь началу 2-ой стадии заживления перелома, тогда как у эутиреоидных животных аналогичной группы она достигает завершения.
Влияние гипофункции щитовидной железы на репаративную реакцию костной ткани в области дефекта нижнечелюстной челюсти в условиях стресса. Сочетание травматического повреждения мандибулярной кости со стрессовым воздействием у гипотиреоидных крыс (группа “Мерказолил + перелом + стресс”) привело к наиболее выраженному ухудшению репаративных процессов в области костного дефекта: количество ПНС-ткани, оцениваемое в 2 балла, наблюдали у 10% животных, в 3 балла – у 90%; количество островков ХТ с оценкой в 1 балл наблюдали у 40%, а у остальных крыс они отсутствовали. Островки незрелой КТ не визуализировались ни в одном препарате. Число коллагеновых волокон составило 35 (29; 39)%, площадь ГК – 1.28 (1.12; 1.53) мкм2 (рис. 2). Площадь ГК по сравнению со значением в группах “Мерказолил”, “Контроль” и “Мерказолил + стресс” была больше в 6.1, 3.4 и 9.1 раза (р < 0.01 во всех случаях).
Рис. 2.
Область репарации дефекта костной ткани нижней челюсти у крыс в руппе “Мерказолил + перелом + стресс”. Увел. об.: 63×.
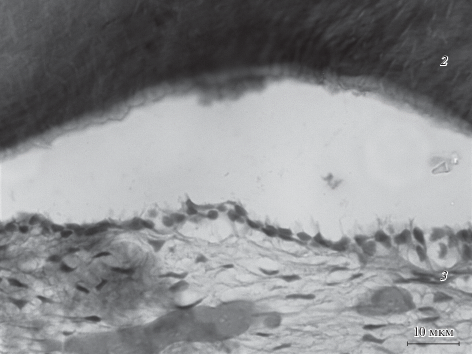
По отношению к группе “Мерказолил + перелом” количество ПНС-ткани в 2 балла было меньше на 20%, в 3 балла, напротив, больше на 30% (р < 0.01), оценка 1 балл отсутствовала. Количество островков ХТ, оцениваемое в 1 балл, стало меньше на 30%, а доля животных, не имеюших островков ХТ в остеорегенерате, выросла на 30% (р < 0.05).
По сравнению с группой “Перелом + стресс” репаративный процесс, протекающий в области костной раны нижней челюсти, значительно замедлился: доля крыс с количеством ПНС-ткани в 2 балла была на 30% меньше, тогда как с оценкой в 3 балла – на 50% больше; отсутствовали животные с числом ПНС-ткани в дефекте в 1 балл и имевшие островки незрелой КТ в его области. Крысы без островков ХТ в остеорегенерате встречались в 2 раза чаще, количество островков ХТ в 1 балл было на 40% меньше. Число коллагеновых волокон было выше на 11% (р < 0.05), площадь ГК выросла в 1.3 раза (р < 0.05).
Следовательно, гипотиреоз значительно ухудшает процесс восстановления костного дефекта нижней челюсти не только в отсутствие стресса, но и в его условиях, в связи с чем остеорегенерация достигает только лишь окончания 1-ой стадии (первичная бластома). Вместе с тем, у эутиреоидных крыс группы “Перелом + стресс” она доходит до завершения.
Таким образом, гипофункция щитовидной железы сама по себе вызывает сужение Гаверсовых каналов мандибулярной костной ткани, провоцирует его при стрессе и тормозит процесс образования регенерата на старте 2-ой стадии заживления после перелома нижней челюсти. При моделировании дефекта у гипотиреоидных животных, подвергнутых стрессу, образование костной мозоли тормозится уже на первой стадии процесса.
Следует обратить внимание на тот факт, что у крыс с интактным тиреоидным статусом стресс способствовал увеличению количества ПНС-ткани и, напротив, уменьшению островков ХТ в области дефекта кости. В целом, эти данные могут быть оценены как ухудшение заживления области травматического повреждения мандибулярной кости в условиях стресса. Отсутствие влияния стресса на число островков незрелой КТ, по нашему мнению, объясняется тем, что консолидация перелома у животных как подвергнутых стрессу, так и у нестрессированных, достигла в период исследования только стадии образования хрящевой мозоли.
У гипотиреоидных крыс группы “Мерказолил + + перелом + стресс” все оцененные нами параметры гистоструктуры образовавшегося регенерата достоверно не отличались от параметров в группе “Мерказолил + перелом” (за исключением площади ГК, которая была больше), однако на большинстве гистологических срезов наблюдали формирование грануляционной ткани в очаге повреждения, что говорит о торможении процесса заживления. Иными словами, стресс оказывает негативное воздействие на восстановление КТ, наблюдавшееся и у эутиреоидных животных, однако менее выраженное. Мы полагаем, что этот факт связан с тем, что моделирование травматического повреждения у крыс, получавших мерказолил, само по себе вызвало глубокие изменения микроструктуры в области дефекта.
Влияние L-Т4 в малых дозах на гистологическую картину ткани нижней челюсти крыс без и в условиях стресса. Введение L-Т4 (группа “Тироксин”) не привело к изменению строения мандибулярной костной ткани. Стресс у животных, получавших L-Т4 (группа “Тироксин + стресс”), как это имело место и после аналогичного воздействия без препарата, не повлиял ни на один из исследованных нами показателей, вследствие чего их величина не отличалась от групп “Контроль” и “Стресс”.
Влияние L-Т4 в дозах, близких к физиологическим, на процесс созидания и развития костной ткани после механического повреждения нижней челюсти. При воспроизведении перелома мандибулы у крыс после курса L-Т4 (группа “Тироксин + перелом”) визуализировали значительное улучшение развития постфрактурной костной мозоли: количество ПНС-ткани, соответствующее 1 баллу, наблюдали у 60% животных, 2 баллам – у 10%, а у остальных животных ее не выявляли; число островков ХТ с оценкой 2 балла было у 40% крыс, 3 балла – у 60%; количество островков незрелой КТ с оценкой 1, 2 и 3 балла наблюдали у 50, 40 и 10% животных соответственно. Количество коллагеновых волокон составило 6 (1; 11)%, площадь ГК – 0.57 (0.49; 0.67) мкм2. По сравнению с группами “Тироксин” и “Контроль” площадь ГК выросла в 1.3 (р < 0.05) и 1.5 (р < 0.025) раза соответственно.
По сравнению с группой “Перелом” процесс репаративной регенерации, происходящий в области костного дефекта нижней челюсти, был значительно ускорен: крыс с количеством ПНС-ткани в 2 балла, было на 30% меньше и появились животные без ПНСТ в области регенерата (30%). Не было выявлено препаратов с количеством островков ХТ в области костной раны в 1 балл, с двумя баллами встречались реже на 20%, с тремя – напротив, на 40% чаще. Во всех срезах остеорегенератов были обнаружены островки незрелой КТ, причем их количество с оценкой 1 и 2 балла было больше на 30 и 20% соответственно, а у 10% крыс образовались островки незрелой КТ в количестве, соответствующем 3 баллам. Количество коллагеновых волокон было ниже на 10%, площадь ГК меньше в 1.2 раза (р < 0.05 в обоих случаях).
Следовательно, близкие к физиологическим дозы тироксина способствуют интенсификации процесса заживления костной раны, индуцированному экспериментальным моделированием перелома нижнечелюстной кости, вследствие чего происходит значительное увеличение скорости образования тканевого регенерата в области дефекта. Полученные нами данные позволяют сделать заключение о том, что в группе “Тироксин + перелом” остеоцитарная регенерация достигла 3-ей стадии (образование ангиогенных костных структур), тогда как в группе “Перелом” – лишь окончания второй.
Влияние малых доз L-Т4 на постфрактурное ремоделирование ткани нижней челюсти на фоне стресса. L-Т4 в малых дозах оказал защитное действие и при сочетании перелома нижнечелюстной кости со стрессом (свободным плаванием в клетке). Так, количество ПНС-ткани, характеризующееся 1 и 2 баллами, визуализировалось у 60 и 40% животных соответственно; число островков ХТ с оценкой в 1, 2 и 3 балла наблюдали у 50, 30 и 20% животных соответственно; количество островков незрелой КТ в 1 и 2 балла – у 60 и 20% крыс, а у остальных их не выявили. Количество коллагеновых волокон составило 12 (7; 18)%, площадь ГК – 66 (0.48; 0.91) мкм2 (рис. 3). По сравнению с показателем в группах “Тироксин”, “Контроль” и “Тироксин + стресс” площадь ГК была больше в 1.5, 1.7 и 2 раза соответственно (р < 0.05, р < < 0.025 и р < 0.025).
Рис. 3.
Регенерация костной раны нижней челюсти у крыс в группе “Тироксин + перелом + стресс”. Увел. об.: 63×.
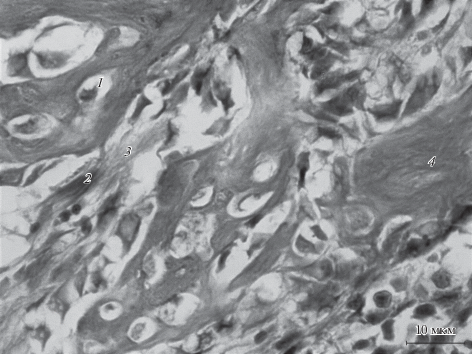
По отношению к группе “Тироксин + перелом” число крыс в группе “Тироксин + перелом + стресс” с количеством ПНС-ткани в 2 балла было на 30% больше, отсутствие ПНС-ткани не регистрировали ни в одном препарате. На гистологических срезах появились островки ХТ с количеством в 1 балл (50%), а с количеством в 2 и в 3 балла они встречались реже на 10 и 40% соответственно. Островки незрелой КТ в области перелома не обнаружили у 20% животных и ни на одном препарате не визуализировали их количество в 3 балла. Площадь ГК была меньше в 1.4 раза (р < 0.05).
По сравнению с группой “Перелом + стресс” скорость репаративной регенерации нижней челюсти в группе “Тироксин + перелом + стресс” была выше: в области костной раны доля крыс с количеством ПНС-ткани в 1 балл была на 40% больше, отсутствовали препараты с количеством ПНС-ткани и островков ХТ в 3 балла. Количество островков ХТ в 1 балл было меньше на 30%, в 2 балла, напротив, больше на 20%. Было обнаружены срезы с количеством островков ХТ в 3 балла (у 20% животных). Число островков незрелой КТ в области дефекта в 1 балл было больше на 20%, появилось 20% животных, в регенерате которых островки незрелой КТ составляли 2 балла, а количество крыс с их отсутствием на гистопрепаратах уменьшилось на 40%. Число коллагеновых волокон было ниже на 12% (р < 0.01), площадь ГК меньше в 1.4 раза (р < 0.05).
Следовательно, тироксин в малых дозах минимизирует негативное воздействие стресса на процесс постфрактурной регенерации нижней челюсти и стимулирует интенсивность процесса восстановления костной раны. Вследствие этого процесс доходит до начала 3-ей стадии остеорегенерации в отличие от эутиреоидных животных с экспериментальным переломом мандибулярной кости, подвергнутых стрессу, у которых он достиг только второй.
В целом, результаты проведенного нами гистологического исследования свидетельствуют о том, что стресс снижает скорость образования тканевого регенерата крыс в области травматического повреждения нижнечелюстной кости и препятствует завершению 2-ой стадии образования костной мозоли. Экспериментальный гипотиреоз per se приводит к сужению просвета Гаверсовых каналов и нарушению трофики костной ткани и интенсифицирует этот процесс при стрессе, а также замедляет постфрактурную репаративную регенерацию. Вследствие этого при сочетанном воздействии гипотиреоза и стресса образование костной мозоли тормозится уже на 1-ой стадии процесса. Введение близких к физиологическим доз тироксина способствует восстановлению травматического дефекта нижней челюсти и ограничивает негативное воздействие стресса на протекание гистологических стадий репаративной реакции.
Полученные результаты доказывают, что реализация фаз восстановления котной ткани в области повреждения, изолированного и комбинированного со стрессом, зависит от тиреоидного статуса – замедляется при гипофункции щитовидной железы и, напротив, интенсифицируется при введении тироксина в дозах, близким к физиологическим. Наши морфологические данные подтверждают высказанное нами предположение об участии ЙТГ в процессе постфрактурной остеорегенерации, в том числе в условиях стресса, обусловленном стимуляцией стресс-лимитирующих механизмов и фундаментальным воздействием ЙТГ на клеточный геном (Bianco et al., 2019). В реализации обсуждаемого эффекта, возможно, имеет значение и негеномное действие ЙТГ, заключающееся в повышении проницаемости клеточных мембран и стимуляции энергетических процессов в митохондриях (Cayrol et al., 2019), что создает условия для создания и эффективного использования ресурсов материнского запаса для формирования костного регенерата.
Результаты работы представляют интерес не только фундаментальный интерес для науке о человеке, но и для практической медицины в связи с широкой распространенностью патологии щитовидной железы (https://www.endocrincentr.ru/news/25-maya-vsemirnyy-den-shchitovidnoy-zhelezy) и серьeзностью еe последствий для всех систем организма, в том числе для костной.
Список литературы
Аверьянов С.В., Галиева Э.И., Рябых Л.А., Мингазева А.З. 2019. Травмы челюстно-лицевой области. Уфа: ФГБОУ ВО БГМУ Минздрава России. (Averyanov S.V., Galieva E.I., Ryabykh L.A., Mingazeva A.Z. 2019. Travmy chelyustno-licevoj oblasti. Ufa: FGBU VO BDMU MinZdrava Rossii. (Russ.))
Автандилов Г.Г. 1990. Медицинская морфометрия. М.: Медицина. (Avtandilov G.G. 1990. Medical morphometry. M.: Medicinа. (Russ.).
Бондаренко С.Н., Манухина Е.Б. 1999. Влияние различных методик стрессирования и адаптации на поведенческие и соматические показатели у крыс. Бюл. экспер. биол. мед. Т. 128. № 8. С. 157. (Bondarenko S.N., Manukhina E.B. 1999. The influence of various methods of stress and adaptation on behavioral and somatic indicators in rats. Bull. Exp. Biol. Med. (Russ.) V. 128. № 8. P. 157.)
Волотовский А.И., Макаревич Е.Р., Чирак В.Э. 2010. Регенерация костной ткани в норме и при патологии. Минск: БГМУ. (Volotovsky A.I., Makarevich E.R., Chirak V.E. 2010. Regeneraciya kostnoj tkani v norme i pri patologii. Minsk: BGMU.)
Городецкая И.В., Гусакова Е.А. 2021. Влияние малых доз L-тироксина на устойчивость к стрессу животных с экспериметально вызванным дефицитом симпатических нервных влияний. Рос. физиол. журн. им. И. М. Сеченова. Т. 107. № 3. С. 352. (Gorodetskaya I.V., Gusakova E.A. 2021. The effect of low doses of L-thyroxine on the resistance to stress of animals with experimentally induced deficiency of sympathetic nervous influences. J. Evol. Biochem. Physiol (Russ.). V. 107. № 3. Р. 352.)
Ефимов Ю.В., Стоматов Д.В., Ефимова Е.Ю. Долгова И.В., Стоматов А.В. 2019. Лечение больных с односторонним косым переломом нижней челюсти. Мед. вестн. Северного Кавказа. Т. 14. № 1.1. С. 94. (Efimov Y.V., Stomatov D.V., Efimova E.Y. Dolgova I.V., Stomatov A.V. 2019. Lechenie bol’nyh s odnostoronnim kosym perelomom nizhnej chelyusti. Med. Vestnik Severnogo Kavkaza (Russ). V. 14. № 1.1. Р. 94.)
Желнин Е.В. 2015. Динамика активности кислой и щелочной фосфатаз в ротовой жидкости при амбулаторных хирургических вмешательствах по поводу одонтогенных воспалительных заболеваниях челюсти и затрудненном прорезывании зубов мудрости. Усп. cовр. естествознания. № 1–4. С. 561. (Zhelnin E.V. 2015. Dinamika aktivnosti kisloj i shchelochnoj fosfataz v rotovoj zhidkosti pri ambulatornyh hirurgicheskih vmeshatel’stvah po povodu odontogennyh vospalitel’nyh zabolevaniyah chelyusti i zatrudnennom prorezyvanii zubov mudrosti. Uspekhi Sovremennogo Estestvoznaniya. № 1–4. Р. 561.)
Здор В.В., Маркелова Е.В., Гельцер Б.И. 2016. Новые участники нарушения толерантности к антигенам щитовидной железы: к концепции иммунопатогенеза аутоиммунных заболеваний щитовидной железы. Мед. иммунол. Т. 18. № 3. С. 209. (Zdor V.V., Markelova E.V., Geltser B.I. 2016. New participants in thyroid antigen tolerance disorders: towards the concept of immunopathogenesis of autoimmune thyroid diseases. Med. Immunol. (Russ.) V. 18. № 3. Р. 209.)
Иванов Д.Г., Александровская Н.В. 2018. Влияние социальной изоляции на стрессоустойчивость и резорбцию костной ткани крыс при термическом стрессе. Биомедицина. № 1. С. 71. (Ivanov D.G., Alexandrovskaya N.V. 2018. The effect of social isolation on stress resistance and bone resorption in rats under thermal stress. Biomed. (Russ.) № 1. Р. 71.)
Кадыков В.А., Морозов А.М. 2020. Хирургия повреждений. М.: Юрайт. (Kadykov V.A., Morozov A.M. 2020. Surgery of injuries (Russ.). Moscow: Yurayt.)
Маянская Н.Н., Рымарь С.С., Маянская С.Д. 2013. Особенности течения воспалительного процесса у крыс с экспериментальным гипо- и гипертиреозом. Казан. мед. журн. Т. 94. № 5. С. 726. (Mayanskaya N.N., Rymar S.S., Mayanskaya S.D. 2013. Features of the course of the inflammatory process in rats with experimental hypo - and hyperthyroidism. Kazan Med. J. (Russ.) V. 94. № 5. Р. 726.)
Храмова Н.В., Тураханов С.В., Махмудов А.А., Рахимов М.М. 2020. Тактика лечения больных с переломами лицевых костей. Мед. новости. № 11. С. 58. (Khramova N.V., Turakhanov S.V., Makhmudov A.A., Rakhimov M.M. 2020. Taktika lecheniya bol’nyh s perelomami licevyh kostej. Med. Novosti. (Russ.). № 11. Р. 58.)
Черных Т.М., Волынкина А.П., Горшков И.П., Захарченко А.В. 2016. Нарушение метаболизма костной ткани у пациентов с нарушениями функции щитовидной железы. Остеопороз и остеопатия. Т. 19. № 2. С. 59. (Chernykh T.M., Volynkina A.P., Gorshkov I.P., Zakharchenko A.V. 2016. Narushenie metabolizma kostnoj tkani u pacientov s narusheniyami funkcii shchitovidnoj zhelezy. Osteoporoz i Osteopatiya (Russ.) V. 19. № 2. Р. 59.)
Ярмолинская М.И., Молотков А.С., Денисова В.М. 2012. Матриксные металлопротеиназы и ингибиторы: классификация, механизм действия. Журн. акуш. и женск. бол. Т. 59. Вып. 1. С. 113. (Yarmolinskaya M.I., Molotkov A.S., Denisova V.M. 2012. Matrix metalloproteinases and inhibitors: classification, mechanism of action. Zhurnal Akusherstva i Zhenskikh Bolezney. V. 59. Iss. 1. Р. 113.)
Bianco A.C., Dumitrescu A., Gereben B., Ribeiro M.O., Fonseca T.L., Fernandes G.W., Bocco B.M.L.C. 2019. Paradigms of dynamic control of thyroid hormone signaling. Endocr. Rev. V. 40 № 4. P. 1000.
Cayrol F., Sterle H.A., Flaqué M.C.D., Arcos M.L.B., Cremaschi G.A. 2019. Non-genomic actions of thyroid hormones regulate the growth and angiogenesis of T cell lymphomas. Front. Endocrinol. V. 10. P. 63.
Degertekin C.K., Iyidir O.T., Yılmaz B.A., Elbeg S., Pasaoglu O.T., Pasaoglu H., Cakır N., Arslan M. 2016. RANKL/Osteoprotegerin system and bone turnover in Hashimoto thyroiditis. Calcif. Tissue Int. V. 99. P. 365.
Fasanya H.O., Siemann D.W. 2021. The role of cathepsins in the growth of primary and secondary neoplasia in the bone. Osteol. V. 1. P. 3.
Wright H.L, McCarthy H.S., Middleton J., Marshall M.J. 2009. RANK, RANKL and osteoprotegerin in bone biology and disease. Curr. Rev. Musculoskelet. Med. V. 2. P. 56.
Дополнительные материалы отсутствуют.


