Цитология, 2021, T. 63, № 6, стр. 538-547
Роль сигнального пути PI3K/Akt/mTOR в регуляции хондрогенной дифференцировки эндометриальных мезенхимных стромальных клеток
А. С. Бровкина 1, Р. Е. Ушаков 1, И. О. Васильева 2, А. П. Домнина 1, Е. Б. Бурова 1, *
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Городская клиническая больница № 31
197110 Санкт-Петербург, Россия
* E-mail: lenbur87@mail.ru
Поступила в редакцию 12.07.2021
После доработки 09.08.2021
Принята к публикации 10.08.2021
Аннотация
В представленной работе исследовали способность мезенхимных стромальных клеток человека (эМСК), выделенных из десквамированного эндометрия в менструальной крови, подвергаться дифференцировке в хондрогенном направлении. Возможность хондрогенной дифференцировки эМСК, как и регулирующие сигнальные пути, ранее не были исследованы. При культивировании монослойной культуры эМСК в индукционной хондрогенной среде уже через 11–14 сут выявили характерное для хондроцитов окрашивание клеточных препаратов альциановым синим и сафранином О, а также значительно повышенную экспрессию гена COL2A1, типичного маркера хондрогенной дифференцировки. Мы изучили взаимосвязь статуса активации PI3- и MAP-киназных сигнальных путей с экспрессией хондрогенных маркеров, культивируя эМСК в хондрогенной среде в присутствии ингибитора PI3-киназы – вещества LY294002. Обнаружили, что в процессе дифференцировки путь PI3К/Akt/mTOR негативно регулирует экспрессию COL1A1 и позитивно – COL2A1, а также вовлекается в регуляцию активности компонентов Raf/MEK/ERK каскада. Полученные данные позволяют заключить, что сигнальный путь PI3К/Akt/mTOR вносит существенный вклад в регуляцию индуцированного хондрогенеза эМСК.
В настоящее время все большую актуальность приобретает поиск возможностей восстановления дегенеративных изменений суставного хряща, возникающих в процессе старения организма человека. В качестве одного из подходов для решения этой глобальной проблемы предлагалось использовать хондроциты для регенерации хряща, поскольку он по причине своей бессосудистой природы имеет низкую способность к самовосстановлению. Однако хондроциты, как известно, имеют ограниченную доступность и пролиферативный потенциал; кроме того, хирургические методы восстановления хрящевой ткани, основанные на трансплантации аутологичных хондроцитов, зачастую давали неоднозначные результаты. В связи с этим, внимание исследователей сфокусировалось на мезенхимных стромальных (стволовых) клетках (МСК) человека в качестве альтернативного источника для терапевтического восстановления хрящевой ткани (Granero-Molto et al., 2008; Richardson et al., 2010; Huselstein et al., 2012; Zha et al., 2021).
МСК представляют собой небольшую популяцию стромальных клеток, присутствующих в большинстве соединительных тканей организма взрослого человека, таких как костный мозг, жировая ткань, пульпа зуба, эндометрий, амниотическая жидкость, пуповина и др. МСК поддерживаются в относительном состоянии покоя in vivo, но в ответ на различные физиологические стимулы способны пролиферировать, а затем дифференцироваться в остеобласты, хондроциты, адипоциты и другие клетки мезодермального типа, такие как кардиомиоциты и гладкомышечные клетки. Благодаря уникальным свойствам МСК – способности к самообновлению, мультипотентности, стабильности кариотипа и секреторному фенотипу – терапия, основанная на их применении, становится с каждым годом всe более перспективным направлением в регенеративной медицине.
Согласно современным представлениям, позитивные эффекты трансплантированных МСК обеспечиваются паракринным действием секретируемых биологически активных молекул (факторов роста, цитокинов, биоактивных липидов и многих других), которые стимулируют регенеративные процессы в повреждeнной ткани, индуцируют ангиогенез и модулируют иммунную систему. Можно отметить несомненные успехи в терапии на основе МСК для лечения сердечно-сосудистых и ревматических заболеваний, диабета, заболеваний костей и хрящевой ткани (Bockeria et al., 2013; Maumus et al., 2013; Konala et al., 2016; Richardson et al., 2016; Cunningham et al., 2018).
Один из подходов, применяемых для восстановления нормальной функции нативного суставного хряща после повреждения или деградации сустава, заключается в предварительном культивировании тканевой конструкции in vitro с использованием хондрогенных клеток, полученных при направленной дифференцировке МСК; для возможного клинического применения тестировали МСК, выделенные из костного мозга, пуповины или жировой ткани (Lee et al., 2004; Kim et al., 2013; Richardson et al., 2016). Очевидно, что прогресс в этой области невозможен без детального изучения молекулярных механизмов, лежащих в основе хондрогенной дифференцировки МСК. Обобщая достижения последних двух десятилетий в области изучения сигнальных путей, вовлечeнных в хондрогенную дифференцировку МСК, следует подчеркнуть важную регуляторную роль MEK/ERK и р38 МАР-киназных каскадов, а также сигнальных путей Wnt и PI3K/Akt (Oh et al., 2000; Lee et al., 2004; McMahon et al., 2008; Li et al., 2010; Zhang et al., 2014; Jiang et al., 2017; Tanthaisong et al., 2017; Ma et al., 2019).
В представленной работе объектом исследования служили МСК, выделенные из десквамированного эндометрия в менструальной крови (эМСК). Высокая пролиферативная активность при длительном культивировании, генетическая стабильность (Domnina et al., 2013), отсутствие онкогенности и низкая иммуногенность (Murphy et al., 2008) делают эМСК весьма перспективным биоматериалом для будущего клинического применения; неинвазивный и легкодоступный источник эМСК обеспечивает широкомасштабные исследования in vitro. Ранее была продемонстрирована дифференцировка этих клеток в остеобласты и адипоциты (Zemelko et al., 2012; Domnina et al., 2016), тогда как дифференцировка в хондрогенном направлении до сих пор в литературе не описана. Соответственно, отсутствуют сведения о механизмах, регулирующих хондрогенез эМСК.
Мы исследовали способность эМСК дифференцироваться в хондрогенном направлении в монослойной (2D) культуре, а также выясняли роль сигнального пути PI3К/Akt/mTOR в регуляции этого процесса.
МАТЕРИАЛ И МЕТОДИКА
Культивирование клеток. эМСК, выделенные из десквамированного эндометрия, содержащегося в менструальной крови здоровых доноров (Zemelko et al., 2012), культивировали во флаконах Т25 и Т75 (Thermo Scientific, США) в среде DMEM/F12 (Gibco, США), содержащей 10% эмбриональной сыворотки (HyClone, США), 1% PenStrep (Gibco, США) и 1% GlutaMAX (Gibco, США), при 37°C в атмосфере 5% CO2. Для экспериментов по индуцированной дифференцировке в монослое клетки трипсинизировали с помощью 0.05%-ного раствора трипсина и ЭДТА (Invitrogen, США) и рассевали на чашки диаметром 35 мм (Thermo Scientific, США): 150 тыс. кл. на 1 чашку для получения клеточных лизатов, или 200 тыс. кл. на 1 чашку для выделения РНК. Для проведения гистологического окрашивания сеяли 150 тыс. кл. на 1 чашку или 50 тыс. кл. в лунку 24-луночного планшета (Costar, США). Стимуляцию дифференцировки осуществляли на следующий день после рассева клеток.
Для проведения дифференцировки эМСК в 3D-культурах клетки рассевали в полной ростовой среде на специальные 96-луночные платы с неадгезивной поверхностью Nunclon Sphera (Thermo Scientific, США), не менее 1 млн кл. в лунку. Через 1 сут после формирования микромасс клеток осторожно заменяли ростовую среду на дифференцировочную и культивировали клетки в течение 3, 14 и 21 сут, меняя среду на свежую каждые 3 сут.
Ингибиторы. Использовали следующие вещества: U0126 (1,4-diamino-2,3-dicyano-1,4-bis(2-amino-phenylthio) butadiene) – высокоселективный ингибитор киназ MEK1/2, регулирующих активность ERK1/2 MAP-киназного пути; SB203580 (4-(4-(4-fluorophenyl)-2-(4-methylsulfinyl) phenyl)-1H-imidazol-5-yl) pyridine) – специфический ингибитор p38-MAP-киназного пути, связывающийся в АТФ-связывающем кармане молекулы p38 и предотвращающий фосфорилирование мишеней p38, но не препятствующий фосфорилированию самой киназы p38; LY294002 (2-(4-morpholinyl)-8-phenyl-4H-1-benzopyran-4-one) – специфический ингибитор PI3К, регулирующий активность PI3К/Akt-киназного пути. Ингибиторы использовали в следующих концентрациях: 10 мкМ U0126, 5 мкМ SB203580 и 1, 10 или 20 мкМ LY294002. Условия предобработки клеток каждым из ингибиторов: инкубация в полной ростовой среде в течение 40 мин при 37°C в атмосфере 5% CO2.
Индукция хондрогенной дифференцировки. Клетки культивировали в монослое (2D-культура) в коммерческой дифференцировочной среде (StemPro Osteocyte/Chondrocyte Differentiation Basal Medium; Gibco, США) в присутствии специального индуктора дифференцировки StemPro Chondrogenesis Supplement (Gibco, США). Хотя состав среды является коммерческим секретом, она содержит, как правило, следующие компоненты: DMEM-HG, инсулин-трансферрин-селенистую кислоту, дексаметазон, L-глютамин, пируват, аскорбат-2-фосфат, фактор роста TGFβ (Spagnoli et al., 2005). Хондрогенную среду меняли через каждые 3 сут; клетки культивировали в течение 3, 11 и 14 сут.
Получение клеточных лизатов. Лизаты получали, как описано ранее (Burova et al., 2013). Концентрацию белка определяли по методу Бредфорда на спектрофотометре GeneQuant 1300 (Biochrom, США). Электрофоретическое разделение белков проводили в полиакриламидном геле (8.5 или 10.5%) с последующим переносом на нитроцеллюлозную мембрану Hybond-C extra (Amersham Pharmacia Biotech, Швеция). Для визуализации белковых полос мембрану окрашивали красителем Ponceau S (Sigma, США).
Вестерн-блот-анализ. Для специфического выявления белков использовали первичные поликлональные антитела против фосфорилированных (р) белков: p-Raf (Ser338), p-MEK1/2 (Ser217/221), pрERK1/2 (Thr202/Tyr204), p-Akt (Thr308), p‑p70S6К (Thr389), p-S6 (Ser240/244), p-4EBP1 (Thr37/46), а также белков ERK2, Akt, α-тубулина и GAPDH. В качестве вторичных антител применяли GAR-HRP, GAM-HRP и DAG-HRP. Все антитела были получены из фирмы Cell Signaling (США). Пероксидазную активность коньюгатов вторичных антител тестировали с помощью метода ECL (Amersham, Швеция); хемилюминесцентное излучение регистрировали экспонированием на рентгеновскую пленку CEA RP NEW (Бельгия).
Выделение РНК. Для анализа экспрессии генов коллагена I типа (COL1A1), коллагена II типа (COL2A1), аггрекана (ACAN) и GAPDH проводили выделение РНК из клеток согласно протоколу RNeasy Mini Kit (Qiagen, Германия). Клеточный лизат подвергали многоступенчатой очистке на специальных колонках. На финальной стадии РНК с колонки элюировали водой, свободной от РНКаз. Степень очистки и концентрацию РНК определяли на приборе NanoDrop 2000C (Thermo Scientific, США); хранили препараты при –80°C.
Анализ экспрессии генов. Использовали следующие праймеры: к COL2A1 прямой GGCAATAGCAGGTTCACGTACA и обратный CGATAACAGTCTTGCCCCACTT; к ACAN прямой GCTACGACGCCATCTGCTAC и обратный GTCAGGCCAGGTCACTGTC; к COL1A1 прямой GACCTAAAGGTGCTGCTGGAG и обратный CTTGTTCACCTCTCTCGCCA; к референсному гену GAPDH прямой GAAATCCCATCACCATCTTCCAGG и обратный GAGCCCCAGCCTTCTCCATG. Все праймеры были синтезированы в компании “Синтол” (Россия). Анализ экспрессии генов проводили с помощью количественной полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) в режиме реального времени, на базе городской больницы № 31 (г. Санкт-Петербург).
Выявление гликозаминогликанов и протеогликанов. Для подтверждения дифференцировки в хондрогенном направлении клетки окрашивали альциановым синим или сафранином О для идентификации гликозаминогликанов и протеогликанов соответственно. Для этого клетки промывали PBS, фиксировали 3.7%-ным раствором формалина и окрашивали в течение 30 мин 1%-ным раствором альцианового синего в 3%-ной уксусной кислоте, либо 0.1%-ным раствором сафранина О в 1%-ной уксусной кислоте. После промывки препараты хранили в PBS при 4°C.
Статистическая обработка. Числовые данные, представленные как средние значения со стандартными отклонениями из трех независимых экспериментов, вычисляли с помощью программы Microsoft Excel с применением метода Дельта-дельта Ct (∆∆Ct).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характерным общим свойством МСК, выделенных из различных источников, является их способность к дифференцировке в клетки мезодермального типа, такие как остеобласты, адипоциты и хондроциты. Что касается традиционного объекта наших исследований – эМСК, их пластичность ранее была подтверждена дифференцировкой в остеобласты и адипоциты (Zemelko et al., 2012; Domnina et al., 2016). Дифференцировка эМСК в хондрогенном направлении, как и контролирующие этот процесс молекулярные механизмы до сих пор оставались неизученными.
Чтобы восполнить этот информационный пробел, мы попытались индуцировать хондрогенную дифференцировку эМСК в микромассах (3D-культуры), согласно известному методу (Johnstone et al., 1998). Клетки культивировали в коммерческой хондрогенной среде в течение 3, 14 и 21 сут с одновременным выделением РНК и гистологическим окрашиванием микромасс альциановым синим в указанных временных точках. Если тест на выявление гликозаминогликанов давал положительный результат, то с выделением РНК возникли непредвиденные сложности. Как показал анализ причин неудач, в процессе дифференцировки в микромассах катастрофически падает жизнеспособность клеток, поэтому через 14 сут и позже оказалось невозможно выделить неповрежденную РНК для проведения ПЦР-анализа экспрессии генов интереса. Препарат РНК приемлемой чистоты и концентрации был выделен лишь через 3 сут после индукции хондрогенеза.
Следует отметить особенность эМСК, которая проявлялась при длительном культивировании монослойных клеток в хондрогенной среде: примерно через 14 сут клетки начинали усиленно мигрировать, образуя агрегаты различной формы типа 3D-структур, которые давали положительную окраску альциановым синим, что в перспективе неизбежно приводило к потере жизнеспособности клеток в таких образованиях.
Принимая во внимание описанные выше результаты, мы решили для дальнейших исследований использовать монослойные (2D) культуры эМСК, индуцируя в них хондрогенную дифференцировку в течение 3, 11 и 14 сут. Такой дизайн экспериментов, во-первых, позволял избежать нежелательного образования 3D-структур; во-вторых, обеспечивал жизнеспособность клеток и выделение нативной РНК; в-третьих, позволял оценить динамику и модуляцию регуляторных сигнальных путей на начальных этапах дифференцировки. Для изучения вовлечeнности основных игроков МАР- и PI3-киназных путей в индуцированный хондрогенез эМСК, применили ингибиторный анализ, основанный на двух подходах: 1) клетки предварительно обрабатывали в полной ростовой среде в течение 40 мин одним из ингибиторов – U0126, SB203580 или LY294002, а затем культивировали в индукционной среде в отсутствие ингибитора; 2) предобработанные одним из ингибиторов клетки культивировали в индукционной среде в присутствии соответствующего ингибитора. В качестве положительного контроля нативные эМСК подвергали хондрогенной дифференцировке в отсутствие ингибиторов.
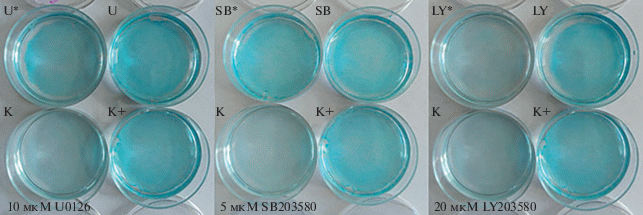
Зависимость эффективности хондрогенной дифференцировки от активности сигнальных путей. Для выбора ингибитора, наиболее эффективно модулирующего дифференцировку, клетки культивировали в индукционной среде в течение 11 сут. Как видно на рис. 1, по сравнению с контрольными (K) нативными эМСК, клетки положительного контроля (K+) были интенсивно окрашены альциановым синим (тест на присутствие гликозаминогликанов, характерных для хондроцитов), что свидетельствует в пользу их дифференцировки. Очевидно также, что из всех вариантов обработки клеток ингибиторами только вариант предобработки ингибитором PI3К (LY294002) с последующим постоянным его присутствием в среде эффективно препятствовал хондрогенной дифференцировке (рис. 1, LY*). Поэтому именно ингибитору PI3К мы отдали предпочтение в дальнейших исследованиях.
Рис. 1.
Влияние ингибиторов U0126 (U), SB203580 (SB) или LY294002 (LY) на эффективность индуцированной хондрогенной дифференцировки эМСК. K – интактные клетки, окрашенные в начальный день эксперимента; K+ – положительный контроль (клетки культивировали в индукционной среде); U, SB, LY – предобработка одним из ингибиторов в течение 40 мин в полной ростовой среде с последующим культивированием в индукционной среде без ингибитора; U*, SB*, LY* – такая же предобработка клеток ингибитором с последующим культивированием при его постоянном присутствии в индукционной среде. Продолжительность дифференцировки – 11 сут, затем клетки во всех лунках, за исключением интактных клеток, были окрашены альциановым синим.
Для выявления зависимости эффективности дифференцировки эМСК от дозы и времени действия LY294002, стимулировали дифференцировку в присутствии 1, 10 или 20 мкМ LY294002, и затем окрашивали клетки альциановым синим через 3 и 14 сут или сафранином О через 14 сут (рис. 2). Как показывает анализ окраски альциановым синим, через 3 сут после индукции дифференцировки наблюдается незначительное, одинаковое по интенсивности, окрашивание клеток во всех лунках (рис. 2, 2а–5а) по сравнению с нативными клетками (рис. 2, лунка 1а). Напротив, через 14 сут (рис. 2, лунки 3б–5б) очевидна зависимость интенсивности окрашивания от концентрации LY294002: 2б ≈ 3б > 4б > 5б. Градиент окраски клеток сафранином О через 14 сут дифференцировки (рис. 2, лунки 2в–5в) аналогичен окрашиванию альциановым синим в той же временной точке: 2в ≈ 3в > 4в > 5в.
Рис. 2.
Зависимость эффективности хондрогенной дифференцировки эМСК от дозы и времени действия ингибитора LY294002 (LY). Окраска клеток в лунках альциановым синим: 3 сут (лунки 1а–5а), 14 сут (лунки 1б–5б); окраска сафранином О: 14 сут (лунки 1в–5в). 1 – интактные клетки, окраска в начальный день эксперимента; 2 – индуцированная дифференцировка (положительный контроль); 3, 4, 5 – дифференцировка в присутствии 1, 10, 20 мкМ LY соответственно.
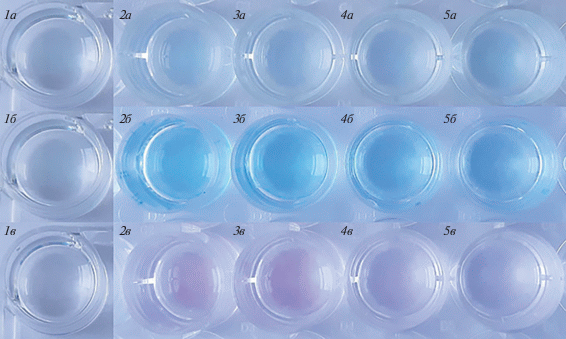
По результатам гистологического окрашивания альциановым синим и сафранином О, которые выявляют характерные для хондроцитов гликозаминогликаны и протеогликаны соответственно, можно предположить, что PI3-киназный сигнальный путь вовлекается в регуляцию хондрогенной дифференцировки. Действительно, при специфическом блокировании этого пути мы наблюдали явно выраженный дозозависимый эффект (интенсивность окраски обратно пропорциональна концентрации ингибитора) и его корреляцию с продолжительностью дифференцировки.
Уровень экспрессии коллагена I типа (COL1A1), коллагена II типа (COL2A1) и аггрекана (ACAN). Интактные и коммитированные к хондрогенной дифференцировке эМСК анализировали с помощью количественного метода ОТ-ПЦР в реальном времени. В необработанных эМСК относительный уровень экспрессии COL1A1 минимален; при запуске хондрогенной дифференцировки (K+) он увеличивался и далее существенно не изменялся в течение всего периода наблюдения (рис. 3а). Под действием ингибитора LY294002 уровень экспрессии COL1A1 через 14 сут возрастал в несколько раз относительно положительного контроля (K+) и почти в 50 раз относительно интактных клеток (K). Можно предположить, что функционально активная PI3К через специфические сигнальные пути вовлечена в негативную регуляцию экспрессии гена COL1A1, что обеспечивает нормальное развитие дифференцировки эМСК.
Рис. 3.
Действие ингибитора LY294002 (LY) на экспрессию генов коллагена I типа (COL1A1), коллагена II типа (COL2A1) и аггрекана (ACAN) в процессе дифференцировки эМСК в хондрогенном направлении. Сравнение уровня экспрессии генов COL1A1 (а), COL2A1 (б) и ACAN (в) в эМСК до и после индукции дифференцировки; показаны средние значения из трeх независимых экспериментов и стандартные отклонения (вертикальные отрезки) относительно GAPDH. K – контрольные интактные клетки; K+ – положительный контроль (клетки, в которых дифференцировка продолжалась в течение 3 или 14 сут); LY – дифференцировка в течение 3 или 14 сут при постоянном присутствии ингибитора в индукционной среде. Хондр. – хондроциты, выделенные из хряща человека.
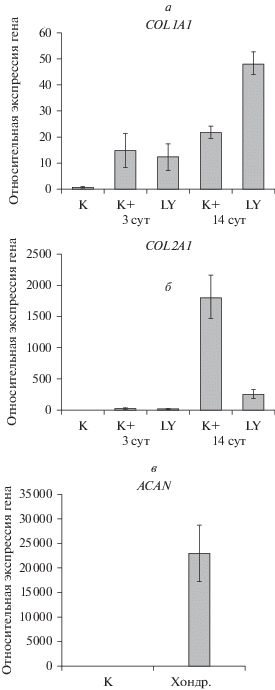
Как видно на рис. 3б, специфичный для хрящевой ткани ген COL2A1 экспрессируется в контрольных эМСК на таком же низком уровне, как и ген COL1A1; после индукции хондрогенеза он увеличивается, достигая на 14-е сут максимального значения: наблюдаемый прирост относительно K+ (3 сут) составляет 60 раз, а относительно K – около 1800 раз. Через 14 сут дифференцировки наиболее ярко выражен и эффект ингибитора LY294002: уровень экспрессии COL2A1 падает почти в 7 раз по сравнению со значением для K+ (14 сут). Следовательно, LY294002 супрессирует экспрессию гена COL2A1 в процессе хондрогенеза, причeм особенно сильно на поздних стадиях. Эти результаты свидетельствуют о том, что активный PI3К-зависимый сигнальный путь может быть включен в сигнальные пути хондрогенеза эМСК и необходим для стимулирования экспрессии коллагена II типа в течение длительного времени.
Мы проверили также уровень экспрессии гена аггрекана (ACAN), специфичного для хрящевой ткани; однако экспрессия ACAN не была выявлена через 14 сут после индукции дифференцировки в монослойной культуре эМСК (данные не представлены). Чтобы исключить возможную ошибку из-за неподходящих праймеров, с помощью ОТ-ПЦР оценили уровень экспрессии аггрекана в первичных хондроцитах, выделенных из хряща человека: как и ожидалось, уровень экспрессии ACAN был высоким (рис. 3в); аналогичные результаты были продемонстрированы в нашей предыдущей работе (Ushakov et al., 2020).
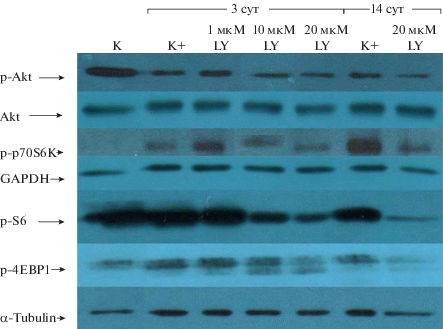
PI3К/Akt/mTOR сигнальный путь. Далее мы исследовали потенциальные механизмы, лежащие в основе наблюдаемых эффектов LY294002. В первую очередь мы проверили участие сигнального пути PI3K/Akt/mTOR в процессе дифференцировки. Механистическая мишень рапамицина (mTOR) является интегральным компонентом этого пути и относится к семейству протеинкиназ, родственных PI3K. Киназа mTOR функционирует как каталитическая субъединица в двух различных мультибелковых комплексах, которые контролируют в клетке разные программы (Loewith et al., 2002). Так, чувствительный к рапамицину комплекс mTORC1 характеризуется регуляторной субъединицей Raptor (regulatory associated protein of mTOR) и контролирует синтез белка (размер клеток) через фосфорилирование эффекторов – рибосомной киназы р70S6K и белка 4E‑BP1, ингибитора фактора инициации элонгации. Это фосфорилирование стимулирует трансляцию мРНК, пролиферацию и клеточный рост (Sarbassov et al., 2005). PI3K/Akt-зависимая регуляция активности mTORС1 представляет собой сложный многоступенчатый процесс, подробно описанный в ряде обзоров (Sarbassov et al., 2005; Huang, Manning, 2009; Steelman et al., 2011).
Статус активации компонентов PI3К/Akt/mTOR пути оценивали методом иммуноблотинга. Рис. 4 показывает, что индукция дифференцировки (K+) приводит к значительному уменьшению уровня фосфорилирования Akt по сравнению с интактными клетками (K), тогда как фосфорилирование эффекторных мишеней mTORC1 – p70S6К и 4ЕВР1 – усиливается, оставаясь на высоком уровне весь период наблюдения, как и рибосомального белка S6. Кроме того, чeтко прослеживается дозозависимый эффект LY294002 на уровень фосфорилирования Akt, p70S6К, S6 и 4EBP1, что подтверждает специфичность действия ингибитора на ось PI3К/Akt/mTOR. Таким образом, можно заключить, что хондрогенная дифференцировка эМСК связана с PI3K-зависимой модуляцией активности всех компонентов исследуемого сигнального пути.
Рис. 4.
Специфическое ингибирование PI3K уменьшает функциональную активность сигнального пути PI3К/Akt/mTOR при хондрогенной дифференцировке эМСК. Вестерн-блот-анализ с использованием специфических антител. K – контрольные интактные клетки; K+ – положительный контроль (клетки, в которых дифференцировка продолжалась в течение 3 или 14 сут); LY294002 (LY) – дифференцировка клеток при постоянном присутствии ингибитора в индукционной среде в течение 3 сут (1, 10 и 20 мкМ LY) или 14 сут (20 мкМ LY). Указаны фосфорилированные формы Akt, p70S6K, S6, 4E-BP1, а также белки Akt, GАPDH, α-Tubulin.
Изучение роли PI3К в хондрогенезе МСК различной природы показало, что эта киназа вовлекается в контроль дифференцировки только в ответ на стимуляцию инсулиноподобным фактором роста (IGF-1), но не трансформирующим фактором роста β (TGF-β) (Starkman et al., 2005; McMahon et al., 2008; Yin et al., 2009), а партнерами PI3К по большей части служат протеинкиназы МАРК-семейства.
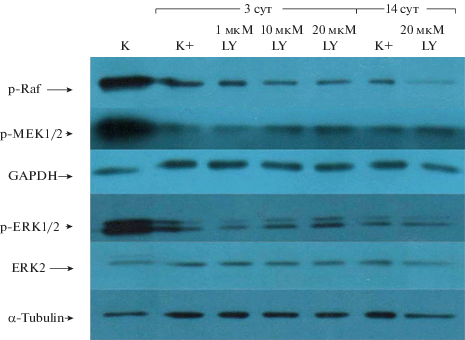
Влияние PI3-киназного пути на активность компонентов сигнального каскада Raf/MEK/ERK. Для понимания механизма хондрогенной дифференцировки эМСК важно выяснить не только функциональный статус отдельных белков в составе сигнальных каскадов, но и взаимную регуляцию различных каскадов (crosstalk). Как показывает анализ данных из литературы, механизмы внутриклеточной передачи сигналов, регулирующих хондрогенную дифференцировку взрослых МСК, включают, помимо PI3K, МАР-киназу ERK1/2. При этом в зависимости от клеточного контекста и используемого фактора роста, отмечали противоположную роль ERK1/2 в качестве регулятора дифференцировки – и негативную (Oh et al., 2000; Oh, Chun, 2003; Starkman et al., 2005; McMahon et al., 2008), и позитивную (Tuli et al., 2003; Lee et al., 2004; McMahon et al., 2008; Zhang et al., 2014; Jiang et al., 2017).
Известно, что PI3К/Akt и МАР-киназные сигнальные пути контролируют функцию mTORC1 (Manning et al., 2002; Ma et al., 2005), причем mTORC1 способен негативно регулировать ERK-зависимый МАР-киназный путь (Грюкова и др., 2017). Здесь мы проверили, возможно ли пересечение этих сигнальных путей в процессе хондрогенной дифференцировки эМСК. С этой целью провели анализ статуса активации МАР-киназного каскада в зависимости от ингибирования PI3К/Akt пути.
Как видно на рис. 5, интактные эМСК (К) характеризуются высоким уровнем фосфорилирования киназ Raf, MEK и ERK, что обеспечивает высокий пролиферетивный потенциал этих клеток. При запуске хондрогенной дифференцировки (K+) уровень фосфорилирования каждой из киназ резко снижается и мало изменяется в течение всего эксперимента. Через 3 сут после индукции дифференцировки наблюдается дозозависимое активирующее действие LY294002 на MEK1/2 и ERK1/2: при увеличении концентрации ингибитора уровень их фосфорилирования повышается, причeм для p-ERK1/2 это не связано с увеличением экспрессии белка ERK2 в процессе дифференцировки. В отношении р-Raf имеет место обратная закономерность. Следовательно, при отсутствии супрессирующего действия ингибитора, активная PI3К способна негативно регулировать активность МАР-киназ MEK1/2 и ERK1/2 и позитивно – МАР-киназы Raf. Эти данные свидетельствуют о пересечении функций сигнальных путей PI3К/Akt и МАРК в ходе хондрогенеза эМСК, причeм для эффективной дифференцировки требуется повышенная активность первого при даун-регуляции второго из упомянутых путей.
Рис. 5.
Ингибитор LY294002 (LY) модулирует статус активации протеинкиназ каскада Raf/MEK/ERK в процессе хондрогенной дифференцировки эМСК. Обозначения те же, что на рис. 4. Указаны фосфорилированные формы киназ Raf, MEK1/2, ERK1/2, а также белков ERK2, GАPDH, α-Tubulin.
В настоящей работе мы продемонстрировали возможность дифференцировки эМСК в хондрогенном направлении в монослойной культуре и оценили динамику этого процесса в течение 14 сут. Применяя фармакологическое ингибирование активности PI3К-зависимого сигнального пути, показали его участие в хондрогенной дифференцировке на уровне аккумуляции гликозаминогликанов и протеогликанов, экспрессии генов COL1A1 и COL2A1 и регуляции активности киназ Raf/MEK/ERK сигнальной оси. Таким образом, наши находки однозначно указывают на важную регуляторную роль функционально активного PI3К/Akt/mTOR сигнального каскада для хондрогенной дифференцировки эМСК, что углубляет представление о молекулярном механизме хондрогенеза эМСК in vitro.
Список литературы
Грюкова А.А., Шатрова А.Н., Дерябин П.И., Бородкина А.В., Князев Н.А., Никольский Н.Н., Бурова Е.Б. 2017. Модуляция фенотипических признаков старения стволовых эндометриальных клеток в условиях ингибирования mTOR и MAP-киназных сигнальных путей. Цитология. Т. 59. № 6. С. 410. (Grukova A.A., Shatrova A.N., Deryabin P.I., Borodkina A.V., Knyazev N.A., Nikolsky N.N., Burova E.B. 2017. Modulation of senescence phenotype of human endometrial stem cells under inhibition of mTOR and MAP-kinase signaling pathways. Tsitologiya. V. 59. № 6. P. 410.)
Bockeria L., Bogin V., Bockeria O., Le T., Alekyan B., Woods E.J., Brown A.A., Ichim T.E., Patel A.N. 2013. Endometrial regenerative cells for treatment of heart failure: a new stem cell enters the clinic. J. Transl. Med. V. 11. P. 56. https://doi.org/10.1186/1479-5876-11-56
Burova E., Borodkina A., Shatrova A., Nikolsky N. 2013. Sublethal oxidative stress induces the premature senescence of human mesenchymal stem cells derived from endometrium. Oxid. Med. Cell. Longev. V. 2013. P. 474931. https://doi.org/10.1155/2013/474931
Cunningham C.J., Redondo-Castro E., Allan S.M. 2018. The therapeutic potential of the mesenchymal stem cell secretome in ischaemic stroke. J. Cereb. Blood Flow Metab. V. 38. P. 1276. https://doi.org/10.1177/0271678X18776802
Domnina A.P., Fridliandskaia I.I., Zemelko V.I., Pugovkina N.A., Kovaleva Z.V., Zenin V.V., Grinchuk T.M., Nikolsky N.N. 2013. Mesenchymal stem cells from human endometrium do not undergo spontaneous transformation during long-term cultivation. Cell Tiss. Biol. V. 7. P. 221
Domnina A.P., Novikova P.V., Lyublinskaya O.G., Zenin V.V., Fridlyanskaya I.I., Mikhailov V.M., Nikolsky N.N. 2016. Mesenchymal stem cells with irreversibly arrested proliferation stimulate decidua development in rats. Exp. Ther. Med. V. 12. P. 2447. https://doi.org/10.3892/etm.2016.3671
Granero-Molto F., Weis J.A., Longobardi L., Spagnoli A. 2008. Role of mesenchymal stem cells in regenerative medicine: application to bone and cartilage repair. Expert Opin. Biol. Ther. V. 8. P. 255. https://doi.org/10.1517/14712598.8.3.255
Huang J., Manning B.D. 2009. A complex interplay between Akt, TSC2 and two mTOR complexes. Biochem. Soc. Trans. V. 37. P. 217. https://doi.org/10.1042/BST0370217
Huselstein C., Li Y., He X. 2012. Mesenchymal stem cells for cartilage engineering. Biomed. Mater. Eng. V. 22. P. 69. https://doi.org/10.3233/BME-2012-0691
Jiang X., Huang B., Yang H., Li G., Zhang C., Yang G., Lin F., Lin G. 2017. TGF-β1 is involved in vitamin d-induced chondrogenic differentiation of bone marrow-derived mesenchymal stem cells by regulating the ERK/JNK pathway. Cell Physiol. Biochem. V. 42. P. 2230. https://doi.org/10.1159/000479997
Johnstone B., Hering T.M., Caplan A.I., Goldberg V.M., Yoo J.U. 1998. In vitro chondrogenesis of bone marrow-derived mesenchymal progenitor cells. Exp. Cell Res. V. 238. P. 265. https://doi.org/10.1006/excr.1997.3858
Kim D.W., Staples M., Shinozuka K., Pantcheva P., Kang S.D., Borlongan C.V. 2013. Wharton’s jelly-derived mesenchymal stem cells: phenotypic characterization and optimizing their therapeutic potential for clinical applications. Int. J. Mol. Sci. V. 14. P. 11692. https://doi.org/10.3390/ijms140611692
Konala V.B., Mamidi M.K., Bhonde R., Das A.K., Pochampally R., Pal R. 2016. The current landscape of the mesenchymal stromal cell secretome: A new paradigm for cell-free regeneration. Cytotherapy. V. 18. P. 13. https://doi.org/10.1016/j.jcyt.2015.10.008
Lee J.W., Kim Y.H., Kim S.-H., Han S.H., Hahn S.B. 2004. Chondrogenic differentiation of mesenchymal stem cells and its clinical applications. Yonsei Med. J. V. 45. Suppl. P. 41. https://doi.org/10.3349/ymj.2004.45.Suppl.41
Li J., Zhao Z., Liu J., Huang N., Long D., Wang J., Li X., Liu Y. 2010. MEK/ERK and p38 MAPK regulate chondrogenesis of rat bone marrow mesenchymal stem cells through delicate interaction with TGF-beta1/Smads pathway. Cell Prolif. V. 43. P. 333. https://doi.org/10.1111/j.1365-2184.2010.00682.x
Loewith R., Jacinto E., Wullschleger S., Lorberg A., Crespo J., Bonenfant D., Oppliger W., Jenoe P., Hall M.N. 2002. Two TOR complexes, only one of which is rapamycin sensitive, have distinct roles in cell growth control. Mol. Cell. V. 10. P. 457. https://doi.org/10.1016/s1097-2765(02)00636-6
Ma L., Chen Z., Erdjument-Bromage H., Tempst P., Pandolfi P.P. 2005. Phosphorylation and functional inactivation of TSC2 by Erk implications for tuberous sclerosis and cancer pathogenesis. Cell. V. 121. P. 179. https://doi.org/10.1016/j.cell.2005.02.031
Ma N., Teng X., Zheng Q., Chen P. 2019. The regulatory mechanism of p38/MAPK in the chondrogenic differentiation from bone marrow mesenchymal stem cells. J. Orthop. Surg. Res. V. 14. P. 434. https://doi.org/10.1186/s13018-019-1505-2
Manning B.D., Tee A.R., Logsdon M.N., Blenis J., Cantley L.C. 2002. Identification of the tuberous sclerosis complex-2 tumor suppressor gene product tuberin as a target of the phosphoinositide 3-kinase/akt pathway. Mol. Cell. V. 10. P. 151. https://doi.org/10.1016/s1097-2765(02)00568-3
Maumus M., Jorgensen C., Noël D. 2013. Mesenchymal stem cells in regenerative medicine applied to rheumatic diseases: role of secretome and exosomes. Biochimie. V. 95. P. 2229. https://doi.org/10.1016/j.biochi.2013.04.017
McMahon L.A., Prendergast P.J., Campbell V.A. 2008. A comparison of the involvement of p38, ERK1/2 and PI3K in growth factor-induced chondrogenic differentiation of mesenchymal stem cells. Biochem. Biophys. Res. Commun. V. 368. P. 990. https://doi.org/10.1016/j.bbrc.2008.01.16
Murphy M.P., Wang H., Patel A.N., Kambhampati S., Angle N., Chan K., Marleau A.M., Pyszniak A., Carrier E., Ichim T.E., Riordan N.H 2008. Allogeneic endometrial regenerative cells: An ′off the shelf solution′ for critical limb ischemia? J. Transl. Med. V. 6. P. 45. https://doi.org/10.1186/1479-5876-6-45
Oh C.D., Chang S.H., Yoon Y.M., Lee S.J., Lee Y.S., Kang S.S., Chun J.S. 2000. Opposing role of mitogen-activated protein kinase subtypes, erk-1/2 and p38, in the regulation of chondrogenesis of mesenchymes. J. Biol. Chem. V. 275. P. 5613. https://doi.org/10.1074/jbc.275.8.5613
Oh C.D., Chun J.S. 2003. Signaling mechanisms leading to the regulation of differentiation and apoptosis of articular chondrocytes by insulin-like growth factor-1. J. Biol. Chem. V. 278. P. 36563. https://doi.org/10.1074/jbc.M304857200
Richardson S.M., Hoyland J.A., Mobasheri R., Csaki C., Shakibaei M., Mobasheri A. 2010. Mesenchymal stem cells in regeneratives medicine: opportunities and challenges for articular cartilage and intervertebral disc tissue engineering. J. Cell Physiol. V. 222. P. 23. https://doi.org/10.1002/jcp.21915
Richardson S.M., Kalamegam G., Pushparaj P.N., Matta C., Memic A., Khademhosseini A., Mobasheri R., Poletti F.L., Hoyland J.A., Mobasheri A. 2016. Mesenchymal stem cells in regenerative medicine: Focus on articular cartilage and intervertebral disc regeneration. Methods. V. 99. P. 69. https://doi.org/10.1016/j.ymeth.2015.09.015
Sarbassov D.D., Ali S.M., Sabatini D.M. 2005. Growing roles for the mTOR pathway. Curr. Opin. Cell Biol. V. 17. P. 596. https://doi.org/10.1016/j.ceb.2005.09.009
Spagnoli A., Longobardi L., O’Rear L. 2005. Cartilage disorders: potential therapeutic use of mesenchymal stem cells. Endocr. Dev. V. 9. P. 17. https://doi.org/10.1159/000085719
Starkman B.G., Cravero J.D., Delcarlo M., Loeser R.F. 2005. IGF-I stimulation of proteoglycan synthesis by chondrocytes requires activation of the PI3-kinase pathway but not ERK MAPK. Biochem. J. V. 389. P. 723. https://doi.org/10.1042/BJ20041636
Steelman L.S., Chappell W.H., Abrams S.L., Kempf R.C., Long J., Laidler P., Mijatovic S., Maksimovic-Ivanic D., Stivala F., Mazzarino M.C., Donia M., Fagone P., Malaponte G., Nicoletti F., Libra M. et al. 2011. Roles of the Raf/MEK/ERK and PI3K/PTEN/ Akt/mTOR pathways in controlling growth and sensitivity to therapy-implications for cancer and aging. Aging (Albany NY). V. 3. P. 192. https://doi.org/10.18632/aging.100296
Tanthaisong P., Imsoonthornruksa S., Ngernsoungnern A., Ngernsoungnern P., Ketudat-Cairns M., Parnpai R. 2017. Enhanced chondrogenic differentiation of human umbilical cord Wharton’s jelly derived mesenchymal stem cells by GSK-3 inhibitors. PLoS One. V. 12. P. e0168059. https://doi.org/10.1371/journal.pone.0168059
Tuli R., Tuli S., Nandi S., Huang X., Manner P.A., Hozack W.J., Danielson K.G., Hall D.J., Tuan R.S. 2003. Transforming growth factor-beta-mediated chondrogenesis of human mesenchymal progenitor cells involves N-cadherin and mitogen-activated protein kinase and Wnt signaling cross-talk. J. Biol. Chem. V. 278. P. 41227. https://doi.org/10.1074/jbc.M305312200
Ushakov R.E., Skvortsova E.V., Vitte M.A., Vassilieva I.O., Shatrova A.N., Kotova A.V., Kenis V.M., Burova E.B. 2020. Chondrogenic differentiation followed IGFBP3 loss in human endometrial mesenchymal stem cells. Biochem. Biophys. Res. Commun. V. 531. P. 133. https://doi.org/10.1016/j.bbrc.2020.07.064
Yin W., Park J.I., Loeser R.F. 2009. Oxidative stress inhibits insulin-like growth factor-I induction of chondrocyte proteoglycan synthesis through differential regulation of phosphatidylinositol 3-Kinase-Akt and MEK-ERK MAPK signaling pathways. J. Biol. Chem. V. 284. P. 31972. https://doi.org/10.1074/jbc.M109.056838
Zemelko V.I., Grinchuk T.M., Domnina A.P., Artzibasheva I.V., Zenin V.V., Kirsanov A.A., Bichevaia N.K., Korsak V.S., Nikolsky N.N. 2012. Multipotent mesenchymal stem cells of desquamated endometrium: Isolation, characterization, and application as a feeder layer for maintenance of human embryonic stem cells. Cell Tiss. Biol. V. 6. P. 1. https://doi.org/10.1134/S1990519X12010129
Zha K., Sun Z., Yang Y., Chen M., Gao C., Fu L., Li H., Sui X., Guo Q., Liu S. 2021. Recent developed strategies for enhancing chondrogenic differentiation of MSC: Impact on MSC-based therapy for cartilage regeneration. Stem Cells Int. V. 2021. P. 8830834. https://doi.org/10.1155/2021/8830834
Zhang Y., Pizzute T., Pei M. 2014. A review of crosstalk between MAPK and Wnt signals and its impact on cartilage regeneration. Cell Tissue Res. V. 358. P. 633. https://doi.org/10.1007/s00441-014-2010-x
Дополнительные материалы отсутствуют.


