Цитология, 2021, T. 63, № 6, стр. 531-537
Роль вне- и внутриклеточного значения pН в регуляции опухолевого процесса
В. А. Кобляков *
Научно-исследовательский медицинский центр онкологии им. Н.Н. Блохина Минздрава России
115478 Москва, Россия
* E-mail: kobliakov@rambler.ru
Поступила в редакцию 02.08.2021
После доработки 10.08.2021
Принята к публикации 10.08.2021
Аннотация
В обзоре приводятся и обсуждаются данные о роли изменения рН вне- и внутри клетки, вызванного аэробным гликолизом в опухолевой ткани. По сравнению с нормальной тканью в опухоли происходит подкисление межклеточного пространства и увеличение рН внутри клеток опухоли. Основным фактором регуляции гликолиза является транскрипционный фактор HIFα. Изменения величины рН связано с тем, что конечным продуктом превращения глюкозы становится не пируват, а лактат. Лактат транспортируется через клеточную мембрану и подкисляет межклеточное пространство. Кроме того, фактор HIFα вызывает транскрипцию ряда протонных помп и матриксных протеиназ, которые активируются в кислой среде межклеточного пространства. Происходит разрушение межклеточного матрикса, что дает клеткам опухоли возможность инвазии. Подкисление межклеточного пространства благодаря функционированию протонных помп вызывает увеличение рН внутри клеток. Повышение внутриклеточного рН стимулирует ускоренное прохождение клетками фазы G2 клеточного цикла. Обсуждаются молекулярные механизмы этого процесса. Делается заключение, что основные факторы опухолевого процесса – инвазия, ускоренная пролиферация, нестабильность генома – обусловлены аэробным гликолизом (эффектом Варбурга).
В настоящее время большое количество публикаций связно с понятием “перепрограммирование опухолевых клеток”. Под этим термином понимается существование в опухолевых клетках отличной от нормальных клеток системы регуляции функционирования клеточных процессов. Исторически сложилось так, что первым описанным различием в функционировании нормальных и опухолевых клеток стало показанное Варбургом наличие гликолиза в опухолевых клетках при нормальном уровне кислорода (Warburg et al., 1924; Lu et al., 2002). Варбург считал, что переход на гликолиз обусловлен поломками в опухолевых клетках функционирования митохондрий, что влечет за собой и другие изменения функций клеток, ведущих в конечном итоге к развитию опухоли. Согласно современным представлениям, переход на аэробный гликолиз опухолевых клеток, как правило, не связан с нарушением митохондриальных функций, а основным фактором развития опухоли являются неконтролируемое функционирование онкогенов и (или) нарушения в структуре генов-супрессоров.
В нормальных клетках переход на гликолиз происходит в условиях гипоксии. Различие превращения глюкозы при нормоксии и гипоксии связано с тем, что при нормоксии основным конечным продуктом превращения глюкозы является пируват (рис. 1), транспортируемый в митохондрии пируватдегидрогеназным комплексом и под воздействием пируватдегидрогеназы превращаемый в ацетилкоэнзим А. Ацетилкоэнзим А является важным элементом цикла Кребса. При гипоксии экспрессируется, во-первых, фермент пируватдегидрогеназы киназа, которая фосфорилирует пируватдегидрогеназу, инактивируя ее (Kim et al., 2006), а во-вторых, лактатдегидрогеназа А, которая превращает пируват в лактат (рис. 1).
Рис. 1.
Регуляция гликолиза. Глюкоза через клеточную мембрану транспортируется глюкозотранспортером внутрь клетки. Под действием гексокиназы образуется глюкоза-6-фосфат, который под действием глюкозо-6-фосфатдегидpогеназы направляется в пентозный цикл, или под действием глюкозо-6-фосфатизомеразы и других ферментов превращается в пируват. Пируват под действием пируватдегидрогеназы преврашается в ацетилкоэнзим А и напраляется в цикл Кребса. В условиях гипоксии транскрипционный фактор HIFα вызывает синтез пируватдегидрогеназы киназы, которая ингибирует пируватдегидрогеназу и препятствует образованию ацетилкоэнзима А. Под действием лактатдегидрогеназы А пируват превращается в лактат.
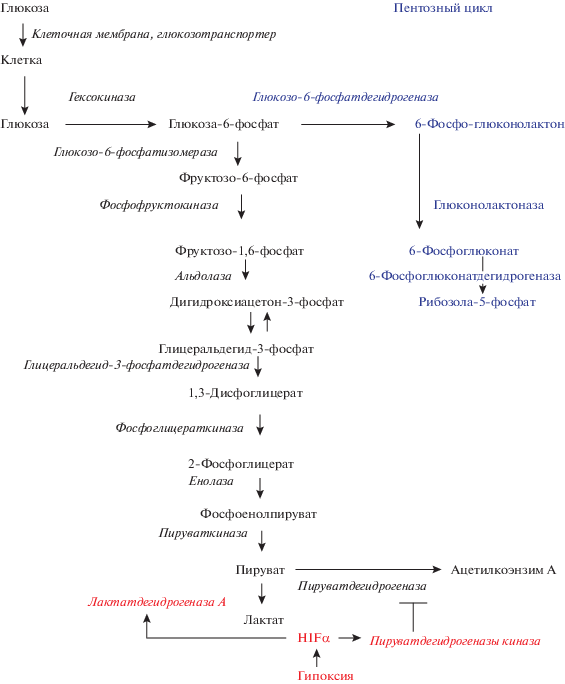
Механизм перехода клеток при гипоксии на гликолиз хорошо изучен. Показано, что основным элементом этого события является функционирование транскрипционного фактора HIFα. При нормоксии этот белок окисляется по остаткам пролина в положении 402 и 405 ферментом пролилоксидазой (Benizri et al., 2003; Cash et al., 2007). Окисленный HIFα взаимодействует с убиквитинлигазой VHL и направляется в протеосомы, где разрушается (см. обзоры: Lee et al., 2007; Кобляков, 2010). При гипоксии в комплексе 3 дыхательной цепи митохондрий образуются активные формы кислорода в форме супероксидного аниона и перoксида водорода (Chandel et al., 2000; Lee et al., 2016). Активированные формы кислорода выходят из митохондрий, взаимодействуют с сульфгидрильными группами пролилоксидазы, блокируя активность фермента. В результате происходит накопление белка HIFα, который взаимодействует с другим компонентом транскрипционного комплекса – белком HIFβ (другое название ARNT), уровень которого в клетке постоянен. Активируемые этим транскрипционным комплексом гены синтезируют белки гликолиза, которые усиливают процесс превращения глюкозы. Синтезируется пируватдегидрогеназа киназа, блокирующая превращение пирувата в коэнзим А, благодаря дезактивации пируватдегидрогеназы (Kim et al., 2006). Экспрессируется лактатдегидрогеназа А, превращающая пируват в лактат. В результате, конечным продуктом превращения глюкозы становится не пируват, а лактат (рис. 1). Одновременно активируются гены, кодирующие монокарбоксилат-транспортеры, транспортирующие лактат вместе с протоном в межклеточное пространство. Помимо синтеза этих ферментов гликолиза, комплекс HIFα–HIFβ транскрибирует экспрессию большого количество других генов, белки которых, так или иначе, участвуют в развитии опухолевого процесса. В настоящее время показано, что комплекс HIFα–HIFβ влияет на транскрипцию более 200 генов.
Анализ механизма действия различных онкогенов приводит к заключению, что синтезируемые ими онкобелки способны вызывать активацию аэробного гликолиза по различным механизмам, вызывая в конечном итоге стабилизацию и накопление HIFα (Кобляков, 2019). Одним из следствий функционирования HIFα является изменение рН в опухолевой ткани при анаэробном гликолизе. Происходят изменения рН как внутри, так и вне клеточного пространства.
В представленном обзоре анализируются механизмы изменения рН в опухолевой ткани, и делается заключение, что такие важные свойства опухолевого роста, как инвазия, нестабильность генома и повышенная пролиферативная активность обусловлены изменениями рН как внутри клеток опухоли, так и в межклеточном пространстве опухоли.
ЗНАЧЕНИЯ рН ВНУТРИ И ВНЕ ОПУХОЛЕВЫХ КЛЕТОК
Одним из последствий перехода опухолевых клеток на гликолиз является изменение величины как внутриклеточного, так и внеклеточного рН. Переход клеток на гликолиз должен был бы понизить значение внутриклеточного рН благодаря образованию органических кислот в процессе гликолиза. Однако наблюдается обратная картина: в нормальных клетках при нормоксии различие между внутриклеточным и внеклеточным рН небольшое: незначительное превышение рН внеклеточного (~7.4) по сравнению с внутриклеточным (~7.2). В опухолевых клетках разброс между внутриклеточными (≥7.4) и внеклеточными (≤6.9) значениями рН значительно выше и наблюдается обратная картина: внутри клетки величина рН более щелочная, чем вне клетки. Считается, что изменение рН в опухолевой ткани является одним из самых ранних показателей опухолевой трансформации (Reshkin et al., 2000; Harguindey et al., 2013).
Связано это с тем, что в опухолевых клетках, благодаря функционированию транскрипционного фактора HIFα, синтезируются различные протонные помпы, которые выбрасывают протоны в межклеточное пространство, создавая протонный градиент между уровнем рН внутри и вне клетки. HIFα активирует следующие протонные помпы: монокарбоксилат-транспортеры, выводящие из клетки лактат вместе с протоном, карбоновые ангидразы, катализирующие образование протона при взаимодействии двуокиси углерода с водой в межклеточном пространстве (по схеме: СО2 + Н2О → ${\text{НСО}}_{3}^{ - }$ + Н+) и трансмембранный Na+/H+ обменник (NHE1 exchanger), транспортирующий в межклеточное пространство протон в обмен на ион натрия (см. обзор: Кобляков, 2017).
ИЗМЕНЕНИЕ ВНЕКЛЕТОЧНОГО ЗНАЧЕНИЯ pН В ОПУХОЛЕВОМ ПРОЦЕССЕ
Различия величин рН в нормальных клетках и опухолях во многом определяет злокачественный фенотип. Показано, что инвазия происходит из зон опухоли с пониженным уровнем рН, а в зонах опухоли с нормальным рН инвазию не наблюдают (Estrella et al., 2013). Введение животным с опухолью слабощелочного буферного раствора (карбонатного или ТРИС) уменьшает метастазирование и рост опухоли (McCarty and Whitaker, 2010; Martin et al., 2012; Fais et al., 2014). Показано также, что пониженный уровень рН в межклеточном пространстве опухоли уменьшает активность Т-лимфоцитов, что способствует росту опухоли (Ma et al., 2021).
Активированный при аэробном гликолизе транскрипционный комплекс HIFα–HIFβ транскрибирует активность генов различных протеиназ: катепсина В (Cheng Xiaofei et al., 2018), металлопротеаз (ММР) (Hui Zhang et al., 2019), сериновую протеазу тромбина (Deryugina, Quigley, 2012). Активность протеиназ вызывает разрушение межклеточного матрикса и способствует инвазии. Протеиназы разрушают также межклеточные связи, что дает возможность опухолевым клеткам отделиться от основной массы опухоли, что является начальной стадией метастазирования.
Катепсин В сначала был выявлен как лизосомный фермент, но в дальнейшем был показан его транспорт во внешнюю мембрану клетки. (Aggarwa, Sloane, 2014). Активность катепсина В увеличивается в кислой среде межклеточного пространства опухоли. Катепсин В, помимо того, сам разрушает компоненты межклеточного матрикса, активируя ММР, активность которых также увеличивается при низких рН внеклеточного пространства (Ning Cui et al., 2017).
Принято считать, что наибольшую роль в разрушении межклеточного матрикса играют ММР, насчитывающие 28 изоформ. Повышенная активность большинства изоформ ММР выявляется в опухолях человека (Ning Cui et al., 2017). Основными “опухолевыми” ММР считаются ММР-2 и ММР-9 (Shao-Wu Jing et al., 2012). Описан и другой механизм активации ММР. Так, при значениях рН ниже 6.5 активируется фосфолипаза D, стимулирующая транскрипционную активность фактора NF-κB и протеинкиназы p38, что вызывает экспрессию ММР-9 (Williger et al., 1999; Kato et al., 2005). Таким образом, при понижении рН вне клетки активация протеиназ может происходить с помощью нескольких механизмов.
ИЗМЕНЕНИЕ pН ВНУТРИ ОПУХОЛЕВЫХ КЛЕТОК
Увеличение внутриклеточного рН изменяет активность внутриклеточных ферментов. Активность ферментов, участвующих в основной цепи превращения глюкозы с образованием пирувата и лактата усиливается. Так, активность одного из ключевых ферментов гликолиза фосфофруктокиназы в опухолевых клетках увеличивается в 100 раз при повышении значения рН на 0.2 единицы (Alfarouk et al., 2014).
Другая ветвь превращения глюкозы (пентозный цикл) в клетке связана с синтезом рибозы, необходимой для пролиферации и других синтетических процессов в клетке (рис. 1). Оптимальная активность ферментов пентозного цикла наблюдается при повышенном значении рН, характерном для опухолевых клеток. Так, для глюкозо-6-дегидрогеназы оптимальное значение рН 7.6, для транскетолазы – 7.4 (Alfarouk et al., 2020). Поэтому в опухолевых клетках резко усиливаются синтетические процессы, в основе которых лежит синтез нуклеиновых кислот.
Изменение каталитической активности белков связано с тем, что аминокислоты, рКа которых находится вблизи нейтрального значения рН, протонируются при понижении рН и теряют протон при повышении рН. Наиболее чувствительным к изменению рН является гистидин, поскольку рКа его аминогруппы ровно 6.5. Помимо гистидина, чувствительными к изменению рН являются глутамин, лизин и аспарагин (Brandon et al., 2020; Czowski et al., 2020). С изменением рН внутри клетки изменяется и аллостерическая структура белков. Если эти изменения затрагивают активный центр белка, то его активность меняется. Белки, функциональная активность которых меняется в зависимости от рН, характеризуются как рН-сенсоры. Присоединение к аминокислотному остатку в структуре белка фосфорной или ацетильной групп изменяет рКа этой аминокислоты, что приводит к изменению функциональной активности белка в зависимости от рН окружающей среды (Schönichen et al., 2013). Так, например, в опухолях простаты показано ацетилирование цитохрома с по лизину 53, что вызывает падение электрон-транспортных свойств фермента и уменьшает его способность активировать каспазу 3. (Bazylianska et al., 2021). Наблюдаемое в опухолях ацетилирование цитохрома с авторы связывают с эффектом Варбурга, считая, что переключение на гликолиз и меньшая чувствительность к апоптозу связаны с ацетилированием цитохрома с.
ВЛИЯНИЕ ВНУТРИКЛЕТОЧНОГО ЗНАЧЕНИЯ рН НА ПРОХОЖДЕНИЕ ФАЗ КЛЕТОЧНОГО ЦИКЛА В НОРМАЛЬНЫХ И ОПУХОЛЕВЫХ КЛЕТКАХ
Клетки, подвергнутые гипоксии, усиливают пролиферацию, что связано с функционированием фактора HIFα (Lee et al., 2008; Zhao et al., 2008). В процессе деления клеток в различных фазах клеточного цикла происходят кратковременные изменения внутриклеточного рН. Важным фактором здесь является то, что в конце фазы S происходит увеличение рН, что необходимо для прохождения границы фаз G2/M (Putney, Barber, 2003).
При ингибировании временного повышения рН происходит уменьшение уровня циклина В (основного элемента, стимулирующего прохождения фаз G2/M), стабилизация ингибиторного фосфорилирования циклинзависимой киназы 1 (Cdk1) по тирозину 15, а также увеличение уровня тирозинкиназы Wee-1, которая фосфорилирует Cdk1 по тирозину 15 (рис. 2). В нормальных клетках Wee-1 ингибирует вход клетки в митоз до полной готовности к митозу, что дает возможность ферментам репарации устранить нарушения в структуре ДНК, возникающие при ее репликации. Этот этап пролиферации обозначается как точка проверки (checkpoint). При окончании проверки происходит повышение рН, что ингибирует активность киназы Wee-1 ( Schmidt et al., 2017). Выключение Wee-1 с помощью трансфекции клеток соответствующей siRNA приводит к исчезновению сверочной точки и нарушению структуры ДНК (Beck et al., 2010).
Рис. 2.
Регуляция пролиферации клеток на стадии G2 клеточного цикла. В фазе G2 основным элементом продвижения клеток к митозу является циклинзависимая киназа cdk1 в комплексе с циклином В. После завершения S-фазы происходит проверка в контрольной точке (checkpoint) и исправление нарушений структуры ДНК после репликации. Для реализации контрольной точки киназа Wee-1 ингибирует активность cdk1, фосфорилируя остаток тирозина в положении 15. Для инактивации Wee-1 происходит повышение рН, благодаря стабилизации HIFα фосфорилированием cdk1. HIFα транскрибирует ген протонной помпы NHE1 (Na+/H+-обменника). Белок NHE1 увеличивает рН внутри клетки, что приводит к дезактивации Wee-1. Фосфатаза cdc25 дефосфорилирует киназу cdk1 по тирозину 15, активированный комплекс ЦиклинВ/cdk1 фосфорилирует Wee-1, что ведет к ее деградации.
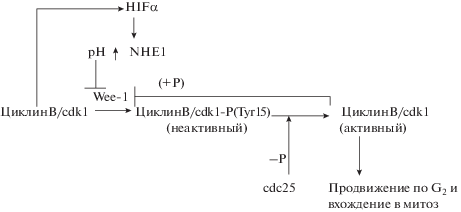
Увеличение уровня рН увеличивает уровень циклина В и активность фосфатазы Cdc25, которая дефосфорилирует циклинзависимую киназу Cdk1 по Tyr15, делая ее активной. Комплекс Cdk1–циклин В фосфорилирует тирозинкиназу Wee1, что вызывает ее убиквитирование и разрушение в протеосомах. Дефосфорилированный комплекс Cdk1–циклин В стимулирует вход клетки в фазы G2 и M и ускоряет пролиферацию (Putney, Barber, 2003; White et al., 2017). Фосфатазы семейства Cdc25 экспрессируются при передаче митотического сигнала транскрипционным фактором E2F и активируются фосфорилированием в поздней G1-фазе (Sur, Agrawa, 2016).
В нормальных клетках регулятором внутриклеточного рН при прохождении фаз G2/M клеточного цикла является, по-видимому, трансмембранный протонно-натриевый обменник NHE1, поскольку ингибирование его активности предотвращает пролиферацию (Putney, Barbe, 2004). Другие регуляторы рН активируются в определенных функциональных состояниях клетки. Так, например, авторы утверждают, что каналы МСТ (монокарбоксилат-ранпортеры), которые транспортируют лактат и протоны в межклеточное пространство, ответственны за увеличение внутриклеточного рН в быстро пролиферирующих клетках и первичных опухолях (Birkeland et al., 2020).
Активация NHE1-обменника обусловлена кратковременным повышением уровня HIFα в фазе G2 клеточного цикла с последующей деградацией в фазе G1 (Warfel et al., 2013; Hubbi et al., 2014). Повышение уровня HIFα происходит благодаря тому, что Cdk1 фосфорилирует HIFα по остатку Ser668, что стабилизирует его и позволяет избежать разрушения (Warfel et al., 2013). Однако повышенный уровень HIFα в клетке кратковременен и после митоза, когда клетки вступают в фазу G1, уровень HIFα падает. Это связано с тем, что Cdk2, которая катализирует прохождение фазы клеточного цикла G1, в комплексе с циклинами Е и А взаимодействует с HIFα. В результате образуется комплекс HIFα с шапероном, и HIFα направляется на деградацию в лизосомы по механизму аутофагии (Hubbi et al., 2014; Druker et al., 2021).
Косвенным подтверждением того, что Cdk1 активирует HIFα, являются данные, в которых показано, что разрушение в клетке Cdk1 блокирует не только пролиферацию клеток, но и ангиогенез (Xin Gao et al., 2019), который регулируется фактором HIFα, транскрибирующим гены фактора роста эндотелия сосудов VEGF (Masoud, Li, 2015; Choueiri, Kaelin, 2020). Поскольку киназа Cdk1 не является транскрипционным фактором, то ее влияние на ангиогенез может быть только опосредованным. Так как HIFα является транскрипционным фактором, вызывающим синтез VEGF, можно предположить, что при нарушении Cdk1 отсутствует активация HIFα и, соответственно, нет ангиогенеза. В опухоли, благодаря постоянно повышенному уровню рН и фактора HIFα, происходит постоянный нерегулируемый процесс пролиферации.
ЗАКЛЮЧЕНИЕ
Показано, что на ранних стадиях канцерогенеза трансформированные клетки переходят на гликолиз и при аэробных условиях (эффект Варбурга). Переход на гликолиз обусловлен функционированием различных онкогенов. Общим свойством активированных онкогенов является стабилизация и активация транскрипционного фактора HIFα, который вызывает экспрессию генов, кодирующих белки гликолиза, протонные помпы, матриксные протеиназы. В результате происходят изменения рН в межклеточном пространстве и внутри опухолевых клеток по сравнению с нормой. Пониженный уровень рН (≤6.9) в межклеточном пространстве активирует матриксные протеиназы, что вызывает разрушение межклеточного матрикса и межклеточного взаимодействия. В результате опухолевые клетки получают возможность прорастать в окружающую нормальную ткань (инвазировать) и образовывать одиночные опухолевые клетки, не связанные с основной массой опухоли, и в дальнейшем давать метастазы. Протонирование межклеточного пространства за счет транспорта протонов из клетки в межклеточное пространство вызывает стабильное увеличение рН внутри опухолевых клеток. В процессе пролиферации нормальных клеток наблюдаются изменения рН в зависимости от фаз клеточного цикла. На стадии G2 нормальные клетки после репликации ДНК имеют возможность репарировать нарушения, связанные с ошибками при репликации. После этого происходит повышение рН, необходимое для вхождения в фазу G2. Благодаря постоянной и более высокой величине рН внутри опухолевых клеток, у них отсутствует сверочная точка (checkpoint) после репликации ДНК и они входят в фазу G2 без исправления нарушений в структуре ДНК, которые ведут к появлению мутаций, наблюдаемых в опухолевых клетках, и поддержанию определенного уровня геномной нестабильности, что в итоге способствует росту опухоли (Ghelli et al., 2020) наравне с другими факторами, вызывающими нестабильность генома, например, мутаций в гене фактора р53.
Таким образом, такие основные свойства опухоли, как инвазия, постоянная пролиферативная активность и нестабильность генома, обусловлены изменением рН по отношению к нормальной ткани, как в межклеточном пространстве, так и внутри клеток, вызываемом постоянно протекающим гликолизом в опухоли, как в аэробных, так и анаэробных условиях.
Список литературы
Кобляков В.А. 2010. Механизмы опухоль-промоторного действия активных форм кислорода. Биохимия. Т. 75. № 6. С. 757. (Kobliakov V. A. 2010. Mechanisms of tumor promotion by reactive oxygen species. Biochemistry (Moscow). V. 75. № 6. P. 757.)
Кобляков В.А. 2017. Роль протонных помп при злокачественном росте. Биохимия. Т. 82. № 4. С. 557. (Kobliakov V.A. 2017. Role of proton pumps in tumorigenesis. Biochemistry (Mosc.). V. 82. № 4. P. 401.)
Кобляков В.А. 2019. механизмы регуляции онкобелками аэробного гликолиза (эффект Варбурга) в процессе канцерогенеза. Биохимия. Т.84. № 10. С. 1371. (Kobliakov VA. 2019. The Mechanisms of regulation of aerobic glycolysis (Warburg effect) by oncoproteins in carcinogenesis. Biochemistry (Mosc.) V. 84. № 10. P.1117. https://doi.org/10.1134/S0006297919100018
Aggarwa N., Sloane B.F. 2014. Cathepsin B: Multiple roles in cancer. Proteomics Clin. Appl. V. 8. P. 427. https://doi.org/10.1002/prca.201300105
Alfarouk K.O., Ahmed S.B.M., Elliott R.L., Benoit A., Alqahtan S.S., Ibrahim M.E., Bashir A.H., Alhoufie S.T.S., Elhassan G.O., Wales C.C., Reshkin S.J. 2020. The pentose phosphate pathway dynamics in cancer and its dependency on intracellular pH. Metabolites. V.10. P. 285. https://doi.org/10.3390/metabo10070285
Alfarouk K.O., Verduzco D., Rauch C., Muddathir A.K., Adil H.H.B., Elhassan G.O., Ibrahim M.E., Orozco J.D.P., Cardone R., Reshkin S.J., Harguindey S. 2014. Glycolysis, tumor metabolism, cancer growth and dissemination. A new pH-based etiopathogenic perspective and therapeutic approach to an old cancer question. Oncoscience. V. 1. P. 777.
Bazylianska V., Kalpage H.A., Wan J., Vaishnav A., Mahapatra G., Turner A.A., D.D., Kim K., Morse P.T., Lee I., Brunzelle J.S. 2021. Lysine 53 acetylation of cytochrome c in prostate cancer: Warburg metabolism and evasion of apoptosis. Cells. V. 10. P. 802. https://doi.org/10.3390/cells10040802
Beck H., Nähse V., Larsen M.S., Groth P., Clancy T., Lees M., Jørgensen M., Helleday T., Syljuåsen R.G., Sørensen C.S. 2010. Regulators of cyclin-dependent kinases are crucial for maintaining genome integrity in S phase. J. Cell. Biol. V. 188. P. 629.
Benizri B.E., Ginouve E., Volmat V., Roux D., PouysBeck H., Nähse V., Larsen M.S., Groth P., Clancy T., Lees M., Jørgensen M., Helleday T., Syljuåsen R.G., Sørensen C.S. 2010. Regulators of cyclin-dependent kinases are crucial for maintaining genome integrity in S phase. J. Cell. Biol. V. 188. P. 629.
Birkeland E.S., Koch L.M., Dechant R. 2020. Another consequence of the warburg effect? Metabolic regulation of Na+/H+ exchangers may link aerobic glycolysis to cell growth. Front. Oncol. V. 10. P. 1561. https://doi.org/10.3389/fonc.2020.01561
Czowski B.J., Romero-Moreno R., Trull K.J., White K.A. 2020. Cancer and pH dynamics: transcriptional regulation, proteostasis, and the need for new molecular tools. Cancers. V. 12. P. 2760. https://doi.org/10.3390/cancers12102760
Cash T.P., Pan Y., Simon M.C. 2007. Reactive oxygen species and cellular oxygen sensing. Free Radic. Biol. Med. V.43. P. 1219.
Chandel N.S., McClintock D.S., Feliciano C.E., Wood T.M., Melendez J.A., Rodriguez A.M., Schumacker P.T. 2000. Reactive oxygen species generated at mitochondrial complex III stabilize hypoxia-inducible factor-1alpha during hypoxia: a mechanism of O2 sensing. J. Biol. Chem. V. 275. P. 25 130.
Cheng Xiaofei, Li Yanqing, Zhou Dongkai, Chen Dong, Zhao Feng, Wang Weilin. 2018. Identification of cathepsin B as a novel target of hypoxia-inducible factor-1-alpha in HepG2 cells. Biochem. Biophys. Res. Com. V. 503. P. 1057. https://doi.org/10.1016/j.bbrc.2018.06.116
Choueiri T.K., Kaelin W.G. Jr. 2020. Targeting the HIF2-VEGF axis in renal cell carcinoma. Nat. Med. 2020. V. 26. P. 1519. https://doi.org/10.1038/s41591-020-1093-z
Deryugina E.L., Quigley J.P. 2012. Cell surface remodeling by plasmin: a new function for an old enzyme. J. Biomed. Biotechnol. V. 2012. Article ID 564259. https://doi.org/10.1155/2012/564259
Druker J., Wilson J.W., Child F., Shakir D., Fasanya T., Rocha S. 2021. Role of hypoxia in the control of the cell cycle. Int. J. Mol. Sci. V. 22. P. 4874. https://doi.org/10.3390/ijms22094874
Estrella V., Chen T., Lloyd M. 2013. Acidity generated by the tumor microenvironment drives local invasion. Cancer Res. V. 73. P. 1524.
Fais. S., Venturi. G., Gatenby. B. 2014. Microenvironmental acidosis in carcinogenesis and metastases: new strategies in prevention and therapy. Cancer Metastasis Rev. V. 33. P. 1095.
Ghelli A di Rorà L., Cerchione C., Martinelli G., Simonetti G. 2020. A WEE1 family business: regulation of mitosis, cancer progression, and therapeutic target. J. Hematol. Oncol. V. 13. Article number126. https://doi.org/10.1186/s13045-020-00959-2
Harguindey S., Arranz J.L., Polo Orozco J.D., Rauch C., Fais S., Cardone R.A., Reshkin S.J. 2013. Cariporide and other new and powerful NHE1 inhibitors as potentially selective anticancer drugs-an integral molecular/biochemical/metabolic/clinical approach after one hundred years of cancer research. Transl. Med. V. 11. P. 282. https://doi.org/10.1186/1479-5876-11-282
Hui Zhang, Qingju Yang, Xuanye Lian, Ping Jiang, Jing Cu. 2019. Hypoxia-inducible factor-1α (HIF-1α) promotes hypoxia-induced invasion and metastasis in ovarian cancer by targeting matrix metallopeptidase 13 (MMP13). Med. Sci. Monit. V. 25. P. 7202.
Hubbi M.E., Gilkesa D.M., Hu H., Ahmede I., Semenza G.L. 2014. Cyclin-dependent kinases regulate lysosomal degradation of hypoxia-inducible factor 1α to promote cell-cycle progression. Proc. Natl. Acad. Sci. USA. V. 111. P. E3325.
Kato Y., Lambert C.A., Colige A.C., Mineur P., Noël A., Frankenne F., Foidart J.M., Baba M., Hata R., Miyazaki K., Tsukuda M. 2005. Acidic extracellular pH induces matrix metalloproteinase-9 expression in mouse metastatic melanoma cells through the phospholipase D-mitogen-activated protein kinase signaling. J. Biol. Chem. V. 25. P. 10938.
Kim J.W., Tchernyshyov I., Semenza G.L., Dang C.V. 2006. HIF-1-mediated expression of pyruvate dehydrogenase kinase: a metabolic switch required for cellular adaptation to hypoxia. Cell Metab. V. 3. P. 177.
Lee G., Won H.S., Lee Y.M., Choi J.W., Oh T.I., Jang J.H., Choi D.K., Lim B.O., Kim Y.J., Park J.W., Puigserver P., Lim J.H. 2016. Oxidative Dimerization of PHD2 is Responsible for its inactivation and contributes to metabolic reprogramming via HIF-1α activation. Sci. Rep. V. 6. P. 18 928. https://doi.org/10.1038/srep18928
Lee K.A., Roth R.A., LaPres J.J. 2007. Hypoxia, drug therapy and toxicity. Pharmacol. Ther. V. 13. P. 229.
Lee S.H., Lee M.Y., Han H.J. 2008. Short-period hypoxia increases mouse embryonic stem cell proliferation through cooperation of arachidonic acid and PI3K/Akt signalling pathways. Cell Prolif. V. 41. P. 230.
Lu H., Forbes R.A., Verma A. 2002. Hypoxia-inducible factor 1 activation by aerobic glycolysis implicates the Warburg effect in carcinogenesis J. Biol. Chem. V. 277. P. 23111.
Ma G., Li C., Zhang Z., Liang Ye, Liang Z., Chen Y., Wang L., Li D., Zeng M., Niu H. 2021. Targeted glucose or glutamine metabolic therapy combined with PD-1/PD-L1 checkpoint blockade immunotherapy for the treatment of tumors. mechanisms and strategies. Front. Oncol. V. 11. Article 697894. https://doi.org/10.3389/fonc.2021.697894
Martin N.K., Robey I.F., Gaffney E.A. 2012. Predicting the safety and efficacy of buffer therapy to raise tumour pHe: an integrative modelling study. Br. J. Cancer. V. 106. P. 1280.
Masoud G.N., Li W. 2015. HIF-1α pathway: Role, regulation and intervention for cancer therapy. Acta Pharm. Sin. B. V. 5. P. 378.
McCarty M.F., Whitaker J. 2010. Manipulating tumor acidification as a cancer treatment strategy. Altern. Med. Rev. V. 15. P. 264.
Ning Cui, Min Hu, Raouf A. 2017. Khalil biochemical and biological attributes of matrix metalloproteinases. Prog. Mol. Biol. Transl. Sci. V. 147. P. 1. https://doi.org/10.1016/bs.pmbts.2017.02.005
Putney D.L., Barber L.K. 2003. Na-H exchange-dependent increase in intracellular pH times G2/M entry and transition. J. Biol. Chem. V. 278. P. 44645. https://doi.orghttps://doi.org/10.1074/jbc.M308099200
Putney D.L., Barber LK. 2004. Expression profile of genes regulated by activity of the Na-H exchanger NHE1. BMC Genomics. V. 16. P. 46. https://doi.orghttps://doi.org/10.1186/1471-2164-5-46
Reshkin S.J., Bellizzi A., Caldeira S., Albarani V., Malanchi I., Poignee M., Alunni-Fabbroni M., Casavola V., Tommasino M. 2000. Na+/H+ exchanger-dependent intracellular alkalinization is an early event in malignant transformation and plays an essential role in the development of subsequent transformation-associated phenotypes. FASEB J. V. 14. P. 2185.
Schönichen B., Webb A., Jacobson M.P., Barbe D.L. 2013. Considering protonation as a posttranslational modification regulating protein structure and function. Ann. Rev. Biophys. V. 42. P. 289.
Schmid M., Rohe A., Platzer C., Najja A., Erdmann F., Sippl W. 2017. Regulation of G2/M transition by inhibition of WEE1 and PKMYT1 kinases. Molecules. V. 22. P. 2045. https://doi.org/10.3390/molecules22122045
Shao-Wu Jing, Ya-Di Wang, Masahiro Kuroda, Jing-Wei Su, Guo-Gui Sun, Qing Liu, Yun-Jie Cheng, Cong-Rong Yang. 2012. HIF-1α contributes to hypoxia-induced invasion and metastasis of esophageal carcinoma via inhibiting E-cadherin and promoting MMP-2 expression. Acta Med. Okayama. V. 66. P. 399. https://doi.org/10.18926/AMO/48964
Sur S., Agrawa D.K. 2016. Phosphatases and kinases regulating CDC25 activity in the cell cycle: clinical implications of cdc25 overexpression and potential treatment strategies. Mol. Cell. Biochem. V. 416. P. 33. https://doi.org/10.1007/s11010-016-2693-2
Warburg O., Posener K., Negelein E. 1924. Über den Stoffwechsel der Karzinomzellen. Biochemische Zeitschrift. V. 152. P. 309.
Warfel N.A., Dolloff N.G., Dicker D.T., Malysz J., El-Deiry W.S. 2013. CDK1 stabilizes HIF-1α via direct phosphorylation of Ser668 to promote tumor grwth. Cell Cycle. V. 12. P. 3689.
White K.A., Grillo-Hil B.K., Baber D.L. 2017. Cancer cell behaviors mediated by dysregulated pH dynamics at a glance. J. Cell. Sci. V. 130. P. 663. https://doi.org/10.1242/jcs.195297
Williger B.T., Ho W.T., Exton J.H. 1999. Phospholipase D mediates matrix metalloproteinase-9 secretion in phorbol ester-stimulated human fibrosarcoma cells. J. Biol. Chem. V. 274. P. 735. https://doi.org/10.1074/jbc.274.2.735
Xin Gao, Yuan Zhang, Rui Zhang, Zichan Zhao, Haorui Zhang, Jinhui Wu, Wei Shen, Ming Zhong. 2019. Cyclin-dependent kinase 1 disruption inhibits angiogenesis by inducing cell cycle arrest and apoptosis. Exp. Ther. Med . V. 18. P. 3062. https://doi.org/10.3892/etm.27883
Zhao T., Zhang C.P., Liu Z.H., Wu L.Y., Huang X., Wu H.T., Xiong L., Wang X., Wang X.M., Zhu L.L., Fan M. 2008. Hypoxia-driven proliferation of embryonic neural stem/progenitor cells-role of hypoxia-inducible transcription factor-1alpha. FEBS J. V. 275. P. 1824.
Дополнительные материалы отсутствуют.


