Цитология, 2021, T. 63, № 6, стр. 568-579
Флуоресцентная визуализация динамики распределения GFP+-клеток донора в органах мышей после трансплантации нативного или криоконсервированного костного мозга
Л. А. Сергиевич 1, *, Е. В. Богданенко 2, А. В. Карнаухов 1, Н. А. Карнаухова 1, И. А. Лизунова 1
1 Институт биофизики клетки РАН
142290 Пущино, Московской обл., Россия
2 НИИ общей патологии и патофизиологии
125315 Москва, Россия
* E-mail: larserg@mail.ru
Поступила в редакцию 22.06.2021
После доработки 14.07.2021
Принята к публикации 19.07.2021
Аннотация
Криоконсервация является единственным способом сохранения собственных стволовых клеток костного мозга (КМ) для использования в регенеративной медицине или перед проведением аблативной терапии злокачественных заболеваний. Трансплантация собственных стволовых клеток КМ (аутотрансплантация) недостаточно изучена в плане взаимодействия пересаживаемых клеток с организмом хозяина (реципиента). В связи с этим, целью данной работы явилась оценка эффективности сингенной трансплантации, как модели аутотрансплантации, нативного или криоконсервированного КМ сублетально облученным мышам-реципиентам. В качестве доноров использовали мышей, несущих ген зеленого флуоресцентного белка (GFP), разводимых на основе инбредной линии C57BL/6, в качестве реципиентов – мышей линии C57BL/6. С помощью флуоресцентной микроскопии изучали динамику уровня химеризма в органах лимфомиелоидного комплекса системы крови (костного мозга, тимуса, селезенки, крови и кишечника) у мышей-реципиентов в разные сроки после трансплантации им нативных или криосохраненных GFP+-клеток донорского цельного сингенного КМ. Различия в способности заселения организма GFP+-клетками оценивали по их процентному содержанию в суспензии клеток КМ, селезенки и тимуса реципиента. GFP+-клетки у реципиентов, получивших размороженный КМ, появлялись в изученных органах на 7–8 сут позже, чем у реципиентов после трансплантации нативного КМ. Однако уже через 14–21 сут после трансплантации относительное содержание клеток донора в исследованных органах у реципиентов обеих групп достоверно не различалось. В тканях целых органов или их поперечных срезов (КМ, селезенки, тимуса и кишечника) химеризм после трансплантации выявляли на 2–3 сут раньше, чем в суспензии этих органов. Также было показано, что мезенхимальные клетки КМ донора участвуют в восстановлении стромы всех исследованных органов, поврежденных радиацией, о чем свидетельствует присутствие в них фибробластоподобных GFP+-клеток, особенно значительное в тимусе реципиентов обеих групп. Таким образом, проведенные нами исследования показали, что клетки КМ, криоконсервированного по используемой методике, оказались достаточно жизнеспособными для эффективного гистогенеза исследованных органов системы крови.
Стволовые клетки костного мозга (СККМ) имеют клиническое значение как потенциальные источники клеток для трансплантации в регенеративной медицине и терапии рака. Способность к длительному самообновлению и дифференцировке в различных направлениях предлагает большие перспективы для замены нефункциональных или утраченных клеток и регенерации поврежденных тканей. Трансплантация собственных СККМ (аутотрансплантация) обеспечивает возможность их использования в регенеративной медицине для замены поврежденных клеток с многократным применением у людей без риска отторжения трансплантата (Карнаухов и др., 2014; Otsu et al., 2014; Богданенко и др., 2015, 2020; Ramaswamy et al., 2018; Kovina et al., 2019). Хотя использование СККМ в медицине имеет большие перспективы, их применение для лечения многих заболеваний находится на стадии разработок и клинических испытаний. Кроме того, терапия на основе СККМ требует регулярного мониторинга процесса регенерации ткани в течение периода полного выздоровления пациента (Biasco et al., 2016). Актуальной является оптимизация процедур трансплантации, обеспечивающих функциональную интеграцию, пролиферацию, дифференцировку и миграцию трансплантированных СККМ, необходимых для восстановления и замены поврежденной ткани и их долгосрочной выживаемости в тканевой нише (Нимирицкий и др., 2018; Wei, Frenette, 2018). В то же время для лечения многих заболеваний используют аутологичную и аллогенную трансплантацию цельного КМ, в котором и содержатся указанные СККМ. Преимущества введения цельного КМ, а не его отдельных фракций показаны для процессов восстановительного гистогенеза костной ткани (Деев и др., 2006; Яковлева и др., 2008), а также на модели экспериментального сахарного диабета (Миллер и др., 2016).
Трансплантация сингенного либо совместимого аллогенного КМ необходима для восстановления процессов кроветворения после облучения, являющейся частью терапии онкологических заболеваний (Цуцаева и др., 1988; Shu et al., 2014). При этом криоконсервированный КМ часто является единственным источником СК, доступным для своевременной терапии. Как было показано (Berz et al., 2007), криоконсервирование цельного КМ является безопасным, поскольку при его трансплантации не наблюдаются значительные неблагоприятные исходы, связанные с его неспособностью к приживлению, недостаточностью его приживления или с развитием реакции “трансплантат против хозяина”.
Исследование взаимодействия криоконсервированных трансплантатов с организмом реципиента в посттрансплантационный период является наиболее важным для их практического применения (Цуцаева и др., 1988, 2009). При этом использование в качестве доноров КМ мышей, несущих ген зеленого флуоресцентного белка (GFP+-мыши), позволяющего проводить визуализацию восстановления исследуемых органов реципиента и однозначно связать процессы гистогенеза с донорскими клетками (Kawakami et al., 1999), явилось удобным средством оценки эффективности трансплантации КМ. Ранее нами было показано (Сергиевич и др., 2018), что КМ, криоконсервированный по методике, применяемой для аутотрансплантации в клинической практике лечения онкологических больных, оказался достаточно эффективным для выживания сублетально облученных мышей, однако наблюдалась более высокая смертность животных в группе с трансплантацией криосохраненного КМ по сравнению с нативным. Необходимо дальнейшее детальное изучение приживаемости клеток криосохраненного КМ доноров в организме реципиентов, особенно в первые два месяца после облучения, когда наиболее выражены проявления повреждающего действие радиации на кроветворную и иммунную системы. В связи с этим целью данной работы было сравнение динамики уровня химеризма в органах лимфомиелоидного комплекса системы крови (костного мозга, селезенки, тимуса и кишечника) и в крови у сублетально облученных мышей-реципиентов в течение 50 дней после трансплантации им нативных или криосохраненных GFP+-клеток донорского цельного сингенного КМ.
МАТЕРИАЛ И МЕТОДИКА
Экспериментальные животные. Мыши содержались в виварии ИБК РАН по 1–3 мыши в клетке на рационе из гранулированного корма с дополнительной подкоpмкой зеpноcмеcью. В качестве доноров КМ использовали самок и самцов мышей в возрасте 3–5 мес., несущих ген зеленого флуоресцентного белка (Enhanced Green Fluorescent Protein – EGFP, Tg(ACTB-EGFP)1Osb/J,) разводимых на основе инбредной линии C57BL/6 EGFP−/−. Трансген egfp в клетках донора (GFP+-мыши) использовали как витальную метку для определения их приживаемости в организме реципиента, не несущего этот трансген (GFP−-мыши). При освещении светом c длиной волны в диапазоне 395–488 нм GFP флуоресцирует в зеленой области спектра c максимумом флуоресценции с длиной волны 508 нм. В качестве реципиентов для трансплантации как нативного, так и размороженного КМ использовали GFP−-мышей в возрасте 3–6 мес., предварительно подвергшихся действию ионизирующего излучения в дозе 6.5 Гр, что соответствует дозе ЛД50/30 для данной линии мышей. При такой дозе помимо заселения донорскими клетками происходило восстановление органов и собственными клетками хозяина.
В качестве контроля для исследования степени химеризма изучаемых органов использовали GFP+-мышей, над которыми не проводили никаких манипуляций (интактные GFP+-мыши). Всего в эксперименте использовали 120 мышей, по 3–5 животных на каждую экспериментальную точку.
Облучение животных. Облучение мышей проводили сотрудники Группы источников излучений Института биофизики клетки РАН г. Пущино на рентгеновской установке РУТ-250-15-2 (РУМ 17), I = 15 мА, U = 200 кВ, с фильтрами из меди и алюминия, толщиной по 1мм каждый, мощность излучения 1 Гр/мин. Мышей облучали в дозе 6.5 Гр, после чего в экспериментальных группах мышей через 1 сут проводили трансплантацию нативного или размороженного КМ.
Выделение клеток КМ. Мышей-доноров выводили из эксперимента диcлокацией шейных позвонков. КМ выделяли из двух бедренных костей донора путем их измельчения в фарфоровой ступке с раствором фосфатно-солевого буфера (ФСБ) в объеме 600 мкл и последующей фильтрацией через капроновый фильтр с размером пор 70 мкм. Общее количество выделенных ядерных клеток подсчитывали в камере Горяева. От 2-х бедренных костей получали (5 ± 1) × 107 клеток.
Методика криоконсервирования. Для криоконсервирования клеток КМ мышей использовали 10%-ный раствор криопротектора ДМСО (Panreac, Испания) в 6%-ном растворе декстрана (ОАО “Биохимик”, Россия) с молекулярной массой 60 000 (полиглюкин). Эквилибрацию проводили в криопробирках на 1.8 мл (TPP, Швейцария) на ледяной бане в течение 6 мин во избежание гипертермии клеток в соотношении клеточной суспензии и криопротектора 1 : 1 (по 500 мкл каждого), получая конечную концентрацию криопротектора 5%. Замораживание проводили в тех же пробирках в два этапа: на первом пробирки помещали на 3 ч в контейнер для бесспиртового замораживания клеток CoolCell (Biocision, США), в котором происходило охлаждение со скоростью 1°С/мин в морозильнике при –80°С, на втором пробирки переносили в сосуды Дьюара с жидким азотом. Перед трансплантацией проводили быстрое размораживание клеточной суспензии на водяной бане при 37°С. Жизнеспособность и морфологию клеток до и после криоконсервирования оценивали после окрашивания суправитальным красителем трипановым синим в конечной концентрации 0.07% под микроскопом в проходящем свете с использованием DIC (дифференциального интерференционного контраста) и при освещении светом c длиной волны 488 нм (поврежденные клетки флуоресцировали в красной области спектра).
Трансплантация КМ. Трансплантацию суспензии клеток нативного КМ проводили сразу после выделения, а криосохраненного – непосредственно после размораживания без удаления криопротектора с учетом совпадения пола донора и реципиента. Суспензию клеток в объеме 100 мкл для нативного и 200 мкл для размороженного КМ вводили в боковую вену предварительно разогретого при температуре 40–42°С хвоста реципиента с помощью инсулинового шприца. В указанных объемах содержалось в среднем (1.3 ± 0.2) × 107 ядерных клеток. До трансплантации КМ хранили в жидком азоте 14–30 сут.
Извлечение органов у реципиентов. Мышей выводили из эксперимента на 1, 3, 6, 7, 11, 14, 22, 30, 40 и 50 сут после трансплантации, извлекали тимус, селезенку и бедренные кости, помещали их в ФСБ, после чего промывали и взвешивали. У кости осторожно срезали эпифизы, диафизальную трубку разрезали вдоль и разворачивали. В образовавшиеся две половинки наносили по нескольку капель ФСБ. Участок толстой кишки длиной около 0.5 см промывали от содержимого и разрезали вдоль. Каплю крови забирали из полости сердца.
Исследование органного химеризма в КМ, селезенке, тимусе и кишечнике. Целые тимус, селезенку, а также участок толстой кишки помещали на предметное стекло и наносили на них ФСБ во избежание высыхания; органы исследовали с 2 сторон. Тимус и селезенку помещали в морозильную камеру на 5 мин при –18°С, а затем делали поперечные срезы толщиной 1–2 мм. Костный мозг исследовали в продольных половинах костей. Флуоресценцию GFP в органах изучали при увеличениях объектива 5×, 10×, 20× и 40×, а в суспензии клеток КМ, селезенки и тимуса – при увеличении 40×. В работе использовали флуоресцентный микроскоп Axio-ImagerZ1 c цветной цифровой камерой AxioCamMRc5 (CarlZeiss, Геpмания).
Приготовление суспензии клеток костного мозга, селезенки и тимуса. Тимус и селезенку протирали c помощью скальпеля через капроновый фильтр c размером пор 70 мкм с промыванием ФСБ в объеме 1 мл для тимуса и 2 мл для селезенки. КМ выделяли из одной бедренной кости по методике, описанной выше.
Определение количества GFP+ клеток в органах реципиентов. По 10 мкл суспензии КМ, тимуса и селезенки помещали на предметные стекла, покрытые полилизином (Thermoscientific, Германия), и накрывали покровными стеклами 20 × 20 мм. Для определения процента GFP+-клеток фотографировали 10–20 полей зрения равномерно по всему препарату; одно и то же поле снимали дважды – в свете флуоресценции и в проходящем свете с использованием DIC, после чего подсчитывали среднее количество клеток в поле зрения (клеточность) и процент флуоресцирующих клеток среди них. Количество клеток на мазках подсчитывали с помощью программы CellAnalyzer-2 (Карнаухов и др., 2010).
Cтатиcтичеcкая обpаботка данныx. Данные обрабатывали с использованием программы SigmaPlot 12.1. Доверительную вероятность Р определяли стандартным образом c использованием t-критерия Стьюдента. Результаты представлены как M ± m, где M – среднее значение, m – стандартная ошибка.
РЕЗУЛЬТАТЫ
У используемых нами в качестве доноров КМ гетерозиготных GFP+-мышей количество GFP+-клеток в суспензии КМ составило 46.1 ± 5.1%, в селезенке – 50.8 ± 4.8% от общего количества ядерных клеток, т.е. примерно половина ядерных клеток экспрессировала GFP. В то же время в суспензии тимуса доноров присутствовало только 9.5 ± 1.0% GFP+-клеток.
Было обнаружено, что через 1 сут после трансплантации как нативных, так и криосохраненных клеток КМ в крови реципиентов присутствовали немногочисленные донорские GFP+ лейкоциты и отдельные тромбоциты. Затем через 5–7 сут их количество в крови мышей, получивших нативный КМ, значительно увеличивалось, появлялись яркие поля, состоящие из тромбоцитов. Позднее, через 11–14 сут, такая же картина наблюдалась и у животных, получивших криосохраненный КМ. Донорские клетки присутствовали в организме обеих групп реципиентов вплоть до смерти животного (от 4 до 12 мес. после трансплантации КМ).
В суспензии клеток КМ реципиентов, получивших нативный КМ (рис. 1а, кривая 1), к 4-м суткам после трансплантации количество донорских GFP+ клеток составляло уже более 15%, в то время как в группе мышей, получивших криосохраненный КМ (рис. 1а, кривая 2), количество GFP+-клеток начинало увеличиваться только через 7 сут после трансплантации, однако к 14 сут их количество возрастало выше 32%. Далее до конца периода наблюдения количество донорских GFP+-клеток в КМ животных из обеих групп почти не различалось.
Рис. 1.
Динамика процентного содержания GFP+-клеток донора в поле зрения в КМ (а), селезенке (б) и тимусе (в) после трансплантации нативного (кривая 1) или криосохраненного (кривая 2) КМ облученным мышам.
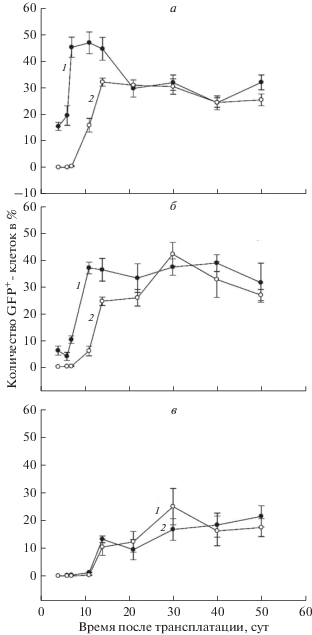
Сходные изменения наблюдали в суспензии клеток селезенки реципиентов обеих групп. Так, заметное увеличение количества GFP+-клеток в группе мышей, получивших криосохраненный КМ (рис. 1б, кривая 2), примерно на 7–8 сут отставало от такового в группе мышей, получивших нативный КМ (рис. 1б, кривая 1). Более низкое процентное содержание GFP+-клеток в селезенке по сравнению с КМ у мышей обеих групп в первую неделю после трансплантации объясняется более значительным опустошением КМ у реципиентов после облучения.
Иная динамика изменения количества GFP+ клеток отмечалась в суспензии клеток тимуса исследованных реципиентов. В группе мышей, получивших нативный КМ (рис. 1в, кривая 1), незначительное количество GFP+-клеток наблюдали, начиная с 6–7-х сут после трансплантации (0.2–0.3%), и только с 11-х сут происходил заметный рост их количества. В то же время в группе реципиентов, получивших криосохраненный КМ (рис. 1в, кривая 2), через 6–11 сут клетки донора в тимусе не обнаруживались, однако с 14-х сут после трансплантации происходило резкое увеличение количества GFP+-клеток, достигающее максимума на 30-е сут и несколько превышающее их количество к этому сроку в группе мышей, получивших нативный КМ.
Более высокое количество донорских GFP+-клеток в тимусе группы реципиентов с криосохраненным КМ может быть связано с их меньшей иммуногенностью по отношению к организму реципиента. Далее изменение числа донорских клеток в обеих группах было сходным, однако превышающее процентное количество GFP+-клеток в тимусе интактных GFP+-мышей. Такое явление, вероятно, можно объяснить тем, что у облученных мышей в тимусе после почти полной его инволюции происходило длительное восстановление органа с помощью трансплантированных клеток донора, которые пролиферировали длительное время, сохраняя высокую концентрацию GFP. Тем не менее, восстановление тимуса происходило медленнее, чем КМ и селезенки. Было также обнаружено, что при изменении режима замораживания (уменьшении времени предварительного охлаждения) донорского КМ у облученных реципиентов тимус не восстанавливался, а в КМ и селезенке восстановление происходило в меньшей степени и не достигало уровня восстановления органов у мышей, которым трансплантировали нативный или криосохраненный КМ по используемой в данной работе методике.
Исследование флуоресценции GFP в целых органах и на их поперечных срезах позволило выявить самые ранние этапы заселения органов донорскими клетками, когда в суспензии они присутствовали в следовых количествах, либо вообще не обнаруживались. Яркая флуоресценция GFP при сканировании органов по всей поверхности с изменением глубины резкости позволила наблюдать за локализацией донорских клеток в органе реципиента.
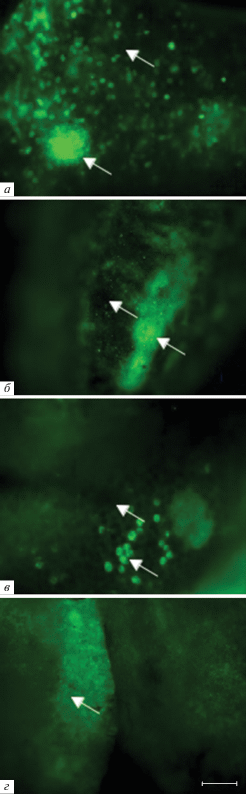
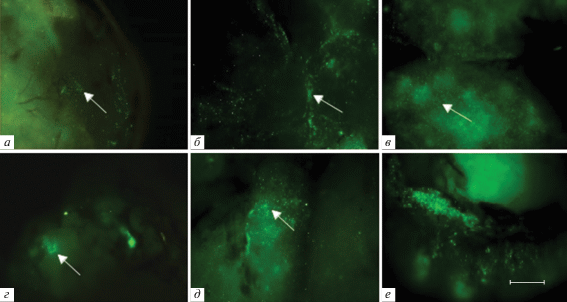
На рис. 2 приведены флуоресцентные микрофотографии КМ (а, б) селезенки (в), участка толстой кишки (г) и тимуса (в) интактных GFP+-мышей. Так как используемые в качестве доноров GFP+-мыши являются гетерозиготами, в тканях исследуемых органов наряду с яркими зелеными колониями клеток, экспрессирующих GFP, присутствуют темные участки, образованные клетками без GFP, причем распределение этих двух типов колоний является неравномерным по органу, что особенно четко просматривается в селезенке и толстой кишке. В тимусе, несмотря на то, что в паренхиме присутствует только 9.5 ± 1.0% GFP+-клеток, наблюдается самая высокая из исследованных органов интенсивность флуоресценции, обусловленная присутствующими в нем в большом количестве эндотелиоцитами и эпителиоретикулоцитами, образующими строму органа.
Рис. 2.
Распределение GFP+-клеток в КМ (а), селезенке (б), кишечнике (в) и тимусе (г) интактных GFP+-мышей. Стрелками указаны колонии флуоресцирующих и нефлуоресцирующих клеток. Масштабный отрезок соответствует 50 мкм. Ув. об.: а – 40×, б, г – 5×, в – 10×.
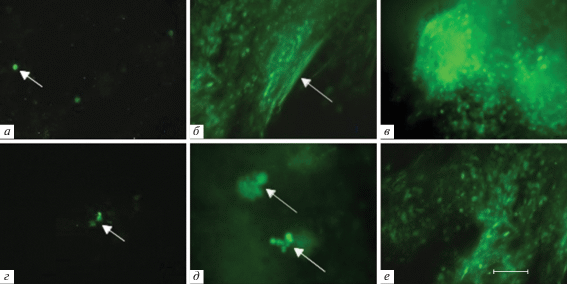
В КМ реципиентов после трансплантации нативного КМ уже через сутки на фоне выраженной гипоплазии собственной ткани обнаруживали мигрирующие туда клетки донора (рис. 3а), а через 3–6 сут были заметны многочисленные кроветворные клетки, а также фибробластоподобные клетки донора и образуемые ими волокна стромы (рис. 3б). У реципиентов, получивших криосохраненный КМ, небольшое количество донорских клеток в КМ обнаруживали через 7 сут после трансплантации (рис. 3г), а через 11 сут были видны отдельные колонии донорских клеток (рис. 3д). Через 14 сут после трансплантации (рис. 3в, е) флуоресцентная морфология КМ реципиентов, получивших как нативный, так и криосохраненный КМ, почти не отличалась от таковой у интактных GFP+-мышей.
Рис. 3.
Распределение GFP+-клеток в КМ облученных мышей-реципиентов после трансплантации нативного (а–в) или криосохраненного (г–е) КМ от GFP+-мышей-доноров. Срок после трансплантации: а – 1 сут, б –6 сут, в, е –14 сут, г – 7 сут, д –11 сут. Стрелками указаны появляющиеся донорские GFP+-клетки (а, г), флуоресцирующие волокна стромы (б) и колонии донорских GFP+-клеток (д). Масштабный отрезок соответствует 50 мкм. Ув. об. 40×.
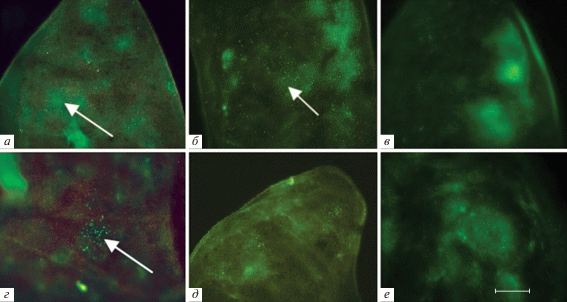
В селезенке реципиентов, получивших нативный КМ, также через сутки после трансплантации обнаруживали GFP+-клетки донора (рис. 4а), а через 3–6 сут в селезенке этих животных количество GFP+-колоний резко увеличивалось, обнаруживались фибробластоподобные клетки донора (рис. 4б). У животных, которым трансплантировали криосохраненный КМ, донорские клетки появлялись через 7 сут после трансплантации (рис. 4г), через 11 сут количество колоний также заметно увеличивалось (рис. 4д), а через 14 сут флуоресцентная морфология селезенки реципиентов была сходна с морфологией селезенки интактных GFP+-мышей (рис. 4в, е).
Рис. 4.
Распределение GFP+-клеток в селезенке облученных мышей-реципиентов после трансплантации нативного (а–в) или криосохраненного (г–е) КМ от GFP+-мышей-доноров. Срок после трансплантации: а – 1 сут, б – 6 сут, в, е – 14 сут, г – 7 сут, д – 11 сут. Стрелками указаны появляющиеся колонии донорских GFP+-клеток (а, г) и фибробластоподобные клетки (б). Масштабный отрезок соответствует 50 мкм. Ув. об. 5×.
В кишечнике реципиентов через сутки после введения нативного КМ обнаруживались отдельные группы клеток КМ донора (рис. 5а), а через 3–6 сут на поверхности органа появлялись многочисленные фибробластоподобные GFP+-клетки (рис. 5б). К 11-м сут после трансплантации уже четко просматривалась яркая ячеистая структура основания ворсин и единичные пейеровы бляшки, состоящие из GFP+-клеток донора, а на 14-е сут наблюдали уже многочисленные пейеровы бляшки (рис. 5в). У мышей, получивших криосохраненный КМ, отдельные колонии донорских клеток обнаруживали на 11-е сут после трансплантации (рис. 5г), где также были заметны фибробластоподобные клетки. На 14-е сут (рис. 5д) флуоресцентная картина органа почти не отличалась от таковой у реципиентов с трансплантацией нативного КМ и интактных GFP+-мышей. Однако обращает на себя внимание тот факт, что у мышей обеих экспериментальных групп количество флуоресцирующих пейеровых бляшек было заметно более высоким (рис. 5е), чем у интактных GFP+-мышей. Значительное количество пейеровых бляшек оставалось у экспериментальных животных в течение всего периода наблюдения. Это, вероятно, можно объяснить тем, что в организме облученных мышей присутствует большое количество разрушающихся под действием радиации собственных клеток и их фрагментов, что вызывает активацию иммунной системы кишечника.
Рис. 5.
Распределение GFP+-клеток в кишечнике облученных мышей-реципиентов после трансплантации нативного (а–в) или криосохраненного (г–е) КМ от GFP+-мышей-доноров. Срок после трансплантации: а – 1 сут, б – 3 сут, в, д –14 сут, г – 11 сут, е – 30 сут. Стрелками указаны появляющиеся колонии донорских GFP+-клеток (а, г), флуоресцирующие фибробластоподобные клетки (б) и пейеровы бляшки (в, д, е). Масштабный отрезок соответствует 50 мкм. Ув. об. 5×.
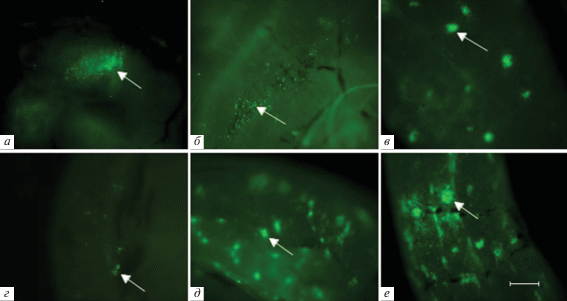
Так как после облучения происходит почти полная инволюция тимуса, применение GFP+ -мышей в качестве доноров КМ позволило проанализировать процессы адгезии и миграции клеток к доле тимуса на самых ранних стадиях восстановления органа. У облученных животных наблюдали выраженную аплазию лимфоидной ткани, повреждение стромы и жировое замещение органа. На 6-е сут после трансплантации в группе реципиентов с нативным КМ среди жировой ткани обнаруживали малочисленные дольки тимуса с мигрирующими туда клетками донора, располагающимися около кровеносных сосудов, и представленными как лимфоидными, так и фибробластоподобными клетками (рис. 6а). К 11 сут количество долек с заселившимися GFP+-клетками донора заметно увеличивалось, с их участием начинали восстанавливаться строма и корковое вещество органа (рис. 6б). На 14-е сут после трансплантации в этой группе мышей восстанавливалась типичная форма тимуса, он уже состоял из двух долей, на поверхности органа были видны многочисленные GFP+-эпителиоретикулоциты, формирующие строму тимуса (рис. 6в). Однако дольки тимуса были заполнены лимфоидными клетками еще не полностью. К 30-м сут увеличивалась плотность заполнения долек тимуса лимфоидными клетками и наблюдалась их незначительная гиперплазия. У животных, получивших криосохраненный КМ, на 11-е сут после трансплантации в тимусе наблюдали только отдельные небольшие вкрапления клеток донора (рис. 6г). Однако к 14-м сут после трансплантации структура тимуса уже состояла из двух долей (рис. 6д), в которых происходило восстановление отдельных долек, немного менее интенсивное, чем в группе животных, получивших нативный КМ. Далее восстановление продолжалось и к 30-м сут (рис. 6е) у этой группы мышей плотность заполнения долек тимуса клетками донора даже несколько превысила таковую у мышей, получивших нативный КМ. К 40–50-м сут наблюдения структура тимуса в обеих группах экспериментальных животных восстанавливалась и имела флуоресцентную морфологию, сходную с тимусом интактных GFP+-мышей.
Рис. 6.
Распределение GFP+-клеток в тимусе облученных мышей-реципиентов после трансплантации нативного (а–в) или криосохраненного (г–е) КМ от GFP+-мышей-доноров. Срок после трансплантации: а – 6 сут, б, г –11 сут, в, д – 14 сут, е – 30 сут. Стрелками указаны появляющиеся колонии донорских GFP+-клеток (а, г), флуоресцирующие строма долек (б) и эпителиоретикулоциты (в, д). Масштабный отрезок соответствует 50 мкм. Ув. об. 5×.
Итак, исследование суспензии клеток паренхимы КМ, селезенки и тимуса реципиентов дало возможность оценить вклад клеток донора в регенерацию органов по степени химеризма (доле флуоресцирующих клеток) и показало, что появление GFP+-клеток доноров у реципиентов, получивших размороженный КМ, на 7–8 сут отставало от такового у реципиентов с нативным КМ. Тем не менее, через 14–21 сут после трансплантации количество клеток донора в исследованных органах у реципиентов обеих групп достоверно не различалось.
Исследование флуоресценции в целых органах (КМ, селезенке, кишечнике и тимусе) позволило обнаружить клетки донора в более ранние сроки после трансплантации, чем в суспензии этих органов. Также было показано, что мезенхимальные клетки КМ донора участвуют в восстановлении стромы органов, поврежденных радиацией, о чем свидетельствует присутствие фибробластоподобных GFP+-клеток во всех исследованных органах, особенно значительное в тимусе реципиентов обеих групп.
ОБСУЖДЕНИЕ
Восстановление достаточного количества СККМ после криоконсервации считается ключевым условием успешной трансплантации. На восстановление пула таких клеток могут влиять различные факторы, в том числе недостаточное количество криосохраненных клеток, часть которых может теряться при образовании агрегатов при размораживании и отмывании от криопротектора (Stiff at al., 1987; Цуцаева и др., 1988; Бабийчук, Землянских, 2001; Костяев и др., 2016; Mohammed et al., 2020). И хотя в настоящее время развиваются новые технологии удаления криопротектора без центрифугирования размороженной суспензии КМ, разработка оптимальных (быстрых, безопасных, простых, управляемых, эффективных и недорогих) методов и устройств для удаления криопротектора с минимальными потерями и повреждениями клеток остается нерешенной проблемой (Shu et al., 2014). Применение нами методики с использованием непроникающего криопротектора полиглюкина в сочетании с 5% ДМСО без отмывания от криопротектора позволило в значительной степени устранить проблему агрегации размораживаемых клеток (Сергиевич и др., 2018).
Как нами было показано в данной работе, к 14–21 сут после трансплантации криосохраненный КМ по успешности восстановления органов не уступал нативному КМ, и донорские клетки присутствовали в организме реципиентов до конца его жизни, что свидетельствует о приживаемости ранних (long-term) предшественников СККМ (Randall, Weissman, 1997; Thanyaphong et al., 2002). Более высокая смертность облученных животных в группе с криосохраненным КМ, вероятно, связана с низкой концентрацией пула именно короткоживущих (short-term) СККМ, состоящих из общих миелоидных и мегакариоцито-эритроидных предшественников, присутствие достаточного количества которых необходимо для восстановления организма после облучения (Sawai et al., 2016). Помимо гибели части клеток, при замораживании у оставшихся клеток могут возникать нелетальные обратимые холодовые повреждения, что сказывается на пролиферации, дифференцировке и созревании различных популяций клеток КМ. Именно обратимость таких изменений, а также повышенная скорость накопления отдельных функционально полноценных популяций клеток по сравнению с нативным КМ (Цуцаева и др., 1988) приводит к быстрому заселению органов реципиента криосохранными клетками донора и высокой степени химеризма, что показано в нашем исследовании, где клетки хранились в жидком азоте 14–30 сут. Это согласуется с данными о том, что клетки, хранившиеся в жидком азоте до 3–6 мес., сохраняли стабильный кариотип (Гринчук, Шилина, 2021). Одним из возможных решений проблемы более высокой смертности животных в группе с криосохраненным КМ может быть введение, наряду с криосохраненными клетками КМ, также криосохраненных, нативных или модифицированных лимфоидных клеток, что, как показано ранее (Цуцаева и др., 1988; Maybury et al., 2016), приводило к увеличению продолжительности жизни облученных реципиентов. В медицинской практике также проводится переливание компонентов крови (эритроцитарная масса, тромбомасса, плазма) совместно с криосохраненным КМ.
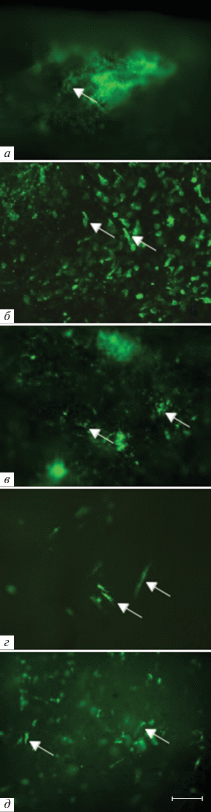
Более высокое, чем у интактных GFP+-мышей, процентное содержание GFP+-клеток, обнаруженное нами в тимусе мышей-реципиентов после трансплантации обоих видов КМ, может объясняться тем, что СККМ при трансплантации в облученный организм пролиферируют более активно, чем в физиологических условиях (Sawen et al., 2016). Под воздействием радиации происходит не только опустошение органов системы крови реципиента, но и разрушение стромы органов, что препятствует размножению, миграции и дифференцировке гематопоэтических стволовых клеток (ГСК). В то же время в суспензии клеток донорского цельного КМ наряду с ГСК находятся и мезенхимальные стромальные клетки (МСК), которые принимают участие в процессах гистогенеза стромы органов и способствуют восстановлению их морфофункциональных свойств, что и было обнаружено нами при исследовании флуоресценции GFP в целых органах или на их поперечных срезах у животных после трансплантации как нативного, так и криосохраненного КМ. Так, было показано, что клетки доноров образуют строму в виде ретикулярной сети в КМ (рис. 7а), селезенке, кишечнике и тимусе реципиентов, четко видную уже при увеличении объектива 5×, а при увеличениях 20–40× в органах можно наблюдать отдельные фибробластоподобные GFP+-клетки различной формы и размеров (рис. 7б–д). В настоящее время общепризнано, что МСК являются основной составляющей ниши ГСК в КМ и основным компонентом многих известных в настоящее время факторов ниш (Ding, Morrison, 2013; Cordeiro et al., 2016). В литературе (Нимирицкий и др., 2018; Wei, Frenette 2018) обсуждаются данные о том, как ГСК и их потомство регулируются взаимозависимой сетью МСК, нервных волокон, сосудистой системы, а также других кроветворных клеток. Облучение, как и другие миелоаблативные технологии, повреждает строму и приводит к опустошению и разрушению клеточных ниш (Abbuehl et al., 2017). Мы полагаем, что после трансплантации происходила регенерация ниш во всех исследованных нами органах, что можно заключить из наблюдаемого процесса восстановления стромы органов и полноценного их заполнения паренхимальными GFP+-клетками донора.
Рис. 7.
Фибробластоподобные GFP+-клетки в КМ (а, б), селезенке (в), кишечнике (г) и тимусе (д) облученных мышей-реципиентов после трансплантации КМ от GFP+-мышей-доноров. Стрелками указаны флуоресцирующие волокна стромы (а) и фибробластоподобные клетки донора (б–д). Масштабный отрезок соответствует 50 мкм.
Таким образом, проведенные нами в модельных экспериментах сравнительные исследования динамики уровня химеризма GFP+-клеток мышей-доноров посредством их флуоресцентной визуализации в органах реципиентов показали, что клетки КМ, криоконсервированного по методике, используемой в клинической практике для аутотрансплантации при лечении онкологических больных, оказались достаточно жизнеспособными для эффективного гистогенеза исследованных органов системы крови.
Список литературы
Бабийчук Л.А., Землянских Н.Г. 2001. Оптимизация и преимущества безотмывочного метода криоконсервирования эритроцитов с ПЭО-1500. Проблемы криобиологии. № 1. С. 35. (Babiychuk L.A., Zemlyanskikh N.G. 2001. Optimization and advantages of the flushless method of cryopreservation of red blood cells with PEO-1500. Problems of cryobiology. № 1. P. 35.)
Богданенко Е.В., Каpнауxов А.В., Каpнауxова Е.В., Cеpгиевич Л.А., Каpнауxова Н.А., Маноxина И.А., Каpнауxов В.Н. 2015. Изучение возможностей клеточной терапии для продления женской половой функции в модельных экспериментах на мышах. Патогенез. Т. 13. № 3. С. 13. (Bogdanenko E.V., Karnaukhov A.V., Karnaukhova E.V., Sergievich L.A., Karnaukhova N.A., Manokhina I.A., Karnaukhov V.N. 2015. Study of cell therapy possibilities for renewal of feminine sexual function on mouse model experiments. Patogenes. V. 13. № 3. P. 13.)
Богданенко Е.В., Cеpгиевич Л.А., Каpнауxов А.В., Каpнауxова Н.А., Лизунова И.А., Каpнауxов В.Н. 2020. Изучение регенеративного потенциала стволовых клеток цельного костного мозга для лечения механических травм кожи в модельных экспериментах на мышах. Патологическая физиология и экспериментальная терапия. Т. 64. № 1. С.31. (Bogdanenko E.V., Sergievich L.A., Karnaukhov A.V., Karnaukhova N.A., Lizunova I.A., Karnaukhov V.N. 2020. The regenerative potential of stem cells from the whole bone marrow for the treatment of skin mechanical trauma in a murine model. V. 64. № 1. P. 31.)
Гринчук Т.М., Шилина М.А. 2021. Влияние криоконсервации на стабильность кариотипа трансформированных фибробластов легкого китайского хомячка in vitro. Цитология. Т. 63. № 1. С. 63. (Grinchuk T. M., Shilina M. A. 2021. The effect of cryopreservation on the karyotype stability of transformed Chinese hamster lung fibroblasts in vitro. Tsitologiya. V. 63. № 1. P. 63.)
Деев Р.В., Цупкина Н.В., Сергеев В.С., Сериков В.Б., Гололобов В.Г., Пинаев Г.П. Особенности физиологического и репаративного остеогенеза после трансфузии ядросодержащих клеток костного мозга. 2006. Гены и Клетки. Т. 1. № 3. С. 54. (Deev R.V., Tsupkina N.V., Sergeev V.S., Serikov V.B., Gololobov V.G., Pinaev G.P. 2006. Features of physiological and reparative osteogenesis after transfusion of nucleated bone marrow cells. Genes and Cells. V. 1. № 3. P. 54.)
Каpнауxов А.В., Каpнауxова Е.В., Сеpгиевич Л.А., Каpнауxова Н.А., Смиpнов A.А., Богданенко Е.В., Маноxина И.А., Каpнауxов В.Н. 2014. Инфоpмационная теоpия cтаpения: изучение влияния тpанcплантации коcтного мозга на пpодолжительноcть жизни мышей. Биофизика. Т. 59. № 4. С. 790. (Karnaukhov A.V., Karnaukhova E.V., Sergievich L.A., Karnaukhova N.A., Bogdanenko E.V., Smirnov A.A., Manokhina I.A., Karnaukhov V.N. 2014. Information theory of ageing: studying the effect of bone marrow transplantation on the life span of mice. Biophysics. V. 59. № 4. P. 646.)
Карнаухов В.А., Карнаухова Н.А., Сергиевич Л.А., Карнаухов В.Н. 2010. Двухволновый микрофлуориметр нового поколения ДМФ-3. В сб.: III Евразийский конгресс по медицинской физике и инженерии. М. Т. 4. С. 43. (Karnaukhov V.A., Karnaukhova N.A., Sergievich L.A., Karnaukhov V.N. 2010. Two-wave microfluorimeter of the new generation DMF-3. In: The III Eurasian Congress on Medical Physics and Engineering. M. V. 4. P. 43.)
Костяев А.А., Утёмов С.В., Андреев А.А., Полежаева Т.В., Мартусевич А.К., Исаева Н.В., Шерстнев Ф.С., Ветошкин К.А., Калинина Е.Н., Князев М.Г. 2016. Анналы криобиологии. Классификации криопротекторов и криоконсервантов для клеток крови и костного мозга. Вестник гематологии. Т. 12. № 3. С. 36. (KostyaevA.A., Utyomov S.V., Andreev A.A., Polezhaeva T.V., Martusevich A.K., Isaeva N.V., Sherstnyov P.S., Vetoshkin K.A., Kalinina E.N., Knyazev M.G. 2016. Annals of cryobiology. Classifications of cryoprotectants and cryoconservants for blood cells and bone marrow. The bulletin of hematology. V. 12. P. 36.)
Миллер Т.В., Повещенко А.Ф., Лыков А.П., Повещенко О.В., Бондаренко Н.А., Петровская И.Ф., Завьялов Е.Л., Дементьева Е.В., Захарова И.С., Грицык О.Б., Шурлыгина А.В., Коненков В.И. 2016. Сравнительный анализ миграционной активности популяций клеток костного мозга в лимфоидные и нелимфоидные органы в норме и на модели экспериментального сахарного диабета. Современные проблемы науки и образования. № 2. С. 137. (Miller T.V., Poveshchenko A.F., Lykov A.P., Poveshchenko O.V., Bondarenko N.A., Petrovskaya I.F., Zavyalov E.L., Dementieva E.V., Zakharova I.S., Gritsyk O.B., Shurlygina A.V., Konenkov V.I. 2016. Comparative analysis of the migration activity of bone marrow cell populations to lymphoid and non-lymphoid organs in normal and experimental diabetes mellitus models. Modern problems of science and education. № 2. P. 137.)
Нимирицкий П.П., Сагарадзе Г.Д., Ефименко А.Ю., Макаревич П.И., Ткачук В.А. 2018. Ниша стволовой клетки. Цитология. Т. 60. № 8. С. 575. (Nimiritsky P.P., Sagaradze G.D., Efimenko A.Yu., Makarevich P.I., Tkachuk V.A. 2018. The stem cell niche. Tsitologiya. V. 60. № 8. P. 575.)
Сергиевич Л.А., Карнаухова Е.В., Карнаухов А.В., Карнаухова Н.А., Богданенко Е.В., Лизунова И.А., Карнаухов В.Н. 2018. Влияние криоконсервирования клеток костного мозга мышей-доноров, несущих ген egfp, на продолжительность жизни мышей при сингенной трансплантации. Биофизика. Т. 63. № 3. С. 517. (Sergievich L.A., Karnaukhova E.V., Karnaukhov A.V., Karnaukhova N.A., Bogdanenko E.V., Lizunova I.A., Karnaukhov V.N. 2018. The effect of cryopreservation of bone marrow cells from donor mice that carry the egfp gene, on the lifespan of mice after syngeneic transplantation. Biophysics. V. 63. № 3. P. 393.)
Цуцаева А.А., Гольцев А.Н., Попов Н.Н., Останкова Л.В., Лобасенко Н.П., Микулинский Ю.Е. 1988. Криоиммунология. Киев: Наукова думка. (Tsutsaeva A.A., Goltsev A.N., Popov N.N., Ostankova L.V., Lobasenko N.P., Mikulinsky Yu.E. 1988. Krioimmunologiya. Kiev: Naukova dumka.)
Цуцаева А.А., Черноусова С.С., Глушко Т.А., Шатилова Л.Е., Волина В.В., Сокол Л.В., Ивахненко Л.Ю., Чернышенко Л.Г., Бровко Е.В. 2009. Влияние трансплантации криоконсервированного костного мозга на динамику восстановления морфофункциональных свойств лимфоидных, миелоидных и эндокринных органов у летально облученных реципиентов. Проблемы криобиологии. Т. 19. № 1. С. 71. (Tsutsayeva A.A., Chernousova S.S., Glushko T.A., Shatilova L.E., Volina V.V., Sokol L.V., Ivakhnenko L.Yu., Chernyshenko L.G., Brovko E.V. 2009. Effect of cryopreserved bone marrow transplantation on dynamics of recovery of morphofunctional properties of lymphoid, myeloid and endocrine organs in lethally irradiated recipients. Problems of cryobiology. V. 19. № 1. P. 71.)
Яковлева Ю.А., Цаур Г.А., Вержбицкая Т.Ю., Попов А.М., Игуменьщев А.А., Вахонина Л.В., Вяткин И.Н., Шориков Е.В., Савельев Л.И., Фечина Л.Г. 2008. Выбор оптимальной стратегии криоконсервирования гемопоэтических стволовых клеток. Вестник Уральской медицинской академической науки. Т. 22. № 4. С. 86. (Yakovleva Yu.A., Tsaur G.A., Verzhbitskaya T.Yu., Popov A.M., Igumenshev A.A., Vakhonina L.V., Vyatkin I.N., Shorikov E.V., Savelyev L.I., Fechina L.G. 2008. Selection of the optimal strategy for cryopreservation of hematopoietic stem cells. Bulletin of the Ural Medical Academic Science. V. 22. № 4. P. 86.)
Abbuehl J-P., Tatarova Z., Held W., Huelsken J. 2017. Long-term engraftment of primary bone marrow stromal cells repairs niche damage and improves hematopoietic stem cell transplantation. Cell Stem Cell. V. 21. P. 241.
Berz D., McCormack E., Winer E., Colvin G., Quesenberry P. 2007. Cryopreservation of hematopoietic stem cells. American Journal of Hematology. V. 82. P. 463.
Biasco L., Pellin D., Scala S., Di Serio C., Naldini L., Aiuti A. 2016. In Vivo tracking of human hematopoiesis reveals patterns of clonal dynamics during early and steady-state reconstitution phases. Cell Stem Cell. V. 19. P. 107.
Cordeiro Gomes A., Hara T., Lim V.Y., Herndler-Brandstetter D., Nevius E., Sugiyama T., Tani-Ichi S., Schlenner S., Richie E., Rodewald H.R., Flavell R.A., Nagasawa T., Ikuta K., Pereira J.P. 2016. Hematopoietic stem cell niches produce lineage-instructive signals to control multipotent progenitor differentiation. Immunity. V. 45. P. 1219.
Ding L., Morrison S. 2013. Haematopoietic stem cells and earlylymphoid progenitors occupy distinct bone marrow niches. Nature. V. 495. P. 231.
Kawakami N., Sakane N., Nishizawa F., Iwao M., Fukada S I., Tsujikawa K., Kohama Y., Ikawa M., Okabe M., Yamamoto H. 1999. Green fluorescent protein-transgenic mice: immune functions and their application to studies of lymphocyte development. Immunol. Lett. V. 70. P. 165.
Kovina M.V., Karnaukhov A.V., Krasheninnikov M.E., Kovin A.L., Gazheev S.T., Sergievich L.A., Karnaukhova E.V., Bogdanenko E.V., Balyasin M.V., Khodarovich Y.M., Dyuzheva T.G. and Lyundup A.V. 2019. Extension of maximal lifespan and high bone marrow chimerism after nonmyeloablative syngeneic transplantation of bone marrow from young to old mice. Frontiers in Genetics. V. 10. P. 310. https://doi.org/10.3389/fgene.2019.00310
Maybury B., Cook G., Pratt G., Yong K., Ramasamy K. 2016. Augmenting autologous stem cell transplantation to improve outcomes in myeloma. Biol. Blood Marrow Transplant. V. 22. P. 1926.
Mohammed R., Ahmad D., Khoshnaw N., Hassan D., Abdulrahman H., Vacca M., Possenti M., Faruq D., Harem O., Muhamad S., Majolino I., Othman D. 2020. Leukapheresis cell concentration adjustment required for a successful recovery of HSC after cryopreservation. Cryobiology. V. 92. P. 21.
Otsu K., Kumakami-Sakano M., Fujiwara N., Kikuchi K., Keller L., Lesot H., Harada H. 2014. Stem cell sources for tooth regeneration: current status and future prospects. Front. Physiol. V. 5. P. 36.
Randall T., Weissman I. 1997. Phenotypic and functional changes induced at the clonal level in hematopoietic stem cells after 5-fluorouracil treatment. Blood. V. 89. P. 3596.
Ramaswamy Reddy SH., Reddy R., Babu N., Ashok G. 2018. Stem-cell therapy and platelet-rich plasma in regenerative medicines: A review on pros and cons of the technologies. J. Oral Maxillofac. Pathol. V. 22. P. 367.
Sawai C., Babovic S., Upadhaya S., Knapp D., Lavin Y., Colleen M. Lau C., Goloborodko A., Feng J., Fujisaki J., Ding L., Mirny L., Merad M., Eaves C., Reizis B. 2016. Hematopoietic stem cells are the major source of multilineage hematopoiesisin adult animals. Immunity. V. 45. P. 597.
Sawen P., Lang S., Mandal P., Rossi D., Soneji S., Bryder D. Mitotic history reveals distinct stem cell populations and their contributions to hematopoiesis. 2016. Cell Reports. V. 14. P. 2809.
Shu Z., Heimfeld S., Gao D. 2014. Hematopoietic SCT with cryopreserved grafts: adverse reactions after transplantation and cryoprotectant removal before infusion. Bone Marrow Transplant. V. 49. P. 469.
Stiff P.J., Murgo J.A., Zarolus C.G. 1987. Unfractionated human marrow cells cryopreservation using dimethylsulfoxide and hydroxyethyl starch. Cryobiology. V. 20. P. 17.
Thanyaphong N., Traver B., Weissman I., Akashi K. 2002. Myeloerythroid-restricted progenitors are sufficient to confer radioprotection and provide the majority of day 8 CFU-S. J. Clin. Invest. V. 109. P. 1579.
Wei Q., Frenette P. 2018. Niches for hematopoietic stem cells and their progeny. Immunity. V. 48. P. 632.
Дополнительные материалы отсутствуют.


